–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –і–µ—Б—П—В–Є–ї–µ—В–Є—П –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –љ–µ–њ—А–µ—А—Л–≤–љ—Л–є —А–Њ—Б—В –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–Њ–ї—М–љ—Л—Е —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О (–°–Э, –•–°–Э), —З—В–Њ –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Б–≤—П–Ј–∞–љ–Њ —Б —Г—Б–њ–µ—И–љ—Л–Љ –ї–µ—З–µ–љ–Є–µ–Љ –Є —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є –Њ—В –Њ—Б—В—А—Л—Е —Д–Њ—А–Љ –Ш–С–°, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Є–Љ–µ–љ–љ–Њ –Ш–С–° –Ј–∞–љ–Є–Љ–∞–µ—В –≤–µ–і—Г—Й–µ–µ –Љ–µ—Б—В–Њ —Б—А–µ–і–Є –њ—А–Є—З–Є–љ —А–∞–Ј–≤–Є—В–Є—П –•–°–Э. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л –њ—А–Њ–≥—А–∞–Љ–Љ—Л –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –•–°–Э, –≤–Ї–ї—О—З–∞—О—Й–Є–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —В–∞–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–∞–Ї –Є–љ–≥–Є–±–Є—В–Њ—А—Л –Р–Я–§, b-–±–ї–Њ–Ї–∞—В–Њ—А—Л, –і–Є—Г—А–µ—В–Є–Ї–Є, –Њ–і–љ–∞–Ї–Њ –њ–Њ–Є—Б–Ї –љ–Њ–≤—Л—Е –њ—Г—В–µ–є –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –•–°–Э, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л—Е –љ–∞ —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Б–љ–Є–ґ–µ–љ–Є–µ —З–Є—Б–ї–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ґ–Є–Ј–љ–Є, –Њ—Б—В–∞–µ—В—Б—П –∞–Ї—В—Г–∞–ї—М–љ—Л–Љ.
–Т–∞–ґ–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–Њ–є —П–≤–ї—П–µ—В—Б—П —В–∞–Ї–ґ–µ —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–µ –≤—Л—П–≤–ї–µ–љ–Є–µ –Є —В–µ—А–∞–њ–Є—П —Б–Њ—Б—В–Њ—П–љ–Є–є, —Г—Б—Г–≥—Г–±–ї—П—О—Й–Є—Е —В—П–ґ–µ—Б—В—М –•–°–Э, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, – –∞–љ–µ–Љ–Є–Є.
–Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –∞–љ–µ–Љ–Є—П –ї—О–±–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є —Б–њ–Њ—Б–Њ–±–љ–∞ –≤—Л–Ј—Л–≤–∞—В—М –Ј–∞—Б—В–Њ–є–љ—Г—О –•–°–Э [1]. –£ –±–Њ–ї—М–љ—Л—Е, –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–Њ –њ–Њ–≤–Њ–і—Г –•–°–Э, —Б—А–µ–і–љ–Є–є —Г—А–Њ–≤–µ–љ—М –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 120 –≥/–ї [2,3]. –≠—В–∞ –≤–µ–ї–Є—З–Є–љ–∞ —П–≤–ї—П–µ—В—Б—П –љ–Є–ґ–љ–µ–є –≥—А–∞–љ–Є—Ж–µ–є –љ–Њ—А–Љ—Л —Г –≤–Ј—А–Њ—Б–ї—Л—Е. –Я–Њ—Н—В–Њ–Љ—Г —Г –Љ–љ–Њ–≥–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э –Њ—В–Љ–µ—З–∞–µ—В—Б—П –∞–љ–µ–Љ–Є—П, –њ—А–Є—З–µ–Љ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≤ —В–∞–Ї–Є—Е —Б–ї—Г—З–∞—П—Е –∞–љ–µ–Љ–Є–Є —Г—Б—Г–≥—Г–±–ї—П—О—В —В—П–ґ–µ—Б—В—М —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Є –Љ–Њ–≥—Г—В –≤—Л–Ј–≤–∞—В—М –µ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ [4].
–§—А–∞–Љ–Є–љ–≥–µ–Љ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –∞–љ–µ–Љ–Є—П —П–≤–ї—П–µ—В—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –і–ї—П –•–°–Э [5], –∞ —А–µ–Ј—Г–ї—М—В–∞—В—Л —В–Њ–ї—М–Ї–Њ —З—В–Њ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П SOLVD –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Г—А–Њ–≤–µ–љ—М –≥–µ–Љ–∞—В–Њ–Ї—А–Є—В–∞ —П–≤–ї—П–ї—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –њ—А–Є –•–°–Э. –Ч–∞ 33 –Љ–µ—Б—П—Ж–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М —Б–Њ—Б—В–∞–≤–Є–ї–∞ 22%, 27% –Є 34% –і–ї—П –≤–µ–ї–Є—З–Є–љ –≥–µ–Љ–∞—В–Њ–Ї—А–Є—В–∞ 40–44, 35–39 –Є –Љ–µ–љ–µ–µ 35 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [6].
–Я–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П 91316 –±–Њ–ї—М–љ—Л—Е, –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –•–°–Э, –∞–љ–µ–Љ–Є—П –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –±–Њ–ї–µ–µ —Б–Є–ї—М–љ—Л–Љ –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є —А–∞–љ–љ–µ–є –њ–Њ–≤—В–Њ—А–љ–Њ–є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є, —З–µ–Љ –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П –Є–ї–Є –љ–∞–ї–Є—З–Є–µ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –Р–Ъ–® [7].
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є, —З—В–Њ –Є—И–µ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–є –Є–ї–Є –≥–Є–њ–µ—А—В—А–Њ—Д–Є—А–Њ–≤–∞–љ–љ—Л–є –Љ–Є–Њ–Ї–∞—А–і –±–Њ–ї–µ–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї–µ–љ, —З–µ–Љ –љ–µ–Є–Ј–Љ–µ–љ–µ–љ–љ—Л–є –Љ–Є–Њ–Ї–∞—А–і, –і–∞–ґ–µ –Ї –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞, –≤—Л–Ј—Л–≤–∞—О—Й–µ–≥–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Є—И–µ–Љ–Є–Є –Є –љ–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є —Б–µ—А–і—Ж–∞ [8]. –≠—В–Њ—В –љ–µ–≥–∞—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –∞–љ–µ–Љ–Є–Є –љ–∞ —А–∞–±–Њ—В—Г —Б–µ—А–і—Ж–∞ –±—Л–ї —В–∞–Ї–ґ–µ –Њ—В–Љ–µ—З–µ–љ –Є –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –љ–∞ –ї—О–і—П—Е [9]. –Ю–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –љ–∞ –ї—О–і—П—Е –Є –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–љ–Њ–µ —Б–µ—А–і—Ж–µ –±–Њ–ї–µ–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ –Ї –∞–љ–µ–Љ–Є–Є –Є/–Є–ї–Є –Ї –Є—И–µ–Љ–Є–Є, —З–µ–Љ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–µ. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Њ–Ї—Б–Є–≥–µ–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –ї–µ–≥–Ї–Њ–≥–Њ, –Њ—Б–Њ–±–µ–љ–љ–Њ –љ–∞ —Д–Њ–љ–µ –Є–Љ–µ—О—Й–µ–є—Б—П –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Б–µ—А–і—Ж–∞.
–≠–Ї–≤–Є–≤–∞–ї–µ–љ—В–Њ–Љ —А–∞–±–Њ—В–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Б–µ—А–і—Ж–∞ –Ї–∞–Ї –љ–∞—Б–Њ—Б–∞ —П–≤–ї—П–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –Љ–Є–Њ–Ї–∞—А–і–Њ–Љ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ (–Я–Ь–Ю2), –Ї–Њ—В–Њ—А–Њ–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В—Б—П –Ї–Њ—А–Њ–љ–∞—А–љ—Л–Љ –Ї—А–Њ–≤–Њ—В–Њ–Ї–Њ–Љ (Q). –Х–≥–Њ –≤–µ–ї–Є—З–Є–љ–∞ —А–µ–≥—Г–ї–Є—А—Г–µ—В—Б—П —В–Њ–љ–Є—З–µ—Б–Ї–Є–Љ —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ –Є —А–∞–Ј–љ–Є—Ж–µ–є –і–∞–≤–ї–µ–љ–Є—П –≤ –≤–Њ—Б—Е–Њ–і—П—Й–µ–Љ –Њ—В–і–µ–ї–µ –∞–Њ—А—В—Л –Є –њ–Њ–ї–Њ—Б—В–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞.
Q = (–†1-–†2) / R (–Љ–ї), –≥–і–µ
–†1 – –і–∞–≤–ї–µ–љ–Є–µ –≤ –≤–Њ—Б—Е–Њ–і—П—Й–µ–Љ –Њ—В–і–µ–ї–µ –∞–Њ—А—В—Л,
–†2 – –і–∞–≤–ї–µ–љ–Є–µ –≤ –ї–µ–≤–Њ–Љ –ґ–µ–ї—Г–і–Њ—З–Ї–µ,
R – —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤.
–≠–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–µ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–µ –љ–∞—Б–Њ—Б–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є —Б–µ—А–і—Ж–∞ –≤ —И–Є—А–Њ–Ї–Њ–Љ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –µ–≥–Њ –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є – –Њ—В —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–Њ–Ї–Њ—П –і–Њ —Г—А–Њ–≤–љ—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Ј–∞ —Б—З–µ—В –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ —А–µ–Ј–µ—А–≤–∞. –Ъ–Њ—А–Њ–љ–∞—А–љ—Л–є —А–µ–Ј–µ—А–≤ – —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А—Г—Б–ї–∞ –≤–Њ –Љ–љ–Њ–≥–Њ —А–∞–Ј —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М –Ї–Њ—А–Њ–љ–∞—А–љ—Л–є –Ї—А–Њ–≤–Њ—В–Њ–Ї –∞–і–µ–Ї–≤–∞—В–љ–Њ —Г—А–Њ–≤–љ—О –Я–Ь–Ю2, –Ј–∞ —Б—З–µ—В –і–Є–ї–∞—В–∞—Ж–Є–Є –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ (—А–Є—Б. 1). –Т–µ–ї–Є—З–Є–љ–∞ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ —А–µ–Ј–µ—А–≤–∞ (I) –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –і–∞–≤–ї–µ–љ–Є—П –≤ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е —Б–Њ—Б—Г–і–∞—Е –Ј–∞–Ї–ї—О—З–µ–љ–∞ –Љ–µ–ґ–і—Г –њ—А—П–Љ–Њ–є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–є –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–Љ—Г –Ї—А–Њ–≤–Њ—В–Њ–Ї—Г –њ—А–Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –і–Є–ї–∞—В–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б–Њ—Б—Г–і–∞—Е (–Р, –С), –Є –Ї—А–Є–≤–Њ–є –≤–µ–ї–Є—З–Є–љ—Л –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ —Б–Њ—Б—Г–і–Є—Б—В–Њ–Љ —В–Њ–љ—Г—Б–µ (–Њ–±–ї–∞—Б—В—М –∞—Г—В–Њ—А–µ–≥—Г–ї—П—Ж–Є–Є). –Я—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞, –љ–Њ—Б–Є—В–µ–ї—П –Ю2, –і–ї—П –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –Я–Ь–Ю2, –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –≤–µ–ї–Є—З–Є–љ—Л –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Њ–±–ї–∞—Б—В–Є –∞—Г—В–Њ—А–µ–≥—Г–ї—П—Ж–Є–Є, —З—В–Њ –≤–µ–і–µ—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ —А–µ–Ј–µ—А–≤–∞ (II), –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–Є (–С) –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ [10].

–†–Є—Б. 1. –Ф–Є–∞–≥—А–∞–Љ–Љ–∞ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ —А–µ–Ј–µ—А–≤–∞. –Р - –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –і–Є–ї–∞—В–∞—Ж–Є—П –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є; –С - –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –і–Є–ї–∞—В–∞—Ж–Є—П —Б–Ї–ї–µ–Њ—А–Њ–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є; I - –Ъ–Њ—А–Њ–љ–∞—А–љ—Л–є —А–µ–Ј–µ—А–≤ –њ—А–Є Hb N; II - –Ъ–Њ—А–Њ–љ–∞—А–љ—Л–є —А–µ–Ј–µ—А–≤ –њ—А–Є Hb ; DP = P–∞–Њ—А—В–∞ - P–ї.–ґ.; R - —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є
–•–°–Э —З–∞—Б—В–Њ —Б–Њ—З–µ—В–∞–µ—В—Б—П —Б —А–∞–Ј–ї–Є—З–љ–Њ–є —Б—В–µ–њ–µ–љ—М—О –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О (–•–Я–Э), –Ї–Њ—В–Њ—А–∞—П —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ–Њ—З–µ—З–љ–Њ–є –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—Ж–Є–Є –Є –Є—И–µ–Љ–Є–Є, –Є —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї —А–∞–Ј–≤–Є—В–Є—О –∞–љ–µ–Љ–Є–Є –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Г–Љ–µ–љ—М—И–µ–љ–Є—П —Б–µ–Ї—А–µ—Ж–Є–Є –њ–Њ—З–Ї–∞–Љ–Є —Н—А–Є—В—А–Њ–њ–Њ—Н—В–Є–љ–∞ (–≠–Я–Ю) [11].–•–°–Э —Б–њ–Њ—Б–Њ–±–љ–∞ —Г—Б—Г–≥—Г–±–ї—П—В—М –•–Я–Э (6). –Ш—И–µ–Љ–Є—П –њ–Њ—З–µ–Ї –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –Њ—З–µ–љ—М —А–∞–љ–Њ —Г –±–Њ–ї—М–љ—Л—Е —Б —Б–µ—А–і–µ—З–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є [12]. –Ю–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ —А–∞–Ј–≤–Є—В–Є–µ –•–°–Э —Г –±–Њ–ї—М–љ—Л—Е —Б —Н—Б—Б–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є —П–≤–ї—П–µ—В—Б—П —Б–∞–Љ—Л–Љ –Љ–Њ—Й–љ—Л–Љ –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П —В–µ—А–Љ–Є–љ–∞–ї—М–љ–Њ–є —Б—В–∞–і–Є–Є –•–Я–Э [13]. –£ –±–Њ–ї—М–љ—Л—Е —Б –•–°–Э –њ–Њ—Б–ї–µ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–ї—Г–±–Њ—З–Ї–Њ–≤–Њ–є —Д–Є–ї—М—В—А–∞—Ж–Є–Є –њ—А–Є–Љ–µ—А–љ–Њ –љ–∞ 1 –Љ–ї/–Љ–Є–љ/–Љ–µ—Б, –µ—Б–ї–Є –•–°–Э –љ–µ –ї–µ—З–Є–ї–∞—Б—М [14].
–Т –љ–µ–і–∞–≤–љ–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SOLVD –ї–µ—З–µ–љ–Є–µ –•–°–Э –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Р–Я–§ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б b-–±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –њ—А–Є–≤–µ–ї–Њ –Ї –ї—Г—З—И–µ–Љ—Г —Б–Њ—Е—А–∞–љ–µ–љ–Є—О –њ–Њ—З–µ—З–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є, —З–µ–Љ –њ—А–Є –ї–µ—З–µ–љ–Є–Є —В–Њ–ї—М–Ї–Њ –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Р–Я–§, —З—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В —В–Њ—В —Д–∞–Ї—В, —З—В–Њ —З–µ–Љ —В–µ—А–∞–њ–Є—П –•–°–Э «–∞–≥—А–µ—Б—Б–Є–≤–љ–µ–µ», —В–µ–Љ –ї—Г—З—И–µ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –њ–Њ—З–µ—З–љ–∞—П —Д—Г–љ–Ї—Ж–Є—П [6].
–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Я–Э –Є –∞–љ–µ–Љ–Є–µ–є –ї–µ—З–µ–љ–Є–µ –∞–љ–µ–Љ–Є–Є –≠–Я–Ю –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ [15], –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—О –і–Є–ї—П—В–∞—Ж–Є–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ [16], –∞ –≤ —Б–ї—Г—З–∞—П—Е –°–Э – –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О —Д—А–∞–Ї—Ж–Є–Є —Б–µ—А–і–µ—З–љ–Њ–≥–Њ –≤—Л–±—А–Њ—Б–∞ (–§–°–Т), —Г–і–∞—А–љ–Њ–≥–Њ –Њ–±—К–µ–Љ–∞ –Є —Б–µ—А–і–µ—З–љ–Њ–≥–Њ –≤—Л–±—А–Њ—Б–∞ [17].
–Т–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –Њ–±—К—П—Б–љ–µ–љ–Є–µ–Љ —Г–ї—Г—З—И–µ–љ–љ–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Љ–Њ–ґ–µ—В –±—Л—В—М –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В, –Ї–Њ—В–Њ—А—Л–є –≠–Я–Ю —Б–∞–Љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ —Д—Г–љ–Ї—Ж–Є—О –Љ–Є–Њ–Ї–∞—А–і–∞ –Є –љ–∞ —А–Њ—Б—В –µ–≥–Њ –Ї–ї–µ—В–Њ–Ї, –љ–µ —Б–≤—П–Ј–∞–љ–љ—Л–є —Б –µ–≥–Њ –і–µ–є—Б—В–≤–Є–µ–Љ –љ–∞ –∞–љ–µ–Љ–Є—О [18,19]. –Ю–љ —Б–њ–Њ—Б–Њ–±–µ–љ —В–∞–Ї–ґ–µ —Г–ї—Г—З—И–∞—В—М —Д—Г–љ–Ї—Ж–Є—О —Н–љ–і–Њ—В–µ–ї–Є—П [20].
–≠—А–Є—В—А–Њ–њ–Њ—Н—В–Є–љ –Љ–Њ–ґ–µ—В –±—Л—В—М –≥–ї–∞–≤–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –њ—А–Є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –∞–љ–µ–Љ–Є–Є –љ–µ —В–Њ–ї—М–Ї–Њ –Є–Ј––Ј–∞ —А–µ–і–Ї–Њ—Б—В–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –љ–∞ –љ–µ–≥–Њ, –љ–Њ —В–∞–Ї–ґ–µ –Є–Ј––Ј–∞ —В–Њ–≥–Њ, —З—В–Њ –Њ–љ –≤—Л–Ј—Л–≤–∞–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Є –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –Љ–Њ–ї–Њ–і—Л—Е –Ї–ї–µ—В–Њ–Ї –Є–Ј –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –≤ –Ї—А–Њ–≤—М. –Ъ—А–Є–≤–∞—П –і–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –Ї–Є—Б–ї–Њ—А–Њ–і–∞ —Г —Н—В–Є—Е –Ї–ї–µ—В–Њ–Ї —Б–і–≤–Є–љ—Г—В–∞ –≤–њ—А–∞–≤–Њ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –≤—Л–Ј—Л–≤–∞—П –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –≤ —В–Ї–∞–љ–Є, —З–µ–Љ —Н—В–Њ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ –љ–Њ—А–Љ–µ [21].
–Э–∞ —А–Є—Б—Г–љ–Ї–µ 2 –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ —Б—Е–µ–Љ–∞ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В–Є –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ–±—Л—В–Є–є –њ—А–Є –°–Э, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є—Е —А–∞–Ј–≤–Є—В–Є—О –∞–љ–µ–Љ–Є–Є. –Я—А–Є –°–Э –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ—З–µ—З–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –Є —Б–Є–љ—В–µ–Ј–∞ –≠–Я–Ю. –£–Љ–µ–љ—М—И–µ–љ–Є–µ –≤—Л–±—А–Њ—Б–∞ –≠–Я–Ю –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞. –°–љ–Є–ґ–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ (–∞–љ–µ–Љ–Є—П) —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–Ј–≤–Є—В–Є—О –≥–Є–њ–Њ–Ї—Б–µ–Љ–Є–Є –Є —В–Ї–∞–љ–µ–≤–Њ–є –≥–Є–њ–Њ–Ї—Б–Є–Є, –Ї–Њ—В–Њ—А—Л–µ –Ї–Њ–Љ–њ–µ–љ—Б–Є—А—Г—О—В—Б—П –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–µ–є. –Т –Њ—В–≤–µ—В –љ–∞ –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є—О –Є —Б–љ–Є–ґ–µ–љ–Є–µ –Р–Ф –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —В–Њ–љ—Г—Б–∞, —З—В–Њ –≤ –µ—Й–µ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є —Г—Е—Г–і—И–∞–µ—В –њ–Њ—З–µ—З–љ—Л–є –Ї—А–Њ–≤–Њ—В–Њ–Ї. –°–љ–Є–ґ–µ–љ–Є–µ –њ–Њ—З–µ—З–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤–µ–і–µ—В –Ї –∞–Ї—В–Є–≤–∞—Ж–Є–Є —А–µ–љ–Є–љ––∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ––∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л (–†–Р–°–°). –Я–Њ–≤—Л—И–µ–љ–Є–µ –≤—Л–±—А–Њ—Б–∞ –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О —Б–Є–љ—В–µ–Ј–∞ –∞–ї—М–і–∞–Ї—В–Њ–љ–∞ –Є –Ј–∞–і–µ—А–ґ–Ї–µ –љ–∞—В—А–Є—П –Є –≤–Њ–і—Л –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ. –Ч–∞–і–µ—А–ґ–Ї–∞ –љ–∞—В—А–Є—П –Є –≤–Њ–і—Л –≤–µ–і–µ—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –Ю–¶–Ъ –Є –≤–Њ–Ј–≤—А–∞—В—Г –Ї—А–Њ–≤–Є –Ї —Б–µ—А–і—Ж—Г —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –і–Є–ї–∞—В–∞—Ж–Є–µ–є –њ–Њ–ї–Њ—Б—В–µ–є. –Ф–Є–ї–∞—В–∞—Ж–Є—П –њ–Њ–ї–Њ—Б—В–µ–є —Б–µ—А–і—Ж–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —А–Њ—Б—В–Њ–Љ –≤–љ—Г—В—А–Є–Љ–Є–Њ–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ –љ–∞–њ—А—П–ґ–µ–љ–Є—П –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Я–Ь–Ю2. –°–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ —А–µ–Ј–µ—А–≤–∞ –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ –Я–Ь–Ю2 –≤—Л–Ј—Л–≤–∞–µ—В –∞–њ–Њ–њ—В–Њ–Ј (–≥–Є–±–µ–ї—М –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤) –Є —Г—Б—Г–≥—Г–±–ї—П–µ—В –°–Э.
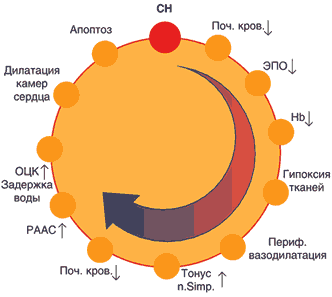
–†–Є—Б. 2. –°—Е–µ–Љ–∞ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Є –∞–љ–µ–Љ–Є–Є
–†–Њ–ї—М –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ –Є –µ–≥–Њ –ї–µ—З–µ–љ–Є—П –њ—А–Є –∞–љ–µ–Љ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э–Ф–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э –Є –∞–љ–µ–Љ–Є–µ–є –Љ–Њ–ґ–µ—В –≤–Њ–Ј–љ–Є–Ї–∞—В—М –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —В–µ—А–∞–њ–Є–Є –∞–љ–µ–Љ–Є–Є –≠–Я–Ю, –Ї–Њ—В–Њ—А–∞—П –љ–µ—А–µ–і–Ї–Њ –≤—Л–Ј—Л–≤–∞–µ—В —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞. –§—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞, –Њ–њ–Є—Б–∞–љ–љ—Л–є –≤–њ–µ—А–≤—Л–µ Eschbach —Б —Б–Њ–∞–≤—В. –≤ 1987 –≥., —А–∞—Б—Ж–µ–љ–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї —Б–Њ—Б—В–Њ—П–љ–Є–µ, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –ґ–µ–ї–µ–Ј–Њ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞–µ—В—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±—Л—Б—В—А–Њ –і–ї—П –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –≤–Њ–Ј—А–Њ—Б—И–Є—Е –њ–Њ—В—А–µ–±–љ–Њ—Б—В–µ–є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –∞–і–µ–Ї–≤–∞—В–љ—Л–µ –Њ–±—Й–Є–µ –Ј–∞–њ–∞—Б—Л –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ [22].
–Ф–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э –Є –∞–љ–µ–Љ–Є–µ–є –Љ–Њ–ґ–µ—В –≤–Њ–Ј–љ–Є–Ї–∞—В—М –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —В–µ—А–∞–њ–Є–Є –∞–љ–µ–Љ–Є–Є –≠–Я–Ю, –Ї–Њ—В–Њ—А–∞—П –љ–µ—А–µ–і–Ї–Њ –≤—Л–Ј—Л–≤–∞–µ—В —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞. –§—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞, –Њ–њ–Є—Б–∞–љ–љ—Л–є –≤–њ–µ—А–≤—Л–µ Eschbach —Б —Б–Њ–∞–≤—В. –≤ 1987 –≥., —А–∞—Б—Ж–µ–љ–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї —Б–Њ—Б—В–Њ—П–љ–Є–µ, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –ґ–µ–ї–µ–Ј–Њ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞–µ—В—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±—Л—Б—В—А–Њ –і–ї—П –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –≤–Њ–Ј—А–Њ—Б—И–Є—Е –њ–Њ—В—А–µ–±–љ–Њ—Б—В–µ–є –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ —Н—А–Є—В—А–Њ–њ–Њ—Н–Ј–∞, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –∞–і–µ–Ї–≤–∞—В–љ—Л–µ –Њ–±—Й–Є–µ –Ј–∞–њ–∞—Б—Л –ґ–µ–ї–µ–Ј–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ [22].–Ф–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —А–∞–Ј–≤–Є—В–Є—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –ї–µ—З–µ–љ–Є—П –≠–Я–Ю –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –њ—А–µ–њ–∞—А–∞—В—Л –ґ–µ–ї–µ–Ј–∞ –і–ї—П –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П. –Ю–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ґ–µ–ї–µ–Ј–∞ –і–ї—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –≤–Љ–µ—Б—В–µ —Б —Н—А–Є—В—А–Њ–њ–Њ—Н—В–Є–љ–Њ–Љ –Є–Љ–µ–µ—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В, –њ–Њ–≤—Л—И–∞—П —Г—А–Њ–≤–µ–љ—М –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, —З–µ–Љ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Њ–і–љ–Њ–≥–Њ —Н—А–Є—В—А–Њ–њ–Њ—Н—В–Є–љ–∞, –Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–љ–Є–Ј–Є—В—М –і–Њ–Ј—Г –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ [23]. –Э–Є–Ј–Ї–Є–µ –і–Њ–Ј—Л –≠–Я–Ю –і–µ—И–µ–≤–ї–µ –Є —Г–Љ–µ–љ—М—И–∞—О—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є [24].
–Я–∞—Ж–Є–µ–љ—В—Л —Б —В—П–ґ–µ–ї–Њ–є –°–Э –Љ–Њ–≥—Г—В –±—Л—В—М —Б–Ї–ї–Њ–љ–љ—Л –Ї –і–µ—Д–Є—Ж–Є—В—Г –ґ–µ–ї–µ–Ј–∞ –Є –њ–Њ –і—А—Г–≥–Є–Љ –њ—А–Є—З–Є–љ–∞–Љ, —З–µ–Љ —В–µ—А–∞–њ–Є—П –≠–Я–Ю. –§–∞–Ї—В–Њ—А–∞–Љ–Є, –њ—А–Є–≤–Њ–і—П—Й–Є–Љ–Є –Ї —А–∞–Ј–≤–Є—В–Є—О –∞–љ–µ–Љ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э, –Љ–Њ–≥—Г—В –±—Л—В—М: –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞—Б–њ–Є—А–Є–љ–∞ [25], –Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є—П [26], —Б–µ—А–і–µ—З–љ–∞—П –Ї–∞—Е–µ–Ї—Б–Є—П, —Б–≤—П–Ј–∞–љ–љ–∞—П —Б –љ–µ–њ–Њ–ї–љ–Њ—Ж–µ–љ–љ—Л–Љ –њ–Є—В–∞–љ–Є–µ–Љ [27]. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –Р–Я–§ —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ —Б–ї—Г—З–∞–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ [28].
–Ф—А—Г–≥–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, –Ї–Њ—В–Њ—А—Л–є –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є—О –∞–љ–µ–Љ–Є–Є, –Љ–Њ–ґ–µ—В —П–≤–ї—П—В—М—Б—П –Њ–њ—Г—Е–Њ–ї–µ–≤—Л–є –љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Є–є —Д–∞–Ї—В–Њ—А, —Г—А–Њ–≤–µ–љ—М –Ї–Њ—В–Њ—А–Њ–≥–Њ –њ–Њ–≤—Л—И–∞–µ—В—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э –Є –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б —В—П–ґ–µ—Б—В—М—О –∞–љ–µ–Љ–Є–Є [29].
–Т –љ–µ–і–∞–≤–љ–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є 142 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ —Б—В–µ–њ–µ–љ—М –∞–љ–µ–Љ–Є–Є —Г–≤–µ–ї–Є—З–Є–≤–∞–ї–∞—Б—М —Б –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М—О –°–Э – —Б—А–µ–і–љ—П—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М –Њ—В 137 –≥/–ї —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б I –§–Ъ –°–Э (NYHA) –і–Њ 109 –≥/–ї —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —В—П–ґ–µ–ї–Њ–є –°–Э (IV –§–Ъ –њ–Њ NYHA), –∞ —З–∞—Б—В–Њ—В–∞ –∞–љ–µ–Љ–Є–Є –≤–Њ–Ј—А–Њ—Б–ї–∞ –Њ—В 9,1% —Г –±–Њ–ї—М–љ—Л—Е —Б I –§–Ъ –°–Э –і–Њ 79,1% —Г –±–Њ–ї—М–љ—Л—Е —Б IV –§–Ъ –°–Э [30].
–Я—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –Є–љ—В–µ—А–µ—Б–љ—Л–Љ —А–µ–Ј—Г–ї—М—В–∞—В –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П [31]. –Т —Н—В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ 32 –±–Њ–ї—М–љ—Л—Е –•–°–Э —Б—А–µ–і–љ–µ—В—П–ґ–µ–ї–Њ–≥–Њ –Є —В—П–ґ–µ–ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П (NYHA –Ї–ї–∞—Б—Б > III), —Г –Ї–Њ—В–Њ—А—Л—Е —Д—А–∞–Ї—Ж–Є—П –≤—Л–±—А–Њ—Б–∞ –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (LVEF) —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ < 40%, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –њ–µ—А–µ–љ–Њ—Б–Є–Љ—Л—Е –і–Њ–Ј —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ —В–µ—З–µ–љ–Є–µ, –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ, 6 –Љ–µ—Б—П—Ж–µ–≤, –Є —Г—А–Њ–≤–µ–љ—М –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –Ї–Њ—В–Њ—А—Л—Е —Б—В–∞–±–Є–ї—М–љ–Њ –љ–∞—Е–Њ–і–Є–ї—Б—П –љ–∞ —Г—А–Њ–≤–љ–µ 100–115 –≥/–ї.
16 –±–Њ–ї—М–љ—Л—Е (–≥—А—Г–њ–њ–∞ –Р) –њ–Њ–ї—Г—З–∞–ї–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Г—О —В–µ—А–∞–њ–Є—О –≠–Я–Ю (–њ/–Ї) –Є —Б–∞—Е–∞—А–∞—В–Њ–Љ –ґ–µ–ї–µ–Ј–∞ –≤/–≤. –≠–Я–Ю –љ–∞–Ј–љ–∞—З–∞–ї–Є –Њ–і–Є–љ —А–∞–Ј –≤ –љ–µ–і–µ–ї—О –≤ —Б—В–∞—А—В–Њ–≤–Њ–є –і–Њ–Ј–µ 4000 –Х–Ф/–љ–µ–і. –њ/–Ї. –Ч–∞—В–µ–Љ –і–Њ–Ј—Г —Г–≤–µ–ї–Є—З–Є–≤–∞–ї–Є, –њ–Њ–≤—Л—И–∞—П —З–∞—Б—В–Њ—В—Г –≤–≤–µ–і–µ–љ–Є—П –і–Њ 2–3 —А–∞–Ј –≤ –љ–µ–і–µ–ї—О, –Є–ї–Є —Г–Љ–µ–љ—М—И–∞–ї–Є, –љ–∞–Ј–љ–∞—З–∞—П —А—З–≠–Я–Ю –Њ–і–Є–љ —А–∞–Ј –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–µ–і–µ–ї—М –і–ї—П —В–Њ–≥–Њ, —З—В–Њ–±—Л –і–Њ—Б—В–Є—З—М –Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—В—М —Ж–µ–ї–µ–≤–Њ–є —Г—А–Њ–≤–µ–љ—М –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –≤ –њ—А–µ–і–µ–ї–∞—Е 125 –≥/–ї. –°–∞—Е–∞—А–∞—В –ґ–µ–ї–µ–Ј–∞ –љ–∞–Ј–љ–∞—З–∞–ї–Є —З–µ—А–µ–Ј –±–Њ–ї–µ–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ—Л–µ –њ—А–Њ–Љ–µ–ґ—Г—В–Ї–Є –≤—А–µ–Љ–µ–љ–Є –і–ї—П —В–Њ–≥–Њ, —З—В–Њ–±—Л –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—В—М –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≤ –Ј–∞–і–∞–љ–љ—Л—Е –њ—А–µ–і–µ–ї–∞—Е. 16 –±–Њ–ї—М–љ—Л—Е (–≥—А—Г–њ–њ–∞ –С) –љ–µ –њ–Њ–ї—Г—З–∞–ї–Є –∞–љ—В–Є–∞–љ–µ–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є (–≠–Я–Ю –Є –≤/–≤ –ґ–µ–ї–µ–Ј–∞). –°—А–µ–і–љ–Є–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б–Њ—Б—В–∞–≤–Є–ї 8,2±2,7 (5–12 –Љ–µ—Б—П—Ж–µ–≤).
–Ф–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ–±–µ –≥—А—Г–њ–њ—Л –±–Њ–ї—М–љ—Л—Е –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М –њ–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ —Б–µ—А–і–µ—З–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є, –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ, —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є —В–µ—А–∞–њ–Є–Є, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ —Д—Г—А–Њ—Б–µ–Љ–Є–і–∞ (—В–∞–±–ї. 1). –§–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –•–°–Э –±—Л–ї–Є –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–Љ–Є –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е, NYHA –Ї–ї–∞—Б—Б –і–Њ –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–ї 3,8±0,4 –≤ –≥—А—Г–њ–њ–µ –Р –Є 3,5±0,5 –≤ –≥—А—Г–њ–њ–µ –С.
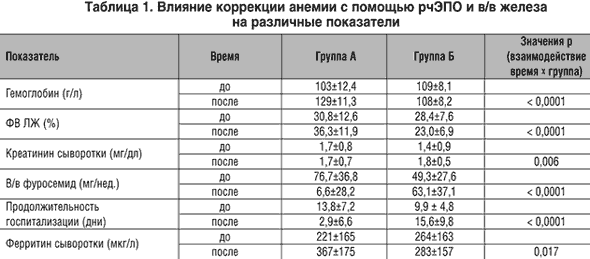
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ї–Њ—А—А–µ–Ї—Ж–Є—П –і–∞–ґ–µ —Б–ї–∞–±–Њ–є –∞–љ–µ–Љ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е —Б —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є —В—П–ґ–µ–ї–Њ–є –Ј–∞—Б—В–Њ–є–љ–Њ–є –°–Э –њ—А–Є–≤–µ–ї–∞ –Ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г —Г–ї—Г—З—И–µ–љ–Є—О —Б–µ—А–і–µ—З–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Є —Б–љ–Є–ґ–µ–љ–Є—О —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–ї–∞—Б—Б–∞ —Б–Њ–≥–ї–∞—Б–љ–Њ NYHA. –Э–∞–±–ї—О–і–∞–ї–Њ—Б—М —В–∞–Ї–ґ–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ —Б—А–Њ–Ї–Њ–≤ –њ—А–µ–±—Л–≤–∞–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–∞–Ї–Њ–≤—Л–Љ –њ–µ—А–Є–Њ–і–Њ–Љ –њ–µ—А–µ–і –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ–Љ. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –≤—Б–µ —Н—В–Њ –±—Л–ї–Њ –і–Њ—Б—В–Є–≥–љ—Г—В–Њ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –і–Њ–Ј—Л —Д—Г—А–Њ—Б–µ–Љ–Є–і–∞ –≤–љ—Г—В—А—М –Є –≤/–≤.
–Т –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –Ї–Њ—А—А–µ–Ї—Ж–Є—П –∞–љ–µ–Љ–Є–Є –љ–µ –Ј–∞–Љ–µ–љ—П–µ—В —Е–Њ—А–Њ—И–Њ –і–Њ–Ї—Г–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –•–°–Э, –љ–Њ, –≤–Є–і–Є–Љ–Њ, —П–≤–ї—П–µ—В—Б—П –Њ—З–µ–љ—М –≤–∞–ґ–љ—Л–Љ (–µ—Б–ї–Є –љ–µ –ґ–Є–Ј–љ–µ–љ–љ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ) –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ–Љ –Ї —В–µ—А–∞–њ–Є–Є.
1. Anand IS, Chandrashekhar Y, Ferrari R, Poole–Wilson PA, Harris P. Pathogenesis of edema in chronic anemia: studies of body water and sodium, renal function, haemodynamics and plasma hormones. Br Heart J 1993; 70:357–62.
2. Haber HL, Leavy JA, Kessler PD et al. The erythrocyte sedimentation rate in congestive heart failure. N Engl J Med 1991; 324:353–8.
3. Rich MW, Shah AS, Vinson JM et al. Iatrogenic congestive heart failure in older adults: clinical course and prognosis. J Am Geriatr Soc 1996; 44: 638–43.
4. Volpe M, Tritto C, Testa U et al. Blood levels of erythropoietin in congestive heart failure and correlation with clinical, haemodynamic and hormonal profiles. Am J Cardiol 1994; 74:468–73.
5. Kannel W. Epidemiology and prevention of cardiac failure: Framingham Study insights. Eur Heart J 1987;8: Suppl F:23–9.
6. Knight EL, Glynn RJ, McIntyre KM et al. Predictors of decreased renal function in patients with heart failure during angiotensin–converting enzyme inhibitor therapy: results from the Studies Of Left Ventricular Dysfunction (SOLVD). Am Heart J 1999;138:849–55.
7. Alexander M, Grumbach K, Remy L et al. Congestive heart failure hospitalizations and survival in California: patterns according to raceethnicity. Am Heart J 1999; 137:919–27.
8. Carson Jl. Morbidity risk assessment in the surgically anemic patients. Av J Surg 1995;170 Suppl:32–3.
9. Carson Jl, Duff A, Poses RM et al. Effect of anemia and cardiovascular disease on surgical mortality and morbidity. Lancet 1996;348:1055–60.
10. –Ю—А–ї–Њ–≤ –Ы.–Ы., –®–Є–ї–Њ–≤ –Р.–Ь., –†–Њ–є—В–±–µ—А–≥ –У.–Х. –°–Њ–Ї—А–∞—В–Є—В–µ–ї—М–љ–∞—П —Д—Г–љ–Ї—Ж–Є—П –Є –Є—И–µ–Љ–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞. «–Э–∞—Г–Ї–∞», 1987.
11. Anand IS, Chuch SS. Mechanisms and management of renal dysfunction in heart failure. Curr Opin Cardiol 1997;12:251–8.
12. Magri P, Rao MAE, Cangianiello S et al. Early impairment of renal haemodynamic reserve in patients with asymptomatic heart failure restored by angiotensin II antagonism. Circulation 1998;98:2849–54.
13. Perry HM, Miller P, Fornoff JR et al. Early predictors of 15 year end–stage renal disease in hypertensive patients. Hypertension 1995;25:587–94.
14. Hillege HL, van Gilst W, Kingma J et al. Myocardial infarction in associated with renal function loss which is counteracted by ACE inhibition. J Fv Soc Nephrol 1999;10:A384.
15. Goldberg N, Lundin AP, Delano et al. Changes in left ventricular size, wall thickness and function in anemic patients treated with recombinant human erythropoietin. Am Heart J 1992;124:424–7.
16. Foley RN, Parfrey PS, Morgan J et al. A randomized controlled trial of complete correction of anemia in hemodialysis patients with asymptomatic concentric LV hypertrophy or LV dilatation. Am Soc Nephrol 1998;9:208.
17. Linde T, Wikstrom D, Andersson LG et al. Renal anemia treatment with recombinant human erythropoietin increases cardiac output in patients with ischaemic heart disease. Scand J Urol Nephrol 1996;30:115–20.
18. Wald MR, Borda ES, Sterin–Borda L. Mitogenic effect of erythropoietin on neonatal rat cardiomyocytes: signal transduction pathways. J Cell Physiol 1996;167:461–8.
19. Wu MR, Lee SH, Liu X et al. Inactivation of erythropoietin leads to defects in cardiac morphogenesis. Development 1999;126:3597–605.
20. Kuriyama S, Hopp I, Yoshida H et al. Evidence for amelioration of endothelial cell dysfunction by erythropoietin therapy in predialysis patients. Am J Hypertension 1996;9:426–31.
21. Sowade O, Gross J, Sowade B et al. Evaluation of oxygen availability with oxygen status algorithm in patients undergoing open heart surgery treated with erythropoietin beta. J Lab Clin Med 1997;129:97–105.
22. Eschbach JW, Egrie JC, Downing MR et al. Correction of the anemia of end–stage renal disease with recombinant human erythropoietin. N Engl J Med 1987;316:73–8.
23. Macdougall IC, Tucker B, Thompson J et al. A randomized controlled study of iron supplementation in patients treated with erythropoietin. Kidney Int 1996;50:1694–9.
24. Maschino G. Erythropoietin and systemic hypertension. Nephrol Dial Transplant 1995;10:Suppl 2:74–9.
25. Weil J, Colin JD, Langman M et al. Prophylactic aspirin and risk of peptic ulcer bleeding. Br Med J 1995;310:827–30.
26. King D, Smith ML, Chapman TJ. Fat malabsorhtion in elderly patients with cardiac cachexia. Age Ageing 1996;25:144–9.
27. Schwengel RH, Gottlieb SS, Fisher ML. Protein–energy malnutrition in patients with ischemic and nonischemic dilated cardiomyopathy and congestive heart failure. Am J Cardiol 1994;73:908–10.
28. Erturk S, Nergizoglu G, Ates K et al. The impact of withdrawing ACE inhibitors on erythropoietin responsiveness and left ventricular hypertrophy in hemodialysis patients. Nephrol Dial Transplant 1999;14:1912–6.
29. Herrera–Garza EH, Stetson SJ, Cubillos–Garzon A et al. Tumor necrosis factor. A mediator of disease progression in the failing human heart. Chest 1999;115:1170–4.
30. Silverberg DS, Wexler D, Blum M et al. The use of subcutaneous erythropoietin and intravenous iron for the treatment of the anemia of severe, resistant congestive heart failure improves cardiac and renal function, functional cardiac class, and markedly reduces hospitalizations. J Am Coll Cardiol 2000;35:1737–44.
31. Silverberg DS, Wexler D, Sheps D, Blum M et al. The effect of correction of mild anemia in severe, resistant congestive heart failure using subcutaneous erythropoietin and intravenous iron: a randomized controlled study. J Am Coll Cardiol 2001;37:1775–80.












