Тромбообразование играет ключевую роль в развитии различных сердечно–сосудистых осложнений. В патогенезе ишемических болезней органов и систем человеческого организма – ИБС, ишемического мозгового инсульта, гангрены конечностей и других нарушений кровоснабжения органов и тканей – значительное место занимают воспалительные и атеросклеротические повреждения сосудов с нарушением целостности интимы, замедление кровотока, дисбаланс свертывающей и противосвертывающей системы и нарушение реологических параметров крови. При повреждении эндотелия сосудов различной этиологии происходит формирование тромба и, вследствие этого, критическое сужение просвета сосудов или его полное закрытие (частичная или полная окклюзия). В нарушениях реологических параметров крови агрегационное состояние тромбоцитов и эритроцитов играет ведущую роль.
Современное лечение и профилактика сердечно–сосудистых осложнений, в частности инфаркта миокарда, невозможны без четкого представления механизмов тромбообразования, материальным субстратом которого являются тромбоциты, эритроциты, фибриноген. В процессе тромбообразования тромбоцит проходит четыре стадии: стадия активации, стадия высвобождения активных биологических веществ (тромбоксаны, АДФ, серотонин, гликопротеидных рецепторов – IIIa/IIb), стадия агрегации, стадия адгезии (рис. 2). Эти процессы (макро– и микротромбообразование) особенно бурно проявляются при дестабилизации коронарного кровотока – остром коронарном синдроме (ОКС), включая инфаркт миокарда (ИМ). В основе макро– и микротромбообразования лежат механизмы, стимулирующие агрегационную активность тромбоцитов и эритроцитов – наличие ускоренного, турбулентного тока крови в суженном атеросклеротической бляшкой участке сосуда, что способствует повреждению эндотелия, с развитием эндотелиальной дисфункции, и «обнажению» коллагена, одного из главных факторов агрегации и адгезии тромбоцитов. Тромбоциты вступают в контакт с субэндотелиальным слоем, в частности с главным стимулятором адгезии – коллагеном, образуют отростки с образованием тромбоцитарных конгломератов (агрегация) и приклеиваются (адгезия) на этих участках, образуя белый тромб [6,8,10].
Активация тромбоцитов осуществляется катехоламинами, тромбином, АДФ, серотонином, коллагеном, тромбоксаном 2 (ТАх2) – продуктом метаболизма арахидоновой кислоты.
В результате активации тромбоцитов происходит высвобождение из последних биологически активных веществ (АДФ, ТАх2, серотонина) и лабилизация мембраны тромбоцита с образованием гликопротеидных (ГП) рецепторов IIIa/IIb под действием АДФ и ТАх2.
Агрегация тромбоцитов – образование тромбоцитарных конгломератов в плазме крови происходит при активации и взаимодействия ГП рецепторов IIIa/IIb, через образования фибриновых мостиков между тромбоцитами.
Адгезия – прилипание тромбоцитарных конгломератов к поврежденной интиме сосудов – контролируется фактором Виллебранта (fWb) (рис. 2).
Таким образом, активация тромбоцитов – ключевой момент в патогенезе сердечно–сосудистых осложнений, во многом определяющий выраженность нарушений кровоснабжения органов и тканей (сердце, головной мозг, периферические сосуды), поэтому антиагрегационная терапия является патогенетически обоснованной [3,6].
В настоящее время выделяют две группы антитромбоцитарных препаратов, в основе разделения которых лежат принципы доказательной медицины, использующие понятия эффективности и наличие побочных эффектов. Первая группа антитромбоцитарных препаратов, применение которых не рекомендуется для практической кардиологии вследствие отсутствия доказательной основы преимуществ перед ацетилсалициловой кислотой (АСК), неэффективности и потенциальной опасности: сульфинпиразон, дипиридамол, простациклин, блокаторы синтетазы тромбоксана А2, антагонисты рецепторов тромбоксана А2, ингибиторы IIIa/IIb рецепторов тромбоцитов для приема внутрь. Вторая группа, составляющая основу современной антитромбоцитарной терапии: АСК, тиенопиридины (клопидогрел, тиклопидин) и блокаторы ГП рецепторов IIIa/IIb для внутривенного применения (абсиксимаб, эптифибатид, тирофибан) [6, 9].
Ацетилсалициловая кислота используется в медицинской практике более 100 лет. Начиная с 80–х годов ХХ века, АСК была активно включена в клиническую практику для профилактики и при ОКС с целью предупреждения развития ИМ. Проведено несколько значительных исследований (VA, RISC, ISIS–2), которые убедительно продемонстрировали способность АСК снизить риск развития ОИМ и острой коронарной смерти на 41–70%. В исследованиях, доказавших положительное действие АСК при нестабильной стенокардии, использовались дозы 75–325 мг/сут. (в некоторых исследованиях более высокие дозы – до 600 мг/сут.). Мета–анализ основных работ по антитромбоцитарной терапии при обострении КБС показал: клиническая эффективность АСК в дозах 75–150 мг/сут. не уступает эффективности более высоких доз. Согласно этому мета–анализу, при применении АСК в меньших дозах (<75 мг/сут.) ее терапевтическая эффективность снижалась и не отличалась от эффективности плацебо. [3]. Одновременно в исследованиях CURE (The Сlopidogrel in Unstable Angina to Prevent Recurrent Events trial) было показано, что при продолжительном приеме АСК в дозах, превышающих 150 мг/сут., возрастал риск кровотечений, как при монотерапии, так и при комбинированном лечении с клопидогрелом [3,12].
В настоящее время постулировано: предпочтительными для длительного лечения КБС следует считать дозы в диапазоне 75–150 мг/сут., при развитии ОКС (на этапе госпитализации) стартовое лечение АСК можно начинать с дозы 360 мг [3,12,18].
Однако в ряде независимых исследований ОКС без подъема сегмента ST ЭКГ (ESSENCE, PISM PLUS) было установлено, что ближайший прогноз зависит от предшествующего приема АСК до развития обострения ИБС. Так, в исследовании PRISM PLUS при применении АСК при ОКС частота развития ИМ, рефрактерной стенокардии и внезапной смерти к 7–му дню наблюдения составила 12,1% среди больных, не принимавших ранее АСК, и 23,5% – среди лиц, принимавших АСК до развития обострения. Этот факт получил образное название «аспириновый парадокс», что послужило поводом для Bhatt D.L. и Topol E.J. (2003 г.) отнести АСК к «субоптимальным антитромбоцитарным средствам». Одновременно отмечено, что применение АСК в малых дозах в сочетании с антиангинальными препаратами у больных ИБС повышает риск возникновения безболевой формы ишемии миокарда, что может привести к развитию более выраженной ишемии миокарда во время физической нагрузки в связи с отсутствием своевременного сигнала в виде болевого приступа. Существует мнение, что при вазоспастической форме стенокардии (Ангина Принцметала) не рекомендуется назначать АСК, так как она ингибирует действие естественного вазодилататора простагландина I2 [3,4,5,9,11].
Доказано, что АСК в дозах 75–325 мг/сут. существенно снижает частоту случаев развития ИМ и внезапной кардиогенной смерти у больных с ОКС. Продолжение приема АСК после стабилизации состояния обеспечивает отдаленный положительный профилактический эффект [12]. В исследованиях, в которых было продемонстрировано позитивное действие АСК при ОКС, использовались преимущественно «простые», не кишечнорастворимые формы препарата. Лечение АСК рекомендуется всем больным с подозрением на ОКС при отсутствии абсолютных противопоказаний. Существует ряд побочных эффектов и противопоказаний при назначении АСК: активная пептическая язва, местное кровотечение или геморрагические диатезы, аллергические реакции [3,13,15].
Механизм действия ацетилсалициловой кислоты представлен на рисунке 3. АСК ингибирует циклооксигеназу тромбоцитов и эндотелия сосудов, принимающую участие в метаболизме арахидоновой кислоты при образовании тромбоксана А2 (агрегант тромбоцитов и вазоконстриктор) и простациклина (дезагрегант и вазодилататор). АСК, ингибируя циклооксигеназу–1, ингибирует агрегацию тромбоцитов и образование тромба в сосудах через блокаду синтеза тромбоксана А2 (ТАХ2) в тромбоцитах из арахидоновой кислоты.
Существуют и другие механизмы действия ацетилсалициловой кислоты, которые отличают от других антиагрегантных препаратов и обусловливают ее уникальность. АСК оказывает ингибирующее влияние на образование фибрина через подавление образования тромбина и функционального состояния фибриногена (блокирует лизин в молекулах фибриногена). Одновременно ацетилсалициловая кислота способна активировать фибринолиз через высвобождение активаторов плазминогена и «разрыхления» волокон фибрина.
В последние годы активно обсуждается проблема резистентности к терапии АСК (АР), под которой понимают неспособность АСК у некоторых больных в должной мере подавлять функцию тромбоцитов, снижать синтез тромбоксана А2 и/или удлинять время кровотечения. Распространенность резистентности к терапии АСК, по данным различных исследований, составляет от 10 до 45%, что противоречит положительным клиническим результатам применения АСК. Одна из наиболее вероятных причин АР – недостаточная приверженность пациентов лечению (non–complience). Режим лечения АСК не соблюдают до 40% больных с сердечно–сосудистыми заболеваниями [3]. Среди возможных причин этого феномена выделяют следующие:
1. Фармакодинамические взаимодействия АСК с нестероидными противовоспалительными препаратами;
2. Наличие нетромбоцитарных источников синтеза тромбоксанов А2 (эндотелий, моноцитарная/макрофагальная циклооксигеназа–2 – ЦОГ–2);
3. Экспрессия ЦОГ–2 во вновь образующихся тромбоцитах;
4. Гидролиз АСК эстеразами слизистой оболочки ЖКТ;
5. Повышенный синтез тромбоксана А2;
6. Гиперлипидемия;
7. Генетические особенности [1,3,7].
Есть основания полагать, что резистентность к терапии АСК может быть связана с полиморфизмом гена циклооксигеназы, затрагивающим активный центр фермента (Ser529), полиморфизмом генов, кодирующих другие ферменты, участвующие в мобилизации и метаболизме арахидоновой кислоты (фосфолипазы, тромбоксансиснтетазы), и полиморфизмом генов, кодирующих другие ГП рецепторы тромбоцитов [7].
Наиболее перспективным c точки зрения эффективности профилактики и лечения тромбозов является использование ацетилсалициловой кислоты без или в сочетании с тиенопиридинами, которое было убедительно показано в международном многоцентровом двойном слепом плацебо–контролируемом исследовании CHARISMA, в которое было включено 15603 пациента в возрасте от 45 лет и старше [7,11,16].
Ацетилсалициловая кислота, дипиридамол, сульфинпиразон обладают рядом побочных эффектов, которые снижают их терапевтичесий эффект, поэтому в настоящее время группа тиенопиридинов – синергистов АСК, представляет интерес для практической медицины. Клопидогрел относится к группе тиенопиридинов, обладает наиболее полноценным антитромботческим действием, его действие начинается с 2–го – 4–го часа от начала приема препарата и достигает максимума антиагрегантного действия к концу 2–3–го дня лечения.
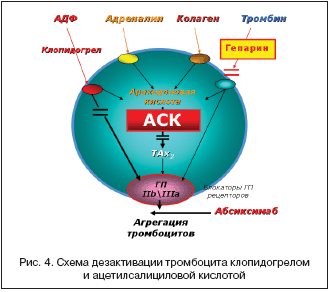
Экспериментальные исследования механизмов действия тиенопиридинов показали, что препараты высокоэффективны только in vivo. В отличие от ацетилсалициловой кислоты, которая ингибирует только вторую фазу агрегации тромбоцитов индуцированную АДФ, тиклопидины ингибируют обе фазы – агрегацию и адгезию. Тиенопиридины также тормозят активацию тромбоцитов, вызванную коллагеном, адреналином, тромбином и серотонином. При этом (в отличие от ацетилсалициловой кислоты) они не затрагивают метаболизм арахидоновой кислоты и, таким образом, не влияют на синтез простациклина эндотелием сосудов (рис. 4).
Ацетилсалициловая кислота и другие нестероидные противовоспалительные препараты (индометацин) действуют на уровне метаболизма арахидоновой кислоты, в больших дозах (АСК от 300 до 500 мг) одновременно блокируют синтез простациклинов, что косвенно может поддерживать агрегационное состояние тромбоцитов в результате количественного уменьшения простациклинов и их дезагрегационного эффекта.
Кроме вышеперечисленного, тиенопиридины повышают пластичность (деформируемость) эритроцитов, способствуя улучшению реологических свойств крови и микроциркуляции, что подтверждено в наших исследованиях – увеличение электрофоретической подвижности эритроцитов под действием тиклопидина в дозе 400 мг/сут.; одновременно препарат понижал вязкость крови путем снижения фибриногена плазмы [9].
В настоящее время накоплен значительный клинический опыт применения тиенопиридинов при различных сердечно–сосудистых патологиях: ОКС, инсульт головного мозга, облитерирующий атеросклероз сосудов нижних конечностей и диабетическая ангиопатия [5,11,16].
Наилучшие результаты получены при комбинированном лечении тиенопиридинами в сочетании с АСК, что позволило уменьшить терапевтические дозы указанных препаратов, снизить количество побочных эффектов и удешевить лечение.
В исследованиях CATS (Canadian–American Ticlopidin Stady), куда были включены результаты лечения 1053 пациентов, перенесших недавно (в последние 4 месяца) эпизоды ишемических приступов, было продемонстрировано уменьшение риска развития ИМ, повторного инсульта и сосудистой смерти на 30,2%.
Сходные результаты представлены французскими исследователями Aican Y.C. с сотрудниками (1989) и в шведском многоцентровом исследовании STIM. Французские исследователи наблюдали за 169 пациентами, в исследовании STIM было включено 687 пациентов с перемежающейся хромотой. Назначение тиклопидина проводилось по стандартной методике 250 мг в сутки с добавлением 75–100 мг АСК в сутки. В обеих группах наблюдения количество сосудистых осложнений снизилось на 38–40%, с одновременным улучшением периферического кровотока [9].
По данным исследования TASS (Ticlopidine Aspirine Stroke Stady), которое было выполнено с целью сравнения профилактической активности тиклопидина (500 мг в сутки) и ацетилсалициловой кислоты (1300 мг в сутки) у больных с ИБС, эффективность тиклопидина была значительно выше при меньшем количестве побочных эффектов: риск развития инсультов и ИМ в группе тиклопидина был на 24% меньше в первый год наблюдения по сравнению с группой пациентов, принимавших только АСК в указанной дозе [11].
Таким образом, в настоящее время наиболее предпочтительным по сравнению с монотерапией, с точки зрения эффективности в профилактике эпизодов ишемии, развития ИМ и стоимости лечения, является использование тиенопиридинов в сочетании с АСК (100 мг в сутки), так как они являются мощными ингибиторами агрегации и адгезии тромбоцитов и эритроцитов, а следовательно, эффективными антитромботическими средствами с минимизацией побочных эффектов, применяющимися в кардиологической практике.
Основной клинической проблемой применения АСК, помимо риска кровотечений (особенно у пожилых пациентов), являются осложнения со стороны желудочно–кишечного тракта в виде развития диспептических расстройств и эрозивно–язвенного гастрита. Эрозивно–язвенные изменения слизистой желудочно–кишечного тракта на фоне приема ацетилсалициловой кислоты в стандартизированных дозах, применяемых в кардиологической практике, – общеизвестный факт.
Долгое время единственным и практически 100% решением этой проблемы многие клиницисты считали применение кишечно–растворимых форм АСК. Однако, согласно результатам последних исследований, отмечено образование эрозий и язв желудка даже при применении АСК, покрытой кишечно–растворимой оболочкой, которые рубцевались в 90% наблюдений при применении циметидина и антацидов только после отмены этих форм АСК.
Сравнительно мало известны и недавно описаны поражения тонкого и толстого кишечника, вызванные АСК и другими нестериодными противовоспалительными препаратами: скрытые и явные кровотечения, перфорации, стриктуры, обострения хронических энтероколитов. Частота этих осложнений дистальнее двенадцатиперстной кишки значительно меньше, чем в желудке и начальном отделе двенадцатиперстной кишки, тем не менее, они также оказывают отрицательное влияние на практическую значимость АСК в профилактике ишемических приступов [13,14,15,17].
Поражения тонкого кишечника в виде энтеропатий при приеме ацетилсалициловой кислоты встречались чаще, чем в контрольной группе пациентов (не принимавших АСК). Наиболее характерными были: диафрагмоподобные стриктуры – синдром обструкции тонкого кишечник и «аспирин–индуцированная» энтеропатия – синдром, характеризующийся кишечными кровотечениями, потерей белка и мальбабсорбцией [14,17,18].
Поражения толстого кишечника при приеме нестероидных противовоспалительных препаратов бывают духа типов:
I – поражения в ранее неизмененной толстой кишке (острый колит, одиночные язвы–эрозии в слепой, ободочной, сигмовидной кишке),
II – поражения в ранее измененном кишечнике (перфорации при дивертикулезе, обострение хронических воспалительных процессов).
Вопросы профилактики поражения слизистой желудочно–кишечного тракта при назначении ацетилсалициловой кислоты до конца не изучены и остаются актуальными в клинической практике. В настоящее время, по данным литературы, очевидно лишь то, что использование кишечно–растворимых форм ацетилсалициловой кислоты не решает этой проблемы.
Все вышеперечисленное ставит перед фармакологами и клиницистами задачи создания и внедрения в клиническую практику новых форм лекарственных препаратов, способных защитить желудочно–кишечный тракт от повреждающего воздействия пероральных нестероидных противовоспалительных препаратов.
АСК–индуцированные осложнения в слизистой желудочно–кишечного тракта диктуют его отмену и назначение цитопротекторов – антацидов. В ряде клинических и экспериментальных исследований показано, что антациды способны эффективно лечить и профилактировать возникновение эрозий и язв в слизистой оболочке желудка при применении нестероидных противовоспалительных препаратов. Было продемонстрировано, что цитопротекторный эффект антацидов реализуется через стимуляцию образования простагландинов в стенке желудка (снижение простагландинов в слизистой желудка – основной механизм эрозивно–язвенного процесса, вызванного применением АСК), усиление секреции бикарбонатов и увеличение гликопротеинов в слизистой желудка.
Особый интерес представляет препарат Кардиомагнил (фармацевтическая компания «Nycomed»), который представляет собой соединение АСК (в наиболее эффективных и безопасных дозах – 75 и 150 мг) с невсасывающимся антацидом – гидроокисью магния.
Невсасывающиеся антациды являются одними из наиболее часто применяемых препаратов в гастроэнтерологической практике при лечении заболеваний желудка, в том числе и язвенной болезни. Свой положительный эффект невсасывающиеся антациды реализуют через адсорбцию соляной кислоты в желудке. Кроме того, они обладают и рядом других положительных эффектов: снижают протеолетическую активность желудочного секрета (адсорбируют пепсин, снижают его активность через повышение рН среды), обладают обволакивающим свойством, связывают лизолецитин и желчные кислоты, оказывающие неблагоприятное воздействие на слизистую желудочно–кишечного тракта.
Гидроокись магния, входящая в состав Кардиомагнила, является наиболее быстродействующим антацидом по сравнению с гидроокисью алюминия, что является чрезвычайно важным моментом при использовании этого препарата в антиагрегантном лечении. Ацетилсалициловая кислота быстро всасывается из желудочно–кишечного тракта: терапевтические концентрации АСК в плазме крови достигаются через 15–20 минут от момента приема препарата, при этом специально проведенные исследования показали, что гидроокись магния в составе Кардиомагнила не влияет на скорость всасывания ацетилсалициловой кислоты [2,4,5,9].
Таким образом, профилактика тромбозов и тромбоэболий, являющихся ключевым моментом в развитии сердечно–сосудистых патологий (острый коронарный синдром, острый инфаркт миокарда, ишемические инсульты, тромбоэмболии легочной артерии, поражение почек, периферические ангиопатии), с помощью антиагрегантных препаратов является определяющим направлением в лечении больных в терапевтической и хирургической практике. Тиенопиридины, ацетилсалициловая кислота способствуют активной профилактике тромбоэмболизма, а их сочетание позволяет уменьшить количество принимаемого препарата с повышением терапевтической активности и снижением частоты побочных эффектов.
Кардиомагнил – комбинация ацетилсалициловой кислоты (антиагрегант) и гидроокиси магния (антацидный компонент) c очень низкими побочными проявлениями (ульцерогенность и диспептические расстройства), что позволяет рекомендовать его в широкую практику профилактики и лечения сердечно–сосудистых заболеваний.



Литература
1. Кудряшова О.Ю., Затейщиков Д.А., Сидоренко Б.А. Гентические основы индивидуальной чувствительности к антитромбоцитарным препаратам. Кардиология. 2005. 9. Т.45,85–89;
2. Кукес В.Г., Остроумова О.Д. Кардиомагнил. Новый взгляд на ацетилсалициловую кислоту. Пособие для врачей.2004;
3. Лечение острого коронарного синдрома без стойкого подъема сегмента ST на ЭКГ. Москва 2006. Всероссийское научное общество кардиологов. Российские рекомендации;
4. Остроумова О.Д. Ацетилсалициловая кислота – препарат номер один для лечения сердечно–сосудистых заболеваний. Основные показания к применению, клинические преимущества, эффективные дозы и пути повышения переносимости. Рус. Мед. Журнал. 2003. т 11,№5, 253–255;
5. Остроумова О.Д. Возможности применения кардиомагнила у пациентов с сахарным диабетом. Рус. Мед. Журнал. 2004, т.12, №5, 350–354;
6. Панченко Е.П. Антитромботическая терапия острых коронарных синдромов без подъема сегмента ST. Consilium Medicum. 2001.Т3, №10, 472–475;
7. Ушкалова Е.А. Аспиринорезистентность: механизмы развития, методы определения и клиническое значение. Фарматека. 2006. № 13 (128), 35 – 41;
8. Шалаев С.В. Антитромбоцитарные средства в лечении острых коронарных синдромов. Фарматека. 2003.312, 94–97;
9. Шилов А.М., Мельник М.В. Тиклин в профилактике и лечении сердечно–сосудистых заболеваний. Ж. Рос. Мед. Вести. 2003, №4, 42–45;
10. Шилов А.М., Святов И.С., Санодзе И.Д. Антиагреганты – современное состояние вопроса. Рус. Мед. Журнал. 2003. Т11, №9, 552–556;
11. Bhatt D.L., Fox K.A.A., Hacke W/ and all. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N. Engl. J. Med. 2006. 354–361;
12. Clopidogrel in Unstable angina to prevent Recurrent Events trial (CURE) investigators. Effects of dopidogrel in addition to aspirin in patients with acute coronary syndromes without ST–segment elevation. N.Engl.J.Med. 2001.345, 494–498;
13. Cole F.T., Hudson N., Liew L.C. et al. Protection of Human gastric mucosa against aspirin–enteric coating or dose reduction?. Aliment. Pharmacol. Ther. 1999. 13 (2): 187–193;
14. Dommann H. G., Burhardt F., Wolf N. Enteric coating of aspirin significantly decreases gastroduodenal mucosal lesions. Aliment. Pharmacol. Ther. 1999. 13 (8): 1109–1114;
15. Kelly J.P., Kaufman D.W., Jugelon J.M. et al. Risk of aspirin–associated major upper– gastrointestinal bleeding with enteric–coated or buffered product. Luncet. 199б, 348:1413–1417;
16. Mehta S., Ysuf S., Peters R and all. Effects of pretreatment with clopidogrel and aspirin fallowed by long–term therapy in patients undergoing percutaneous coronary intervention: the PCI–CURE study. Lancet. 2001. 358, 527–531;
17. Petrosky D. Gastric safety and enteric–coated aspirin. Luncet, 1997, 349–354;
18. Savon J., Allen M.L., DiMarino A.J. Gastrointestinal blood loss with low–dose (325 mg) plain and enteric–coated aspirin administration. Am. J. Gastrointerol. 1995, 90: 581–586.












