–Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Р–У –њ–Њ —Н—В–Є–Њ–ї–Њ–≥–Є–Є:
I) –Я–µ—А–≤–Є—З–љ–∞—П (—Н—Б—Б–µ–љ—Ж–Є–∞–ї—М–љ–∞—П) – –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Р–Ф, –њ—А–Є—З–Є–љ–∞ –Ї–Њ—В–Њ—А–Њ–≥–Њ –љ–µ—П—Б–љ–∞. –Т –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–є –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А–µ –Њ–љ–Њ –љ–Њ—Б–Є—В –љ–∞–Ј–≤–∞–љ–Є–µ «–≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–∞—П –±–Њ–ї–µ–Ј–љ—М», –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ–Њ–µ –У.–§. –Ы–∞–љ–≥–Њ–Љ.
II) –Т—В–Њ—А–Є—З–љ–∞—П (—Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–∞—П)
1) –Я–Њ—З–µ—З–љ–∞—П –Р–У
• –†–µ–љ–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П
• –†–µ–љ–Њ–њ–∞—А–µ–љ—Е–Є–Љ–∞—В–Њ–Ј–љ–∞—П
2) –≠–љ–і–Њ–Ї—А–Є–љ–љ–∞—П –Р–У
• –§–µ–Њ—Е—А–Њ–Љ–∞—Ж–Є—В–Њ–Љ–∞
• –У–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ
• –У–Є–њ–µ—А–њ–∞—А–∞—В–Є—А–µ–Њ–Ј
3) –Э–µ–є—А–Њ–≥–µ–љ–љ–∞—П –Р–У
• –Я–Њ–≤—Л—И–µ–љ–Є–µ –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П (–Њ–њ—Г—Е–Њ–ї—М, —В—А–∞–≤–Љ–∞, –Є–љ—Д–∞—А–Ї—В –Љ–Њ–Ј–≥–∞)
• –Ф–Є—Н–љ—Ж–µ—Д–∞–ї—М–љ—Л–є —Б–Є–љ–і—А–Њ–Љ
4) –°–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–∞—П (–≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–∞—П) –Р–У
• –Р—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј –∞–Њ—А—В—Л (–Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–∞—П —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–∞—П –Р–У)
• –Ъ–Њ–∞—А–Ї—В–∞—Ж–Є—П –∞–Њ—А—В—Л
• –Ю—В–Ї—А—Л—В—Л–є –∞—А—В–µ—А–Є–∞–ї—М–љ—Л–є –њ—А–Њ—В–Њ–Ї
• –Э–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –∞–Њ—А—В–∞–ї—М–љ–Њ–≥–Њ –Ї–ї–∞–њ–∞–љ–∞
• –Я–Њ–ї–љ–∞—П –∞—В—А–Є–Њ–≤–µ–љ—В—А–Є–Ї—Г–ї—П—А–љ–∞—П –±–ї–Њ–Ї–∞–і–∞
• –Ч–∞—Б—В–Њ–є–љ–∞—П —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М
• –≠—А–Є—В—А–µ–Љ–Є—П
• –У–Є–њ–µ—А—В–Є—А–µ–Њ–Ј
5) –Ы–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–∞—П (—П—В—А–Њ–≥–µ–љ–љ–∞—П) –Р–У
• –≠—Б—В—А–Њ–≥–µ–љ—Л
• –У–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і—Л
• –Э–µ—Б—В–µ—А–Њ–Є–і–љ—Л–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (–Э–Я–Т–Я)
• –Ъ–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ—Л
• –Ю—В–Љ–µ–љ–∞ –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Њ—Б–Њ–±–µ–љ–љ–Њ –Ї–ї–Њ–љ–Є–і–Є–љ–∞)
6) –Ґ–Њ–Ї—Б–Є—З–µ—Б–Ї–∞—П –Р–У
• –Ч–ї–Њ—Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –∞–ї–Ї–Њ–≥–Њ–ї–µ–Љ
• –Ю—Б—В—А–Њ–µ –Њ—В—А–∞–≤–ї–µ–љ–Є–µ —Б–≤–Є–љ—Ж–Њ–Љ
7) –Р–У —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞
• –У–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П
• –Я–Њ—А—Д–Є—А–Є—П
• –Я–Њ–Ј–і–љ–Є–є —В–Њ–Ї—Б–Є–Ї–Њ–Ј –±–µ—А–µ–Љ–µ–љ–љ—Л—Е
–Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Р–У –њ–Њ –њ–∞—В–Њ–≥–µ–љ–µ–Ј—Г:
I) –Р–У –≤—Л–±—А–Њ—Б–∞ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —Г–≤–µ–ї–Є—З–µ–љ–Є—П —Г–і–∞—А–љ–Њ–≥–Њ (–£–Ю–°) –Є –Љ–Є–љ—Г—В–љ–Њ–≥–Њ (–Ь–Ю–°) –Њ–±—К–µ–Љ–Њ–≤ —Б–µ—А–і—Ж–∞
II) –У–Є–њ–µ—А—В–µ–љ–Ј–Є—П —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П (–њ–Њ–≤—Л—И–µ–љ–Є–µ —В–Њ–љ—Г—Б–∞ –∞—А—В–µ—А–Є–Њ–ї)
III) –Ю–±—К–µ–Љ–љ–∞—П (–≥–Є–њ–µ—А–≤–Њ–ї–µ–Љ–Є—З–µ—Б–Ї–∞—П) –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П (–њ–Њ–ї–Є—Ж–Є—В–µ–Љ–Є—П)
–Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Р–У –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ—Г —В–µ—З–µ–љ–Є—О:
I) –Ф–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–∞—П
II) –Ч–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–∞—П – –Њ—Б—В—А–Њ–µ —А–∞–Ј–≤–Є—В–Є–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є –љ–∞ —Д–Њ–љ–µ –љ–µ–Ї—Г–њ–Є—А—Г—О—Й–µ–≥–Њ—Б—П –≤—Л—Б–Њ–Ї–Њ–≥–Њ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П
–°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ –Т–Ю–Ч, –≤–µ–і—Г—Й–Є–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є —Б–Љ–µ—А—В–Є –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є —П–≤–ї—П—О—В—Б—П –Є–љ—Б—Г–ї—М—В (14,6%) –Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–∞—П –±–Њ–ї–µ–Ј–љ—М —Б–µ—А–і—Ж–∞ (13,4%), –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, 2,1% —Б–Љ–µ—А—В–µ–є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Н—В–Є—Е –њ–∞—В–Њ–ї–Њ–≥–Є–є. –Т –Њ—В–љ–Њ—И–µ–љ–Є–Є –Р–У –†–Њ—Б—Б—В–∞—В –њ—А–Є–≤–Њ–і–Є—В –і–∞–љ–љ—Л–µ, –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —Б–ї–µ–і—Г–µ—В, —З—В–Њ –њ–Њ–≤—Л—И–µ–љ–љ—Л–µ —Ж–Є—Д—А—Л –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –Є–Љ–µ—О—В –Љ–µ—Б—В–Њ —Г 30 –Љ–ї–љ –љ–∞—И–Є—Е —Б–Њ–Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤, —З—В–Њ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 21% –Њ—В –Њ–±—Й–µ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П —Б—В—А–∞–љ—Л. –Я—А–Є —Н—В–Њ–Љ –Њ—Д–Є—Ж–Є–∞–ї—М–љ–∞—П —Б—В–∞—В–Є—Б—В–Є–Ї–∞ —Г—З–Є—В—Л–≤–∞–µ—В —В–Њ–ї—М–Ї–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Њ–±—А–∞—Й–∞–µ–Љ–Њ—Б—В–Є –Є–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –і–Є—Б–њ–∞–љ—Б–µ—А–Є–Ј–∞—Ж–Є–Є –љ–∞—Б–µ–ї–µ–љ–Є—П. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –љ–∞ –њ—А–∞–Ї—В–Є–Ї–µ –і–µ–ї–∞ –Њ–±—Б—В–Њ—П—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Е—Г–ґ–µ. –Р —Б—Г—Й–µ—Б—В–≤—Г–µ—В –ї–Є —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –∞—А—В–µ—А–Є–∞–ї—М–љ—Л–Љ –і–∞–≤–ї–µ–љ–Є–µ–Љ –Є —З–∞—Б—В–Њ—В–Њ–є —А–∞–Ј–≤–Є—В–Є—П –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Ї–∞—В–∞—Б—В—А–Њ—Д, –Њ—В –Ї–Њ—В–Њ—А—Л—Е –њ–Њ–≥–Є–±–∞–µ—В —В–∞–Ї –Љ–љ–Њ–≥–Њ –ї—О–і–µ–є?
–° —Н—В–Њ–є —Ж–µ–ї—М—О –≤ –Њ–і–љ–Њ–Љ –Є–Ј –Ї—А—Г–њ–љ—Л—Е –Љ–љ–Њ–≥–Њ–њ—А–Њ—Д–Є–ї—М–љ—Л—Е —Б—В–∞—Ж–Є–Њ–љ–∞—А–Њ–≤ —Б–Ї–Њ—А–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –Ь–Њ—Б–Ї–≤—Л, –±—Л–ї–Њ –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–Њ 3239 –њ—А–Њ—В–Њ–Ї–Њ–ї–Њ–≤ –∞—Г—В–Њ–њ—Б–Є–є –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 3 –≥–Њ–і–∞. –Я–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Њ –Ї–Њ–љ—Б—В–∞—В–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ –љ–∞ –і–Њ–ї—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л (–°–°–Ч) –њ—А–Є—Е–Њ–і–Є—В—Б—П –њ–Њ—З—В–Є 50% –≤—Б–µ—Е –њ—А–Є—З–Є–љ –ї–µ—В–∞–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –≤ 96% —Б–ї—Г—З–∞–µ–≤ –≤—Л—П–≤–ї–µ–љ—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ–Њ–≤—Л—И–µ–љ–Є—П –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, –њ–Њ –њ–Њ–≤–Њ–і—Г –Ї–Њ—В–Њ—А–Њ–≥–Њ —Г –њ–Њ–і–∞–≤–ї—П—О—Й–µ–є –Љ–∞—Б—Б—Л –±–Њ–ї—М–љ—Л—Е –љ–µ –±—Л–ї–Њ –њ–Њ–і–Њ–±—А–∞–љ–Њ –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Р–≤—В–Њ—А–∞–Љ–Є –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –Р–У –њ—А–Є –Њ—Б—В—А–Њ–Љ –Є–љ—Д–∞—А–Ї—В–µ –Љ–Є–Њ–Ї–∞—А–і–∞ –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ 85%, –њ—А–Є –њ–Њ—Б—В–Є–љ—Д–∞—А–Ї—В–љ–Њ–Љ –Ї–∞—А–і–Є–Њ—Б–Ї–ї–µ—А–Њ–Ј–µ – –≤ 67%, –њ—А–Є –Њ—Б—В—А–Њ–Љ –љ–∞—А—Г—И–µ–љ–Є–Є –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П – –≤ 95%, –∞ –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є –Є–љ—Д–∞—А–Ї—В–∞ –Є –Є–љ—Б—Г–ї—М—В–∞ – –≤ 91% —Б–ї—Г—З–∞–µ–≤. –Ю–і–љ–∞–Ї–Њ –Р–У —П–≤–ї—П–µ—В—Б—П —Г–і–µ–ї–Њ–Љ –љ–µ —В–Њ–ї—М–Ї–Њ –±–Њ–ї—М–љ—Л—Е —Б –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є, –љ–Њ –і–Њ–≤–Њ–ї—М–љ–Њ —З–∞—Б—В–Њ –≤—Б—В—А–µ—З–∞–µ—В—Б—П –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –ї–µ–≥–Ї–Є—Е (–•–Ю–С–Ы) (83%) –Є –њ—А–Є —Б–∞—Е–∞—А–љ–Њ–Љ –і–Є–∞–±–µ—В–µ 2––≥–Њ —В–Є–њ–∞ (–°–Ф) (89%), –∞ —В–∞–Ї–ґ–µ –≤ 72% —Б–ї—Г—З–∞–µ–≤ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –њ—А–Є—З–Є–љ–Њ–є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–•–Я–Э).
–Я—А–Є —Н—В–Њ–Љ –Р–У —П–≤–ї—П–µ—В—Б—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Д–Њ–љ–Њ–≤–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є, —Г—В—П–ґ–µ–ї—П—О—Й–µ–є –Њ–±—Й–µ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б—В—А–∞–і–∞—О—Й–Є—Е —Ж–µ–ї—Л–Љ —Б–њ–µ–Ї—В—А–Њ–Љ —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –Ї–Њ—В–Њ—А–∞—П –Њ–±—К–µ–і–Є–љ–µ–љ–∞ –≤ –њ–Њ–љ—П—В–Є–µ –њ–Њ–ї–Є–њ–∞—В–Є–Є. –І–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –њ–Њ–ї–Є–њ–∞—В–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 33%, –∞ –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–є —П–≤–ї—П–µ—В—Б—П –њ–Њ–ї–Є–њ–∞—В–Є—П, –≤–Ї–ї—О—З–∞—О—Й–∞—П –≤ —Б–µ–±—П 3–4 –љ–Њ–Ј–Њ–ї–Њ–≥–Є–Є (—В–∞–±–ї. 2).
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Ї–∞–Ї —Г–њ–Њ–Љ–Є–љ–∞–ї–Њ—Б—М —А–∞–љ–µ–µ, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–У, —Г–Љ–µ—А—И–Є—Е –Њ—В –Њ—Б—В—А–Њ–≥–Њ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞, –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –≤ 10% —Б–ї—Г—З–∞–µ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —Б–Њ—З–µ—В–∞–µ—В—Б—П —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–є –±–Њ–ї–µ–Ј–љ—М—О –ї–µ–≥–Ї–Є—Е (–•–Ю–С–Ы), –≤ 27% —Б–ї—Г—З–∞–µ–≤ – —Б –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П–Љ–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–є –Є –≤ 34% —Б–ї—Г—З–∞–µ–≤ – —Б –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є –≥–Є–њ–µ—А–њ–ї–∞–Ј–Є–µ–є –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (–Ф–У–Я–Ц) [1].
–Я–Њ–і–Њ–±–љ–∞—П –Ї–∞—А—В–Є–љ–∞ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–љ—Д–∞—А–Ї—В–Њ–Љ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞. –Ы–Є—И—М 14% –Є–Ј –љ–Є—Е –љ–µ –Є–Љ–µ—О—В –Ї—А–Њ–Љ–µ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –Р–У –і—А—Г–≥–Є—Е –њ–∞—В–Њ–ї–Њ–≥–Є–є. –Ю—Б—В–∞–ї—М–љ—Л–µ –ґ–µ –±–Њ–ї—М–љ—Л–µ —Б—В—А–∞–і–∞—О—В —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ (–°–Ф) 2––≥–Њ —В–Є–њ–∞ (14%), –•–Ю–С–Ы (26%), –Ф–У–Я–Ц (21%).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –∞–≤—В–Њ—А–∞–Љ —Б–і–µ–ї–∞—В—М —А—П–і –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ—Л—Е –≤—Л–≤–Њ–і–Њ–≤, –≥–ї–∞—Б—П—Й–Є—Е, —З—В–Њ, –≤–Њ––њ–µ—А–≤—Л—Е, –≤—Б–µ —Б–Њ—Б—Г–і–Є—Б—В—Л–µ –љ–µ–≥–∞—В–Є–≤–љ—Л–µ –њ—А–Њ–≥–љ–Њ–Ј—Л –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ—Л —Б –Р–У, –≤–Њ––≤—В–Њ—А—Л—Е, —З—В–Њ —З–∞—Б—В–Њ—В–∞ —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –Њ—Б—В—А—Л—Е —Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–∞–љ—Л –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є, –Є, –љ–∞–Ї–Њ–љ–µ—Ж, –≤–—В—А–µ—В—М–Є—Е, —З—В–Њ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П –±–Њ–ї—М–љ—Л—Е —Б –Р–У —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —В—А—Г–і–љ–Њ—Б—В–Є –≤ –≤—Л–±–Њ—А–µ –љ—Г–ґ–љ–Њ–≥–Њ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞.
–Ъ–∞–Ї–Њ–≤—Л –ґ–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —А–∞–Ј–≤–Є—В–Є—П —Б—В–Њ–ї—М –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –Є –≥—А–Њ–Ј–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П, –Ї–∞–Ї –Р–У? –Ю–љ–Є –≤–µ—Б—М–Љ–∞ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л. –°–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –Є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї—Г—О –њ–Њ–ї–Є—Д–∞–Ї—В–Њ—А–љ–Њ—Б—В—М —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є —Г—П—Б–љ–Є—В—М, —З—В–Њ –Њ–љ–Њ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –Є —Д–∞–Ї—В–Њ—А–Њ–≤ –≤–љ–µ—И–љ–µ–є —Б—А–µ–і—Л –љ–∞ —Д–Њ–љ–µ –і–Є—Б–±–∞–ї–∞–љ—Б–∞ –Њ—Б–љ–Њ–≤–љ—Л—Е –њ—А–µ—Б—Б–Њ—А–љ—Л—Е –Є –і–µ–њ—А–µ—Б—Б–Њ—А–љ—Л—Е —Б–Є—Б—В–µ–Љ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –С–Њ–ї–µ–µ –њ–Њ–і—А–Њ–±–љ–Њ —А–∞—Б—Б–Љ–Њ—В—А–Є–Љ –њ—А–µ—Б—Б–Њ—А–љ—Л–µ –∞–≥–µ–љ—В—Л —Б–Є—Б—В–µ–Љ—Л –Ї–Њ–љ—В—А–Њ–ї—П –Р–Ф.
–Т –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Б–ї–µ–і—Г–µ—В —Г–њ–Њ–Љ—П–љ—Г—В—М –њ–Њ–≤—Л—И–µ–љ–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–Є–Љ–њ–∞—В–Њ––∞–і—А–µ–љ–∞–ї–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л (–°–Р–°), –Ї–Њ—В–Њ—А–∞—П —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –њ–µ—А–≤–Є—З–љ–Њ–є –Р–У –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –µ–µ —Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О. –Р–Ї—В–Є–≤–∞—Ж–Є—П —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –Љ–µ—А–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ —Б—В—А–µ—Б—Б–Њ–≤—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –Є –Љ–∞–ї–Њ–њ–Њ–і–≤–Є–ґ–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –ґ–Є–Ј–љ–Є. –С–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≤ —А–∞–Ј–≤–Є—В–Є–Є –µ–µ –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є–Љ–µ—О—В –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л, –Ї—Г—А–µ–љ–Є–µ, –њ–Њ—Б—В–Њ—П–љ–љ–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –≤—Л—Б–Њ–Ї–Њ–Ї–∞–ї–Њ—А–Є–є–љ–Њ–є –і–Є–µ—В—Л. –Ю–њ—А–µ–і–µ–ї–µ–љ–љ–∞—П —А–Њ–ї—М –≤ –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В —В–∞–Ї–ґ–µ –Є –љ–∞—А—Г—И–µ–љ–Є—О —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –Р–Ї—В–Є–≤–∞—Ж–Є—П –°–Р–° –љ–µ —В–Њ–ї—М–Ї–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—О –Р–Ф –Є —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є –≤ –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ –Р–У, –љ–Њ –Є –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –і—А—Г–≥–Є–µ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б–Є—Б—В–µ–Љ—Г, –Є–≥—А–∞—П –Њ–і–љ—Г –Є–Ј –Ї–ї—О—З–µ–≤—Л—Е —А–Њ–ї–µ–є –≤ —А–∞–Ј–≤–Є—В–Є–Є –љ–∞—А—Г—И–µ–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ–≥–Њ —А–Є—В–Љ–∞ –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є —А–Є—Б–Ї–∞ –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–Љ–µ—А—В–Є. –Я–Њ–≤—Л—И–µ–љ–љ—Л–є —В–Њ–љ—Г—Б —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –љ–∞—А–∞—Б—В–∞–љ–Є–µ–Љ –і–Є—Б–ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ–µ–Љ–Є–Є –Є –±–ї–∞–≥–Њ–њ—А–Є—П—В—Б—В–≤—Г–µ—В —А–∞–Ј–≤–Є—В–Є—О –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Б–µ—А–і—Ж–∞ (–Ш–С–°).
–У–Є–њ–µ—А–∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–Є–Љ–њ–∞—В–Њ––∞–і—А–µ–љ–∞–ї–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ—А–Є–≤–Њ–і–Є—В –љ–µ —В–Њ–ї—М–Ї–Њ –Ї –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—Ж–Є–Є, –љ–Њ –Є –Ї –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є, –Ї–Њ—В–Њ—А–∞—П –≤—Л—П–≤–ї—П–µ—В—Б—П –±–Њ–ї–µ–µ —З–µ–Љ —Г 50% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є. –Ш–Љ–µ–љ–љ–Њ –Њ–љ–∞, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –њ–Њ–≤—Л—И–∞—П —В–Њ–љ—Г—Б —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –≤–µ–і–µ—В –Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, –Р–У, —А–∞–Ј–≤–Є—В–Є—О –°–Ф 2––≥–Њ —В–Є–њ–∞ –Є –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є–Є (—А–Є—Б. 1).
–Т—Л—Б–Њ–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –≤ –њ–Њ—З–Ї–∞—Е —А–µ–љ–Є–љ–∞ –Є –≤—Л–Ј—Л–≤–∞–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є—О –≤—Б–µ–є —А–µ–љ–Є–љ––∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ––∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —А–Њ—Б—В—Г –Њ–±—Й–µ–≥–Њ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П —Б–Њ—Б—Г–і–Њ–≤ (–Ю–Я–°–°), –Ј–∞–і–µ—А–ґ–Ї–µ –Є–Њ–љ–Њ–≤ –љ–∞—В—А–Є—П –Є –Љ–Њ–ї–µ–Ї—Г–ї –≤–Њ–і—Л –Є, –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ, –њ–Њ–≤—Л—И–µ–љ–Є—О –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П.
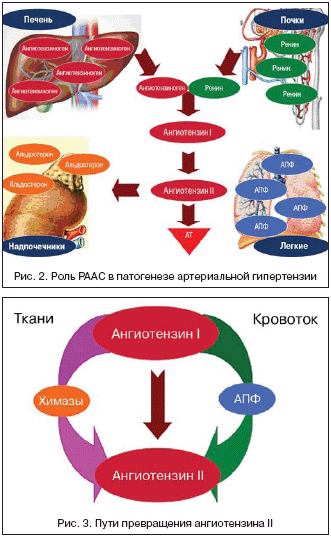
–Э–µ–Љ–∞–ї–Њ–≤–∞–ґ–љ—Г—О —А–Њ–ї—М –Є–≥—А–∞–µ—В –Є –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–љ–Њ—Б—В—М —А–µ–љ–Є–љ––∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ––∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л (–†–Р–Р–°). –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ–Њ–≤—Л—И–µ–љ–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –†–Р–Р–°, –Ї–∞–Ї —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–µ–є –≤ –Ї—А–Њ–≤–Є, —В–∞–Ї –Є —В–Ї–∞–љ–µ–≤–Њ–є, —Б—З–Є—В–∞–µ—В—Б—П –≤–∞–ґ–љ–µ–є—И–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Р–У –Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞. –†–Р–Р–° – —Н—В–Њ —Б–ї–Њ–ґ–љ–Њ –Њ—А–≥–∞–љ–Є–Ј–Њ–≤–∞–љ–љ–∞—П –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–—Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–∞—П —Б–Є—Б—В–µ–Љ–∞, –≤ –Ї–Њ—В–Њ—А—Г—О –≤–Њ–≤–ї–µ—З–µ–љ—Л –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ –Њ—А–≥–∞–љ—Л –Є —В–Ї–∞–љ–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –Э–Њ –њ—А–µ–ґ–і–µ —З–µ–Љ –њ–µ—А–µ—Е–Њ–і–Є—В—М –Ї –≤–Њ–њ—А–Њ—Б–∞–Љ —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –±–Њ–ї–µ–µ –њ–Њ–і—А–Њ–±–љ–Њ –Њ—Б—В–∞–љ–Њ–≤–Є—В—М—Б—П –Є–Љ–µ–љ–љ–Њ –љ–∞ —А–∞–±–Њ—В–µ –†–Р–Р–°. –Т –љ–Њ—А–Љ–µ –≤ –њ–µ—З–µ–љ–Є –Ј–і–Њ—А–Њ–≤–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞ –Є–і–µ—В –∞–Ї—В–Є–≤–љ—Л–є —Б–Є–љ—В–µ–Ј a2––≥–ї–Њ–±—Г–ї–Є–љ–∞ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≥–µ–љ–∞. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤ –≥—А–∞–љ—Г–ї—П—А–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е —О–Ї—Б—В–∞–≥–ї–Њ–Љ–µ—А—Г–ї—П—А–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ –њ–Њ—З–µ–Ї –≤ –Њ—В–≤–µ—В –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ –≤–љ—Г—В—А–Є–њ–Њ—З–µ—З–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, —Б–љ–Є–ґ–µ–љ–љ—Г—О –і–Њ—Б—В–∞–≤–Ї—Г –Є–Њ–љ–Њ–≤ –љ–∞—В—А–Є—П –Є —Е–ї–Њ—А–∞, –∞ —В–∞–Ї–ґ–µ –≥–Є–њ–Њ–Ї—Б–Є—О –∞–Ї—В–Є–≤–љ–Њ –≤—Л—А–∞–±–∞—В—Л–≤–∞–µ—В—Б—П –њ—А–Њ—В–µ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–є —Д–µ—А–Љ–µ–љ—В —А–µ–љ–Є–љ, –Ї–Њ—В–Њ—А—Л–є, –≤—Л—Е–Њ–і—П –≤ —Б–Є—Б—В–µ–Љ–љ—Л–є –Ї—А–Њ–≤–Њ—В–Њ–Ї, –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г–µ—В —Б –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≥–µ–љ–Њ–Љ, –њ—А–Є–≤–Њ–і—П –Ї –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—О –і—А—Г–≥–Њ–≥–Њ –њ–µ–њ—В–Є–і–∞ – –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ I. –Я–Њ—Б–ї–µ–і–љ–Є–є –љ–µ –Њ–±–ї–∞–і–∞–µ—В –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ—А–µ—Б—Б–Њ—А–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, —П–≤–ї—П—П—Б—М –ї–Є—И—М –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–Љ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II – –≥–ї–∞–≤–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ –†–Р–Р–°. –Ф–∞–љ–љ–Њ–µ –њ—А–µ–≤—А–∞—Й–µ–љ–Є–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–њ—А–µ–≤—А–∞—Й–∞—О—Й–µ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ (–Р–Я–§), –љ–∞–Ї–∞–њ–ї–Є–≤–∞–µ–Љ–Њ–≥–Њ –≤ –Њ–≥—А–Њ–Љ–љ—Л—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞—Е –≤ —Б–Њ—Б—Г–і–∞—Е –ї–µ–≥–Ї–Є—Е.
–Р–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ II –Ї—А–Њ–Љ–µ –Љ–Њ—Й–љ–Њ–≥–Њ –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞, —В–∞–Ї–ґ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤—Г–µ—В –љ–∞ –Њ—А–≥–∞–љ—Л –Љ–Є—И–µ–љ–Є, –≤ –Ї–Њ—В–Њ—А—Л—Е —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ—Л —А–µ—Ж–µ–њ—В–Њ—А—Л –Ї –љ–µ–Љ—Г (—Н–љ–і–Њ—В–µ–ї–Є–є —Б–Њ—Б—Г–і–Њ–≤, —Б–µ—А–і—Ж–µ, –њ–Њ—З–Ї–Є, –њ–µ—З–µ–љ—М, –≥–Њ–ї–Њ–≤–љ–Њ–є –Љ–Њ–Ј–≥ –Є –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Є), –њ—А–Є–≤–Њ–і—П –Ї —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—О —Б–Њ—Б—Г–і–Њ–≤, –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞, –Љ–Є–Њ–Ї–∞—А–і–Є–Њ—Д–Є–±—А–Њ–Ј—Г, –љ–µ—Д—А–Њ–∞–љ–≥–Є–Њ—Б–Ї–ї–µ—А–Њ–Ј—Г, —Г—Б–Є–ї–µ–љ–Є—О —Б–Є–љ—В–µ–Ј–∞ –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –Є —В.–і. –Ш–Љ–µ–љ–љ–Њ –њ–Њ—Н—В–Њ–Љ—Г, –Ї—А–Њ–Љ–µ –Р–У, —А–µ–љ–Є–љ––∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ––∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤–∞—П —Б–Є—Б—В–µ–Љ–∞ —В–∞–Ї–ґ–µ –Є–≥—А–∞–µ—В —А–Њ–ї—М –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Б–µ—А–і—Ж–∞, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є (–•–°–Э) –Є –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (—А–Є—Б. 2).
–Т –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ —А–∞–Ј–≥–Њ–≤–Њ—А–∞ –Њ —Б–∞—А—В–∞–љ–∞—Е –љ—Г–ґ–љ–Њ –≤–љ–Њ–≤—М —Г–њ–Њ–Љ—П–љ—Г—В—М, —З—В–Њ –њ—А–µ–≤—А–∞—Й–µ–љ–Є–µ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ I –≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ II –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –Р–Я–§ –Є–і–µ—В –ї–Є—И—М –≤ —Б–Є—Б—В–µ–Љ–љ–Њ–Љ –Ї—А–Њ–≤–Њ—В–Њ–Ї–µ, –≤ —В–Ї–∞–љ—П—Е –ґ–µ –Њ–љ–Њ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ —Д–µ—А–Љ–µ–љ—В–Њ–≤ —Е–Є–Љ–∞–Ј—Л –Є CAGE (—Е–Є–Љ–Њ—Б—В–∞—В–Є–љ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–є –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–II –≥–µ–љ–µ—А–Є—А—Г—О—Й–Є–є —Д–µ—А–Љ–µ–љ—В). –С–Њ–ї–µ–µ —В–Њ–≥–Њ, —Д–µ—А–Љ–µ–љ—В—Л –Ї–∞—В–µ–њ—Б–Є–љ G, —Н–ї–∞—Б—В–∞–Ј–∞ –Є —В–Њ–љ–Є–љ –њ–Њ–Ј–≤–Њ–ї—П—О—В —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞—В—М –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ II –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –Є–Ј –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≥–µ–љ–∞, –Љ–Є–љ—Г—П —Н—В–∞–њ –µ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Б —А–µ–љ–Є–љ–Њ–Љ (—А–Є—Б. 3).
–Ш–Љ–µ–љ–љ–Њ —Е–Є–Љ–∞–Ј–љ—Л–Љ, –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ –Њ—В –Р–Я–§, –њ—Г—В–µ–Љ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –і–ї–Є—В–µ–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –†–Р–Р–°, –њ—А–Є–≤–Њ–і—П—Й–Є–µ –Ї —А–∞–Ј–≤–Є—В–Є—О –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ –Њ—А–≥–∞–љ–∞—Е –Є —В–Ї–∞–љ—П—Е, –Ї–Њ—В–Њ—А—Л–µ –љ–µ –Љ–Њ–≥—Г—В –±—Л—В—М –њ–Њ–ї–љ–Њ—Б—В—М—О –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞–љ—Л —В–Њ–ї—М–Ї–Њ –њ—А–Є–µ–Љ–Њ–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Є–љ–≥–Є–±–Є—А—Г—О—Й–Є—Е –Р–Я–§.
–°—Г—Й–µ—Б—В–≤—Г—О—В –Є –і—А—Г–≥–Є–µ –њ—Г—В–Є —А–∞–Ј–≤–Є—В–Є—П –Р–У, –Њ–і–Є–љ –Є–Ј –љ–Є—Е – Na––Ј–∞–≤–Є—Б–Є–Љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ.
–Ь–µ–ґ–і—Г –†–Р–Р–° –Є —Б–µ–Ї—А–µ—Ж–Є–µ–є –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –Ї–ї—Г–±–Њ—З–Ї–Њ–≤–Њ–є –Ј–Њ–љ–Њ–є –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤ –Є–Љ–µ—О—В—Б—П —В–µ—Б–љ—Л–µ –≤–Ј–∞–Є–Љ–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П. –Р–ї—М–і–Њ—Б—В–µ—А–Њ–љ – –≥–Њ—А–Љ–Њ–љ, —Г—З–∞—Б—В–≤—Г—О—Й–Є–є –≤ –Ї–Њ–љ—В—А–Њ–ї–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ —А–µ–≥—Г–ї—П—Ж–Є–Є –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј–∞ –Ї–∞–ї–Є—П, –љ–∞—В—А–Є—П –Є –Њ–±—К–µ–Љ–∞ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є. –¶–Є—А–Ї—Г–ї—П—В–Њ—А–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –љ–∞—З–Є–љ–∞—О—В –њ—А–Њ—П–≤–ї—П—В—М—Б—П –ї–Є—И—М —Б–њ—Г—Б—В—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —З–∞—Б–Њ–≤ –Є –і–Њ—Б—В–Є–≥–∞—О—В –Љ–∞–Ї—Б–Є–Љ—Г–Љ–∞ —З–µ—А–µ–Ј –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –і–љ–µ–є. –Ф–µ–є—Б—В–≤–Є–µ –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–Њ –≤ –і–Є—Б—В–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–∞—Е –њ–Њ—З–µ—З–љ—Л—Е –Ї–∞–љ–∞–ї—М—Ж–µ–≤ –Є —Б–Њ–±–Є—А–∞—В–µ–ї—М–љ—Л—Е —В—А—Г–±–Њ—З–Ї–∞—Е. –Я–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ —Н—В–Њ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞, —Г—Б–Є–ї–Є–≤–∞—О—Й–µ–≥–Њ –Ї–∞–љ–∞–ї—М—Ж–µ–≤—Г—О —А–µ–∞–±—Б–Њ—А–±—Ж–Є—О –Ї–∞—В–Є–Њ–љ–Њ–≤ –љ–∞—В—А–Є—П, –∞–љ–Є–Њ–љ–Њ–≤ —Е–ї–Њ—А–∞ –Є –≤–Њ–і—Л, –∞ —В–∞–Ї–ґ–µ –Ї–∞–љ–∞–ї—М—Ж–µ–≤—Г—О —Н–Ї—Б–Ї—А–µ—Ж–Є—О –Ї–∞—В–Є–Њ–љ–Њ–≤ –Ї–∞–ї–Є—П, –њ–Њ–≤—Л—И–∞–µ—В—Б—П –≥–Є–і—А–Њ—Д–Є–ї—М–љ–Њ—Б—В—М —В–Ї–∞–љ–µ–є, —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–µ—А–µ—Е–Њ–і—Г –≤ –љ–Є—Е –Є–Ј —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А—Г—Б–ї–∞ –ґ–Є–і–Ї–Њ—Б—В–Є –Є –Є–Њ–љ–Њ–≤ –љ–∞—В—А–Є—П, —Г–≤–µ–ї–Є—З–µ–љ–Є—О –Њ–±—К–µ–Љ–∞ —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–µ–є –Ї—А–Њ–≤–Є –Є –њ–Њ–≤—Л—И–µ–љ–Є—О –Р–Ф. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ –њ–Њ–≤—Л—И–∞–µ—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –≥–ї–∞–і–Ї–Є—Е –Љ—Л—И—Ж —Б–Њ—Б—Г–і–Њ–≤ –Ї –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–љ—Л–Љ –∞–≥–µ–љ—В–∞–Љ, —Г—Б–Є–ї–Є–≤–∞—П –і–µ–є—Б—В–≤–Є–µ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II, –Є —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≤ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ–µ, –њ–Њ—В–µ–љ—Ж–Є—А—Г—П —Н—Д—Д–µ–Ї—В—Л –†–Р–Р–°. –Ш, –љ–∞–Ї–Њ–љ–µ—Ж, —Г –±–Њ–ї—М–љ—Л—Е –Р–У –љ–∞ —Д–Њ–љ–µ –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –°–Р–° –Є –†–Р–Р–° –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–∞–ї–ї–Є–Ї—А–µ–Є–љ––Ї–Є–љ–Є–љ–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л, –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П —Н–љ–і–Њ—В–µ–ї–Є—П —Б –і–Є—Б–±–∞–ї–∞–љ—Б–Њ–Љ —Б–Є–љ—В–µ–Ј–∞ –≤ –љ–µ–Љ –≤–∞–Ј–Њ–і–Є–ї–∞—В–Є—А—Г—О—Й–Є—Е –Є –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–љ—Л—Е –∞–≥–µ–љ—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ –љ–∞—А—Г—И–µ–љ–Є–µ –і–µ–њ—А–µ—Б—Б–Њ—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Я–µ—А–µ—Е–Њ–і—П –Ї –≤–Њ–њ—А–Њ—Б–∞–Љ –ї–µ—З–µ–љ–Є—П –Р–У, –љ—Г–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є –≤ —Ж–µ–ї–Њ–Љ, –Є –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Б—Г—Й–µ—Б—В–≤—Г–µ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –і–µ—Б—П—В–Ї–Њ–≤ –Є–Љ–µ—О—Й–Є—Е –њ—А–∞–≤–Њ –љ–∞ —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–љ–Є–µ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П —Б–љ–Є–ґ–µ–љ–Є—П –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –Є —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –≤–µ—Й–µ—Б—В–≤, –Њ–±–ї–∞–і–∞—О—Й–Є—Е –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ. –Я—А–Є–≤–µ–і–µ–Љ –ї–Є—И—М –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Є–Ј –љ–Є—Е. –Т —В–∞–±–ї–Є—Ж–µ 3 –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е —Б—А–µ–і—Б—В–≤ –њ–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Г –і–µ–є—Б—В–≤–Є—П.
–°—Г—Й–µ—Б—В–≤—Г—О—В –Є –і—А—Г–≥–Є–µ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є, —Б–Њ–≥–ї–∞—Б–љ–Њ –Ї–Њ—В–Њ—А—Л–Љ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Њ–±–ї–∞–і–∞—О—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ (–Є–љ–≥–Є–±–Є—В–Њ—А—Л –Р–Я–§, —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ a1––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л, –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞, –∞–≥–Њ–љ–Є—Б—В—Л –Є–Љ–Є–і–∞–Ј–Њ–ї–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤), –і—А—Г–≥–Є–µ –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П (–∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л –Ї–∞–ї—М—Ж–Є—П –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П, —Г–ї—М—В—А–∞—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ b––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л, —В–Є–∞–Ј–Є–і–љ—Л–µ –і–Є—Г—А–µ—В–Є–Ї–Є), –∞ —В—А–µ—В—М–Є–Љ —Б–≤–Њ–є—Б—В–≤–µ–љ–љ–Њ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ (–љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ b––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л, –њ–µ—В–ї–µ–≤—Л–µ –і–Є—Г—А–µ—В–Є–Ї–Є). –Ю–і–љ–∞–Ї–Њ –ї—О–±–Њ–є –Є–Ј –љ–Є—Е «–≤ –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –і–Њ–Ј–µ –Є –њ—А–Є –њ—А–∞–≤–Є–ї—М–љ–Њ–Љ —А–µ–ґ–Є–Љ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —П–≤–ї—П–µ—В—Б—П –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ –њ–Њ –Ї–Њ–љ—В—А–Њ–ї—О –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –Є –≤–ї–Є—П–љ–Є—О –љ–∞ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л–µ —Б–Њ–±—Л—В–Є—П –Є –љ–µ –Є–Љ–µ–µ—В –Ї–∞–Ї–Є—Е––ї–Є–±–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤» [—Г—А–Њ–≤–µ–љ—М –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ—Б—В–Є –Р] [–Т–Ю–Ч]. –Э–Њ –≤ —В–Њ –ґ–µ –≤—А–µ–Љ—П –Є–Ј –≤—Б–µ–≥–Њ –Љ–љ–Њ–ґ–µ—Б—В–≤–∞ —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –≤–µ—Й–µ—Б—В–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П –Р–У –Т–Ю–Ч —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В –ї–Є—И—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≥—А—Г–њ–њ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –∞ –Є–Љ–µ–љ–љ–Њ: b––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л, –і–Є—Г—А–µ—В–Є–Ї–Є (—В–Є–∞–Ј–Є–і–љ—Л–µ, –њ–µ—В–ї–µ–≤—Л–µ, –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞), –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л –Ї–∞–ї—М—Ж–Є—П, –Є–љ–≥–Є–±–Є—В–Њ—А—Л –Р–Я–§ –Є –±–ї–Њ–Ї–∞—В–Њ—А—Л —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–µ –і–Њ–ї–ґ–љ—Л –љ–∞–Ј–љ–∞—З–∞—В—М—Б—П –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–Є–≤–ї–µ–Ї–∞–µ—В –Ї —Б–µ–±–µ –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞–Є–±–Њ–ї–µ–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ–∞—П –Є —Б–Њ–≤—А–µ–Љ–µ–љ–љ–∞—П –≥—А—Г–њ–њ–∞ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ – –±–ї–Њ–Ї–∞—В–Њ—А—Л —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ –Є–ї–Є —Б–∞—А—В–∞–љ—Л –Є –Є—Е –Ї–Њ–љ–Ї—А–µ—В–љ—Л–є –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—М –≤–∞–ї—Б–∞—А—В–∞–љ (–Т–∞–ї—М—Б–∞–Ї–Њ—А, –≤—Л–њ—Г—Б–Ї–∞—О—Й–Є–є—Б—П —Б–ї–Њ–≤–µ–љ—Б–Ї–Њ–є –Ї–Њ–Љ–њ–∞–љ–Є–µ–є –Ъ–†–Ъ–Р, –Ї–Њ—В–Њ—А—Л–є –Њ–±–ї–∞–і–∞–µ—В –њ–Њ–ї–љ–Њ–є –±–Є–Њ—Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ—Б—В—М—О —Б –Њ—А–Є–≥–Є–љ–∞–ї—М–љ—Л–Љ –≤–∞–ї—Б–∞—А—В–∞–љ–Њ–Љ).
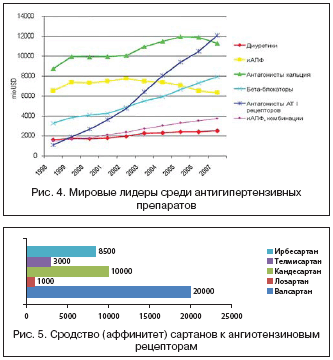
–Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М —Б–∞—А—В–∞–љ—Л –Ј–∞–љ–Є–Љ–∞—О—В –ї–Є–і–Є—А—Г—О—Й—Г—О –њ–Њ–Ј–Є—Ж–Є—О —Б—А–µ–і–Є –≤—Б–µ—Е –Ї–ї–∞—Б—Б–Њ–≤ –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –∞ —Б–∞–Љ—Л–Љ –љ–∞–Ј–љ–∞—З–∞–µ–Љ—Л–Љ –±–ї–Њ–Ї–∞—В–Њ—А–Њ–Љ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ —П–≤–ї—П–µ—В—Б—П –Є–Љ–µ–љ–љ–Њ –≤–∞–ї—Б–∞—А—В–∞–љ [2] (—А–Є—Б. 4).
–†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ–∞—П –љ–∞—З–∞–ї—М–љ–∞—П –і–Њ–Ј–Є—А–Њ–≤–Ї–∞ –Т–∞–ї—М—Б–∞–Ї–Њ—А–∞ –њ—А–Є –Р–У —А–∞–≤–љ–∞ 80 –Љ–≥ –і–ї—П –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–≥–Њ —Г—В—А–µ–љ–љ–µ–≥–Њ –њ—А–Є–µ–Љ–∞, –∞ –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–∞—П –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–∞—П –і–Њ–Ј–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 160 –Љ–≥ 1 —А–∞–Ј/—Б—Г—В. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —В–Є—В—А–Њ–≤–∞–љ–Є—П –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ —В—А–µ–±—Г–µ—В—Б—П, —З—В–Њ, –љ–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, –њ–Њ–≤—Л—И–∞–µ—В –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ї —В–µ—А–∞–њ–Є–Є –і–∞–љ–љ—Л–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ.
–Э–∞ –Њ—Б–љ–Њ–≤—Л–≤–∞–љ–Є–Є –љ–∞ –∞–љ–∞–ї–Є–Ј–∞ –±–Њ–ї–µ–µ 140 —В—Л—Б. –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –і–Њ–ї—П –±–Њ–ї—М–љ—Л—Е, –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–Є—Е –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Г—О —В–µ—А–∞–њ–Є—О –≤–∞–ї—Б–∞—А—В–∞–љ–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ 1 –≥–Њ–і–∞, –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї—М—И–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–µ—А–∞–њ–Є–µ–є –і—А—Г–≥–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є (–∞–Љ–ї–Њ–і–Є–њ–Є–љ –Є –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї) [3].
–Ф–ї—П –≤—Б–µ—Е —Б–∞—А—В–∞–љ–Њ–≤ —Е–∞—А–∞–Ї—В–µ—А–µ–љ –≤—Л—Б–Њ–Ї–Є–є –∞—Д—Д–Є–љ–Є—В–µ—В (—Б—В–µ–њ–µ–љ—М —Б—А–Њ–і—Б—В–≤–∞) –Ї –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≤—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ, –њ—А–µ–≤—Л—И–∞—О—Й–Є–є —В–∞–Ї–Њ–≤–Њ–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II –≤ —В—Л—Б—П—З–Є —А–∞–Ј, –љ–Њ –≤ —Н—В–Њ–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ –±–µ–Ј–Њ–≥–Њ–≤–Њ—А–Њ—З–љ–Њ –ї–Є–і–Є—А—Г–µ—В –≤—Л—Б–Њ–Ї–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–є –≤–∞–ї—Б–∞—А—В–∞–љ (—А–Є—Б. 5).
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≤—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ, –Њ—В–љ–Њ—Б—П—Й–Є–Љ—Б—П –Ї —В–Є–њ—Г 1, —Г –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –≤ 24 —В—Л—Б. —А–∞–Ј –≤—Л—И–µ, —З–µ–Љ –Ї —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ –Ї –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ—Г —В–Є–њ–∞ 2. –≠—В–Є–Љ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Є–Љ–µ–љ–љ–Њ —З–µ—А–µ–Ј —Б—В–Є–Љ—Г–ї—П—Ж–Є—О —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Ї –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ—Г 1 —В–Є–њ–∞ –Њ–њ–Њ—Б—А–µ–і—Г–µ—В—Б—П –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II, —В–∞–Ї–Є—Е –Ї–∞–Ї: –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—Ж–Є—П –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ –Р–Ф, —А–µ–∞–±—Б–Њ—А–±—Ж–Є—П –љ–∞—В—А–Є—П –≤ –њ–Њ—З–µ—З–љ—Л—Е –Ї–∞–љ–∞–ї—М—Ж–∞—Е –Є –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ, –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞, —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є –Є –Љ–Є–Њ–Ї–∞—А–і–∞ (–њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—П –Є –Љ–Є–≥—А–∞—Ж–Є—П –Ї–ї–µ—В–Њ–Ї –≥–ї–∞–і–Ї–Њ–є –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А—Л, –≥–Є–њ–µ—А–њ–ї–∞–Ј–Є—П –Є–љ—В–Є–Љ—Л, –≥–Є–њ–µ—А—В—А–Њ—Д–Є—П –Є —Д–Є–±—А–Њ–Ј –Љ–Є–Њ–Ї–∞—А–і–∞, –∞–Ї—В–Є–≤–∞—Ж–Є—П —Б–Є–Љ–њ–∞—В–Є–Ї–Њ––∞–і—А–µ–љ–∞–ї–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л (—Ж–µ–љ—В—А–∞–ї—М–љ–∞—П –љ–∞ –њ—А–µ—Б–Є–љ–∞–њ—В–Є—З–µ—Б–Ї–Њ–Љ —Г—А–Њ–≤–љ–µ –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–∞—П –≤ –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–∞—Е)), –њ–Њ–≤—Л—И–µ–љ–Є–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –±–∞—А–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –∞—А–≥–Є–љ–Є–љ––≤–∞–Ј–Њ–њ—А–µ—Б—Б–Є–љ–∞, –Ј–∞–і–µ—А–ґ–Ї–∞ –≤–Њ–і—Л –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, –њ–Њ–≤—Л—И–µ–љ–Є–µ –≥–ї–Є–Ї–Њ–≥–µ–љ–Њ–ї–Є–Ј–∞ –Є –≥–ї—О–Ї–Њ–љ–µ–Њ–≥–µ–љ–µ–Ј–∞, –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ —А–µ–љ–Є–љ–∞, –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—Ж–Є—П –њ—А–Є–љ–Њ—Б—П—Й–Є—Е –Є –≤ –µ—Й–µ –±–Њ–ї—М—И–Њ–є —Б—В–µ–њ–µ–љ–Є –≤—Л–љ–Њ—Б—П—Й–Є—Е –∞—А—В–µ—А–Є–Њ–ї –њ–Њ—З–µ—З–љ—Л—Е –Ї–ї—Г–±–Њ—З–Ї–Њ–≤, –∞ —В–∞–Ї–ґ–µ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ –Љ–µ–Ј–∞–љ–≥–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є —Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ—З–µ—З–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞. –С–Њ–ї—М—И–µ–є —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О –±–ї–Њ–Ї–∞–і—Л –†–Р–Р–°, –≤ —В–Њ–Љ —З–Є—Б–ї–µ, –Њ–±—К—П—Б–љ—П–µ—В—Б—П –ї—Г—З—И–∞—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ 1 —В–Є–њ–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Р–Я–§.
–Т–∞–ї—Б–∞—А—В–∞–љ –Њ–±–ї–∞–і–∞–µ—В –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є VALUE –Њ–љ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є, –∞ —В–∞–Ї–ґ–µ –Љ–µ–љ—М—И—Г—О –љ–∞ 19% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є –Ї–∞–ї—М—Ж–Є—П —З–∞—Б—В–Њ—В—Г –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–Ј––Ј–∞ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–•–°–Э) —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤—Л—Б–Њ–Ї–Є–Љ –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ. –Т —Е–Њ–і–µ –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П VALUE –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –≤–∞–ї—Б–∞—А—В–∞–љ, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В 2––≥–Њ —В–Є–њ–∞ –≤–Њ–Ј–љ–Є–Ї–∞–ї –љ–∞ 23% —А–µ–ґ–µ, —З–µ–Љ –њ—А–Є –њ—А–Є–µ–Љ–µ –≤—Б–µ —В–Њ–≥–Њ –ґ–µ –∞–Љ–ї–Њ–і–Є–њ–Є–љ–∞, —З—В–Њ —П–≤–Є–ї–Њ—Б—М –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ –і–Њ–≤–Њ–і–Њ–Љ –≤ –њ–Њ–ї—М–Ј—Г –Њ—А–≥–∞–љ–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л—Е —Б–≤–Њ–є—Б—В–≤ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ [4].
–Ф—А—Г–≥–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, Val–HeFT, –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э –і–Њ–±–∞–≤–ї–µ–љ–Є–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –Ї —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ј–љ–∞—З–Є–Љ–Њ (–љ–∞ 13,2%) —Б–љ–Є–ґ–∞–µ—В —А–Є—Б–Ї (–Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М) –Є —Г–ї—Г—З—И–∞–µ—В –µ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л. –Ю—Б–Њ–±–µ–љ–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ (44%) —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ –±—Л–ї–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, —Б –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –љ–∞ –†–Р–Р–° [5]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ VALIANT, –Ї–Њ—В–Њ—А–Њ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ—Б–ї–µ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞, –і–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –≤–∞–ї—Б–∞—А—В–∞–љ —Б–љ–Є–ґ–∞–µ—В —А–Є—Б–Ї –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –≤ –њ–Њ—Б—В–Є–љ—Д–∞—А–Ї—В–љ—Л–є –њ–µ—А–Є–Њ–і –љ–∞ 25%. –Т–∞–ї—Б–∞—А—В–∞–љ –њ–µ—А–µ–љ–Њ—Б–Є–ї—Б—П –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є –ї—Г—З—И–µ, —З–µ–Љ —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л–є —Б –љ–Є–Љ –Ї–∞–њ—В–Њ–њ—А–Є–ї [6].
–°–љ–Є–ґ–µ–љ–Є–µ –Р–Ф –і–Њ –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е —Ж–Є—Д—А –Є 24–—З–∞—Б–Њ–≤–Њ–є –µ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—М –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ—Л –≤ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Р–Ф —Б–љ–Є–ґ–∞–µ—В—Б—П «—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–љ–Њ», —Б–Њ—Е—А–∞–љ—П—П –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–є —Ж–Є—А–Ї–∞–і–љ—Л–є —А–Є—В–Љ (—А–Є—Б. 6) [7].
–У–Њ–≤–Њ—А—П –Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г–Ї–∞–Ј–∞—В—М, —З—В–Њ —З–∞—Б—В–Њ—В–∞ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Б–∞—А—В–∞–љ–Њ–≤ –≤ —Ж–µ–ї–Њ–Љ, –Є –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–∞ —Б —З–∞—Б—В–Њ—В–Њ–є –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ–ї–∞—Ж–µ–±–Њ [8].
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є PREVAIL –±—Л–ї–∞ –і–Њ–Ї–∞–Ј–∞–љ–∞ –ї—Г—З—И–∞—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –ї–Є–Ј–Є–љ–Њ–њ—А–Є–ї–Њ–Љ – –Ї–∞—И–µ–ї—М –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –Њ—В–Љ–µ—З–∞–ї—Б—П –≤ 2 —А–∞–Ј–∞ —А–µ–ґ–µ [9].
–Ш—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ Val–Syst –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Њ, —З—В–Њ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –∞–Љ–ї–Њ–і–Є–њ–Є–љ–Њ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –≤–∞–ї—Б–∞—А—В–∞–љ, –љ–∞–±–ї—О–і–∞–µ—В—Б—П –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–∞—П —З–∞—Б—В–Њ—В–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Њ—В–µ–Ї–Њ–≤ [10]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –≤—Л–Ј—Л–≤–∞—О—В —Н—А–µ–Ї—В–Є–ї—М–љ—Г—О –і–Є—Б—Д—Г–љ–Ї—Ж–Є—О [11]. –Я—А–Є–µ–Љ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –љ–µ –љ–µ—Б–µ—В –≤ —Б–µ–±–µ —В–∞–Ї–Њ–є –Њ–њ–∞—Б–љ–Њ—Б—В–Є: —З–∞—Б—В–Њ—В–∞ —Н—А–µ–Ї—В–Є–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є–Є —Б—А–∞–≤–љ–Є–Љ–∞ —Б –њ–ї–∞—Ж–µ–±–Њ [10].
–С–Њ–ї—М—И–Њ–є –Є–љ—В–µ—А–µ—Б –≤—Л–Ј—Л–≤–∞–µ—В –Є–Љ–µ–љ–љ–Њ –њ–Њ—Б–ї–µ–і–љ–µ–µ —Г—В–≤–µ—А–ґ–і–µ–љ–Є–µ, –∞ –њ–Њ—Н—В–Њ–Љ—Г –∞–≤—В–Њ—А–∞–Љ–Є —Б —Ж–µ–ї—М—О –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –≤–ї–Є—П–љ–Є—П –і–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ –∞–љ–і—А–Њ–≥–µ–љ–љ—Л–є —Б—В–∞—В—Г—Б –Є —Н—А–µ–Ї—В–Є–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –Љ—Г–ґ—З–Є–љ —Б –Р–У –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –Р–Я–§ –Ј–∞–њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–Њ –Є –Є–љ–Є—Ж–Є–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Љ–µ—В–Њ–і–Є–Ї, –Ї–Њ—В–Њ—А–Њ–µ –њ—А–Њ–і–ї–Є—В—Б—П 12 –љ–µ–і–µ–ї—М.
–Ш—В–∞–Ї, –±–Њ–≥–∞—В–∞—П –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–∞—П –љ–∞—Г—З–љ–∞—П –±–∞–Ј–∞ –≤–∞–ї—Б–∞—А—В–∞–љ–∞, –µ–≥–Њ –≤—Л—Б–Њ–Ї–Є–є –њ—А–Њ—Д–Є–ї—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —Г —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–∞—В–µ–≥–Њ—А–Є–є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є, –∞ —В–∞–Ї–ґ–µ –Є–љ—В–µ—А–µ—Б –µ–≥–Њ –Є–Ј—Г—З–µ–љ–Є—П –Є –∞–Ї—В—Г–∞–ї—М–љ–Њ—Б—В—М –њ—А–Њ–≤–µ–і–µ–љ–Є—П –љ–Њ–≤—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ј–≤–Њ–ї—П—О—В –≤–∞–ї—Б–∞—А—В–∞–љ—Г –љ–∞–є—В–Є —И–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е —Б –Р–У.





–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Т–µ—А—В–Ї–Є–љ –Р.–Ы., –Р–і–Њ–љ–Є–љ–∞ –Х.–Т., –У–∞–ї–Ї–Є–љ –Ш.–Т., –Ч–≤—П–≥–Є–љ—Ж–µ–≤–∞ –Х.–Ш., –°—В–∞—Е–љ–µ–≤ –Х.–Ѓ., –°–Ї–Њ—В–љ–Є–Ї–Њ–≤ –Р.–°. –Ь–µ—Б—В–Њ –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ –≤ —В–µ—А–∞–њ–Є–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–ї–Є–њ–∞—В–Є–µ–є // –†—Г—Б—Б–Ї–Є–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–є –ґ—Г—А–љ–∞–ї вДЦ8, 2009.
2. World Sales IMS Data, 2007.
3. Wogen J. et al. Patient adherence with amlodipine, lisinopril, or valsartan therapy in a usual–care setting // J Managed Care Pharm., 2003; 9:424–429.
4. Julius S. et al. Blood pressure dependent and independent effects of antihypertensive treatment on clinical events in the VALUE Trial // Lancet, June 2004; 363.
5. Cohn J.N. et al. A randomized trial of the angiotensin–receptor blocker valsartan in chronic heart failure // N Engl J Med., 2001; 345:1667–1675.
6. Pfeffer M.A. et al. Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both // N Engl J Med. 2003;349:1893–1906.
7. Neutel J. et al. Valsartan, a new angiotensin II antagonist: antihypertensive effects over 24 hours // Clin Ther. 1997; 19:447–457.
8. Mclnnes G.T. et al. Angiotensin II antagonism in clinical practice: experience with valsartan. // J. Cardiovascular Pharmacol., 1999; 33 suppl 1: S29–S32.
9. Malacco E. et al. Comparison of valsartan 160 mg with lisinopril 20 mg, given as monotherapy or in combination with a diuretic, for the treatment of hypertension: the Blood Pressure Reduction and Tolerability of Valsartan in Comparison with Lisinopril (PREVAIL) study // Clin Ther., 2004 Jun; 26(6):855–65.
10. Malacco E. et al. A randomized, double–blind, active–controlled, parallel–group comparison of valsartan and amlodipine in the treatment of isolated systolic hypertension in elderly patients: the Val–Syst study.et al. // Clin Ther. 2003 Nov;25(11):2765–80.
11. –Я—Г—И–Ї–∞—А—М –Ф.–Ѓ., –Т–µ—А—В–Ї–Є–љ –Р.–Ы. –≠—А–µ–Ї—В–Є–ї—М–љ–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П: –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л // –Ь–µ–і–њ—А–µ—Б—Б––Є–љ—Д–Њ—А–Љ. –Ь., 2005.












