С конца 1970–х, когда пришел в клиническую практику первый ингибитор ангиотензинпревращающего фермента – каптоприл, появилось много доказательств эффективности этой группы препаратов в лечении артериальной гипертонии, проявляющих свой антигипертензивный эффект за счет подавления превращения ангиотензина I в ангиотензин II (АII) с благоприятными метаболическими эффектами. Однако исследования последнего десятилетия показали, что некоторые лекарственные средства этого класса могут не только эффективно контролировать АД, но и снижать сердечно–сосудистую заболеваемость и смертность. Настоящий обзор посвящен лизиноприлу – лизиновому деривату эналаприла. В отличие от большинства других ингибиторов ангиотензин–превращающего фермента (АПФ), лизиноприл не должен подвергаться биотрансформации для образования активных метаболитов, а также не содержит сульфгидрильной группы, являющейся причиной ряда побочных эффектов (нейтропения и протеинурия) [1]. Лизиноприл применяют для лечения больных артериальной гипертонией, застойной сердечной недостаточностью, после острого инфаркта миокарда [2]. Более того, недавно в ряде стран (Великобритания, Испания, Бельгия) он был утвержден для лечения диабетической нефропатии, а в Мексике, Португалии и Новой Зеландии – для лечения больных диабетической ретинопатией [3].
Фармакокинетика
Пища не влияет на биодоступность препарата. Он не подвергается пресистемному метаболизму. Пик плазменной концентрации (Смах) наступает к 6 часам. Определимые уровни в плазме после 10 мг – 72 ч., 20 мг – 96 ч. Биодоступность варьирует от 25 до 50%. Распределение – с белками плазмы не связывается, объем распределения составляет 124 л. Лизиноприл не метаболизируется в печени, экскретируется почками в неизмененном виде за счет тубулярной секреции с последующей частичной реабсорбцией. В быструю фазу элиминации Т 1/2 составляет 12,6 часов. Вторая фаза элиминации – около 30 часов (обусловлена временем связывания с АПФ), состояние стабильной равновесной концентрации («steady–state») наступает ко второму–третьему дню постоянного приема. Средний почечный клиренс 3,11–3,76 л/час при применении доз в 2,5 – 5 мг. У здоровых добровольцев – 6,36 л/час.
У больных пожилого возраста абсорбция не меняется. Клиренс лизиноприла коррелирует с клиренсом креатинина, поэтому с возрастными изменениями клиренса креатинина уменьшается и клиренс лизиноприла.
У больных с хронической почечной недостаточностью (ХПН) Смах увеличивается и сохраняется дольше, замедляется выведение, что требует снижения дозы (табл. 1).

Влияние на РААС
Ингибиторный эффект лизиноприла на АПФ был изучен in vitro на легких кролика. Константа сродства АПФ к лизиноприлу была сравнима с таковой у эналаприлата и каптоприла, однако диссоциационный период полувыведения препарата составил соответственно 105, 27 и 9 минут. Эти данные свидетельствуют о большем сродстве лизиноприла к АПФ [4]. Основное действие лизиноприла достигается ингибированием плазменного и тканевого АПФ. Острый эффект 10 мг лизиноприла на плазменную концентрацию ангиотензина II (p<0,05), активность АПФ (p<0,05), снижение активности ренина плазмы (p<0,05) и уровня альдостерона (p<0,05) начинается через 2–3 часа, достигая максимальной степени к 6–8 часам. Зависимость от дозы у больных артериальной гипертонией находится в интервале 5–10 мг. Ингибирование лизиноприлом активности АПФ персистирует от 12 до 24 часов [5].
Ингибиторный эффект лизиноприла на АПФ был изучен in vitro на легких кролика. Константа сродства АПФ к лизиноприлу была сравнима с таковой у эналаприлата и каптоприла, однако диссоциационный период полувыведения препарата составил соответственно 105, 27 и 9 минут. Эти данные свидетельствуют о большем сродстве лизиноприла к АПФ [4]. . Острый эффект 10 мг лизиноприла на плазменную концентрацию ангиотензина II (p<0,05), активность АПФ (p<0,05), снижение активности ренина плазмы (p<0,05) и уровня альдостерона (p<0,05) начинается через 2–3 часа, достигая максимальной степени к 6–8 часам. Зависимость от дозы у больных артериальной гипертонией находится в интервале 5–10 мг. Ингибирование лизиноприлом активности АПФ персистирует от 12 до 24 часов [5].Влияние лизиноприла на АД
Начало действия лизиноприла сравнимо с таковым для эналаприла. Максимальное снижение от 4 до 6 часов. Степень снижения среднего АД у больных с застойной сердечной недостаточностью составляет ~ 20% в сравнении с эналаприлом, вызывающим 28% снижение (дозы по 10 мг). Продолжительность – не менее 24 часов. В соответствии с принятыми рекомендациями оптимальная антигипертензивная терапия должна обеспечивать 24–часовую эффективность при однократном режиме дозирования и сохранять, как минимум, 50% эффективность остаточного АД к максимальному в конце междозового интервала (показатель T/P) [6]. В таблице 2 представлены показатели систолического и диастолического Т/Р по данным ряда авторов.


Рис. 1. Влияние лизиноприла на артериальное давление с сохранением суточного ритма

Рис. 2. Влияние лизиноприла на уровни АД в ранние утренние часы
Гипотензивная эффективность лизиноприла у пожилых больных достаточно хорошо изучена. Таблица 3 приводит результаты ряда контролируемых и неконтролируемых, а также сравнительных исследований эффективности лизиноприла у лиц пожилого возраста. Результаты этих исследований указывают на то, что лизиноприл является эффективным препаратом для лечения больных неосложненной артериальной гипертонией в этой возрастной группе.


Больные с избыточной массой тела. В двух крупных исследованиях NHS (некурящие женщины) и Study Seventh–Day Adventist (вегетарианцы, не употребляют алкоголь, некурящие мужчины) была выявлена прямая корреляционная взаимосвязь между индексом массы тела и сердечно–сосудистой смертностью [7]. Более того, в первом исследовании было выявлено, что риск диабета при превышении веса на 5–7,9 кг увеличивается вдвое, а при весе более 8 кг – втрое. Данные Фрамингамского исследования указывают на то, что каждые 4,5 кг веса способствуют увеличению систолического АД на 4,4 мм рт.ст.у мужчин и 4,2 мм рт.ст. у женщин, а риск ИБС у больных сахарным диабетом в два раза выше. В исследовании TROPHY было проведено сравнительное изучение эффективности лизиноприла с гидрохлортиазидом (ГХТ) у больных гипертонической болезнью с избыточной массой тела (рис. 3 и 4). Снижение диастолического АД ниже 90 мм рт.ст. отмечено у 60% больных, леченных лизиноприлом и 43% больных, леченных гидрохлортиазидом (p<0,05). В группе лизиноприла у 60% нормализация АД отмечена при лечении в дозе 10 мг, 15% – 20 мг, 25% – 40 мг, а в группе гидрохлортиазида у 40% больных потребовалось применение диуретической дозы в 50 мг, которая обладает неблагоприятными метаболическими эффектами. Оба препарата не оказали существенного влияния на уровни инсулина или липидный профиль, однако уровень глюкозы плазмы через 12 недель различался существенно (p<0,001) в группах лизиноприла (–0.21 ммоль/л) и гидрохлортиазида (+0,31 ммоль/л) [8].
. В двух крупных исследованиях (некурящие женщины) и (вегетарианцы, не употребляют алкоголь, некурящие мужчины) была выявлена прямая корреляционная взаимосвязь между индексом массы тела и сердечно–сосудистой смертностью [7]. Более того, в первом исследовании было выявлено, что риск диабета при превышении веса на 5–7,9 кг увеличивается вдвое, а при весе более 8 кг – втрое. Данные указывают на то, что каждые 4,5 кг веса способствуют увеличению систолического АД на 4,4 мм рт.ст.у мужчин и 4,2 мм рт.ст. у женщин, а риск ИБС у больных сахарным диабетом в два раза выше. В исследовании было проведено сравнительное изучение эффективности лизиноприла с гидрохлортиазидом (ГХТ) у больных гипертонической болезнью с избыточной массой тела (рис. 3 и 4). Снижение диастолического АД ниже 90 мм рт.ст. отмечено у 60% больных, леченных лизиноприлом и 43% больных, леченных гидрохлортиазидом (p<0,05). В группе лизиноприла у 60% нормализация АД отмечена при лечении в дозе 10 мг, 15% – 20 мг, 25% – 40 мг, а в группе гидрохлортиазида у 40% больных потребовалось применение диуретической дозы в 50 мг, которая обладает неблагоприятными метаболическими эффектами. Оба препарата не оказали существенного влияния на уровни инсулина или липидный профиль, однако уровень глюкозы плазмы через 12 недель различался существенно (p<0,001) в группах лизиноприла (–0.21 ммоль/л) и гидрохлортиазида (+0,31 ммоль/л) [8].
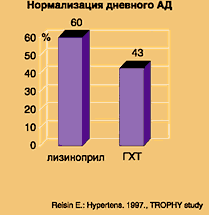
Рис. 3. Эффективность лизиноприла и гидрохлортиазида у тучных пациентов с артериальной гипертонией (ДАД<90 мм рт.ст.)

Рис. 4. Нормализация АД в зависимости от дозы лизиноприла и годрохлортиазида
Больные с сахарным диабетом. В рандомизированном плацебо–контролируемом исследовании у 530 больных инсулинзависимым сахарным диабетом в возрасте 20–59 лет с нормальным АД и отсутствием макропротеинурии изучали действие лизиноприла на прогрессирование нефропатии и (вторичная точка), прогрессирование ретинопатии. По окончании исследования у больных, получавших лизиноприл, общая экскреция альбумина была на 18,8% ниже (p=0,03), чем в группе плацебо. У больных с исходной нормоальбумиурией различия составили 12,7%, а при исходной микроальбуминурии отмечалось снижение на 49,7% (р=0,04) (рис. 5).

Рис. 5. Контролируемое исследование лизиноприла у больных инсулин- зависимым сахарным диабетом (EUCLID)
Ретинопатия прогрессировала у 13,2% больных, леченных лизиноприлом, а в плацебо–группе – у 23,4% больных (рис. 6) [9].

Рис. 6. Влияние лизиноприла на прогрессирование ретинопатии у больных инсулинзависимым сахарным диабетом (EUCLID)
Эффективность раннего применения лизиноприла при остром инфаркте миокардаПовреждение клеточных и структурных компонентов миокарда и расширение зоны инфаркта предрасполагают к желудочковой дилатации и дисфункции у больных, перенесших инфаркт миокарда, и это основные предвестники смертности восприимчивых пациентов [10]. Изменения в структуре левого желудочка в первые 3 дня и пролиферация фибробластов и синтез коллагена в последующие недели и месяцы приводят к прогрессирующему ремоделированию. Активным участником этих процессов является AII, провоцирующий спазм коронарных артерий и увеличение работы сердца, повышение потребления миокардом кислорода, а в последующем вызывающий пролиферацию фибробластов [11]. В исследованиях на животных увеличение AII в плазме и тканях сочеталось с острым некрозом миоцитов, высвобождением катехоламинов, особенно норадреналина [12,13].
Повреждение клеточных и структурных компонентов миокарда и расширение зоны инфаркта предрасполагают к желудочковой дилатации и дисфункции у больных, перенесших инфаркт миокарда, и это основные предвестники смертности восприимчивых пациентов [10]. Изменения в структуре левого желудочка в первые 3 дня и пролиферация фибробластов и синтез коллагена в последующие недели и месяцы приводят к прогрессирующему ремоделированию. Активным участником этих процессов является AII, провоцирующий спазм коронарных артерий и увеличение работы сердца, повышение потребления миокардом кислорода, а в последующем вызывающий пролиферацию фибробластов [11]. В исследованиях на животных увеличение AII в плазме и тканях сочеталось с острым некрозом миоцитов, высвобождением катехоламинов, особенно норадреналина [12,13].Таким образом появились теоретические основания для использования ингибиторов АПФ при инфаркте миокарда для предотвращения или уменьшения негативных изменений в структуре миокарда и его функциях, вызванных АII и РААС. Эффективность различных ингибиторов АПФ в ведении больных в ранние часы инфаркта миокарда уже достаточно хорошо изучена (AIRE, CATS, CONSENSUS II, ISIS, SAVE, SMILE). Целью исследования GISSI–3 было получение ответов на два основных вопроса:
Действительно ли раннее назначение ингибитора АПФ лизиноприла (в течение 24 часов после появления первых симптомов) у обычной популяции больных с установленным инфарктом миокарда может снижать смертность?
Действительно ли даже небольшая продолжительность лечения ингибитором АПФ лизиноприлом (в течение 6 недель с последующей отменой) при условии раннего назначения может предотвратить дисфункцию левого желудочка?
Результаты исследования GISSI–3 показали, что если лечение лизиноприлом начинается в первые сутки инфаркта миокарда при стабильной гемодинамике, то отмечается достоверное снижение общей смертности. Лечение в группе нитратов не улучшало этих показателей. Комбинированное лечение нитратов с лизиноприлом вызывало существенное снижение смертности и комбинированных конечных точек. Показатели смертности и комбинированных конечных точек к 6 месяцу были достоверно ниже (p=0,03) в группе больных, пролеченных лизиноприлом [14].
Лизиноприл при застойной сердечной недостаточности
Прогноз общей смертности у больных с застойной сердечной недостаточностью составляет 50% от момента установления диагноза в течение 4 лет и 50% для тяжелой сердечной недостаточности в течение года [15]. Ингибиторы АПФ доказали свою эффективность в улучшении выживаемости и снижении количества госпитализаций больных и замедлении прогрессирования сердечной недостаточности [16]. Однако сложным остается вопрос дозировок при систолической недостаточности. В одном из исследований 869 больных с сердечной недостаточностью, получавших ингибитор АПФ, было выявлено, что только 34% получали адекватные дозы препарата. Следует отметить, что использование субэффективных доз приводит к увеличению количества госпитализаций, что влияет на увеличение стоимости лечения этих пациентов [17,18].
Большинство нейрогуморальных эффектов ингибиторов АПФ, в частности, лизиноприла, являются дозозависимыми. Так, у больных с застойной сердечной недостаточностью доза в 20 мг обладает значительно более значимым действием на плазменную концентрацию альдостерона и эндотелина, чем доза в 5 мг [19].
Исследование ATLAS (Assessment of Treatment with Lisinopril and Survival) было запланировано и проведено для получения ответа на вопрос:
Действительно ли высокие дозы (32,5–35 мг) лизиноприла более предпочтительны для снижения заболеваемости и смертности, чем низкие дозы (2,5–5 мг) у больных застойной сердечной недостаточностью?
Были рандомизированы 3164 пациента с сердечной недостаточностью II–IV функциональных классов по NYHA и фракцией выброса Ј30% [20]. С помощью двойного слепого метода изучалось назначение как низких (2,5–5,0 мг ежедневно, n=1596), так и высоких доз (32,5–35 мг ежедневно, n=1568) лизиноприла в течение 39–58 месяцев. Во время данного исследования продолжалась базовая терапия сердечной недостаточности.
Результаты исследования показали, что использование высоких доз лизиноприла снижает комбинированный риск неблагоприятных клинических исходов у пациентов с хронической сердечной недостаточностью на 12% (p=0,002). Количество госпитализаций было значительно ниже в группе высоких доз как по кардиоваскулярным причинам (16% p=0,05), так и по поводу ухудшения течения сердечной недостаточности (24% p=0,002). Аналогичные результаты получены у больных пожилого возраста.
В результате исследования ATLAS было установлено:
• прямая стоимость в группе высоких доз лизиноприла (стоимость таблеток и трех дополнительных визитов к врачу, необходимых для титрования дозы) увеличивалась;
• в группе высоких и низких доз не было различий по переносимости;
• снизилось количество госпитализаций и их продолжительность;
• экономический эффект – стоимость лечения больных в группе высоких доз ниже на $2 млрд/год [21].
Подводя итоги, следует отметить, что лизиноприл показал себя, как эффективный ингибитор АПФ, отвечающий всем установленным и перспективным показаниям для ингибиторов АПФ – артериальная гипертония, застойная сердечная недостаточность, инфаркт миокарда, сахарный диабет с развитием нефропатии и ретинопатии.
Лизиноприл -
Диротон (торговое название)
(Gedeon Richter)
Полный список литературы Вы можете найти на сайте http://www.rmj.ru
1. Chodoff L. Lisinopril: a new ACE inhibitor for the treatment of hypertension and congestive heart failure. Mt Sinai J Med 1990 May; 57:169–71.
2. Lisinopril. Mosby’s GenRx – The complete reference for generic and brand drugs. 9th edn., Mosby, Inc., St. Louis, Missouri, 1999.
3. AstraZeneca. ‘Zestril’ prescribing information. [Accessed 2000, March 10]. Available from: http://www.zestrilinfo.com/info/info.htm.
4. Bull H.G. et al. Inhibition of rabbit lung ACE by lisinipril, enalaprilat and captopril. J. Of Biological Chem 260: 2952–2962,1985b.
5. Semple PF et al. Onset of action of captopril, enalapril, enalaprilic acid and lisinopril in normal man. Cardiovascular Drugs and Therapy 1: 45–50, 1987.
6. 6th Report of the JNC on Prevention, Detection, Evaluation, and Treatment of high BP. Arch Intern Med. 1997: 157:2413–46.
7. Lindsted K. Study Seventh–Day Adventist. Int J Obesity, 1991.
8. Reisin E et al. Lisinopril versus HCTZ in obese hypertensive patients: a multicenter placebo–controlled trial. Treatment in obese Patients with Hypertension (TROPHY) Study Group. Hypert 1997: Jul 30:140–145.
9. EUCLID Study Group. Effect of lisinopril on progression of retipathy in normotensive people with type 1 diabetes. Lancet 1998; 351:28–31.
10. Young JB. Angiotensin–converting enzyme inhibitors post–myocardial infarction. Cardiol Clin 1995: 13: 379–90.
11. Lonn EV., Yusuf S., Jha P. et al. Emerging role of ansiotensin–converting enzyme inhibitors in cardiac and vascular protection. Circulation 1994:90:2056–69
12. Weber KT., Brilla CG., Campbell SE., et al. Myocardial fibrosis: role of angiotensin II and aldosterone. Basic Res Cardiol 1993:88 Suppl. 1: 107–24
13. Sun Y., Ratajska A., Zhou G. et al. Angiotensin–converting enzyme and myocardial fibrosis in the rat receiving angiotensin II or aldosterone. J Lab Clin Med 1993: 122: 395–403
14. Latini R., Nicolosi G., Maggioni AP. et al. The beneficial effect of lisinopril on left ventricular remodelling after a first myocardial infarction is modulated by age. The GISSI–3 Echo database (abstract) no. 775–11. .1 Am Coll Cardiol 1996; 27(2) Suppl. A: 281 A
15. Ryden L. Remme WJ. Treatment of congestive heart failure: has he time come for decreased complexity? Eur Heart J 1999 Jun; 20:867–71.
16. Packer M, Cohn JN. Consensus recomendations for the management of chronic heart failure. Am.J Cardiol 1999 Jan;83 Suppl.2A: 1A–38A.
17. Andersson F et al. ACE inhibitor and heart failure: the consequence of underprescribing. Pharmacoeconomics 1999; 15(6): 535–50.
18. Roe CM et al. ACE inhibitor compliance
19. Mushahwar SS et al. Effective suppression of plasma aldosterone with high dose lisinopril in patients with mild left dysfunction. Eur Heart J 1996; 17 Suppl.:60
20. Packer M. et al. Comparative effects of low and high doses of lisinopril on morbidity and mortality in chronic heart failure. Circulation, Dec1999; 7
21. Packer M et al. Comparative effects of low and high doses of the ACEi lisinopril, on morbidity and mortality in chronic heart failure. Circulation 1999; 100:1–7.












