фармакодинамические эффекты:
особенности бисопролола
Фармакологические эффекты b–адреноблокаторов можно подразделить на [1]:
• обусловленные блокадой b1–адренорецепторов;
• обусловленные блокадой b2–адренорецепторов;
• не связанные с блокадой b–адренорецепторов.
Кардиальные фармакологические эффекты b–адреноблокаторов связаны с блокадой преимущественно b1–адренорецепторов сердца. b–адреноблокаторы, связываясь с b1–адренорецепторами, препятствуют взаимодействию с ними эндогенных катехоламинов (норадреналина, адреналина), что ведет к снижению стимулирующего действия Gs–белка, связанного с b1–адреноцептором на аденилатциклазу. Ее активность резко падает, что проявляется в замедлении синтеза цАМФ.
Снижение содержания внутриклеточного цАМФ приводит к тому, что цАМФ–зависимые протеинкиназы остаются неактивными, не могут фосфорилировать мембранные кальциевые каналы, которые остаются закрытыми и, таким образом, снижается ток ионов кальция из внеклеточного пространства, который мог бы играть роль «кальциевой искры», необходимой для массивного высвобождения ионов кальция из депо (саркоплазматического ретикулума). В «рабочих» кардиомиоцитах отсутствие ионов кальция приводит к тому, что не может образоваться комплекс кальций–тропонин С, способный «освободить» места связывания сократительных белков актина и миозина, следствием этого является невозможность образования актино–миозинового комплекса и снижение силы сердечных сокращений (отрицательный инотропный эффект).
Уменьшение концентрации ионизированного кальция в клетках проводящей системы сердца (сино–атриального узла – SA узла) приводит к уменьшению ЧСС (отрицательный хронотропный эффект) и угнетению проводимости (отрицательный дромотроный эффект), в большей степени в антеградном направлении через AV узел и пучок Кента, а также снижению автоматизма (отрицательный батмотропный эффект), особенно в клетках SA узла, AV узла, предсердий и в меньшей степени – желудочков.
Снижение силы сердечных сокращений и ЧСС способствуют уменьшению потребности миокарда в кислороде, что обосновывает возможность применения b–адреноблокаторов в качестве антиангинальных ЛС у больных ИБС. Наличие у этой группы ЛС способности угнетать проводимость и автоматизм обусловливает антиаритмическое действие b–адреноблокаторов. Понижение содержания внутриклеточного кальция за счет блокады b1–адренорецепторов в клетках юкст–гломерулярного аппарата (ЮГА) почек сопровождается угнетением выброса ренина в кровь, уменьшением образования ангиотензина II, что наряду со снижением сердечного выброса (за счет уменьшения силы сердечных сокращений и ЧСС) ведет к снижению АД и определяет эффективность бета–адреноблокаторов в качестве антигипертензивных ЛС [2].
С блокадой b2–адренорецепторов при применении низкоселективных в отношении b1–адренорецепторов препаратов связан целый ряд нежелательных лекарственных реакций, что не характерно для бисопролола. Так, блокада b2–адренорецепторов гладкой мускулатуры бронхов также вызывает снижение активности аденилатциклазы и замедление синтеза цАМФ. Снижение уровня внутриклеточного цАМФ приводит к тому, что цАМФ–зависимые протеинкиназы остаются неактивными, а значит, не способны фосфорилировать и подавлять активность киназы «легких» цепей миозина. Последняя, в свою очередь, начинает активно фосфорилировать «легкие» цепи сократительного белка миозина, при этом миозин соединяется с актином и осуществляется сокращение гладкомышечной клетки, сопровождающиеся повышением тонуса бронхов и развитием бронхоспазма. По аналогичному механизму повышается тонус матки (стимуляция родовой деятельности); активируется моторика желудочно–кишечного тракта (ЖКТ) – боли в животе, понос, тошнота, рвота; отмечается некоторое повышение ОПСС за счет сужения артериол и венул (вплоть до развития синдрома Рейно). Метаболические эффекты b–адреноблокаторов также опосредованы блокадой b–адренорецепторов. Блокада b2–адренорецепторов жировой ткани обусловливает уменьшение активности аденилатциклазы и замедление синтеза цАМФ, последнее приводит к тому, что цАМФ–зависимые протеинкиназы остаются неактивными и неспособными фосфорилировать и, таким образом, активировать триацилглицеролипазу. В результате происходит угнетение распада (липолиза) триглицеридов в жировой ткани, что препятствует повышению содержания свободных жирных кислот, при этом возрастает содержание триглицеридов в плазме крови, а концентрация общего холестерина не изменяется, содержание холестерина в липопротеидах высокой плотности снижается, уровень холестерина липопротеидов низкой плотности увеличивается. Блокада b1–адренорецепторов в печени также сопровождается снижением активности аденилатциклазы, замедлению синтеза цАМФ и к уменьшению работы цАМФ–зависимых протеинкиназ, которые становятся не способными определять функцию гликогенсинтетазы. В результате в печени происходит активация синтеза гликогена из глюкозы, что может привести к развитию гипогликемии. Следует отметить, что b–адреноблокаторы могут вызвать и гипергликемию за счет блокады b2–адренорецепторов клеток островкового аппарата поджелудочной железы (при этом угнетается выброс инсулина). У людей без нарушения углеводного обмена описанные изменения не вызывают клинически значимых последствий. У больных сахарным диабетом, в случаях неадекватной противодиабетической терапии, b–адреноблокаторы могут привести к развитию серьезных осложнений (гипогликемическая кома, кетоацидотическая кома и др.), также они могут «маскировать» симптомы гипогликемии (дрожь, сердцебиение, потливость), полностью нивелируя их, лишая больных «сигналов» тревоги и приводя к тому, что больные не принимают соответствующие меры [1].
Классификация b–адреноблокаторов: место бисопролола
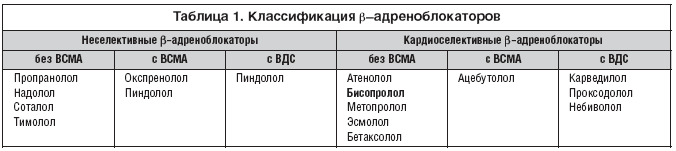
Основываясь на фармакологических эффектах, b–адреноблокаторы принято подразделять на неселективные (неизбирательные), блокирующие b1– и b2–адренорецепторы (окспренолол, пропранолол, пиндолол, тимолол, надолол, соталол) и кардиоселективные (избирательные), преимущественно блокирующие b1–адренорецепторы (ацебутолол, талинолол, атенолол, метопролол) (табл. 1) [1].
Следует отметить, что ряд b–адреноблокаторов обладает собственной или, как ее еще называют, внутренней (частичной агонистической) симпатомиметической активностью (ВСМА), проявляющейся при низкой базальной (в покое) эндогенной симпатической активности, при повышении уровня эндогенной симпатической активности (например, при физической нагрузке) проявляется их b–адреноблокирующее действие. К таким препаратам (табл. 1) относят пиндолол, окспренолол, ацебутолол, талинолол. Они в меньшей степени снижают ЧСС и сократимость миокарда в покое, не оказывают негативного влияния на липидный обмен, у них слабее выражен синдром «отмены» [1].
Выделяют b–адреноблокаторы с дополнительными вазодилатирующими свойствами (ВДС) (табл. 1). Гипотензивная и антиангинальная эффективность обычно выше, чем у препаратов без ВДС. ВДС b–адреноблокаторов могут быть обусловлены четырьмя основными механизмами [1]:
• сочетанием b–адреноблокирующей и ?–адреноблокирующей активности: карведилол, проксодолол;
• высвобождением из эндотелиальных клеток оксида азота, обладающего вазодилатирующими свойствами: небиволол;
• выраженной ВСМА в отношении b2–адренорецепторов сосудов: пиндолол.
При сравнении неселективных и кардиоселективных b–адреноблокаторов можно отметить, что кардиоселективные b–адреноблокаторы в низких дозах мало влияют на физиологические реакции, опосредуемые периферическими b2–адренорецепторами (на тонус бронхов и артерий, секрецию инсулина, мобилизацию глюкозы из печени, сократительную активность матки во время беременности), что делает возможным их осторожное назначение для лечения больных с хроническими обструктивными заболеваниями легких, сахарным диабетом, выраженными нарушениями периферического кровообращения («перемежающаяся» хромота, синдром Рейно), а также во время беременности. Кроме того, кардиоселективные b–адреноблокаторы в минимальной степени ограничивают физическую активность, так как, в отличие от неселективных препаратов, они не вызывают сужения сосудов скелетной мускулатуры; поэтому при их применении реже наблюдается повышенная утомляемость и мышечная слабость. На фоне назначения кардиоселективных b–адреноблокаторов у некоторых больных, например, с гиперкинетическим типом кровообращения, физическая работоспособность может даже увеличиться.
Но и группа кардиоселективных b–адреноблокаторов также неоднородна: препараты существенно различаются по «степени» кардиоселективности. Например, отличительной особенностью именно бисопролола является самая высокая среди b–адреноблокаторов селективность относительно b1–адренорецепторов. Так, если для метопролола и атенолола она составляет 1:20 и 1:35 соответственно, то для бисопролола равна 1:75, то есть сродство бисопролола к b1–адренорецепторам в 75 раз выше, чем к b2–адренорецепторам. С практической точки зрения это означает, что в стандартной дозе препарат почти не оказывает блокирующего действия на b2–адренорецепторы и поэтому лишен многих нежелательных эффектов, механизм которых описан выше.
Следует отметить, что в настоящее время активно изучается генетическая предрасположенность к чувствительности к b–адреноблокаторам, основой которой является полиморфизм гена ADRB1, кодирующий b1–адренорецептор [3]. Ряд исследований демонстрирует более выраженные фармакологические эффекты b–адреноблокаторов у носителей аллельных вариантов данного гена. В исследовании Bruck H. и соавт. (2005) было показано, что бисопролол блокировал воздействие агониста b–адренорецепторов добутамина на гемодинамику и гуморальный статус (повышение активности ренина) в большей степени у носителей варианта Arg389, чем у носителей Gly389 (42% в белой популяции) [4]. Поэтому можно предположить, что именно у носителей варианта Arg389, эффективность бисопролола (антиангинальная, гипотензивная, антиаритмическая и т.д.) будет наиболее выраженной. Можно надеяться, что в будущем внедрение подобных фармакогенетических исследований позволит отбирать пациентов у которых бисопролол будет наиболее эффективен в минимальных дозах.
Фармакокинетика b–адреноблокаторов: особенности бисопролола
Особенности фармакокинетики различных b–адреноблокаторов в значительной мере определяются степенью их растворимости в липидах и воде. По этому признаку различают 3 группы b–адреноблокаторов: липофильные, гидрофильные, липо– и гидрофильные [1,5].
• Липофильные b–адреноблокаторы (бетаксолол, карведилол, метопролол, окспренолол, пропранолол, тимолол и др.) быстро и полностью (около 90%) всасываются в ЖКТ, легко проникают через гематоэнцефалический барьер (сопровождается повышением частоты побочных явлений со стороны ЦНС – бессонницей, общей слабостью, сонливостью, депрессией, кошмарными сновидениями, галлюцинациями и т.д.). Некоторые липофильные b–адреноблокаторы (карведилол, талинолол) являются субстратами для гликопротеина–Р*. Все липофильные b–адреноблокаторы подвергаются биотрансформации путем окисления с участием изофермента цитохрома Р450 2D6 (CYP2D6), причем пресистемный метаболизм b–адреноблокаторов при первом прохождении через печень составляет до 80%. Следует отметить, что биотрансформация липофильных b–адреноблокаторов под действием CYP2D6 имеет стереоселективный характер: CYP2D6 в большей степени метаболизирует R–энантиомеры b–адреноблокаторов, чем S–энантиомеры. Необходимо учитывать, что метаболизм b–адреноблокаторов с эффектом «первого прохождения» через печень может меняться даже при нормальной функциональной активности гепатоцитов: липофильные b–адреноблокаторы, уменьшая печеночный кровоток (пропранолол, например, на 30%), могут замедлять свой собственный метаболизм в печени и таким образом удлинять период полувыведения (Т1/2) при длительном применении. Так, при длительном назначении Т1/2 пропранолола может увеличиться в 2–3 раза по сравнению с однократным приемом. Пропранолол, как и другие липофильные b–адреноблокаторы, может замедлять выведение из крови других ЛС, которые метаболизируются в печени (например, лидокаина, гидралазина, теофиллина). Снижение биотрансформации b–адреноблокаторов с выраженным пресистемным метаболизмом особенно выражено у больных циррозом печени, застойной сердечной недостаточностью и в пожилом возрасте (у этих групп больных доза b–адреноблокаторов должна быть снижена). Липофильные b–адреноблокаторы интенсивно связываются с белками плазмы крови (пропранолол – на 80–93%). У липофильных b–адреноблокаторов отмечается большой объем распределения.
• Гидрофильные b–адреноблокаторы (атенолол, надолол, соталол и др.) не полностью (30–70%) и неравномерно всасываются в ЖКТ и обычно в незначительной мере (0–20%) метаболизируются в печени. Они выводятся почками в неизмененном виде (40–70%) либо в виде метаболитов. Гидрофильные b–адреноблокаторы имеют более продолжительный Т1/2 (от 6 до 24 ч.), чем липофильные. Т1/2 гидрофильных b–адреноблокаторов увеличивается у больных со сниженной скоростью клубочковой фильтрации (СКФ), т.е. при почечной недостаточности, а также у пожилых лиц; в таких случаях следует уменьшить суточную дозу препаратов за счет кратности приема. При выраженной почечной недостаточности более безопасным является назначение не гидрофильных, а липофильных b–адреноблокаторов (бисопролол и др.), которые метаболизируются в печени. Поскольку выведение гидрофильных b–адреноблокаторов мало зависит от функции печени, они не взаимодействуют с ЛС, которые метаболизируются в печени и более предпочтительны у больных тяжелыми заболеваниями печени.
• К третьей группе относятся b–адреноблокаторы, растворимые как в жирах, так и в воде (ацебутолол, бисопролол, пиндолол, целипролол и др.), они частично подвергаются биотрансформации в печени (40–60%) под действием CYP2D6, остальная часть выводится почками в неизмененном виде. b–адреноблокаторы со сбалансированным клиренсом обычно имеют небольшой Т1/2 (от 3 до 12 ч.). Так, сбалансированный клиренс бисопролола объясняет низкую вероятность взаимодействия этого препарата с другими ЛС и большую безопасность их применения у больных с умеренной печеночной или почечной недостаточностью. В то же время при тяжелой печеночной и/или почечной недостаточности суточные дозы b–адреноблокаторов со сбалансированным клиренсом рекомендуют уменьшать в 1,5–2 раза.
Следует отметить, что скорость биотрансформации большинства липофильных и липо– и гидрофильных b–адреноблокаторов генетически детерминирована, что связано с полиморфизмом гена CYP2D6. Носители функционально дефектных аллельных вариантов гена CYP2D6, т.н. «медленные» метаболизаторы по CYP2D6, в популяции могут составлять от 0,7% (китайцы) до 6%, как среди белого населения США, и даже 20%, как среди жителей Гонконга. При этом 95% всех «медленных» метаболизаторов по CYP2D6 являются носителями вариантов CYP2D6*3, CYP2D6*4, CYP2D6*5, остальные варианты (CYP2D6*6, CYP2D6*7, CYP2D6*8, и др.) встречаются гораздо реже [5]. Накопилось большое количество данных, свидетельствующих о том, что полиморфизм гена CYP2D6 оказывает существенное влияние на фармакокинетику некоторых b–блокаторов: метопролола, карведилола, небиоволола, которое заключается в замедлении их биотрансформации, а это, в свою очередь, может приводить к нежелательным лекарственным реакциям. Однако Taguchi M. и соавт. (2005) не обнаружили влияния полиморфизма гена CYP2D6 на фармакокинетику бисопролола у японцев пожилого возраста [6]. Эти данные подтверждены в исследовании Nozawa T. и соавт. (2005), в котором сопоставляли реакцию ЧСС на введение изопротеренола на фоне применения бисопролола, что отражает «степень» b–адреноблокады. Оказалось, что повышение ЧСС на введение изопротеренола не зависело от носительства функционально дефектных аллелей гена CYP2D6 [7]. В упомянутой работе Taguchi M. и соавт. (2005) было также показано, что замены в гене CYP2C19 не влияют на фармакокинетику бисопролола [6]. Таким образом, в настоящее время бисопролол (Конкор) является единственным b–адреноблокатором для которого доказано отсутствие влияния полиморфизма гена CYP2D6 на фармакокинетику и фармакодинамику препарата. Следовательно, бисопролол, в отличие от метопролола и пропранолола, будет одинаково эффективным и безопасным как у «медленных» метаболизаторов, так и «быстрых» метаболизаторов по CYP2D6.
Безопасность бисопролола
Высокая степень селективности Конкора в отношении b1–адренорецептора, обуславливает высокую безопасность препарата у широкого контингента больных.
Брадикардия, АВ–блокада, декомпенсация сердечной недостаточности, ортостатическая гипотензия наблюдались только у 0,1–1% пациентов. Исследование Chatterjee S.S. (1986) было посвящено изучению эффектов бисопролола у больных с бронхиальной астмой. Показано, что бисопролол вызывал несущественное снижение ОФВ1 и сопротивление дыхательных путей, сравнимое с плацебо [8]. Принято считать, что бисопролол может с осторожностью применяться у больных с обструктивными болезнями легких при условии сопутствующей адекватной бронхолитической терапии под тщательным контролем клинического состояния больных и параметров функции внешнего дыхания. И действительно, исследование Contini M. (2005) показало более высокую диффузионную способность легких (DLco), а также минутный объем дыхания и пиковую вентиляцию у пациентов с хронической сердечной недостаточностью (ХСН), принимавших бисопролол, по сравнению с группой карведилола [9].
Часто прием b–адреноблокаторов связывают с возможностью возникновения сексуальной дисфункции. Однако в исследовании Prisant L.M. и соавт. (1999) продемонстрировано, что частота сексуальной дисфункции при приеме бисопролола не отличалась от таковой при приеме плацебо [10]. Следовательно, бисопролол является единственным b–адреноблокатором для которого убедительно доказано отсутствие влияния на сексуальную функцию у мужчин. Кроме того, бисопролол характеризуется хорошим профилем метаболической безопасности. В исследовании Saku K. и соавт. не было выявлено значимых изменений концентрации липопротеидов, аполипопротеинов и липопротеина (а) в сыворотке крови на фоне приема бисопролола в течение 12 месяцев [11].
В ряде случаев бисопролол, как и другие b–адреноблокаторы, может повышать сенсибилизацию к аллергенам, провоцировать обострение псориаза. При феохромоцитоме применение бисопролола допустимо только после назначения ?–адреноблокатора. При тиреотоксикозе бисопролол может «маскировать» симптомы данного заболевания.
Бисопролол противопоказан при острой сердечной недостаточности, кардиогенном шоке, АВ–блокаде 2–3 степени, синдроме слабости синусового узла, синоатриальной блокаде, брадикардии (при ЧСС менее 60 в мин. до начала лечения), гипотензии (систолическое АД менее 100 мм. рт.ст.), при тяжелом течении бронхиальной астмы или ХОБЛ, при индивидуальной непереносимости. Детям бисопролол не назначают в связи с отсутствием достаточного опыта применения.
Показания к применению
b–адреноблокаторов и доказательная база эффективности
Ишемическая болезнь сердца
Антиангинальный эффект b–адреноблокаторов объясняется следующими возможными механизмами:
• уменьшением потребности миокарда в кислороде за счет снижения ЧСС, АД и сократимости миокарда;
• увеличением коронарного кровотока за счет увеличения времени диастолической перфузии в условиях снижения ЧСС;
• улучшением коллатерального кровотока, перераспределением кровотока в зоны ишемии миокарда;
• уменьшением микрососудистых повреждений миокарда;
• стабилизацией клеточных и лизосомальных мембран;
• улучшением высвобождения кислорода из оксигемоглобина;
• торможением агрегации тромбоцитов.
Антиангинальное действие b–адреноблокаторов широко используется при стабильной стенокардии, нестабильной стенокардии и при остром ИМ. И хотя антиангинальное действие является групп–специфическим свойством всех b–адреноблокаторов, результаты многочисленных мультицентровых исследований, показали, что только липофильные b–адреноблокаторы без ВСМА способны снижать риск развития острого ИМ у больных ИБС, обеспечивая как первичную, так и вторичную профилактику развития данного осложнения. Гидрофильные b–адреноблокаторы и b–адреноблокаторы с ВСМА не влияют на прогноз больных ИБС. Так, рандомизированное контролируемое исследование TIBBS было посвящено сравнению эффективности бисопролола с нифедипином замедленного высвобождения [12]. Было включено 330 пациентов, перенесших по меньшей мере 3 эпизода ишемии миокарда по ЭКГ в течение 48 часов, предшествовавших рандомизации. После 4 недель лечения (бисопрололом, 161 пациент, или нифедипином замедленного высвобождения, 169 пациентов) среднее число эпизодов ишемии снизилось в обеих группах, однако значимо больше в группе бисопролола – 60% против 29%. Кроме того, эффект бисопролола был круглосуточным, что позволило снизить частоту ишемии в ранние утренние часы. Прогностическая значимость эпизодов ишемии миокарда, выявленных по ЭКГ, оценивалась в исследовании TIBBS follow up, в котором приняли участие пациенты из исследования TIBBS. Было доказано, что наличие эпизодов ишемии у больных со стенокардией отрицательно влияет на прогноз по сравнению с пациентами со стенокардией без каких–либо изменений ЭКГ (или с незначительными изменениями). В группе пациентов, получавших бисопролол, частота заданных событий (сердечная или внесердечная смерть, инфаркт миокарда, госпитализация по поводу нестабильной стенокардии, операция коронарного шунтирования или чрескожная ангиопластика) в течение года составила 22,1%, тогда как в группе нифедипина этот показатель составил 33,1% [13].
Таким образом, эксперты Американского колледжа кардиологов и Американской ассоциации сердца относят b–адреноблокаторы к препаратам I ряда для лечения стабильной стенокардии.
Артериальная гипертензия
Механизм антигипертензивного действия различных b–адреноблокаторов обусловлен:
• уменьшением сердечного выброса в результате ослабления сократительной способности миокарда левого желудочка и урежения ЧСС;
• торможением секреции ренина;
• перестройкой барорефлекторных механизмов дуги аорты и каротидного синуса;
• увеличением высвобождения вазодилатирующих веществ (простагландинов Е2 и I2, оксида азота, предсердного натрийуретического фактора и др.);
• уменьшением ОПСС;
• влиянием на сосудодвигательные центры продолговатого мозга.
Механизмы антигипертензивного действия b–адреноблокаторов не одинаковы и зависят от наличия или отсутствия у них таких дополнительных свойств, как липофильность, кардиоселективность, ВСМА и ВДС (см. выше). b–адреноблокаторы особенно показаны больным АГ на фоне гиперкатехоламинемии и гиперсимпатикотонии. Как правило, у таких пациентов имеются тахикардия, повышенный ударный и минутный выброс крови. Эффект достигает максимума к концу 3–й недели. На 1–й неделе на терапию b–адреноблокаторами отвечают около 30% больных, на второй – 65%, поэтому судить об эффективности антигипертензивной терапии b–адреноблокаторами следует лишь к концу 2–3–й недели.
При лечении АГ очень важное значение имеет не только снижение АД, но и защита органов–мишеней – сердца, почек, головного мозга, периферических сосудов. b–адреноблокаторы наравне с ингибиторами АПФ снижают выраженность гипертрофии миокарда левого желудочка.
В двух рандомизированных исследованиях была показана дозозависимая антигипертензивная эффективность бисопролола. Использовались дозы 5, 10 и 20 мг один раз в сутки у пациентов с исходным диастолическим АД 95–120 мм. рт.ст. К третьему месяцу наблюдения систолическое АД снизилось в среднем на 30 мм. рт.ст. у пациентов, получавших бисопролол в дозе 20 мг в сут., на 25 мм рт.ст. у получавших 10 мг в сут., на 15 мм рт.ст. – 5 мг в сут. Снижение диастолического АД составило соответственно 20, 15 и 10 мм рт.ст. [14,15,16]. Эти данные были подтверждены в дальнейшем в исследованиях Boejinga J.K. и Davidov M.E. с соавт. [17,18]. В проспективном многоцентровом исследовании изучали эффект монотерапии бисопрололом у 2012 пациентов [19]. У 76% целевое значение диастолического АД менее 95 мм рт.ст. было достигнуто с помощью монотерапии бисопрололом в дозе 5 мг в сут. Остальным пациентам доза повышена до 10 мг, что позволило суммарно 94% больных достичь целевого АД. Долгосрочная эффективность бисопролола при артериальной гипертензии также доказана в исследовании с участием 1002 пациентов [20].
Эксперты ВОЗ и Международного Общества по изучению АГ (МОАГ) в Международных рекомендациях по профилактике и лечению АГ определили место b–адреноблокаторов в терапии АГ: b–адреноблокаторы особенно показаны при сочетании АГ со стенокардией напряжения, тахаритмиями и после перенесенного острого ИМ.
Хроническая сердечная недостаточность
В последнее время b–адреноблокаторы стали применяться у больных хронической сердечной недостаточностью (ХСН). Активация симпато–адреналовой системы (САС) – это один из основных ранних компенсаторных механизмов при снижении сердечного выброса и развитии сердечной недостаточности. При ХСН имеет место длительная хроническая гиперактивация САС, которая из компенсаторной реакции превращается в патогенный фактор, способствующий усугублению ХСН. В настоящее время имеется «солидная» доказательная база эффективности Конкора при ХСН. Влиянию бисопролола (Конкора) на прогноз больных ХСН были посвящены исследования CIBIS, CIBIS II, CIBIS III. В первом из них – CIBIS – было отмечено снижение общей смертности на 20% при применении бисопролола, что, однако, не было достоверным [21]. Причиной этому, как оказалось, послужила невысокая доза препарата – 5 мг. В дальнейшем было проведено более длительное исследование CIBIS II, которое показало статистически достоверное снижение общей смертности на 34%, сердечно–сосудистой на 29% и внезапной смертности на 44%, а смертности, связанной с прогрессированием ХСН, на 36% [22]. В исследовании CIBIS III показано, что начальная терапия ХСН бисопрололом с последующим присоединением эналаприла столь же эффективна и безопасна, как и обратная «классическая» схема. В группе, где лечение начинали с бисопролола, отмечалась тенденция к лучшей выживаемости, особенно в первый год лечения. Но в то же время в этой группе пациентов наблюдалась большая частота госпитализаций, связанных с прогрессированием ХСН, особенно на начальных этапах исследования [23].
Заключение
Таким образом, клинико–фармакологическая характеристика бисопролола (Конкора), в основе которых лежат результаты многочисленных клинических исследований, позволяет считать его эталонным кардиоселективным b–адреноблокатором для лечения широкого контингента больных с сердечно–сосудистыми заболеваниями. Клинико–фармакологическими преимуществами бисопролола перед другими кардиоселективными b–адреноблокаторами можно считать следующие:
• высокая селективность бисопролола в отношении b1–адренорецепторов, что является главной причиной низкой частоты развития нежелательных лекарственных реакций при его применении;
• доказанная в клинических исследованиях безопасность в отношении органов дыхания, сексуальной функции у мужчин и обмена веществ;
• эффективен у пациентов вне зависимости от полиморфизма гена CYP2D6;
• «хорошая» доказательная база эффективности бисопролола при ИБС, АГ и ХСН.
Литература
1. Кукес В.Г. Клиническая фармакология. М.: ГЕОТАРМЕД, 2004.
2. Williams B. beta–blockers and the treatment of hypertension.J Hypertens. 2007 Jul;25(7):1351–3.
3. Muszkat M., Stein C.M.. Pharmacogenetics and response to beta–adrenergic receptor antagonists in heart failure // Clin. Pharmacol. Ther. – 2005. – № 77(3). – Р. 123–6.
4. Bruck H, Leineweber K, Temme T, Weber M, Heusch G, Philipp T, Brodde OE. The Arg389Gly beta1–adrenoceptor polymorphism and catecholamine effects on plasma–renin activity. J Am Coll Cardiol. 2005 Dec 6;46(11):2111–5.
5. Кукес В.Г. Метаболизм лекарственных средств: клинико–фармакологические аспекты. М.: Реафарм, 2004. с. 18–27, с. 40–47.
6. Taguchi M, Nozawa T, Igawa A, Inoue H, Takesono C, Tahara K, Hashimoto Y. Pharmacokinetic variability of routinely administered bisoprolol in middle–aged and elderly Japanese patients. Biol Pharm Bull. 2005 May;28(5):876–81
7. Nozawa T, Taguchi M, Tahara K, Hashimoto Y, Igarashi N, Nonomura M, Kato BI, Igawa A, Inoue H. Influence of CYP2D6 Genotype on Metoprolol Plasma Concentration and beta–Adrenergic Inhibition During Long–Term Treatment: A Comparison With Bisoprolol. J Cardiovasc Pharmacol. 2005 Nov;46(5):713–720.
8. Chatterjee SS. The cardioselective and hypotensive effects of bisoprolol in hypertensive asthmatics. J Cardiovasc Pharmacol. 1986;8 Suppl 11:S74–7.
9. Contini M, Apostolo A, Palermo P, Cattadori G, Bussotti M, Andreini D, Meloni C, Agostoni PG. Cardiopulmonary effects of beta–blockade in heart failure: differences between carvedilol and bisoprolol. Epub 2006.
10. Prisant LM, Weir MR, Frishman WH, Neutel JM, Davidov ME, Lewin AJ. Self Reported Sexual Dysfunction in Men and Women Treated With Bisoprolol, Hydrochlorothiazide, Enalapril, Amlodipine, Placebo, or Bisoprolol/Hydrochlorothiazide. J Clin Hypertens (Greenwich). 1999 Jul;1(1):22–26.
11. Saku K, Liu K, Takeda Y, Jimi S, Arakawa K. Effects of lisinopril and bisoprolol on lipoprotein metabolism in patients with mild–to–moderate essential hypertension. Clin Ther. 1995 Nov–Dec;17(6):1136–46.
12. Von Arnim T et al: Medical treatment to reduce total ischaemic burden: Total Ischemic Burden Bisoprolol Study (TIBBS), a multicenter trial comparing bisoprolol and nifedipine. J Am Coll Cardiol 1995; 1: 231.
13. Von Arnim T: Prognostic significance of transient ischaemic episodes: response to treatment shows improved prognosis. Results of the TIBBS follow–up. J Am Coll Cardiol 1996; 28: 20–4.
14. Weiner L et al: Antihypertensive effects of bisoprolol during once daily administration in patients with essential hypertension. A dose–ranging study with parallel groups. Eur J Clin Pharmacol 1986; 29: 517.
15. Weiner L et al: Dose–effect relationship and longterm effects of bisoprolol in mild to moderate hypertension. J Cardiovasc Pharmacol 1986; 8 (Suppl 11): S106.
16. Kirsten R et al: Influence of different bisoprolol doses on hemodynamics, plasma catecholamines, platelet aggregation and a2– and b–receptors in hypertensive patients. J Cardiovasc Pharmacol 1986; 8 (Suppl 11): S113–21.
17. Boejinga JK et al: A dose–finding study with bisoprolol in the treatment of mild to moderate essential hypertension. Curr Ther Res 1990; 6: 1036.
18. Davidov ME et al: Bisoprolol, a once–a–day beta–blocking agent for patients with mild to moderate hypertension. Clin Cardiol 1994; 17: 263–8.
19. Hoffler D et al: Zur Monotherapie der Hypertonie mit einem lang wirksamen Betablocker. Therapiewoche 1988; 38: 391.
20. Giesecke HG et al: Three years experience with bisoprolol in the treatment of mild to moderate hypertension. J Cardiovasc Pharmacol 1990; 16 (Suppl 5): S175.
21. CIBIS Investigators and Committees: A randomized trial of beta–blockade in heart failure. The Cardiac Insufficiency Bisoprolol Study (CIBIS). Circulation 1994; 90: 1765–73.
22. CIBIS II Investigators and Committees: The Cardiac Insufficiency Bisoprolol Study II (CIBIS II): a randomized trial. Lancet 1999; 353: 9–13.
23. Willenheimer R, van Veldhuisen DJ, Silke B, Erdmann E, Follath F, Krum H, Ponikowski P, Skene A, van de Ven L, Verkenne P, Lechat P; CIBIS III Investigators. Effect on survival and hospitalization of initiating treatment for chronic heart failure with bisoprolol followed by enalapril, as compared with the opposite sequence: results of the randomized Cardiac Insufficiency Bisoprolol Study (CIBIS) III. Circulation. 2005 Oct 18;112(16):2426–35. Epub 2005 Sep 4.












