Результаты исследований с использованием БРА II и их фармакоэкономический анализ показали, что назначение этого класса препаратов пациентам с сахарным диабетом (СД) 2–го типа, диабетической нефропатией и АГ является жизнеспасающим, экономически обоснованным шагом по сравнению с традиционной антигипертензивной терапией [7].
Существуют данные, поддерживающие назначение БРА II в более высоких дозах, чем традиционно использующиеся для снижения АД, с целью обеспечения максимальной нефропротекции и уменьшения протеинурии у больных СД 2–го типа [8]. Так, при сравнении эффектов стандартной (160 мг/сут.) и высоких (320 и 640 мг/сут.) доз валсартана в отношении экскреции альбумина с мочой у пациентов с АГ и СД 2–го типа и суточной экскрецией альбумина с мочой 20–700 мг/мин в течение 30 нед. было установлено преимущество высоких доз препарата. При использовании валсартана в дозе 640 мг/сут. частота восстановления нормоальбуминурии была в 2 раза выше (24%), чем при использовании дозы 160 мг/сут. (12%). Высокие дозы валсартана хорошо переносились, дозозависимых нежелательных эффектов, включая гиперкалиемию, зарегистрировано не было. Ранее способность стандартных доз валсартана уменьшать альбуминурию у больных с СД была показана в исследованиях MARVAL [9] и SMART [10]. В исследовании the MicroAlbuminuria Reduction with VALsartan (MARVAL) у 332 больных СД 2–го типа при одинаковом снижении АД экскреция альбумина в группе валсартана снизилась на 44%, в группе амлодипина – на 8%. Доля больных, достигших уровня нормоальбуминурии, на фоне приема валсартана (29,9%) была достоверно выше таковой на фоне приема амлодипина (14,5%). Снижение экскреции альбумина с мочой в группе валсартана начиналось уже с первых недель лечения при использовании дозы 80 мг/сут. [9]. В аналогичной группе пациентов японского открытого сравнительного исследования Shiga Microalbuminuria Reduction Trial (SMART) [10] при одинаковой антигипертензивной эффективности отношение альбумин/креатинин в моче в группе лечения валсартаном достоверно снизилось на 32%, а в группе лечения амлодипином – увеличилось на 18%. Доля пациентов, у которых был отмечен регресс микроальбуминурии, была достоверно больше в группе валсартана в сравнении с амлодипином.
Большинству пациентов с ХБП для достижения контроля АД требуется диуретик (уровень доказанности А). Выбор третьего препарата зависит от наличия сопутствующих состояний и показаний для назначения того или иного класса (уровень доказанности В) [3–5].
Необходимость многокомпонентной антигипертензивной терапии делает обоснованным назначение фиксированных комбинаций, при этом наиболее распространенным и оправданным вариантом является комбинация блокатора ренин–ангиотензин–альдостероновой системы (РААС) и тиазидного диуретика. Имеются данные о том, что комбинирование блокатора РААС с тиазидным диуретиком / тиазидоподобным диуретиком усиливает суррогатные органопротективные эффекты первого за счет дальнейшего снижения системного АД, альбуминурии и внутриклубочкового давления [11,12].
Комбинация блокатор РААС/дигидропиридиновый антагонист кальция и нефропротекция
Данные крупных контролируемых исследований в области АГ, которые завершились в последние годы, показали возможность использования при ХБП комбинации блокатора РААС и дигидропиридинового антагониста кальция.
Одни из первых данных в этой области были получены в ходе рандомизированного плацебо–контролируемого двойного слепого исследования RENAAL (Reduction of Endpoints in Non–Insulin dependent Diabetes Mellitus with the Angiotensin II Antagonist Losartan), в котором 1513 пациентов с СД 2–го типа и диабетической нефропатией наблюдались в течение 3,4 года. Добавление лозартана 50–100 мг/сут. к стандартной антигипертензивной терапии значительно (на 28%) снижало риск развития терминальной почечной недостаточности и на 25% — риск увеличения в два раза концентрации креатинина. При этом уровень смертности достоверно не снижался. Дигидропиридиновый антагонист кальция получали 54% больных в начале исследования и 62% – на момент его завершения, диуретик – соответственно 58 и 84%. Частота назначения этих классов препаратов не различалась в группе блокатора РААС и плацебо [13].
В исследовании ASCOT–BPLA, в котором наблюдались пациенты с АГ, относительный риск развития нарушения функции почек на фоне приема блокатора РААС в комбинации с амлодипином был достоверно ниже и составил 0,85 (0,75–0,97) по сравнению с комбинацией β–блокатора и тиазидного диуретика [14].
Однако в упомянутых исследованиях лишь часть пациентов получала комбинацию блокатора РААС и дигидропиридинового антагониста кальция, а режим сравнения не был основан на блокаторе РААС.
Почечные исходы в исследовании ACCOMPLISH
Прямое сравнение нефропротективных эффектов комбинаций блокатор РААС / дигидропиридиновый антагонист кальция и блокатор РААС / тиазидный диуретик было предпринято при проведении запланированного анализа исследования ACCOMPLISH (Avoiding Cardiovascular Events through Combination Therapy in Patients Living with Systolic Hypertension) [15].
В этом исследовании сравнивались два режима фиксированной комбинированной терапии, основанные на блокаторе РААС: беназеприл 40 мг/амлодипин 5–10 мг и беназеприл 40 мг/гидрохлоротиазид 12,5–25 мг – у 11 506 больных АГ высокого риска с определенными показаниями для назначения дигидропиридинового антагониста кальция (у 60% больных имелся СД, у 46% – ишемическая болезнь сердца (ИБС), у 13%– инсульт в анамнезе, 23,5% перенесли инфаркт миокарда, 11,5% госпитализировались по поводу нестабильной стенокардии). Важно отметить, что протоколом исследования было предусмотрено обязательное повышение дозы иАПФ от стартовой 20 мг/сут. и до 40 мг/сут. В группе пациентов, получавших блокатор РААС / амлодипин, частота первичной точки (комбинации сердечно–сосудистой заболеваемости и смертности) была ниже на 19,6% по сравнению с группой, получавшей блокатор РААС/тиазидный диуретик (ОР 0,80, 95% ДИ 0,72–0,90; p<0,001) [14].
Сравнительный анализ эффектов режимов терапии в отношении почечных исходов был предопределен протоколом исследования. Важно отметить, что статистическая сила исследования была в определенной мере снижена ввиду его досрочного прекращения в связи с достижением достоверных различий по первичной конечной точке. Кроме того, оценка функции почек основалась преимущественно на динамике креатинина сыворотки, не скорости клубочковой фильтрации (СКФ).
ХБП в данном исследовании была определена как уровень креатинина сыворотки >106,1 мкмоль/л у женщин и >114,9 мкмоль/л у мужчин и при включении имелась у 561 пациента из 5744 в группе блокатора РААС / антагониста кальция и 536 человек из 5762 – в группе блокатора РААС / тиазидного диуретика.
Прогрессирование ХБП (первичная конечная точка) было определено как удвоение сывороточного креатинина и развитие терминальной почечной недостаточности (расчетная СКФ по MDRD <15 мл/мин/мин/ 1,73 м2 или потребность в диализе).
Кроме того, оценивалась частота комбинации развития ХБП и смертности (общей и сердечно–сосудистой), изменение СКФ, а также прогрессирование ХБП.
Исходная скорость клубочковой фильтрации (СКФ) в подгруппах с ХБП составила 45,1±8,8 мл/мин/мин/ 1,73 м2 , уровень креатинина 139,7±26,5 мл/мин/1,73 м2, отношение альбумин/креатинин в разовой порции утренней мочи 28,8±70,3 мг/моль. По сравнению с пациентами без ХБП больные с ХБП чаще были мужчинами (соответственно, 59,8 и 67,2%, р<0,0001), представителями негроидной расы (11,5 и 19,9%, p<0,0001), чаще имели возраст более 75 лет (18 и 32,4%, p<0,0001). Подгруппы пациентов с ХБП, выделенные в зависимости от рандомизированного режима терапии, между собой не различались.
Сердечно–сосудистая смертность и общая смертность была выше у пациентов с ХБП, чем без ХБП: соответственно, ОР 1,64, 95% ДИ 1,15–2,34 и ОР 1,70, 95% ДИ 1,33–2,18, p<0, 0001.
Целевое АД у пациентов с ХБП составляло <130/80 мм рт.ст., частота его достижения составила 39,2% в группе блокатора РААС / амлодипина и 37,2% в группе блокатора РААС / гидрохлоротиазида, p=0,37).
В подгруппе пациентов 65 лет и старше с ХБП уровень АД в группе блокатора РААС / амлодипина (133,1±16,7/71,2±10,3 мм рт.ст.) был достоверно ниже, чем в группе блокатора РААС / гидрохлоротиазида (134,4±18,2/73,2±11,3 мм рт.ст., p=0,004).
Первичная конечная точка и влияние на СКФ
Исходная СКФ в популяции intention–to–treat была сопоставима: в группе блокатора РААС/антагониста кальция 79±21,2 мл/мин/1,73 м2, блокатора РААС / тиазидного диуретика 79,0±21,5 мл/мин/1,73 м2. Снижение СКФ в течение 2,9 года наблюдения было достоверно меньше в группе блокатора РААС / амлодипина (–0,88±15,6 мл/мин/1,73 м2), чем в группе сравнения (–4,22±16,3 мл/мин/1,73 м2; p=0,01). У пациентов с исходной ХБП различия в снижении СКФ носили такой же характер и составили 1,6±12,7 мин/1,73 м2 и –2,3±10,6 мин/1,73 м2; p=0,001).
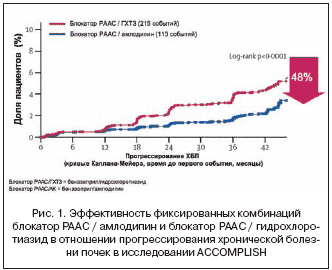
При анализе intention–to–treat в группе, получавшей комбинацию блокатор РААС / антагонист кальция, риск развития ХБП был на 48% ниже, чем в группе блокатора РААС / гидрохлоротиазида (табл.1, рис. 1).
В группе пациентов с исходной ХБП частота диабетической нефропатии в группе блокатора РААС / антагониста кальция и блокатора РААС / гидрохлоротиазида асоставила 59,7% и 58,1% соответственно. Частота прогрессирования ХБП между группами существенно не различалась и составляла соответственно 16 (4,8%) и 17 (5,5%), ОР 0,78, 95% ДИ 0,38–1,56; p=0,48. Частота комбинации прогрессирования ХБП и сердечно–сосудистой смертности также существенно не различалась (ОР 0,79, 95% ДИ 0,47–1,34; p=0,39).
Таким образом, результаты исследования ACCOMPLISH показали, что использование комбинации блокатор РААС / дигидропиридиновый антагонист кальция может в большей степени замедлять прогрессирование снижения функции почек у больных АГ высокого риска, чем комбинация блокатор РААС / гидрохлоротиазид.
Однако интерпретация результатов исследования ACCOMPLISH в отношении «почечной» первичной конечной точки сопряжена с рядом сложностей. В частности, необходимо принимать во внимание тот факт, что первичная конечная точка была представлена комбинацией удвоения сывороточного креатинина и потребности в диализе. Удвоение креатинина сыворотки является широко используемым компонентном комбинированной почечной конечной точки, поскольку динамика СКФ отражает снижение почечной функции, связанное со структурными изменениями. Удвоение сывороточного креатинина соответствует снижению исходной СКФ на 50%. Однако многие вмешательства – от диеты до приема некоторых лекарственных средств – могут по–разному влиять на СКФ. Например, при начале терапии препарат может изменять СКФ за счет гемодинамических эффектов, а при длительном приеме – за счет влияния на структурное состояние почки. В частности, для блокаторов РААС, особенно иАПФ, описано гемодинамическое снижение СКФ при начале терапии [17]. Поэтому удвоение креатинина сыворотки может отражать как обратимые гемодинамические изменения СКФ, так и структурные изменения почки. Амлодипин при краткосрочном приеме может повышать СКФ, а гидрохлоротиазид – снижать (особенно при использовании в комбинации с блокатором РААС) [18,19]. И данные по динамике СКФ в ходе исследования ACCOMPLISH демонстрируют, что в течение первых недель режим лечения с использованием гидрохлоротиазида приводил к закономерному отчетливому снижению СКФ, а с использованием амлодипина – повышению (рис. 2) [20]. В группе блокатора РААС / амлодипина в течение первого месяца после рандомизации было отмечено повышение СКФ на 2,7±12,7 мл/мин/1,73 м2 с дальнейшим постепенным снижением при длительном 36–месячном наблюдении на 3,8±16,6 мл/мин/1,73 м2. В группе с использованием тиазидного диуретика начальный период лечения сопровождался снижением СКФ. Через 3 мес. различия СКФ между группами составляли около 5,5 мл/мин/1,73 м2 и увеличились до 7 мл/мин/1,73 м2 в конце исследования. У пациентов с СКФ <60 мл/мин/1,73 м2, увеличение СКФ через 1 мес. лечения наблюдалось как в группе блокатор РААС / амлодипин, так и в группе блокатор РААС / гидрохлоротиазид и было более выраженным на фоне режима с использованием антагониста кальция (5,5±9,9 vs 1,4±9,6 мл/мин/1,73 м2). При длительном наблюдении в обеих группах отмечалось очень медленное снижение СКФ, и различия по сравнению с исходными значениями составили на момент окончания исследования 1,1±12,8 мл/мин/1,73 м2 в группе блокатора РААС / амлодипина и –2,9±11,2 мл/мин/1,73 м2 – в группе сравнения. Для ответа на вопрос, являются ли различия СКФ, отмеченные через 3 года наблюдения в исследовании, следствием сохранения острого гемодинамического эффекта, или отражают различия структурного состояния почки, необходимы дальнейшие исследования, спланированные с этой целью и обладающие достаточной статистической силой.
Отношение альбумин/креатинин в разовой порции мочи
Пропорция пациентов с альбуминурией была в исследовании ACCOMPLISH невелика, что наряду с досрочным прекращением исследования существенно ограничило его статистическую силу при анализе данных по этой вторичной конечной точке.
У 446 пациентов без ХБП с исходной альбуминурией более 33,9 мг/моль снижение отношения альбу-мин/креатинин в группе блокатора РААС / гидрохлоротиазида составило 63,8%, в группе блокатора РААС / амлодипина – 29,0% (p<0,0001). У 409 пациентов с ХБП снижение отношения альбумин/креатинин также было более выраженным в группе блокатора РААС / тиазидного диуретика и составило 26,8%, в то время как в группе блокатора РААС / амлодипина произошло увеличение показателя на 2,9% (p=0,0001).
Среди 2207 пациентов с исходной микроальбуминурией (отношение альбумин/креатинин 3,39–33,9 мг/моль) частота достижения нормоальбуминурии была выше в группе блокатора РААС / гидрохлоротиазида (68,3%), чем блокатора РААС / амлодипина 41,7% (p=0,0016). У 585 пациентов с исходной альбуминурией более 33,9 мг/моль пропорция пациентов, достигших нормоальбуминурии, также была достоверно выше у пациентов, получавших комбинацию блокатора РААС / гидрохлоротиазида (89,6 против 49,7%, p=0,0012).
Результаты исследования ACCOMPLISH по влиянию двух режимов терапии на альбуминурию согласуются с данными исследования Gauging Albuminuria Reduction with Lotrel in Diabetic Patients with Hypertension (GUARD) у 332 больных с АГ и СД 2–го типа и отношением альбумин/креатинин 2,26–56,5 мг/моль, в котором комбинация беназеприла и гидрохлоротиазида была более эффективна по сравнению с комбинацией беназеприл/амлодипин в отношении снижения альбуминурии в течение 1 года наблюдения [21].
В исследовании NEPHROS у 158 больных АГ и недиабетическим поражением почек комбинация рамиприла и фелодипина сопровождалась меньшей скоростью прогрессирования почечной недостаточности по сравнению с группой фелодипина и не отличалась от таковой в сравнении с группой рамиприла. Ни рамиприл, ни его комбинация с антагонистом кальция не привели к достоверному уменьшению альбуминурии через 2 года наблюдения, в то время как в группе фелодипина было отмечено ее увеличение [22].
В то же время имеются данные о том, что добавление дигидропиридинового антагониста кальция к БРА II, а не к иАПФ может приводить к уменьшению альбуминурии/протеинурии. Так, в исследовании с включением 70 пациентов с АГ без СД 2–го типа и ХБП 1–2–й стадии, получавших валсартан в течение 12 мес., дополнительное назначение амлодипина или гидрохлоротиазида сопровождалось дальнейшим снижением АД и сопоставимым уменьшением экскреции альбумина с мочой [23].
В другом исследовании 108 пациентов с АГ, СД 2–го типа и ХБП 1–й стадии (протеинурия 1–2 г/сут.) были рандомизированы для 12–недельной терапии амлодипином 10 мг, валсартаном 160 мг/сут. или их комбинацией. Все режимы терапии приводили к уменьшению суточной протеинурии: в группе амлодипина было отмечено снижение со 1560 (600–2800) до 1200 (200–2130) мг/сут., в группе валсартана со 1560 (780–2700) до 670 (220–2000) мг/сут., в группе валсартан/амлодипин со 1590 (600–2800) до 745 (110–2130) мг/сут. [24]. Таким образом, полученные данные демонстрируют выраженный антипротеинурический эффект комбинации валсартана и амлодипина, доступной в нашей стране в виде фиксированного препарата «Эксфорж» («Новартис»). Противоречивость данных о влиянии разных блокаторов РААС в комбинации с амлодипином на альбуминурию/протеинурию требует дальнейших исследований.
Заключение
Предотвращение и замедление прогрессирования ХБП у пациентов с АГ является важнейшей задачей антигипертензивной терапии. Ключевое значение для защиты почки имеет достижение контроля АД, для чего большинству пациентов требуется комбинированная антигипертензивная терапия. В соответствии с современными рекомендациями по ведению пациентов с ХБП блокаторы РААС – иАПФ и БРА II – должны быть обязательным компонентом терапевтического режима. Фиксированные комбинации блокатора РААС с гидрохлоротиазидом или амлодипином являются обоснованным выбором у этой категории пациентов.


Литература
1. Рекомендации по профилактике, диагностике и лечению артериальной гипертензии. Российские рекомендации (второй пересмотр). Кардиоваск тер профил 2008; 4 (Приложение).
2. Mancia G., De Backer G., Dominiczak A., et al. 2007 Guidelines for the Management of Arterial Hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens 2007; 25: 1105–1187.
3. K/DOQI clinical practice guidelines on hypertension and antihypertensive agents in chronic kidney disease. Am J Kidney Dis 2004; 43 (5 Suppl 1): S1–290.
4. Mancia G., Laurent S., Agabiti–Rosei E. et al. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document. J Hypertens 2009, 27: 2121–2158.
5. Функциональное состояние почек и прогнозирование сердечно–сосудистого риска. Рекомендации Всероссийского общества кардиологов и Научного общества нефрологов России. Кардиоваскулярная терапия и профилактика 2008; 7 (6), Приложение 3 www.scardio.ru/downloads/c4m0i228
6. www.fda.gov
7. Boersma C., Atthobari J., Gansevoort R.T., et al. Pharmacoeconomics of angiotensin II antagonists in type 2 diabetic patients with nephropathy: implications for decision making. Pharmacoeconomics 2006; 24 (6): 523–35.
8. Hollenberg N.K., Parving H.–H., Viberti G., et al. Albuminuria response to very high–dose valsartan in type 2 diabetes mellitus. J Hypertens 2007; 25: 1921–1926.
9. Viberti G. Microalbuminuria Reduction With Valsartan in Patients With Type 2 Diabetes Mellitus: A Blood Pressure – Independent Effect. Wheeldon and for the Microalbuminuria Reduction With VALsartan (MARVAL) Study Investigators. Circulation 2002; 106: 672–678.
10. The Shiga Microalbuminuria Reduction Trial (SMART) Group. Reduction of Microalbuminuria in Patients with Type 2 Diabetes. Diabetes Care; 2007:30,6: 1581–1583.
11. Vogt L., Waanders F., Boomsma F., de Zeeuw D., Navis G. Eff ects of dietary sodium and hydrochlorothiazide on the antiproteinuric effi cacy of losartan. J Am Soc Nephrol 2008; 19: 999–1007.
12. Lambers Heerspink H.J., Ninomiya T., Perkovic V. et al. for the ADVANCE Collaborative Group. Effects of a fixed combination of perindopril and indapamide in patients with type 2 diabetes and chronic kidney disease. European Heart Journal doi:10.1093/eurheartj/ehq139
13. Brenner B.M., Cooper M.E., de Zeeuw D., Keane W.F., Mitch W.E., Parving H.H., Remuzzi G., Snapinn S.M., Zhang Z., Shahinfar S.; RENAAL Study Investigators. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med. 2001 Sep 20; 345 (12): 861–869.
14. Dahlof B, Sever PS, Poulter NR et al. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo–Scandinavian Cardiac Outcomes Trial–Blood Pressure Lowering Arm (ASCOT–BPLA): a multicentre randomised controlled trial. Lancet 2005; 366: 895–906.
15. Bakris GL, Sarafi dis PA, Weir MR, et al, for the ACCOMPLISH Trial investigators. Renal outcomes with diff erent fi xed–dose combination therapies in patients with hypertension at high risk for cardiovascular events (ACCOMPLISH): a prespecifi ed secondary analysis of a randomized controlled trial. Lancet 2010; published online Feb 18. DOI:10.1016/S0140–6736(09)62100–0.
16. Jamerson K, Weber MA, Bakris GL, et al for the ACCOMPLISH Trial Investigators. Benazepril plus amlodipine or hydrochlorothiazide for hypertension in high–risk patients. N Engl J Med 2008; 359: 2417–28.
17. Bakris GL, Weir MR. Angiotensin converting enzyme inhibitor–associated elevations in serum creatinine is this a cause for concern? Arch Intern Med 2000; 160: 685–93.
18. Vogt L, Waanders F, Boomsma F, de Zeeuw D, Navis G. Eff ects of dietary sodium and hydrochlorothiazide on the antiproteinuric effi cacy of losartan. J Am Soc Nephrol 2008; 19: 999–1007.
19. Delles C, Klingbeil AU, Schneider MP, Handrock R, Weidinger G, Schmieder RE. Direct comparison of the eff ects of valsartan and amlodipine on renal hemodynamics in human essential hypertension. Am J Hypertens 2003; 16: 1030–35.
20. Sarafidis PA, Bakris G, Weber M, et al. Changes in glomerular filtration rate with benazepril plus amlodipine or benazepril plus hydrochlorothiazide treatment in hypertensive patients at high risk; an analysis of the ACCOMPLISH trial. World Congress of Nephrology, Milan, Italy; May 23, 2009: Sa199 (abstr). http://www.abstracts2view.com/wcn/view.php?nu=WCN09L_455 (accessed Jan 7, 2010).
21. Bakris GL, Toto RD, McCullough PA, Rocha R, Purkayastha D, Davis P. Eff ects of diff erent ACE inhibitor combinations on albuminuria: results of the GUARD study. Kidney Int 2008; 73: 1303–09.
22. Herlitz H, Harris K, Risler T, et al. The eff ects of an ACE inhibitor and a calcium antagonist on the progression of renal disease: the Nephros Study. Nephrol Dial Transplant 2001; 16: 2158–65.
23. Kaneshiro Y, Ichihara A, Sakoda M, Kurauchi–Mito A, Kinouchi K, Itoh H. Add–on benefits of amlodipine and thiazide in nondiabetic chronic kidney disease stage 1/2 patients treated with valsartan. Kidney Blood Press Res.2009;32(1):51–8.
24. Yilmaz MI, Carrero JJ, Martyn–Ventura JL, et al. Combined Therapy with Renin–Angiotensin System and Calcium Channel Blockers in Type 2 Diabetic Hypertensive Patients with Proteinuria: Effects on Soluble TWEAK, PTX3, and Flow–Mediated Dilation. Clin J Am Soc Nephrol 5: 1174–1181,












