В фокусе внимания находится резистентная, или рефрактерная, артериальная гипертония (АГ) как одна из причин плохого контроля АД. Под резистентной АГ, в соответствии с рекомендациями РМОАГ/ВНОК [5], Европейского общества по АГ/Европейского общества кардиологов (ESH/ESC), а также Американской коллегии кардиологов (АСС) и Американской ассоциации сердца (AHA) [6,7], понимают превышение целевого уровня АД несмотря на лечение тремя гипотензивными препаратами, один из которых – диуретик. Резистентная АГ может быть контролируемой в том случае, если контроль АД достигается при назначении большего количества препаратов. В противном случае АГ является резистентной неконтролируемой.
Также выделяют псевдорезистентную АГ, обусловленную неправильным измерением АД, низкой приверженностью к лечению и «офисным» повышением АД. В большинстве случаев резистентной является нераспознанная вторичная АГ: связанная с синдромом обструктивного апноэ во время сна (СОАС), первичным альдостеронизмом, феохромоцитомой, гиперкортицизмом, паренхиматозными заболеваниями почек, стенозом почечных артерий, часто плохо контролируемая АГ встречается при сахарном диабете. Кроме того, к резистентности могут приводить чрезмерное потребление соли, алкоголя и некоторые лекарства (нестероидные противовоспалительные препараты (НПВП), слабительные, амфетамины, производные эфедрина, эстрогенсодержащие оральные контрацептивы, лакрица, глюкокортикостероиды, эритропоэтины). Выраженность гипертензивного действия указанных средств индивидуальна, однако доказано, что его проявлению способствуют пожилой возраст, сахарный диабет, снижение почечной функции.
Особой формой АГ является злокачественная гипертония. Злокачественная АГ характеризуется значительным повышением АД (более 180/120 мм рт.ст.) с развитием тяжелых изменений сосудистой стенки (фибриноидный некроз), что приводит к кровоизлияниям и/или отеку соска зрительного нерва, ишемии тканей и нарушению функции различных органов. Переход АГ в злокачественную возможен при всех ее формах, однако чаще это происходит у пациентов со вторичной или тяжелой АГ. При отсутствии эффективного лечения 50% пациентов умирают в течение первого года. Наличие злокачественной АГ оценивается как тяжелое неотложное состояние и требует снижения ДАД до 100–110 мм рт. ст. в течение 24 ч. Пациентам со злокачественной АГ показана трехкомпонентная гипотензивная терапия.
Предикторами недостаточного контроля АД являются пожилой возраст (старше 75 лет), гипертрофия левого желудочка (ГЛЖ), ожирение (индекс массы тела более 30 кг/м2), высокое исходное АД (систолическое АД более 160 мм рт.ст.), хроническая почечная недостаточность (ХПН) с креатинином более 1,5 мг/дл, сахарный диабет, а также, по результатам исследования ALLHAT, принадлежность к негроидной расе и женский пол. Наряду с этим представляют несомненный интерес обнаруженные в исследовании ASCOT данные о снижении риска развития резистентности у больных, получающих лечение антагонистами кальция (АК) (амлодипином) с последующим присоединением ингибитора ангиотензинпревращающего фермента (иАПФ) периндоприла [8] (табл. 1).
Способы преодоления резистентной АГ, рекомендованные
для клинической практики
Непременными условиями успешного лечения АГ являются снижение веса, ограничение потребления соли, употребления алкоголя, регулярные физические нагрузки умеренной интенсивности, диета с ограничением животных жиров и употреблением большого количества полиненасыщенных жиров, грубой клетчатки, овощей, фруктов (DASH–diet: Dietary Approaches to Stop Hypertension), по возможности, отмена препаратов, способствующих повышению АД или уменьшающих эффективность гипотензивной терапии, выявление и лечение вторичной АГ, а также наблюдение у специалиста по АГ.
Очень важно, чтобы врач и пациент проявляли настойчивость в снижении повышенного АД и достижении его целевого уровня. Для достижения эффективного контроля АД от пациента требуется приверженность к лечению, а она во многом зависит от того, насколько добросовестно врач будет проводить разъяснительную работу и сможет убедить больного в необходимости лечиться. Зачастую АГ бывает формально признана резистентной, хотя средства фармакотерапии не выбраны, дозы препаратов не доведены до максимальных терапевтических, не использованы рациональные комбинации гипотензивных средств и т.д.
Для наиболее эффективного лечения резистентной АГ целесообразно воздействие на разные звенья патогенеза. Огромное значение придается назначению блокаторов ренин–ангиотензин–альдостероновой системы (РААС). Доказана эффективность комбинации блокаторов РААС с АК как при гипо–, так и при гиперрениновой форме АГ за счет прямого и ренин–опосредованного механизма вазодилатации. При комбинированном применении препаратов этих групп потенцируются органопротективные эффекты (регресс ГЛЖ, протеинурии, антиишемическое, антиатеросклеротическое, натрийуретическое действие). Кроме того, при совместном назначении иАПФ либо блокатора рецепторов ангиотензина (БРА) с АК нейтрализуются контррегуляторные механизмы, снижающие эффективность каждого из препаратов в монотерапии: в противовес АК иАПФ и БРА подавляют активность РААС и симпатической нервной системы (СНС); в свою очередь АК усиливают экскрецию натрия, что повышает эффективность иАПФ/БРА. Благодаря этому частота таких нежелательных эффектов, как тахикардия и отеки голеней, значительно снижается.
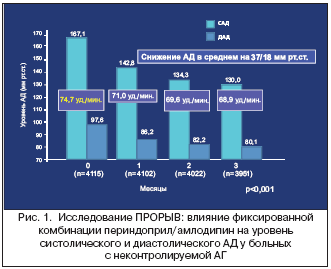
Большая эффективность комбинации АК с блокаторами РААС в снижении АД и предотвращении осложнений АГ подтверждается результатами как российских, так и зарубежных исследований: АSCOT–BPLA (комбинация АК + иАПФ сравнивалась с комбинацией β–блокатор + диуретик), ACCOMPLISH (комбинация иАПФ + АК сравнивалась с комбинаций иАПФ + диуретик), HAMLET (комбинация амлодипина и лизиноприла сравнивалась с монотерапией), EMEA (комбинации амлодипина с валсартаном 5/160 мг и 10/160 мг сравнивались с монотерапией валсартаном 160 мг). В российском исследовании ПРОРЫВ [9] была показана высокая эффективность фиксированной комбинации периндоприла с амлодипином у 4115 больных с неконтролируемой АГ в достижении целевого уровня АД (рис. 1). При резистентной и тяжелой АГ с целью повышения приверженности к лечению и экономической эффективности рекомендованы их фиксированные комбинации. В то же время двойная блокада РААС (одновременное назначение иАПФ и БРА или присоединение к одному из них прямого ингибитора ренина алискирена) себя не оправдала из–за развития нежелательных эффектов.
В большинство схем лечения резистентной АГ входят мочегонные средства. Учитывая имеющуюся у больных с резистентной АГ скрытую (как правило, отеки отсутствуют) перегрузку объемом даже при лечении мочегонными в стандартных дозах, последние должны назначаться в максимально переносимой/эффективной дозе. Доза диуретика постепенно увеличивается до максимально допустимой. В этой ситуации необходимо помнить о возможности появления клинических признаков чрезмерной дегидратации, таких как слабость, ортостатическая гипотония, снижение перфузии тканей (повышение креатина, не объясняющееся другими причинами). Чрезмерная терапия мочегонными препаратами может приводить к избыточному выведению натрия с последующей активацией РААС и повышением АД.
Начинать лечение мочегонными препаратами рекомендуют с тиазидных диуретиков (гидрохлоротиазид, в некоторых случаях – сульфонамидное производное тиазидов индапамид, а также препараты, отсутствующие на территории РФ: бендрофлуазид, хлорталидон, метолазон). Наиболее эффективно в этой группе снижает АД хлорталидон (доступный на территории РФ только в виде фиксированных комбинаций с атенололом). Хлорталидон имеет большую продолжительность действия и более выраженный гипотензивный эффект, чем гидрохлоротиазид, его назначение в меньших дозировках приводило к сопоставимому снижению АД. В исследовании ALLHAT показана способность хлорталидона снижать риск сосудистых событий. При ХПН могут применяться петлевые диуретики (фуросемид, торасемид, буметанид, этакриновая кислота). За рубежом при АГ в сочетании с ХПН преимущество имеет тиазидное производное метолазон и его усовершенствованная формула микрокс в дозе 0,5–1,0 мг/сут. (в настоящее время не продается в РФ), однако его недостатком является вариабельная абсорбция.
Основным побочным эффектом мочегонных средств является гипокалиемия, поэтому в течение первых 10–14 дней, пока не установится новый баланс калия, необходим контроль его уровня в плазме. Полезны могут быть калийсберегающие агенты и их комбинации с тиазидами.
В рекомендациях РМОАГ/ВНОК по диагностике и лечению АГ [4] говорится о целесообразности назначения при резистентной АГ тройной полнодозовой гипотензивной терапии; рациональными признаны следующие трехкомпонентные комбинации: иАПФ + дигидропиридиновый АК + β–адреноблокаторы (β–АБ); БРА + дигидропиридиновый АК + β–АБ; иАПФ + АК + диуретик; БРА + АК + диуретик; иАПФ + диуретик + β–АБ; БРА + диуретик + β–АБ; дигидропиридиновый АК + диуретик + β–АБ.
Из представленных комбинация блокатора РААС с АК и мочегонным средством представляется наиболее эффективной, именно ее рекомендуют и американские эксперты (резистентная АГ). При наличии специальных показаний (ИБС, ХСН) оправданно присоединение к этой схеме β–блокатора, предпочтительно с вазодилатирующими свойствами.
В последние годы возобновился интерес к антагонистам альдостерона, давно известному спиронолактону и относительно недавно вошедшему в клиническую практику селективному антагонисту минералокортикоидных рецепторов эплеренону. При резистентной АГ эффективность антагонистов альдостерона доказана вне зависимости от наличия или отсутствия гиперальдостеронизма.
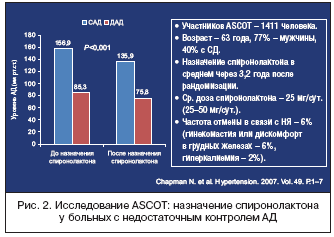
В одном из крупнейших исследований – ASCOT – был проведен анализ, включивший 1411 человек, соответствующих критериям резистентности [10]. К проводимой терапии у больных, не достигших целевого уровня АД, присоединялся спиронолактон в средней дозе 25 мг/сут., который способствовал дополнительному снижению систолического/диастолического АД на 22/10 мм рт.ст. через год лечения (рис. 2). В этом и в ряде других исследований показано увеличение риска гиперкалиемии у больных с ХПН, а также при одновременном назначении других препаратов, повышающих концентрацию калия в плазме: иАПФ или БРА, НПВП.
В недавно завершившемся рандомизированном исследовании ASPIRANT (включено 117 больных) спиронолактон или плацебо были присоединены к терапии в среднем четырьмя гипотензивными средствами, была показана эффективность спиронолактона в снижении систолического АД при резистентной АГ. В другом рандомизированном исследовании 42 пациента с избыточным весом или ожирением в дополнение к исходной терапии, включавшей БРА или иАПФ и еще 3 препарата, получали иАПФ или БРА либо спиронолактон (25–50 мг/сут.); было показано, что при резистентной АГ эффект спиронолактона выше, чем при двойной блокаде РААС.
Эплеренон отличается значительно более редкой частотой развития таких нежелательных эффектов спиронолактона, как гиперкалиемия и гинекомастия. Эффективность эплеренона при резистентной АГ изучалась в одном из исследований, включавшем 52 больных с резистентной АГ, избыточным весом/ожирением и разным состоянием почечной функции. При добавлении эплеренона в дозе 50–100 мг/сут. к терапии от 3 до 7 гипотензивных средств (в том числе иАПФ или БРА) происходило достоверное снижение АД вне зависимости от исходного уровня альдостерона и активности ренина плазмы, а также уменьшалась потребность в назначении других средств, снижающих АД. Только у 2 пациентов было в общей сложности 3 случая умеренной гиперкалиемии (калий плазмы менее 6, но более 5,5 ммоль/л). Эти исследования, несмотря на относительно небольшую выборку участников, свидетельствуют о целесообразности включения спиронолактона или эплеренона в схему лечения больных с резистентной АГ. Имеются данные об эффективности при резистентной АГ сочетания амилорида с гидрохлоротиазидом, особенно при невозможности применения антагонистов минералокортикоидных рецепторов.
В резерве фармакотерапии препараты, назначение которых ограничено побочными эффектами и требует врачебного контроля: гипотензивные средства центрального действия (клонидин, гуанфацин), миотропные периферические вазодилататоры (гидралазин, миноксидил, отсутствующие на данный момент на территории РФ), симпатолитики (резерпин, гуанетидин), α1–блокаторы (доксазозин, теразозин).
Новые гипотензивные средства
в стадии разработки
В последнее десятилетие предпринимаются попытки поиска новых фармакологических мишеней и воздействия на них с целью более эффективного снижения АД и уменьшения частоты побочных эффектов. С этой точки зрения привлекательной представлялась блокада РААС на уровне ренина, однако преимущество его прямого ингибитора алискирена при резистентной артериальной гипертонии не доказано. Кроме того, существуют данные о негативных эффектах алискирена в определенных группах больных. Так, по результатам исследования ALTITUDE одновременное назначение прямого ингибитора ренина алискирена с иАПФ или БРА у больных с сахарным диабетом 2 типа приводит к нарушению почечной функции, гипотонии и гиперкалиемии. Также на фоне лечения этой комбинацией было отмечено увеличение смертности и частоты инсультов, в связи с чем исследование было досрочно прекращено. Одновременное назначение алискирена с иАПФ или БРА при сахарном диабете и почечной недостаточности (скорость клубочковой фильтрации (СКФ) – менее 60 мл/мин.) не рекомендуется.
В настоящее время можно выделить следующие классы новых фармакологических средств на разных этапах разработки: препараты, воздействующие на РААС (блокаторы рецептора проренина, двойные и тройные ингибиторы вазопептидаз – АПФ, неприлизина, эндотелинпревращающего фактора; антагонисты альдостероновой синтазы; полимеры – ионообменники калия, созданные для предотвращения гиперкалиемии 39; антагонисты рецепторов альдостерона, отличные от спиронолактона и эплеренона, например нестероидные гибриды со свойствами антагонистов кальция; препараты, воздействующие на систему реналазы); селективные антагонисты рецепторов эндотелина–А; донаторы оксида азота (препараты, высвобождающие оксид азота: нитрозил–кобаламид, NO–высвобождающие гибриды лозартана и телмисартана, непептидные нитропроизводные ингибиторов ренина, напроксинод – донатор NO со свойствами НПВП (для лечения АГ с артритом); агонисты натрийуретических пептидов, агонисты рецепторов к АТ–2 типа 2.
В лабораторных экспериментах на крысах показана эффективность методов генетической терапии с внедрением на вирусных и других векторах генов, ответственных за экспрессию веществ, способствующих снижению АД. Также ведется работа над созданием вакцины против АТ–2. Интерес представляют молекулы, направленные на борьбу с клеточным старением, т.е. ингибиторы (аминогуанидин, пиридоксамин) и лидазы (алагебриум и структурные аналоги пиридина) конечных продуктов гликирования, которые способствуют повышению жесткости артерий и формированию изолированной систолической АГ.
Эндоваскулярное лечение
резистентной АГ
Наличие резистентной АГ стимулирует разработку методов нелекарственного воздействия на патогенетические механизмы заболевания. Перспективным методом в лечении резистентной артериальной гипертонии в настоящее время считается катетерная аблация симпатического сплетения почечной артерии, или почечная денервация [11,12]. В начале XX века R. Smithwick, возглавлявший отделение хирургии в Бостонском университете (США), предложил операцию для лечения АГ, во время которой выполнялась билатеральная люмбодорсальная симпатэктомия и спланхникэктомия с резекцией симпатических ганглиев в нижнегрудном отделе. Частым осложнением была симптоматическая ортостатическая гипотензия, но, несмотря на это, многие пациенты с тяжелой АГ чувствовали себя после вмешательства лучше. В дальнейшем данный хирургический метод не получил развития ввиду появления гипотензивных средств. Сегодня метод Smithwick переживает свое второе рождение.
Патофизиология. При АГ практически любого генеза имеет место повышение тонуса симпатической нервной системы (СНС). Гиперактивация СНС и прогрессирующее повышение АД взаимно усиливают друг друга и участвуют в формировании порочного круга. Повышенная активность СНС больше всего затрагивает почки. При гиперактивации СНС в почке происходит вазоконстрикция, снижаются кровоток и фильтрация, усиливается секреция ренина, увеличивается реабсорбция натрия и воды. Афферентная импульсация от почек по афферентным нервным волокнам поступает сначала в боковые рога спинного мозга, а затем в сосудистый центр в центральной нервной системе, способствуя повышению АД. Она усиливается при растяжении механорецепторов, ишемии почек, под воздействием гипоксии. В эксперименте показано, что электрическая стимуляция афферентных нервных волокон почек повышает АД и вызывает спазм сосудов. Денервация этих волокон, наоборот, способствует снижению АД.
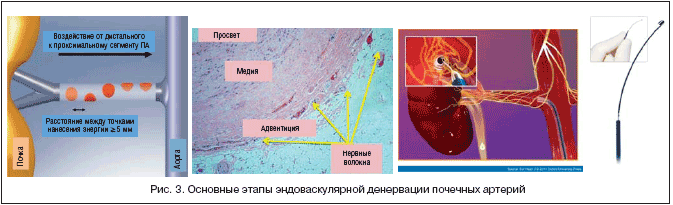
Процедура. Система для денервации Medtronic Ardian Sympicity Catheter System состоит из генератора радиочастотных волн и одноразового катетера с механизмом управления кончиком. Генератор вырабатывает радиочастотные волны мощностью 5–8 Вт и постоянно контролирует температуру и импеданс на кончике катетера. При превышении или недостижении необходимых параметров либо через 2 мин. эффективного воздействия система автоматически отключается. Кончик катетера представляет собой платиновоиридиевый электрод, он рентгеноконтрастен и благодаря этому выполняет также функцию метки при катетеризации.
При эндоваскулярной почечной денервации после ангиографии почечной артерии в ее устье устанавливается направляющий катетер 6F, затем под ангиографическим контролем катетер для радиочастотной аблации (РЧА) подводится до уровня бифуркации и подключается к генератору (рис. 3). После этого с помощью специального механизма, позволяющего ориентировать катетер для РЧА в нужном направлении, он продвигается проксимально (от почки к аорте). При этом выполняется 4–6 радиочастотных воздействий по 2 мин. с шагом не менее 5 мм и углом вращения 45° по окружности сосуда. Катетер воздействует на симпатические волокна через всю толщу почечной артерии. Аблация приводит к определенному повреждению эндотелия, однако пока по результатам контрольных ангиограмм не выявлено клинически значимых последствий этого повреждения. В литературе встречаются попытки объяснить отсутствие значимого повреждения эндотелия его меньшей чувствительностью к выбранному воздействию, а также охлаждающим действием крови, омывающей внутреннюю стенку артерии.
Доказательная база
В настоящее время эффективность и безопасность эндоваскулярной денервации почек активно изучается во всем мире. К данному моменту завершены исследования Symplicity HTN–1,2; проводятся исследования HTN–3 и Duration of Renal Sympathetic Activation and Hypertension [12–14]. В проведенных исследованиях показана эффективность метода в снижении АД при резистентной АГ, а также его безопасность. Максимальная длительность наблюдения составила 2 года, к концу этого срока снижение АД составило в среднем около 30/10 мм рт.ст. По данным Symplicity HTN–1, после почечной денервации уровень САД ниже 140 мм рт.ст. был достигнут у 39%, ниже 160 мм рт.ст. – у 82% оперированных.
При высокой эффективности процедуры осложнения имели место в небольшом количестве случаев и успешно излечивались. Среди осложнений была 1 псевдоаневризма, 1 диссекция, успешно устраненная стентированием, 1 эпизод послеоперационной гипотензии, 1 случай инфекции мочевых путей, 1 случай болевого синдрома в спине, у 7 человек из 52 оперированных во время процедуры отмечалась преходящая брадикардия, в части случаев потребовавшая введения атропина, у 2 больных имело место усугубление атеросклероза почечной артерии, эндоваскулярного лечения не потребовалось (в частности, в HTN –1 был случай прогрессирования стеноза почечных артерий в сегменте, удаленном от места воздействия). Случаев нарушения азотовыделительной функции почек не было (оценивались через 6 мес. по креатинину, СКФ, цистатину С).
Впервые в России эта процедура была осуществлена в 2011 г. в РКНПК. Опубликованы данные о 5 успешно проведенных операциях [15]. При контроле через 1 мес. сохранялся стойкий эффект от процедуры, АД продолжало снижаться, побочных эффектов, а также ранних и поздних осложнений не отмечалось.
Симпатическая денервация почечных артерий пока является недостаточно изученным методом, поэтому эксперты ESH/ESC рекомендует прибегать к ней только при наличии строгих показаний. Показанием к процедуре является резистентная неконтролируемая эссенциальная АГ (систолическое АД при измерении у врача и самоконтроле – более 160 мм рт.ст. или 150 мм рт.ст. – у больных сахарным диабетом), несмотря на проводимое специалистом по АГ трехкомпонентное лечение и удовлетворительную приверженность пациента к лечению.
Противопоказаниями к процедуре являются: почечные артерии менее 4 мм в диаметре и менее 20 мм в длину, манипуляции на почечных артериях (ангиопластика, стентирование) в анамнезе, стеноз почечных артерий более 50%, почечная недостаточность (СКФ менее 45 мл/мин./1,75 м2), сосудистые события (ИМ, эпизод нестабильной стенокардии, транзиторная ишемическая атака, инсульт) менее 6 мес. до процедуры, любая вторичная форма АГ.
Метод электрической стимуляции
барорецепторов каротидного синуса
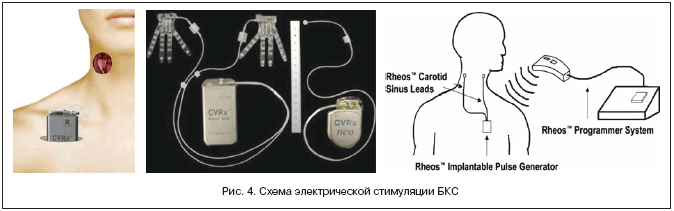
Еще один метод воздействия на активность СНС на стадии клинических испытаний заключается в электрической стимуляции барорецепторов каротидного синуса (БКС) с целью рефлекторного снижения АД. БКС, расположенные в области бифуркации сонных артерий, принимают участие в регуляции АД. При его повышении происходит растяжение рецепторов, далее импульсация от них поступает в сосудистый центр головного мозга, что приводит к снижению АД. При АГ чувствительность барорецепторов снижается. Схема БКС предсталена на рисунке 4.
При электрической стимуляции электроды стимулятора каротидного синуса Rheos (CVRx, Minneapolis, MN, USA) подводятся к сонным артериям и соединяются с генератором, который вшивается под кожу передней грудной стенки. Имплантация стимулятора проводится сосудистым хирургом, кардио– или нейрохирургом. Перед внедрением электрода в толщу стенки сонной артерии проводится выбор наиболее чувствительной к стимуляции зоны каротидного синуса: генератор подает на электрод небольшой разряд (для терапии ВАТ используется ток под напряжением 1–6 В); через 30 с после воздействия на данный участок каротидного синуса измеряется АД. Электрод оставляется в том месте, где снижение АД в ответ на разряд заданной силы максимально. Сила подаваемого на электроды разряда регулируется компьютерной программой, по аналогии с тем, как это происходит при настройке электрокардиостимулятора; генератор и компьютер находятся в радиочастотном сопряжении.
Данные первого рандомизированного двойного слепого плацебо–контролируемого исследования по оценке клинической эффективности стимуляции БКС – Rheos Pivotal Trial опубликованы в 2011 г. [16]. В ходе исследования у 265 пациентов с резистентной АГ была показана эффективность метода стимуляции БКС. При контроле через год снижение систолического АД составило в среднем 35 мм рт.ст.; у половины испытуемых были достигнуты значения АД менее 140 мм рт.ст. Максимальная длительность наблюдения составила 53 мес., в течение всего этого срока гипотензивный эффект сохранялся. Основные осложнения были связаны с инфицированием операционной раны и повреждением нерва, однако их частота была значительно меньше, чем при хорошо отработанной операции эндартерэктомии, и в большинстве случаев эти осложнения были обратимыми, а резидуальные эффекты – незначительными. Важно отметить, что для достижения полного эффекта необходимо продолжительное время, т.к. перестройка сосудистого тонуса является по своей природе длительным процессом.
В другом недавно опубликованном исследовании Barostim neo (30 пациентов) изучался прибор 2–го поколения, значительно меньших размеров для односторонней стимуляции. Барорецепторная стимуляция показала свою эффективность даже у тех 6 больных, у которых в анамнезе были ранее выполненная безуспешная катетерная денервация почечных артерий и более высокий исходный уровень АД [17]. Полученные результаты свидетельствуют о перспективности метода. В настоящее время продолжается его совершенствование. Возможно, в недалеком будущем начнется внедрение электрической стимуляции БКС в клиническую практику. В РФ клинические испытания данного метода не проводились.
Таким образом, создается впечатление, что в арсенале специалистов по АГ скоро появятся новые способы нелекарственного лечения – денервация почечных артерий и электрическая стимуляция БКС. Помимо оценки эффективности этих методов остаются неясными разные аспекты лечения: предикторы успеха и критерии эффективности процедур, длительность эффекта, возможность повреждения эндотелия сосудов, риск развития нежелательных эффектов. Тем не менее успех их первых клинических испытаний позволяет рассчитывать на их применение в ближайшем будущем.
Процедуры и аппаратные методы лечения АГ на этапе научной
разработки
Интерес представляет метод нейроваскулярной декомпрессии ствола мозга. Есть данные о том, что повышенное АД может быть связано с его сдавлением извитыми артериями, в основном задней нижней мозжечковой артерией. В небольших работах (рандомизированные исследования в этой области еще не проводились) отмечено стойкое снижение АД в результате хирургической декомпрессии мозга, однако, в соответствии с данными Norman Kaplan, не любая извитость артерий патогенетически обусловлена АГ и хирургическая декомпрессия помогает не всем больным с АГ. Пока неизвестно, как определить, связана ли АГ у конкретного больного с нейроваскулярной компрессией, но описаны синдромы, при которых эта связь достоверно существует (брахидактилия, гипертония, нейроваскулярная компрессия).
Замечено, что глубокая стимуляция головного мозга, используемая при синдроме хронической боли, болезни Паркинсона и др., может приводить к снижению АД при сопутствующей АГ, но пока она не применяется в клинической практике. Обсуждается также возможность разработки нового метода лечения АГ с помощью аппаратного контроля функции дыхания, основанного на связи дыхательного и сосудодвигательного центров.
Заключение
Эффективное лечение АГ относится к приоритетным направлениям в медицине. «Преодоление резистентности» при лечении больных с АГ во многом базируется на соблюдении всех рекомендуемых принципов ведения данной категории пациентов, включая рациональный подбор комбинированной терапии. В случаях истинной резистентности к терапии существуют методики лечения с помощью аппаратов, позволяющих достичь контроля АД с приемлемой степенью безопасности.

Литература
1. Kearney P.M., Whelton M., Reynolds K. et al. Global burden of hypertension: analysis of worldwide data // Lancet. 2005. Vol. 365. P. 217–233.
2. Guidelines for the management of arterial hypertension. The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // Eur. Heart J. 2007. Vol. 28. P. 1462–1536.
3. Оганов Р.Г., Тимофеева Т.Н., Колтунов И.Е. и др. Эпидемиология артериальной гипертонии в России. Результаты федерального мониторинга 2003–2010 гг. // Кардиоваск. терапия и профилактика. – 2011. – Т. 10(1). – С. 8–12.
4. Российское медицинское общество по артериальной гипертонии (РМОАГ)/Всероссийское научное общество кардиологов (ВНОК). Диагностика и лечение артериальной гипертензии. Российские рекомендации (четвертый пересмотр) // Системные гипертензии. – 2010. – № 3. – С. 5–26.
5. The 7th report of the Joint National Committee on prevention, detection, evaluation, and treatment of high blood pressure // JAMA. 2003. Vol. 289. P. 2560–2572.
6. Calhoun D.A., Jones D., Textor S. et al. Resistant hypertension: diagnosis, evaluation, and treatment. A scientific statement from the American Heart Association Professional Education Committee of the Council for High Blood Pressure Research // Hypertension. 2008. Vol. 51. P. 1403.
7. Acelajado M.C., Pisoni R., Dudenbostel T. et al. Refractory hypertension: definition, prevalence, and patient characteristics // J. Clin. Hypertens. (Greenwich). 2012. Vol. 14(1). P. 7–12.
8. Gupta A.K., Nasothimioua E.G., Changa C.L. et al. Baseline predictors of resistant hypertension in the Anglo–Scandinavian Cardiac Outcome Trial (ASCOT): a risk score to identify those at high–risk // J. Hypertens. 2011. Vol. 29.
9. Карпов Ю.А., Деев А.Д. от имени врачей–участников программы ПРОРЫВ. Неконтролируемая АГ – новые возможности в решении проблемы повышения эффективности лечения // Кардиология. – 2012. – № 2. – С. 29–35.
10. Chapman N., Dobson J., Wilson S. et al. Anglo–Scandinavian Cardiac Outcomes Trial Investigators. Effect of spironolactone on blood pressure in subjects with resistant hypertension // Нypertens. 2007. Vol. 49. P. 839–845.
11. Schmieder R.E., Redon J., Grassi G. et al. ESH Position Paper: renal denervation – an interventional therapy of resistant hypertension // J. Hypertens. 2012. Vol. 30(5).
12. Krum H., Schlaich M., Whitbourn R. et al. Catheter–based renal sympathetic denervation for resistant hypertension: a multicentre safety and proof–of–principle cohort study //Lancet. 2009. Vol. 373. P. 1275–1281.
13. Symplicity HTN–1 Investigators. Catheter–based renal sympathetic denervation for resistant hypertension: durability of blood pressure reduction out to 24 months // Hypertens. 2011. Vol. 57. P. 911–917.
14. Symplicity HTN–2 Investigators. Renal sympathetic denervation in patients with treatment–resistant hypertension (The Symplicity HTN–2 Trial): a randomized controlled trial // Lancet. 2010. Vol. 376. P. 1903–1909.
15. Данилов Н.М., Матчин Ю.Г., Чазова И.Е. Эндоваскулярная радиочастотная денервация почечных артерий – инновационный метод лечения рефрактерной артериальной гипертонии. Первый опыт в России // Ангиол. и сосуд. Хирургия. – 2012. – № 18(1). – С. 51–56.
16. Burke S.L., Evans R.G. et al. Levels of renal and extrarenal sympathetic drive in angiotensin–2–induced hypertension // Hypertens. 2008. Vol. 51. P. 878–883.
17. Bisognano J.D., Bakris G., Nadim M.K. et al. Baroreflex activation therapy lowers blood pressure in patients with resistant hypertension: results from the double–blind, randomized, placebo–controlled rheos pivotal trial // JACC. 2011. Vol. 58. P. 765.












