–Я—А–Њ–≥–љ–Њ–Ј –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є (–Р–У) –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Б—В–µ–њ–µ–љ—М—О –њ–Њ—А–∞–ґ–µ–љ–Є—П –Њ—А–≥–∞–љ–Њ–≤ –Љ–Є—И–µ–љ–µ–є – —Б–µ—А–і—Ж–∞, –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –њ–Њ—З–µ–Ї –Є —Б–Њ—Б—Г–і–Њ–≤ [56]. –Я–Њ—Н—В–Њ–Љ—Г –∞–Ї—В—Г–∞–ї—М–љ–Њ–є –Ј–∞–і–∞—З–µ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є (–У–С) —П–≤–ї—П–µ—В—Б—П –≤–∞–Ј–Њ–њ—А–Њ—В–µ–Ї—Ж–Є—П, —Ж–µ–ї—М—О –Ї–Њ—В–Њ—А–Њ–є —П–≤–ї—П–µ—В—Б—П —А–µ–≥—А–µ—Б—Б–Є—П –≥–Є–њ–µ—А—В—А–Њ—Д–Є—А–Њ–≤–∞–љ–љ–Њ–є –Љ–µ–і–Є–Є —А–µ–Ј–Є—Б—В–Є–≤–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ –Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ —А–µ–≥—Г–ї—П—В–Њ—А–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О —Н–љ–і–Њ—В–µ–ї–Є—П. –Т –ї–Є—В–µ—А–∞—В—Г—А–µ –Є–Љ–µ—О—В—Б—П —Б–≤–µ–і–µ–љ–Є—П –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є —А–µ–≥—Г–ї—П—Ж–Є–Є —В–Њ–љ—Г—Б–∞ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –∞—А—В–µ—А–Є–є –њ—А–Є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–њ—А–µ–≤—А–∞—Й–∞—О—Й–µ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ (–Є–Р–Я–§) [9].
–Ш–Ј –±–Њ–ї—М—И–Њ–є –≥—А—Г–њ–њ—Л –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–љ—Л—Е –≤–µ—Й–µ—Б—В–≤, –њ–Њ–Љ–Є–Љ–Њ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II, –љ–µ –Љ–µ–љ—М—И–Є–є –Є–љ—В–µ—А–µ—Б –і–ї—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Н–љ–і–Њ—В–µ–ї–Є–є––њ—А–Њ–і—Г—Ж–Є—А—Г–µ–Љ—Л–µ —Д–∞–Ї—В–Њ—А—Л –Є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Н–љ–і–Њ—В–µ–ї–Є–љ. –°—В–µ–њ–µ–љ—М –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Б–Њ—Б—Г–і–Њ—Б—Г–ґ–Є–≤–∞—О—Й–µ–≥–Њ –і–µ–є—Б—В–≤–Є—П —Н—В–Њ–≥–Њ –њ–µ–њ—В–Є–і–∞ –њ–Њ–Ј–≤–Њ–ї–Є–ї–∞ –Њ–њ—А–µ–і–µ–ї–Є—В—М –µ–≥–Њ –Ї–∞–Ї —Б–∞–Љ—Л–є —Б–Є–ї—М–љ—Л–є –Є–Ј –љ—Л–љ–µ –Є–Ј–≤–µ—Б—В–љ—Л—Е –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–љ—Л—Е –∞–≥–µ–љ—В–Њ–≤, –Њ–±–ї–∞–і–∞—О—Й–Є–є —Б–Є—Б—В–µ–Љ–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ [26].
–≠–љ–і–Њ—В–µ–ї–Є–љ —А–µ–∞–ї–Є–Ј—Г–µ—В —Б–≤–Њ–Є —Н—Д—Д–µ–Ї—В—Л –њ—Г—В–µ–Љ —Б–≤—П–Ј—Л–≤–∞–љ–Є—П —Б–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є – –≠–Ґ-a –Є –≠–Ґ-b . –≠–Ґ a–—А–µ—Ж–µ–њ—В–Њ—А—Л –њ—А–µ–Њ–±–ї–∞–і–∞—О—В –≤ –Љ–Є–Њ–Ї–∞—А–і–µ –Є –≥–ї–∞–і–Ї–Є—Е –Љ—Л—И—Ж–∞—Е —Б–Њ—Б—Г–і–Њ–≤, –Њ—В–ї–Є—З–∞—О—В—Б—П –≤—Л—Б–Њ–Ї–Є–Љ —Б—А–Њ–і—Б—В–≤–Њ–Љ –Ї –≠–Ґ. [1,17,34,41]. –≠–Ґ b–—А–µ—Ж–µ–њ—В–Њ—А—Л —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ—Л –Є –≤ –і—А—Г–≥–Є—Е –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–∞—Е.
–®–Є—А–Њ–Ї–Њ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П —Н–љ–і–Њ—В–µ–ї–Є–љ–∞. –Ґ–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –∞–≤—В–Њ—А–Њ–≤, —Н–љ–і–Њ—В–µ–ї–Є–љ —Б–њ–Њ—Б–Њ–±–µ–љ –≤—Л–Ј—Л–≤–∞—В—М –њ—А—П–Љ—Г—О [12, 23] –Є–ї–Є –љ–µ–њ—А—П–Љ—Г—О [31] –∞–Ї—В–Є–≤–∞—Ж–Є—О –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –Ї–∞–ї—М—Ж–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤, –њ–Њ–≤—Л—И–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–Њ—Б—Д–Њ–ї–Є–њ–∞–Ј –° –Є –Р2 [33, 42]. –Я–Њ—Б–ї–µ–і–љ–µ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ–≤—Л—И–µ–љ–Є—О —Г—А–Њ–≤–љ—П –∞—А–∞—Е–Є–і–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л [33,42] –Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Є–Ј –љ–µ–µ –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ —Ж–Є–Ї–ї–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞ –Х2. –°–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –і–µ–њ—А–µ—Б—Б–Њ—А–љ–Њ–є –Є –Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–љ–Њ–є —Д–∞–Ј –і–µ–є—Б—В–≤–Є—П —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ –Ј–∞–≤–Є—Б–Є—В –Њ—В —Г—А–Њ–≤–љ—П –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ [16,30]. –Т –≥–µ–љ–µ–Ј–µ –Њ—В–≤–µ—В–∞ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є –љ–∞ —Н–љ–і–Њ—В–µ–ї–Є–љ –≤–µ–і—Г—Й–∞—П —А–Њ–ї—М –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є –Ї–∞–љ–∞–ї–Њ–≤ –Љ–µ–і–ї–µ–љ–љ–Њ–≥–Њ —В–Њ–Ї–∞ –Ї–∞–ї—М—Ж–Є—П –≤ –Ї–ї–µ—В–Ї—Г.
–Т—Л—И–µ–Њ–њ–Є—Б–∞–љ–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л —Н–љ–і–Њ—В–µ–ї–Є–љ–∞, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –љ–∞ —Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б–Є—Б—В–µ–Љ—Г, –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є —Б–і–µ–ї–∞—В—М –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ –±–Њ–ї—М—И–Њ–є —А–Њ–ї–Є —Н—В–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ —А–∞–Ј–ї–Є—З–љ—Л—Е —В–Є–њ–Њ–≤ –Р–У [20]. –Т–µ—А–Њ—П—В–љ–Њ, –њ—А–Є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є –љ–∞—А—Г—И–µ–љ–Њ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ —Н–љ–і–Њ—В–µ–ї–Є–µ–Љ –Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ [30]. –Ы–Њ–Ї–∞–ї—М–љ–∞—П –њ—А–Њ–і—Г–Ї—Ж–Є—П —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ –≤ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–µ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї —А–∞–Ј–≤–Є—В–Є—О –≥–Є–њ–µ—А—В–Њ–љ–Є–Є –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —Г—А–Њ–≤–љ—П –µ–≥–Њ –≤ –њ–ї–∞–Ј–Љ–µ [26]. –Э–∞—А—Г—И–µ–љ–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —Б–Є–љ—В–µ–Ј–∞ –Є –і–µ–≥—А–∞–і–∞—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ –Њ—В—А–∞–ґ–∞–µ—В—Б—П –љ–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–Є —В–Њ–љ—Г—Б–∞ —Б–Њ—Б—Г–і–Њ–≤ [36]. –Ф–Є—Б–±–∞–ї–∞–љ—Б —Н–љ–і–Њ—В–µ–ї–Є–є–Ј–∞–≤–Є—Б–Є–Љ–Њ–є —Б–Њ–Ї—А–∞—В–Є–Љ–Њ—Б—В–Є –Є —А–µ–ї–∞–Ї—Б–∞—Ж–Є–Є —Б–Њ—Б—Г–і–Њ–≤ –њ—А–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –њ–Њ–≤—Л—И–µ–љ–Є—О –Њ–±—Й–µ–≥–Њ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П —Б–Њ—Б—Г–і–Њ–≤ (–Ю–Я–°–°) –Є –њ–Њ—П–≤–ї–µ–љ–Є—О —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є [30,31,32].
–Ф–∞–љ–љ—Л–µ –Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–∞–є–љ–µ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л. –†—П–і–Њ–Љ –∞–≤—В–Њ—А–Њ–≤ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ –≤ –Ї—А–Њ–≤–Є –Ї—А–∞–є–љ–µ –Љ–∞–ї–∞ (–љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 0,1 – 1,0 —Д–Љ–Њ–ї—М/–Љ–ї) –Є–ї–Є –Њ–љ –Љ–Њ–ґ–µ—В —Б–Њ–≤—Б–µ–Љ –љ–µ –Њ–њ—А–µ–і–µ–ї—П—В—М—Б—П [4,27,46]. –Я—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ–Њ, —З—В–Њ —Г—А–Њ–≤–µ–љ—М –Є–Љ–Љ—Г–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ–Њ–≤—Л—И–∞–µ—В—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О II – III —Б—В–∞–і–Є–Є (—Б –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Њ—А–≥–∞–љ–Њ–≤––Љ–Є—И–µ–љ–µ–є), –∞ —В–∞–Ї–ґ–µ —Г –±–Њ–ї—М–љ—Л—Е —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О [15,36,44,48,55]. –•–∞—А–∞–Ї—В–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ –Ї—А–Њ–≤–Є —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ. –Э–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ –Њ—В–Љ–µ—З–µ–љ –њ—А–Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–µ, –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–Љ –∞–Њ—А—В–Њ–∞—А—В–µ—А–Є–Є—В–µ, –±–Њ–ї–µ–Ј–љ–Є –С—О—А–≥–µ—А–∞ (–Њ–±–ї–Є—В–µ—А–Є—А—Г—О—Й–µ–Љ —В—А–Њ–Љ–±–∞–љ–≥–Є–Є—В–µ), —В.–µ. –њ—А–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е, –њ—А–Њ—В–µ–Ї–∞—О—Й–Є—Е —Б –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ–Љ —Н–љ–і–Њ—В–µ–ї–Є—П [33].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–Њ –Ї–Њ–љ—Ж–∞ –љ–µ –≤—Л—П—Б–љ–µ–љ–Њ, —П–≤–ї—П–µ—В—Б—П –ї–Є –≤—Л–±—А–Њ—Б —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ —А–µ–∞–Ї—Ж–Є–µ–є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є –љ–∞ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ –Є–ї–Є –±–Њ–ї—М—И–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–µ—В –њ–Њ–≤—Л—И–µ–љ–Є–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Н–љ–і–Њ—В–µ–ї–Є—П –Ї –≤—Л—А–∞–±–∞—В—Л–≤–∞–µ–Љ–Њ–Љ—Г –њ–µ–њ—В–Є–і—Г.
–Э–∞—А—П–і—Г —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ –і–ї—П –У–С —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≤–∞–Ј–Њ–і–Є–ї–∞—В–Є—А—Г—О—Й–Є—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є (–њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤, –њ—А–µ–і—Б–µ—А–і–љ–Њ–≥–Њ –љ–∞—В—А–Є–є—Г—А–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–µ–њ—В–Є–і–∞), —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–љ–Є–ґ–µ–љ–Є—О –Ю–Я–°–° –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—О –≤—Л–≤–µ–і–µ–љ–Є—П –љ–∞—В—А–Є—П [43,52,55].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –±–Њ–ї—М—И–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ —Г–і–µ–ї—П–µ—В—Б—П –Є–Ј—Г—З–µ–љ–Є—О –њ—А–µ–і—Б–µ—А–і–љ–Њ–≥–Њ –љ–∞—В—А–Є–є—Г—А–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–µ–њ—В–Є–і–∞ (–Я–Э–£–Я), –Њ–±–ї–∞–і–∞—О—Й–µ–≥–Њ –љ–∞—В—А–Є–є—Г—А–µ—В–Є—З–µ—Б–Ї–Є–Љ –Є –≤–∞–Ј–Њ–і–Є–ї–∞—В–Є—А—Г—О—Й–Є–Љ —Б–≤–Њ–є—Б—В–≤–∞–Љ [3,13,19]. –Я–Э–£–Я – –Њ–і–Є–љ –Є–Ј —А–µ–≥—Г–ї—П—В–Њ—А–Њ–≤ —Б—Г—В–Њ—З–љ–Њ–≥–Њ —А–Є—В–Љ–∞ —Н–Ї—Б–Ї—А–µ—Ж–Є–Є –љ–∞—В—А–Є—П, –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є–є –Ї–Њ–ї–µ–±–∞–љ–Є—П –Р–Ф –Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є [9]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Я–Э–£–Я –њ—А–Є–љ–Є–Љ–∞–µ—В —Г—З–∞—Б—В–Є–µ –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ—Л—Е –∞–і–∞–њ—В–∞—Ж–Є–Њ–љ–љ–Њ––Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –њ—А–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л [2,5,11,24,47,49].
–°–µ–Ї—А–µ—Ж–Є—П –Я–Э–£–Я —А–µ–≥—Г–ї–Є—А—Г–µ—В—Б—П —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є: –і–∞–≤–ї–µ–љ–Є–µ–Љ –≤ –њ—А–µ–і—Б–µ—А–і–Є—П—Е, –Њ–±—К–µ–Љ–Њ–Љ —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–µ–є –Ї—А–Њ–≤–Є, –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ–Љ –љ–∞—В—А–Є—П, –∞ —В–∞–Ї–ґ–µ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л–Љ–Є —Б–Њ–µ–і–Є–љ–µ–љ–Є—П–Љ–Є (–∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–Љ II, –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–∞–Љ–Є, –Ї–Є–љ–Є–љ–∞–Љ–Є, –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞–Љ–Є, –∞–љ—В–Є–і–Є—Г—А–µ—В–Є—З–µ—Б–Ї–Є–Љ –≥–Њ—А–Љ–Њ–љ–Њ–Љ, –∞—Ж–µ—В–Є–ї—Е–Њ–ї–Є–љ–Њ–Љ) [9, 18, 50]. –Т–∞–ґ–љ—Л–Љ —Г—Б–ї–Њ–≤–Є–µ–Љ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П –Я–Э–£–Я –≤ –Ї—А–Њ–≤—М —П–≤–ї—П–µ—В—Б—П —А–∞—Б—В—П–ґ–µ–љ–Є–µ —Б—В–µ–љ–Ї–Є –њ—А–µ–і—Б–µ—А–і–Є–є [37,49,52].
–Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Њ—А–≥–∞–љ–∞–Љ–Є––Љ–Є—И–µ–љ—П–Љ–Є –і–ї—П –Я–Э–£–Я —П–≤–ї—П—О—В—Б—П –њ–Њ—З–Ї–Є, —Б–Њ—Б—Г–і—Л, –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Є –Є –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Б—В—А—Г–Ї—В—Г—А—Л —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –Є —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –≤ –Ї–Њ—В–Њ—А—Л—Е –љ–∞—Е–Њ–і—П—В—Б—П —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ —А–µ—Ж–µ–њ—В–Њ—А—Л [3]. –§–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л —Н—В–Њ–≥–Њ –њ–µ–њ—В–Є–і–∞ –Ј–∞–Ї–ї—О—З–∞—О—В—Б—П –≤ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є —А–µ–ї–∞–Ї—Б–∞—Ж–Є–Є –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б–Њ—Б—Г–і–Њ–≤, —Б–љ–Є–ґ–µ–љ–Є–Є —Г—А–Њ–≤–љ—П –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, –њ–Њ–і–∞–≤–ї–µ–љ–Є–Є —Б–µ–Ї—А–µ—Ж–Є–Є —А–µ–љ–Є–љ–∞ –Є –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞, –∞ —В–∞–Ї–ґ–µ –≤ —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –Ї–ї—Г–±–Њ—З–Ї–Њ–≤–Њ–є —Д–Є–ї—М—В—А–∞—Ж–Є–Є –Є –њ–Њ–≤—Л—И–µ–љ–Є–Є —Н–Ї—Б–Ї—А–µ—Ж–Є–Є –љ–∞—В—А–Є—П —Б –Љ–Њ—З–Њ–є [54].
–Т —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Я–Э–£–Я –≤ –њ–ї–∞–Ј–Љ–µ —З–µ–ї–Њ–≤–µ–Ї–∞, –њ–Њ –і–∞–љ–љ—Л–Љ —А–∞–Ј–ї–Є—З–љ—Л—Е –∞–≤—В–Њ—А–Њ–≤, —Б–Њ—Б—В–∞–≤–ї—П—О—В 25–100 –њ–≥/–Љ–ї [22,54] –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Љ–µ—В–Њ–і–Є–Ї–Є –Є–Ј–Љ–µ—А–µ–љ–Є—П. –Т—Л—П–≤–ї–µ–љ—Л —Ж–Є—А–Ї–∞–і–Є–∞–љ–љ—Л–µ –Ї–Њ–ї–µ–±–∞–љ–Є—П —Г—А–Њ–≤–љ—П –Я–Э–£–Я —Б –Љ–∞–Ї—Б–Є–Љ—Г–Љ–Њ–Љ –≤ –љ–Њ—З–љ—Л–µ —З–∞—Б—Л [6].
–Т –≤–Њ–њ—А–Њ—Б–µ –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–є —Б–≤—П–Ј–Є —Г—А–Њ–≤–љ—П –Я–Э–£–Я —Б –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ–Љ –Р–У, –љ–µ—В –µ–і–Є–љ–Њ–≥–Њ –Љ–љ–µ–љ–Є—П. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є [37,51,55] –Њ—В–Љ–µ—З–∞—О—В, —З—В–Њ —Г –±–Њ–ї—М–љ—Л—Е –У–С –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Я–Э–£–Я –≤ –Ї—А–Њ–≤–Є –њ–Њ–≤—Л—И–∞–µ—В—Б—П, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ [53] –Є –і–Є–ї–∞—В–∞—Ж–Є–Є –Ї–∞–Љ–µ—А —Б–µ—А–і—Ж–∞. –Ф—А—Г–≥–Є–µ –∞–≤—В–Њ—А—Л –њ–Њ–ї–∞–≥–∞—О—В, —З—В–Њ —Н—Б—Б–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –љ–Є–Ј–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –Я–Э–£–Я –Є–ї–Є —Г—Е—Г–і—И–µ–љ–Є–µ–Љ –Њ—В–≤–µ—В–∞ –љ–∞ –µ–≥–Њ –і–µ–є—Б—В–≤–Є–µ [21], —Б—З–Є—В–∞—П —Н—В–Њ—В —Д–∞–Ї—В–Њ—А –Њ–і–љ–Є–Љ –Є–Ј –≤–µ–і—Г—Й–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –Ј–∞–Ї—А–µ–њ–ї–µ–љ–Є—П –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є.
–†—П–і —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤ –≤–Њ–Њ–±—Й–µ –љ–µ –Њ–±–љ–∞—А—Г–ґ–Є–ї –љ–Є–Ї–∞–Ї–Њ–є —А–∞–Ј–љ–Є—Ж—Л –≤ –Є—Б—Е–Њ–і–љ–Њ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–Є –Я–Э–£–Я —Г –≥–Є–њ–µ—А—В–Њ–љ–Є–Ї–Њ–≤ –Є –љ–Њ—А–Љ–Њ—В–Њ–љ–Є–Ї–Њ–≤ [18], –Њ–±—К—П—Б–љ—П—П –≤—Л—И–µ–Њ–њ–Є—Б–∞–љ–љ—Л–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л–Љ –њ–Њ–і—Е–Њ–і–Њ–Љ –Ї –Њ—Ж–µ–љ–Ї–µ –Р–У [56] –Ю—Б—В–∞–µ—В—Б—П –Њ—В–Ї—А—Л—В—Л–Љ –≤–Њ–њ—А–Њ—Б –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –≤–ї–Є—П–љ–Є—П —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –Р–Ф –љ–∞ –≤—Л–±—А–Њ—Б –Я–Э–£–Я [5,9].
–У–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –Я–Э–£–Я –њ—А–Њ—П–≤–ї—П—О—В—Б—П, –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤ –≤–Є–і–µ —Б–љ–Є–ґ–µ–љ–Є—П –Р–Ф –Ї–∞–Ї —Г –љ–Њ—А–Љ–Њ—В–Њ–љ–Є–Ї–Њ–≤, —В–∞–Ї –Є —Г –±–Њ–ї—М–љ—Л—Е –У–С [2,8,11,39]. –Ю–±–љ–∞—А—Г–ґ–µ–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П —Б–µ—А–і—Ж–∞ –≤ —Б–≤—П–Ј–Є —Б —А–∞—Б—И–Є—А–µ–љ–Є–µ–Љ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є, –∞ —В–∞–Ї–ґ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –∞—А—В–µ—А–Є—П—Е –њ–µ—З–µ–љ–Є –Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П –Ї–Њ–ґ–Є, —Б–Ї–µ–ї–µ—В–љ—Л—Е –Љ—Л—И—Ж –Є –ґ–µ–ї—Г–і–Ї–∞.
–Ь–µ—Е–∞–љ–Є–Ј–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –Я–Э–£–Я –љ–∞ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б–Є—Б—В–µ–Љ—Г —Б–ї–Њ–ґ–µ–љ –Є –і–Њ –Ї–Њ–љ—Ж–∞ –µ—Й–µ –љ–µ –Є–Ј—Г—З–µ–љ. –Т –ї–Є—В–µ—А–∞—В—Г—А–µ –≤—Б—В—А–µ—З–∞—О—В—Б—П —А–∞–Ј–љ–Њ—А–µ—З–Є–≤—Л–µ –і–∞–љ–љ—Л–µ –Њ –≤–ї–Є—П–љ–Є–Є –Я–Э–£–Я –љ–∞ —Б–µ—А–і–µ—З–љ—Л–є –≤—Л–±—А–Њ—Б –Є —З–∞—Б—В–Њ—В—Г —Б–µ—А–і–µ—З–љ—Л—Е —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є (–І–°–°) [5,24,29,39]. –Ь–Њ–ґ–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –Я–Э–£–Я –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ —А–µ–ї–∞–Ї—Б–Є—А—Г—О—Й–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –Ї–∞–Ї –љ–∞ –∞—А—В–µ—А–Є–Њ–ї—Л, —В–∞–Ї –Є –љ–∞ –≤–µ–љ—Г–ї—Л.
–°—З–Є—В–∞—О—В, —З—В–Њ –Я–Э–£–Я —П–≤–ї—П–µ—В—Б—П –Ї–Њ–љ—В—А—А–µ–≥—Г–ї–Є—А—Г—О—Й–Є–Љ –≥–Њ—А–Љ–Њ–љ–Њ–Љ, –Ї–Њ—В–Њ—А—Л–є –≤–Њ–Ј–і–µ–є—Б—В–≤—Г–µ—В –љ–∞ —А–µ–≥–Є–Њ–љ–∞—А–љ—Л–є –Ї—А–Њ–≤–Њ—В–Њ–Ї –њ—Г—В–µ–Љ –њ—А—П–Љ–Њ–є –≤–∞–Ј–Њ—А–µ–ї–∞–Ї—Б–∞—Ж–Є–Є, –ї–Є–±–Њ –њ–Њ–і–∞–≤–ї—П—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –і—А—Г–≥–Є—Е –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ (–Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–Њ–≤, –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II –Є –≤–∞–Ј–Њ–њ—А–µ—Б—Б–Є–љ–∞) [7,39], a —В–∞–Ї–ґ–µ –њ—Г—В–µ–Љ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П —Б–µ–Ї—А–µ—Ж–Є–Є —А–µ–љ–Є–љ–∞ –Є –∞–і—А–µ–љ–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤ [35]. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Я–Э–£–Я –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Є—З–µ—Б–Ї–Є—Е –≤–Ј–∞–Є–Љ–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П—Е —Б —А–µ–љ–Є–љ––∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ–Њ–є (–†–Р–°), –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–є –Њ–±—А–∞—В–љ–Њ–є —Б–≤—П–Ј–Є [28], –њ–Њ–і–∞–≤–ї—П–µ—В —Б–Є–љ—В–µ–Ј —А–µ–љ–Є–љ–∞ [19] –Є –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ [5,10] , –±–ї–Њ–Ї–Є—А—Г–µ—В –і–µ–є—Б—В–≤–Є–µ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II –љ–∞ –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Г—О —В–Ї–∞–љ—М [37,45]. –Ю–і–љ–∞–Ї–Њ –љ–∞—А—П–і—Г —Б –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ–Љ —Б–Є–љ—В–µ–Ј–∞ —А–µ–љ–Є–љ–∞ –Я–Э–£–Я —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –њ—А–Є –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є –љ–∞ –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Є [1,2]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б–ї–µ–і—Г–µ—В —Г—З–Є—В—Л–≤–∞—В—М —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –°––Ї–Њ–љ—Ж–µ–≤–∞—П –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В—М –Я–Э–£–Я, —Б –Ї–Њ—В–Њ—А–Њ–є —Б–≤—П–Ј–∞–љ—Л –≤—Б–µ –µ–≥–Њ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ [35], —А–∞—Б—Й–µ–њ–ї—П–µ—В—Б—П –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–њ—А–µ–≤—А–∞—Й–∞—О—Й–µ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ —З–µ–ї–Њ–≤–µ–Ї–∞ [40].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Є–Ј—Г—З–µ–љ–Є–µ –љ–µ–є—А–Њ–≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Р–У, –Њ—Б–Њ–±–µ–љ–љ–Њ —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б —Н–љ–і–Њ—В–µ–ї–Є–µ–Љ, —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ–Њ–є –Є –∞–Ї—В—Г–∞–ї—М–љ–Њ–є –Ј–∞–і–∞—З–µ–є —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є–Є [24, 56]. –Ю—Б–Њ–±—Л–є –Є–љ—В–µ—А–µ—Б –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –Є–Ј—Г—З–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б —Н–љ–і–Њ—В–µ–ї–Є–µ–Љ –љ–µ–є—А–Њ–≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е —Б–Є—Б—В–µ–Љ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Р–У, –µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є, —Б—В–∞–і–Є–Є –Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Њ—А–≥–∞–љ–Њ–≤––Љ–Є—И–µ–љ–µ–є, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –±—Л —А–∞–Ј—А–∞–±–Њ—В–∞—В—М –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–µ –Љ–µ—В–Њ–і—Л –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –Р–У. –Э–µ–Ї–Њ—В–Њ—А—Л–Љ –∞—Б–њ–µ–Ї—В–∞–Љ —А–µ—И–µ–љ–Є—П —Н—В–Њ–є –Ј–∞–і–∞—З–Є –њ–Њ—Б–≤—П—Й–µ–љ–∞ –љ–∞—И–∞ —А–∞–±–Њ—В–∞.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Є—Б—М –±–Њ–ї—М–љ—Л–µ –Њ–±–Њ–µ–≥–Њ –њ–Њ–ї–∞ —Б –Љ—П–≥–Ї–Њ–є –Є —Г–Љ–µ—А–µ–љ–љ–Њ–є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–µ–є, –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 18 –і–Њ 60 –ї–µ—В (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 46,7±5,1 –ї–µ—В), —Б–Њ —Б—В–∞–±–Є–ї—М–љ–Њ –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ–Є —Ж–Є—Д—А–∞–Љ–Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П (–Ф–Р–Ф) –≤ –њ—А–µ–і–µ–ї–∞—Е –Њ—В 90 –і–Њ114 –Љ–Љ.—А—В.—Б—В. –°—А–µ–і–љ–Є–є —Г—А–Њ–≤–µ–љ—М —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П (–°–Р–Ф) —Б–Њ—Б—В–∞–≤–Є–ї 158,5±2,1 –Љ–Љ —А—В.—Б—В.; —Б—А–µ–і–љ–Є–є —Г—А–Њ–≤–µ–љ—М –Ф–Р–Ф – 102,3±0,7 –Љ–Љ —А—В.—Б—В. –Ф–Њ–ї—П –±–Њ–ї—М–љ—Л—Е —Б –Љ—П–≥–Ї–Њ–є –Р–У (—Г—А–Њ–≤–µ–љ—М –Ф–Р–Ф 90–105 –Љ–Љ —А—В.—Б—В.) – 65,7%; —Б —Г–Љ–µ—А–µ–љ–љ–Њ–є –Р–У (—Г—А–Њ–≤–µ–љ—М –Ф–Р–Ф – 105–114 –Љ–Љ —А—В.—Б—В.) – 34,3%. –°—А–µ–і–љ—П—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–∞ – 7,7±0,4 –ї–µ—В.
–Ъ—А–Є—В–µ—А–Є–µ–Љ –≤–Ї–ї—О—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —П–≤–ї—П–ї–Њ—Б—М –љ–∞–ї–Є—З–Є–µ –Љ—П–≥–Ї–Њ–є –Є–ї–Є —Г–Љ–µ—А–µ–љ–љ–Њ–є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є –њ–Њ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є JNC–V, 1993 –≥.
–Ф–Є–∞–≥–љ–Њ–Ј –У–С –њ–Њ–і—В–≤–µ—А–ґ–і–∞–ї—Б—П –љ–∞–ї–Є—З–Є–µ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–є –Њ—А–≥–∞–љ–Њ–≤––Љ–Є—И–µ–љ–µ–є:
• –≥–Є–њ–µ—А—В—А–Њ—Д–Є–µ–є –Љ–Є–Њ–Ї–∞—А–і–∞ –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞, –≤—Л—П–≤–ї–µ–љ–љ–Њ–є –њ—А–Є —Д–Є–Ј–Є–Ї–∞–ї—М–љ–Њ–Љ –Є–ї–Є —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ—Л–µ —Н–ї–µ–Ї—В—А–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є –Є/–Є–ї–Є —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є;
• –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–є –∞–љ–≥–Є–Њ–њ–∞—В–Є–Є —Б–µ—В—З–∞—В–Ї–Є.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–µ –≤–Ї–ї—О—З–∞–ї–Є—Б—М –±–Њ–ї—М–љ—Л–µ —Б —В—П–ґ–µ–ї–Њ–є –Є–ї–Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Р–У, –µ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–Љ —В–µ—З–µ–љ–Є–µ–Љ, –≤—В–Њ—А–Є—З–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є –Р–У, –љ–∞–ї–Є—З–Є–µ–Љ –Є–љ—Б—Г–ї—М—В–∞ –Є–ї–Є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–Є –ї–µ–≥–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є –≤ —В–µ—З–µ–љ–Є–µ 3–—Е –Љ–µ—Б—П—Ж–µ–≤ –і–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞ –Є –њ—А–Њ–≤–Њ–і–Є–Љ–Њ—Б—В–Є, –њ—А–Є—Б—В—Г–њ–Њ–≤ —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–Є –љ–∞–њ—А—П–ґ–µ–љ–Є—П II–IV –§–Ъ, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П, —В—П–ґ–µ–ї—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –њ–µ—З–µ–љ–Є, –њ–Њ—З–µ–Ї –Є —Б–Є—Б—В–µ–Љ—Л –Ї—А–Њ–≤–Є, –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –Њ–ґ–Є—А–µ–љ–Є–µ–Љ (–Є–љ–і–µ–Ї—Б –Љ–∞—Б—Б—Л —В–µ–ї–∞ –≤—Л—И–µ 40 –Ї–≥/–Љ2), –∞ —В–∞–Ї–ґ–µ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –Є–Р–Я–§.
–Ю—Б–љ–Њ–≤–љ—Г—О –≥—А—Г–њ–њ—Г —Б–Њ—Б—В–∞–≤–Є–ї–Є 10 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (5 –Љ—Г–ґ—З–Є–љ –Є 5 –ґ–µ–љ—Й–Є–љ, —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 51,3±5,52 –ї–µ—В), —Б–Њ —Б—А–µ–і–љ–µ—Б—Г—В–Њ—З–љ—Л–Љ –°–Р–Ф 151,96+3,14 –Љ–Љ —А—В. —Б—В., –Є –Ф–Р–Ф 92,74±2,18 –Љ–Љ —А—В. —Б—В. –С–Њ–ї—М–љ—Л–µ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –њ–Њ–ї—Г—З–∞–ї–Є –≠–і–љ–Є—В –і–≤–∞ —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є – –≤ 8 –Є 20 —З–∞—Б–Њ–≤ – —А–∞–≤–љ—Л–Љ–Є –і–Њ–Ј–∞–Љ–Є) –≤ —Б—А–µ–і–љ–µ–є –і–Њ–Ј–µ 16,75±2,16 –Љ–≥/—Б—Г—В–Ї–Є, –≤ —В–µ—З–µ–љ–Є–µ 50,09±1,08 –і–љ–µ–є.
–Т –њ–µ—А–≤–Њ–є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –±—Л–ї–Њ 10 –Ј–і–Њ—А–Њ–≤—Л—Е –і–Њ–±—А–Њ–≤–Њ–ї—М—Ж–µ–≤ (5 –Љ—Г–ґ—З–Є–љ –Є 5 –ґ–µ–љ—Й–Є–љ, —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 50,1 + 4,39 –ї–µ—В), —Б–Њ —Б—А–µ–і–љ–µ—Б—Г—В–Њ—З–љ—Л–Љ–Є –°–Р–Ф 125,96±3,14 –Љ–Љ —А—В.—Б—В. –Є –Ф–Р–Ф 78,74±2,18 –Љ–Љ —А—В.—Б—В. –Т—В–Њ—А—Г—О –Ї–Њ–љ—В—А–Њ–ї—М–љ—Г—О –≥—А—Г–њ–њ—Г —Б–Њ—Б—В–∞–≤–Є–ї–Є 10 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –У–С, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є–µ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –Љ–µ—Б—П—Ж–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є (5 –Љ—Г–ґ—З–Є–љ –Є 5 –ґ–µ–љ—Й–Є–љ, —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 51,3±5,52 –ї–µ—В), —Б–Њ —Б—А–µ–і–љ–µ—Б—Г—В–Њ—З–љ—Л–Љ–Є –°–Р–Ф 148,85±2,73 –Љ–Љ —А—В.—Б—В. –Є –Ф–Р–Ф 90,38±1,51 –Љ–Љ —А—В.—Б—В.
–Я–Њ–Љ–Є–Љ–Њ –Њ–±—Й–µ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ –≤ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б—Г—В–Њ—З–љ–Њ–µ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–Њ–љ–Є—В–Њ—А–Њ–≤ –Р–Т–†–Ь–02 –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–∞ —Д–Є—А–Љ—Л MEDITECH (–Т–µ–љ–≥—А–Є—П) –Є “OMRON” (–У–µ—А–Љ–∞–љ–Є—П). –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М —Б—Г—В–Њ—З–љ–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞ –Р–Ф –±—Л–ї–∞ –љ–µ –Љ–µ–љ–µ–µ 22,5–24 —З–∞—Б–Њ–≤. –Т –Ї–∞—З–µ—Б—В–≤–µ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ —Б—В–∞–љ–і–∞—А—В–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–∞—Б—М —Б–ї–µ–і—Г—О—Й–∞—П —З–∞—Б—В–Њ—В–∞ –Є–Ј–Љ–µ—А–µ–љ–Є–є: –Њ–і–Є–љ —А–∞–Ј –≤ 15 –Љ–Є–љ—Г—В —Б 8 –і–Њ 23 —З–∞—Б–Њ–≤, –Њ–і–Є–љ —А–∞–Ј –≤ 30 –Љ–Є–љ—Г—В —Б 23 –і–Њ 6 —З–∞—Б–Њ–≤, –Њ–і–Є–љ —А–∞–Ј –≤ 10 –Љ–Є–љ—Г—В —Б 6 –і–Њ 8 —З–∞—Б–Њ–≤. –Т –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ—Л—Е —Б–ї—Г—З–∞—П—Е –і–Њ–њ—Г—Б–Ї–∞–ї–Њ—Б—М —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –Є–Ј–Љ–µ—А–µ–љ–Є–є –≤ –і–љ–µ–≤–љ–Њ–µ –≤—А–µ–Љ—П –і–Њ –Њ–і–љ–Њ–≥–Њ —А–∞–Ј–∞ –≤ 20–30 –Љ–Є–љ—Г—В, –∞ –≤ –љ–Њ—З–љ–Њ–µ – –і–Њ –Њ–і–љ–Њ–≥–Њ —А–∞–Ј–∞ –≤ 40–60 –Љ–Є–љ. –°—В–∞–љ–і–∞—А—В–љ—Л–є —Б—А–Њ–Ї –љ–∞—З–∞–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є – 9.00 –10.00 —З, –Њ–Ї–Њ–љ—З–∞–љ–Є–µ – –≤ —В–∞–Ї–Њ–µ –ґ–µ –≤—А–µ–Љ—П –љ–∞ —Б–ї–µ–і—Г—О—Й–Є–є –і–µ–љ—М.
–Э–Њ—А–Љ–Њ—В–µ–љ–Ј–Є–µ–є —Б—З–Є—В–∞–ї–Њ—Б—М: –і–ї—П –Ј–љ–∞—З–µ–љ–Є—П –≤ —В–µ—З–µ–љ–Є–µ —Б—Г—В–Њ–Ї –љ–µ –±–Њ–ї–µ–µ 135/85 –Љ–Љ —А—В.—Б—В., –і–љ–µ–Љ – –љ–µ –±–Њ–ї–µ–µ 140/90 –Љ–Љ.—А—В.—Б—В., –љ–Њ—З—М—О –љ–µ –±–Њ–ї–µ–µ 120/80 –Љ–Љ —А—В.—Б—В.
–†–µ–Ј—Г–ї—М—В–∞—В—Л —Б—Г—В–Њ—З–љ–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Њ–±—Б—З–Є—В—Л–≤–∞–ї–Є—Б—М –љ–∞ –≠–Т–Ь —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л—Е –Ї–Њ–Љ–њ—М—О—В–µ—А–љ—Л—Е –њ—А–Њ–≥—А–∞–Љ–Љ –њ–Њ—Б—В–∞–≤–ї—П–µ–Љ—Л—Е –≤–Љ–µ—Б—В–µ —Б –Љ–Њ–љ–Є—В–Њ—А–Њ–Љ.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ–Њ—А—Д–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –Є —Г–і–∞—А–љ–Њ–є —А–∞–±–Њ—В—Л —Б–µ—А–і—Ж–∞ –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–Њ—Б—М –љ–∞ –∞–њ–њ–∞—А–∞—В–µ OCUSON (–ѓ–њ–Њ–љ–Є—П) –≤ –Ь– –Є –Т–—А–µ–ґ–Є–Љ–∞—Е —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –і–Њ–њ–њ–ї–µ—А–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є —В–µ—Е–љ–Є–Ї–Є. –Я—А–Њ–Є–Ј–≤–Њ–і–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є (—Б–µ—А–і–µ—З–љ—Л–є –Є–љ–і–µ–Ї—Б, –Њ–±—Й–µ–µ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–µ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ —Б–Њ—Б—Г–і–Њ–≤ —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Є—Б—М –њ–Њ –Њ–±—Й–µ–њ—А–Є–љ—П—В—Л–Љ —Д–Њ—А–Љ—Г–ї–∞–Љ.
–Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ –Є –Я–Э–£–Я –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є —А–∞–і–Є–Њ–Є–Љ–Љ—Г–љ–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–Њ—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О —Б—В–∞–љ–і–∞—А—В–љ—Л—Е –љ–∞–±–Њ—А–Њ–≤ –Ї–Њ–Љ–њ–∞–љ–Є–Є “Phoenix Pharmaceuticals Inc.”. –Т–Ј—П—В–Є–µ –Ї—А–Њ–≤–Є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Њ—Б—М —Г –±–Њ–ї—М–љ–Њ–≥–Њ —Г—В—А–Њ–Љ –љ–∞—В–Њ—Й–∞–Ї, –≤ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є –ї–µ–ґ–∞ –љ–∞ —Б–њ–Є–љ–µ, –њ—А–Є—З–µ–Љ –≤ —Н—В–Њ–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є –±–Њ–ї—М–љ–Њ–є –і–Њ–ї–ґ–µ–љ –±—Л–ї –њ—А–µ–±—Л–≤–∞—В—М –љ–µ –Љ–µ–љ–µ–µ 15 –Љ–Є–љ—Г—В –і–Њ –Љ–Њ–Љ–µ–љ—В–∞ –≤–Ј—П—В–Є—П –Ї—А–Њ–≤–Є.
–Ъ–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ –Є –Я–Э–£–Я –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–Њ—Б—М –љ–∞ –≥–∞–Љ–Љ–∞–—Б—З–µ—В—З–Є–Ї–µ RIA 1217 (–Ы–Ъ–С, –®–≤–µ—Ж–Є—П).
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–∞—Б—М –љ–∞ –≠–Т–Ь —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ–≥—А–∞–Љ–Љ–љ–Њ–≥–Њ –њ–∞–Ї–µ—В–∞ STATISTICA –і–ї—П Windows 5.0 (StatSoft®). –Ф–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П —А–∞–Ј–љ—Л—Е –≥—А—Г–њ–њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –Ї—А–Є—В–µ—А–Є–є Mann–Whitney; –і–ї—П –Њ—Ж–µ–љ–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є –і–Є–љ–∞–Љ–Є–Ї–Є –≤–љ—Г—В—А–Є –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (–і–Њ –Є –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –≠–і–љ–Є—В–Њ–Љ) – –Ї—А–Є—В–µ—А–Є–є Wilcoxon. –†–∞–Ј–ї–Є—З–Є—П —Б—З–Є—В–∞–ї–Є—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ–Є –њ—А–Є p<0,05.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Я–Њ –і–∞–љ–љ—Л–Љ 24–—З–∞—Б–Њ–≤–Њ–≥–Њ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є—П –і–Є–љ–∞–Љ–Є–Ї–∞ —Б—А–µ–і–љ–Є—Е —Б—Г—В–Њ—З–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ—Л –њ–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є–Є –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є –≠–љ–∞–ї–∞–њ—А–Є–ї–Њ–Љ –≤—Л–≥–ї—П–і–µ–ї–∞ —Б–ї–µ–і—Г—О—Й–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ: –°–Р–Ф –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є —Б–љ–Є–Ј–Є–ї–Њ—Б—М –љ–∞ 9,67% (p<0,01), –Ф–Р–Ф – –љ–∞ 10,14% (p<0,01), —Б—А–µ–і–љ–µ–µ –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–µ –Р–Ф (–°–Ф–Ф) – –љ–∞ 9,92% (p<0,001), –њ—Г–ї—М—Б–Њ–≤–Њ–µ –Р–Ф (–Я–Ф), —З–∞—Б—В–Њ—В–∞ —Б–µ—А–і–µ—З–љ—Л—Е —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є (–І–°–°) –Є –≤–∞—А–Є–∞–±–µ–ї—М–љ–Њ—Б—В—М —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф (–Т–°–Р–Ф) –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф (–Т–Ф–Р–Ф) –Є–Ј–Љ–µ–љ–Є–ї–Є—Б—М –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ. –Ш–љ–і–µ–Ї—Б –≤—А–µ–Љ–µ–љ–Є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф (–Ш–Т –°–Р–Ф) —Г–Љ–µ–љ—М—И–Є–ї—Б—П –љ–∞ 39,84%, p<0,01 (–і–Њ –ї–µ—З–µ–љ–Є—П —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Б–Њ—Б—В–∞–≤–ї—П–ї 79,88%, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П – 48,06%), –Є–љ–і–µ–Ї—Б –≤—А–µ–Љ–µ–љ–Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф (–Ш–Т –Ф–Р–Ф) —Б–љ–Є–Ј–Є–ї—Б—П –љ–∞ 57,25% (—Б 58,2% –і–Њ 24,88%, p<0,01). –°—Г—В–Њ—З–љ—Л–µ –Є–љ–і–µ–Ї—Б—Л –°–Р–Ф –Є –Ф–Р–Ф —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Є–Ј–Љ–µ–љ–Є–ї–Є—Б—М. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Б—А–µ–і–љ–µ—Б—Г—В–Њ—З–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –°–Р–Ф –њ—А–Є –Ї—Г—А—Б–Њ–≤–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –≠–і–љ–Є—В–∞ –≤—Б–µ–≥–Њ –љ–∞ 8,99% –њ—А–µ–≤—Л—И–∞–ї —В–∞–Ї–Њ–≤–Њ–є —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж (p<0,05), –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Б—А–µ–і–љ–µ—Б—Г—В–Њ—З–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ф–Р–Ф —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ —Д–Њ–љ–µ –њ–Њ—Б–ї–µ —В–µ—А–∞–њ–Є–Є –≠–і–љ–Є—В–Њ–Љ –Є —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–Є—Б—М.
–°—А–µ–і–љ–Є–µ –і–љ–µ–≤–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –њ–Њ—Б–ї–µ –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є –≠–і–љ–Є—В–Њ–Љ —В–∞–Ї–ґ–µ —Г–ї—Г—З—И–Є–ї–Є—Б—М –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ–Є –і–∞–љ–љ—Л–Љ–Є: –°–Р–Ф –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–Љ–µ–љ—М—И–Є–ї–Њ—Б—М –љ–∞ 9,78% (p<0,01), –Ф–Р–Ф – –љ–∞ 10,39% (p<0,01), –°–Ф–Ф – –љ–∞ 10,12% (p<0,01). –≠—В–∞ –і–Є–љ–∞–Љ–Є–Ї–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–∞—Б—М —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –љ–∞–≥—А—Г–Ј–Ї–Є –і–∞–≤–ї–µ–љ–Є–µ–Љ: –Ш–Т –°–Р–Ф —Б–љ–Є–Ј–Є–ї—Б—П –љ–∞ 48,05% (p<0,01), –∞ –Ш–Т –Ф–Р–Ф – –љ–∞ 64,34% (p<0,01). –І–°–°, –Т–°–Р–Ф –Є –Т–Ф–Р–Ф, –Ї–∞–Ї –Є —Б—А–µ–і–љ–µ—Б—Г—В–Њ—З–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, –Є–Ј–Љ–µ–љ–Є–ї–Є—Б—М –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ.
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –і–Є–љ–∞–Љ–Є–Ї–Є —Б—А–µ–і–љ–Є—Е –љ–Њ—З–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Њ—В–Љ–µ—З–µ–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –°–Р–Ф –љ–∞ 10,76%, –Ф–Р–Ф – –љ–∞ 10,63%, –°–Ф–Ф –љ–∞ 10,7%. –Ш–Т–Ф–Р–Ф —Г–Љ–µ–љ—М—И–Є–ї—Б—П –љ–∞ 26,54% (p<0,05). –Я–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Г—В—А–µ–љ–љ–µ–≥–Њ –њ–Њ–і—К–µ–Љ–∞ –Р–Ф –Є–Љ–µ–ї–Є –≤—Л—А–∞–ґ–µ–љ–љ—Г—О —В–µ–љ–і–µ–љ—Ж–Є—О –Ї —Б–љ–Є–ґ–µ–љ–Є—О –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П.
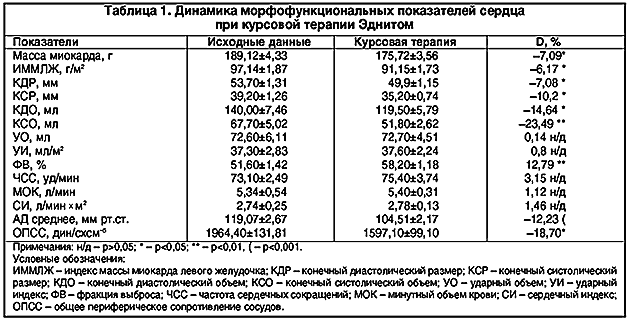
–Я–Њ—Б–ї–µ –Ї—Г—А—Б–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –≠–і–љ–Є—В–Њ–Љ –Њ—В–Љ–µ—З–∞–ї–∞—Б—М —Б–ї–µ–і—Г—О—Й–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є (—В–∞–±–ї. 1): —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ї–Њ–љ–µ—З–љ—Л—Е –Њ–±—К–µ–Љ–Њ–≤ –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ – –Ї–Њ–љ–µ—З–љ–Њ–≥–Њ –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ (–Ъ–Ф–Ю) –љ–∞ 14,64% (p<0,05) –Є –Ї–Њ–љ–µ—З–љ–Њ–≥–Њ —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ (–Ъ–°–Ю) –љ–∞ 23,49% (p<0,01). –§—А–∞–Ї—Ж–Є—П –≤—Л–±—А–Њ—Б–∞ —Г–≤–µ–ї–Є—З–Є–ї–∞—Б—М –љ–∞ 12,79% (p<0,05). –£–і–∞—А–љ—Л–є –Њ–±—К–µ–Љ (–£–Ю), –Љ–Є–љ—Г—В–љ—Л–є –Њ–±—К–µ–Љ –Ї—А–Њ–≤–Є (–Ь–Ю–Ъ) –Є –І–°–° –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Є–Ј–Љ–µ–љ—П–ї–Є—Б—М. –Э–∞–±–ї—О–і–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ –Ю–Я–°–° –љ–∞ 18,70% (p<0,05). –Ь–∞—Б—Б–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М –љ–∞ 7,09% (p<0,05), –∞ –Є–љ–і–µ–Ї—Б –Љ–∞—Б—Б—Л –Љ–Є–Њ–Ї–∞—А–і–∞ –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ – –љ–∞ 6,74% (p<0,05).

–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤
–Т –ї–Є—В–µ—А–∞—В—Г—А–µ –Є–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ –≤–ї–Є—П–љ–Є–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ –Ї–∞–ї—М—Ж–Є—П –Є –±–µ—В–∞––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –љ–∞ –њ–ї–∞–Ј–Љ–µ–љ–љ—Г—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –Я–Э–£–Я —Г –±–Њ–ї—М–љ—Л—Е –У–С –Є –•–Э–Ъ [54]. –Ґ–∞–Ї, –Ї—Г—А—Б–Њ–≤–∞—П —В–µ—А–∞–њ–Є—П –љ–Є—Д–µ–і–Є–њ–Є–љ–Њ–Љ –њ—А–Є–≤–Њ–і–Є–ї–∞ –Ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О —Г —Н—В–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –±–Њ–ї—М–љ—Л—Е —Г—А–Њ–≤–љ—П –Я–Э–£–Я –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –Є —А–∞–Ј–≤–Є—В–Є—О —В–∞—Е–Є–Ї–∞—А–і–Є–Є, —В–Њ–≥–і–∞ –Ї–∞–Ї b––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А –∞—В–µ–љ–Њ–ї–Њ–ї, –љ–∞ —Д–Њ–љ–µ –њ–Њ–љ–Є–ґ–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –°–Р–°, –Є –Њ—В—З–∞—Б—В–Є –†–Р–°, –≤—Л–Ј—Л–≤–∞–ї –∞–і–µ–Ї–≤–∞—В–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –њ–ї–∞–Ј–Љ–µ–љ–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Я–Э–£–Я [55].
–Ш–Ј—Г—З–∞–ї–Њ—Б—М —В–∞–Ї–ґ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –Я–Э–£–Я –Є —Г—А–Њ–≤–µ–љ—М —А–∞–Ј–ї–Є—З–љ—Л—Е —Н–љ–і–Њ—В–µ–ї–Є–є–Ј–∞–≤–Є—Б–Є–Љ—Л—Е —А–µ–≥—Г–ї—П—В–Њ—А–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є–Ј –≥—А—Г–њ–њ—Л –Є–Р–Я–§. –Ю–њ—А–µ–і–µ–ї–µ–љ–љ—Л–є –Є–љ—В–µ—А–µ—Б –≤—Л–Ј—Л–≤–∞–µ—В —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –Є–Р–Я–§ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Б–љ–Є–ґ–∞—О—В –Р–Ф —Г –±–Њ–ї—М–љ—Л—Е –У–С, —Г–ї—Г—З—И—О—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Є –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [9], –њ–Њ–і–∞–≤–ї—П—П –њ—А–Є —Н—В–Њ–Љ –ї–Є—И—М –Р–Я–§––Ј–∞–≤–Є—Б–Є–Љ–Њ–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II, –њ–Њ –Ї–Њ—В–Њ—А–Њ–Љ—Г –Њ–±—А–∞–Ј—Г–µ—В—Б—П –ї–Є—И—М –Њ–Ї–Њ–ї–Њ 20% –Њ–±—Й–µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ —Г–Љ–µ—Б—В–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М –љ–∞–ї–Є—З–Є–µ –Ї–∞–Ї–Є—Е––ї–Є–±–Њ –і—А—Г–≥–Є—Е –љ–µ–є—А–Њ–≥—Г–Љ–Њ—А–∞–ї—М–љ—Л—Е –њ—Г—В–µ–є —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є –Є—Е –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞. –Т –Ї–∞—З–µ—Б—В–≤–µ –Є–ї–ї—О—Б—В—А–∞—Ж–Є–Є —Н—В–Њ–≥–Њ –њ–Њ–ї–Њ–ґ–µ–љ–Є—П –њ—А–Є–≤–µ–і–µ–Љ —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–µ–Ї–Њ—В–Њ—А—Л—Е –љ–∞—Г—З–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –£ –±–Њ–ї—М–љ—Л—Е –У–С –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –≤–ї–Є—П–љ–Є–µ —Н–љ–∞–ї–∞–њ—А–Є–ї–∞ –љ–∞ —Г—А–Њ–≤–µ–љ—М –Я–Э–£–Я [53], –њ—А–Є—З–µ–Љ —Г—А–Њ–≤–µ–љ—М —Н—В–Њ–≥–Њ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ —Б–љ–Є–ґ–∞–ї—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≤–љ—Г—В—А–Є—Б–µ—А–і–µ—З–љ–Њ–є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є [55]. –Р–≤—В–Њ—А—Л –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є–ї–Є –љ–∞–ї–Є—З–Є–µ –њ—А—П–Љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П —Н–љ–∞–ї–∞–њ—А–Є–ї–∞ –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –Я–Э–£–Я. –Ю—В–ї–Є—З–љ–Њ–µ –Њ—В —Н—В–Њ–≥–Њ –Љ–љ–µ–љ–Є–µ –≤—Л—Б–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П —А–∞–±–Њ—В–∞—Е –Ѓ.–Ь. –Ы–Њ–њ–∞—В–Є–љ–∞, –Р.–Ш. –†–Њ–≥–Њ–Ј—Л, –Ю.–Ѓ. –Р—В—М–Ї–Њ–≤–∞, –Ѓ.–Э. –С–µ–ї–µ–љ–Ї–Њ–≤–∞, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –≤–Њ–њ—А–Њ—Б–∞–Љ –Є–Ј—Г—З–µ–љ–Є—П –±–∞—А–Њ—А–µ—Д–ї–µ–Ї—В–Њ—А–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П (1993). –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –±–∞—А–Њ—А–µ—Д–ї–µ–Ї—Б–∞ –љ–∞ —Д–Њ–љ–µ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ—Б–љ–Њ–≤–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, –≤–ї–Є—П—О—Й–Є–Љ –љ–∞ –љ–µ–є—А–Њ–≥—Г–Љ–Њ—А–∞–ї—М–љ—Г—О —Б–Є—Б—В–µ–Љ—Г.
–Ф–∞–љ–љ—Л–µ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ –љ–∞—И–µ–є —А–∞–±–Њ—В–µ, –і–∞—О—В –Њ—Б–љ–Њ–≤–∞–љ–Є–µ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М –љ–∞–ї–Є—З–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –≠–і–љ–Є—В–∞ –љ–∞ –њ–ї–∞–Ј–Љ–µ–љ–љ—Г—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е –У–С. –°–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≠–і–љ–Є—В–Њ–Љ –Љ–Њ–ґ–µ—В –њ—А–Њ–Є—Б—Е–Њ–і–Є—В—М –њ–Њ –і–≤—Г–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ. –Т–Њ––њ–µ—А–≤—Л—Е, –њ—А–Є —В–Њ—А–Љ–Њ–ґ–µ–љ–Є–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Р–Я–§ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М –њ—А—П–Љ—Л—Е —Б—В–Є–Љ—Г–ї—П—В–Њ—А–Њ–≤ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ – –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II –Є –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–Њ–≤ [15,16]. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –µ–≥–Њ —Б–Є–љ—В–µ–Ј –Љ–Њ–ґ–µ—В –њ–Њ–і–∞–≤–ї—П—В—М—Б—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ–Њ–≤—Л—И–µ–љ–Є—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ї–Є–љ–Є–љ–Њ–≤ –Є –њ—А–Њ—Б—В–∞—Ж–Є–Ї–ї–Є–љ–∞.
–Т—Л—П–≤–ї–µ–љ–љ–Њ–µ –≤ —Е–Њ–і–µ –љ–∞—И–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–љ–Є–ґ–µ–љ–Є–µ –њ–ї–∞–Ј–Љ–µ–љ–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Я–Э–£–Я –њ—А–Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –≠–і–љ–Є—В–Њ–Љ, –≤–µ—А–Њ—П—В–љ–Њ, —В–∞–Ї–ґ–µ —Б–≤—П–Ј–∞–љ–Њ —Б –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ —Н—В—Г –љ–µ–є—А–Њ–≥—Г–Љ–Њ—А–∞–ї—М–љ—Г—О —Б–Є—Б—В–µ–Љ—Г. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ –љ–∞–ї–Є—З–Є–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ–Њ–є —Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ –Р–Ф –Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є –Я–Э–£–Я –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є [53], —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М —Г–Љ–µ–љ—М—И–µ–љ–Є—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Я–Э–£–Я –Њ—В –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є. –Э–∞—А—П–і—Г —Б —Н—В–Є–Љ, —Б—Г—Й–µ—Б—В–≤—Г–µ—В —А—П–і —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–і–њ–Њ—Б—Л–ї–Њ–Ї —В–Њ–≥–Њ, —З—В–Њ –°––Ї–Њ–љ—Ж–µ–≤–∞—П –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В—М –Я–Э–£–Я, —Б –Ї–Њ—В–Њ—А–Њ–є —Б–≤—П–Ј–∞–љ—Л –≤—Б–µ –µ–≥–Њ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞, —А–∞—Б—Й–µ–њ–ї—П–µ—В—Б—П –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ –Р–Я–§ [2,35,40]. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —В–∞–Ї–ґ–µ –њ—А—П–Љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –≠–і–љ–Є—В–∞ –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –Я–Э–£–Я.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –љ–∞–Љ–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ј–≤–Њ–ї—П—О—В —Б–і–µ–ї–∞—В—М —Б–ї–µ–і—Г—О—Й–Є–µ –≤—Л–≤–Њ–і—Л:
1. –Ш–љ–≥–Є–±–Є—В–Њ—А –Р–Я–§ –≠–і–љ–Є—В –Љ–Њ–ґ–µ—В –±—Л—В—М —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ —Г –±–Њ–ї—М–љ—Л—Е –У–С –і–ї—П –Ї—Г—А—Б–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤—Л–±–Њ—А–∞. –≠–і–љ–Є—В –љ–µ —В–Њ–ї—М–Ї–Њ –љ–Њ—А–Љ–∞–ї–Є–Ј—Г–µ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Р–Ф –њ–Њ –і–∞–љ–љ—Л–Љ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Б—Г—В–Њ—З–љ–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є—П, –љ–Њ –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–ї—Г—З—И–∞–µ—В –Љ–Њ—А—Д–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–µ –њ–∞—А–∞–Љ–µ—В—А—Л —Б–µ—А–і—Ж–∞, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є–љ–і–µ–Ї—Б –Љ–∞—Б—Б—Л –Љ–Є–Њ–Ї–∞—А–і–∞ –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞, —Г–ґ–µ –њ–Њ—Б–ї–µ –њ–Њ–ї—Г—В–Њ—А–∞ –Љ–µ—Б—П—Ж–µ–≤ –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є.
2. –≠–і–љ–Є—В –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ —Д–∞–Ї—В–Њ—А—Л –љ–µ–є—А–Њ–≥—Г–Љ–Њ—А–∞–ї—М–љ–Њ–є —А–µ–≥—Г–ї—П—Ж–Є–Є –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П:
• —Б–љ–Є–ґ–∞–µ—В —Г—А–Њ–≤–µ–љ—М –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–∞ —Н–љ–і–Њ—В–µ–ї–Є–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –њ—А–Є –Ї—Г—А—Б–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є;
• “–Љ–Њ–і—Г–ї–Є—А—Г–µ—В” –њ–ї–∞–Ј–Љ–µ–љ–љ—Г—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –Я–Э–£–Я –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е –Љ—П–≥–Ї–Њ–є –Є —Г–Љ–µ—А–µ–љ–љ–Њ–є —Д–Њ—А–Љ–∞–Љ–Є –У–С.
–Я–Њ–ї–љ—Л–є —Б–њ–Є—Б–Њ–Ї –ї–Є—В–µ—А–∞—В—Г—А—Л –Т—Л –Љ–Њ–ґ–µ—В–µ –љ–∞–є—В–Є –љ–∞ —Б–∞–є—В–µ http://www.rmj.ru
–≠–љ–∞–ї–∞–њ—А–Є–ї -
–≠–і–љ–Є—В (—В–Њ—А–≥–Њ–≤–Њ–µ –љ–∞–Ј–≤–∞–љ–Є–µ)
(Gedeon Richter)
1. Aguilera G.; Wynn P.C., Mendelsohn F.A., Catt K.J., Millan–M. Alitoradiographic localization of brain receptors for peptide hormones: angiotensin II, corticotropin–releasing factor, and gonadotropin–releasing hormone // Methods. Enzymol.– 1986; V. 124. – P. 590–606.
2. Atlas S., Kleinert H., Camargo M., Voipe M. et al. Structure and biological action of the atrial natriuretic factor (auriculin) // Kardiologia. – 1986; V. 26 (1). – P. 20–7.
3. Ballermann BJ, Bloch KD, Seidrnan JG, Brenner BM. Atrial natriuretic peptide transcription, secretion, and glomerular receptor activity during mineralocorticoid escape in the rat // J. Clin. Invest. – 1986. – Vol.78. – N3. – P.840–843.
4. Cemacek P., Stewart D.J. Immunoreactive endothelin in human plasma: marked elevations in patients in cardiogenic shock // Biochem. Biophys. Res. Commun.. – 1989; V. 161 (2).–P. 562–567.
5. Christensen G. Cardiovascular and renal effects of atrial natriuretic factor //Scand. J. Clin. Lab. Invest. – 1993. –V. 53, N 3.–P. 203–209.
6. Colantonio D., Casale R., Desiati P., Di–Lauro G.; Pasqualetti P., Natali G. Circadian rhythm of atrial natriuretic peptide in healthy man // Cardiologia. –1988; V. 33 (5). –P. 511–513.
7. Creager M.A., Hirsch A.T., Nabel E.G., Cutler S.S., Colucci W.S., Dzau V.J. Responsiveness of atrial natriuretic factor to reduction in right atrial pressure in patients with el–ironic congestive heart failure // J. Am. Coil. Cardiol. – 1988; V. II (6).–P. 1191–1198.
8. Cuneo R.C., Espiner E.A., Nicholls M.G., Yandle T.G., Livesey J.H. Effect of physiological levels of atrial natriuretic peptide on hormone secretion: inhibition of angiotensin–induced aldosterone secretion and renin release in normal man // J. Clin.Endocrinol. Metab. – 1987; V. 65 (4). – P. 765–772.
9. Dzau V. Mechanisms of action of ACE inhibitors in hypertension and heart failure // Drugs. – 1990. –V. 39.–P. 16.
10. Edwards B.S., Zimmerman R.S., Schwab T.R., Heublein D.M., Bumett J.C. Jr. Atrial stretch, not pressure, is the principal determinant controlling the acute release of atrial natriuretic factor// Circ. Res. – 1988; V. 62 (2). –P. 191–195.
11. Faber J.E., Gettes D.R., Gianturco D.P. Microvascular effects of atrial natriuretic factor: interaction with alpha I– and alpha 2–adrenoceptors // Circ. Res. – 1988; V. 63 (2). – P. 415–428.
12. Gardiner S.M., Campton A.M., Bennet T. Regional hemodinamic effects of endotelin in conscious, unrestrained, Wistar rats // J.cardiovasc. Pharmacol. –1989–V. 13.–P. 202–204.
13. Gutkowska S., Horky K., Schiffrin E.L. et al. Atrial natriuretic factor: radioimmunoassay and effects on adrenal and pitytary glands // Fed. Prog. –1986.–Vol. 45.–P. 2101–2105.
14. Cusson J.R.; Thibault G.; Cantin M.; Larochelle P. Prolonged low dose infusion of atrial natriuretic factor in essential hypertension // Clin. Exp. Hypertens. A. –1990; V. 12 (1).–P. 111–135.
15. Halawa B. Level ofendothelin increases in chronic congestive heart failure // Kardiol. Pol.–1993.–V.38,N 3.–P. 169–172.
16. Hamilton–CA; Huang–YT; Reid–JL. Effects of endothelin upon blood pressure in normotensive rabbits and in perinephritis hypertension // J. Hypertens. – 1992; V. 10 (8). – P. 787–794.
17. Hayness W.G., Webb D.J. The endothelin family ofpeptides: local hormones with diverse roles in health and disease? // Clin. Sci. –1993.–V. 84.–P. 485–500.
18. Hedner J.; Hedner T.; Towie A.C.; Pettersson A.; Persson B.; Wysocki M.; Andersson O.K. Increase in plasma atrial natriuretic peptides during acute volume expansion in hypertensive man // Acta. Med. Scand. – 1986; V. 219 (5). –P. 469–472.
19. Hidaka T–Ф Risaka K., Inomata N. et al. Effect of carperitide (alpha–human atrial natriuretic polypeptide) on the cardiovascular system in experimental animals // Nippon. Yakurigaku. Zasshi. – 1993. –V. 101,N 5.–P. 309–325.
20. Highsmith R.F.; Pang D.C.; Rapoport R.M. Endothelial cell–derived vasoconstrictors: mechanisms of action in vascular smooth muscle // J. Cardiovasc. Pharmacol. – 1989; V. 13.–P. 36–44.
21. Hollister A.S.; Inagami T. Atrial natriuretic factor and hypertension. A review and metaanalysis // Am. J. Hypertens. –1991; V. 4.–P. 850–865.
22. Horky K. Humoral mechanisms in the pathogenesis of arterial hypertension with emphasis on the renin–angiotensin–aldosterone system and natriuretic substances // Vnitr. Lek. – 1989; V. 35 (3). – P. 219–225.
23. Igarashi Y.; Aizawa Y.; Tamura M.; Ebe K.; Yamaguchi T.; Shibata A. Vasoconstrictor effect of endothelin on the canine coronary artery: is a novel endogenous peptide involved in regulating myocardial blood flow and coronary spasm? // Am. Heart. J. – 1989; V. 118 (4). – P. 674–678.
24. Itoh H.; Nakao K.; Mukoyama M.; Hosada K.; Saito Y. et al. Peptides derived from atrial natriuretic polypeptide precursor in human and monkey brains // J. Hypertens. Suppi. – 1988; V. 6 (4). – P. 309–313.
25. Jolmston C.I.; Jackson B.; Cubela R.; Sivell D.; Kozhuki M. Phan–nacokinetics of angiotensin converting enzyme inhibitors in plasma and tissue using radioinhibitor binding and displacement assays // Adv. Exp. Med. Biol. – 1989; V. 247. – P. 29–34.
26. King A.J.; Brenner B.M.; Anderson S. Endothelin: a potent renal and systemic vasoconstrictorpeptide //Am. J. Physiol. – 1989; V. 256. – P. 1051–1058.
27. Koyama H.; Tabata T.; Nishzawa Y.; Inoue T.; Morii H.; Yamaji T. Plasma endothelin levels in patients with uraemia // Lancet. – 1989; V. I. – P. 991–992.
28. Kurtz A. Transmembrane signalling of atrial natriuretic peptide in rat renal juxtaglomenilar cells //Klin. Wochenschr. – 1986; V. 64. – P.37–41.
29. Leitman D., Murad F.; Waidman S.; Molina C.; Bemiett B. Regulation and role ofglianylate cyclase–cyclic GMP in vascular relaxation // Prog. Clin. Biol. Res. –1987: V. 249. – P. 65–76.
30. Luscher T.F., Boulanger C.M., Dohi Y., Yang Z. Endothelium–derived contracting factors // Hypertension. – 1992. –V.19. –P. 117–130.
31. Luscher T.F., Tanner F.C. Endothelial regulation of vascular tone and growth // Am. J. Hypertension. –1993.–V. 6.–P. 283–293.
32. Luscher Th.F., Yang Z., Diedrich D. Different effects ofendotelin on cAMP–and cGMP–mediated vascular relaxation in human arteries and veins: comparison with norepinephrine // J. cardiovasc. Pharmacol. – 1989. –V. 14, N 6. – P. 63–69.
33. Mene P.; Simonson M.S.; Wann S.; Dubyak G.R.; Kester M.; Dunn M.J. Endothelin–I activates the phosphoinositide cascade in cultured glomerular mesangial cells //J. Cardiovasc. Pharmacol. – 1989; V. 13. – P. 80–83.
34. Miller R.C–Ф Pelton Huggins J.P. Endothelins – from receptors to medicine // TIPS.–1993.–V. 14.–P. 54–60.
35. Molina C.R.; Fowler M.B.; McCrory S..; Peterson C.; Myers B.D.; Schroeder J.S.; Murad F. Hemodynamic, renal and endocrine effects of atrial natriuretic peptide infusion in severe heart failure // J. Am. Coil. Cardiol. – 1988; V. 12 (1). –P. 175–186.
36. Naruse M.; Kawana M.; Hifumi S.; Naruse K. et al. Plasma immunoreactive endothelin, but not thrombomodulin, is increased in patients with essential hypertension and ischemic heart disease // J. Cardiovasc. Pharmacol. – 1991; V. 17.–P. 471–474.
37. Reiss U., Stimpel M. Is there a clinical indication for the determination of atrial natrmretic peptid? // Schweiz. Rundsch. Med. Prax. –1993.–V. 82.–P. 755–758.
38. Riegger A.J. Atrial natriuretic peptide in cardiac insufficiency // Arzneimittelforschung. –1988; V. 38.–P. 79–83.
39. Saito Y.;: Aral H.; Nakao K.; Sugawara A. et al. Expression of atrial natriuretic factor gene in hearts from neonates of spontaneously hypertensive rats and stroke–prone spontaneously hypertensive rats // J. Hypertens. Suppi. – 1988; V. 6 (4). – P. 276–278.
40. Sakharov 1.Y.; Dukhanina E.A.; Molokoedov A.S. et al. Atriopeptin 2 is hydrolysed by cardiac but not pulmonary isozyme of angiotensin–converting enzyme // Biochem. Biophys. Res. Commun. – 1988; V. 151 (1).–P. 109–1 13.
41. Sakurai T.; Yanagisawa M.; Masaki T. Molecular characterization of endothelin receptors // Trends. Pharmacol. Sci. – 1992; V. 13 (3). – P. 103–108.
42. Simonson M.S., Wann S–Ф Mene P. et al. Endotelin activates the phosphoinositide cascade in cultured glomerular mesangial cells //J.clib. Invest. – 1989–V. 83, P. 708–712.
43. Sonnenblick E.H.; LeJemtel T.H. Pathophysiology of congestive heart failure. Role ofangiotensin–converting enzyme inhibitors // Am. J. Med. – 1989; V. 87 (6B).–P.88–91.
44. Stewart D.J. Endothelin in cardiopulmonary disease: factor paracrine is neurohumoral //Eur. Heart. J. –1993.– V. 14, N 1.–P. 48–54.
45. Stimpel M.; Kaufinann W.; Wambach G. Atrial natriuretic peptide (ANP) in essential hypertension: a humoral marker for salt sensitivity and hypertensive heart disease at a clinically asymptomatic stage? // Z. Kardiol. – 1988; V. 77.–P. 92–98.
46. Sugiura M.,lnagami T.,Kon V. Endotoxin stimulates endotelin – release in vivo and in vitro as determined by radioimmunassay //lbid. –V. 161, p. 1220–1227.
47. Swanegaard J., Angelo–Nielsen K., Pindborg T. Atrial natriuretic peptide in congestive heart failure after acute myocardial infarction //Cardiology. –1993.–V. 82, N 1.–P. 1–6.
48. Tsutamoto T., Wada A., Maeda Y., Adachi T., Kinoshita M. Relation between endothelin spillover in the lungs and pulmonary vascular resistance in patients with chronic heart failure // J. Am. Coil. Cardiol. – 1994. –V. 23, N 6.–P. 1427–1433.
49. Valdemarsson S., Bergdahl A., Edvinsson L. Relationships between plasma levels of catecholamines and neuropeptides and the survival time in patients with congestive heart failure // J. Intern. Med. – 1994. – V. 235, N 6. – P.595–601.
50. Walsh K.P.; Williams T.D.; Spiteri C.; Pitts E.; Lightman S.L.; Sutton R. Role of atrial pressure and rate in release of atrial natriuretic peptide // Am. J. Physiol. –1988; V. 254.–P. 607–610.
51. Wambach G.; Hannekum A.; Schmidt S.; Kaufinann W.; Dalichau H. Increased concentrations of atrial natriuretic peptide in the plasma and heart atrium of patients with aortic and mitral valve diseases compared to patients with coronary heart disease // Z. Kardiol. – 1987; V. 76 (2). – P. 76–80.
52. Yasue H., Yoshimura M., Sumida H. et al. Localization and mechanism of secretion of B–type natriuretic peptide in comparison with those of A–type natriuretic peptide in normal subjects and patients with heart failure // Circulation. – 1994.– V.90., N 1. – P. 195–203.
53. –С–Є–ї—М—З–µ–љ–Ї–Њ –Р.–Т., –Т–∞—Б–Є–ї—М–µ–≤ –Ѓ.–Ь. –Я—А–µ–і—Б–µ—А–і–љ—Л–є –љ–∞—В—А–Є–є—Г—А–µ—В–Є—З–µ—Б–Ї–Є–є —Д–∞–Ї—В–Њ—А —Г –±–Њ–ї—М–љ—Л—Е –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О //–Ъ–∞—А–і–Є–Њ–ї–Њ–≥–Є—П.– 1991.–N 3.–—Б. 64–67.
54. –Ь–∞–ї–∞—П –Ы.–Ґ., –У–Њ—А–± –Ѓ.–У., –†–∞—З–Є–љ—Б–Ї–Є–є –Ш.–Ф. –•—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П. – –Ъ.: 3–і–Њ—А–Њ–≤’—П, 1994. – 624 —Б.
55. –І—Г–Љ–∞–Ї–Њ–≤ –°.–Э. –Т–ї–Є—П–љ–Є–µ –∞—В–µ–љ–Њ–ї–Њ–ї–∞ –Є –љ–Є—Д–µ–і–Є–њ–Є–љ–∞ –љ–∞ —Д–∞–Ї—В–Њ—А—Л –љ–µ–є—А–Њ–≥—Г–Љ–Њ—А–∞–ї—М–љ–Њ–є —А–µ–≥—Г–ї—П—Ж–Є–Є –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П —Г –±–Њ–ї—М–љ—Л—Е –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О: –Р–≤—В–Њ—А–µ—Д. –і–Є—Б—Б. –Ї–∞–љ–і. –Љ–µ–і. –љ–∞—Г–Ї. – –Т–Њ–ї–≥–Њ–≥—А–∞–і, 1996. –21—Б.
56. –®—Г–ї—Г—В–Ї–Њ –С.–Ш., –Я–µ—А–Њ–≤ –Ѓ.–Ы. –Р—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П. – –°––Я. : –Ь–µ–і–Є—Ж–Є–љ–∞, 1993.–302—Б.












