"–У—А—П–і—Г—В –≤–Њ–ї–љ—Г—О—Й–Є–µ –≤—А–µ–Љ–µ–љ–∞ -
–≤ –љ–Њ–≤–Њ–Љ —В—Л—Б—П—З–µ–ї–µ—В–Є–Є –Ї–ї–Є–љ–Є—Ж–Є—Б—В—Л –Љ–Њ–≥—Г—В –њ–Њ–ї—Г—З–Є—В—М –Ј–∞–Љ–µ–љ—Г
–і–ї—П –љ–µ—Д—А–∞–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≥–µ–њ–∞—А–Є–љ–∞"
E. Antman, R. Handlin [1]
–У–µ–њ–∞—А–Є–љ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –≥—А—Г–њ–њ–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Њ–±–ї–∞–і–∞—О—Й–Є—Е –∞–љ—В–Є—В—А–Њ–Љ–±–Є–љ–Њ–≤–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –і–µ–є—Б—В–≤–Є–µ –Ї–Њ—В–Њ—А—Л—Е –Њ–њ–Њ—Б—А–µ–і—Г–µ—В—Б—П —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ–Є –Ї–Њ—Д–∞–Ї—В–Њ—А–∞–Љ–Є, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –∞–љ—В–Є—В—А–Њ–Љ–±–Є–љ–Њ–Љ III (—В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ –љ–µ–њ—А—П–Љ—Л–µ –∞–љ—В–Є—В—А–Њ–Љ–±–Є–љ—Л). –Э–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –≥–µ–њ–∞—А–Є–љ—Л (–Э–Ь–У) –њ–Њ–ї—Г—З–∞—О—В –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –Є–ї–Є —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–є –і–µ–њ–Њ–ї–Є–Љ–µ—А–Є–Ј–∞—Ж–Є–Є –љ–µ—Д—А–∞–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≥–µ–њ–∞—А–Є–љ–∞ (–Э–§–У) –Є –Њ–љ–Є –Њ–±–ї–∞–і–∞—О—В —А—П–і–Њ–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –њ–µ—А–µ–і –Э–§–У. –Ґ–∞–Ї, –Э–Ь–У –≥–Њ—А–∞–Ј–і–Њ –ї—Г—З—И–µ –≤—Б–∞—Б—Л–≤–∞—О—В—Б—П –њ—А–Є –њ–Њ–і–Ї–Њ–ґ–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є, –Љ–µ–љ—М—И–µ —Б–≤—П–Ј—Л–≤–∞—О—В—Б—П —Б –±–µ–ї–Ї–∞–Љ–Є –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є, —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є –Є –Љ–∞–Ї—А–Њ—Д–∞–≥–∞–Љ–Є, –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –Є–љ–∞–Ї—В–Є–≤–Є—А—Г—О—В—Б—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ 4. –Т—Б–µ —Н—В–Њ –і–µ–ї–∞–µ—В —Н—Д—Д–µ–Ї—В –Э–Ь–У –±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ—Л–Љ –Є –њ—А–µ–і—Б–Ї–∞–Ј—Г–µ–Љ—Л–Љ, –њ–Њ–Ј–≤–Њ–ї—П—П –≤–≤–Њ–і–Є—В—М –Є—Е –њ–Њ–і–Ї–Њ–ґ–љ–Њ 1–2 —А–∞–Ј–∞ –≤ —Б—Г—В («–Є–љ—Б—Г–ї–Є–љ–Њ–њ–Њ–і–Њ–±–љ–∞—П –Є–љ—К–µ–Ї—Ж–Є—П –і–ї—П –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Б–µ—А–і—Ж–∞» [1]). –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –њ—А–Є –≤—Л–±–Њ—А–µ –і–Њ–Ј—Л –Э–Ь–У –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Б–ї–µ–і—Г–µ—В –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞—В—М—Б—П —В–Њ–ї—М–Ї–Њ –љ–∞ –≤–µ—Б –±–Њ–ї—М–љ–Њ–≥–Њ (–і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П —И–Є—А–Њ–Ї–Њ–≥–Њ –≤–љ–µ–і—А–µ–љ–Є—П –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –і–Њ–Ј—Л –Э–Ь–У –њ–Њ —Г—А–Њ–≤–љ—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Њ—В–Є–≤ —Д–∞–Ї—В–Њ—А–∞ —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –•–∞ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ) [2]. –Ф–ї—П —В–Њ–≥–Њ —З—В–Њ–±—Л –≤—Л—П—Б–љ–Є—В—М, –µ—Б—В—М –ї–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї–µ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Э–Ь–У —Г –±–Њ–ї—М–љ—Л—Е —Б –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О –Є –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, –Ї–Њ–≥–і–∞ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б —Г—З–µ—В–Њ–Љ –≤–µ—Б–∞ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –Њ—И–Є–±–Ї–∞–Љ, –љ—Г–ґ–љ—Л –і–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П [2]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Э–§–У –Э–Ь–У –Њ–±–ї–∞–і–∞—О—В –±–Њ–ї–µ–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О (–±–ї–Њ–Ї–∞–і–∞ –Ї–∞—Б–Ї–∞–і–∞ –Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є –љ–∞ –±–Њ–ї–µ–µ —А–∞–љ–љ–Є—Е —Н—В–∞–њ–∞—Е, —Г–≥–љ–µ—В–µ–љ–Є–µ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П —Д–∞–Ї—В–Њ—А–∞ —Д–Њ–љ –Т–Є–ї–ї–µ–±—А–∞–љ–і–∞, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –њ—Г—В–Є —В–Ї–∞–љ–µ–≤–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞), —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–∞–і–µ—П—В—М—Б—П –љ–∞ –Є—Е –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М.
–°–ї–µ–і—Г–µ—В —Г—З–Є—В—Л–≤–∞—В—М, —З—В–Њ –Є–Ј––Ј–∞ —А–∞–Ј–ї–Є—З–Є–є –≤ —Б–њ–Њ—Б–Њ–±–∞—Е –њ–Њ–ї—Г—З–µ–љ–Є—П, —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤–∞—Е –Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П—Е –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –Э–Ь–У —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П, –Ї–∞–Ї –Њ—В–і–µ–ї—М–љ—Л–µ, –љ–µ –≤–Ј–∞–Є–Љ–Њ–Ј–∞–Љ–µ–љ—П–µ–Љ—Л–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –≤–µ—Й–µ—Б—В–≤–∞ [2]. –Я–Њ—Н—В–Њ–Љ—Г –њ–µ—А–µ–љ–Њ—Б–Є—В—М —А–µ–Ј—Г–ї—М—В–∞—В—Л, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ —Б –Њ–і–љ–Є–Љ –Э–Ь–У, –љ–∞ –і—А—Г–≥–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л, –Њ—В–љ–Њ—Б—П—Й–Є–µ—Б—П –Ї —Н—В–Њ–є –≥—А—Г–њ–њ–µ, –љ–∞–і–Њ —Б –Њ—Б–Њ–±–Њ–є –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В—М—О (–µ—Б–ї–Є –≤–Њ–Њ–±—Й–µ –њ—А–Є–µ–Љ–ї–µ–Љ–Њ). –Э–µ–і–Њ–њ—Г—Б—В–Є–Љ —В–∞–Ї–ґ–µ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–є –њ–µ—А–µ—Б—З–µ—В –і–Њ–Ј —А–∞–Ј–ї–Є—З–љ—Л—Е –Э–Ь–У, —Б –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–Ї–Є —В–Њ–ї—М–Ї–Њ –љ–∞ –Є—Е –∞–љ—В–Є––•–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М [3].
–Я—А–Є –ї–µ—З–µ–љ–Є–Є –Ш–С–° –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≥–µ–њ–∞—А–Є–љ–∞ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤ –њ–µ—А–Є–Њ–і –Њ–±–Њ—Б—В—А–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [4–8]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –∞–љ—В–Є—В—А–Њ–Љ–±–Є–љ—Л –љ–∞–Ј–љ–∞—З–∞—О—В—Б—П –і–ї—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤–Њ –≤—А–µ–Љ—П –Є –≤—Б–Ї–Њ—А–µ –њ–Њ—Б–ї–µ —З—А–µ—Б–Ї–Њ–ґ–љ–Њ–є —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ (–І–†–Ь) [9], –∞ —В–∞–Ї–ґ–µ –њ—А–Є –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–µ –Ї –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –Ј–∞—В—П–љ—Г–≤—И–Є–Љ—Б—П –њ–∞—А–Њ–Ї—Б–Є–Ј–Љ–Њ–Љ –Љ–µ—А—Ж–∞—В–µ–ї—М–љ–Њ–є –∞—А–Є—В–Љ–Є–Є/—В—А–µ–њ–µ—В–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є [10,11]. –Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Э–Ь–У –≤ —Н—В–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є—В—Г–∞—Ж–Є—П—Е –Є –±—Г–і–µ—В –њ–Њ—Б–≤—П—Й–µ–љ–Њ –і–∞–љ–љ–Њ–µ —Б–Њ–Њ–±—Й–µ–љ–Є–µ.
–Э–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –≥–µ–њ–∞—А–Є–љ—Л –њ—А–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П—Е –Ш–С–°
–Р–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Њ—А–Љ –Њ–±–Њ—Б—В—А–µ–љ–Є—П –Ш–С–° (–Є–ї–Є –Њ—Б—В—А—Л—Е –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е —Б–Є–љ–і—А–Њ–Љ–Њ–≤ – –Ю–Ъ–°) –љ–∞—З–Є–љ–∞–µ—В—Б—П —Б –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ –∞–≥–µ–љ—В–∞ –Є –≤—Б–µ, —З—В–Њ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П –љ–Є–ґ–µ, –Ї–∞—Б–∞–µ—В—Б—П –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г. –Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б –і—А—Г–≥–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П –Ј–∞–≤–Є—Б—П—В –Њ—В –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–∞—А–Є–∞–љ—В–∞ –Ю–Ъ–° –Є –≤—А–µ–Љ–µ–љ–Є, –њ—А–Њ—И–µ–і—И–µ–≥–Њ –њ–Њ—Б–ї–µ —Г—В—П–ґ–µ–ї–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Я—А–Є –љ–∞–ї–Є—З–Є–Є –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ–Њ–≥–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–∞ —Б—В–Њ–є–Ї–Њ–є –Њ–Ї–Ї–ї—О–Ј–Є–Є –Ї—А—Г–њ–љ–Њ–є —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–є –∞—А—В–µ—А–Є–Є (—Б—В–Њ–є–Ї–Є—Е –њ–Њ–і—К–µ–Љ–Њ–≤ —Б–µ–≥–Љ–µ–љ—В–∞ ST –љ–∞ –≠–Ъ–У –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є) –Њ—Б–љ–Њ–≤–љ–Њ–є —Ж–µ–ї—М—О –ї–µ—З–µ–љ–Є—П —П–≤–ї—П–µ—В—Б—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –±—Л—Б—В—А–Њ–µ, –њ–Њ–ї–љ–Њ–µ –Є —Б—В–Њ–є–Ї–Њ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ–Њ —Б–Њ—Б—Г–і—Г (–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–µ –њ—А–Є –њ–Њ–Љ–Њ—Й–Є —В—А–Њ–Љ–±–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Є–ї–Є –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–µ, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —З—А–µ—Б–Ї–Њ–ґ–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤). –У–µ–њ–∞—А–Є–љ –≤ —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е –Є–≥—А–∞–µ—В –≤—Б–њ–Њ–Љ–Њ–≥–∞—В–µ–ї—М–љ—Г—О —А–Њ–ї—М, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—П —А–µ–Ї–∞–љ–∞–ї–Є–Ј–∞—Ж–Є–Є –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–є –∞—А—В–µ—А–Є–Є –Є —Г–Љ–µ–љ—М—И–∞—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —А–µ–Њ–Ї–Ї–ї—О–Ј–Є–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–Є –Њ–±—Й–Є—А–љ–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ –Є –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –љ–∞–ї–Є—З–Є–Є —В—А–Њ–Љ–±–∞ –≤ –њ–Њ–ї–Њ—Б—В–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –≥–µ–њ–∞—А–Є–љ–∞ –њ—А–Є–Ј–≤–∞–љ–Њ —Г–Љ–µ–љ—М—И–Є—В—М –Њ–њ–∞—Б–љ–Њ—Б—В—М —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Т —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –і–ї–Є—В–µ–ї—М–љ–Њ–є –Њ–Ї–Ї–ї—О–Ј–Є–Є –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–є –∞—А—В–µ—А–Є–Є –љ–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В, –Є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, —Б—В–Њ–є–Ї–Є–µ –њ–Њ–і—К–µ–Љ—Л —Б–µ–≥–Љ–µ–љ—В–∞ ST –љ–∞ –≠–Ъ–У –Њ—В—Б—Г—В—Б—В–≤—Г—О—В, —Ж–µ–ї—М –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–Њ–Є—В –≤ –±—Л—Б—В—А–Њ–Љ, –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –њ–Њ–ї–љ–Њ–Љ –Є —Б—В–Њ–є–Ї–Њ–Љ –њ–Њ–і–∞–≤–ї–µ–љ–Є–Є –∞–Ї—В–Є–≤–љ–Њ –Є–і—Г—Й–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —В—А–Њ–Љ–±–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П, –ї–µ–ґ–∞—Й–Є—Е –≤ –Њ—Б–љ–Њ–≤–µ —Г—В—П–ґ–µ–ї–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є—Е –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї –Њ—Б–ї–Њ–ґ–µ–љ–Є–є.
–Э–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –≥–µ–њ–∞—А–Є–љ—Л –њ—А–Є –Њ—Б—В—А–Њ–Љ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ —Б –њ–Њ–і—К–µ–Љ–∞–Љ–Є —Б–µ–≥–Љ–µ–љ—В–∞ ST –љ–∞ –≠–Ъ–У
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є–Ј—Г—З–µ–љ–Є—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Э–Ь–У –≤ –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї —В—А–Њ–Љ–±–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є–≤–µ–і–µ–љ—Л –≤ —В–∞–±–ї. 1. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–Њ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞. –Т —Ж–µ–ї–Њ–Љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П, —З—В–Њ –Э–Ь–У —Б–њ–Њ—Б–Њ–±—Б—В –≤—Г—О—В –±–Њ–ї–µ–µ –±—Л—Б—В—А–Њ–є —А–µ–њ–µ—А—Д—Г–Ј–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ (–Њ–њ—А–µ–і–µ–ї—П–µ–Љ–Њ–є –њ–Њ —Г—Б–Ї–Њ—А–µ–љ–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О —Б–µ–≥–Љ–µ–љ—В–∞ ST), –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї—Г—О –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В—М –∞—А—В–µ—А–Є–Є, –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–∞—О—Й–µ–є –Ј–Њ–љ—Г –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ (–Ш–Ь), —Г–Љ–µ–љ—М—И–∞—О—В —З–∞—Б—В–Њ—В—Г —А–µ–Њ–Ї–Ї–ї—О–Ј–Є–Є –Є —А–µ–Ш–Ь –≤–Њ –≤—А–µ–Љ—П –ї–µ—З–µ–љ–Є—П. –Я—А–Є —Н—В–Њ–Љ —З–∞—Б—В–Њ—В–∞ —Б–µ—А—М–µ–Ј–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –љ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П. –Т —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Э–Ь–У –Њ–Ї–∞–Ј–∞–ї–Є—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–µ–µ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–є –Є–љ—Д—Г–Ј–Є–Є –Э–§–У [14,16–18]. –Я—А–Њ–і–ї–µ–љ–Є–µ –њ–Њ–і–Ї–Њ–ґ–љ—Л—Е –Є–љ—К–µ–Ї—Ж–Є–є –Э–Ь–У –≤–њ–ї–Њ—В—М –і–Њ 1 –Љ–µ—Б –њ–Њ—Б–ї–µ –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ–є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–є –Є–љ—Д—Г–Ј–Є–Є –Э–§–У –Њ–±–ї–∞–і–∞–ї–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ (–њ—А–Є–≤–µ–ї–Њ –Ї —Б–љ–Є–ґ–µ–љ–Є—О —З–∞—Б—В–Њ—В—Л –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —А–µ–Ш–Ь) [15].
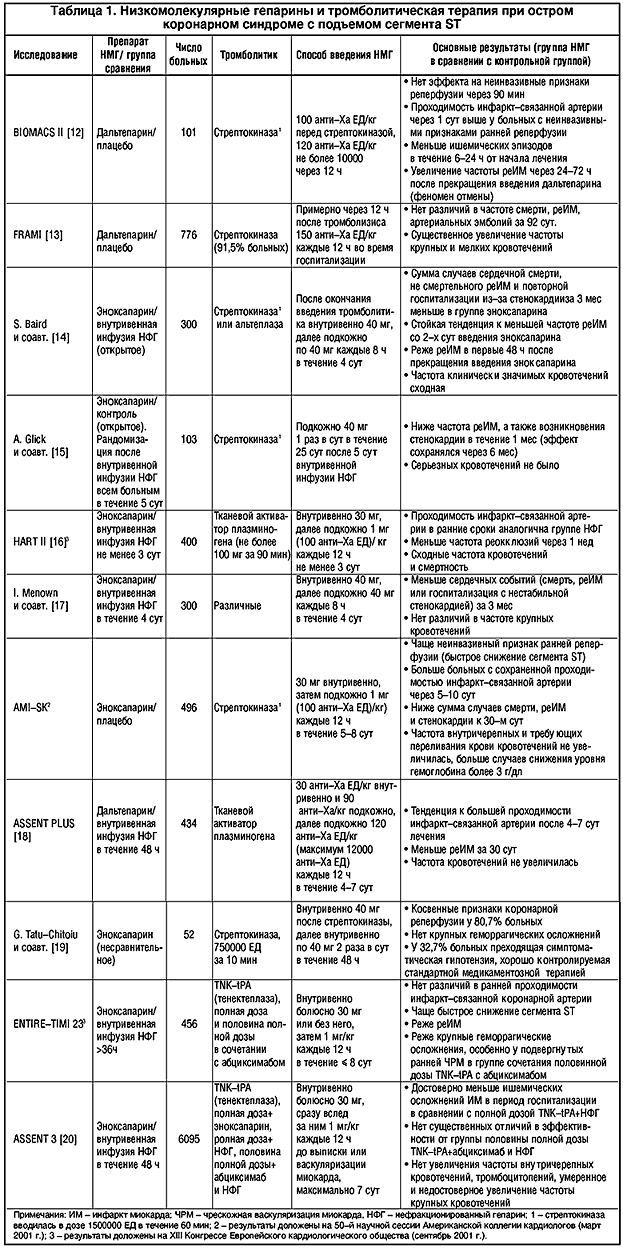
–£ —А—П–і–∞ –±–Њ–ї—М–љ—Л—Е —Б –Ю–Ъ–° —Б–Њ —Б—В–Њ–є–Ї–Є–Љ–Є –њ–Њ–і—К–µ–Љ–∞–Љ–Є —Б–µ–≥–Љ–µ–љ—В–∞ ST –љ–∞ –≠–Ъ–У —В—А–Њ–Љ–±–Њ–ї–Є—В–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П –њ–Њ –Ї–∞–Ї–Є–Љ––ї–Є–±–Њ –њ—А–Є—З–Є–љ–∞–Љ –љ–µ –њ—А–Њ–≤–Њ–і–Є—В—Б—П. –Э—Г–ґ–љ–Њ –ї–Є —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≥–µ–њ–∞—А–Є–љ –≤ —Н—В–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є, –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ —П—Б–љ–Њ [2,8]. –Ф–∞–љ–љ—Л–µ, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П –Э–Ь–У, —В–∞–Ї–ґ–µ –љ–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В —Б–і–µ–ї–∞—В—М –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е –≤—Л–≤–Њ–і–Њ–≤. –Ґ–∞–Ї, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є FAMI 1128 –±–Њ–ї—М–љ—Л—Е –≤ –њ–µ—А–≤—Л–µ 3 —Б—Г—В –њ–Њ—Б–ї–µ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –њ–Њ–ї—Г—З–∞–ї–Є –і–∞–ї—М—В–µ–њ–∞—А–Є–љ –≤ –і–Њ–Ј–µ 120 –∞–љ—В–Є–X–∞ –Х–Ф/–Ї–≥ –Ї–∞–ґ–і—Л–µ 12 —З. –Ч–∞—В–µ–Љ –і–≤–Њ–є–љ—Л–Љ —Б–ї–µ–њ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Њ—Б—М –≤–≤–µ–і–µ–љ–Є–µ –і–∞–ї—М—В–µ–њ–∞—А–Є–љ–∞ 7500 –∞–љ—В–Є–X–∞ –Х–Ф 1 —А–∞–Ј –≤ —Б—Г—В –Є–ї–Є –њ–ї–∞—Ж–µ–±–Њ –≤ —В–µ—З–µ–љ–Є–µ 30 —Б—Г—В. –†–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –≤ —З–∞—Б—В–Њ—В–µ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Б–Њ–±—Л—В–Є–є –Ј–∞ —Н—В–Њ—В —Б—А–Њ–Ї –љ–µ –±—Л–ї–Њ [21]. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–Є—З–µ–≥–Њ –љ–µ–ї—М–Ј—П —Б–Ї–∞–Ј–∞—В—М –Њ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Э–Ь–У –≤ —А–∞–љ–љ–Є–µ —Б—А–Њ–Ї–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —В—А–Њ–Љ–±–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є, –∞ –і–Њ–Ј–∞ –Э–Ь–У, –≤—Л–±—А–∞–љ–љ–∞—П –і–ї—П –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, —Б–Ї–Њ—А–µ–µ –≤—Б–µ–≥–Њ, –±—Л–ї–∞ —Б–ї–Є—И–Ї–Њ–Љ –Љ–∞–ї–∞. –¶–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Э–§–У, —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞ –Є –Є—Е —Б–Њ—З–µ—В–∞–љ–Є—П —Б –±–ї–Њ–Ї–∞—В–Њ—А–Њ–Љ –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤–Њ–≥–Њ —А–µ—Ж–µ–њ—В–Њ—А–∞ IIb/IIIa —В–Є—А–Њ—Д–Є–±–∞–љ–Њ–Љ —Г –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б—В—А—Л–Љ –Ш–Ь, –љ–µ –њ–Њ–і—Е–Њ–і—П—Й–Є—Е –і–ї—П —А–∞–љ–љ–µ–є —А–µ–њ–µ—А—Д—Г–Ј–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Є–Ј—Г—З–∞–µ—В—Б—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є TETAMI [22].
–С—Л—Б—В—А–Њ—В–∞ —А–µ–Ї–∞–љ–∞–ї–Є–Ј–∞—Ж–Є–Є –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–є –∞—А—В–µ—А–Є–Є, –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–∞—О—Й–µ–є –Ј–Њ–љ—Г –Є–љ—Д–∞—А–Ї—В–∞, –Њ—Б—В–∞–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —Г—Б–њ–µ—Е–∞ –ї–µ—З–µ–љ–Є—П –Є –≤ —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≤—Л–њ–Њ–ї–љ–Є—В—М –љ–µ–Њ—В–ї–Њ–ґ–љ—Г—О —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є—О –Љ–Є–Њ–Ї–∞—А–і–∞. –° —Н—В–Њ–є —Ж–µ–ї—М—О –њ—А–µ–і–ї–∞–≥–∞—О—В –Њ–і–љ–Њ–Љ–Њ–Љ–µ–љ—В–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –≥–µ–њ–∞—А–Є–љ–∞, –Ї–Њ—В–Њ—А–Њ–µ –Љ–Њ–ґ–љ–Њ –ї–µ–≥–Ї–Њ –Њ—Б—Г—Й–µ—Б—В–≤–Є—В—М –љ–∞ –і–Њ–≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–Љ —Н—В–∞–њ–µ. –Я–Њ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Л–Љ –і–∞–љ–љ—Л–Љ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ –љ–∞ –Љ–∞–ї–Њ–Љ —З–Є—Б–ї–µ –±–Њ–ї—М–љ—Л—Е (100 —З–µ–ї–Њ–≤–µ–Ї) –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CHEAPER, –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ 80 –Љ–≥ —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞ –≤ –њ–µ—А–≤—Л–µ 12 —З –њ–Њ—Б–ї–µ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Ю–Ъ–° —Б –љ–∞–ї–Є—З–Є–µ–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –і–ї—П —А–µ–њ–µ—А—Д—Г–Ј–Є–Є –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –±–Њ–ї–µ–µ —З–∞—Б—В–Њ–є –±—Л—Б—В—А–Њ–є —А–µ–Ї–∞–љ–∞–ї–Є–Ј–∞—Ж–Є–Є –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–є –∞—А—В–µ—А–Є–Є –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–њ—А–Є–Љ–µ—А–љ–Њ 60% –њ—А–Њ—В–Є–≤ 13%, —А=0,01). –•–Њ—В—П –≤—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ –≤ —Б—А–µ–і–љ–µ–Љ —З–µ—А–µ–Ј 75 –Љ–Є–љ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –Ї–Њ—А–Њ–љ–∞—А–љ–∞—П –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—П —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –∞–љ–≥–Є–Њ–њ–ї–∞—Б—В–Є–Ї–Њ–є –њ—А–Є–Љ–µ—А–љ–Њ –≤ –њ–Њ–ї–Њ–≤–Є–љ–µ —Б–ї—Г—З–∞–µ–≤ –Є —З–∞—Б—В–Њ–є —Г—Б—В–∞–љ–Њ–≤–Ї–Њ–є –≤–љ—Г—В—А–Є—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –њ—А–Њ—В–µ–Ј–∞ (—Б—В–µ–љ—В–∞), —З–Є—Б–ї–Њ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –љ–µ–±–Њ–ї—М—И–Є–Љ [23,24].
–Я–Њ–Љ–Є–Љ–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В—М –∞—А—В–µ—А–Є–Є, –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–∞—О—Й–µ–є –Ј–Њ–љ—Г –Є–љ—Д–∞—А–Ї—В–∞, –Є —З–∞—Б—В–Њ—В—Г –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –≥–µ–њ–∞—А–Є–љ –Є–љ–Њ–≥–і–∞ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В —Г –±–Њ–ї—М–љ—Л—Е —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–є (—Б –Њ–±—И–Є—А–љ—Л–Љ/–њ–µ—А–µ–і–љ–Є–Љ –Ш–Ь, –і–Њ–Ї—Г–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–љ—Л–Љ —В—А–Њ–Љ–±–Њ–Љ –≤ –њ–Њ–ї–Њ—Б—В–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞, –∞—А—В–µ—А–Є–∞–ї—М–љ—Л–Љ–Є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—П–Љ–Є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, –Љ–µ—А—Ж–∞—В–µ–ї—М–љ–Њ–є –∞—А–Є—В–Љ–Є–µ–є) [8]. –Ю—З–µ–≤–Є–і–љ–Њ, –≤ —Н—В–Є—Е —Б–Є—В—Г–∞—Ж–Є—П—Е –Э–Ь–У –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М —Е–Њ—А–Њ—И–µ–є –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–Њ–є –Э–§–У. –Я—А–Є —Н—В–Њ–Љ, –Ї–∞–Ї –Є –і–ї—П –Э–§–У, –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Б–ї–Є—И–Ї–Њ–Љ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –Э–Ь–У —Б–њ–Њ—Б–Њ–±–љ–Њ –њ—А–Є–≤–µ—Б—В–Є –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О —З–Є—Б–ї–∞ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Ґ–∞–Ї, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –і–∞–ї—М—В–µ–њ–∞—А–Є–љ–∞ –≤ –і–Њ–Ј–µ 150 –∞–љ—В–Є–X–∞ –Х–Ф/–Ї–≥ –Ї–∞–ґ–і—Л–µ 12 —З –≤–Њ –≤—А–µ–Љ—П –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б—В—А—Л–Љ –њ–µ—А–µ–і–љ–Є–Љ –Ш–Ь (–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ FRAMI, 776 —З–µ–ї–Њ–≤–µ–Ї, –Ї–Њ—В–Њ—А—Л–Љ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Њ–≤–µ–і–µ–љ–∞ —В—А–Њ–Љ–±–Њ–ї–Є—В–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П —Б—В—А–µ–њ—В–Њ–Ї–Є–љ–∞–Ј–Њ–є), –љ–∞—А—П–і—Г —Б —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —В—А–Њ–Љ–±–∞ –≤ –њ–Њ–ї–Њ—Б—В–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —З–∞—Б—В–Њ—В—Л –Ї—А—Г–њ–љ—Л—Е –Є –Љ–µ–ї–Ї–Є—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є [25]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —Г 148 –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б—В—А—Л–Љ –њ–µ—А–µ–і–љ–Є–Љ –Ш–Ь, –љ–µ –њ–Њ–і–≤–µ—А–≥–љ—Г—В—Л—Е —В—А–Њ–Љ–±–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є, –±—Л–ї–∞ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ —А–∞–≤–љ–∞—П —З–∞—Б—В–Њ—В–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —В—А–Њ–Љ–±–∞ –≤ –њ–Њ–ї–Њ—Б—В–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ –≤ —В–µ—З–µ–љ–Є–µ 10 —Б—Г—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є –Є –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Њ–є –і–Њ–Ј—Л –љ–∞–і—А–Њ–њ–∞—А–Є–љ–∞ (93 –Є 56 –∞–љ—В–Є–X–∞ –Х–Ф/–Ї–≥ –њ–Њ—Б–ї–µ –њ—А–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П 2850 –∞–љ—В–Є–X–∞ –Х–Ф) –њ—А–Є —В–Њ–Љ, —З—В–Њ –Ї—А—Г–њ–љ—Л–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –≤ –Њ–±–Њ–Є—Е —Б–ї—Г—З–∞—П—Е –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є [26].
–Э–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –≥–µ–њ–∞—А–Є–љ—Л –њ—А–Є –Њ—Б—В—А–Њ–Љ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ –±–µ–Ј —Б—В–Њ–є–Ї–Є—Е –њ–Њ–і—К–µ–Љ–Њ–≤ —Б–µ–≥–Љ–µ–љ—В–∞ ST –љ–∞ –≠–Ъ–У
–Э–µ—Б—В–∞–±–Є–ї—М–љ–∞—П —Б—В–µ–љ–Њ–Ї–∞—А–і–Є—П –Є –Њ—Б—В—А—Л–є –Ш–Ь –±–µ–Ј –њ–Њ–і—К–µ–Љ–Њ–≤ —Б–µ–≥–Љ–µ–љ—В–∞ ST –љ–∞ –≠–Ъ–У (–≤ –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ – –Ш–Ь –±–µ–Ј —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј—Г–±—Ж–Њ–≤ Q) –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Э–Ь–У –љ–µ –≤—Л–Ј—Л–≤–∞—О—В —Б–Њ–Љ–љ–µ–љ–Є–є.
–Ю –≤—Л—Б–Њ–Ї–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є —Б–≤—П–Ј–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П –Ш–С–° —Б –∞–Ї—В–Є–≤–љ—Л–Љ —В—А–Њ–Љ–±–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –≤ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є—П—Е, –Ї–Њ–≥–і–∞ –Љ–Њ–ґ–љ–Њ —А–∞—Б—Б—З–Є—В—Л–≤–∞—В—М –љ–∞ —Г—Б–њ–µ—Е –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –љ–µ–і–∞–≤–љ–µ–µ –њ–Њ—П–≤–ї–µ–љ–Є–µ –Ј–∞—В—П–ґ–љ—Л—Е –њ—А–Є—Б—В—Г–њ–Њ–≤ —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–Є (–Є–ї–Є –і—А—Г–≥–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, –Ї–∞–ґ—Г—Й–Є—Е—Б—П —Б–≤—П–Ј–∞–љ–љ—Л–Љ–Є —Б –Є—И–µ–Љ–Є–µ–є –Љ–Є–Њ–Ї–∞—А–і–∞) –≤ –њ–Њ–Ї–Њ–µ (–Є–ї–Є –њ—А–Є –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–Љ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–Љ —Г—Б–Є–ї–Є–Є), –≤ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Б–Њ—З–µ—В–∞—О—Й–Є—Е—Б—П —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –љ–∞ –≠–Ъ–У (–њ—А–µ—Е–Њ–і—П—Й–Є–µ —Б–Љ–µ—Й–µ–љ–Є—П —Б–µ–≥–Љ–µ–љ—В–∞ ST –≤–≤–µ—А—Е –Њ—В –Є–Ј–Њ—Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–є –ї–Є–љ–Є–Є, –њ—А–µ—Е–Њ–і—П—Й–Є–µ –Є–ї–Є —Б—В–Њ–є–Ї–Є–µ –і–µ–њ—А–µ—Б—Б–Є–Є —Б–µ–≥–Љ–µ–љ—В–∞ ST –±–Њ–ї–µ–µ 0,05–0,1 –Љ–Т, –њ–Њ—П–≤–ї–µ–љ–Є–µ –Є–љ–≤–µ—А—Б–Є–Є –Ј—Г–±—Ж–Њ–≤ –Ґ, ‘’–њ—Б–µ–≤–і–Њ–љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П’’ –Ј—Г–±—Ж–Њ–≤ –Ґ), –∞ —В–∞–Ї–ґ–µ —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≤ –Ї—А–Њ–≤–Є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –Љ–∞—А–Ї–µ—А–Њ–≤, —З—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –љ–µ–і–∞–≤–љ–Њ –њ—А–Њ–Є–Ј–Њ—И–µ–і—И–Є–є –љ–µ–Ї—А–Њ–Ј –Љ–Є–Њ–Ї–∞—А–і–∞ (–Ї—А–µ–∞—В–Є–љ—Д–Њ—Б—Д–Њ–Ї–Є–љ–∞–Ј–∞, –µ–µ –Ь–Т —Д—А–∞–Ї—Ж–Є—П –Є –Њ—Б–Њ–±–µ–љ–љ–Њ —Б–µ—А–і–µ—З–љ—Л–є —В—А–Њ–њ–Њ–љ–Є–љ –Ґ –Є–ї–Є I).
–°—Г—Й–µ—Б—В–≤—Г—О—В –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ —Г–≤–µ–ї–Є—З–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –њ—А–Є –і–Њ–±–∞–≤–ї–µ–љ–Є–Є –Э–Ь–У (–і–∞–ї—М—В–µ–њ–∞—А–Є–љ–∞) –Ї –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–µ –≤ –њ–µ—А–≤—Л–µ 72 —З –њ–Њ—Б–ї–µ –±–Њ–ї–µ–≤–Њ–≥–Њ –њ—А–Є—Б—В—Г–њ–∞, –њ–Њ—Б–ї—Г–ґ–Є–≤—И–µ–≥–Њ –њ–Њ–≤–Њ–і–Њ–Љ –Ї –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є, –њ—А–Є –љ–∞–ї–Є—З–Є–Є –њ—А–µ—Е–Њ–і—П—Й–Є—Е –Є–ї–Є —Б–Њ—Е—А–∞–љ—П—О—Й–Є—Е—Б—П –і–µ–њ—А–µ—Б—Б–Є–є —Б–µ–≥–Љ–µ–љ—В–∞ ST –љ–∞ 0,1 –Љ–Т –Є –±–Њ–ї–µ–µ –Є/–Є–ї–Є –Є–љ–≤–µ—А—Б–Є–Є –Ј—Г–±—Ж–Њ–≤ –Ґ –љ–∞ 0,1 –Љ–Т –Є –±–Њ–ї–µ–µ, –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ, –≤ –і–≤—Г—Е —Б–Љ–µ–ґ–љ—Л—Е –Њ—В–≤–µ–і–µ–љ–Є—П—Е [27]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є —Б–Њ–і–µ—А–ґ–∞—В —Г–Ї–∞–Ј–∞–љ–Є–µ –љ–∞–Ј–љ–∞—З–∞—В—М –≥–µ–њ–∞—А–Є–љ —Г–ґ–µ –њ—А–Є –њ–Њ–і–Њ–Ј—А–µ–љ–Є–Є –љ–∞ –љ–∞–ї–Є—З–Є–µ –Ю–Ъ–° –±–µ–Ј —Б—В–Њ–є–Ї–Є—Е –њ–Њ–і—К–µ–Љ–Њ–≤ —Б–µ–≥–Љ–µ–љ—В–∞ ST [4,5]. –Я—А–Є —Н—В–Њ–Љ –њ–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –≤–≤–µ–і–µ–љ–Є–µ –≥–µ–њ–∞—А–Є–љ–∞ (–Є–ї–Є –Э–Ь–У) –Љ–Њ–ґ–љ–Њ –њ—А–µ–Ї—А–∞—В–Є—В—М —Г –±–Њ–ї—М–љ—Л—Е –љ–Є–Ј–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞, –Ї–Њ–≥–і–∞ –љ–Њ–≤—Л–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –љ–∞ –≠–Ъ–У –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є –і–Њ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П, –љ–µ –њ–Њ—П–≤–ї—П—О—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ 8–12 —З –љ–∞–±–ї—О–і–µ–љ–Є—П –Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≤ –Ї—А–Њ–≤–Є —Б–µ—А–і–µ—З–љ–Њ–≥–Њ —В—А–Њ–њ–Њ–љ–Є–љ–∞ –њ—А–Є –њ–Њ–≤—В–Њ—А–љ–Њ–Љ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –Њ—Б—В–∞–≤–∞–ї–∞—Б—М –љ–µ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є [5].
–°—А–∞–≤–љ–µ–љ–Є–µ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–є –Є–љ—Д—Г–Ј–Є–Є –Э–§–У –њ–Њ–і –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —З–∞—Б—В–Є—З–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–њ–ї–∞—Б—В–Є–љ–Њ–≤–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Є –њ–Њ–і–Ї–Њ–ґ–љ—Л—Е –Є–љ—К–µ–Ї—Ж–Є–є –Э–Ь–У –≤ –і–Њ–Ј–µ, –њ–Њ–і–Њ–±—А–∞–љ–љ–Њ–є –њ–Њ –≤–µ—Б—Г –±–Њ–ї—М–љ–Њ–≥–Њ, –≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Ї—А—Г–њ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –і–ї—П —В—А–µ—Е –Э–Ь–У – –і–∞–ї—М—В–µ–њ–∞—А–Є–љ–∞, –љ–∞–і—А–Њ–њ–∞—А–Є–љ–∞ –Є —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –і–∞–ї—М—В–µ–њ–∞—А–Є–љ–∞ –Є –љ–∞–і—А–Њ–њ–∞—А–Є–љ–∞ –≤ —А–∞–љ–љ–µ–Љ (–Њ—Б—В—А–Њ–Љ) –њ–µ—А–Є–Њ–і–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ–є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–є –Є–љ—Д—Г–Ј–Є–Є –Э–§–У, —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ –Њ–±–ї–∞–і–∞–ї –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ –њ–µ—А–µ–і –Э–§–У (—А–Є—Б–Ї –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –њ—А–Є –µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –±—Л–ї –љ–Є–ґ–µ –њ—А–Є–Љ–µ—А–љ–Њ –љ–∞ 20%) [28–32]. –Т —Ж–µ–ї–Њ–Љ, –∞–љ–∞–ї–Є–Ј–Є—А—Г—П –Є–Љ–µ—О—Й–Є–µ—Б—П –і–∞–љ–љ—Л–µ, —Н–Ї—Б–њ–µ—А—В—Л –Њ—В–Љ–µ—З–∞—О—В, —З—В–Њ –≤ —А–∞–љ–љ–µ–Љ –ї–µ—З–µ–љ–Є–Є –Ю–Ъ–° –±–µ–Ј —Б—В–Њ–є–Ї–Є—Е –њ–Њ–і—К–µ–Љ–Њ–≤ —Б–µ–≥–Љ–µ–љ—В–∞ ST –Э–Ь–У –Њ–±–ї–∞–і–∞—О—В —П–≤–љ—Л–Љ–Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞–Љ–Є (–њ—А–Њ—Б—В–Њ—В–∞ –≤–≤–µ–і–µ–љ–Є—П, –±–Њ–ї–µ–µ –њ—А–µ–і—Б–Ї–∞–Ј—Г–µ–Љ—Л–є –Є –і–ї–Є—В–µ–ї—М–љ—Л–є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ—Л–є —Н—Д—Д–µ–Ї—В, –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б—В—А–Њ–≥–Њ–є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї–µ) [2,4–6].
–†–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В –њ—А–Є–і–µ—А–ґ–Є–≤–∞—В—М—Б—П –і–Њ–Ј –Є —Б—А–Њ–Ї–Њ–≤ –≤–≤–µ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Э–Ь–У, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–≤—И–Є—Е—Б—П –≤ –Ї—А—Г–њ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, —Б–њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –і–ї—П –Њ—Ж–µ–љ–Ї–Є –Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є (—В–∞–±–ї. 2) [6].

–Я—А–Њ–і–ї–µ–љ–Є–µ –≤–≤–µ–і–µ–љ–Є—П –Э–Ь–У –±–Њ–ї–µ–µ 1 –љ–µ–і –≤–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П [2,4–6]. –Ю–і–љ–∞–Ї–Њ –Ї–Њ–≥–і–∞ –±—Л—Б—В—А–Њ –њ–Њ–і–∞–≤–Є—В—М –Є—И–µ–Љ–Є—О –Љ–Є–Њ–Ї–∞—А–і–∞ –љ–µ —Г–і–∞–µ—В—Б—П, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –і—А—Г–≥–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –∞–Ї—В–Є–≤–љ–Њ –Є–і—Г—Й–Є–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є —В—А–Њ–Љ–±–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –≤ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є—П—Е (–≤—Л—П–≤–ї–µ–љ–Є–Є –њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Б–µ—А–і–µ—З–љ—Л—Е —В—А–Њ–њ–Њ–љ–Є–љ–Њ–≤ –≤ –Ї—А–Њ–≤–Є, —А–∞–љ–љ–µ–є –њ–Њ—Б—В–Є–љ—Д–∞—А–Ї—В–љ–Њ–є —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–Є), –Є–љ—К–µ–Ї—Ж–Є–Є –Э–Ь–У –њ—А–µ–і–ї–∞–≥–∞—О—В –њ—А–Њ–і–Њ–ї–ґ–Є—В—М, –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ, –≤ —В–µ—З–µ–љ–Є–µ –µ—Й–µ 1 –љ–µ–і [5]. –≠—В–Є –±–Њ–ї—М–љ—Л–µ –њ–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П–Љ –љ—Г–ґ–і–∞—О—В—Б—П –≤ —А–∞–љ–љ–µ–Љ –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ [4,5]. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П FRISC II —Г–Ї–∞–Ј—Л–≤–∞—О—В –љ–∞ –њ–Њ–ї—М–Ј—Г –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є—П –≤–≤–µ–і–µ–љ–Є—П –Э–Ь–У (–і–∞–ї—М—В–µ–њ–∞—А–Є–љ–∞) –њ–Њ –Љ–µ–љ—М—И–µ–є –Љ–µ—А–µ –≤ —В–µ—З–µ–љ–Є–µ 1–1,5 –Љ–µ—Б –±–Њ–ї—М–љ—Л–Љ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ (–њ–Њ—Б—В—Г–њ–Є–≤—И–Є—Е —Б –њ—А–Є—Б—В—Г–њ–Њ–Љ —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–Є –≤ –њ—А–µ–і—И–µ—Б—В–≤—Г—О—И–Є–µ 48 —З, —Б–Њ—З–µ—В–∞—О—Й–Є–Љ—Б—П —Б –љ–∞–ї–Є—З–Є–µ–Љ –і–µ–њ—А–µ—Б—Б–Є–є —Б–µ–≥–Љ–µ–љ—В–∞ ST –љ–∞ –≠–Ъ–У –Є –Њ—Б–Њ–±–µ–љ–љ–Њ —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ —Б–µ—А–і–µ—З–љ—Л—Е —В—А–Њ–њ–Њ–љ–Є–љ–Њ–≤ –≤ –Ї—А–Њ–≤–Є), —Г –Ї–Њ—В–Њ—А—Л—Е –Є–љ–≤–∞–Ј–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –њ–Њ –Ї–∞–Ї–Є–Љ––ї–Є–±–Њ –њ—А–Є—З–Є–љ–∞–Љ –Њ—В–Ї–ї–∞–і—Л–≤–∞–µ—В—Б—П –Є–ї–Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ [33]. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Э–Ь–У –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М —Б–≤–Њ–µ–Њ–±—А–∞–Ј–љ—Л–Љ «–Љ–Њ—Б—В–Є–Ї–Њ–Љ» –і–ї—П —В–µ—Е, –Ї—В–Њ –≤—Л–љ—Г–ґ–і–µ–љ –ґ–і–∞—В—М —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞, —Г–Љ–µ–љ—М—И–∞—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–µ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤ —Н—В–Њ—В –њ–µ—А–Є–Њ–і –≤—А–µ–Љ–µ–љ–Є [34]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —Б–ї–µ–і—Г–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є, –љ–µ —П—Б–љ—Л: —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б—В–Њ–ї—М –ґ–µ –≤—Л—Б–Њ–Ї–Њ–є –і–Њ–Ј—Л –Э–Ь–У, –Ї–∞–Ї –Є –≤ —А–∞–љ–љ–Є–µ —Б—А–Њ–Ї–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Љ–Њ–ґ–µ—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±—Л—Б—В—А–Њ –њ—А–Є–≤–µ—Б—В–Є –Ї —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–Љ—Г —Г–≤–µ–ї–Є—З–µ–љ–Є—О —З–∞—Б—В–Њ—В—Л –Ї—А—Г–њ–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є [29], —Б –і—А—Г–≥–Њ–є – –љ–µ –Є—Б–Ї–ї—О—З–µ–љ–Њ, —З—В–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞ —Б–њ–Њ—Б–Њ–±–љ–Њ —Б–≤–µ—Б—В–Є –љ–∞ –љ–µ—В –Њ–ґ–Є–і–∞–µ–Љ—Л–є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞. –Э–µ –≤—Л–Ј—Л–≤–∞–µ—В —Б–Њ–Љ–љ–µ–љ–Є–є –њ–Њ–Ї–∞ —В–Њ–ї—М–Ї–Њ –і–Њ–Ј–∞ –і–∞–ї—М—В–µ–њ–∞—А–Є–љ–∞ –і–ї—П –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П: —Г –ґ–µ–љ—Й–Є–љ <80 –Ї–≥ –Є –Љ—Г–ґ—З–Є–љ <70 –Ї–≥ – 5000 –∞–љ—В–Є–X–∞ –Х–Ф 2 —А–∞–Ј–∞ –≤ —Б—Г—В, –њ—А–Є –±–Њ–ї—М—И–µ–Љ –≤–µ—Б–µ – 7500 –∞–љ—В–Є–X–∞ –Х–Ф 2 —А–∞–Ј–∞ –≤ —Б—Г—В [33]. –Ю—З–µ–≤–Є–і–љ–Њ, –≤ —Б—Г—Й–µ—Б—В–≤—Г—О—Й–µ–є —Б–Є—В—Г–∞—Ж–Є–Є —А–µ—И–µ–љ–Є–µ –Њ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Э–Ь–У –Є –µ–≥–Њ –і–Њ–Ј–µ –і–Њ–ї–ґ–љ–Њ –њ—А–Є–љ–Є–Љ–∞—В—М—Б—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ —Б —Г—З–µ—В–Њ–Љ –Њ–ґ–Є–і–∞–µ–Љ–Њ–є –њ–Њ–ї—М–Ј—Л –Є —А–Є—Б–Ї–∞ –Њ—В –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П.
–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П —Г –±–Њ–ї—М–љ—Л—Е –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –≤ –Њ—Б—В—А—Г—О —Д–∞–Ј—Г –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —Б–Њ—З–µ—В–∞–љ–Є–µ –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л —Б –±–Њ–ї–µ–µ –∞–Ї—В–Є–≤–љ—Л–Љ–Є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л–Љ–Є –∞–≥–µ–љ—В–∞–Љ–Є – –±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤–Њ–≥–Њ —А–µ—Ж–µ–њ—В–Њ—А–∞ IIb/IIIa [4,5]. –°—В–∞–љ–і–∞—А—В–љ—Л–Љ –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ–Љ –Ї —Н—В–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О —П–≤–ї—П–µ—В—Б—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–∞—П –Є–љ—Д—Г–Ј–Є—П –Э–§–У. –•–Њ—В—П —Б–≤–µ–і–µ–љ–Є—П –Њ–± –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Э–Ь–У –≤ –і–∞–љ–љ–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є –њ–Њ–Ї–∞ –љ–µ–Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л, –µ–≥–Њ –і–Њ–±–∞–≤–ї–µ–љ–Є–µ –Ї –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–µ –Є –±–ї–Њ–Ї–∞—В–Њ—А—Г –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤–Њ–≥–Њ —А–µ—Ж–µ–њ—В–Њ—А–∞ IIb/IIIa –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –Ї–∞–Ї –њ—А–Є –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–Њ–Љ, —В–∞–Ї –Є –Є–љ–≤–∞–Ј–Є–≤–љ–Њ–Љ –њ–Њ–і—Е–Њ–і–∞—Е –Ї –ї–µ—З–µ–љ–Є—О –±–Њ–ї—М–љ—Л—Е (–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е GUSTO IV–ACS, NICE 3, ACUTE II –Њ—Ж–µ–љ–µ–љ–Њ —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –і–∞–ї—М—В–µ–њ–∞—А–Є–љ–∞ —Б –∞–±—Ж–Є–Ї—Б–Є–Љ–∞–±–Њ–Љ, —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞ – —Б –∞–±—Ж–Є–Ї—Б–Є–Љ–∞–±–Њ–Љ, —В–Є—А–Њ—Д–Є–±–∞–љ–Њ–Љ –Є —Н–њ—В–Є—Д–Є–±–∞—В–Є–і–Њ–Љ). –Х—Б—В—М —В–∞–Ї–ґ–µ –Њ—Б–љ–Њ–≤–∞–љ–Є—П –љ–∞–і–µ–µ—П—В—М—Б—П, —З—В–Њ –Є –Ј–і–µ—Б—М –Э–Ь–У –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј–∞—В—М—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–µ–µ –Э–§–У. –Ю–ґ–Є–і–∞—О—В—Б—П —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П INTERACT, –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ A to Z, –≤ –Ї–Њ—В–Њ—А—Л—Е —Б–Њ–њ–Њ—Б—В–∞–≤–ї—П—О—В—Б—П —Б–Њ—З–µ—В–∞–љ–Є—П —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞ –Є –Э–§–У —Б —В–Є—А–Њ—Д–Є–±–∞–љ–Њ–Љ –Є —Н–њ—В–Є—Д–Є–±–∞—В–Є–і–Њ–Љ. –°—А–∞–≤–љ–µ–љ–Є–µ —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞ –Є –Э–§–У –њ—А–Є —А–∞–љ–љ–µ–Љ –Є–љ–≤–∞–Ј–Є–≤–љ–Њ–Љ –њ–Њ–і—Е–Њ–і–µ –Ї –ї–µ—З–µ–љ–Є—О –±–Њ–ї—М–љ—Л—Е –Ю–Ъ–° –±–µ–Ј –њ–Њ–і—К–µ–Љ–Њ–≤ —Б–µ–≥–Љ–µ–љ—В–∞ ST —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤–Њ–≥–Њ —А–µ—Ж–µ–њ—В–Њ—А–∞ IIb/IIIa –Є –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї—П –њ—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –І–†–Ь –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–µ—И–µ–љ–Є–µ–Љ –ї–µ—З–∞—Й–µ–≥–Њ –≤—А–∞—З–∞ –њ—А–Њ–≤–Њ–і–Є—В—Б—П –≤ –Ї—А—Г–њ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SYNERGY.
–Э–µ–і–∞–≤–љ–Њ –њ–Њ—П–≤–Є–ї–Є—Б—М –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ —Г–≤–µ–ї–Є—З–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –Ю–Ъ–° –±–µ–Ј —Б—В–Њ–є–Ї–Є—Е –њ–Њ–і—К–µ–Љ–Њ–≤ —Б–µ–≥–Љ–µ–љ—В–∞ ST –њ—А–Є –і–Њ–±–∞–≤–ї–µ–љ–Є–Є –Ї –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–µ –њ—А–µ–њ–∞—А–∞—В–∞ —Б –і—А—Г–≥–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П – –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї—П (–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ CURE, 12 562 –±–Њ–ї—М–љ—Л—Е2). –° –њ–µ—А–≤—Л—Е 24 —З –њ–Њ—Б–ї–µ –њ–Њ—П–≤–ї–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Њ–±–Њ—Б—В—А–µ–љ–Є—П –Ш–С–° –≤ –і–Њ–±–∞–≤–ї–µ–љ–Є–µ –Ї –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–µ –љ–∞–Ј–љ–∞—З–∞–ї—Б—П –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї—М (–њ–µ—А–≤–∞—П –і–Њ–Ј–∞ 300 –Љ–≥, –і–∞–ї–µ–µ 75 –Љ–≥/—Б—Г—В) –Є 56% –±–Њ–ї—М–љ—Л—Е –њ–Њ–ї—Г—З–∞–ї–Њ –Э–Ь–У. –Ю–± –Њ–њ–∞—Б–љ–Њ—Б—В–Є —В–∞–Ї–Њ–≥–Њ —Б–Њ—З–µ—В–∞–љ–Є—П –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –∞–≥–µ–љ—В–Њ–≤ –љ–µ —Б–Њ–Њ–±—Й–∞–ї–Њ—Б—М.
–Э–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –≥–µ–њ–∞—А–Є–љ—Л –Є —З—А–µ—Б–Ї–Њ–ґ–љ–∞—П —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞
–®–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Э–Ь–У –њ—А–Є —З—А–µ—Б–Ї–Њ–ґ–љ–Њ–є —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ (–І–†–Ь) (–±–∞–ї–ї–Њ–љ–љ–∞—П –∞–љ–≥–Є–Њ–њ–ї–∞—Б—В–Є–Ї–∞, —Б—В–µ–љ—В–Є—А–Њ–≤–∞–љ–Є–µ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є –Є –і—А.) —Б–і–µ—А–ґ–Є–≤–∞–µ—В—Б—П –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –ї–µ–≥–Ї–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М –Є—Е –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –≤ –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Є –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ –і–∞–љ–љ—Л—Е –Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Э–Ь–У –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Є–љ–≤–∞–Ј–Є–≤–љ—Л–Љ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ–Љ, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ —Б–Є—В—Г–∞—Ж–Є—П—Е, –Ї–Њ–≥–і–∞ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤–Њ–≥–Њ —А–µ—Ж–µ–њ—В–Њ—А–∞ IIb/IIIa [3,9]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–Є –І–†–Ь —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –Э–§–У –њ–Њ–і –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є [9]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –Њ—В–Љ–µ—З–∞—О—В, —З—В–Њ –Э–§–У –љ–µ —П–≤–ї—П–µ—В—Б—П –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–Љ –і–ї—П –І–†–Ь –Є –µ–≥–Њ —И–Є—А–Њ–Ї–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б—В–∞–ї–Њ —Б—В–∞–љ–і–∞—А—В–Њ–Љ –Є–Ј––Ј–∞ –Њ—В—Б—Г—В—Б—В–≤–Є—П –∞–ї—М—В–µ—А–љ–∞—В–Є–≤—Л3.
–Э–∞—А—П–і—Г —Б —Н—В–Є–Љ –љ–∞–Ї–∞–њ–ї–Є–≤–∞—О—В—Б—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–∞ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –І–†–Ь –љ–∞ —Д–Њ–љ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Э–Ь–У –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Ї–Њ–∞–≥—Г–ї–Њ –≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П. –Э–∞ –љ–µ–±–Њ–ї—М—И–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –±–Њ–ї—М–љ—Л—Е –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –і–Њ—Б—В–Є–≥–љ—Г—В—М –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ —Б—В–∞–±–Є–ї—М–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є –њ—А–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–Љ –±–Њ–ї—О—Б–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –Є –њ–Њ–і–Ї–Њ–ґ–љ—Л—Е –Є–љ—К–µ–Ї—Ж–Є—П—Е –Э–Ь–У, –∞ —В–∞–Ї–ґ–µ –њ—А–Є–µ–Љ–ї–µ–Љ–Њ–є —З–∞—Б—В–Њ—В—Л —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ —З—А–µ—Б–Ї–Њ–ґ–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞, —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–Њ–є —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Э–§–У. –С—Л–ї–Є –Є–Ј—Г—З–µ–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ –і–Њ–Ј—Л –Э–Ь–У: —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ –њ–Њ–і–Ї–Њ–ґ–љ–Њ 1 –Љ–≥/–Ї–≥ –Ј–∞ 2–8 —З –і–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ (–Ї–Њ—В–Њ—А–Њ–Љ—Г –њ—А–µ–і—И–µ—Б—В–≤–Њ–≤–∞–ї–Њ –≤–≤–µ–і–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –і–Њ–Ј–µ 1 –Љ–≥/–Ї–≥ –Ї–∞–ґ–і—Л–µ 12 —З –љ–µ –Љ–µ–љ–µ–µ 2–—Е —Б—Г—В) [35], —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ –њ–Њ–і–Ї–Њ–ґ–љ–Њ 1 –Љ–≥/–Ї–≥ –Ј–∞ 8–12 —З –і–Њ –≤–љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ —Б –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–Љ –≤–≤–µ–і–µ–љ–Є–µ–Љ 0,3 –Љ–≥/–Ї–≥ –њ–µ—А–µ–і –љ–∞—З–∞–ї–Њ–Љ –І–†–Ь [36], –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–є –±–Њ–ї—О—Б —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞ 1 –Љ–≥/–Ї–≥ –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–µ—А–µ–і –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ–Љ [37,38], 7000 –Х–Ф —А–µ–≤–Є–њ–∞—А–Є–љ–∞ –њ–µ—А–µ–і –∞–љ–≥–Є–Њ–њ–ї–∞—Б—В–Є–Ї–Њ–є —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –Є–љ—Д—Г–Ј–Є–µ–є 10500 –Х–Ф –≤ —В–µ—З–µ–љ–Є–µ 24 —З [39]. –Т –њ–Њ—Б–ї–µ–і–љ–µ–Љ —Б–ї—Г—З–∞–µ —Г –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —А–µ–≤–Є–њ–∞—А–Є–љ –≤ –±–ї–Є–ґ–∞–є—И–Є–µ 24 —З –±—Л–ї–Њ –Љ–µ–љ—М—И–µ –Њ—Б—В—А—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–є –Є–љ—Д—Г–Ј–Є–µ–є –Э–§–У [39]. –≠—В–Њ—В —А–µ–Ј—Г–ї—М—В–∞—В –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–∞–і–µ—П—В—М—Б—П, —З—В–Њ –њ—А–Є –І–†–Ь –Э–Ь–У –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј–∞—В—М—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–µ–µ –Э–§–У. –£ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –±–Њ–ї–µ–µ –∞–Ї—В–Є–≤–љ–Њ–µ –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ (–љ–µ –Љ–µ–љ–µ–µ, —З–µ–Љ –≤ —В–µ—З–µ–љ–Є–µ 3–—Е —Б—Г—В –і–Њ –њ—А–Њ—Ж–µ–і—Г—А—Л –≤ –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–µ –љ–∞–Ј–љ–∞—З–∞–ї—Б—П —В–Є–Ї–ї–Њ–њ–Є–і–Є–љ –≤ –і–Њ–Ј–µ 250 –Љ–≥ 2 —А–∞–Ј–∞ –≤ —Б—Г—В), –Є—Б—Е–Њ–і—Л –І–†–Ь –љ–∞ —Д–Њ–љ–µ –≤–≤–µ–і–µ–љ–Є—П –Э–§–У –Є —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞ (1 –Љ–≥/–Ї–≥ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –њ–µ—А–µ–і –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ–Љ), –±—Л–ї–Є –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–Љ–Є [40]. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≤ —В–Њ–є –ґ–µ —Б–Є—В—Г–∞—Ж–Є–Є –і–∞–ї—М—В–µ–њ–∞—А–Є–љ–∞ (–≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ 120 –∞–љ—В–Є––•–∞ –Х–Ф/–Ї–≥, –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ – 10000 –∞–љ—В–Є––•–∞ –Х–і/–Ї–≥) –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –љ–µ —Б—В–Њ–ї—М –Њ–±–љ–∞–і–µ–ґ–Є–≤–∞—О—Й–Є–Љ: –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ –≤–≤–µ–і–µ–љ–Є–µ–Љ –Э–§–У –≤ –≥—А—Г–њ–њ–µ –і–∞–ї—М—В–µ–њ–∞—А–Є–љ–∞ –±—Л–ї–Њ –±–Њ–ї—М—И–µ –Љ–∞–ї—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є –њ–Њ—Б–ї–µ –І–†–Ь —З–∞—Й–µ –њ–Њ–≤—Л—И–∞–ї–Є—Б—М —Г—А–Њ–≤–љ–Є –Љ–∞—А–Ї–µ—А–Њ–≤ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞ [41]. –Я—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞ (–Ъ–ї–µ–Ї—Б–∞–љ–∞) (–Њ—В 30 –і–Њ 60 –Љ–≥ –њ–Њ–і–Ї–Њ–ґ–љ–Њ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–µ—Б–∞ –і–≤–∞–ґ–і—Л –≤ —Б—Г—В), –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є –Є —В–Є–Ї–ї–Њ–њ–Є–і–Є–љ–Њ–Љ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 30 –і–љ–µ–є –њ–Њ—Б–ї–µ —Б—В–µ–љ—В–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є (–њ–µ—А–≤–∞—П –Є–љ—К–µ–Ї—Ж–Є—П —З–µ—А–µ–Ј 2 —З –њ–Њ—Б–ї–µ –њ—А–Њ—Ж–µ–і—Г—А—Л) –Њ—В–Љ–µ—З–µ–љ–∞ –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–∞—П —З–∞—Б—В–Њ—В–∞ —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –≤ —Н—В–Є –ґ–µ —Б—А–Њ–Ї–Є —Б–Њ—З–µ—В–∞–љ–Є—П –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –і–Є–њ–Є—А–Є–і–∞–Љ–Њ–ї–∞ –Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–є –Є–љ—Д—Г–Ј–Є–Є –Э–§–У —Б –њ–µ—А–µ—Е–Њ–і–Њ–Љ –љ–∞ –љ–µ–њ—А—П–Љ—Л–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л [42] (–њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Н—В–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–µ—Б—М–Љ–∞ –Њ–≥—А–∞–љ–Є—З–µ–љ–Њ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ–Њ—З—В–Є –≤—Б–µ –±–Њ–ї—М–љ—Л–µ, –њ–Њ–і–≤–µ—А–≥–љ—Г—В—Л–µ —Б—В–µ–љ—В–Є—А–Њ–≤–∞–љ–Є—О, –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і—Г—О—Й–Є—Е 2–4 –љ–µ–і –њ–Њ–ї—Г—З–∞—О—В —Б–Њ—З–µ—В–∞–љ–Є–µ –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л —Б —В–Є–Ї–ї–Њ–њ–Є–і–Є–љ–Њ–Љ –Є–ї–Є –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї–µ–Љ). –¶–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –і–Њ–±–∞–≤–ї–µ–љ–Є—П —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞ –Ї —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ—Г –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–Љ—Г —А–µ–ґ–Є–Љ—Г —Г –±–Њ–ї—М–љ—Л—Е —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —В—А–Њ–Љ–±–Њ–Ј–∞ –њ—А–Є —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є–Є –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є –љ–∞ –±–Њ–ї—М—И–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –±–Њ–ї—М–љ—Л—Е –Є–Ј—Г—З–∞–µ—В—Б—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є ATLAST.
–°–Њ—З–µ—В–∞–љ–Є–µ –Э–Ь–У —Б –±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤–Њ–≥–Њ —А–µ—Ж–µ–њ—В–Њ—А–∞ IIb/IIIa, –Ї–Њ—В–Њ—А—Л–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –њ—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –∞–љ–≥–Є–Њ–њ–ї–∞—Б—В–Є–Ї–Є/—Б—В–µ–љ—В–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ [6], —В–∞–Ї–ґ–µ –Ї–∞–ґ–µ—В—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ [38,43–45, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ NICE 34]. –Я—А–Є —Н—В–Њ–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є—П —З–Є—Б–ї–∞ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Э–§–У –љ–µ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –Є –≤ —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –≤ –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–µ –і–Њ –∞–љ–≥–Є–Њ–њ–ї–∞—Б—В–Є–Ї–Є –љ–∞–Ј–љ–∞—З–∞–ї–Є —В–Є–Ї–ї–Њ–њ–Є–і–Є–љ [46].
–Р–Ї—В–Є–≤–љ–Њ–µ –Є–Ј—Г—З–µ–љ–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Э–Ь–У –њ—А–Є —З—А–µ—Б–Ї–Њ–ґ–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞—Е –љ–∞ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є—П—Е –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П, –Є –Љ–Њ–ґ–љ–Њ –Њ–ґ–Є–і–∞—В—М, —З—В–Њ –њ–Њ—Б–ї–µ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П –Њ—В–Љ–µ—З–µ–љ–љ—Л—Е –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ—Б—В–µ–є –≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Ї—А—Г–њ–љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є, –њ—А–µ–і–њ–Є—Б—Л–≤–∞—О—Й–Є–µ –≤ —Н—В–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є –њ—А–µ–і–њ–Њ—З–µ—Б—В—М –Э–§–У, –±—Г–і—Г—В –њ–µ—А–µ—Б–Љ–Њ—В—А–µ–љ—Л. –Я–µ—А–≤—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Э–Ь–У –њ—А–Є –І–†–Ь —Г–ґ–µ –њ–Њ—П–≤–Є–ї–Є—Б—М5. –£–ґ–µ —Б–µ–є—З–∞—Б –Љ–љ–Њ–≥–Є–µ —Н–Ї—Б–њ–µ—А—В—Л –њ–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –ї–µ—З–µ–љ–Є–µ –Ю–Ъ–° –±–µ–Ј –њ–Њ–і—К–µ–Љ–Њ–≤ —Б–µ–≥–Љ–µ–љ—В–∞ ST –Э–Ь–У (—Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–Њ–Љ) –љ–µ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–њ—П—В—Б—В–≤–Є–µ–Љ –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –І–†–Ь, –Ї–Њ—В–Њ—А—Г—О –Љ–Њ–ґ–љ–Њ –≤—Л–њ–Њ–ї–љ—П—В—М, –љ–µ –њ—А–µ—А—Л–≤–∞—П –≤–≤–µ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞; –≤ —Б–ї—Г—З–∞—П—Е –Њ—З–µ–љ—М —А–∞–љ–љ–µ–≥–Њ —З—А–µ—Б–Ї–Њ–ґ–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞, –≤—Л–њ–Њ–ї–љ—П–µ–Љ–Њ–≥–Њ –≤ –њ–µ—А–≤—Л–µ —З–∞—Б—Л –њ–Њ—Б–ї–µ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А, –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤–≤–µ—Б—В–Є —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ (–Ъ–ї–µ–Ї—Б–∞–љ) –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–µ—А–µ–і –љ–∞—З–∞–ї–Њ–Љ –њ—А–Њ—Ж–µ–і—Г—А—Л (–≤ –і–Њ–Ј–µ 0,75 –Є 1,0 –Љ–≥/–Ї–≥ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —В–Њ–≥–Њ, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –Є–љ—Д—Г–Ј–Є—П –±–ї–Њ–Ї–∞—В–Њ—А–∞ –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤–Њ–≥–Њ —А–µ—Ж–µ—Ж–њ—В–Њ—А–∞ IIb/IIIa –Є–ї–Є –љ–µ—В) [35].
–° —Г—З–µ—В–Њ–Љ –њ—А–Њ—Б—В–Њ—В—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Э–Ь–У –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј–∞—В—М—Б—П –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–Љ–Є, –Ї–Њ–≥–і–∞ –њ–Њ—Б–ї–µ —З—А–µ—Б–Ї–Њ–ґ–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–љ—В–Є—В—А–Њ–Љ–±–Є–љ–Њ–≤–Њ–≥–Њ –∞–≥–µ–љ—В–∞ (—Б–Њ—Е—А–∞–љ—П—О—Й–Є–є—Б—П —В—А–Њ–Љ–± –≤ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–є –∞—А—В–µ—А–Є–Є, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–∞—П –і–Є—Б—Б–µ–Ї—Ж–Є—П –Є–љ—В–Є–Љ—Л) [9].
–Я—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є—П –Њ —В–Њ–Љ, —З—В–Њ –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –Э–Ь–У –Љ–Њ–ґ–µ—В —Г–Љ–µ–љ—М—И–Є—В—М —З–∞—Б—В–Њ—В—Г —А–µ—Б—В–µ–љ–Њ–Ј–Њ–≤ –њ–Њ—Б–ї–µ –њ—А–Њ—Ж–µ–і—Г—А –∞–љ–≥–Є–Њ–њ–ї–∞—Б—В–Є–Ї–Є, –љ–µ –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В—Б—П [1]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –њ–Њ—П–≤–Є–ї–Є—Б—М —Б–Њ–Њ–±—Й–µ–љ–Є—П –Њ –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–Љ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є –љ–µ–Њ–Є–љ—В–Є–Љ—Л –њ–Њ—Б–ї–µ —Г—Б—В–∞–љ–Њ–≤–Ї–Є –≤–љ—Г—В—А–Є—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –њ—А–Њ—В–µ–Ј–∞ (—Б—В–µ–љ—В–∞) –≤ —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤—Г –њ—А–µ–і—И–µ—Б—В–≤–Њ–≤–∞–ї–Њ –Є–љ—В—А–∞–Љ—Г—А–∞–ї—М–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ–∞ [47]. –Я—А–Є –ї–Њ–Ї–∞–ї—М–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –љ–∞–і—А–Њ–њ–∞—А–Є–љ–∞ –≤ –њ—А–Њ—Б–≤–µ—В –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–є –∞—А—В–µ—А–Є–Є –њ–Њ—Б–ї–µ —Г—Б—В–∞–љ–Њ–≤–Ї–Є —Б—В–µ–љ—В–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Њ—В–Љ–µ—З–µ–љ–Њ –љ–µ –±—Л–ї–Њ [49]
–Э–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –≥–µ–њ–∞—А–Є–љ—Л –Є –Њ–њ–µ—А–∞—Ж–Є—П —И—Г–љ—В–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є
–Т –Ї—А—Г–њ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Э–Ь–У —Г –±–Њ–ї—М–љ—Л—Е —Б –Ю–Ъ–° –±–µ–Ј —Б—В–Њ–є–Ї–Є—Е –њ–Њ–і—К–µ–Љ–Њ–≤ —Б–µ–≥–Љ–µ–љ—В–∞ ST –≤–≤–µ–і–µ–љ–Є–µ –≤—Л—Б–Њ–Ї–Њ–є –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–µ–Ї—А–∞—Й–∞–ї–Є –Ј–∞ 12 —З –і–Њ –Њ–њ–µ—А–∞—Ж–Є–Є —И—Г–љ—В–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є [31,49]. –Я–Њ–Ј–і–љ–µ–µ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є –Њ—В–Љ–µ–љ–µ –Э–Ь–У –±–Њ–ї–µ–µ —З–µ–Љ –Ј–∞ 12 —З –і–Њ –Њ–њ–µ—А–∞—Ж–Є–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –њ–µ—А–Є–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П, –Њ–і–љ–∞–Ї–Њ –љ–µ –Є—Б–Ї–ї—О—З–µ–љ–Њ, —З—В–Њ —Г –±–Њ–ї—М–љ—Л—Е —Б –љ–µ–і–∞–≤–љ–Є–Љ –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ –Ш–С–° —Н—В–Њ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О —А–Є—Б–Ї–∞ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е —Б–Њ–±—Л—В–Є–є –≤ –њ–µ—А–Є–Њ–і —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≥–µ–њ–∞—А–Є–љ–∞ [50].
–Ъ–∞–Ї –Є –њ—А–Є –і—А—Г–≥–Є—Е –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞—Е –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–µ –і–Њ–Ј—Л –Э–Ь–У –Љ–Њ–≥—Г—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –і–ї—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –њ–µ—А–Є–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞ –≤–µ–љ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –Є –Ґ–≠–Ы–Р –≤ –њ–µ—А–Є–Њ–і —Б–Њ–±–ї—О–і–µ–љ–Є—П –њ–Њ—Б—В–µ–ї—М–љ–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞.
–Э–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –≥–µ–њ–∞—А–Є–љ—Л –њ—А–Є –Љ–µ—А—Ж–∞—В–µ–ї—М–љ–Њ–є –∞—А–Є—В–Љ–Є–Є/ —В—А–µ–њ–µ—В–∞–љ–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є
–Я—А–Є –Љ–µ—А—Ж–∞—В–µ–ї—М–љ–Њ–є –∞—А–Є—В–Љ–Є–Є/—В—А–µ–њ–µ—В–∞–љ–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ –≥–µ–њ–∞—А–Є–љ–µ –Њ–±—Л—З–љ–Њ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤ –њ–µ—А–Є–Њ–і –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–Є –Ї –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞. –Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П —Г –±–Њ–ї—М–љ—Л—Е —Б –Ј–∞—В—П–ґ–љ—Л–Љ (–і–ї—П—Й–Є–Љ—Б—П –±–Њ–ї–µ–µ 48 —З) –њ–∞—А–Њ–Ї—Б–Є–Ј–Љ–Њ–Љ –≤—Б–µ —И–Є—А–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П —В–∞–Ї—В–Є–Ї–∞ –ї–µ—З–µ–љ–Є—П, –Њ—Б–љ–Њ–≤–∞–љ–љ–∞—П –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е —З—А–µ—Б–њ–Є—Й–µ–≤–Њ–і–љ–Њ–≥–Њ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–µ—А–і—Ж–∞. –Я—А–Є —Н—В–Њ–Љ –њ–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –≤ —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ —В—А–Њ–Љ–±–∞ –≤ –ї–µ–≤–Њ–Љ –њ—А–µ–і—Б–µ—А–і–Є–Є –≤—Л—П–≤–Є—В—М –љ–µ —Г–і–∞–µ—В—Б—П, –Ї–∞—А–і–Є–Њ–≤–µ—А—Б–Є—О –Љ–Њ–ґ–љ–Њ –њ—А–Њ–≤–Њ–і–Є—В—М –±–µ–Ј –і–ї–Є—В–µ–ї—М–љ–Њ–є (–љ–µ –Љ–µ–љ–µ–µ 3 –љ–µ–і) –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–Є –љ–µ–њ—А—П–Љ—Л–Љ–Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞–Љ–Є [9,10]. –Я—А–µ–і–ї–∞–≥–∞—О—В –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –љ–∞—З–∞—В—М –≤–≤–µ–і–µ–љ–Є–µ –≥–µ–њ–∞—А–Є–љ–∞ –Є –њ—А–Є–µ–Љ –љ–µ–њ—А—П–Љ—Л—Е –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ –≤–љ—Г—В—А—М, –њ—А–Њ–≤–µ—Б—В–Є –Ї–∞—А–і–Є–Њ–≤–µ—А—Б–Є—О –Є –Њ—В–Љ–µ–љ–Є—В—М –≥–µ–њ–∞—А–Є–љ —З–µ—А–µ–Ј –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –і–љ–µ–є, –Ї–Њ–≥–і–∞ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–µ –љ–Њ—А–Љ–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–µ –Њ—В–љ–Њ—И–µ–љ–Є–µ —Б—В–Њ–є–Ї–Њ –і–Њ—Б—В–Є–≥–љ–µ—В 2,5±0,5 (–і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –љ–µ–њ—А—П–Љ—Л—Е –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П—В–љ–Њ–≤ –і–Њ–ї–ґ–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П—В—М –љ–µ –Љ–µ–љ–µ–µ 4–—Е –љ–µ–і). –Т –і–∞–љ–љ–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є –Э–Ь–У –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П —Е–Њ—А–Њ—И–µ–є –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–Њ–є –Э–§–У [51].
–Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Э–Ь–У –њ—А–Є —Г–Ї–∞–Ј–∞–љ–љ–Њ–є —В–∞–Ї—В–Є–Ї–µ –ї–µ—З–µ–љ–Є—П –±—Л–ї–∞ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –≤ –љ–µ–±–Њ–ї—М—И–Є—Е –љ–µ—Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б –і–∞–ї—М—В–µ–њ–∞—А–Є–љ–Њ–Љ (–≤ –і–Њ–Ј–µ 100 –∞–љ—В–Є––•–∞ –Х–Ф/–Ї–≥, –љ–Њ –љ–µ –≤—Л—И–µ 10000 –∞–љ—В–Є––•–∞ –Х–Ф, –њ–Њ–і–Ї–Њ–ґ–љ–Њ 2 —А–∞–Ј–∞ –≤ —Б—Г—В) [52,53]. –Х—Б—В—М –≤—Б–µ –Њ—Б–љ–Њ–≤–∞–љ–Є—П –љ–∞–і–µ—П—В—М—Б—П, —З—В–Њ —Н—В–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ –±—Г–і—Г—В —З–µ—А–µ–Ј –љ–µ–Ї–Њ—В–Њ—А–Њ–µ –≤—А–µ–Љ—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ—Л –≤ –±–Њ–ї–µ–µ –Ї—А—Г–њ–љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –і–ї—П —А–∞–Ј–ї–Є—З–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Э–Ь–У.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Т —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Э–§–У –Э–Ь–У –Њ–±–ї–∞–і–∞—О—В —А—П–і–Њ–Љ –љ–µ—Б–Њ–Љ–љ–µ–љ–љ—Л—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤, –Ї –Ї–Њ—В–Њ—А—Л–Љ, –њ–Њ–Љ–Є–Љ–Њ –њ—А–Њ—Б—В–Њ—В—Л –≤–≤–µ–і–µ–љ–Є—П –Є –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П, –Њ—В–љ–Њ—Б–Є—В—Б—П –±–Њ–ї–µ–µ —Б—В–∞–±–Є–ї—М–љ–Њ–µ, –њ—А–µ–і—Б–Ї–∞–Ј—Г–µ–Љ–Њ–µ, —Г—Б—В–Њ–є—З–Є–≤–Њ–µ –Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ.
–Я—А–Є –Ш–С–° –љ–∞–Є–±–Њ–ї–µ–µ —Е–Њ—А–Њ—И–Њ –Є–Ј—Г—З–µ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Э–Ь–У –≤ —А–∞–љ–љ–µ–Љ –ї–µ—З–µ–љ–Є–Є –љ–µ—Б—В–∞–±–Є–ї—М–љ–Њ–є —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–Є –Є –Ш–Ь –±–µ–Ј –њ–Њ–і—К–µ–Љ–Њ–≤ —Б–µ–≥–Љ–µ–љ—В–∞ ST –љ–∞ –≠–Ъ–У. –£ –±–Њ–ї—М–љ—Л—Е —Б —Н—В–Њ–є —Д–Њ—А–Љ–Њ–є –Њ–±–Њ—Б—В—А–µ–љ–Є—П –Ш–С–° –і–Њ–Ї–∞–Ј–∞–љ–∞ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –і–Њ–±–∞–≤–ї–µ–љ–Є—П –Э–Ь–У –Ї –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–µ. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–є –Є–љ—Д—Г–Ј–Є–µ–є –Э–§–У –Э–Ь–У (–љ–∞–і—А–Њ–њ–∞—А–Є–љ –Є –і–∞–ї—М—В–µ–њ–∞—А–Є–љ), –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ, —Б—В–Њ–ї—М –ґ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –Є –±–µ–Ј–Њ–њ–∞—Б–љ—Л, —Н–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ –Њ–±–ї–∞–і–∞–µ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞–Љ–Є –њ–µ—А–µ–і –Э–§–У. –Х—Б—В—М —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–∞ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Э–Ь–У —Г –±–Њ–ї—М–љ—Л—Е –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞.
–Э–∞–Ї–∞–њ–ї–Є–≤–∞—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ–± –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Э–Ь–У –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —В—А–Њ–Љ–±–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–µ–є –њ—А–Є –Њ—Б—В—А–Њ–Љ –Ш–Ь, —Б –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–є –Є–љ—Д—Г–Ј–Є–µ–є –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤–Њ–≥–Њ —А–µ—Ж–µ–њ—В–Њ—А–∞ IIb/IIIa, –≤–Њ –≤—А–µ–Љ—П –њ—А–Њ—Ж–µ–і—Г—А —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞, –њ–µ—А–µ–і –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ–Љ —Б–Є–љ—Г—Б–Њ–≤–Њ–≥–Њ —А–Є—В–Љ–∞ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ–∞—А–Њ–Ї—Б–Є–Ј–Љ–µ –Љ–µ—А—Ж–∞—В–µ–ї—М–љ–Њ–є –∞—А–Є—В–Љ–Є–Є/—В—А–µ–њ–µ—В–∞–љ–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є. –Т —Н—В–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є—В—Г–∞—Ж–Є—П—Е –Э–Ь–У —В–∞–Ї–ґ–µ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В—Б—П —Е–Њ—А–Њ—И–µ–є –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–Њ–є –Э–§–У.
–°–њ–Є—Б–Њ–Ї –ї–Є—В–µ—А–∞—В—Г—А—Л –Т—Л –Љ–Њ–ґ–µ—В–µ –љ–∞–є—В–Є –љ–∞ —Б–∞–є—В–µ http://www.rmj.ru
–≠–љ–Њ–Ї—Б–∞–њ–∞—А–Є–љ –љ–∞—В—А–Є–є –
–Ъ–ї–µ–Ї—Б–∞–љ (—В–Њ—А–≥–Њ–≤–Њ–µ –љ–∞–Ј–≤–∞–љ–Є–µ)
(Aventis Pharma)
1. E. Antman, R. Handin. Low–Molecular–Weight Heparins. An Intriguing New Twist With Profound Implications. Circulation 1998; 98: 287–289.
2. J. Hirsh, S. Anand, J. Halperin, V. Fuster. Guide to Anticoagulant Therapy: Heparin. A Statement for Healthcare Professionals From the American Heart Association. Circulation 2001; 103: 2994–3018.
3. U. Cornelli, J. Fareed. Human Pharmacokinetics of Low Molecular Weight Heparins. Sem Thormb Hemost 1999; 25 (suppl. 3): 57–61.
4. ACC/AHA Guidelines for the Management of Patients With Unstable Angina and Non–ST–Segment Elevation Myocardial Infarction. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on the Management of Patients With Unstable Angina). JACC 2000; 36: 970–1062.
5. Management of acute coronary syndromes: acute coronary syndromes without persistent ST segment elevation. Recommendations of the Task Force of the European Society of Cardiology. Eur Heart J 2000; 21: 1406–1432.
6. J. Cairns, P. Theroux, H. Lewis et al. Antithrombotic Agents in Coronary Artery Disease. In: Sixth ACCP Consensus Conference on Antithrombotic Therapy. Chest 2001; 119 (suppl.): 228S–252S.
7. ACC/AHA/ACP–ASIM Guidelines for the Management of Patients With Chronic Stable Angina. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Management of Patients With Chronic Stable Angina). JACC 1999; 33: 2092–2197.
8. ACC/AHA Guidelines for the Management of Patients With Acute Myocardial Infarction. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Management of Acute Myocardial Infarction). Web Version.
9. ACC/AHA Guidelines for Percutaneous Coronary Intervention (Revision of the 1993 PTCA Guidelines). A Report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines (Committee to Revise the 1993 Guidelines for Percutaneous Transluminal Coronary Angioplasty). JACC 2001; 37: 2239i–2239lxvi.
10. S. Levy, G. Breithardt, R. Campbell et al. on behalf of the Working Group on Arrhythmias of the European Society of Cardiology. Atrial fibrillation: current knowledge and recommendations for management. Eur Heart J 1998; 19: 1294–1320.
11. G. Albers, J. Dalen, A. Laupacis et. al. Antithrombotic Therapy in Atrial Fibrillation. Chest 2001; 119: 194S–206S.
12. G. Frostfeldt, G. Ahlberg, G. Gustafsson et al. Low Molecular Weight Heparin (Dalteparin) as Adjuvant Treatment to Thrombolysis in Acute Myocardial Infarction – A Pilot Study: Biochemical Markers of Acute Coronary Syndromes (BIOMACS II). JACC 1999; 33: 627–633.
13. F. Kontny, J. Dale, U. Abildgaard et al. Randomized trial of low molecular weight heparin (dalteparin) in prevention of left ventricular thrombus formation and arterial embolism after acute anterior myocardial infarction: the Fragmin in Acute Myocardial Infarction (FRAMI) Study. JACC 1997; 39: 962–969.
14. S. Baird, S. McBride, T. Trouton, C. Wilson. Low Molecular Weight Heparin Versus Unfractionated Heparin Following Thrombolysis in Myocardial Infarction. JACC 1998; 31 (suppl. 2A): 191A.
15. A. Glick, R. Kornowski, Y. Michowich et al. Reduction of reinfarction and angina with use of low–molecular–weight heparin therapy after streptokinase (and heparin) in acute myocardial infarction. Am J Cardiol 1996; 77: 1145–1148.
16. A. Ross, P. Molhoek, C. Lundergan et al. Randomized Comparison of Enoxaparin Low–Molecular–Weight Heparin With Unfractionated Hepfrin Adjunctive to Recombinant Tissue Plasminogen Activator Thrombolysis and Aspirin Second Trial of Hepfrin and Aspirin Reperfusion Therapy (HART II). Circulation 2001; 104: 648–652.
17. I. Menown, S. Baird, S. McBride et al. Evaluation of low–molecular–weight heparin in patients receiving fibrinolytic therapy for myocardial infarction. Eur Heart J 2000; 21 (abstr. suppl.): 599.
18. L. Wallentin, D. Dellborg, B. Nilsson et al. The Low–Molecular–Weight Heparin Dalteparin as Adjuvant Therapy in Acute Myocardial Infarction: the ASSENT PLUS study. Clin Cardiol 2001; 24 (suppl. I): I–12–14.
19. G. Tatu–Chitoiu, M. Oprisan, O. Cismara et al. Accelerated streptokinase (0.75 MU in 10 minutes) and enoxaparin in the prehospital management of acute myocardial infarction. Eur Heart J 1999; 20 (abstr. suppl.): 517.
20. V. Kakkar, S. Iyengar, F. De Lorenzo et al. Low molecular weight heparin for treatment of acute myocardial infarction (FAMI). Indian Heart J 2000; 52: 533–539.
21. M. Cohen, F. Maritz, G, Gensini et al. The TETAMI trial: the safety and efficacy of subcutaneous enoxaparin versus intravenous unfractionated heparin and tirofiban versus placebo in the treatment of acute myocardial infarction for patients not thronbolyzed: methods and design. J Thromb Thrombolys 2000; 10: 241–246.
22. F. Esteves, J. Braga, M. Rocha et al. Comfirmation that heparins are an alternative to promote early reperfusion – the CHEAPER study. Eur Heart J 1997; 18 (abstr. suppl.): 455.
23. F. Esteves, J. Braga, M. Rocha et al. Comfirmation that heparins are an alternative to promote early reperfusion – the CHEAPER study. Am J Cardiol 1998; 31 (suppl. C): 94C.
24. F. Kontny, J. Dale, U. Abildgaard et al. Randomized trial of low molecular weight heparin (dalteparin) in prevention of left ventricular thrombus formation and arterial embolism after acute anterior myocardial infarction: the Fragmin in Acute Myocardial Infarction (FRAMI) Study. JACC 1997; 39: 962–969.
25. B. Charbonnier. Fraxiparine and prevention of left ventricular thrombosis in non–thrombolyzed myocardial infarction. FATIV Study. Arch Mal Coeur Vaiss 1997; 90: 1215–1221.
26. Fragmin during Instability in Coronary Artery Disease (FRISC) study group. Low–molecular–weight heparin during in instability in coronary artery disease. The Lancet 1996; 347: 561–568.
27. W. Klein, A. Buchwald, S. Hillis et al. Comparison of Low–Molecular–Weight Heparin With Unfractionated Heparin Acutely and With Placebo for 6 Weeks in the Management of Unstable Coronary Artery Disease. Fragmin in Unstable Coronary Artery Disease Study (FRIC). Circulation 1997; 96: 61–68.
28. The FRAX.I.S. Study Group. Comparison of two treatment durations (6 days and 14 days) of low molecular weight heparin with a 6–day treatment of unfractionated heparin in the initial management of unstable angina or non–Q–wave myocardial infarction: FRAX.I.S. (FRAxiparine in Ischemic Syndrome). Eur Heart J 1999; 20: 1553–1562.
29. M. Cohen, C. Demers, E. Gurfinkel et al. A comparison of low–molecular–weight he—Аarin with unfractionated heparin for unstable coronary artery disease. N Engl J Med 1997; 337: 447–452.
30. E. Antman, C. McCabe, E. Gurfinkel et al. Enoxaparin Prevents Death and Cardiac Ischemic Events in Unstable Angina/Non–Q–Wave Myocardial Infarction. Results of the Thrombolysis in Myocardial Infarction (TIMI) 11B Trial. Circulation 1999: 100: 1593–1601.
31. Antman E.M., Cohen M., Radley D. et al. Assessment of the Treatment Effect of Enoxaparin for Unstable Angina/Non–Q–Wave Myocardial Infarction. TIMI 11B–ESSENCE Meta–Analysis. Circulation 1999: 100: 1602–1608.
32. FRISC II Investigators. Long–term low–molecular–mass heparin in unstable coronary artery disease: FRISC II prospective randomized multicentre study. Lancet 1999; 354: 701–707.
33. S. Husted, R. Becker, A. Kher. A Critical Review of Clinical Trials for Low–Molecular–Weight Heparin Therapy in Unstable Coronary Artery Disease. Clin Cardiol 2001; 24: 492–499.
34. FRISC II Investigators. Invasive compared with non–invasive treatment in unstable coronary–artery disease: FRISC II prospective randomized multicentre study. Lancet 1999; 354: 708–715.
35. J. Coillet, G. Montalescot, L. Lison, et al. Percutaneous Coronary Intervention After Subcutaneous Enoxaparin Pretreatment in Patients With Unstable Angina Pectoris. Circulation 2001; 103: 658–663.
36. M. Rabah, J. Premmereur, M. Graham et al. Usefulness of intravenous enoxaparin for percutaneous coronary intervention in stable angina pectoris. Am J Cardiol 1999; 84: 1391–1395.
37. D. Kereiakes, C. Grines, E. Fry et al. Enoxaparin and abxicimab adjunctive pharmacotherapy during percutaneous coronary intervention. J Invasive Cardiol 2001; 13: 272–278.
38. K. Karsch, M. Preisack, B. Baildon et al. and REDUCE trial group. Low molecular weight heparin (reviparin) in percutaneous transluminal coronary angioplasty: Results of randomized, double–blind, unfractionated heparin and and placebo–controlled, multicenter trial (REDUCE trial). JACC 1996: 28: 1437–1443.
39. D. Dudek, P. Zymek, S. Bartus, et al. Prospective randomized comparison of enoxaparin versus unfractionated heparin for elective percutaneous coronary interventions among ticlopidine–pretreated patients. Eur Heart J 2000; 21: (abstr. suppl): 381.
40. J. Zidar. Low molecular weight heparins in coronary stenting. The ENTICES trial. Am J Cardiol 1998; 82: 29L–32L.
41. M. Cohen. Initial experience with the n of combination therapy with the low–molecular–weight heparin, enoxaparin, in combination with platelet glycoprotein IIb/IIIa blocker, tirofiban, in patients with non–ST segment elevation acute coronary syndromes. J Invasive Cardiol 2000; 12 (suppl. E): 5–9.
42. D. Kereiakes, N. Kleiman, E. Fry et al. Dalterarin in combination with abciximab during percutaneous coronary intervention. Am Heart J 2001; 141: 348–352..
43. D. Dudek, S. Bartus, P. Zymek et al. Abciximab and Enoxaparin Administration During Elective High–Risk PTCA in Patients With More Than 3 Days of Ticlopidine Pretreatment. JACC 2000; 35 (suppl A): 91.
44. R. Kiesz, P. Buszman, M. Rozek et al. Local delivery of low–molecular–weight heparin decreases restenosis rate after coronary stenting: final results of the POLONIA randomized study. Eur Heart J 2000; 21 (abstr. suppl.): 366.
45. N. Meneveau, J–P Bassand, G. Grollier et al. Local delivery of nadroparin for the prevention of neointimal hyperplasia following stent implantation: final results of the IMPRESS trial. Eur Heart J 2000; 21 (abstr. suppl.): 366.
46. S. Clark, N. Vitale, J. Zacharias, J. Forty. Effect of low molecular weight heparin (fragmin) on bleeding after surgery. Ann Thorac Surg 2000; 69: 762–764.
47. A. Camm. Atrial fibrillation: is there a role for low–molecular–weight heparin? Clin Cardiol 2001; 24 (suppl. 3): 115–119.
48. A. Roijer, J. Eskilsson, B. Olsson. Transoesophageal echocardiographyguided cardioversion of atrial fibrillation or flutter: selection of a low–risk group for immediate cardioversion. Eur Heart J 2000; 21: 837–847.
49. H. Bechtold, H. Sawitzki, D. Guzenhauser, D. Janssen. Anticoagulation with low–molecular–weight heparin dalteparin in atrial fibrillation. Eur Heart J 2000; 21 (abstr. suppl.): 8.












