В последние годы у статинов обнаружено множество новых терапевтических свойств, которые не связаны с их гиполипидемическим действием, хотя в некоторых случаях один и тот же эффект может быть достигнут и липидным, и нелипидным действием статинов. Речь идет о так называемых плеотропных, т.е. дополнительных эффектах препаратов, не зависящих от их основного механизма действия (табл. 1).

Влияние статинов на барьерную функцию эндотелия
Одним из важных свойств эндотелия является его барьерная функция, предупреждающая проникновение посторонних элементов (микробов, липидов как per se, так и включенных в макрофаги). Vоn Nieum Amеrongen и соавт. (2000) изучали влияние симвастатина на проницаемость и барьерную функцию эндотелия. У кроликов Ватанабе с наследственной гиперхолестеринемией лечение симвастатином в течение 1 месяца приводило к достоверному снижению проникновения синей краски Эванса через эндотелий грудной и брюшной аорты указанных кроликов; снижалась также возможность проникновения через эндотелий окисленных липопротеинов низкой плотности (ЛПНП). Уровень холестеринемии у кроликов под влиянием лечения снижался, но недостоверно; не наблюдалось также регрессии атеросклеротических бляшек за указанный срок лечения.
Приведенные данные доказывают, что в лабораторных условиях получены новые данные, свидетельствующие о наличии у одного из статинов достаточно выраженного влияния на барьерную функцию эндотелия, препятствующую проникновению через монослой эндотелия как модифицированных ЛПНП, так и синей краски Эванса.
Влияние статинов на эндотелиальную дисфункцию
Наиболее важным является способность статинов влиять на нарушенную функцию артериального эндотелия. Следует оговориться, что эндотелиальную дисфункцию статины корригируют двояко:
– опосредованно через нормализацию липидного спектра крови;
– с помощью прямого воздействия на эндотелий (вне зависимости от воздействия на липидный спектр крови).
Последнее и считается плеотропным эффектом. Нормализующее влияние статинов на эндотелиальную дисфункцию установлено многими авторами (Huggies et al., 1998; Laufs et al., 1998, Mullen et al., 1997 и др.). Наиболее доказательными являются результаты исследований Laufs et al, (1998).
Авторы обрабатывали эндотелий вен голени человека окисленными ЛПНП в присутствии симвастатина и ловастатина. Окисленные ЛПНП при экспозиции в течение 72 часов вызывали уменьшение РНК и белка синтетазы эндотелиальной окиси азота NO (на 91±1% и 67±8% соответственно). Добавление к эндотелию симвастатина и ловастатина увеличивало экспрессию эндотелиальной NO в 3,8 и в 3,6 раза соответственно и полностью предупреждало ингибирующий эффект окисленных ЛПНП. Авторы приходят к выводу о том, что ингибирование ГМГ–КоА редуктазы статинами усиливает экспрессию эндотелиальной NO–синтетазы вне зависимости от гиполипидемической активности препарата. Вместе с тем доказан факт нормализации функции эндотелия и под влиянием улучшения липидного спектра крови.
Nakashima с соавт. (1996) лечили малой дозой симвастатина (5 мг/день) больных с гиперхолестеринемией свыше 220 мг/дл. До начала лечения, а также через 4 и 12 недель терапии в плазме крови определяли концентрацию окиси азота (NO). Через 4 недели лечения симвастатином произошло снижение уровня общего холестерина на 17%, ХС ЛПНП – на 15% при отсутствии достоверной динамики липопротеинов высокой плотности (ЛПВП). Концентрация NО в крови при этом достоверно не изменилась. Через 12 недель лечения уровень ЛПНП практически оставался на том же уровне, что и на 4–й неделе лечения, но при этом отмечено достаточно значимое (с 33 мг/дл до 39 мг/дл, р<0,05) увеличение уровня ХС ЛПВП. Именно в это время авторы обнаружили значительное (на 69% от исходного) повышение концентрации NO (<0,002). Авторы пришли к выводу о том, что в данном случае не снижение уровня атерогенных липидов, а повышение концентрации ЛПВП явилось причиной усиления выработки NО.
Установлено, что под влиянием ингибирования ГМГ–КоА редуктазы диаметр стенотически пораженного сегмента артерии в ответ на введение аденозина расширяется, и кровоток по нему увеличивается на 45% по сравнению с показателями до лечения. В нормальных сегментах пораженной венечной артерии введение аденозина после терапии не приводило к увеличению кровотока. Этот факт может иметь существенное значение. Восстанавливая нормальную функцию эндотелия, симвастатин выступает в роли сосудорасширяющего средства на месте самого препятствия кровотоку. Выявленный феномен может явиться одним из главных объяснений механизма антиишемического действия липидкорригирующей терапии (Huggins и соавт., 1998).
Shige и соавт. (2001) выявили, что лечение симвастатином приводит к увеличению скорости пульсовой волны артерий ног, но не аорты. Авторы связывают этот феномен с улучшением кровотока в артериях мышечного типа под влиянием усилившейся выработки эндотелиальной NО. Установлено также, что после лечения симвастатином степень снижения уровня ЛПНП прямо коррелирует со степенью восстановления вазодилатации артерий мышечного типа. Наибольший вазодилатирующий эффект наблюдался при снижении уровня ЛПНП крови менее 100 мг/дл (Shechter и соавт., 2000).
Таким образом доказано, что статины обладают способностью восстанавливать функцию эндотелия и тем самым способствовать нормальному вазомоторному ответу венечных и периферических артерий. Следует подчеркнуть, что это свойство статинов проявляется даже при малых дозах и для этого не требуется продолжительных сроков лечения. Через месяц после начала терапии уже можно обнаружить признаки улучшения функции эндотелия по результатам исследования кровотока в сосудах предплечья в ответ на введение ацетилхолина (O’Driscol et al., 1997). Симвастатин у больных гиперхолестеринемией уже через месяц уменьшает экспрессию антигена к тканевому фактору моноцитов и снижает активность тканевого фактора моноцитов, что может играть роль в предотвращении атерогенеза и улучшения клинического течения КБС.
Сосудорасширяющее и антиишемическое действие статинов
Статины обладают явным антиишемическим влиянием на миокард. Этот эффект напрямую связан с восстановлением нормальной функции эндотелия артерий. Выражается он в уменьшении приступов стенокардии и признаков ишемии миокарда при физической нагрузке. Антиишемическое действие установлено практически у всех статинов. При этом у больных, принимавших статины, значительно снижается величина депрессии сегмента S–T, увеличивается время до наступления ишемии при нагрузочной пробе (De Devitiis и соавт., 1996), выявляется значительное снижение периферического сопротивления в периферических артериях.
Улучшение перфузии миокарда наблюдается при лечении статинами, не сопровождается качественными изменениями состояния венечных артерий. Это связано с тем, что в данном случае большее значение имеет функциональный, нежели морфологический компонент состояния венечного кровообращения.
Антитромбогенное действие статинов
Ferro и соавт. (1997) задались целью выяснить, влияет ли симвастатин напрямую на экспрессию тканевого фактора моноцитов, играющих определенную роль в патогенезе тромбообразования.
В результате исследования было установлено, что у леченных симвастатином больных активность тканевого фактора и антигена к нему снизилась в обоих случаях в три раза (р<0,0002, р<0,002), в то время как в контрольной группе не произошло никаких сдвигов. Снизилась также концентрация суммы фрагментов тромбина (р<0,001). Это подтверждает предположение о прямом влиянии статина на процессы тромбогенеза. Часть эффектов препарата направлена на предотвращение тромбообразования, чем и можно объяснить быстрое (1–2 мес) уменьшение тромботических осложнений при отсутствии каких–либо сдвигов в морфологии коронарного атеросклероза.
Как известно, ведется интенсивный поиск методов профилактики тромбоза шунтов после операции АКШ.
В этом плане интересны результаты исследований Christensеn (1999). 77 больных с гиперхолестеринемией более 6,2 ммоль/л, которым предстояло подвергнуться АКШ, за 4 недели до операции были рандомизированы на получающих и не получающих симвастатин (20 мг/день). Липидные показатели крови больных I группы перед операцией оказались несравненно предпочтительнее. По остальным биохимическим и клиническим показателям, а также по характеру и объему операции шунтирования группы не отличались между собой. В послеоперационном периоде (через 7 дней) у больных II группы гипертромбоцитоз (>400000) наблюдался в 81%, а у больных I группы – в 3% случаев. Таким образом, обнаружено новое свойство симвастатина – способность предупреждать постоперационный тромбоцитоз, являющийся предиктором тромботических осложнений. В антитромботическом влиянии симвастатина определенную роль играют и благоприятные изменения со стороны вязкости крови и микроциркуляции. Установлено, что через 6 недель лечения симвастатином у больных с гиперлипидемией происходит снижение вязкости крови, что приводит к явному улучшению микроциркуляции в легких, о чем судили по достоверному снижению объема эритроцитов в легочном капиллярном ложе (Pintaric и соавт., 2001).
Влияние статинов на пролиферацию гладкомышечных клеток
Статины обладает сложным влиянием на пролиферацию гладкомышечных клеток стенки артерии. Известно, что гиперхолестеринемия усиливает деление и рост гладкомышечных клеток. В опытах на крысах установлено, что в культуре гладкомышечных клеток все статины (кроме правастатина) подавляют их воспроизводство, что напрямую связано с ингибированием внутриклеточного синтеза холестерина; добавление к культуре клеток мевалоната (важной промежуточной субстанции на пути синтеза холестерина) восстанавливает прежнюю пролиферативную активность. Способность подавлять пролиферацию гладкомышечных клеток, а также миоцитов имеет прямое отношение к подавлению наклонности стенки артерии к атеросклерозу, поскольку именно пролиферация клеток стенки артерий является начальным этапом заболевания.
Противовоспалительные свойства статинов
В последнее время все больше подтверждений получает гипотеза о важной роли воспаления и иммунных реакций организма в генезе атеросклероза и, особенно, его осложнений и обострений (Shеonfeld et al., 2001). С учетом этого особую ценность представляют исследования, посвященные влиянию статинов на воспаление. Установлено, что симвастатин уменьшает на 48% выраженность асептического воспаления, вызванного инъекцией сarriginen (экстракт из ирландского мха) в кожу экспериментальных мышей, получавших симвастатин. Поскольку у мышей не было гиперхолестеринемии, и уровень липидов не менялся, Sparrow и соавт. (2000) считают, что противовоспалительный эффект симвастатина не зависит от липидного фактора. В исследовании Kothe и соавт. (2000) было установлено, что церивастатин оказывает противовоспалительное действие на макрофаги, инфицированные Chlаmydiа pneumonia. Таким образом, статины обладают противовоспалительным действием как при асептическом, так и при инфекционном характере воспаления. Установлено, что чем выше уровень С–реактивного белка (СРБ) (наиболее важного маркера воспаления) в крови больного, тем выше частота осложнений атеросклероза и смертность от них. Статины, успешно подавляя воспалительный процесс в сосудах (о чем можно судить по нормализации уровня С–реактивности белка), значительно и быстро улучшают течение атеросклеротической болезни сердца, головного мозга, периферических артерий. Это особенно ярко видно на примере лечения больных с нестабильной стенокардией и острым инфарктом миокарда (ОИМ) статинами. В рандомизированных исследованиях больные с указанными заболеваниями, получавшие статины (симвастатин, правастатин и др.), погибали достоверно реже, чем больные, не получавшие их (рис. 1 и 2).
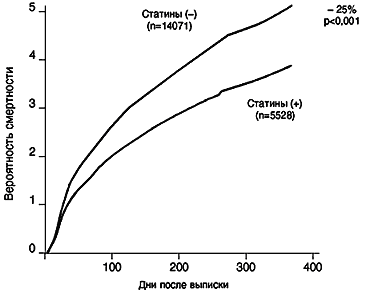
Рис. 1. Риск смерти у больных, перенесших ОИМ, в зависимости от лечения статинами
JAMA, 2001, 285, 431-435
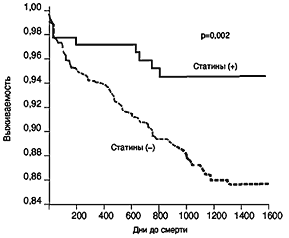
Рис. 2. Выживаемость больных ОИМ, в зависимости от уровня СРБ и лечения статинами
Horne et al; Am.J.Cardiol., 2000, 36, 6
В связи с быстро возрастающим числом больных КБС, которым производится операция на сосудах сердца, приобретает актуальность свойство симвастатина предотвращать развитие атеросклероза в шунтированных сосудах, а также в артериях трансплантированного сердца (Wenke и соавт., 1997; Valantine и соавт., 1997). Установлено также необычайно быстрое прогрессирование атеросклероза венечных артерий после пересадки сердца реципиентам. В связи с этим представляют существенный интерес результаты рандомизированного проспективного исследования, в котором 2 группы больных, которым была произведена трансплантация донорского сердца, наблюдались в течение 4 лет. Группы реципиентов были одинаковы по возрасту, половому составу, весу, наличию сопутствующего сахарного диабета, степени гиперхолестеринемии до операции; одинаковы были возраст доноров, отношение: цитомегаловирус – позитивные доноры/цитомегаловирус – отрицательные рецепиенты. Одна группа больных после операции получала антиатеросклеротическую диету и симвастатин, начиная с первого послеоперационного дня в начальной дозе 5 мг с увеличением дозы, необходимой для достижения целевого уровня ЛПНП в пределах 110–120 мг/дл. Другая группа находилась только на гиперхолестеринемической диете. Четырехлетние наблюдения установили достоверно лучший липидный профиль у получавших симвастатин, достоверно большую их выживаемость за срок наблюдения, существенную разницу в атеросклеротическом заболевании венечных артерий (соотношение 1:2 в пользу больных группы симвастатина). В основной группе наблюдался 1 случай отторжения донорского сердца, в контрольной группе – 5 случаев. Хотя разница не была статистически значимой (вероятнее всего, из–за малого числа больных в сравниваемых группах), сама тенденция представляется весьма обнадеживающей.
В связи с быстро возрастающим числом больных КБС, которым производится операция на сосудах сердца, приобретает актуальность свойство симвастатина предотвращать развитие атеросклероза в шунтированных сосудах, а также в артериях трансплантированного сердца (Wenke и соавт., 1997; Valantine и соавт., 1997). Установлено также необычайно быстрое прогрессирование атеросклероза венечных артерий после пересадки сердца реципиентам. В связи с этим представляют существенный интерес результаты рандомизированного проспективного исследования, в котором 2 группы больных, которым была произведена трансплантация донорского сердца, наблюдались в течение 4 лет. Группы реципиентов были одинаковы по возрасту, половому составу, весу, наличию сопутствующего сахарного диабета, степени гиперхолестеринемии до операции; одинаковы были возраст доноров, отношение: цитомегаловирус – позитивные доноры/цитомегаловирус – отрицательные рецепиенты. Одна группа больных после операции получала антиатеросклеротическую диету и симвастатин, начиная с первого послеоперационного дня в начальной дозе 5 мг с увеличением дозы, необходимой для достижения целевого уровня ЛПНП в пределах 110–120 мг/дл. Другая группа находилась только на гиперхолестеринемической диете. Четырехлетние наблюдения установили достоверно лучший липидный профиль у получавших симвастатин, достоверно большую их выживаемость за срок наблюдения, существенную разницу в атеросклеротическом заболевании венечных артерий (соотношение 1:2 в пользу больных группы симвастатина). В основной группе наблюдался 1 случай отторжения донорского сердца, в контрольной группе – 5 случаев. Хотя разница не была статистически значимой (вероятнее всего, из–за малого числа больных в сравниваемых группах), сама тенденция представляется весьма обнадеживающей.С одной стороны такой блестящий результат, несомненно, является следствием липидснижающей терапии с помощью статинов, с другой стороны – значительное уменьшение степени и случаев отторжения вживленного сердца донора заставляет думать о собственно иммунодепрессантной активности статинов. Вспомним данные о способности статинов регулировать ДНК в клетках, ингибировать хемотаксис моноцитов. регулировать цитотоксичность Т–лимфоцигов и ингибировать клеточную цитоксичность, связанную с клеточными антителами. В опытах с культурой клеток установлено, что подобно циклоспорину, ловастатин оказывает иммуносупрессивный эффект путем ингибирования синтеза интерлейкина–2 в активированных Т–лимфоцитах. Этот эффект был заблокирован, когда к культуре клеток был добавлен интерлейкин–2. Таким образом, циклоспорин и ловастатин (а возможно, и все статины – речь идет о групповом свойстве статинов) действуют синергично; вдобавок через механизм нормализации липидного спектра крови они еще обладают антиатеросклеротическнм эффектом. Не является ли такое сочетание свойств статинов идеальным для сохранения пересаженного сердца?! Вполне обоснованно Valantine и Schroeder (1997) предлагают всем больным с пересаженным сердцем сразу после операции назначать лечение статинами.
Гипертрофия левого желудочка и симвастатин
Известно, что гипертрофия левого желудочка (ГЛЖ) сердца ассоциируется с плохим прогнозом КБС и других заболеваний сердечно–сосудистой системы. Достижение регресса ГЛЖ различными антигипертензивными средствами (b–адреноблокаторы, ингибиторы АПФ, диуретики и др.) считается одним из важных достижений терапии. Lorenzo и соавт. (2000) представили экспериментальные данные по влиянию симвастатина на ГЛЖ, вызванную у крыс, у которых был моделирован стеноз аорты с помощью танталового кольца, помещенного на аорту. Крысы со стенозом аорты и без него были рандомизированы на группы получающих 40 мг/кг симвастатина и неполучающих его. Под воздействием симвастатина у крыс со стенозом аорты наблюдалось уменьшение Сd к4, ответственного за синтез белка и увеличение Р–27 КipI (ответственного за торможение продукции белка миоцита). Это сопровождалось у крыс со стенозом аорты снижением энддиастолического давления левого желудочка. Таким образом впервые показано, что представитель статинов (симвастатин), влияя на регуляцию экспрессии митохондриального РНК и синтез белка митохондриальных клеток, предотвращает развитие гипертрофии левого желудочка, непосредственной предпосылкой которого является снижение давления в левом желудочке сердца, во время диастолы. Неясно, является ли эта способность индивидуальной особенностью симвастатина или же это присуще и другим статинам.
Статины и деменция
Деменция вследствие болезни Альцгеймера и церебро–сосудистых заболеваний у лиц старшего возраста представляет собой серьезную медико–социальную проблему. Более 10% лиц старше 65 лет страдают этими заболеваниями. Известно, что в развитие деменции вовлечены, в том числе, сосудистые и липидные факторы. В частности, болезнь Альцгеймера развивается преимущественно у лиц с аллелем апо Ее4. Эти и другие соображения явились основанием для изучения возможной протективной роли липидкорригирующих средств по отношению к деменции у пожилых людей. Jick и соавт. (2000) из базы данных Великобритании выбрали 1136 чел в возрасте 50–85 лет для составления основной (лица с гиперлипидемией и деменцией) и контрольной (лица без деменции) групп.
Определяли риск развития деменции у групп больных с гиперлипидемией, получавших статины (преимущественно симвастатин), получавших фибраты или никотиновую кислоту и лиц с гиперлипидемией, никогда не применявших липидкорригирующей терапии. Были обнаружены впечатляющие различия по риску развития деменции в группах. У больных, получавших по поводу гиперлипидемии статины, риск развития деменции был самым низким (0,29) и достоверно (р<0,002) отличался от показателей больных двух других групп (у лечившихся фибратами и никотиновой кислотой – 0,96, у нелечившихся гиполипидемическими средствами – 0,72; p>0,05; разница недостоверна). Аналогичные данные о роли статинов получены Wolozin и соавт. (2000) в отношении болезни Альцгеймера.
Поскольку больные с гиперлипидемией, леченные фибратами и никотиновой кислотой, имели риск развития деменции, равный риску у нелечившихся статинами больных, можно предположить, что феномен влияния статинов на деменцию обусловлен нелипидными факторами, т.е. речь идет о плеотропном эффекте.
Статины и желудочковые нарушения ритма сердца высокой градации
Выявлена удивительная способность длительной терапии статинами (в т.ч. симвастатином) улучшать прогноз у больных с тяжелыми желудочковыми нарушениями ритма. De Sutter и соавт. (2000) наблюдали в течение более 4 лет две одинаковые группы больных, которым был имплантирован искусственный дефибриллятор в связи с наличием у них частых желудочковых тахикардий и фибрилляции сердца с повторными эпизодами клинической смерти. Одна группа больных сразу после операции принимала статины или фибраты, другая – нет. Через 4,1 года была выявлена существенная разница между группами в частоте показателя «летальные случаи и госпитализация» (15% в группе гиполипидемических средств, 45% – в контрольной группе), а также в частоте пароксизмов фибрилляции сердца и желудочковых тахикардий (р<0,01).
Влияние статинов на насыщение желчи холестерином
Симвастатин и ловастатин достоверно снижают насыщение желчи холестерином. Считается, что это свойство может быть использовано для растворения холестериновых камней желчного пузыря при сочетанном применении симвастатина и урсодеоксихолевой кислоты. Описан положительный результат такой терапии. При лечении в течение 6 месяцев симвастатином (20 мг/день) в сочетании с урсодеоксихолевой кислотой (750 мг/день) произошло растворение 20 камней желчного пузыря диаметром 2–3 мм (Bateson, 1990).
Статины предотвращают перелом костей
В последние годы было обнаружено, что у больных, длительно принимающих статины, реже случаются переломы костей таза и нижних конечностей, и таким образом они могут служить не только профилактике сердечно–сосудистых инцидентов, но и переломов костей у пожилых людей (Cumming и Bauer, 2000). Установлено, что именно статины (симвастатин и ловастатин), а не другие гиполипидемические препараты (фибраты или другие гиполипидемические лекарства) достоверно уменьшают в популяции больных старше 50 лет частоту переломов бедренной кости. Эти сведения были получены при анализе данных, относящихся к популяции из 91611 человек старше 50 лет. Среди указанной популяции было 28340 человек, принимающих липидкорригирующую терапию в связи с гиперлипидемией, 13271 человек с гиперлипидемией, не получавших указанной терапии, и 50000 человек без гиперлипидемии. Среди всей этой популяции случилось 3940 переломов костей. После подбора одинаковых по индексу массы тела, курению, числу визитов к врачу, приему кортикостероидов и эстрогенов были составлены сопоставимые группы больных с гиперлипидемией, получавших и неполучавших статины (ловастатин, симвастатин). Оказалось, что в группе получавших статины риск перелома костей был на 45% меньше, чем в аналогичной группе больных, не получавших статинов (Meier и соавт., 2000).
Аналогичным образом был проанализирован клинический материал врачей общей практики Нью Джерси (США), включающий 6110 больных, оперированных по поводу перелома бедренной кости. Риск перелома бедренной кости у лечившихся статинами был на 71% меньше, чем у аналогичных больных, не получавших статинов (Wong и соавт., 2000). Как и в предыдущей работе, больные с гиперлипидемией, получавшие фибраты или другие гиполипидемические средства, не имели такого преимущества.
При исследовании плотности позвонков, костей таза и нижних конечностей у женщин в постменопаузе, принимавших разные статины (симвастатин – 51%) и не принимавших их (соответственно 41 и 100 женщин), установлено, что плотность костей у первых была выше, чем у женщин контрольной группы (Edwards и соавт., 2000).
Эти и немногочисленные другие данные (в том числе экспериментальные на животных) обосновывают наличие у статинов совершенно неожиданных терапевтических свойств – влияние на формирование костной ткани. Совсем недавно было установлено, что статины (церивастатин) оказывают подобный эффект благодаря их способности стимулировать выработку костьобразующего белка 2 – фактора роста пролиферации и созревания остеобластов и формирования в конечном итоге костной ткани (Mundy и соавт., 1999; Comming и Bauer, 2000). Считается, что благодаря выявленному феномену статины предупреждают и даже лечат остеопороз у пожилых людей.
Заключение
Как видно из приведенного обзора, статины ни в коем случае нельзя рассматривать только как гиполипидемическое средство. На рис. 3 представлены кривые выживаемости больных, перенесших инфаркт миокарда и подвергшихся операции плеоцекального шунтирования. Благодаря исключению из процесса всасывания пищевых жиров части тонкого кишечника уровень ЛПНП снизился вскоре после операции на 40% и сохраняется на целевом уровне более 10 лет. У оперированных больных выживаемость достоверно лучше, чем у больных контрольной группы. Но разница в частоте летальных исходов и инфарктов миокарда стала достоверно выявляться лишь через 4 года. В то же время у больных, получавших в исследовании 4S симвастатин, подобное расхождение кривых смертности произошло уже через 2 года, т.е. на 2 года раньше, чем при «чистой» гиполипидемической терапии (рис. 4). Ускорение клинического эффекта статина на 2 года, безусловно можно объяснить комплексом нелипидных положительных эффектов статинов.
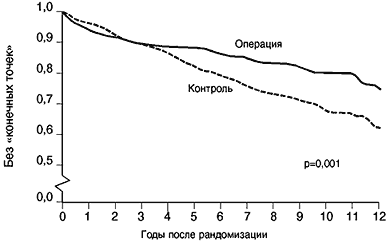
Рис. 3. Частота <конечных точек> (подтвержденный инфаркт миокарда и смерть от атеросклеротической КБС) у больных основной (операция шунтирования тонкого кишечника) и контрольной групп в процессе длительного наблюдения
Buchwald et al., New Engl.Med.J., 1990, 323,946-955
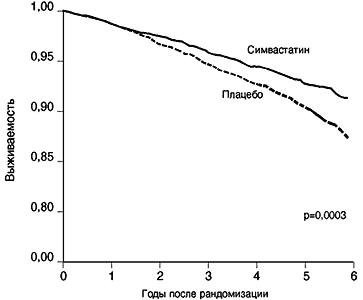
Рис. 4. Кривые общей смертности по методу Каплана-Мейера у больных, получавших симвастатин или плацебо
4S group, Lancet, 1994, 344, 1384-1389
Аронов Д.М. «Лечение и профилактика атеросклероза» Москва, 2000, «Триада–Х», 411 стр.
Симвастатин – Зокор (торговое название)
(Merck Sharp & Dohme Idea)












