По современным представлениям стандартным дополнением к тромболитической терапии наряду с антиагрегантами (сочетание ацетилсалициловой кислоты (АСК) и клопидогрела) служит парентеральное введение антикоагулянтов. Исторически сложилось, что схема использования фибрин–специфичных препаратов (алтеплазы, тенектеплазы, ретеплазы) включает 48–часовую инфузию нефракционированного гепарина (НФГ) [3,4,6]. При мета–анализе 26 рандомизированных исследований, включавшем в совокупности 68 000 больных, 93% из которых получало фибринолитик (в основном стрептокиназу), добавление НФГ к АСК за время госпитализации на каждую 1000 леченных позволяло предотвратить в среднем 5 смертей (р=0,03), 3 повторных ИМ (р=0,04) и 1 тромбоэмболию легочной артерии (р=0,01) [7]. Этот положительный эффект сопровождался высокодостоверным увеличением числа серьезных кровотечений и инсульта (в среднем 3 и 1 на каждую 1000 леченных соответственно). В целом представляется, что краткосрочное введение НФГ при использовании стрептокиназы как минимум сравнительно безопасно (если введение надлежащим образом контролируется и не используются слишком высокие дозы препарата) и, возможно, способно положительно сказаться на исходах заболевания.
С появлением новых парентеральных антикоагулянтов, более удобных для повседневного использования (подкожное введение 1 или 2 раза в сутки без строгой необходимости в коагулологическом контроле), появилась возможность не только существенно упростить лечение, но и проверить гипотезу о целесообразности продления активного антитромботического лечения после тромболитической терапии, по крайней мере, вплоть до 1 недели [8].
Низкомолекулярные гепарины. История изучения эффективности и безопасности низкомолекулярных гепаринов (НМГ) в сочетании с тромболитической терапией при ОКС с подъемами сегмента ST на ЭКГ насчитывает более 10 лет (табл. 1) [9–23]. При этом абсолютное большинство рандомизированных клинических испытаний были выполнены с использованием эноксапарина (Клексана, «Санофи–авентис групп»). Данные небольших клинических исследований показали, что 4–8–дневное лечение НМГ (в основном эноксапарином) по сравнению с 2–3–дневной инфузией НФГ способствует снижению частоты рецидивов ИМ примерно наполовину без существенного увеличения риска крупных кровотечений (включая внутричерепные), и это преимущество сохраняется, по крайней мере, на протяжении ближайшего месяца [24,25]. Однако объем большинства из них был небольшим, и поэтому полученные результаты не могли служить основанием для каких–либо практических рекомендаций.
Наиболее крупным клиническим испытанием, которое определило место НМГ при тромболитической терапии у больных с ОКС со стойкими подъемами сегмента ST на ЭКГ и позволило сформировать суждение о целесообразности продленного введения антикоагулянта, является исследование ExTRACT–TIMI 25 [22,26]. Его результаты стали основанием для расширения показаний к применению эноксапарина, который в данной клинической ситуации стал препаратом первого ряда [1–4].
В это многоцентровое двойное слепое плацебо–контролируемое клиническое испытание было рандомизировано 20 506 больных не моложе 18 лет с показаниями к тромболитической терапии и давностью симптомов не более 6 ч. Не включали больных, получивших НМГ в предшествующие 8 ч, а также с уровнем креатинина в крови >220 мкмоль/л у мужчин и >177 мкмоль/л у женщин.
Исследуемые препараты следовало ввести в промежуток времени от 15 мин. до и 30 мин. после начала тромболитической терапии. Больным, рандомизированным в группу НФГ, первоначально вводился внутривенный болюс 60 ЕД/кг (максимально 4000 ЕД). В ближайшие 15 мин. начиналась постоянная внутривенная инфузия с начальной скоростью 12 ЕД/кг⋅ч (максимально 1000 ЕД/ч). В последующем доза (скорость введения) подбиралась таким образом, чтобы обеспечить увеличение активированного частичного тромбопластинового времени (АЧТВ) в 1,5–2 раза выше нормального (контрольного) для данной лаборатории. Минимальная длительность введения НФГ или его плацебо должна была составлять 48 ч.
Доза эноксапарина (Клексана) корригировалась с учетом возраста и функции почек. У больных моложе 75 лет первоначально вводился болюс 30 мг. Через 15 мин. начинали подкожные введения 1 мг/кг каждые 12 ч (2 раза/сут.), причем первые две дозы не должны были превышать 100 мг. У больных ≥75 лет болюс не применялся, и доза препарата для подкожного введения была уменьшена до 0,75 мг/кг каждые 12 ч (2 раза/сут.), причем величина первых двух доз не должны была превышать 75 мг. В случаях, когда значение клиренса креатинина составляло <30 мл/мин., доза препарата уменьшалась до 1 мг/кг 1 раз/сут. Кроме того, если до включения в исследование больной в ближайшие 3 ч уже получил ≥4000 ЕД НФГ, болюс эноксапарина не вводился. Длительность использования эноксапарина или его плацебо должна была составлять 8 сут. или до выписки, если она наступала ранее.
Сумма случаев смерти и несмертельного рецидива ИМ за 30 суток была ниже в группе эноксапарина (9,9% против 12,0% у получавших НФГ, что соответствует снижению риска на 17%; р<0,001). Оно было достигнуто в основном за счет более редкого развития несмертельного рецидива ИМ (снижение риска на 33%; p<0,001), начиная с первых 48 ч после начала исследования. В абсолютном выражении преимущество эноксапарина по влиянию на сумму указанных неблагоприятных исходов, наметившееся через 48 ч (предотвращено 5 случаев смерти или несмертельного рецидива ИМ на каждую 1000 леченных; р=0,08), заметно увеличилось к 8–м суткам (предотвращен 21 исход на каждую 1000 леченных; р<0,001) и сохранялось неизменным вплоть до 30–х суток. Очевидно, этот результат свидетельствует о целесообразности достаточно продолжительного введения эноксапарина.
В группе эноксапарина достоверно реже возникала потребность в неотложной реваскуляризации миокарда из–за возобновившейся ишемии. К 30–м суткам риск этого события уменьшился на 36%, причем тенденция к преимуществу эноксапарина отмечалась уже в первые 48 ч после начала лечения. Достоверное уменьшение риска суммы случаев смерти, несмертельного рецидива ИМ и неотложной реваскуляризации миокарда отмечалось через 48 ч и сохранялось вплоть до 30–х суток.
Частота крупных кровотечений (включая внутричерепные) оказалась выше у получавших эноксапарин уже с первых 48 ч от начала лечения (4 дополнительных случая на каждые 1000 леченных; р=0,004), причем, несмотря на большую длительность введения эноксапарина по сравнению с НФГ, это различие к 30–м суткам серьезно не увеличилось (7 дополнительных случаев на каждую 1000 леченных; р<0,001). При этом по частоте внутричерепных кровотечений группы достоверно не различались.
При одновременном учете событий, отражающих эффективность и безопасность сопоставлявшихся подходов (сумма случаев смерти, несмертельного рецидива ИМ и несмертельного инвалидизирующего инсульта; сумма случаев смерти, несмертельного рецидива ИМ и несмертельного крупного кровотечения; сумма случаев смерти, несмертельного рецидива ИМ и несмертельного внутричерепного кровотечения), преимущество эноксапарина перед НФГ не утратилось (отмечено высокодостоверное снижение риска в группе эноксапарина на 14–18% за 30 суток, что соответствовало предотвращению 18–22 неблагоприятных исходов на каждую 1000 леченных).
Результаты сопоставления эффектов эноксапарина и НФГ у больных разного возраста. При сопоставлении эффективности лечения у больных разного возраста в исследовании ExTRACT–TIMI 25 оказалось, что уменьшение риска суммы случаев смерти и несмертельного рецидива ИМ у лиц моложе 75 лет составляет 20%, в то время как в более пожилом возрасте – всего 6% [27]. Однако из–за более высокой частоты неблагоприятных исходов у пожилых в абсолютном выражении преимущество эноксапарина перед НФГ в этих возрастных группах было сопоставимо – уменьшение частоты встречаемости указанных событий составило 2,0% и 1,5% соответственно.
Частота крупных кровотечений при введении эноксапарина у более молодых пациентов повышалась в большей степени (с 1,1% до 1,9%, что соответствует увеличению риска на 67%; р<0,001), чем в возрасте ≥75 лет (с 2,9% до 3,3%, что соответствует увеличению риска на 15%; р=0,53). Достоверных различий по частоте внутричерепных кровотечений между больными, получавшими эноксапарин и НФГ, в указанных возрастных группах не было. По–видимому, менее выраженный прирост частоты кровотечений при введении эноксапарина у больных ≥75 лет был во многом связан с применением у них уменьшенной дозы препарата. Так, результаты фармакокинетического исследования, выполненного в подгруппе из 73 больных, показали, что накопление анти–Ха активности у пожилых происходило в меньшей степени, чем у больных моложе 75 лет.
Таким образом, можно полагать, что снижение дозы эноксапарина у пожилых в исследовании ExTRACT–TIMI 25 способствовало повышению безопасности лечения (уменьшению частоты серьезных кровотечений), но не привело к потере его эффективности. Очевидно также, что преимущество эноксапарина перед стандартным подходом к использованию НФГ распространялось как на лиц преклонного возраста, так и на больных, принадлежащих к более молодой возрастной группе.
Результаты сопоставления эффектов эноксапарина и НФГ у больных с различной функцией почек. При учете исходных различий между больными с различным исходным клиренсом креатинина преимущество эноксапарина перед НФГ по влиянию на сумму случаев смерти и несмертельного рецидива ИМ отмечалось только при значениях этого показателя, превышающих 60 мл/мин. [28]. Аналогичная закономерность прослеживалась при учете совокупного клинического эффекта вмешательства (сумма случаев смерти, несмертельного рецидива ИМ и несмертельного крупного кровотечения), а также только несмертельного рецидива ИМ (рис. 1). При этом тенденция к преимуществу эноксапарина отмечалась и у больных с клиренсом креатинина <30 мл/мин., однако их число в данном исследовании оказалось слишком мало для того, чтобы продемонстрировать статистическую значимость имевшихся различий (всего 212 человек).
Частота крупных кровотечений при нормальной функции почек (клиренс креатинина >90 мл/мин.) у больных, получавших эноксапарин и НФГ, была практически одинаковой. Однако по мере снижения клиренса креатинина рост частоты геморрагических осложнений при использовании эноксапарина оказался более выраженным. Эти факты позволяют предполагать, что уменьшение дозы эноксапарина может быть оправданным не только у больных ≥75 лет или при клиренсе креатинина <30 мл/мин., но и при менее выраженном нарушении функции почек.
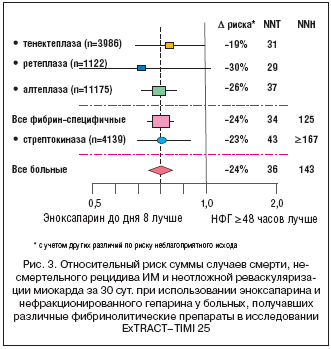
Результаты сопоставления эффектов эноксапарина и НФГ при использовании различных фибринолитических агентов. Преимущество эноксапарина перед НФГ по влиянию на сумму случаев смерти и несмертельного рецидива ИМ за 30 суток, отмеченное в исследовании в целом, прослеживалось при применении всех изученных фибринолитиков (рис. 2 и 3) [29]. При этом польза от замены НФГ на эноксапарин во всех случаях заметно превосходила опасность геморрагических осложнений.
Результаты сопоставления эноксапарина и НФГ при ЧКВ. Проведение тромболитической терапии не исключает пользу от проведения в ближайшие дни коронарной ангиографии с последующим ЧКВ, если будут найдены соответствующие анатомические показания [1–5]. В исследовании ExTRACT–TIMI 25 ЧКВ рекомендовалось отсрочить как минимум до 48 ч после рандомизации, если не было неотложных показаний к реваскуляризации миокарда (безуспешная тромболитическая терапия, возобновление ишемии миокарда, рецидив ИМ). Причем в первые 8 суток лечения вмешательство рекомендовалось проводить на том антикоагулянте, который больной уже получал в рамках исследования (была предусмотрена процедура, позволяющая не нарушать принцип маскировки), а в более поздние сроки должны были использоваться стандартные дозы НФГ [22,26]. При этом в группе эноксапарина в случаях, когда после последней подкожной инъекции препарата прошло не более 8 ч, дополнительное введение антикоагулянтов не практиковалось. Если после последней подкожной инъекции препарата прошло от 8 до 12 ч, следовало ввести внутривенно дополнительную дозу эноксапарина 0,3 мг/кг. После успешного ЧКВ антикоагулянты можно было отменить.
В данном клиническом испытании ЧКВ до 30–х суток было выполнено у 4676 больных, в том числе в период введения исследуемых препаратов при соблюдении принципов двойного слепого исследования – у 2178 [30]. В этих подгруппах при использовании эноксапарина по сравнению с НФГ отмечалось достоверное уменьшение риска суммы случаев смерти и несмертельного рецидива ИМ, аналогичное исследованию в целом, притом что частота крупных кровотечений не увеличилась. Это различие возникло до проведения ЧКВ и сохранялось вплоть до 30–х суток. При этом уменьшение частоты неблагоприятных исходов отмечалось как в случаях, когда эноксапарин или НФГ продолжали использовать непосредственно до ЧКВ, так и в случаях, когда двойное слепое лечение ко времени вмешательства уже прекратилось и было возобновлено для проведения ЧКВ.
Результаты исследования ExTRACT–TIMI 25 свидетельствуют в пользу преимущества эноксапарина не только при медикаментозном лечении ОКС со стойкими подъемами сегмента ST на ЭКГ, но и в случаях, когда на фоне лечения антикоагулянтами возникает необходимость в ЧКВ. При этом процедуру безопасно выполнять с использованием эноксапарина, не прибегая к введению других антикоагулянтов.
Применение эноксапарина
при тромболитической терапии:
современные представления
В исследовании ExTRACT–TIMI 25 сопоставлялись не только два препарата, но и два подхода к применению антикоагулянтов при ОКС со стойкими подъемами сегмента ST на ЭКГ: краткосрочная внутривенная инфузия НФГ под контролем АЧТВ и более длительные подкожные инъекции НМГ эноксапарина. Так же, как и в ряде других, менее крупных клинических испытаний, было показано, что в условиях современного медикаментозного лечения заболевания последний подход способствует более редкому возникновению рецидивов ИМ и позволяет предотвратить возобновление ишемии миокарда (по крайней мере, достаточно тяжелой, чтобы стать поводом к неотложной реваскуляризации миокарда) [20,24,25]. Замена НФГ на эноксапарин не оказала заметного влияния на смертность, однако этот аспект эффективности лечения и не планировалось оценивать.
Повышение эффективности лечения привело к увеличению частоты крупных и мелких кровотечений. При этом важно, что увеличения частоты внутричерепных кровотечений не произошло, а в целом частота крупных кровотечений оказалась достаточно низкой (менее 1% за 30 суток). Не исключено, что безопасность применения эноксапарина возросла благодаря принятым мерам предосторожности: уменьшению дозы препарата у лиц ≥75 лет и при клиренсе креатинина <30 мл/мин., низкой (15,9% случаев) частоте применения НФГ до начала исследования (и, соответственно, смене препарата после рандомизации), исключению возможности чрезмерной антикоагуляции в начале лечения во время ЧКВ. В абсолютном выражении (число событий на каждую 1000 леченных) преимущество в эффективности длительного введения эноксапарина заметно превосходило опасность крупных кровотечений (21 случай смерти или несмертельного рецидива ИМ против 6 крупных кровотечений в первые 8 суток и 21 против 7 за 30 суток).
В целом исследование EXTRACT–TIMI 25 продемонстрировало, что у больных без существенного увеличения уровня креатинина в крови и чрезмерно высокого риска кровотечений длительное введение эноксапарина после тромболитической терапии эффективнее предотвращает несмертельные рецидивы ИМ и возобновление тяжелой ишемии миокарда, чем краткосрочная (рекомендуемая современными руководствами) инфузия НФГ. И хотя при этом увеличивается частота возникновения геморрагических осложнений, ожидаемая польза вмешательства заметно превосходит связанный с ним риск.
В 2007 г. был проведен новый мета–анализ 6–ти наиболее крупных сравнительных исследований эноксапарина и НФГ при тромболитической терапии у больных ИМ (ENTIRE–TIMI 23, HART II, Baird A. и соавт., ASSENT–3, ASSENT–3 PLUS и ExTRACT–TIMI 25), включавших в совокупности 27 131 больного [31]. Было показано, что подход, предусматривающий 4–8–дневные подкожные инъекции эноксапарина, по сравнению с 2–3–дневной внутривенной инфузией НФГ обеспечивает уменьшение частоты наиболее важных неблагоприятных исходов, объединяющих как эффективность, так и безопасность лечения (сумма случаев смерти, рецидива ИМ и крупных кровотечений) с 12,9% до 11,1% в ближайшие 30 суток, что соответствует достоверному уменьшению риска на 16% (р=0,018). При этом риск рецидива ИМ у получавших эноксапарин уменьшился на 46% (р=0,001), суммы случаев смерти и рецидива ИМ – на 22% (р=0,002). И хотя частота крупных кровотечений оказалась выше в группах эноксапарина – 1,8% и 2,5% соответственно (увеличение риска на 45%; р=0,001), это не устранило положительное воздействие вмешательства, которое, как представляется, в основном связано с предотвращением рецидива ИМ.
Фондапаринукс натрия. Данные о результатах применения фондапаринукса при тромболитической терапии у больных с ОКС со стойкими подъемами сегмента ST на ЭКГ были получены в крупном многоцентровом двойном слепом плацебо–контролируемом исследовании OASIS–6, в которое было рандомизировано 12 092 больных [32]. Это клиническое испытание было достаточно сложно организовано, чтобы охватить наиболее широкий контингент больных и определить место фондапаринукса при различных подходах к лечению заболевания (первичное ЧКВ, тромболитическая терапия с использованием различных фибринолитиков, а также отсутствие реперфузионного лечения).
Первоначально рандомизация осуществлялась в пределах 24 ч после начала симптомов, однако после включения 4300 человек этот срок был уменьшен до 12 ч. Не подходили больные, имевшие уровень креатинина в крови более 265 мкмоль/л (3 мг/дл).
Фондапаринукс, вводимый однократно в суточной дозе 2,5 мг на протяжении 8 суток или до более ранней выписки из стационара, сопоставлялся либо с 24–48–часовой инфузией НФГ под контролем АЧТВ, либо с плацебо.
В целом при использовании фондапаринукса риск смерти или рецидива ИМ в первые 9 суток был достоверно ниже на 17%, что соответствовало предотвращению 15 событий на каждую 1000 леченных. Данное различие сохранялось на протяжении ближайших месяцев. При этом достоверно уменьшалась как смертность (на 13%), так и частота рецидивов ИМ (на 33%). Частота крупных и внутричерепных кровотечений при использовании фондапаринукса не увеличилась.
Тромболитическая терапия в этом исследовании была выполнена у 45% больных [33]. Результат в этой подгруппе получился аналогичным исследованию в целом (рис. 4). Однако при дальнейшем анализе оказалось, что он, по–видимому, имеет отношение только к больным, получавшим стрептокиназу, когда фондапаринукс в основном сопоставлялся с плацебо. При этом частота крупных кровотечений при недельном введении фондапаринукса не только достоверно не отличалась от плацебо, но и оказалась даже несколько меньшей. Фибрин–специфичные фибринолитики (тенектеплазу, ретеплазу, алтеплазу) получало небольшое число больных, и при сопоставлении с краткосрочной инфузией НФГ преимуществ в эффективности у длительного лечения фондапаринуксом не было.
При ретроспективном анализе результатов исследования OASIS–6 отмечено, что риск смерти или рецидива ИМ при сопоставлении фондапаринукса с плацебо достоверно уменьшался уже в первые 3 суток после начала лечения (на 20%, что соответствовало предотвращению 13 событий на каждую 1000 леченных). С 4 по 9 сутки положительное влияние вмешательства увеличивалось – риск совокупности указанных неблагоприятных исходов уменьшился на 32%, удалось предотвратить еще 14 событий на каждую 1000 леченных. Таким образом, было получено еще одно свидетельство в пользу целесообразности продленного использования антикоагулянтов после тромболитической терапии.
В случаях, когда на фоне продолжающегося использования фондапаринукса выполнялось ЧКВ (231 человек), протокол исследования OASIS–6 предусматривал внутривенное болюсное введение стандартных доз НФГ, как это принято в ангиографической лаборатории. В итоге частота осложнений процедуры в группе фондапаринукса и стандартного лечения существенно не различалась, случаев тромбоза проводникового катетера отмечено не было.
Таким образом, очевидно, что 1–недельное введение фондапаринукса при тромболитической терапии положительно влияет на исходы заболевания и при надлежащем отборе больных достаточно безопасно. В последующем на фоне начатого лечения фондапаринуксом можно выполнять ЧКВ при условии, что во время процедуры будут вводиться стандартные дозы НФГ. Вместе с тем свидетельства пользы продленного введения фондапаринукса касаются только больных, получавших стрептокиназу, в то время как его сочетание с другими фибринолитиками изучено мало.
Современные подходы к использованию
антикоагулянтов при тромболитической
терапии
На сегодняшний день представляется, что наилучшим подходом к использованию антикоагулянтов при тромболитической терапии является длительное (1–недельное) подкожное введение эноксапарина или фондапаринукса (другие лекарственные средства не обладают здесь достаточной доказательной базой). При введении стрептокиназы свидетельства пользы есть как для эноксапарина, так и для фондапаринукса. Из–за отсутствия прямого сравнения и существенных различий в характере проведенного изучения нельзя определить, какое из этих лекарственных средств является предпочтительным. В частности, эноксапарин сопоставлялся с краткосрочной инфузией НФГ, в то время как фондапаринукс – преимущественно с плацебо. Вместе с тем, привлекают внимание, с одной стороны, менее благоприятные результаты применения эноксапарина у больных с умеренной почечной недостаточностью (клиренсом креатинина от 30 до 60 мл/мин.), с другой – в целом низкая (сопоставимая с плацебо) частота кровотечений при использовании фондапаринукса. Очевидно, на практике решение о выборе препарата следует принимать индивидуально, с учетом особенностей, присущих конкретному больному, с одной стороны, а также фармакологических свойств и результатов изучения каждого из этих лекарственных средств, с другой (табл. 2).
При использовании фибрин–специфичных фибринолитиков положительный результат был получен только при изучении эноксапарина, в то время как данные по фондапаринуксу крайне ограничены.
Для обеспечения приемлемого соотношения эффективности и безопасности лечения у получающих эноксапарин необходимо строго придерживаться методики его введения, изложенной в аннотации к препарату (определять дозу исходя из реальной массы тела, уменьшать дозу у больных старческого возраста и при тяжелом нарушении функции почек).
Следует также учитывать, что длительное подкожное введение антикоагулянтов было изучено на больных, исходно не имевших чрезмерно высокого риска кровотечений и выраженного повышения креатинина в крови. Очевидно, что при наличии подобных обстоятельств разумно ограничиться менее длительным (48–часовым) и более управляемым режимом поддержания гипокоагуляции (внутривенной инфузией НФГ). При этом, согласно современным представлениям, использовать фибрин–специфичные препараты (алтеплазы, тенектеплазы, ретеплазы) без сопутствующего введения гепарина нельзя. Если используется стрептокиназа, в ситуации, когда приоритетом является снижение риска геморрагических осложнений, может быть разумным пожертвовать возможной дополнительной эффективностью в пользу безопасности и воздержаться от введения антикоагулянтов (табл. 3).
Не следует также забывать, что важнейшее условие безопасного применения НФГ – строгий контроль АЧТВ, особенно в ранние сроки после начала введения препарата, когда его действие накладывается на эффект введенного фибринолитика. При тромболитической терапии современные рекомендации предписывают определять АЧТВ (и при необходимости изменять дозу НФГ) через 3 и 6 ч после начала инфузии НФГ и добиваться его увеличения в 1,5–2 раза выше контрольной величины (верхняя граница нормы или среднее значение у здоровых лиц для данной лаборатории) [3].
Заключение
Парентеральное введение антикоагулянтов является стандартным компонентом тромболитической терапии при ОКС со стойкими подъемами сегмента ST на ЭКГ. Наилучший результат достигается при длительном (вплоть до 1 нед.) подкожном введении эноксапарина или фондапаринукса. Выбор лекарственных средств осуществляют в соответствии с итогами их изучения в тех или иных клинических обстоятельствах. Так, в сочетании со стрептокиназой есть основания для использования как эноксапарина, так и фондапаринукса, в то время как при введении фибрин–специфичных агентов необходимая доказательная база существует только у эноксапарина.
В случаях, когда продленное использование антикоагулянтов представляется не оправданным из–за неприемлемо высокого риска кровотечений, остается актуальным подход, предусматривающий краткосрочную внутривенную инфузию нефракционированного гепарина с подбором дозы под контролем АЧТВ. При этом в случаях, когда используется стрептокиназа, можно рассмотреть целесообразность отказа от дополнительного введения антикоагулянтов.






Литература
1. ACC/AHA Guidelines for the Management of Patients With ST–Elevation Myocardial Infarction. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Revise the 1999 Guidelines for the Management of Patients With Acute Myocardial Infarction). Полная версия доступна на сайте www.acc.org.
2. 2007 Focused Update of the ACC/AHA 2004 Guidelines for the Management of Patients With ST–Elevation Myocardial Infarction. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. // JACC. 2008;51:210–247.
3. The Task Force on the management of ST–segment elevation acute myocardial infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with persistent ST–segment elevation. // Eur Heart J. 2008;29:2909–2945.
4. Goodman S.G., Menon V., Cannon C.P. et al. Acute ST–Segment Elevation Myocardial Infarction: American College of Chest Physicians Evidence–Based Clinical Practice Guidelines (8th Edition). // Chest. 2008;133:708S–775S.
5. Диагностика и лечение больных острым инфарктом миокарда с подъемами сегмента ST ЭКГ. Рекомендации Всероссийского научного общества кардиологов. // Кардиоваскулярная терапия и профилактика. – 2007. – № 6 (8), приложение 1.
6. The GUSTO Investigators. An International Randomized Trial Comparing Four Thrombolytic Strategies for Acute Myocardial Infarction. // N Engl J Med. 1993;329:673–682.
7. Collins R. Drug Therapy: Aspirin, heparin and Fibrinolytic Therapy in Suspected Acute Myocardial Infarction. // N Engl J Med. 1997;336:847–860.
8. Hirsh J., Bauer K.A., Donati M.B. et al. Parenteral anticoagulants: American College of Chest Physicians Evidence–Based Clinical Practice Guidelines (8th Edition). // Chest 2008;133:141S–159S.
9. Chamuleau S.A.J., de Winter R.J., Levi M. et al. On behalf of the Fraxiparin Anticoagulant Therapy in Myocardial Infarction Study Amsterdam (FATIMA) Study Group Low molecular weight heparin as an adjunct to thrombolysis for acute myocardial infarction: the FATIMA study. // Heart. 1998;80:35–39.
10. Curylo A.M., Kawecka–Jaszcz K., Czarnecka D. et al. Nadroparin calcium in the treatment of acute myocardial infarction. // Med Sci Monit. 1997;3:700–703.
11. Frostfeldt G., Ahlberg G., Gustafsson G. et al. Low Molecular Weight Heparin (Dalteparin) as Adjuvant Treatment to Thrombolysis in Acute Myocardial Infarction – A Pilot Study: Biochemical Markers of Acute Coronary Syndromes (BIOMACS II). // JACC. 1999;33:627–633.
12. F. Kontny, J. Dale, U. Abildgaard et al. Randomized trial of low molecular weight heparin (dalteparin) in prevention of left ventricular thrombus formation and arterial embolism after acute anterior myocardial infarction: the Fragmin in Acute Myocardial Infarction (FRAMI) Study. // JACC. 1997;39:962–969.
13. Wallentin L., Dellborg D., Nilsson B. et al. The Low–Molecular–Weight Heparin Dalteparin as Adjuvant Therapy in Acute Myocardial Infarction: the ASSENT PLUS study. // Clin Cardiol. 2001;24(suppl. I):I–12–I–14.
14. Glick A., Kornowski R., Michowich Y. et al. Reduction of reinfarction and angina with use of low–molecular–weight heparin therapy after streptokinase (and heparin) in acute myocardial infarction. // Am J Cardiol. 1996;77:1145–1148.
15. Simoons M., Krzeminska–Pakula M., Alonso A. et al. For the AMI–SK Investigators. Improved reperfusion and clinical outcome with enoxaparin as an adjuvant to streptokinase thrombolysis in acute myocardial infarction: The AMI–SK study. // Eur Heart J. 2002;23:1282–1290.
16. Tatu–Chitoiu G., Teodorescu C., Fluerasu A. et al. Accelerated SK + enoxaparine – a new thrombolytic regimen in acute MI. The ASENOX study. // Rom J Intern Med. 1998;36: 183–196.
17. Baird S., Menown I., McBride S. et al. Randomized comparison of enoxaparin with unfractionated heparin following fibrinolytic therapy for acute myocardial infarction. // Eur Heart J. 2002;23:627–632.
18. Antman E., Louwerenburg H., Baars H. et al. Enoxaparin as Adjunctive Antithrombin Therapy for ST–Elevation Myocardial Infarction. Results of the ENTIRE–Thrombolysis in Myocardial Infarction (TIMI) 23 Trial. // Circulation. 2002;105:1642–1649.
19. Ross A., Molhoek P., Lundergan C. et al. Randomized Comparison of Enoxaparin, a Low–Molecular–Weight Heparin, With Unfractionated Heparin Adjunctive to Recombinant Tissue Plasminogen Activator Thrombolysis and Aspirin Second Trial of Heparin and Aspirin Reperfusion Therapy (HART II). // Circulation. 2001;104:648–652.
20. The Assessment of the Safety and Efficacy of a New Thrombolytic Regimen (ASSENT)–3 Investigators. Efficacy and safety of tenecteplase in combination with enoxaparin, abciximab, or unfractionated heparin: the ASSENT–3 randomised trial in acute myocardial infarction. // Lancet 2001;358:605–613.
21. Wallentin L., Goldstein P., Armstrong P.W. et al. Efficacy and Safety of Tenecteplase in Combination With the Low–Molecular–Weight Heparin Enoxaparin or Unfractionated Heparin in the Prehospital Setting. The Assessment of the Safety and Efficacy of a New Thrombolytic Regimen (ASSENT)–3 PLUS Randomized Trial in Acute Myocardial Infarction. // Circulation. 2003;108:135–142.
22. Antman E.M., Morrow D.A., McCabe C.H. et al. For the ExTRACT–TIMI 25 Investigators. Enoxaparin versus Unfractionated Heparin with Fibrinolysis for ST–Elevation Myocardial Infarction. // N Engl J Med. 2006;354:1477–1488.
23. The CREATE Trial Group Investigators. Effects of reviparin, a low–molecular–weight heparin, on mortality, reinfarction, and strokes in patients with acute myocardial infarction presenting with ST–segment elevation. // JAMA. 2005;293:427–436.
24. Eikelboom J.W., Quinlan D.J., Mehta S.R. et al. Unfractionated and Low–Molecular–Weight Heparin as Adjuncts to Thrombolysis in Aspirin–Treated Patients With ST–Elevation Acute Myocardial Infarction. A Meta–Analysis of the Randomized Trials. // Circulation. 2005;112:3855–3867.
25. Theroux P., Welsh R.C. Meta–analysis of randomized trials comparing enoxaparin versus unfractionated heparin as adjunctive therapy to fibrinolysis in ST–elevation acute myocardial infarction. // Am J Cardiol. 2003;91:860–864.
26. Antman E.M., Morrow D.A., McCabe C.H. et al. For the ExTRACT–TIMI 25 Investigators Enoxaparin versus unfractionated heparin as antithrombin therapy in patients receiving fibrinolysis for ST–elevation myocardial infarction: Design and rationale for the Enoxaparin and Thrombolysis Reperfusion for Acute Myocardial Infarction Treatment–Thrombolysis In Myocardial Infarction study 25 (ExTRACT–TIMI 25). // Am Heart J. 2005;149:217–226.
27. White H.D., Braunwald E., Murphy S.A. et al. Enoxaparin vs. unfractionated heparin with fibrinolysis for ST–elevation myocardial infarction in elderly and younger patients: results from ExTRACT–TIMI 25. // Eur Heart J. 2007;28:1066–1071.
28. Fox K.A.A., Antman E.M., Montalescot G. et al. The Impact of Renal Dysfunction on Outcomes in the ExTRACT–TIMI 25 Trial. // JACC. 2007;49:2249–2255.
29. Giraldez R.R., Nicolau J.C., Corbalan R. et al. Enoxaparin is superior to unfractionated heparin in patients with ST elevation myocardial infarction undergoing fibrinolysis regardless of the choice of lytic: an ExTRACT–TIMI 25 analysis. // Eur Heart J. 2007;28:1566–1573.
30. Gibson C.M., Murphy S.A., Montalescot G. et al. For the ExTRACT–TIMI 25 Investigators. Percutaneous Coronary Intervention in Patients Receiving Enoxaparin or Unfractionated Heparin After Fibrinolytic Therapy for ST–Segment Elevation Myocardial Infarction in the ExTRACT–TIMI 25 Trial. // JACC. 2007;49:2238–2246.
31. Murphy S.A., Gibson C.M., Morrow D.A. et al. Efficacy and safety of the low–molecular weight heparin enoxaparin compared with unfractionated heparin across the acute coronary syndrome spectrum: a meta–analysis. // Eur Heart J. 2007;28:2077–2086.
32. The OASIS–6 Trial Group. Effects of Fondaparinux on Mortality and Reinfarction in Patients With Acute ST–Segment Elevation Myocardial Infarction. The OASIS–6 Randomized Trial. // JAMA. 2006;295:1519–1530.
33. Peters R.J.G., Joyner C., Bassand J.–P. et al. For the OASIS–6 investigators. The role of fondaparinux as an adjunct to thrombolytic therapy in acute myocardial infarction: a subgroup analysis of the OASIS–6 trial. // Eur Heart J. 2008;29:324–331.












