–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ї–Њ—А—А–µ–Ї—Ж–Є—П –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Ь–°, –≤ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –Р–У, –і–Њ–ї–ґ–љ–∞ –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П —Б —Г—З–µ—В–Њ–Љ –≤–ї–Є—П–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ —Н–љ–і–Њ—В–µ–ї–Є–є, —Г—А–Њ–≤–µ–љ—М —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Г–≥–ї–µ–≤–Њ–і–љ–Њ–≥–Њ –Є –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —В–µ—А–∞–њ–Є—П –Р–У —Г –Љ—Г–ґ—З–Є–љ –Љ–Њ–ґ–µ—В –±—Л—В—М –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ –Є–Ј-–Ј–∞ –љ–Є–Ј–Ї–Њ–є –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –љ–∞—А—Г—И–µ–љ–Є–є —Б–µ–Ї—Б—Г–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є. –Я—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–µ –≤—А–∞—З–Є —З–∞—Б—В–Њ –љ–µ —Г–і–µ–ї—П—О—В –і–Њ–ї–ґ–љ–Њ–≥–Њ –≤–љ–Є–Љ–∞–љ–Є—П –і–∞–љ–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–µ, —Д–Њ–Ї—Г—Б–Є—А—Г—П—Б—М –љ–∞ –Њ—Б–љ–Њ–≤–љ—Л—Е —Ж–µ–ї—П—Е –Є –Ј–∞–і–∞—З–∞—Е –ї–µ—З–µ–љ–Є—П [24].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ь–°, –і–Њ–ї–ґ–љ—Л –Њ—В–≤–µ—З–∞—В—М —Б–ї–µ–і—Г—О—Й–Є–Љ —В—А–µ–±–Њ–≤–∞–љ–Є—П–Љ:
1) –Њ–Ї–∞–Ј—Л–≤–∞—В—М –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –≤ —В–µ—З–µ–љ–Є–µ —Б—Г—В–Њ–Ї (—Г–ї—Г—З—И–µ–љ–Є–µ —Б—Г—В–Њ—З–љ–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П –Р–Ф —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Ї–∞–Ї –і–љ–µ–≤–љ–Њ–≥–Њ, —В–∞–Ї –Є –љ–Њ—З–љ–Њ–≥–Њ –Р–Ф);
2) —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —А–µ–≥—А–µ—Б—Б—Г –њ–Њ—А–∞–ґ–µ–љ–Є–є –Њ—А–≥–∞–љ–Њ–≤-–Љ–Є—И–µ–љ–µ–є (–≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Г–Љ–µ–љ—М—И–µ–љ–Є—О –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞);
3) –Њ–±–ї–∞–і–∞—В—М –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є.
4) –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –і–Њ 40% –љ–µ–ї–µ—З–µ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –і–Њ 60% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–У –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –Є–Љ–µ—О—В –љ–∞—А—Г—И–µ–љ–Є—П —Б–µ–Ї—Б—Г–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є —А–∞–Ј–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є [15]. –Я—А–µ–њ–∞—А–∞—В—Л, –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–µ —Г –Љ—Г–ґ—З–Є–љ —Б –Р–У –Є –Ь–°, –і–Њ–ї–ґ–љ—Л –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–∞—В—М –≠–Ф –Є —Г—А–Њ–≤–µ–љ—М —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞.
–Я–Њ–Ј–Є—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–µ–Ї—Б—Г–∞–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–њ—А–µ–≤—А–∞—Й–∞—О—Й–µ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ (–Є–Р–Я–§) –Є –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ —А–µ—Ж–µ–њ—В–Њ—А–∞ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II (–С–†–Р II) –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –≤ —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е –Є –Ј–∞—А—Г–±–µ–ґ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е.
–°–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –Т—Б–µ—А–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –љ–∞—Г—З–љ–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Њ–≤, –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –Р–У —Г –ї–Є—Ж —Б –Ь–°, –°–Ф –Є –≠–Ф –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ —П–≤–ї—П—О—В—Б—П –Є–Љ–µ–љ–љ–Њ –і–∞–љ–љ—Л–µ –≥—А—Г–њ–њ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л –Ї–∞–ї—М—Ж–Є—П –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —В–Є–∞–Ј–Є–і–љ—Л–Љ–Є –і–Є—Г—А–µ—В–Є–Ї–∞–Љ–Є [8]. –Ю–і–љ–∞–Ї–Њ –љ–∞–ї–Є—З–Є–µ –њ—А–Є –Ь–° –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (–°–Э–°) —Б—В–∞–≤–Є—В –≤–Њ–њ—А–Њ—Б –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П β-–∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ (–С–Р–С) —Г –і–∞–љ–љ–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [1]. –Р–У –Ї–∞–Ї –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В –Ь–° –Є–Љ–µ–µ—В —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є. –Ю–љ–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –≤–ї–Є—П–љ–Є–µ–Љ –≥–Є–њ–µ—А–Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є–Є: –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —В—А–∞–љ—Б–њ–Њ—А—В–∞ –Є–Њ–љ–Њ–≤, –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, —А–µ–љ–Є–љ-–∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ-–∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л, —Г—Б–Є–ї–µ–љ–љ—Л–Љ —Б–Є–љ—В–µ–Ј–Њ–Љ —Б–≤–Њ–±–Њ–і–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В –Є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є —Н–љ–і–Њ—В–µ–ї–Є—П.
–Т —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –С–Р–С I–II –њ–Њ–Ї–Њ–ї–µ–љ–Є—П, —А–∞–≤–љ–Њ –Ї–∞–Ї –Є –і–Є—Г—А–µ—В–Є–Ї–Њ–≤, –Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П (–Љ–µ—В–Є–ї–і–Њ–њ–∞, –Ї–ї–Њ–љ–Є–і–Є–љ), —Б–Њ—З–µ—В–∞–µ—В—Б—П —Б –±–Њ–ї—М—И–µ–є —З–∞—Б—В–Њ—В–Њ–є –њ–Њ–ї–Њ–≤–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, –≤ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Г –Љ—Г–ґ—З–Є–љ [17].
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –С–Р–С I –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ –≤–ї–Є—П—О—В –љ–∞ —Г–≥–ї–µ–≤–Њ–і–љ—Л–є [20] –Є –ї–Є–њ–Є–і–љ—Л–є [21] –Њ–±–Љ–µ–љ. –Ф—А—Г–≥–Є–Љ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–Љ –њ–Њ–±–Њ—З–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ —В–µ—А–∞–њ–Є–Є –С–Р–С I–II –њ–Њ–Ї–Њ–ї–µ–љ–Є—П —П–≤–ї—П–µ—В—Б—П –Є—Е —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –≤—Л–Ј—Л–≤–∞—В—М –њ—А–Є–±–∞–≤–Ї—Г –Љ–∞—Б—Б—Л —В–µ–ї–∞ [26]. –Ф–∞–љ–љ–∞—П –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М —Н—В–Њ–є –≥—А—Г–њ–њ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Е–Њ—А–Њ—И–Њ –Є–Ј—Г—З–µ–љ–∞ [12, 29]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Љ–љ–Њ–≥–Є–µ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ β1-–∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л —Г—В—А–∞—З–Є–≤–∞—О—В —Б–≤–Њ—О —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –±–Њ–ї—М—И–Є—Е –і–Њ–Ј–∞—Е –Є –Є—Е –∞–љ—В–∞–≥–Њ–љ–Є–Ј–Љ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є β2-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Я—А–Є –±–ї–Њ–Ї–∞–і–µ β2-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Љ–Њ–ґ–µ—В –њ—А–Њ–Є—Б—Е–Њ–і–Є—В—М —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–∞.
–Ю–і–љ–∞–Ї–Њ –њ–Њ—П–≤–ї–µ–љ–Є–µ –≤—Л—Б–Њ–Ї–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –С–Р–С III –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ (–С–Є–љ–µ–ї–Њ–ї) –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–∞—Б—И–Є—А–Є–ї–Њ –≥—А–∞–љ–Є—Ж—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –С–Р–С –Ј–∞ —Б—З–µ—В –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Є —Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤.
–Э–µ–±–Є–≤–Њ–ї–Њ–ї (–С–Є–љ–µ–ї–Њ–ї) –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В –і—А—Г–≥–Є—Е –С–Р–С —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –Њ–Ї–∞–Ј—Л–≤–∞—В—М —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–µ —Б–Њ—Б—Г–і–Њ—А–∞—Б—И–Є—А—П—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ –љ–µ —Б–≤—П–Ј–∞–љ–Њ —Б β-–±–ї–Њ–Ї–Є—А—Г—О—Й–µ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –њ—А–µ–њ–∞—А–∞—В–∞, –∞ —П–≤–ї—П–µ—В—Б—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П —Н–љ–і–Њ—В–µ–ї–Є–є–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ —А–µ–ї–∞–Ї—Б–Є—А—Г—О—Й–µ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ (EDRF). –Ь–µ—Е–∞–љ–Є–Ј–Љ –і–∞–љ–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ —Б–≤—П–Ј–∞–љ —Б —В–µ–Љ, —З—В–Њ –љ–µ–±–Є–≤–Њ–ї–Њ–ї, —Б–Њ–µ–і–Є–љ—П—П—Б—М —Б L-–∞—А–≥–Є–љ–Є–љ–Њ–Љ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—О NO —Н–љ–і–Њ—В–µ–ї–Є–µ–Љ —Б–Њ—Б—Г–і–Њ–≤ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–µ–є [13]. –≠—В–∞ –ґ–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ (–С–Є–љ–µ–ї–Њ–ї–∞) –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≥–Њ–≤–Њ—А–Є—В—М –Њ –љ–µ–Љ –Ї–∞–Ї –Њ–± –Њ–і–љ–Њ–Љ –Є–Ј –њ—А–Є–Њ—А–Є—В–µ—В–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –°–Ф –Є –Ь–°. –Х–≥–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –≤–∞–Ј–Њ–і–Є–ї–∞—В–Є—А—Г—О—Й–Є–є —Н—Д—Д–µ–Ї—В –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ–Њ–≤—Л—И–µ–љ–Є—П N–Ю-–Ј–∞–≤–Є—Б–Є–Љ–Њ–є –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–Є –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –Њ–±—Й–µ–≥–Њ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П —Б–Њ—Б—Г–і–Њ–≤ –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Ї –Є–љ—Б—Г–ї–Є–љ—Г, —З—В–Њ –≤—Л–Ј—Л–≤–∞–µ—В —Г–ї—Г—З—И–µ–љ–Є–µ –Њ–±–Љ–µ–љ–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є–Ј–≤–µ—Б—В–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –≤–ї–Є—П–љ–Є—П –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ –љ–∞ —Д—Г–љ–Ї—Ж–Є—О —Н–љ–і–Њ—В–µ–ї–Є—П [2, 4, 6, 9, 16, 18, 19]:
– —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є NO-—Б–Є–љ—В–∞–Ј—Л (–µNOS);
– –Ј–∞–Љ–µ–і–ї–µ–љ–Є–µ —Б–љ–Є–ґ–µ–љ–Є—П NO —Б—Г–њ–µ—А–Њ–Ї—Б–Є–і–љ—Л–Љ–Є —А–∞–і–Є–Ї–∞–ї–∞–Љ–Є;
– –∞–Ї—В–Є–≤–∞—Ж–Є—П β3-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≤ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –Љ–Є–Ї—А–Њ—Б–Њ—Б—Г–і–∞—Е –Њ–њ–Њ—Б—А–µ–і—Г–µ—В —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Є–Њ–љ–Њ–≤ –Ї–∞–ї—М—Ж–Є—П, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–µ –і–ї—П –∞–Ї—В–Є–≤–∞—Ж–Є–Є eNOS;
– –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ —Б —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –Ї —Н—Б—В—А–∞–і–Є–Њ–ї—Г, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л–Љ–Є –љ–∞ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е, –∞–Ї—В–Є–≤–∞—Ж–Є—П –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤–Њ–≥–Њ –њ—Г—В–Є –Ј–∞ —Б—З–µ—В –Є–љ–і—Г–Ї—Ж–Є–Є PGI2;
– —Б—В–Є–Љ—Г–ї—П—Ж–Є—П –њ—Г—А–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, –≤–µ–і—Г—Й–∞—П –Ї –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—О NO –Є–Ј —Н–њ–Є—В–µ–ї–Є—П –Љ–Є–Ї—А–Њ—Б–Њ—Б—Г–і–Њ–≤ –њ–Њ—З–µ—З–љ—Л—Е –Ї–ї—Г–±–Њ—З–Ї–Њ–≤;
– —Г—Б—В—А–∞–љ–µ–љ–Є–µ –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞, –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –∞–і–Є–њ–Њ–љ–µ–Ї—В–Є–љ–∞ –Є —Б–љ–Є–ґ–µ–љ–Є–µ –†-—Б–µ–ї–µ–Ї—В–Є–љ–∞.
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ (–С–Є–љ–µ–ї–Њ–ї–∞) –њ—А–Є–≤–Њ–і–Є—В –Ї –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є —Д—Г–љ–Ї—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є—П –Є —Г—Б—В—А–∞–љ–µ–љ–Є—О –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞, –њ—А–Є —Н—В–Њ–Љ —Г–ї—Г—З—И–∞–µ—В—Б—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —В–Ї–∞–љ–µ–є –Ї –Є–љ—Б—Г–ї–Є–љ—Г, —Б–љ–Є–ґ–∞–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М –≥–ї—О–Ї–Њ–Ј—Л –љ–∞ 16%, –Є–љ—Б—Г–ї–Є–љ–∞ – –љ–∞ 10–20%, –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М – –љ–∞ 18–20%.
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Њ—В–Љ–µ—З–µ–љ–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Г—А–Њ–≤–µ–љ—М –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤ –Є —Н—А–µ–Ї—В–Є–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є —В–µ—А–∞–њ–Є–Є –љ–µ–±–Є–≤–Њ–ї–Њ–ї–Њ–Љ. –Э–µ–±–Є–≤–Њ–ї–Њ–ї, –Љ–Њ–і—Г–ї–Є—А—Г—П –≤—Л—А–∞–±–Њ—В–Ї—Г NO —Н–љ–і–Њ—В–µ–ї–Є–µ–Љ, –њ—А–Є–≤–Њ–і–Є—В –Ї –Љ—П–≥–Ї–Њ–є –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—Г–і–Њ–≤, –≤ —В.—З. —Б–Њ—Б—Г–і–Њ–≤ –Ї–∞–≤–µ—А–љ–Њ–Ј–љ—Л—Е —В–µ–ї –Є –њ–Њ–ї–Њ–≤—Л—Е –ґ–µ–ї–µ–Ј —Г –Љ—Г–ґ—З–Є–љ, —З—В–Њ —Г—Б–Є–ї–Є–≤–∞–µ—В –≤—Л—А–∞–±–Њ—В–Ї—Г –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤ –ґ–µ–ї–µ–Ј–∞–Љ–Є –Ї–∞–Ї –љ–∞–њ—А—П–Љ—Г—О, —В–∞–Ї –Є –Ј–∞ —Б—З–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є–Є –≥–Є–њ–Њ—В–∞–ї–∞–Љ–Њ-–≥–Є–њ–Њ—Д–Є–Ј–∞—А–љ–Њ–є –Њ—Б–Є –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Г–ї—Г—З—И–µ–љ–Є—П —Н—А–µ–Ї—В–Є–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є [7]. –Э–µ–±–Є–≤–Њ–ї–Њ–ї (–С–Є–љ–µ–ї–Њ–ї) –љ–µ —Б–Њ–і–µ—А–ґ–Є—В –≤ –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є —Г–Ї–∞–Ј–∞–љ–Є–є –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ —Н—А–µ–Ї—В–Є–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Є –ї–Є–±–Є–і–Њ, —З—В–Њ —Г–Љ–µ–љ—М—И–∞–µ—В —А–Є—Б–Ї –Њ—В–Ї–∞–Ј–∞ –Љ—Г–ґ—З–Є–љ –Њ—В –µ–ґ–µ–і–љ–µ–≤–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
–Э–∞–ї–Є—З–Є–µ –≥–Є–њ–µ—А—Б–Є–Љ–њ–∞—В–Є–Ї–Њ—В–Њ–љ–Є–Є –њ—А–Є –Ь–° –Є –Р–У —В—А–µ–±—Г–µ—В –Њ—Ж–µ–љ–Є—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ —Н—В–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є –љ–Њ–≤–Њ–≥–Њ –≤—Л—Б–Њ–Ї–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–≥–Њ β1-–∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–∞ III –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ (–С–Є–љ–µ–ї–Њ–ї), –Њ–±–ї–∞–і–∞—О—Й–µ–≥–Њ, –њ–Њ–Љ–Є–Љ–Њ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–≥–Њ, –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ–Є –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ–Є –њ–ї–µ–є–Њ—В—А–Њ–њ–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є –Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О —Г–ї—Г—З—И–∞—В—М –≤—Л—А–∞–±–Њ—В–Ї—Г NO.
–Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –Р–У —Г –Љ—Г–ґ—З–Є–љ —Б –Ь–° –±—Л–ї –њ—А–Њ–≤–µ–і–µ–љ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –С–Р–С –С–Є–љ–µ–ї–Њ–ї–∞ (–љ–µ–±–Є–≤–Њ–ї–Њ–ї) –Є –С–†–Р II –≤–∞–ї—Б–∞—А—В–∞–љ–∞.
–Т–∞–ї—Б–∞—А—В–∞–љ –±—Л–ї –≤—Л–±—А–∞–љ –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–∞, —А–∞–љ–µ–µ –і–Њ–Ї–∞–Ј–∞–≤—И–µ–≥–Њ —Б–≤–Њ—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М, –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї—Г—О –љ–µ–є—В—А–∞–ї—М–љ–Њ—Б—В—М –Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ —Б–µ–Ї—Б—Г–∞–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О —Г –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –±–Њ–ї—М–љ—Л—Е [5].
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л
–Ф–ї—П –Є–Ј—Г—З–µ–љ–Є—П –≤–ї–Є—П–љ–Є—П –С–Є–љ–µ–ї–Њ–ї–∞ (–љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞) –Є –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –љ–∞ —Г—А–Њ–≤–µ–љ—М –Р–Ф, —Б—В–µ–њ–µ–љ—М –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –≠–Ф, —Г—А–Њ–≤–µ–љ—М –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤ —Г –Љ—Г–ґ—З–Є–љ —Б –Ь–° –љ–∞–Љ–Є –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –Њ—В–Ї—А—Л—В–Њ–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ, —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤ –њ–∞—А–∞–ї–ї–µ–ї—М–љ—Л—Е –≥—А—Г–њ–њ–∞—Е.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л 40 –±–Њ–ї—М–љ—Л—Е —Б –Р–У I–III —Б—В–µ–њ–µ–љ–Є, —Г –Ї–Њ—В–Њ—А—Л—Е –љ–µ –±—Л–ї –і–Њ—Б—В–Є–≥–љ—Г—В —Ж–µ–ї–µ–≤–Њ–є —Г—А–Њ–≤–µ–љ—М –Р–Ф –≤ —В–µ—З–µ–љ–Є–µ –љ–µ –Љ–µ–љ–µ–µ 3 –Љ–µ—Б. –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–є –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є.
–С–Њ–ї—М–љ—Л–µ –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –љ–∞ 2 –≥—А—Г–њ–њ—Л «–Љ–µ—В–Њ–і–Њ–Љ –Ї–Њ–љ–≤–µ—А—В–Њ–≤» –≤ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–Є 1:1. –Т –Є—В–Њ–≥–µ –њ–Њ 20 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–ї—Г—З–∞–ї–Є —В–µ—А–∞–њ–Є—О –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –С–Є–љ–µ–ї–Њ–ї –≤ –і–Њ–Ј–µ 5/7,5 –Љ–≥ –Є–ї–Є –≤–∞–ї—Б–∞—А—В–∞–љ–Њ–Љ – 80/120 –Љ–≥. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –і–Њ–Ј—Л –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–Њ—Б—М –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є —З–µ—А–µ–Ј 4 –љ–µ–і. –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є.
–Я–∞—Ж–Є–µ–љ—В –≤–Ї–ї—О—З–∞–ї—Б—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Є —Б–Њ–±–ї—О–і–µ–љ–Є–Є –њ—А–∞–≤–Є–ї G–°P – Good clinical practice (–Ъ–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є), –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –њ–Њ–і–њ–Є—Б–∞–љ–Є—П –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б–Њ–≥–ї–∞—Б–Є—П –Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є—П –Ї—А–Є—В–µ—А–Є—П–Љ –≤–Ї–ї—О—З–µ–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Ї—А–Є—В–µ—А–Є–µ–≤ –Є—Б–Ї–ї—О—З–µ–љ–Є—П.
–Ъ—А–Є—В–µ—А–Є–Є –≤–Ї–ї—О—З–µ–љ–Є—П:
1. –Т–Њ–Ј—А–∞—Б—В – –Љ—Г–ґ—З–Є–љ—Л –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 30 –і–Њ 60 –ї–µ—В (–≤–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ).
2. –Э–∞–ї–Є—З–Є–µ –Р–У I–II —Б—В–µ–њ–µ–љ–Є —Б —Г—А–Њ–≤–љ–µ–Љ –°–Р–Ф 140–160 –Љ–Љ —А—В.—Б—В. –Є –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–µ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –ї—О–±—Л–Љ –Ї–ї–∞—Б—Б–Њ–Љ –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ –Љ–µ–љ–µ–µ 3 –Љ–µ—Б.
3. –Э–∞–ї–Є—З–Є–µ –Ь–° –њ–Њ –Ї—А–Є—В–µ—А–Є—П–Љ IDF.
4. –Э–∞–ї–Є—З–Є–µ –≠–Ф: –Њ—Ж–µ–љ–Ї–∞ –њ–Њ —И–Ї–∞–ї–µ –Ь–Ш–≠–§-5 – –Љ–µ–љ–µ–µ 21 –±–∞–ї–ї–∞.
5. –Я–Є—Б—М–Љ–µ–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ –±–Њ–ї—М–љ–Њ–≥–Њ –љ–∞ —Г—З–∞—Б—В–Є–µ –≤ –њ—А–Њ–≥—А–∞–Љ–Љ–µ.
–Ъ—А–Є—В–µ—А–Є–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П:
–Я–∞—Ж–Є–µ–љ—В—Л, –Є–Љ–µ—О—Й–Є–µ –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ –Њ–і–Є–љ –Є–Ј –љ–Є–ґ–µ–њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤, –љ–µ –Љ–Њ–≥—Г—В –±—Л—В—М –≤–Ї–ї—О—З–µ–љ—Л –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ:
1. –Т–Њ–Ј—А–∞—Б—В –Љ–Њ–ї–Њ–ґ–µ 30 –Є —Б—В–∞—А—И–µ 60 –ї–µ—В.
2. –Э–∞–ї–Є—З–Є–µ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Є–ї–Є –Њ—В–Љ–µ—З–µ–љ–љ–Њ–є —А–∞–љ–µ–µ –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –С–Р–С, –С–†–Р II.
3. –°–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–∞—П –Р–У.
4. –Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –љ–∞—А—Г—И–∞—О—Й–Є–µ –Ї–Є—И–µ—З–љ—Г—О –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В—М –Є/–Є–ї–Є –∞–±—Б–Њ—А–±—Ж–Є—О.
5. –°–Ф 1 —В–Є–њ–∞ (–°–Ф1) –Є –љ–µ–Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–є –Є–љ—Б—Г–ї–Є–љ–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–є –°–Ф 2.
6. –Ы—О–±—Л–µ —В—П–ґ–µ–ї—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –њ–µ—З–µ–љ–Њ—З–љ–Њ-–њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є.
7. –Ч–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–µ –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П.
8. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–∞—П –±—А–Њ–љ—Е–Є–∞–ї—М–љ–∞—П –Њ–±—Б—В—А—Г–Ї—Ж–Є—П.
9. –Э–µ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –њ–Њ–љ—П—В—М —Б—Г—В—М –њ—А–Њ–≥—А–∞–Љ–Љ—Л –Є –і–∞—В—М –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ –љ–∞ —Г—З–∞—Б—В–Є–µ.
–°—Е–µ–Љ–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
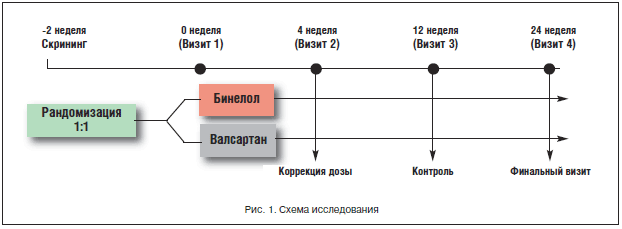
–°—Е–µ–Љ–∞ –њ—А–Њ–≥—А–∞–Љ–Љ—Л –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1. –Ш—Б—Е–Њ–і–љ–Њ –љ–∞ –≤–Є–Ј–Є—В–µ 0 –±—Л–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–∞ –Њ—Ж–µ–љ–Ї–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –±–Њ–ї—М–љ—Л—Е, –Ї—А–Є—В–µ—А–Є–µ–≤ –≤–Ї–ї—О—З–µ–љ–Є—П –Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П, –Њ—Ж–µ–љ–Ї–∞ —А–µ–≥—Г–ї—П—А–љ–Њ—Б—В–Є –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є –њ–Њ–і–њ–Є—Б–∞–љ–Њ —Б–Њ–≥–ї–∞—Б–Є–µ –љ–∞ —Г—З–∞—Б—В–Є–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є. –Ф–Њ–Ј—Л –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –±—Л–ї–Є —Б—В–∞–±–Є–ї—М–љ—Л –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ 2-–љ–µ–і–µ–ї—М–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ —Б–Ї—А–Є–љ–Є–љ–≥–∞.
–Я–Њ—Б–ї–µ –њ–µ—А–Є–Њ–і–∞ —Б–Ї—А–Є–љ–Є–љ–≥–∞ –±–Њ–ї—М–љ—Л–µ (–≤–Є–Ј–Є—В 1) –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –љ–∞ 2 –≥—А—Г–њ–њ—Л: –њ–µ—А–≤–∞—П –≥—А—Г–њ–њ–∞ – —В–µ—А–∞–њ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –С–Є–љ–µ–ї–Њ–ї BELUPO (–љ–µ–±–Є–≤–Њ–ї–Њ–ї) –њ–Њ 5 –Љ–≥/—Б—Г—В., –≤—В–Њ—А–∞—П –≥—А—Г–њ–њ–∞ – —В–µ—А–∞–њ–Є—П –≤–∞–ї—Б–∞—А—В–∞–љ–Њ–Љ –њ–Њ 80 –Љ–≥/—Б—Г—В.
–Ъ–Њ–љ—В—А–Њ–ї—М–љ—Л–µ –≤–Є–Ј–Є—В—Л —Б –Њ—Ж–µ–љ–Ї–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М —З–µ—А–µ–Ј 4 (–≤–Є–Ј–Є—В 2), 12 (–≤–Є–Ј–Є—В 3) –Є 24 (–≤–Є–Ј–Є—В 4) –љ–µ–і. –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П.
–Я—А–Є–µ–Љ –і—А—Г–≥–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є, —Б—А–µ–і—Б—В–≤, –≤–ї–Є—П—О—Й–Є—Е –љ–∞ —Н—А–µ–Ї—Ж–Є—О (–Є–љ–≥–Є–±–Є—В–Њ—А—Л —Д–Њ—Б—Д–Њ–і–Є—Н—Б—В–µ—А–∞–Ј—Л-5, –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞), –Є –Ї–Њ—А—А–µ–Ї—Ж–Є—П –і–Њ–Ј –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –±—Л–ї–Є –Ї—А–Є—В–µ—А–Є–µ–Љ –Є—Б–Ї–ї—О—З–µ–љ–Є—П –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Т—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –Њ–±—Й–µ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤–Ї–ї—О—З–∞—О—Й–µ–µ —Д–Є–Ј–Є–Ї–∞–ї—М–љ—Л–є –Њ—Б–Љ–Њ—В—А, –∞–љ–∞–ї–Є–Ј –ґ–∞–ї–Њ–±, –∞–љ–∞–Љ–љ–µ–Ј–∞, –≤—Л—П—Б–љ—П–ї–Њ—Б—М –љ–∞–ї–Є—З–Є–µ –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ—Б—В–Є –Є –≤—А–µ–і–љ—Л—Е –њ—А–Є–≤—Л—З–µ–Ї, —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–Є—Б—М –≤—Б–µ –њ—А–Є–љ–Є–Љ–∞–µ–Љ—Л–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л. –Т—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –∞–љ–Ї–µ—В–Є—А–Њ–≤–∞–љ–Є–µ —Б –њ–Њ–Љ–Њ—Й—М—О —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Њ–њ—А–Њ—Б–љ–Є–Ї–Њ–≤: –Њ–њ—А–Њ—Б–љ–Є–Ї –њ–Њ —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ —Б—В–∞—А–µ–љ–Є—П —Г –Љ—Г–ґ—З–Є–љ (AMS), –∞–љ–Ї–µ—В–∞ –і–ї—П –Њ—Ж–µ–љ–Ї–Є —Б–µ–Ї—Б—Г–∞–ї—М–љ–Њ–≥–Њ –Ј–і–Њ—А–Њ–≤—М—П –Љ—Г–ґ—З–Є–љ—Л (–Ь–Ш–≠–§-5), –∞–љ–Ї–µ—В–∞ –Њ—Ж–µ–љ–Ї–Є —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–µ–љ–љ–Њ—Б—В–Є —Б–µ–Ї—Б—Г–∞–ї—М–љ—Л—Е –њ–∞—А—В–љ–µ—А–Њ–≤ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ–µ—В–Њ–і–Њ–Љ –ї–µ—З–µ–љ–Є—П –≠–Ф (EDITS), –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–∞—П —И–Ї–∞–ї–∞ –і–µ–њ—А–µ—Б—Б–Є–Є –Є —В—А–µ–≤–Њ–≥–Є (HADS), –Я–Є—В—В—Б–±—Г—А–≥—Б–Ї–Є–є –Њ–њ—А–Њ—Б–љ–Є–Ї –љ–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Є–љ–і–µ–Ї—Б–∞ –Ї–∞—З–µ—Б—В–≤–∞ —Б–љ–∞ (PSQI).
–Ю—Ж–µ–љ–Є–≤–∞–ї—Б—П –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є (–Њ–±—Й–Є–є —Е–Њ–ї–µ—Б—В–µ—А–Є–љ (–Ю–•), —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і—Л (–Ґ–У), –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і—Л –љ–Є–Ј–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є (–Ы–Я–Э–Я), –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і—Л –≤—Л—Б–Њ–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є (–Ы–Я–Т–Я), –≥–ї—О–Ї–Њ–Ј–∞, –Љ–Њ—З–µ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ (–Ь–Ъ)). –£—А–Њ–≤–љ–Є –Њ–±—Й–µ–≥–Њ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –Є –°–°–°–У –Є—Б—Б–ї–µ–і–Њ–≤–∞–ї–Є—Б—М –љ–∞ –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–µ IMMULITE 1000 (–°–®–Р). –Ч–∞–±–Њ—А –Ї—А–Њ–≤–Є –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї—Б—П —В—А–Є–ґ–і—Л —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ –≤ 20 –Љ–Є–љ., –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є—Б—В–Є–љ–љ–Њ–≥–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–ї—Б—П —Б–∞–Љ—Л–є –љ–Є–Ј–Ї–Є–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М. –§—А–∞–Ї—Ж–Є–Є –Ґ –Њ–њ—А–µ–і–µ–ї—П–ї–Є—Б—М —А–∞—Б—З–µ—В–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –њ–Њ –Є–Ј–≤–µ—Б—В–љ—Л–Љ –Љ–∞—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ —Д–Њ—А–Љ—Г–ї–∞–Љ (–њ–∞—В–µ–љ—В вДЦ 2439578 –Њ—В 10.01. 2012 –≥.). –Ю—Ж–µ–љ–Ї–∞ —Б–Њ—Б—В–Њ—П–љ–Є—П —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є (–°–Я–Т–Ї—Д, —Ж–°–Р–Ф, Alx) –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–∞—Б—М –љ–∞ –∞–њ–њ–∞—А–∞—В–µ SphygmoCor. –Ґ–Ш–Ь –°–Р –Є –Я–Ч–Т–Ф –љ–∞ –њ–ї–µ—З–µ–≤–Њ–є –∞—А—В–µ—А–Є–Є –Њ–њ—А–µ–і–µ–ї—П–ї–Є –љ–∞ –∞–њ–њ–∞—А–∞—В–µ Aloka ProSound a7(USA). –Я—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є –°–Ь–Р–Ф —Б –њ–Њ–Љ–Њ—Й—М—О BR-102 plus (S—Бhiller AG).
–Т–ї–Є—П–љ–Є–µ –љ–∞ —Г–≥–ї–µ–≤–Њ–і–љ—Л–є –Њ–±–Љ–µ–љ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –њ—Г—В–µ–Љ –∞–љ–∞–ї–Є–Ј–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б—Г—В–Њ—З–љ–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є—П —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л, —А–µ–≥–Є—Б—В—А–Є—А—Г–µ–Љ–Њ–≥–Њ —Б –њ–Њ–Љ–Њ—Й—М—О –≥–ї—О–Ї–Њ–Љ–µ—В—А–∞ OneTouch Select, Johnson&Johnson, –Љ–Є–љ–Є–Љ—Г–Љ –≤ 12 —В–Њ—З–Ї–∞—Е –Є–Ј–Љ–µ—А–µ–љ–Є—П –Ј–∞ —Б—Г—В–Ї–Є –Є —Б–Є—Б—В–µ–Љ—Л –Њ–±—А–∞–±–Њ—В–Ї–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Б–∞–Љ–Њ–Ї–Њ–љ—В—А–Њ–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ «–У–ї—О–Ї–Њ–њ—А–Є–љ—В» (–§–У–С–£ –≠–Э–¶ –†–§).
–Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є —Г—Б—В–љ—Л–µ –Є –њ–Є—Б—М–Љ–µ–љ–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—О –њ–Є—Й–µ–≤–Њ–≥–Њ –њ–Њ–≤–µ–і–µ–љ–Є—П –Є –њ–Њ–≤—Л—И–µ–љ–Є—О —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є (—А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–ї–Њ—Б—М –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ 150 –Љ–Є–љ. –≤ –љ–µ–і–µ–ї—О —Г–Љ–µ—А–µ–љ–љ–Њ–є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є). –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –љ–∞–±–ї—О–і–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б–Њ—Б—В–∞–≤–Є–ї–∞ 24 –љ–µ–і.
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ–≥—А–∞–Љ–Љ STATISTICA 10.0, StatSoft, Inc –Є Microsoft Excel 2010. –Я—А–Њ–≤–µ—А–Ї–∞ –љ–Њ—А–Љ–∞–ї—М–љ–Њ—Б—В–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –Љ–µ—В–Њ–і–Њ–Љ –Ъ–Њ–ї–Љ–Њ–≥–Њ—А–Њ–≤–∞-–°–Љ–Є—А–љ–Њ–≤–∞ —Б –њ–Њ–њ—А–∞–≤–Ї–Њ–є –Ы–Є–ї–ї–Є–µ—Д–Њ—А—Б–∞. –Э–µ–њ—А–µ—А—Л–≤–љ—Л–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –≤—Л—А–∞–ґ–∞–ї–Є—Б—М –≤ –≤–Є–і–µ M±SD, –≥–і–µ –Ь – —Б—А–µ–і–љ–µ–µ –∞—А–Є—Д–Љ–µ—В–Є—З–µ—Б–Ї–Њ–µ, SD – –°–Ъ–Ю. –Ф–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П –і–≤—Г—Е –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –≥—А—Г–њ–њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є t-–Ї—А–Є—В–µ—А–Є–є C—В—М—О–і–µ–љ—В–∞. –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ–Є —Б—З–Є—В–∞–ї–Є —А–∞–Ј–ї–Є—З–Є—П –њ—А–Є p<0,05.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Ъ–ї–Є–љ–Є–Ї–Њ-–і–µ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –±–Њ–ї—М–љ—Л—Е, –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 1. –Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е, –њ–Њ –Њ—Б–љ–Њ–≤–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л–µ –≥—А—Г–њ–њ—Л –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є.
–Ю–±—Б–ї–µ–і—Г–µ–Љ—Л–µ –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –≤ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–Є 1:1:
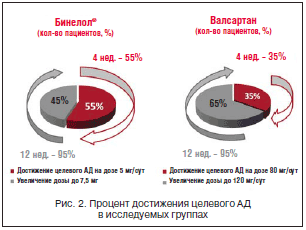
–Я–∞—Ж–Є–µ–љ—В—Л 1-–є –≥—А—Г–њ–њ—Л –њ–Њ–ї—Г—З–∞–ї–Є –С–Є–љ–µ–ї–Њ–ї (–љ–µ–±–Є–≤–Њ–ї–Њ–ї) 5 –Љ–≥ 1 —А–∞–Ј/—Б—Г—В., –њ–Њ—Б–ї–µ –Њ—Ж–µ–љ–Ї–Є –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Р–Ф –і–Њ–Ј–∞ –Љ–Њ–≥–ї–∞ –±—Л—В—М —Г–≤–µ–ї–Є—З–µ–љ–∞ –і–Њ 7,5 –Љ–≥ 1 —А–∞–Ј/—Б—Г—В. –Я–∞—Ж–Є–µ–љ—В—Л 2-–є –≥—А—Г–њ–њ—Л – –≤–∞–ї—Б–∞—А—В–∞–љ 80 –Љ–≥ 1 —А–∞–Ј/—Б—Г—В., –њ–Њ—Б–ї–µ –Њ—Ж–µ–љ–Ї–Є –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Р–Ф –і–Њ–Ј–∞ –Љ–Њ–≥–ї–∞ –±—Л—В—М —Г–≤–µ–ї–Є—З–µ–љ–∞ –і–Њ 120 –Љ–≥ 1 —А–∞–Ј/—Б—Г—В. –Я–Њ—Б–ї–µ –њ—А–Њ—Ж–µ–і—Г—А—Л —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є –њ—А–Њ–≤–µ–ї–Є –Њ—Ж–µ–љ–Ї—Г –Є–Ј—Г—З–∞–µ–Љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –Є—Б—Е–Њ–і–љ–Њ, —Б–њ—Г—Б—В—П 4, 12 –Є 24 –љ–µ–і. —В–µ—А–∞–њ–Є–Є. –Э–∞ –≤–Є–Ј–Є—В–µ 2 –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М —Б—В–µ–њ–µ–љ—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є, –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Њ—Б—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —А–∞–Љ–Ї–∞—Е –њ—А–Њ—В–Њ–Ї–Њ–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Я–∞—Ж–Є–µ–љ—В—Л —Б—З–Є—В–∞–ї–Є—Б—М «–і–Њ—Б—В–Є–≥—И–Є–Љ–Є —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П», –µ—Б–ї–Є –і–Њ—Б—В–Є–≥–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Р–Ф –Љ–µ–љ–µ–µ 140/90 –Љ–Љ —А—В.—Б—В. —Б–њ—Г—Б—В—П 4 –љ–µ–і. —В–µ—А–∞–њ–Є–Є. –Т –≥—А—Г–њ–њ–µ –С–Є–љ–µ–ї–Њ–ї–∞ —Ж–µ–ї–µ–≤—Л—Е —Г—А–Њ–≤–љ–µ–є –Р–Ф —З–µ—А–µ–Ј 4 –љ–µ–і. —В–µ—А–∞–њ–Є–Є –і–Њ—Б—В–Є–≥–ї–Є 55% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ – 35%. –Я—А–Є –љ–µ–і–Њ—Б—В–Є–ґ–µ–љ–Є–Є —Ж–µ–ї–µ–≤—Л—Е —Г—А–Њ–≤–љ–µ–є –Р–Ф –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л–Љ –љ–∞ –≤–Є–Ј–Є—В–µ 2 —Г–≤–µ–ї–Є—З–Є–ї–Є –і–Њ–Ј—Г –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ –і–Њ 7,5 –Љ–≥ (–С–Є–љ–µ–ї–Њ–ї), –≤–∞–ї—Б–∞—А—В–∞–љ–∞ – –і–Њ 120 –Љ–≥.
–£–≤–µ–ї–Є—З–µ–љ–Є–µ –і–Њ–Ј—Л –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М 9 (45%) –њ–∞—Ж–Є–µ–љ—В–∞–Љ –≤ –≥—А—Г–њ–њ–µ –С–Є–љ–µ–ї–Њ–ї–∞ –Є 13 (65%) – –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ (—А–Є—Б. 2).
–Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л, –Ї–Њ—В–Њ—А—Л–Љ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–∞—Б—М –Ї–Њ—А—А–µ–Ї—Ж–Є—П –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ–є –і–Њ–Ј—Л –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Є—Б—Е–Њ–і–љ–Њ –Є–Љ–µ–ї–Є –Ш–Ь–Ґ >25 –Ї–≥/–Љ2 –Є –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Г—О —Б—В–µ–њ–µ–љ—М –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Њ–ґ–Є—А–µ–љ–Є—П –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–Љ –Ї–Њ—А—А–µ–Ї—Ж–Є—П –і–Њ–Ј—Л –љ–µ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–∞—Б—М.
–Э–∞ –≤–Є–Ј–Є—В–µ 12 –Њ—Ж–µ–љ–Є–ї–Є —Б—В–µ–њ–µ–љ—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є. –¶–µ–ї–µ–≤—Л—Е —Г—А–Њ–≤–љ–µ–є –Р–Ф —Г–і–∞–ї–Њ—Б—М –і–Њ—Б—В–Є—З—М —Г 95% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ (–С–Є–љ–µ–ї–Њ–ї) –Є —Г 95% – –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –љ–∞ –≤–Є–Ј–Є—В–µ –≤ 24 –љ–µ–і. –Њ—Ж–µ–љ–Є–ї–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ї–Њ–љ—В—А–Њ–ї—П –Р–У (—В–∞–±–ї. 2).
–Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е, –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ (–С–Є–љ–µ–ї–Њ–ї) –Є –≤–∞–ї—Б–∞—А—В–∞–љ–∞ —З–µ—А–µ–Ј 12 –љ–µ–і. –њ–Њ —Б–љ–Є–ґ–µ–љ–Є—О –°–Р–Ф –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ –±—Л–ї–Њ. –Я—А–Є –Є—Б—Е–Њ–і–љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–Љ —Г—А–Њ–≤–љ–µ –Ф–Р–Ф –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –µ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —З–µ—А–µ–Ј 24 –љ–µ–і. —В–∞–Ї–ґ–µ –±—Л–ї–Њ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ, –љ–Њ —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –±—Л–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ–Є. –Т —Е–Њ–і–µ –ї–µ—З–µ–љ–Є—П –љ–µ–±–Є–≤–Њ–ї–Њ–ї–Њ–Љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≤–∞–ї—Б–∞—А—В–∞–љ–Њ–Љ –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –≤ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –І–°–°. –°—А–µ–і–љ—П—П –І–°–° —Б–Є–і—П –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –љ–µ–±–Є–≤–Њ–ї–Њ–ї–Њ–Љ —Б–љ–Є–Ј–Є–ї–∞—Б—М –Ј–∞ 24 –љ–µ–і. –љ–∞ 14,2% (p<0,05), –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ —Б—А–µ–і–љ—П—П –І–°–° –Ј–љ–∞—З–Є–Љ–Њ –љ–µ –Є–Ј–Љ–µ–љ–Є–ї–∞—Б—М, —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 5,2%. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –і–∞–љ–љ—Л—Е –°–Ь–Р–Ф –Њ—В–Љ–µ—З–∞–ї–∞—Б—М –і–Є–љ–∞–Љ–Є–Ї–∞, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–∞—П –≤ —В–∞–±–ї–Є—Ж–µ 3.
–°—В–µ–њ–µ–љ—М —Б–љ–Є–ґ–µ–љ–Є—П —Б—А–µ–і–љ–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ф–Р–Ф –≤ –љ–Њ—З–љ—Л–µ —З–∞—Б—Л –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —А–∞–Ј–ї–Є—З–∞–ї–∞—Б—М: –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –Ф–Р–Ф —Б–љ–Є–ґ–∞–ї–Њ—Б—М –≤ –≥—А—Г–њ–њ–µ –С–Є–љ–µ–ї–Њ–ї–∞ – 18,9% (—А<0,05) –њ—А–Њ—В–Є–≤ 11,8% (—А<0,05) –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞. –≠—В–Є –і–∞–љ–љ—Л–µ –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В—Б—П —В–∞–Ї–ґ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —А–∞–Ј–ї–Є—З–Є–µ–Љ –Є–љ–і–µ–Ї—Б–∞ –≤—А–µ–Љ–µ–љ–Є –Ф–Р–Ф –≤ –љ–Њ—З–љ—Л–µ —З–∞—Б—Л –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е – —Б–љ–Є–ґ–µ–љ–Є–µ –Ї 24-–є –љ–µ–і. —В–µ—А–∞–њ–Є–Є –≤ –≥—А—Г–њ–њ–µ –С–Є–љ–µ–ї–Њ–ї–∞ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 77,3% (—А<0,05), –≤–∞–ї—Б–∞—А—В–∞–љ–∞ – 69,6% (—А<0,05), —А–∞–Ј–ї–Є—З–Є–µ –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –±—Л–ї–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ (—А<0,05).
–Ф–∞–љ–љ—Л–µ –°–Ь–Р–Ф –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ (–С–Є–љ–µ–ї–Њ–ї) –Є –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –њ–Њ —Б–љ–Є–ґ–µ–љ–Є—О —Б—А–µ–і–љ–µ–і–љ–µ–≤–љ–Њ–≥–Њ –°–Р–Ф –Є –Ф–Р–Ф. –°—В–µ–њ–µ–љ—М —Б–љ–Є–ґ–µ–љ–Є—П —Б—А–µ–і–љ–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –°–Р–Ф –≤ –љ–Њ—З–љ—Л–µ —З–∞—Б—Л —В–∞–Ї–ґ–µ –Ј–љ–∞—З–Є–Љ–Њ –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–∞—Б—М. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –ї–µ—З–µ–љ–Є—П —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М —Б—В–µ–њ–µ–љ—М –љ–∞–≥—А—Г–Ј–Ї–Є –і–∞–≤–ї–µ–љ–Є–µ–Љ — –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–Љ–µ–љ—М—И–Є–ї—Б—П –Є–љ–і–µ–Ї—Б –≤—А–µ–Љ–µ–љ–Є –°–Р–Ф –≤ –і–љ–µ–≤–љ—Л–µ –Є –љ–Њ—З–љ—Л–µ —З–∞—Б—Л, –∞ —В–∞–Ї–ґ–µ –Є–љ–і–µ–Ї—Б –≤—А–µ–Љ–µ–љ–Є –°–Р–Ф –≤ –љ–Њ—З–љ—Л–µ —З–∞—Б—Л, —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –±—Л–ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ–Є.
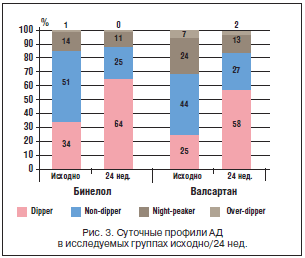
–Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –ї–µ—З–µ–љ–Є—П –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —Б–і–≤–Є–≥–Є –≤ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П—Е —Б—Г—В–Њ—З–љ–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П –Р–Ф (—А–Є—Б. 3). –Ґ–∞–Ї, –і–Њ –ї–µ—З–µ–љ–Є—П —Г –±–Њ–ї—М–љ—Л—Е –≤ –≥—А—Г–њ–њ–µ –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ –љ–∞–±–ї—О–і–∞–ї–Є —Б–ї–µ–і—Г—О—Й–Є–µ –њ—А–Њ—Д–Є–ї–Є –°–Р–Ф: dipper – 34%, non-dipper – 51%; night-peaker – 14%; over-dipper – 1%. –І–µ—А–µ–Ј 24 –љ–µ–і. —В–µ—А–∞–њ–Є–Є –љ–µ–±–Є–≤–Њ–ї–Њ–ї–Њ–Љ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –і–≤—Г—Е–Ї—А–∞—В–љ–Њ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –љ–Њ—З–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є, –і–≤—Г—Е–Ї—А–∞—В–љ–Њ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –њ—А–Њ—Д–Є–ї—П dipper, –∞ —В–∞–Ї–ґ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –њ—А–Њ—Д–Є–ї—П night-peaker. –Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Е–∞—А–∞–Ї—В–µ—А–∞ —Б—Г—В–Њ—З–љ–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П –Р–Ф –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л–µ –±–Њ–ї—М–љ—Л–µ –њ–Њ—Б–ї–µ —В–µ—А–∞–њ–Є–Є –љ–µ–±–Є–≤–Њ–ї–Њ–ї–Њ–Љ —А–∞—Б–њ—А–µ–і–µ–ї–Є–ї–Є—Б—М —Б–ї–µ–і—Г—О—Й–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ: dipper – 64% (—А<0,05); non-dipper – 25% (—А<0,05); night-peaker – 11% (—А<0,05); over-dipper – 0% (—А>0,05). –Т –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –Є—Б—Е–Њ–і–љ–Њ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —Б–ї–µ–і—Г—О—Й–Є–µ –њ—А–Њ—Д–Є–ї–Є –°–Р–Ф: 25% – dipper, 44% – non-dipper, 7% – over-dipper, 24% – night-peaker. –Я–Њ—Б–ї–µ 24 –љ–µ–і. –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є —Б—В—А—Г–Ї—В—Г—А–∞ –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –Є–Ј–Љ–µ–љ–Є–ї–∞—Б—М: 58% – dipper, 27% – non-dipper, 2% – over-dipper, 13% – night-peaker. –¶–µ–ї–µ–≤—Л—Е —Г—А–Њ–≤–љ–µ–є –Р–Ф –≤ –і–љ–µ–≤–љ—Л–µ —З–∞—Б—Л –њ–Њ –і–∞–љ–љ—Л–Љ –°–Ь–Р–Ф (<130/85 –Љ–Љ —А—В.—Б—В.) –≤ –≥—А—Г–њ–њ–µ –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ –і–Њ—Б—В–Є–≥–ї–Є 75% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ – 60%, –≤ –љ–Њ—З–љ—Л–µ —З–∞—Б—Л (<120/70 –Љ–Љ —А—В.—Б—В) – 60 –Є 50% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ.
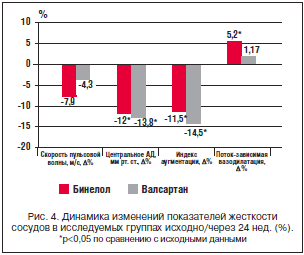
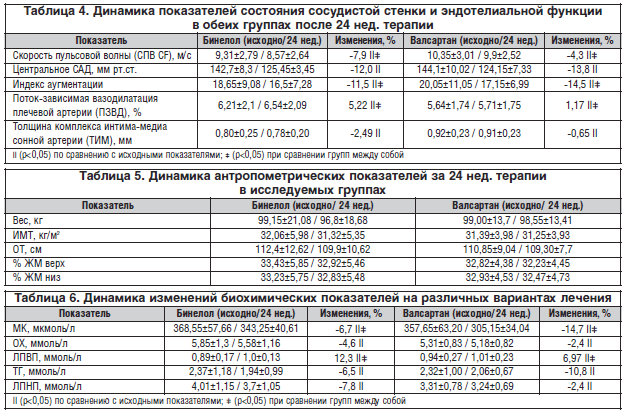
–Ф–Є–љ–∞–Љ–Є–Ї–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф –Є —Г–њ—А—Г–≥–Њ—Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ –∞—А—В–µ—А–Є–є –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 4 –Є –љ–∞ —А–Є—Б—Г–љ–Ї–µ 4. –Т –≥—А—Г–њ–њ–∞—Е –ї–µ—З–µ–љ–Є—П –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Ж–°–Р–Ф –љ–∞ 12% (—А<0,05) –≤ –≥—А—Г–њ–њ–µ –С–Є–љ–µ–ї–Њ–ї–∞ (–љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞) –Є –љ–∞ 13,8% (—А<0,05) – –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞. –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –∞—А—В–µ—А–Є–є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ –Є–љ–і–µ–Ї—Б –∞—Г–≥–Љ–µ–љ—В–∞—Ж–Є–Є. –Ш–љ–і–µ–Ї—Б –∞—Г–≥–Љ–µ–љ—В–∞—Ж–Є–Є – —Н—В–Њ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –њ—А—П–Љ–Њ–є –Є –Њ—В—А–∞–ґ–µ–љ–љ–Њ–є –њ—Г–ї—М—Б–Њ–≤—Л—Е –≤–Њ–ї–љ, –њ—А–Њ—Е–Њ–і—П—Й–Є—Е –њ–Њ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–µ. –Ш–Ј–Љ–µ–љ–µ–љ–Є–µ –і–∞–љ–љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П —Б–Њ—Б—В–∞–≤–Є–ї–Њ 11,5% (—А<0,05) –≤ –≥—А—Г–њ–њ–µ –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ –Є 14,5% (—А<0,05) – –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞. –Э–∞–Љ–Є –Њ—В–Љ–µ—З–µ–љ–Њ —В–∞–Ї–ґ–µ —Г–ї—Г—З—И–µ–љ–Є–µ —Г–њ—А—Г–≥–Њ—Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ –∞—А—В–µ—А–Є–є –Ј–∞ —Б—З–µ—В —Б–љ–Є–ґ–µ–љ–Є—П –°–Я–Т –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е. –Ф–Є–љ–∞–Љ–Є–Ї–∞ –Я–Ч–Т–Ф –≤ –≥—А—Г–њ–њ–µ –С–Є–љ–µ–ї–Њ–ї–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 5,22% (—А<0,05), –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –і–∞–љ–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —В–∞–Ї–ґ–µ —Г–≤–µ–ї–Є—З–Є–ї—Б—П, –љ–Њ —Б—В–µ–њ–µ–љ—М —Г–≤–µ–ї–Є—З–µ–љ–Є—П –љ–µ –і–Њ—Б—В–Є–≥–ї–∞ —Г—А–Њ–≤–љ—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є. –Я—А–Є –Њ—Ж–µ–љ–Ї–µ –≤–ї–Є—П–љ–Є—П –љ–∞ –Ї–Њ–Љ–њ–ї–µ–Ї—Б –Є–љ—В–Є–Љ–∞-–Љ–µ–і–Є–∞ —Б–Њ–љ–љ–Њ–є –∞—А—В–µ—А–Є–Є –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –і–∞–љ–љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П (—А<0,05), –Њ–і–љ–∞–Ї–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є —Б—В–µ–њ–µ–љ—М –µ–≥–Њ –±—Л–ї–∞ –љ–µ–±–Њ–ї—М—И–Њ–є.
–°—А–µ–і–љ–µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –≤–µ—Б–∞ –Ј–∞ 24 –љ–µ–і. —В–µ—А–∞–њ–Є–Є —Б–Њ—Б—В–∞–≤–Є–ї–Њ -2,35 –Ї–≥ –≤ –≥—А—Г–њ–њ–µ –С–Є–љ–µ–ї–Њ–ї–∞ –Є -0,45 –Ї–≥ – –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞. –Т —Б–≤—П–Ј–Є —Б –љ–µ–±–Њ–ї—М—И–Є–Љ –њ–µ—А–Є–Њ–і–Њ–Љ –љ–∞–±–ї—О–і–µ–љ–Є—П –Є–Ј–Љ–µ–љ–µ–љ–Є—П –∞–љ—В—А–Њ–њ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ј–∞ 24 –љ–µ–і. —В–µ—А–∞–њ–Є–Є –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –љ–µ –і–Њ—Б—В–Є–≥–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є –Є –љ–µ –Њ—В–ї–Є—З–∞–ї–Є—Б—М –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є (p>0,05) (—В–∞–±–ї. 5).
–С—Л–ї –њ—А–Њ–≤–µ–і–µ–љ –∞–љ–∞–ї–Є–Ј –і–Є–љ–∞–Љ–Є–Ї–Є –Є–Ј–Љ–µ–љ–µ–љ–Є–є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–∞—А–Є–∞–љ—В–∞—Е –ї–µ—З–µ–љ–Є—П (—В–∞–±–ї. 6).
–Я—А–Є —В–µ—А–∞–њ–Є–Є –С–Є–љ–µ–ї–Њ–ї–Њ–Љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ (p<0,05) —Б–љ–Є–Ј–Є–ї–Є—Б—М —Г—А–Њ–≤–љ–Є –Ю–• –Є –Ы–Я–Э–Я – –љ–∞ 4,6 –Є 7,8% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Т –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ —В–∞–Ї–ґ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ, –Њ–і–љ–∞–Ї–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Љ–∞–ї–Њ–≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –і–∞–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є.
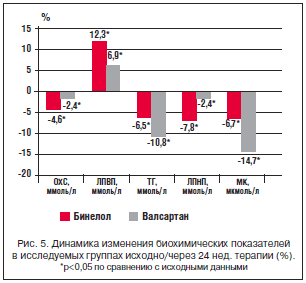
–Я—А–Є –Њ—Ж–µ–љ–Ї–µ –≤–ї–Є—П–љ–Є—П –љ–∞ —Г—А–Њ–≤–µ–љ—М –Ґ–У –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —А–∞–≤–љ–Њ–Ј–љ–∞—З–љ–Њ–µ –Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є —Б–љ–Є–ґ–µ–љ–Є–µ –Ґ–У –≤ –≥—А—Г–њ–њ–∞—Е –С–Є–љ–µ–ї–Њ–ї–∞ –Є –≤–∞–ї—Б–∞—А—В–∞–љ–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Я–Њ –≤–ї–Є—П–љ–Є—О –љ–∞ —Г—А–Њ–≤–µ–љ—М –Ы–Я–Т–Я –≥—А—Г–њ–њ—Л –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є – –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ы–Я–Т–Я (–љ–∞ 12,3% (—А<0,05)) –≤ –≥—А—Г–њ–њ–µ –С–Є–љ–µ–ї–Њ–ї–∞ –Є –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ – –љ–∞ 6,97% (—А<0,05). –Я–Њ –≤–ї–Є—П–љ–Є—О –љ–∞ —Г—А–Њ–≤–µ–љ—М –Ь–Ъ –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П. –Т –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ –µ–µ —Г—А–Њ–≤–љ—П –љ–∞ 14,7% (—А<0,05) –њ—А–Њ—В–Є–≤ 6,7% (—А<0,05) –≤ –≥—А—Г–њ–њ–µ —В–µ—А–∞–њ–Є–Є –љ–µ–±–Є–≤–Њ–ї–Њ–ї–Њ–Љ, —З—В–Њ —П–≤–ї—П–µ—В—Б—П —Б–њ–µ—Ж–Є—Д–Є—З–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –і–ї—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≥—А—Г–њ–њ—Л –С–†–Р II (—А–Є—Б. 5).
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –≤–ї–Є—П–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ–ґ–Є–Љ–Њ–≤ —В–µ—А–∞–њ–Є–Є –љ–∞ —Г–≥–ї–µ–≤–Њ–і–љ—Л–є –Њ–±–Љ–µ–љ –≤—Л—П–≤–ї–µ–љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Б—А–µ–і–љ–µ—Б—Г—В–Њ—З–љ–Њ–є –≥–ї–Є–Ї–µ–Љ–Є–Є –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е, —З—В–Њ, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, —Б–≤—П–Ј–∞–љ–Њ —Б–Њ —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–µ–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Р–Ф. –Т –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ –∞–Љ–њ–ї–Є—В—Г–і—Л –≥–ї–Є–Ї–µ–Љ–Є–Є, –Њ–і–љ–∞–Ї–Њ –Њ–љ–Њ –±—Л–ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ. –Т–ї–Є—П–љ–Є—П –љ–∞ –≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –љ–Є –≤ –≥—А—Г–њ–њ–µ –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞, –љ–Є –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ –±—Л–ї–Њ.
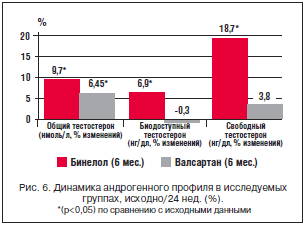
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –і–Є–љ–∞–Љ–Є–Ї–Є –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Њ–±—Й–µ–≥–Њ, —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –Є –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ–≥–Њ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –≤ –Ї—А–Њ–≤–Є –≤ –≥—А—Г–њ–њ–µ –С–Є–љ–µ–ї–Њ–ї–∞ –њ—А–Є—А–Њ—Б—В —Г—А–Њ–≤–љ—П –Њ–±—Й–µ–≥–Њ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ —Б–Њ—Б—В–∞–≤–Є–ї 9,7% (—А<0,05), —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ – 18,7% (—А<0,05), –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ–≥–Њ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ – 6,9% (—А<0,05). –Т –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –љ–∞–±–ї—О–і–∞–ї—Б—П –њ—А–Є—А–Њ—Б—В —Г—А–Њ–≤–љ—П –Њ–±—Й–µ–≥–Њ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –љ–∞ 6,45% (p<0,05). –Ф–Є–љ–∞–Љ–Є–Ї–∞ –њ—А–Є—А–Њ—Б—В–∞ –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –±—Л–ї–∞ –Љ–µ–і–ї–µ–љ–љ–Њ–є – –Ї 12 –љ–µ–і. –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Њ–±—Й–µ–≥–Њ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –µ—Й–µ –љ–µ –і–Њ—Б—В–Є–≥–ї–Њ —Г—А–Њ–≤–љ—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є. –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –і—А—Г–≥–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –∞–љ–і—А–Њ–≥–µ–љ–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є (—А>0,05) (—В–∞–±–ї. 7, —А–Є—Б. 6).
–Я—А–Є –Є–Ј—Г—З–µ–љ–Є–Є –і–Є–љ–∞–Љ–Є–Ї–Є –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ –і–∞–љ–љ—Л–Љ –Њ–њ—А–Њ—Б–љ–Є–Ї–Њ–≤ –Ь–Ш–≠–§, AMS –Є HADS, –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–∞—А–Є–∞–љ—В–∞—Е –ї–µ—З–µ–љ–Є—П –њ–Њ–ї—Г—З–µ–љ—Л –і–∞–љ–љ—Л–µ, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –≤ —В–∞–±–ї–Є—Ж–µ 8.
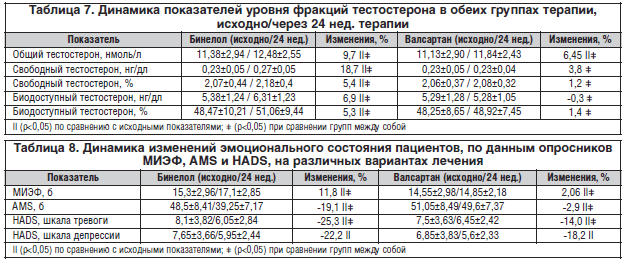
–Ю—В–Љ–µ—З–µ–љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–µ —А–∞–Ј–ї–Є—З–Є–µ –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –њ–Њ —И–Ї–∞–ї–∞–Љ, –Њ—В—А–∞–ґ–∞—О—Й–Є–Љ —Б—В–µ–њ–µ–љ—М –≠–Ф –Є –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Г –Љ—Г–ґ—З–Є–љ. –Т –≥—А—Г–њ–њ–µ –С–Є–љ–µ–ї–Њ–ї–∞ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –Ј–љ–∞—З–Є–Љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –≠–Ф: —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–∞–ї–ї–Њ–≤ –њ–Њ —И–Ї–∞–ї–µ –Ь–Ш–≠–§-5 —Б–Њ—Б—В–∞–≤–Є–ї–Њ 11,8% (—А<0,05) –њ—А–Њ—В–Є–≤ 2,06% (—А<0,05) –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞. –£–Љ–µ–љ—М—И–µ–љ–Є–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ —Б—В–∞—А–µ–љ–Є—П —Г –Љ—Г–ґ—З–Є–љ –≤ –≥—А—Г–њ–њ–µ –С–Є–љ–µ–ї–Њ–ї–∞ –њ–Њ —И–Ї–∞–ї–µ AMS –±—Л–ї–Њ –±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л–Љ –Є —Б–Њ—Б—В–∞–≤–Є–ї–Њ 19,1% (—А<0,05) –њ—А–Њ—В–Є–≤ 2,9% (—А<0,05) –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (—А–Є—Б. 7).
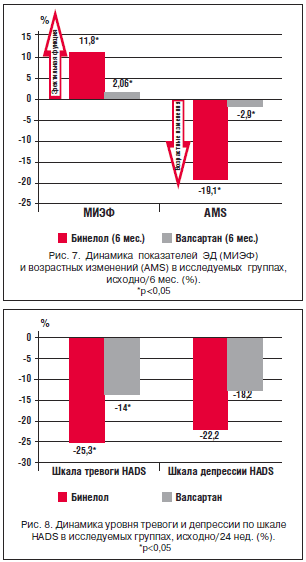
–Ю—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –Њ–±—А–∞—Й–∞–µ—В –љ–∞ —Б–µ–±—П –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —В—А–µ–≤–Њ–≥–Є –њ–Њ —И–Ї–∞–ї–µ HADS – –Њ—В–Љ–µ—З–µ–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ (p<0,05) —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —В—А–µ–≤–Њ–≥–Є –≤ –≥—А—Г–њ–њ–µ –С–Є–љ–µ–ї–Њ–ї–∞ –љ–∞ 25,3%. –Т –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ –±—Л–ї–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–Љ – 14% (p<0,05) (—А–Є—Б. 8).
–Я–Њ —И–Ї–∞–ї–µ –і–µ–њ—А–µ—Б—Б–Є–Є –Њ—В–Љ–µ—З–∞–µ—В—Б—П –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е (p<0,05), —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –њ–Њ —Б—В–µ–њ–µ–љ–Є —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П –і–µ–њ—А–µ—Б—Б–Є–Є –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ (—А–Є—Б. 8).
–Ч–∞ –≤—Б–µ –≤—А–µ–Љ—П –њ—А–Є–µ–Љ–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є –С–Є–љ–µ–ї–Њ–ї–∞ –Є –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –љ–µ –±—Л–ї–Њ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –Є –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є. –Ґ–µ—А–∞–њ–Є—П –љ–µ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–∞ –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞ –љ–Є –≤ –Њ–і–љ–Њ–є –Є–Ј –≥—А—Г–њ–њ. –Я–Њ –і–∞–љ–љ—Л–Љ —Н–ї–µ–Ї—В—А–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞–Љ–Љ—Л (–≠–Ъ–У) –љ–µ –±—Л–ї–Њ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –љ–∞—А—Г—И–µ–љ–Є–є –њ—А–Њ–≤–Њ–і–Є–Љ–Њ—Б—В–Є –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –±—А–∞–і–Є–Ї–∞—А–і–Є–Є.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤
–Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –Р–У —Г –Љ—Г–ґ—З–Є–љ —Б –Ь–° –±—Л–ї –њ—А–Њ–≤–µ–і–µ–љ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–≥–Њ β-–±–ї–Њ–Ї–∞—В–Њ—А–∞ –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ (–С–Є–љ–µ–ї–Њ–ї, BELUPO) –Є –С–†–Р II –≤–∞–ї—Б–∞—А—В–∞–љ–∞.
–Э–∞–ї–Є—З–Є–µ –≥–Є–њ–µ—А—Б–Є–Љ–њ–∞—В–Є–Ї–Њ—В–Њ–љ–Є–Є –њ—А–Є –Ь–° –Є –Р–У —В—А–µ–±—Г–µ—В –Њ—Ж–µ–љ–Ї–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ —Н—В–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Г–Љ–µ–љ—М—И–∞—О—Й–Є—Е –≥–Є–њ–µ—А—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В—М –°–Э–°. –Ф–ї—П —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Є –≤—Л–±—А–∞–љ—Л: β1-–±–ї–Њ–Ї–∞—В–Њ—А III –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –љ–µ–±–Є–≤–Њ–ї–Њ–ї (–С–Є–љ–µ–ї–Њ–ї), –Њ–±–ї–∞–і–∞—О—Й–Є–є –њ–Њ–Љ–Є–Љ–Њ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–≥–Њ —А—П–і–Њ–Љ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –њ–ї–µ–є–Њ—В—А–Њ–њ–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О —Г–ї—Г—З—И–∞—В—М –≤—Л—А–∞–±–Њ—В–Ї—Г –Њ–Ї—Б–Є–і–∞ –∞–Ј–Њ—В–∞, –Є –њ—А–µ–њ–∞—А–∞—В –≥—А—Г–њ–њ—Л –С–†–Р II –≤–∞–ї—Б–∞—А—В–∞–љ, –і–Њ–Ї–∞–Ј–∞–≤—И–Є–є —Б–≤–Њ—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї—Г—О –љ–µ–є—В—А–∞–ї—М–љ–Њ—Б—В—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ь–° –Є –Р–У [5].
–Я—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є —Б —Н—В–∞–ї–Њ–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≥—А—Г–њ–њ—Л –С–†–Р II β-–±–ї–Њ–Ї–∞—В–Њ—А—Л –Њ–±—Л—З–љ–Њ –њ—А–Њ–Є–≥—А—Л–≤–∞–ї–Є –≤ –њ–ї–∞–љ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ —Б–µ–Ї—Б—Г–∞–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О [10]. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –∞–≤—В–Њ—А—Л –≤—Л—Б–Ї–∞–Ј—Л–≤–∞–ї–Є –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є—П, —З—В–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Њ–±—Й–µ–≥–Њ —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –∞—В–µ–љ–Њ–ї–Њ–ї–Њ–Љ –Љ–Њ–≥—Г—В –±—Л—В—М —Б–≤—П–Ј–∞–љ—Л —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –Ґ–У, –≤—Л–Ј–≤–∞–љ–љ—Л–Љ —Н—В–Є–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ [11]. –С—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –Љ–µ–ґ–і—Г –Ґ–У –Є —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ—Л–Љ–Є —Г—А–Њ–≤–љ—П–Љ–Є —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ —Г –≤–Ј—А–Њ—Б–ї—Л—Е –Љ—Г–ґ—З–Є–љ [27].
–Р–љ–∞–ї–Є–Ј –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –љ–∞–Љ–Є –і–∞–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –ї–µ—З–µ–љ–Є–µ –Р–У —Г –±–Њ–ї—М–љ—Л—Е —Б –Ь–° –Ї–∞–Ї –С–Є–љ–µ–ї–Њ–ї–Њ–Љ (–љ–µ–±–Є–≤–Њ–ї–Њ–ї), —В–∞–Ї –Є –≤–∞–ї—Б–∞—А—В–∞–љ–Њ–Љ, –њ—А–Є–≤–µ–ї–Њ –Ї —Е–Њ—А–Њ—И–µ–Љ—Г –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–Љ—Г —Н—Д—Д–µ–Ї—В—Г —Б —Г–ї—Г—З—И–µ–љ–Є–µ–Љ —Б—Г—В–Њ—З–љ–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П –Р–Ф. –Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤–ї–Є—П–љ–Є—П –С–Є–љ–µ–ї–Њ–ї–∞ –Є –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –љ–∞ –Р–Ф –њ—А–Є –њ—А–Є–µ–Љ–µ —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 24 –љ–µ–і. –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –Њ–±–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є —Б—В–µ–њ–µ–љ–Є —Б–љ–Є–ґ–∞—О—В –Р–Ф –Є –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ —Е–Њ—А–Њ—И–Њ –њ–µ—А–µ–љ–Њ—Б—П—В—Б—П, –Њ–і–љ–∞–Ї–Њ –С–Є–љ–µ–ї–Њ–ї –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ –≤–ї–Є—П–µ—В –љ–∞ –І–°–°. –Я—А–Є —Н—В–Њ–Љ –љ–µ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ —З—А–µ–Ј–Љ–µ—А–љ–Њ–є –±—А–∞–і–Є–Ї–∞—А–і–Є–Є –Є –љ–∞—А—Г—И–µ–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ –≠–Ъ–У. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –Љ–Њ–ґ–љ–Њ –Њ–±—К—П—Б–љ–Є—В—М –і–µ–є—Б—В–≤–Є–µ–Љ –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ (–С–Є–љ–µ–ї–Њ–ї) –љ–∞ —Б–Є–Љ–њ–∞—В–Є–Ї–Њ—В–Њ–љ–Є—О, –Њ—В—Б—Г—В—Б—В–≤—Г—О—Й–Є–Љ —Г –≤–∞–ї—Б–∞—А—В–∞–љ–∞ [22].
–≠—В–Њ —А–∞–Ј–ї–Є—З–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–Њ –і–ї—П –±–Њ–ї—М–љ—Л—Е —Б –Ь–°, –і–ї—П –Ї–Њ—В–Њ—А—Л—Е —Е–∞—А–∞–Ї—В–µ—А–љ–∞ —Б–Є–Љ–њ–∞—В–Є–Ї–Њ—В–Њ–љ–Є—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є. –°–ї–µ–і—Б—В–≤–Є–µ–Љ —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Г—А–Њ–≤–µ–љ—М –І–°–° –Љ–Њ–ґ–љ–Њ –Њ–±—К—П—Б–љ–Є—В—М –Є —В–Њ—В —Д–∞–Ї—В, —З—В–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –і–Њ–Ј—Л –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М –Љ–µ–љ—М—И–µ–Љ—Г –њ—А–Њ—Ж–µ–љ—В—Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –С–Є–љ–µ–ї–Њ–ї–∞. –≠—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В —А–Њ–ї—М –І–°–° –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –°–Э–° –Є —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ —А–Є—Б–Ї–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –љ–∞–Љ–Є –і–∞–љ–љ—Л–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—В –Є–Љ–µ—О—Й–Є–Љ—Б—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–∞–Љ –Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ –І–°–° –Є —В–µ—З–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–У [23]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є –њ—А–Њ—Ж–µ–љ—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–Љ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–∞—Б—М –Ї–Њ—А—А–µ–Ї—Ж–Є—П –і–Њ–Ј—Л –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞, —Б–≤—П–Ј–∞–љ, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, —Б —В–µ–Љ, —З—В–Њ —В–µ—А–∞–њ–Є—П –С–Є–љ–µ–ї–Њ–ї–Њ–Љ, –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –≤–ї–Є—П—О—Й–∞—П –љ–∞ –∞–љ–і—А–Њ–≥–µ–љ–љ—Л–є –њ—А–Њ—Д–Є–ї—М, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Г–ї—Г—З—И–µ–љ–Є—О –Њ—В–≤–µ—В–∞ –љ–∞ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Г—О —В–µ—А–∞–њ–Є—О —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ь–° –Є –∞–љ–і—А–Њ–≥–µ–љ–љ—Л–Љ –і–µ—Д–Є—Ж–Є—В–Њ–Љ.
–Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –ї–µ—В —Г–≤–µ–ї–Є—З–Є–ї—Б—П –Є–љ—В–µ—А–µ—Б –Ї —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤–ї–Є—П—В—М –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ –ґ–µ—Б—В–Ї–Њ—Б—В–Є —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—Г–і–Њ–≤ –Є –Ј–∞ —Б—З–µ—В —Н—В–Њ–≥–Њ —Б–љ–Є–ґ–∞—В—М –°–° —А–Є—Б–Ї, –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Є–Ј—Г—З–∞–≤—И–Є—Е –≤–ї–Є—П–љ–Є–µ –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞ –і–∞–љ–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М. –С–†–Р II –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –Њ–і–љ–Є–Љ –Є–Ј –њ–µ—А–≤—Л—Е –Ї–ї–∞—Б—Б–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –і–Њ–Ї–∞–Ј–∞–≤—И–Є—Е –≤ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –љ–∞–ї–Є—З–Є–µ –Њ—А–≥–∞–љ–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л—Е —Б–≤–Њ–є—Б—В–≤ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є. β-–±–ї–Њ–Ї–∞—В–Њ—А II –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –∞—В–µ–љ–Њ–ї–Њ–ї, –љ–∞–Њ–±–Њ—А–Њ—В, –љ–µ –њ–Њ–Ї–∞–Ј–∞–ї –љ–∞–ї–Є—З–Є—П –Њ—А–≥–∞–љ–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞. –†–µ—З—М –Є–і–µ—В –Њ–± –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є LIFE, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –Є–Ј—Г—З–∞–ї–Є—Б—М –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–µ –Є –Њ—А–≥–∞–љ–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –ї–Њ–Ј–∞—А—В–∞–љ–∞ –Є –∞—В–µ–љ–Њ–ї–Њ–ї–∞ [28]. –Т —Н—В–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –њ—А–Є —А–∞–≤–љ–Њ–є —Б—В–µ–њ–µ–љ–Є —Б–љ–Є–ґ–µ–љ–Є—П –Р–Ф –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –С–†–Р II, –љ–∞ 13% (—А=0,021) —А–µ–ґ–µ –Є–Љ–µ–ї–∞ –Љ–µ—Б—В–Њ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є —Б–Љ–µ—А—В–Є (–њ–µ—А–≤–Є—З–љ–∞—П –Ї–Њ–љ–µ—З–љ–∞—П —В–Њ—З–Ї–∞), –∞ —В–∞–Ї–ґ–µ –љ–∞ 24,9% (—А=0,001) – –Є–љ—Б—Г–ї—М—В–∞. –Ю—А–≥–∞–љ–Є–Ј–∞—В–Њ—А—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –≥–ї–∞–≤–љ–Њ–≥–Њ –Њ–±—К—П—Б–љ–µ–љ–Є—П —Н—В–Њ–≥–Њ —Д–µ–љ–Њ–Љ–µ–љ–∞ –њ—А–Є–≤–Њ–і—П—В —В–∞–Ї–Є–µ –∞—А–≥—Г–Љ–µ–љ—В—Л, –Ї–∞–Ї –љ–∞–ї–Є—З–Є–µ —Г –С–†–Р II —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л—Е —В–Ї–∞–љ–µ–≤—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, –љ–µ —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б —Г—А–Њ–≤–љ–µ–Љ –Р–Ф. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –±—Л–ї–∞ –і–Њ–Ї–∞–Ј–∞–љ–∞ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –ї–Њ–Ј–∞—А—В–∞–љ–∞ —Г–Љ–µ–љ—М—И–∞—В—М –Є–љ–і–µ–Ї—Б –∞—Г–≥–Љ–µ–љ—В–∞—Ж–Є–Є (–≤–µ–ї–Є—З–Є–љ—Г –Њ—В—А–∞–ґ–µ–љ–љ–Њ–є –Њ—В –њ–µ—А–Є—Д–µ—А–Є–Є –њ—Г–ї—М—Б–Њ–≤–Њ–є –≤–Њ–ї–љ—Л) –Ї–∞–Ї –Њ–і–Є–љ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤ –ґ–µ—Б—В–Ї–Њ—Б—В–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –С–†–Р II —Б–њ–Њ—Б–Њ–±–љ—Л —Г–ї—Г—З—И–∞—В—М —Г–њ—А—Г–≥–Њ—Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ —Б–Њ—Б—Г–і–Њ–≤ – –Є–љ—Л–Љ–Є —Б–ї–Њ–≤–∞–Љ–Є, –≤—Л—Б—В—Г–њ–∞—В—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є—Б—В–Є–љ–љ—Л—Е –Њ—А–≥–∞–љ–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–Њ–≤ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є. –Ъ–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є–µ –С–Р–С, –љ–∞–њ—А–Њ—В–Є–≤, –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ –≤–ї–Є—П—О—В –љ–∞ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–µ –Р–Ф –Є –≤–µ–ї–Є—З–Є–љ—Г –Є–љ–і–µ–Ї—Б–∞ –∞—Г–≥–Љ–µ–љ—В–∞—Ж–Є–Є (Alx) –Ј–∞ —Б—З–µ—В —Г–і–ї–Є–љ–µ–љ–Є—П —Б–Є—Б—В–Њ–ї—Л –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—П –∞–Љ–њ–ї–Є—В—Г–і—Л –Њ—В—А–∞–ґ–µ–љ–љ–Њ–є –њ—Г–ї—М—Б–Њ–≤–Њ–є –≤–Њ–ї–љ—Л.
–Р–љ–∞–ї–Є–Ј –і–∞–љ–љ—Л—Е, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –≤ –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –њ–Њ–Ї–∞–Ј–∞–ї –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Г –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ (–С–Є–љ–µ–ї–Њ–ї) –Ї–ї–∞—Б—Б-—Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ–≥–Њ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–µ –Р–Ф –Є –Є–љ–і–µ–Ї—Б –∞—Г–≥–Љ–µ–љ—В–∞—Ж–Є–Є (Alx). –Ф–Є–љ–∞–Љ–Є–Ї–∞ –Я–Ч–Т–Ф —В–∞–Ї–ґ–µ –њ–Њ–і—В–≤–µ—А–і–Є–ї–∞ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –С–Є–љ–µ–ї–Њ–ї–∞ (–љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞) –љ–∞ —Н–љ–і–Њ—В–µ–ї–Є–є. –Т –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ґ–Ш–Ь –°–Р, –Њ–і–љ–∞–Ї–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Њ–љ–Њ –±—Л–ї–Њ –Љ–∞–ї–Њ–≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –С–Є–љ–µ–ї–Њ–ї (–љ–µ–±–Є–≤–Њ–ї–Њ–ї), –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≥—А—Г–њ–њ—Л β––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤, —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ —Б –≤–∞–ї—Б–∞—А—В–∞–љ–Њ–Љ –≤ –њ–ї–∞–љ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ —Б—В–µ–њ–µ–љ—М –ґ–µ—Б—В–Ї–Њ—Б—В–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є. –С–Є–љ–µ–ї–Њ–ї (–љ–µ–±–Є–≤–Њ–ї–Њ–ї) –љ–µ —В–Њ–ї—М–Ї–Њ –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П, –љ–Њ –Є –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Њ—В–љ–Њ—И–µ–љ–Є—П—Е –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –≤–∞–ї—Б–∞—А—В–∞–љ –њ–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—О –љ–∞ –°–Я–Т –Є —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О. –≠—В–Њ—В —Н—Д—Д–µ–Ї—В, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, —Б–≤—П–Ј–∞–љ –Њ–њ—П—В—М –ґ–µ —Б –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ –љ–∞ —Н–љ–і–Њ—В–µ–ї–Є–є –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, –љ–∞ –Њ–±—Й–µ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б—В–µ–љ–Ї–Є —Б–Њ—Б—Г–і–Њ–≤.
–Ю—В–Љ–µ—З–µ–љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –С–Є–љ–µ–ї–Њ–ї–∞ (–љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞) –љ–∞ —Г—А–Њ–≤–µ–љ—М –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤ –Є –њ—Б–Є—Е–Њ—Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Љ—Г–ґ—З–Є–љ —Б –≠–Ф –Є –Р–У. –Я–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —Н—В–∞–ї–Њ–љ–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≥—А—Г–њ–њ—Л –С–†–Р II –≤–∞–ї—Б–∞—А—В–∞–љ–Њ–Љ, –і–Њ–Ї–∞–Ј–∞–≤—И–Є–Љ —Б–≤–Њ–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–µ–Ї—Б—Г–∞–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О [14], –С–Є–љ–µ–ї–Њ–ї (–љ–µ–±–Є–≤–Њ–ї–Њ–ї) –њ–Њ–Ї–∞–Ј–∞–ї –≥–Њ—А–∞–Ј–і–Њ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –њ–Њ–Ј–Є—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Г—А–Њ–≤–µ–љ—М –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤. –≠—В–Њ –Љ–Њ–ґ–љ–Њ –Њ–±—К—П—Б–љ–Є—В—М —Б–ї–µ–і—Г—О—Й–Є–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є:
1. –≠–љ–і–Њ—В–µ–ї–Є–є–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞, –Љ—П–≥–Ї–∞—П –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –µ–≥–Њ –њ—А–Є–µ–Љ–∞, –≤ —В.—З. —Б–Њ—Б—Г–і–Њ–≤ –Ї–∞–≤–µ—А–љ–Њ–Ј–љ—Л—Е —В–µ–ї –Є –њ–Њ–ї–Њ–≤—Л—Е –ґ–µ–ї–µ–Ј —Г –Љ—Г–ґ—З–Є–љ.
2. –£—Б–Є–ї–µ–љ–Є–µ –≤—Л—А–∞–±–Њ—В–Ї–Є —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –ґ–µ–ї–µ–Ј–∞–Љ–Є –љ–∞–њ—А—П–Љ—Г—О –Ј–∞ —Б—З–µ—В —Г–ї—Г—З—И–µ–љ–Є—П –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П –Ї–ї–µ—В–Њ–Ї –Ы–µ–є–і–Є–≥–∞.
3. –£—Б–Є–ї–µ–љ–Є–µ –≤—Л—А–∞–±–Њ—В–Ї–Є —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –Ј–∞ —Б—З–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є–Є –≥–Є–њ–Њ—В–∞–ї–∞–Љ–Њ-–≥–Є–њ–Њ—Д–Є–Ј–∞—А–љ–Њ–є –Њ—Б–Є –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Г–ї—Г—З—И–µ–љ–Є—П —Н—А–µ–Ї—В–Є–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є.
4. –£–Љ–µ–љ—М—И–µ–љ–Є–µ —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞ –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞.
5. –Т–ї–Є—П–љ–Є–µ –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ –љ–∞ –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –њ—А–Є–≤–Њ–і–Є—В –Ї –µ–µ —Б–љ–Є–ґ–µ–љ–Є—О –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Є–љ–≥–Є–±–Є—А—Г—О—Й–µ–≥–Њ –≤–ї–Є—П–љ–Є—П –Ш–† –љ–∞ —Б–Є–љ—В–µ–Ј –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤.
–Т—Л—И–µ–Њ–њ–Є—Б–∞–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В —В–∞–Ї–ґ–µ –і–Є–љ–∞–Љ–Є–Ї–∞ –њ—Б–Є—Е–Њ—Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Љ—Г–ґ—З–Є–љ. –Ю—В–Љ–µ—З–µ–љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–µ —А–∞–Ј–ї–Є—З–Є–µ –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –њ–Њ —И–Ї–∞–ї–∞–Љ, –Њ—В—А–∞–ґ–∞—О—Й–Є–Љ —Б—В–µ–њ–µ–љ—М –≠–Ф –Є –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Г –Љ—Г–ґ—З–Є–љ. –Э–∞–±–ї—О–і–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —В—А–µ–≤–Њ–≥–Є –≤ –≥—А—Г–њ–њ–µ –С–Є–љ–µ–ї–Њ–ї–∞ (–љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞), –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –њ–Њ –і–∞–љ–љ–Њ–Љ—Г –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—О –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ –±—Л–ї–Њ. –Я–Њ —И–Ї–∞–ї–µ –і–µ–њ—А–µ—Б—Б–Є–Є –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е.
–Т –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Ј–∞ 24 –љ–µ–і. –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –≤–ї–Є—П–љ–Є—П –љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –Љ–µ–ґ–і—Г –С–Є–љ–µ–ї–Њ–ї–Њ–Љ (–љ–µ–±–Є–≤–Њ–ї–Њ–ї–Њ–Љ) –Є –≤–∞–ї—Б–∞—А—В–∞–љ–Њ–Љ –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ –±—Л–ї–Њ, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б—З–Є—В–∞—В—М –Њ–±–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є –љ–µ–є—В—А–∞–ї—М–љ—Л–Љ–Є. –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є–µ β-–±–ї–Њ–Ї–∞—В–Њ—А—Л –њ–Њ–≤—Л—И–∞—О—В —Г—А–Њ–≤–µ–љ—М –Ґ–У, —Б–љ–Є–ґ–∞—О—В —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Ы–Я–Т–Я –Є –њ–Њ–≤—Л—И–∞—О—В –Є–ї–Є –љ–µ –Є–Ј–Љ–µ–љ—П—О—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –Ы–Я–Э–Я. β1–—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –±–ї–Њ–Ї–∞—В–Њ—А—Л –≤—Л–Ј—Л–≤–∞—О—В —В–∞–Ї–Є–µ –ґ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –Њ–і–љ–∞–Ї–Њ –Њ–љ–Є –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ—Л [21]. –Т –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –љ–∞ —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л—Е —А–µ–ґ–Є–Љ–∞—Е —В–µ—А–∞–њ–Є–Є. –С–Є–љ–µ–ї–Њ–ї (–љ–µ–±–Є–≤–Њ–ї–Њ–ї) –±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ–Њ –њ–Њ–≤—Л—И–∞–ї —Г—А–Њ–≤–µ–љ—М –Ы–Я–Т–Я, —З—В–Њ —Б–≤—П–Ј–∞–љ–Њ, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, —Б –µ–≥–Њ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ —Б–Є–Љ–њ–∞—В–Є–Ї–Њ—В–Њ–љ–Є—О, —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –Є —Г—А–Њ–≤–µ–љ—М –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤ –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, —Г–ї—Г—З—И–µ–љ–Є–µ–Љ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤.
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –≤–ї–Є—П–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ–ґ–Є–Љ–Њ–≤ —В–µ—А–∞–њ–Є–Є –љ–∞ —Г–≥–ї–µ–≤–Њ–і–љ—Л–є –Њ–±–Љ–µ–љ –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ, –љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Б—А–µ–і–љ–µ—Б—Г—В–Њ—З–љ–Њ–є –≥–ї–Є–Ї–µ–Љ–Є–Є –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е, —З—В–Њ, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, —Б–≤—П–Ј–∞–љ–Њ —Б–Њ —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–µ–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Р–Ф.
–Я–Њ –≤–ї–Є—П–љ–Є—О –љ–∞ –∞–љ—В—А–Њ–њ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Њ–±–∞ –њ—А–µ–њ–∞—А–∞—В–∞ —В–∞–Ї–ґ–µ –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –љ–µ–є—В—А–∞–ї—М–љ—Л–Љ–Є –Є –љ–µ –≤—Л–Ј—Л–≤–∞–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –≤–µ—Б–µ, –Њ–Ї—А—Г–ґ–љ–Њ—Б—В–Є —В–∞–ї–Є–Є, –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П—Е –Є–Љ–њ–µ–і–∞–љ—Б–Њ–Љ–µ—В—А–Є–Є –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –≥—А—Г–њ–њ–∞—Е.
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В, —З—В–Њ –С–Є–љ–µ–ї–Њ–ї—Г (–љ–µ–±–Є–≤–Њ–ї–Њ–ї—Г) –љ–µ –њ—А–Є—Б—Г—Й–Є –Ї–ї–∞—Б—Б-—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ –і–ї—П β––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ —Г–≥–ї–µ–≤–Њ–і–љ—Л–є [20] –Є –ї–Є–њ–Є–і–љ—Л–є [21] –Њ–±–Љ–µ–љ. –Ґ–∞–Ї–ґ–µ, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є—Е β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤, –≤—Л–Ј—Л–≤–∞—О—Й–Є—Е –њ—А–Є–±–∞–≤–Ї—Г –Љ–∞—Б—Б—Л —В–µ–ї–∞ [26], –С–Є–љ–µ–ї–Њ–ї (–љ–µ–±–Є–≤–Њ–ї–Њ–ї) –љ–µ–є—В—А–∞–ї–µ–љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –∞–љ—В—А–Њ–њ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –С–Є–љ–µ–ї–Њ–ї (–љ–µ–±–Є–≤–Њ–ї–Њ–ї) —П–≤–ї—П–µ—В—Б—П –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Є –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–Љ –Ї–ї–∞—Б—Б–∞ β––±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П –Р–У —Г –±–Њ–ї—М–љ—Л—Е —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Г–≥–ї–µ–≤–Њ–і–љ–Њ–≥–Њ –Є –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ –Є –∞–љ–і—А–Њ–≥–µ–љ–љ—Л–Љ –і–µ—Д–Є—Ж–Є—В–Њ–Љ. –° –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –С–Є–љ–µ–ї–Њ–ї –њ–Њ–Ї–∞–Ј–∞–љ –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –±–Њ–ї—М–љ—Л–Љ –Р–У —Б —Б–Є–Љ–њ–∞—В–Є–Ї–Њ—В–Њ–љ–Є–µ–є, —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є.
–Т—Л–≤–Њ–і—Л
1. –Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤–ї–Є—П–љ–Є—П –С–Є–љ–µ–ї–Њ–ї–∞ –Є –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –љ–∞ –Р–Ф —Г –Љ—Г–ґ—З–Є–љ —Б –Ь–° –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Њ–±–∞ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є —Б—В–µ–њ–µ–љ–Є —Б–љ–Є–ґ–∞—О—В –Р–Ф. –Ю–і–љ–∞–Ї–Њ –С–Є–љ–µ–ї–Њ–ї —А–µ–ґ–µ —В—А–µ–±—Г–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—П –і–Њ–Ј—Л –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Ж–µ–ї–µ–≤–Њ–≥–Њ –Р–Ф —Г –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ —Б–љ–Є–ґ–∞–µ—В –І–°–°. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –Љ–Њ–ґ–љ–Њ –Њ–±—К—П—Б–љ–Є—В—М –і–µ–є—Б—В–≤–Є–µ–Љ –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ (–С–Є–љ–µ–ї–Њ–ї) –љ–∞ —Б–Є–Љ–њ–∞—В–Є–Ї–Њ—В–Њ–љ–Є—О, –Њ—В—Б—Г—В—Б—В–≤—Г—О—Й–Є–Љ —Г –≤–∞–ї—Б–∞—А—В–∞–љ–∞.
2. –С–Є–љ–µ–ї–Њ–ї (–љ–µ–±–Є–≤–Њ–ї–Њ–ї), –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є—Е β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤, —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ —Б –≤–∞–ї—Б–∞—А—В–∞–љ–Њ–Љ –њ–Њ —Г–ї—Г—З—И–µ–љ–Є—О —Г–њ—А—Г–≥–Њ—Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ —Б–Њ—Б—Г–і–Њ–≤. –С–Є–љ–µ–ї–Њ–ї –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –≤–∞–ї—Б–∞—А—В–∞–љ –њ–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–Љ—Г –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—О –љ–∞ —Б–Ї–Њ—А–Њ—Б—В—М –њ—Г–ї—М—Б–Њ–≤–Њ–є –≤–Њ–ї–љ—Л –Є —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О.
3. –Ю—В–Љ–µ—З–µ–љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–µ –Є –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –С–Є–љ–µ–ї–Њ–ї–∞ –љ–∞ —Г—А–Њ–≤–µ–љ—М –Ы–Я–Т–Я. –°–љ–Є–ґ–µ–љ–Є–µ –≤–µ—Б–∞ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –љ–µ –і–Њ—Б—В–Є–≥–ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є.
4. –С–Є–љ–µ–ї–Њ–ї –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Г—А–Њ–≤–µ–љ—М –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤, —Н—А–µ–Ї—В–Є–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –Љ—Г–ґ—З–Є–љ —Б –Р–У –Є –Ь–°, –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –Ј–љ–∞—З–Є–Љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ.
5. –С–Є–љ–µ–ї–Њ–ї —Г–Љ–µ–љ—М—И–∞–µ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Љ—Г–ґ—Б–Ї–Њ–≥–Њ —Б—В–∞—А–µ–љ–Є—П –Є —В—А–µ–≤–Њ–ґ–љ–Њ—Б—В–Є —Г –Љ—Г–ґ—З–Є–љ —Б –Р–У –Є –Ь–°, –≤–∞–ї—Б–∞—А—В–∞–љ –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Т–µ—А—В–Ї–Є–љ –Р.–Ы., –Ы–Њ—А–∞–љ –Ю.–С., –Ґ–Њ–њ–Њ–ї—П–љ—Б–Ї–Є–є –Р.–Т. –Є –і—А. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –≤–ї–Є—П–љ–Є–µ b-–∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –љ–∞ –Ї–Њ–њ—Г–ї—П—В–Є–≤–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О —Г –±–Њ–ї—М–љ—Л—Е —Б –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є // –Ъ–∞—А–і–Є–Њ–ї–Њ–≥–Є—П. 2002. –Ґ. 42 (9). –°. 39–42.
2. –Ъ–Њ–љ—А–∞–і–Є –Р.–Ю., –С–µ—А–љ–≥–∞—А–і—В –≠.–†., –°–Љ–Є—А–љ–Њ–≤–∞ –Х.–Э. –С–µ—В–∞-–∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л –њ—А–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є: –≤–Ј–≥–ї—П–і —В—А–µ—В—М–µ–≥–Њ —В—Л—Б—П—З–µ–ї–µ—В–Є—П // Cons. Med. 2005. вДЦ 11 (1). –°. 13–16.
3. –Ь–∞–Ј–Њ –Х.–С., –У–∞–Љ–Є–і–Њ–≤ –°.–Ш., –°–Њ—В–љ–Є–Ї–Њ–≤–∞ –Х.–Ь, –Ъ–Њ—А–Њ—В–µ–µ–≤ –†.–Т. –Т–ї–Є—П–љ–Є–µ –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤ –љ–∞ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О —Г –±–Њ–ї—М–љ—Л—Е —Н—А–µ–Ї—В–Є–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Є –≤–Њ–Ј—А–∞—Б—В–љ—Л–Љ –∞–љ–і—А–Њ–≥–µ–љ–љ—Л–Љ –і–µ—Д–Є—Ж–Є—В–Њ–Љ. VI –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–∞—П –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–∞—П –≤—Л—Б—В–∞–≤–Ї–∞ «–Ь—Г–ґ—Б–Ї–Њ–µ –Ј–і–Њ—А–Њ–≤—М–µ –Є –і–Њ–ї–≥–Њ–ї–µ—В–Є–µ». –Ь–Њ—Б–Ї–≤–∞, 19–20 —Д–µ–≤—А–∞–ї—П 2008. –°. 63.
4. –Ь–∞–Ї–Њ–ї–Ї–Є–љ –Т.–Ш. –Ю–њ—А–µ–і–µ–ї–µ–љ–Њ –ї–Є –Љ–µ—Б—В–Њ b-–∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є // Cons. Med. 2006. вДЦ 4. –°. 43–47.
5. –Ь—А–∞–≤—П–љ –°.–†., –Ъ–∞–ї–Є–љ–Є–љ –Р.–Я. –Я–∞—В–Њ–≥–µ–љ–µ–Ј –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є –њ—А–Є —Б–∞—Е–∞—А–љ–Њ–Љ –і–Є–∞–±–µ—В–µ –Є –њ–Њ–±–Њ—З–љ—Л–µ –і–µ–є—Б—В–≤–Є—П –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л—Е –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е —Б—А–µ–і—Б—В–≤ // –†–Њ—Б. –Ї–∞—А–і–Є–Њ–ї. –ґ—Г—А–љ–∞–ї. 2001. вДЦ 1. –°. 66–70.
6. –Э–µ–±–Є–µ—А–Є–і–Ј–µ –Ф.–Т. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є—П –њ—А–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є // –°ons. Med. –Я—А–Є–ї. –°–Є—Б—В–µ–Љ–љ—Л–µ –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є. 2005. вДЦ 1. –°. 31–38.
7. –Э—Г—А–Љ–∞–Љ–µ–і–Њ–≤–∞ –У.–°., –У—Г–Љ–±–∞—В–Њ–≤ –Э.–С., –Ь—Г—Б—В–∞—Д–∞–µ–≤ –Ш.–Ш. –£—А–Њ–≤–µ–љ—М –≥–Њ—А–Љ–Њ–љ–Њ–≤ –≥–Є–њ–Њ—Д–Є–Ј–∞—А–љ–Њ-–≥–Њ–љ–∞–і–љ–Њ–є –Њ—Б–Є, –њ–µ–љ–Є–ї—М–љ—Л–є –Ї—А–Њ–≤–Њ—В–Њ–Ї –Є –њ–Њ–ї–Њ–≤–∞—П —Д—Г–љ–Ї—Ж–Є—П —Г –Љ—Г–ґ—З–Є–љ —Б –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–µ–є –њ—А–Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –±–Є—Б–Њ–њ—А–Њ–ї–Њ–ї–Њ–Љ –Є –љ–µ–±–Є–≤–Њ–ї–Њ–ї–Њ–Љ // –Ъ–∞—А–і–Є–Њ–ї–Њ–≥–Є—П. 2007. –Ґ. 47 (6). –°. 50–53.
8. –†–Њ—Б—Б–Є–є—Б–Ї–Њ–µ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–µ –Њ–±—Й–µ—Б—В–≤–Њ –њ–Њ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є (–†–Ь–Ю–Р–У), –Т—Б–µ—А–Њ—Б—Б–Є–є—Б–Ї–Њ–µ –љ–∞—Г—З–љ–Њ–µ –Њ–±—Й–µ—Б—В–≤–Њ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Њ–≤ (–Т–Э–Ю–Ъ). –Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Є –ї–µ—З–µ–љ–Є–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є. –†–Њ—Б—Б–Є–є—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є (—З–µ—В–≤–µ—А—В—Л–є –њ–µ—А–µ—Б–Љ–Њ—В—А). 2010.
9. –°–∞–≤–µ–љ–Ї–Њ–≤ –Ь.–Я., –Т–Њ–ї–Ї–Њ–≤ –Р.–°., –Ш–≤–∞–љ–Њ–≤ –°.–Э. –Є –і—А. –£—А–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –±–µ—В–∞-–∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤: –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –љ–µ–±–Є–≤–Њ–ї–Њ–ї–∞ // –†–∞—Ж. —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А. –≤ –Ї–∞—А–і–Є–Њ–ї. 2008. вДЦ 3. –°. 60–65.
10. –§–Њ–≥–∞—А—В–Є –†., –Я—А–µ—В–Є –Я., –Ф–µ—А–Њ–Ј–∞ –У. –Т–ї–Є—П–љ–Є–µ –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤–∞–ї—Б–∞—А—В–∞–љ–Њ–Љ –Є–ї–Є –∞—В–µ–љ–Њ–ї–Њ–ї–Њ–Љ –љ–∞ —Б–µ–Ї—Б—Г–∞–ї—М–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Є —Г—А–Њ–≤–љ–Є —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ —Г –Љ—Г–ґ—З–Є–љ —Б –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є // –Р—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П. 2011. вДЦ 1 (15).
11. Andersen P, Seljeflot I, Herzog A et al. Effects ofdoxazosin and atenolol on atherothrombogenic risk profile in hypertensive middle-aged men // J. Cardiovasc. Pharmacol. 1998. Vol. 31. P. 677–683.
12. Davis B.R., Oberman A., Blaufox M.D. et al. Effect of antihypertensive therapy on weight loss: the Trial of Antihypertensive Interventions and Management Research Group // Hypertension. 1992. Vol. 19. P. 393–399.
13. De Boer R.A., Voorsl A.A., van Veldhuisen D.J. Nebivolol: third-generation b-blockade // Exp. Opin. Pharmacother. 2007. Vol. 8 (10). P. 1539–1550.
14. Dusing R. Effect of the angiotensin II antagonist valsartan on sexual function in hypertensive men // Blood Press. 2003. Vol. 2 (Suppl.). P. 29–34.
15. Ferrario C.M., Levy P. Sexual dysfunction in patients with hypertension: implications for therapy // J. Clin. Hypertens. Greenwich. 2002. Vol. 4 (6). P. 424–432.
16. Garban H.J., Buga G.M., Ignarro L.J. Estrogen – receptor mediated vascular responsiveness to nebivolol: a novel endothelium-related mechanism of therapeutic vasorelaxation // J. Cardiovasc. Pharmacol. 2004. Vol. 43. P. 638–644.
17. Grimm R.H. Jr., Grandits G.A., Prineas R.J. et al. Long-term effects on sexual function of five antihypertensive drugs and nutritional hygienic treatment in hypertensive men and women. Treatment of Mild Hypertension Study (TOMHS) // Hypertension. 1997. Vol. 29 (1 Pt. 1). P. 8–14.
18. Jgnarro L.J. Experimental evidences of nitric oxide-dependent vasodilatatory activity of nebivolol, a third-generation beta-blocker // Blood Press. 2004. Vol. 1 (Suppl.). P. 2–16.
19. Kalinowski L et al. Third – generation beta-blockers stimulate nitric oxide release from endothelial cells through ATP efflux: f novel mechanism for antihypertensive action // Circulation. 2003. Vol. 107 (21). P. 2747–2752.
20. Kaplan N.M. Effects of antihypertensive therapy on insulin resistance // Hypertension. 1992. Vol. 19 (Suppl. I). P. I-116–I-118.
21. Kasiske B., Ma J.Z., Kalil R.S.N., Louis T.A. Effects of antihypertensive therapy on serum lipids // Ann. Intern. Med. 1995. Vol. 122. P. 133–141.
22. Ohlslein E., Brooks D., Feuerstein G., Ruffolo R. Jr. Inhibition of sympathetic outflow by the angiotensin II receptor antagonist, eprosartan, but not losartan, valsartan or irbesartan: relationship to differences in prejunctional angiotensin II receptor blockade // Pharmacol. 1997. Vol. 55. P. 244–251.
23. Palatini P., Benetos A., Julius S. Impact of increased heart rate on clinical outcomes in hypertension: implications for antihypertensive drug therapy // Drugs. 2006. Vol. 66. P. 133–144.
24. Rosen R.C. Sexual dysfunction as an obstacle to compliance with antihypertensive therapy // Blood Press. 1997. (Suppl. 1). P. 47–51.
25. Rosmond R., Wallerius S., Wanger P. et al. A 5-year follow-up study of disease incidence in men with an abnormal hormone pattern // J. Intl. Med. 2003. Vol. 254 (4). P. 386–390.
26. Rossner S., Taylor C.L., Byington R.P., Furberg C.D. Long term propranolol treatment and changes in body weight after myocardial infarction // BMJ. 1990. Vol. 300. P. 902–903.
27. Stellato R.K., Feldman H.A., Hamdy O. et al. Testosterone, sex hormone-binding globulin, and the development of type 2 diabetes in middle-aged men: prospective results from the Massachusetts Male Aging Study // Diabet. Care. 2000. Vol. 23 (4). P. 490–494.
28. Wachtell K., Lehto M., Gerdts E. et al. Angiotensin II receptor blockade reduces new-onset atrial fibrillation and subsequent stroke compared to atenolol: the Losartan Intervention For Endpoint reduction in hypertension study (LIFE) study // J. Am. Coll. Cardiol. 2005. Vol. 45, <5. P. 712–719.
29. Wilhelmsen L., Berglund G., Elmfeldt D. et al. Beta-blockers versus diuretics in hypertensive men: main results from the HAPPHY trial // J. Hypertens. 1987. Vol. 5. P. 561–572.
30. Zmuda J.M., Cauley J.A., Kriska A. et al. Longitudinal relation between endogenous testosterone and cardiovascular disease risk factors in middle-aged men: a 13-year follow-up of former multiple risk factor intervention trial participants // Am. J. Epidemiol. 1997. Vol. 146 (8). P. 609–617.












