–Т —А–∞–Ј–≤–Є—В–Є–Є –Њ–ґ–Є—А–µ–љ–Є—П –Є–≥—А–∞—О—В —А–Њ–ї—М —А–∞–Ј–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л, –≤–Ї–ї—О—З–∞—П –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ (–Є–Ј–≤–µ—Б—В–љ–Њ –±–Њ–ї–µ–µ 50 –≥–µ–љ–Њ–≤-–Ї–∞–љ–і–Є–і–∞—В–Њ–≤). –Э–Њ —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –ї—О–і–µ–є –љ–µ—В –Љ–Њ–љ–Њ–≥–µ–љ–љ–Њ–≥–Њ –љ–∞—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ–ґ–Є—А–µ–љ–Є—П. –Ю–і–љ–∞ –Є–Ј –≥–ї–∞–≤–љ—Л—Е –њ—А–Є—З–Є–љ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—П –Њ–ґ–Є—А–µ–љ–Є—П –≤ –Љ–Є—А–µ – —Н—В–Њ –љ–µ–њ—А–∞–≤–Є–ї—М–љ—Л–є (–љ–µ–Ј–і–Њ—А–Њ–≤—Л–є) –Є —Е–∞–Њ—В–Є—З–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А –њ–Є—В–∞–љ–Є—П —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –Є–Ј–±—Л—В–Њ—З–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Ї–∞–ї–Њ—А–Є–є, –њ–Њ—Б—В—Г–њ–∞—О—Й–Є—Е —Б –њ–Є—Й–µ–є (—З–∞—Й–µ –Є–Ј –њ—А–Њ–і—Г–Ї—В–Њ–≤ –±—Л—Б—В—А–Њ–≥–Њ –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П – fast food), —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ—А–µ–≤—Л—И–∞–µ—В –Є—Е —А–∞—Б—Е–Њ–і. –≠—В–Њ–Љ—Г —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –Є –Љ–∞–ї–Њ–њ–Њ–і–≤–Є–ґ–љ—Л–є –Њ–±—А–∞–Ј –ґ–Є–Ј–љ–Є –љ–∞—Б–µ–ї–µ–љ–Є—П, –≤ —В. —З. –і–ї–Є—В–µ–ї—М–љ–Њ–µ —Б–Є–і–µ–љ–Є–µ –њ–µ—А–µ–і —В–µ–ї–µ–≤–Є–Ј–Њ—А–Њ–Љ –Є –Ј–∞ –Ї–Њ–Љ–њ—М—О—В–µ—А–Њ–Љ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б—А–µ–і–Є –љ–∞—Б–µ–ї–µ–љ–Є—П –Є–Љ–µ–µ—В—Б—П –љ–µ–њ–Њ–љ–Є–Љ–∞–љ–Є–µ —В–Њ–≥–Њ, —З—В–Њ –Њ–ґ–Є—А–µ–љ–Є–µ – —Н—В–Њ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ –њ—А–Є –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є –∞–Ї—В–Є–≤–љ–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г–µ—В.
–Ґ–Њ–ї—М–Ї–Њ –њ–Њ–ґ–Є–Ј–љ–µ–љ–љ—Л–є —Б–∞–Љ–Њ–Ї–Њ–љ—В—А–Њ–ї—М –њ–Њ—В—А–µ–±–ї—П–µ–Љ–Њ–є –њ–Є—Й–Є –Є —Б–Њ—Б—В–Њ—П–љ–Є—П –Ј–і–Њ—А–Њ–≤—М—П –љ–∞ —Д–Њ–љ–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М –Ь–Ґ. –Я—А–Є—З–µ–Љ —З–∞—Б—В—М –±–Њ–ї—М–љ—Л—Е —В—А–µ–±—Г–µ—В –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –њ–Њ—Б—В—А–Њ–µ–љ–љ–Њ–≥–Њ –љ–∞ –њ—А–Є–љ—Ж–Є–њ–∞—Е –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л.
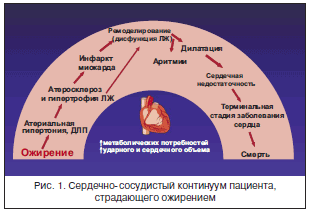
–Ю–ґ–Є—А–µ–љ–Є–µ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–њ—П—В—Б—В–≤–Є–µ–Љ –љ–∞ –њ—Г—В–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –љ–µ–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –≤–Ї–ї—О—З–∞—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (–°–°–Ч). –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —А–Њ–ї—М –Њ–ґ–Є—А–µ–љ–Є—П –≤ –Є–љ–Є—Ж–Є–∞—Ж–Є–Є —А–∞–Ј–≤–Є—В–Є—П —А—П–і–∞ –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ (–§–†), –∞ —В–∞–Ї–ґ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–∞ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–∞—П –Њ—Б–љ–Њ–≤–∞ –љ–µ–≥–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –Њ–ґ–Є—А–µ–љ–Є—П –љ–∞ —Б—В—А—Г–Ї—В—Г—А–љ–Њ-—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–µ—А–і—Ж–∞ –Є —Б–Њ—Б—Г–і–Њ–≤. –І–µ–ї–Њ–≤–µ–Ї, —Б—В—А–∞–і–∞—О—Й–Є–є –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, –Є–Љ–µ–µ—В –±–Њ–ї—М—И–µ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –°–°–Ч, –Ї–Њ—В–Њ—А—Л–µ –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М –Љ–Њ–≥—Г—В –њ—А–Є–≤–µ—Б—В–Є –Ї —В—П–ґ–µ–ї—Л–Љ –њ–∞—В–Њ–ї–Њ–≥–Є—П–Љ —Б–µ—А–і—Ж–∞ (—А–Є—Б. 1). –Я–Њ—З–µ–Љ—Г —В–∞–Ї –њ—А–Њ–Є—Б—Е–Њ–і–Є—В?
–Ц–Є—А–Њ–≤–∞—П —В–Ї–∞–љ—М: —Б—В—А–Њ–µ–љ–Є–µ –Є —Д—Г–љ–Ї—Ж–Є–Є
–Т—Б–µ –љ–∞—З–Є–љ–∞–µ—В—Б—П —Б –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є (–Ц–Ґ), –Ї–Њ—В–Њ—А–∞—П –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –љ–µ —В–Њ–ї—М–Ї–Њ «–Ї–∞–Љ–µ—А—Г —Е—А–∞–љ–µ–љ–Є—П» –ґ–Є—А–∞, –љ–Њ –Є –∞–Ї—В–Є–≤–љ—Л–є —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л–є –Є –њ–∞—А–∞–Ї—А–Є–љ–љ—Л–є –Њ—А–≥–∞–љ. –Ц–Ґ —З–µ–ї–Њ–≤–µ—З–µ—Б–Ї–Њ–≥–Њ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –њ–Њ–і—А–∞–Ј–і–µ–ї—П–µ—В—Б—П –љ–∞ –±–µ–ї—Г—О –Є –±—Г—А—Г—О –Ц–Ґ (–±–µ–ї–Њ–є –Ц–Ґ —Г —З–µ–ї–Њ–≤–µ–Ї–∞ –±–Њ–ї—М—И–µ). –†–∞–Ј–љ—Л–µ —В–Є–њ—Л –Ц–Ґ –Є–Љ–µ—О—В —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є.
–Р–і–Є–њ–Њ—Ж–Є—В –±–µ–ї–Њ–є –Ц–Ґ —Б–Њ–і–µ—А–ґ–Є—В –≤–љ—Г—В—А–Є —Б–µ–±—П –Њ–і–Є–љ –±–Њ–ї—М—И–Њ–є –ґ–Є—А–Њ–≤–Њ–є –њ—Г–Ј—Л—А—М, –Ј–∞–љ–Є–Љ–∞—О—Й–Є–є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б—О –њ–ї–Њ—Й–∞–і—М –Ї–ї–µ—В–Ї–Є, —Б —П–і—А–Њ–Љ –љ–∞ –њ–µ—А–Є—Д–µ—А–Є–Є. –Ю—Б–љ–Њ–≤–љ—Л–µ –Ј–∞–і–∞—З–Є –±–µ–ї–Њ–є –Ц–Ґ – —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ (–і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ) —Н–љ–µ—А–≥–Є–Є –≤ –≤–Є–і–µ —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–Њ–≤ (–Ґ–У) –Є —А–µ–≥—Г–ї—П—Ж–Є—П —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –±–∞–ї–∞–љ—Б–∞, –∞ —В–∞–Ї–ґ–µ —В–µ–њ–ї–Њ–Є–Ј–Њ–ї—П—Ж–Є—П, —Б–Њ–Ј–і–∞–љ–Є–µ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–є –Ј–∞—Й–Є—В—Л –≤–Њ–Ї—А—Г–≥ –Њ—А–≥–∞–љ–Њ–≤ –≤ –≤–Є–і–µ –ґ–Є—А–Њ–≤–Њ–є –њ–Њ–і—Г—И–Ї–Є, —Н–љ–і–Њ–Ї—А–Є–љ–љ–∞—П —Д—Г–љ–Ї—Ж–Є—П.
–Т –∞–і–Є–њ–Њ—Ж–Є—В–∞—Е –±—Г—А–Њ–є –Ц–Ґ –Є–Љ–µ–µ—В—Б—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–µ–±–Њ–ї—М—И–Є—Е –ґ–Є—А–Њ–≤—Л—Е –Ї–∞–њ–µ–ї—М –Є –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–є, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –ґ–µ–ї–µ–Ј–Њ (–≤ —Ж–Є—В–Њ—Е—А–Њ–Љ–∞—Е) –Є –Њ–Ї—А–∞—И–Є–≤–∞—О—Й–Є—Е –Ц–Ґ –≤ –±—Г—А—Л–є —Ж–≤–µ—В. –С—Г—А–∞—П –Ц–Ґ —Е–Њ—А–Њ—И–Њ –Є–љ–љ–µ—А–≤–Є—А—Г–µ—В—Б—П —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –љ–µ—А–≤–∞–Љ–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ β3-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є, –њ—А—П–Љ–∞—П —Б—В–Є–Љ—Г–ї—П—Ж–Є—П –Ї–Њ—В–Њ—А—Л—Е –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–Њ —В–µ–њ–ї–∞ [2]. –Ь—Г—В–∞—Ж–Є—П –≥–µ–љ–∞, –Ї–Њ–і–Є—А—Г—О—Й–µ–≥–Њ β3-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А—Л, –Њ–њ–Њ—Б—А–µ–і—Г–µ—В –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–∞–Љ–Є —В–µ—А–Љ–Њ–≥–µ–љ–µ–Ј –≤ –±—Г—А–Њ–є –Ц–Ґ –Є –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–і–љ–Њ–є –Є–Ј –њ—А–Є—З–Є–љ –љ–∞—А–∞—Б—В–∞–љ–Є—П –Ь–Ґ. –§—Г–љ–Ї—Ж–Є—П –±—Г—А–Њ–є –Ц–Ґ – —Н—В–Њ –≥–µ–љ–µ—А–∞—Ж–Є—П —Н–љ–µ—А–≥–Є–Є –≤ –≤–Є–і–µ —В–µ–њ–ї–∞ (—В–µ—А–Љ–Њ–≥–µ–љ–µ–Ј, —З–∞—Б—В—М –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ —В–µ—А–Љ–Њ—А–µ–≥—Г–ї—П—Ж–Є–Є).
–Ц–Ґ —А–∞–Ј–ї–Є—З–∞—О—В –њ–Њ –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Њ–Љ—Г —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–Є—О, –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–∞–Љ. –С—Г—А—Л–є –ґ–Є—А –≤ –њ–Њ–і–Ї–Њ–ґ–љ–Њ-–ґ–Є—А–Њ–≤–Њ–є –Ї–ї–µ—В—З–∞—В–Ї–µ –≤ —З–µ–ї–Њ–≤–µ—З–µ—Б–Ї–Њ–Љ —В–µ–ї–µ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ —А–∞–≤–љ–Њ–Љ–µ—А–љ–Њ —Б –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ–Љ –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ј–Њ–љ–µ (–≤ –Њ–±–ї–∞—Б—В–Є —П–≥–Њ–і–Є—Ж –Є –±–µ–і–µ—А). –С–µ–ї–∞—П –Ц–Ґ –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –љ–µ—А–∞–≤–љ–Њ–Љ–µ—А–љ—Л–Љ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ —Б –Є–Ј–±—Л—В–Њ—З–љ—Л–Љ –Њ—В–ї–Њ–ґ–µ–љ–Є–µ–Љ –ґ–Є—А–∞ –≤ –Њ–±–ї–∞—Б—В–Є –≤–µ—А—Е–љ–µ–є –њ–Њ–ї–Њ–≤–Є–љ—Л —В—Г–ї–Њ–≤–Є—Й–∞ –Є –љ–∞ –ґ–Є–≤–Њ—В–µ (–≤–љ—Г—В—А–Є–∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ—Л–є –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л–є –ґ–Є—А – –≤ —Б–∞–ї—М–љ–Є–Ї–µ, –±—А—Л–ґ–µ–є–Ї–µ, —А–µ—В—А–Њ–њ–µ—А–Є—В–Њ–љ–µ–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є), –∞ —В–∞–Ї–ґ–µ –≤–Њ –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–∞—Е, –≤–Ї–ї—О—З–∞—П —Б–µ—А–і—Ж–µ, –њ–Њ—З–Ї–Є –Є –њ–µ—З–µ–љ—М (–≤–љ–µ–∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ—Л–µ –Њ—В–ї–Њ–ґ–µ–љ–Є—П –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–≥–Њ –ґ–Є—А–∞).
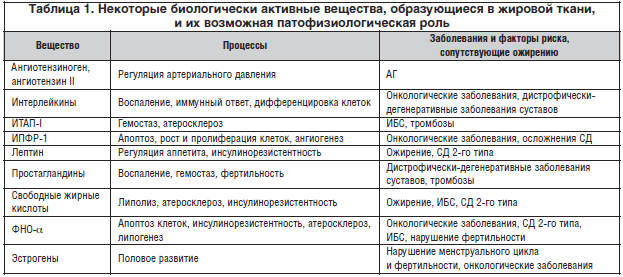
–Т–Є—Б—Ж–µ—А–∞–ї—М–љ—Л–є –ґ–Є—А, —П–≤–ї—П—П—Б—М –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ –∞–Ї—В–Є–≤–љ—Л–Љ, –≤—Л–њ–Њ–ї–љ—П–µ—В –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Г—О —А–Њ–ї—М: —Б–µ–Ї—А–µ—В–Є—А—Г–µ—В —Н—Б—В—А–Њ–≥–µ–љ—Л (–∞—А–Њ–Љ–∞—В–∞–Ј–∞ –∞–і–Є–њ–Њ—Ж–Є—В–Њ–≤ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–Є–љ—В–µ–Ј—Г —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –Є–Ј –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤—Л—Е –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤), –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≥–µ–љ, –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ—Л, —Д–∞–Ї—В–Њ—А –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є α (–§–Э–Ю-α), –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ-6 (–Ш–Ы-6), –ї–µ–њ—В–Є–љ, —А–µ–Ј–Є—Б—В–Є–љ, –∞–і–Є–њ–Њ–љ–µ–Ї—В–Є–љ, –Є–љ—Б—Г–ї–Є–љ–Њ–њ–Њ–і–Њ–±–љ—Л–є —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞ 1 (–Ш–Я–§–†-1), –Є–љ–≥–Є–±–Є—В–Њ—А —В–Ї–∞–љ–µ–≤–Њ–≥–Њ –∞–Ї—В–Є–≤–∞—В–Њ—А–∞ –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞ I (–Ш–Ґ–Р–Я–I), —Д–Є–±—А–Є–љ–Њ–≥–µ–љ (—В–∞–±–ї. 1). [3]. –Ю–і–Є–љ –Є–Ј –Є—В–Њ–≥–Њ–≤ –і–µ–є—Б—В–≤–Є—П –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –≤–µ—Й–µ—Б—В–≤ – —А–∞–Ј–≤–Є—В–Є–µ —Г –њ–∞—Ж–Є–µ–љ—В–∞, —Б—В—А–∞–і–∞—О—Й–µ–≥–Њ –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, –°–°–Ч, –≤ –Њ—Б–љ–Њ–≤–µ –Ї–Њ—В–Њ—А—Л—Е –ї–µ–ґ–∞—В –њ—А–Њ—Ж–µ—Б—Б—Л –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ–≥–µ–љ–µ–Ј–∞, –Є –љ–∞—А—Г—И–µ–љ–Є—П –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ.
–Ц–Ґ —Б–µ—А–і—Ж–∞ —А–∞–Ј–і–µ–ї—П–µ—В—Б—П –љ–∞ —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л–є –ґ–Є—А (–≠–Ц) – –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л–є —Б–ї–Њ–є –њ–µ—А–Є–Ї–∞—А–і–∞ – –Є –њ–µ—А–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л–є –ґ–Є—А – –њ–∞—А–Є–µ—В–∞–ї—М–љ—Л–є —Б–ї–Њ–є –њ–µ—А–Є–Ї–∞—А–і–∞.
–≠–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л–є –ґ–Є—А –Є –µ–≥–Њ —Д—Г–љ–Ї—Ж–Є–Є
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Г—О –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М —Б–µ—А–і—Ж–∞ —З–µ–ї–Њ–≤–µ–Ї–∞ –њ–Њ–Ї—А—Л–≤–∞–µ—В —А–∞–Ј–ї–Є—З–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –ґ–Є—А–∞, –Ї–Њ—В–Њ—А—Л–є –ї–Њ–Ї–∞–ї–Є–Ј—Г–µ—В—Б—П –Љ–µ–ґ–і—Г –≤–љ–µ—И–љ–µ–є —Б—В–µ–љ–Ї–Њ–є –Љ–Є–Њ–Ї–∞—А–і–∞ –Є –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Л–Љ —Б–ї–Њ–µ–Љ –њ–µ—А–Є–Ї–∞—А–і–∞ [4, 5]. –Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –ґ–Є—А —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є, –Ї–∞–Ї –Є –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–∞—П –Ц–Ґ –і—А—Г–≥–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є, —Д–Њ—А–Љ–Є—А—Г–µ—В—Б—П –Є–Ј –Љ–µ–Ј–Њ–і–µ—А–Љ—Л –Є –Њ–±–ї–∞–і–∞–µ—В –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О [6, 7]. –≠–Ц –њ–Њ–Ї—А—Л–≤–∞–µ—В –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –Њ–±–Њ–Є—Е –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤ —Б–µ—А–і—Ж–∞ –Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –ї–Є—И—М 20% –Њ—В –Є—Е –Њ–±—Й–µ–є –Љ–∞—Б—Б—Л (–µ–≥–Њ –≤–µ—Б – –≤ —Б—А–µ–і–љ–µ–Љ 50 –≥) [8]. –≠–Ц –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Є–Ј —Б–њ–ї–∞–љ—Е–љ–Њ–њ–ї–µ–≤—А–∞–ї—М–љ–Њ–є –Љ–µ–Ј–Њ–і–µ—А–Љ—Л, –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–∞–µ—В—Б—П –Ј–∞ —Б—З–µ—В –≤–µ—В–≤–µ–є –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є (–Ъ–Р) –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є –Њ—З–µ–љ—М –∞–Ї—В–Є–≤–µ–љ.
–≠–Ц –≤—Л–њ–Њ–ї–љ—П–µ—В –≤–∞–ґ–љ—Л–µ —Д—Г–љ–Ї—Ж–Є–Є:
1) –≤ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е –і–µ–є—Б—В–≤—Г–µ—В –Ї–∞–Ї –±—Г—Д–µ—А–љ–∞—П —Б–Є—Б—В–µ–Љ–∞, –∞–±—Б–Њ—А–±–Є—А—Г—П —Б–≤–Њ–±–Њ–і–љ—Л–µ –ґ–Є—А–љ—Л–µ –Ї–Є—Б–ї–Њ—В—Л (–°–Ц–Ъ) –Є –Ј–∞—Й–Є—Й–∞—П —Б–µ—А–і—Ж–µ –Њ—В –Є—Е –≤—Л—Б–Њ–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є. –≠–Ц –Є–Љ–µ–µ—В –≤—Л—Б–Њ–Ї—Г—О —Б–Ї–Њ—А–Њ—Б—В—М –њ–Њ–≥–ї–Њ—Й–µ–љ–Є—П –Ц–Ъ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –і—А—Г–≥–Є—Е –Ј–Њ–љ –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –ґ–Є—А–∞;
2) —Б–ї—Г–ґ–Є—В –ї–Њ–Ї–∞–ї—М–љ—Л–Љ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ —Н–љ–µ—А–≥–Є–Є, –∞–Ї—В–Є–≤–љ–Њ —Б–µ–Ї—А–µ—В–Є—А—Г—П –°–Ц–Ъ –≤ –њ–µ—А–Є–Њ–і –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –љ–Є—Е –Љ–Є–Њ–Ї–∞—А–і–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –Ј–∞–њ—Г—Б–Ї–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–∞—Б–Ї–∞–і–∞.
–Ю—З–µ–≤–Є–і–љ–Њ, —З—В–Њ, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ–Њ–≤—Л—И–µ–љ–љ—Л–є –Њ–±—К–µ–Љ –≠–Ц –Љ–Њ–ґ–µ—В –њ–Њ–і–∞–≤–ї—П—В—М —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–µ –≤–ї–Є—П–љ–Є–µ –Є–Ј–±—Л—В–Њ—З–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –°–Ц–Ъ, –Љ–µ—И–∞—О—Й–Є—Е –≥–µ–љ–µ—А–∞—Ж–Є–Є –Є–Љ–њ—Г–ї—М—Б–Њ–≤ –Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—О —Б–Њ–Ї—А–∞—В–Є—В–µ–ї—М–љ—Л—Е —Ж–Є–Ї–ї–Њ–≤ —Б–µ—А–і—Ж–∞. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П –Ј–љ–∞—З–µ–љ–Є–µ –≠–Ц –Ї–∞–Ї –≤–∞–ґ–љ–Њ–≥–Њ –Є—Б—В–Њ—З–љ–Є–Ї–∞ –њ—А–Њ–і—Г–Ї—Ж–Є–Є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е –∞–і–Є–њ–Њ–Ї–Є–љ–Њ–≤, —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –Ї–∞–Ї –њ—А—П–Љ–Њ, —В–∞–Ї –Є –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, —Б–Њ–і–µ–є—Б—В–≤—Г—О—Й–Є—Е —А–∞–Ј–≤–Є—В–Є—О –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є (–Р–У), —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—О —Б–µ—А–і—Ж–∞, –≤–Њ—Б–њ–∞–ї–µ–љ–Є—О, –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ–≥–µ–љ–µ–Ј—Г, –Є–љ—Б—Г–ї–Є–љ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є (–Ш–†) [9,10].
–Ш–Ј-–Ј–∞ –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Њ–є –±–ї–Є–Ј–Њ—Б—В–Є –Ї —Б–µ—А–і—Ж—Г –Є –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Д–∞—Б—Ж–Є–∞–ї—М–љ—Л—Е –≥—А–∞–љ–Є—Ж –Љ–µ–ґ–і—Г –ґ–Є—А–Њ–≤—Л–Љ–Є –Є –Љ—Л—И–µ—З–љ—Л–Љ–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ–Є —Б–µ—А–і—Ж–∞ –≠–Ц –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М –Љ–µ—Б—В–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–µ –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є–µ, —Б–µ–Ї—А–µ—В–Є—А—Г—П –∞–і–Є–њ–Њ–љ–µ–Ї—В–Є–љ –Є –∞–і—А–µ–љ–Њ–Љ–µ–і—Г–ї–ї–Є–љ –≤ –Ї–Њ—А–Њ–љ–∞—А–љ—Л–є –Ї—А–Њ–≤–Њ—В–Њ–Ї. –Ґ–Њ–ї—Й–Є–љ–∞ –≠–Ц (–њ–Њ –і–∞–љ–љ—Л–Љ —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є–Є) –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б —Г—А–Њ–≤–љ–µ–Љ —Н—В–Є—Е —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–Є—Е –∞–і–Є–њ–Њ–Ї–Є–љ–Њ–≤ [11].
–Р–і–Є–њ–Њ–љ–µ–Ї—В–Є–љ – —Н—В–Њ –±–µ–ї–Њ–Ї (–Њ—В–Ї—А—Л—В –≤ 1985 –≥.), –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ —В–Њ—А–Љ–Њ–Ј—П—Й–Є–є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї—Г –њ—А–µ–∞–і–Є–њ–Њ—Ж–Є—В–Њ–≤ [12]. –Р–і–Є–њ–Њ–љ–µ–Ї—В–Є–љ –≤ –Љ—Л—И–µ—З–љ–Њ–є —В–Ї–∞–љ–Є —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –Њ–Ї–Є—Б–ї–µ–љ–Є–µ –ґ–Є—А–Њ–≤, —Б–љ–Є–ґ–∞–µ—В –Є–љ—В—А–∞–Љ–Є–Њ—Ж–µ–ї–ї—О–ї—П—А–љ–Њ–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –ї–Є–њ–Є–і–Њ–≤ –Є —Г–ї—Г—З—И–∞–µ—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Љ—Л—И—Ж –Ї –Є–љ—Б—Г–ї–Є–љ—Г; –≤ –њ–µ—З–µ–љ–Є – —Г–Љ–µ–љ—М—И–∞–µ—В –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –Ц–Ъ –Є —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –Є—Е –Њ–Ї–Є—Б–ї–µ–љ–Є–µ, —З—В–Њ —Б–љ–Є–ґ–∞–µ—В –њ—А–Њ–і—Г–Ї—Ж–Є—О –≥–ї—О–Ї–Њ–Ј—Л –Є —Б–Є–љ—В–µ–Ј –Ґ–У; –≤ —Б–Њ—Б—Г–і–∞—Е – –њ—А–Њ—П–≤–ї—П–µ—В –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Є –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞; –≤ —Б–µ—А–і—Ж–µ – –Љ–Њ–і—Г–ї–Є—А—Г–µ—В —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ –Љ–Є–Њ–Ї–∞—А–і–∞ –њ–Њ—Б–ї–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –њ—А–Њ—В–µ–Ї—Ж–Є—О –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–∞–Љ –њ–Њ—Б–ї–µ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ (–Ш–Ь).
–Т—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –∞–і–Є–њ–Њ–љ–µ–Ї—В–Є–љ–∞ —Б–≤—П–Ј–∞–љ —Б –љ–Є–Ј–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Ш–Ь –Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Б–µ—А–і—Ж–∞ (–Ш–С–°). –Э–∞–њ—А–Њ—В–Є–≤, –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –∞–і–Є–њ–Њ–љ–µ–Ї—В–Є–љ–∞ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є (–≠–Ф), –Ї–Њ–љ—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–µ—А—В—А–Њ—Д–Є–µ–є –Љ–Є–Њ–Ї–∞—А–і–∞ –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–Ы–Ц). –Я–Њ–і–∞–≤–ї—П—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –Є —Б–µ–Ї—А–µ—Ж–Є—О —Б–∞–Љ–Њ–≥–Њ –∞–і–Є–њ–Њ–љ–µ–Ї—В–Є–љ–∞ –Њ–Ї–∞–Ј—Л–≤–∞—О—В –§–Э–Ю-α –Є –Ш–Ы-6. –Ш–Љ–µ—О—В—Б—П –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ —В–Њ–≥–Њ, —З—В–Њ –≥–Є–њ–Њ–∞–і–Є–њ–Њ–љ–µ–Ї—В–Є–љ–µ–Љ–Є—О —Б–ї–µ–і—Г–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –Ї–∞–Ї –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–є –§–† –і–ї—П –°–°–Ч.
–Р–і—А–µ–љ–Њ–Љ–µ–і—Г–ї–ї–Є–љ – –Љ–Њ—Й–љ—Л–є –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—В–Њ—А —Б –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є. –Ю–љ –њ—А–Њ–і—Г—Ж–Є—А—Г–µ—В—Б—П –≤ –њ–Њ–і–Ї–Њ–ґ–љ–Њ–є –Ї–ї–µ—В—З–∞—В–Ї–µ, –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–є –Ц–Ґ –Є —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –Ц–Ґ. –Р–і—А–µ–љ–Њ–Љ–µ–і—Г–ї–ї–Є–љ –Є–Љ–µ–µ—В –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ.
–Т –≠–Ц –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ –њ–Њ–≤—Л—И–µ–љ–љ–∞—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—П —А–µ–Ј–Є—Б—В–Є–љ–∞ – –≥–Њ—А–Љ–Њ–љ–∞, –Њ–±—А–∞—В–љ–Њ–≥–Њ –њ–Њ —Б–≤–Њ–µ–є —Д—Г–љ–Ї—Ж–Є–Є –∞–і–Є–њ–Њ–љ–µ–Ї—В–Є–љ—Г [13]. –Я–Њ–ї–∞–≥–∞—О—В, —З—В–Њ —А–µ–Ј–Є—Б—В–Є–љ —Б–љ–Є–ґ–∞–µ—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —В–Ї–∞–љ–µ–є –Ї –Є–љ—Б—Г–ї–Є–љ—Г, –њ–Њ–≤—Л—И–∞–µ—В —Г—А–Њ–≤–љ–Є –Љ–∞—А–Ї–µ—А–Њ–≤ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П, –њ—А–Њ–≤–Њ—Ж–Є—А—Г–µ—В –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ —Н–љ–і–Њ—В–µ–ї–Є–љ–∞-1, —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В —Б–Є–љ—В–µ–Ј –Љ–Њ–љ–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ —Е–µ–Љ–Њ—В–∞–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—В–µ–Є–љ–∞-1 –≤ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е, —Б–Њ–і–µ–є—Б—В–≤—Г–µ—В —А–∞–Ј–≤–Є—В–Є—О –≠–Ф —Б–Њ—Б—Г–і–Њ–≤.
–≠–Ц —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ—В —И–Є—А–Њ–Ї–Є–є –Ї—А—Г–≥ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤: —Е–µ–Љ–Њ–Ї–Є–љ–Њ–≤ (–Љ–Њ–љ–Њ—Ж–Є—В–∞—А–љ—Л–є —Е–µ–Љ–Њ—В–∞–Ї—Б–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—В–µ–Є–љ-1) –Є —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ (–Ш–Ы-1, –Ш–Ы-6, –§–Э–Ю-α). –Т —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –Ц–Ґ –Љ–Њ–≥—Г—В –њ—А–Є—Б—Г—В—Б—В–≤–Њ–≤–∞—В—М –Є–љ—Д–Є–ї—М—В—А–∞—В—Л –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї [14]. –Т–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –∞–і–Є–њ–Њ–Ї–Є–љ—Л –Є–Ј –≠–Ц –њ–Њ–њ–∞–і–∞—О—В –≤ —Б—В–µ–љ–Ї—Г –Ъ–Р –Є –≤—Л–Ј—Л–≤–∞—О—В –≤ –љ–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –њ—А–Є–≤–Њ–і—П—Й–Є–µ –Ї —А–∞–Ј–≤–Є—В–Є—О –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ [15].
–Я—А–Є—Б—Г—В—Б—В–≤–Є–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ (–љ–∞–њ—А–Є–Љ–µ—А, –§–Э–Ю-α) –≤ —В–Ї–∞–љ–Є, –Њ–Ї—А—Г–ґ–∞—О—Й–µ–є —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л–µ –Ъ–Р, —Г –±–Њ–ї—М–љ—Л—Е –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–є –±–Њ–ї–µ–Ј–љ—М—О —Б–µ—А–і—Ж–∞ (–Ъ–С–°) —Г—Б–Є–ї–Є–≤–∞–µ—В —Б–Њ—Б—Г–і–Є—Б—В–Њ–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –Є –њ—А–Њ–≤–Њ—Ж–Є—А—Г–µ—В —Б–Њ—Б—В–Њ—П–љ–Є–µ –љ–µ—Б—В–∞–±–Є–ї—М–љ–Њ—Б—В–Є –±–ї—П—И–Ї–Є. G. Iacobellis –Є —Б–Њ–∞–≤—В. –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Н–Ї—Б–њ—А–µ—Б—Б–Є—П –∞–і–Є–њ–Њ–љ–µ–Ї—В–Є–љ–∞ –њ—А–Є–Љ–µ—А–љ–Њ –љ–∞ 40% –љ–Є–ґ–µ –≤ —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –Ц–Ґ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Б—В—А–∞–і–∞—О—Й–Є—Е –Ъ–С–° [16]. –Я—А–Є—З–µ–Љ —Н—В–Њ –љ–µ –Ј–∞–≤–Є—Б–µ–ї–Њ –Њ—В –Є–љ–і–µ–Ї—Б–∞ –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ш–Ь–Ґ) –Є –≤–Њ–Ј—А–∞—Б—В–∞ –њ–∞—Ж–Є–µ–љ—В–∞. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–і–≤–µ—А–≥–љ—Г—В—Л—Е –∞–Њ—А—В–Њ–Ї–Њ—А–Њ–љ–∞—А–љ–Њ–Љ—Г —И—Г–љ—В–Є—А–Њ–≤–∞–љ–Є—О, —Г—А–Њ–≤–µ–љ—М –Љ–∞—А–Ї–µ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –≤ —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –Ц–Ґ –њ–Њ–≤—Л—И–∞–µ—В—Б—П [17].
–Т–Њ–ї–Њ–Ї–љ–∞ –Ц–Ґ –њ—А–Њ–љ–Є–Ј—Л–≤–∞—О—В —В–Њ–ї—Й–Є–љ—Г –Љ–Є–Њ–Ї–∞—А–і–∞. –Я—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є —В–Њ–ї—Й–Є–љ—Л –≠–Ц —Б–µ—А–і—Ж–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П «–Ј–∞–Ї–Њ–≤–∞–љ–љ—Л–Љ» –≤ –ґ–Є—А–Њ–≤–Њ–є –њ–∞–љ—Ж–Є—А—М. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Њ–±—К–µ–Љ –≠–Ц –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–Њ –Љ–∞—Б—Б–µ –Љ–Є–Њ–Ї–∞—А–і–∞ –Ы–Ц (—В. –µ. —Б—В–µ–њ–µ–љ–Є –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є) –Є –љ–∞—А—Г—И–µ–љ–Є—О –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є [18, 19].
–Я–Њ—Б–Ї–Њ–ї—М–Ї—Г —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–∞—П –Ц–Ґ –Є–≥—А–∞–µ—В –∞–Ї—В–Є–≤–љ—Г—О —А–Њ–ї—М –≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ –Љ–Є–Њ–Ї–∞—А–і–∞, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –µ–µ –Њ–±—К–µ–Љ–∞ –Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤–µ–і–µ—В –Ї –љ–∞—А—Г—И–µ–љ–Є—О —А–∞–±–Њ—В—Л –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–є. –Ь–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П –Є –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤ —Б–Њ–і–µ–є—Б—В–≤—Г—О—В —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є —Б–µ—А–і—Ж–∞ —Г —В—Г—З–љ—Л—Е –±–Њ–ї—М–љ—Л—Е. –Я—А–Є —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–Љ –Њ–ґ–Є—А–µ–љ–Є–Є —Б–µ—А–і—Ж–∞ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±—Л—Б—В—А–Њ –Љ–Њ–ґ–µ—В —А–∞–Ј–≤–Є–≤–∞—В—М—Б—П —Д–Є–±—А–Њ–Ј –Љ–Є–Њ–Ї–∞—А–і–∞, —З—В–Њ —Г—Б–Ї–Њ—А—П–µ—В –∞–њ–Њ–њ—В–Њ–Ј –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤. –Р–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ II, –≤ –Є–Ј–±—Л—В–Ї–µ —Б–µ–Ї—А–µ—В–Є—А—Г–µ–Љ—Л–є –≠–Ц, –њ–Њ–≤—Л—И–∞–µ—В —Б–Є–љ—В–µ–Ј —Д–Є–±—А–Њ–Ј–∞. –§–Є–±—А–Њ–Ј –Љ–Њ–ґ–µ—В –њ—А–µ–і—И–µ—Б—В–≤–Њ–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є—О –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ –Ы–Ц, –Ї–Њ—В–Њ—А–∞—П —Б–ї—Г–ґ–Є—В –Њ–і–љ–Є–Љ –Є–Ј –њ—Г—Б–Ї–Њ–≤—Л—Е –Љ–Њ–Љ–µ–љ—В–Њ–≤ –љ–∞—А—Г—И–µ–љ–Є—П –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є —Д—Г–љ–Ї—Ж–Є–Є —Б–µ—А–і—Ж–∞. –≠–Ц –≤–љ–Њ—Б–Є—В —Б–≤–Њ–є –≤–Ї–ї–∞–і –Є –≤ —А–∞–Ј–≤–Є—В–Є–µ —Д–Є–±—А–Њ–Ј–∞ –њ—А–µ–і—Б–µ—А–і–Є–є, —В. –Ї. –≤ –љ–Њ—А–Љ–µ –љ–µ–±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –Ц–Ґ –њ–Њ–Ї—А—Л–≤–∞–µ—В —Г—И–Ї–Є –њ—А–µ–і—Б–µ—А–і–Є–є, –∞ —В–∞–Ї–ґ–µ –Є—Е –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М.
J. Shirani –Є —Б–Њ–∞–≤—В. –≤—Л—П–≤–Є–ї–Є, —З—В–Њ –Є–Ј–±—Л—В–Њ—З–љ–Њ–µ –і–µ–њ–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ –ґ–Є—А–∞ –≤ –њ—А–µ–і—Б–µ—А–і–љ–Њ–є –њ–µ—А–µ–≥–Њ—А–Њ–і–Ї–µ –њ–Њ–≤—Л—И–∞–µ—В —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є (–§–Я) [20]. –Ъ —Н–ї–µ–Ї—В—А–Њ–Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ –њ—А–µ–і—Б–µ—А–і–Є–є –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Є –Ј–∞–Љ–µ—В–љ–∞—П –ґ–Є—А–Њ–≤–∞—П –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞ –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤ [21].
–Т–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ –Њ–ґ–Є—А–µ–љ–Є—П —Б –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ –≤—Л–Ј—Л–≤–∞–µ—В –њ–Њ–≤—Л—И–µ–љ–љ—Л–є –Є–љ—В–µ—А–µ—Б –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є [22]. –У.–Р. –І—Г–Љ–∞–Ї–Њ–≤–Њ–є –Є —Б–Њ–∞–≤—В. —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —В–Њ–ї—Й–Є–љ—Л –≠–Ц —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–С–° –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–∞–љ–Њ —Б –±–Њ–ї–µ–µ —В—П–ґ–µ–ї—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є (–Ъ–Р), –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є, –≥–Є–њ–µ—А–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Є —Б–і–≤–Є–≥–∞–Љ–Є –≤ —Б–Є—Б—В–µ–Љ–µ –ї–Є–њ–Є–і–љ–Њ–≥–Њ —В—А–∞–љ—Б–њ–Њ—А—В–∞ –∞—В–µ—А–Њ–≥–µ–љ–љ–Њ–є –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ—Б—В–Є [23]. –≠—В–Є –і–∞–љ–љ—Л–µ –±—Л–ї–Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ—Л –і—А—Г–≥–Є–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є: —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–µ –Њ–ґ–Є—А–µ–љ–Є–µ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–Њ—Б—М —Б–Њ —Б—В–µ–љ–Њ–Ј–∞–Љ–Є –Ъ–Р –њ–Њ –і–∞–љ–љ—Л–Љ –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є –Є —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ —Б–Њ–љ–љ—Л—Е –∞—А—В–µ—А–Є–є [24, 25]. –Ґ–Њ–ї—Й–Є–љ–∞ –≠–Ц, –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–∞—П –њ–Њ –і–∞–љ–љ—Л–Љ —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є–Є, —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї –њ—А–µ–і–Є–Ї—В–Њ—А –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ —А–µ–Ј–µ—А–≤–∞ —Г –ґ–µ–љ—Й–Є–љ —Б –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є «—З–Є—Б—В—Л–Љ–Є» –Ъ–Р [26].
S. Eroglu –Є —Б–Њ–∞–≤—В. —Г—Б—В–∞–љ–Њ–≤–Є–ї–Є, —З—В–Њ —В–Њ–ї—Й–Є–љ–∞ –≠–Ц >7 –Љ–Љ –љ–∞–Є–±–Њ–ї–µ–µ –Ј–∞–Љ–µ—В–љ–Њ —Б–Њ–њ—А—П–ґ–µ–љ–∞ —Б –љ–∞–ї–Є—З–Є–µ–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –љ–∞ —Б—В–∞–і–Є–Є –µ–≥–Њ —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П [27]. –Я–Њ –і–∞–љ–љ—Л–Љ L.E. Sade –Є —Б–Њ–∞–≤—В., —Е–Њ—А–Њ—И—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М –≤ —Б–љ–Є–ґ–µ–љ–Є–Є –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ —Г –ґ–µ–љ—Й–Є–љ –њ–Њ–Ї–∞–Ј–∞–ї–Њ –Њ—В—А–µ–Ј–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —В–Њ–ї—Й–Є–љ—Л –≠–Ц >4,5 –Љ–Љ [28]. –Ґ–Њ–ї—Й–Є–љ–∞ –≠–Ц >3,0 –Љ–Љ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–ї–∞—Б—М –Ї–∞–Ї –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–є –њ—А–µ–і–Є–Ї—В–Њ—А –љ–∞–ї–Є—З–Є—П –Ъ–С–° —Г –Ї–Њ—А–µ–є—Б–Ї–Є—Е –Љ—Г–ґ—З–Є–љ –Є –ґ–µ–љ—Й–Є–љ [29].
–Ю–±—Б—Г–ґ–і–∞–µ—В—Б—П —А–Њ–ї—М —Н—В–љ–Є—З–µ—Б–Ї–Є—Е —А–∞–Ј–ї–Є—З–Є–є –≤ –≤–∞—А–Є–∞–±–µ–ї—М–љ–Њ—Б—В–Є —В–Њ–ї—Й–Є–љ—Л –≠–Ц. –Ш–і–µ—В –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є—Е –Њ —Б–≤—П–Ј–Є —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ –Њ–ґ–Є—А–µ–љ–Є—П —Б –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ—Л–Љ –ґ–Є—А–Њ–Љ. –Т—Б–µ –±–Њ–ї—М—И–Є–є –Є–љ—В–µ—А–µ—Б –≤—Л–Ј—Л–≤–∞–µ—В —Д–∞–Ї—В, —З—В–Њ —В–Њ–ї—Й–Є–љ–∞ –≠–Ц –Љ–Њ–ґ–µ—В –≤—Л—Б—В—Г–њ–∞—В—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –љ–Њ–≤–Њ–≥–Њ –Љ–∞—А–Ї–µ—А–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А–Є—Б–Ї–∞ (–°–°–†) –Є —Г—З–Є—В—Л–≤–∞—В—М—Б—П –њ—А–Є —Б—В—А–∞—В–Є—Д–Є–Ї–∞—Ж–Є–Є –°–°–† [30].
–Ґ. –Ї. –≠–Ц –Њ—В—А–∞–ґ–∞–µ—В —Б—В–µ–њ–µ–љ—М –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–≥–Њ –Њ–ґ–Є—А–µ–љ–Є—П, –µ–≥–Њ —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–µ –Є–Ј–Љ–µ—А–µ–љ–Є–µ –Љ–Њ–ґ–µ—В –±—Л—В—М —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є —Ж–µ–ї—М—О —Г –±–Њ–ї—М–љ—Л—Е, –њ–Њ–і–≤–µ—А–≥–љ—Г—В—Л—Е –ї–µ—З–µ–љ–Є—О –њ–Њ —Б–љ–Є–ґ–µ–љ–Є—О –Ь–Ґ –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –і–Є–µ—В—Л, —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –љ–∞–≥—А—Г–Ј–Њ–Ї –Є–ї–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞. –Ф—А—Г–≥–Њ–є –≤–Њ–њ—А–Њ—Б: –љ–∞—Б–Ї–Њ–ї—М–Ї–Њ —Н—В–Є –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –±—Г–і—Г—В —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ –Њ–ґ–Є—А–µ–љ–Є—П? –Ш–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ 3 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —Д–Є–Ї—Б–Є—А—Г—О—Й–Є—Е —Б–љ–Є–ґ–µ–љ–Є–µ —В–Њ–ї—Й–Є–љ—Л –≠–Ц –њ–Њ—Б–ї–µ –Љ–Њ–і—Г–ї—П—Ж–Є–Є –Ь–Ґ –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –љ–Є–Ј–Ї–Њ–Ї–∞–ї–Њ—А–Є–є–љ–Њ–є –і–Є–µ—В—Л, –њ—А–Њ–≥—А–∞–Љ–Љ—Л —Г–Љ–µ—А–µ–љ–љ—Л—Е —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е —В—А–µ–љ–Є—А–Њ–≤–Њ–Ї –Є —Е–Є—А—Г—А–≥–Є–Є [31–33]. –Я—А–Є —Н—В–Њ–Љ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ –Њ–±—К–µ–Љ–∞ –≠–Ц –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ –±—Л—Б—В—А–µ–µ, —З–µ–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ш–Ь–Ґ, –Њ–±—К–µ–Љ–∞ —В–∞–ї–Є–Є –Є –≤–µ—Б–∞ —В–µ–ї–∞.
–Ю–±—Б—Г–ґ–і–∞–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ–∞—А–∞–Љ–µ—В—А–∞ —В–Њ–ї—Й–Є–љ—Л –≠–Ц (–њ–Њ –і–∞–љ–љ—Л–Љ —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є–Є) –≤ –Ї–∞—З–µ—Б—В–≤–µ –љ–Њ–≤–Њ–є —Ж–µ–ї–Є –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ –і–ї—П —Б–љ–Є–ґ–µ–љ–Є—П –Ь–Ґ [34].
–Я–µ—А–Є–Ї–∞—А–і–Є–∞–ї—М–љ–∞—П –Ц–Ґ
–Я–µ—А–Є–Ї–∞—А–і–Є–∞–ї—М–љ–∞—П –Ц–Ґ (–ґ–Є—А –≤–Њ–Ї—А—Г–≥ —Б–µ—А–і—Ж–∞) –љ–∞—Е–Њ–і–Є—В—Б—П –Љ–µ–ґ–і—Г –≤–љ–µ—И–љ–µ–є —З–∞—Б—В—М—О –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–≥–Њ –њ–µ—А–Є–Ї–∞—А–і–∞ –Є –њ–∞—А–Є–µ—В–∞–ї—М–љ—Л–Љ –њ–µ—А–Є–Ї–∞—А–і–Њ–Љ. –Т –љ–Њ—А–Љ–µ –њ–µ—А–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л–є –ґ–Є—А –њ–Њ–Ї—А—Л–≤–∞–µ—В –Њ–Ї–Њ–ї–Њ 80% –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Б–µ—А–і—Ж–∞ –Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –≤ —Б—А–µ–і–љ–µ–Љ 40% –Њ—В –≤—Б–µ–є –µ–≥–Њ –Љ–∞—Б—Б—Л [35]. –Я–µ—А–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л–є –ґ–Є—А —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Є–Ј –њ—А–Њ–Є–Ј–≤–Њ–і–љ–Њ–є –Љ–µ–Ј–Њ–і–µ—А–Љ—Л – –Љ–µ–Ј–µ–љ—Е–Є–Љ—Л –Є –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–∞–µ—В—Б—П –Ј–∞ —Б—З–µ—В –≤–µ—В–≤–µ–є –∞—А—В–µ—А–Є–є –∞. pericardia cophrenica, –≤–µ—В–≤–Є a. –Љammaria interna. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–µ—А–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л–є –ґ–Є—А –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –≠–Ц –љ–µ –Є–Љ–µ–µ—В –Њ–±—Й–µ–≥–Њ –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П —Б –Љ–Є–Њ–Ї–∞—А–і–Њ–Љ.
–Ю–±–љ–∞—А—Г–ґ–µ–љ—Л —Д–∞–Ї—В—Л, —Г–Ї–∞–Ј—Л–≤–∞—О—Й–Є–µ –љ–∞ —Г—З–∞—Б—В–Є–µ –њ–µ—А–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ –ґ–Є—А–∞ –≤ —А–∞–Ј–≤–Є—В–Є–Є –°–°–Ч, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л—Е –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, – –Ъ–С–° –Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ —З–µ—А–µ–Ј –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ [36–39]. –Я–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П Multi-Ethnic Study of Atherosclerosis (MESA), –љ–∞–ї–Є—З–Є–µ –њ–µ—А–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ –ґ–Є—А–∞ —З–∞—Й–µ –њ—А–Є—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Њ –њ—А–Є –Ї–∞–ї—М—Ж–Є—Д–Є–Ї–∞—Ж–Є–Є –∞—В–µ—А–Њ–Љ—Л [40, 41]. –Ф–∞–љ–љ—Л–µ –§—А–∞–Љ–Є–љ–≥–µ–Љ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ–µ—А–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л–є –ґ–Є—А —Б–≤—П–Ј–∞–љ —Б –Њ—В–ї–Њ–ґ–µ–љ–Є–µ–Љ –Ї–∞–ї—М—Ж–Є—П –≤ –∞—В–µ—А–Њ–Љ–µ –Ъ–Р –њ–Њ –і–∞–љ–љ—Л–Љ –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є [42]. –Я—А–Є —Н—В–Њ–Љ –≤—Л—П–≤–ї–µ–љ–љ—Л–µ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є –≠–Ц —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –Ъ–С–° –Є –љ–∞–ї–Є—З–Є–µ–Љ –∞—В–µ—А–Њ–Љ—Л –љ–µ –Ј–∞–≤–Є—Б–µ–ї–Є –Њ—В –Њ–±—Й–µ–≥–Њ –Є –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Њ–ґ–Є—А–µ–љ–Є—П.
–Т—Б–µ –±–Њ–ї—М—И–µ –њ–Њ—П–≤–ї—П–µ—В—Б—П —Б–Њ–Њ–±—Й–µ–љ–Є–є –Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –њ–µ—А–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ –ґ–Є—А–∞ –Ј–∞–њ—Г—Б–Ї–∞—В—М –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л, —Б–Њ–і–µ–є—Б—В–≤—Г—О—Й–Є–µ —А–∞–Ј–≤–Є—В–Є—О —Д–Є–±—А–Є–ї–ї—П—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є (–§–Я) –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є [43]. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –§—А–∞–Љ–Є–љ–≥–µ–Љ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Њ–±—К–µ–Љ–∞ –≠–Ц —Б–Њ–њ—А—П–ґ–µ–љ–Њ —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –§–Я –љ–∞ 40%. –Ґ–∞–Ї–Є–µ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Љ–µ–і–Є–∞—В–Њ—А—Л, –Ї–∞–Ї –§–Э–Ю-α –Є –Ш–Ы-6, –≤—Л—А–∞–±–∞—В—Л–≤–∞–µ–Љ—Л–µ –њ–µ—А–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л–Љ –ґ–Є—А–Њ–Љ, –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ—Л–є –∞—А–Є—В–Љ–Њ–≥–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –љ–∞ —В–Ї–∞–љ—М –њ—А–µ–і—Б–µ—А–і–Є–є –Є —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –Є–љ–Є—Ж–Є–Є—А–Њ–≤–∞—В—М –њ–Њ—П–≤–ї–µ–љ–Є–µ –§–Я [44–46]. –Я–µ—А–Є–Ї–∞—А–і–Є–∞–ї—М–љ—Л–є –ґ–Є—А –Љ–Њ–ґ–µ—В –Љ–Њ–і—Г–ї–Є—А–Њ–≤–∞—В—М –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≤–љ—Г—В—А–µ–љ–љ–µ–є –∞–≤—В–Њ–љ–Њ–Љ–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л —Б–µ—А–і—Ж–∞ –Є —В–µ–Љ —Б–∞–Љ—Л–Љ –њ–Њ–≤—Л—И–∞—В—М –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М –Ї –§–Я [47].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ—В –њ–Њ–ї–љ–Њ–≥–Њ –њ–Њ–љ–Є–Љ–∞–љ–Є—П –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —В–∞–Ї–Њ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –њ–µ—А–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ –ґ–Є—А–∞ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –°–°–Ч, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л—Е –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ, –Є –њ–Њ—Н—В–Њ–Љ—Г —В—А–µ–±—Г–µ—В—Б—П –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –і–∞–ї—М–љ–µ–є—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.
–Я–µ—А–Є–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П –Ц–Ґ
–Я–µ—А–Є–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П –Ц–Ґ, –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–∞—П –≤–Њ–Ї—А—Г–≥ —Б–Њ—Б—Г–і–Њ–≤, –Љ–Њ–ґ–µ—В –Є–≥—А–∞—В—М –∞–Ї—В–Є–≤–љ—Г—О —А–Њ–ї—М –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —В–Њ–љ—Г—Б–∞ [4]. –Я–µ—А–Є–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–є –ґ–Є—А –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞–µ—В —Б–Њ—Б—Г–і–Є—Б—В—Л–µ —Д–∞–Ї—В–Њ—А—Л —А–µ–ї–∞–Ї—Б–∞—Ж–Є–Є –Є —В–µ–Љ —Б–∞–Љ—Л–Љ –Љ–Њ–ґ–µ—В –Љ–Њ–і—Г–ї–Є—А–Њ–≤–∞—В—М —Д—Г–љ–Ї—Ж–Є—О —Б–Њ—Б—Г–і–Њ–≤, –∞ —В–∞–Ї–ґ–µ –≤–ї–Є—П—В—М –љ–∞ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–µ. –° —Ж–µ–ї—М—О –Є–Ј—Г—З–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–µ–є –њ–µ—А–Є–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–≥–Њ –ґ–Є—А–∞ –Є –µ–≥–Њ —А–Њ–ї–Є –≤ –∞—В–µ—А–Њ–≥–µ–љ–µ–Ј–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –і–∞–ї—М–љ–µ–є—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.
–Ю–ґ–Є—А–µ–љ–Є–µ –Є –і—А—Г–≥–Є–µ –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞
–Ъ–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–є –Ї–Њ–љ—В–Є–љ—Г—Г–Љ —В—Г—З–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –љ–∞—З–Є–љ–∞–µ—В—Б—П —Б –њ—А–Є—Б–Њ–µ–і–Є–љ–µ–љ–Є—П –Ї –Њ–ґ–Є—А–µ–љ–Є—О –і—А—Г–≥–Є—Е –§–†, –Ї–Њ—В–Њ—А—Л–µ —Г—Б–Ї–Њ—А—П—О—В «–і–≤–Є–ґ–µ–љ–Є–µ» —Н—В–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –Ї —А–∞–Ј–≤–Є—В–Є—О —Б–µ—А—М–µ–Ј–љ–Њ–є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є.
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –∞—В–µ—А–Њ–≥–µ–љ–љ–∞—П –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є—П (–Ф–Ы–Я) —Г –ї–Є—Ж —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Ь–Ґ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –≤ 1,5 —А–∞–Ј–∞ —З–∞—Й–µ, —З–µ–Љ —Г –ї–Є—Ж —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Ь–Ґ [48]. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –Ь–Ґ –љ–∞ –Ї–∞–ґ–і—Л–µ 10% –≤–µ–і–µ—В –Ї –њ–Њ–≤—Л—И–µ–љ–Є—О —Г—А–Њ–≤–љ—П –Њ–±—Й–µ–≥–Њ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ (–Ю–•) –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –љ–∞ 0,3 –Љ–Љ–Њ–ї—М/–ї, —З—В–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Ш–С–° –≤ —В–µ—З–µ–љ–Є–µ 5 –ї–µ—В –љ–∞ 10%.
–Я—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є –њ—А–µ–Њ–±–ї–∞–і–∞–µ—В –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є—П (–У–Ы–Я) IV —В–Є–њ–∞ (—А–µ–і–Ї–Њ – V —В–Є–њ–∞). –Э–∞ —Д–Њ–љ–µ –љ–∞—А–∞—Б—В–∞–љ–Є—П –Ь–Ґ –≤ –Ї—А–Њ–≤–Є –њ–Њ–≤—Л—И–∞–µ—В—Б—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Ґ–У –Є —Б–љ–Є–ґ–∞–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М –•–° –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–Њ–≤ –≤—Л—Б–Њ–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є (–Ы–Я–Т–Я). –Я—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є –њ—А–Њ–Є—Б—Е–Њ–і—П—В –Ј–∞–Љ–µ—В–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–љ—Л—Е —З–∞—Б—В–Є—Ж–∞—Е. –° –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –≤ –Ї—А–Њ–≤–Є —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Љ–µ–ї–Ї–Є—Е, –њ–ї–Њ—В–љ—Л—Е –Є –Њ—Б–Њ–±–µ–љ–љ–Њ –∞—В–µ—А–Њ–≥–µ–љ–љ—Л—Е —З–∞—Б—В–Є—Ж –Ы–Я–Э–Я, –∞ —Б –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –љ–∞—А—Г—И–∞–µ—В—Б—П –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ы–Я–Т–Я –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Б–љ–Є–ґ–µ–љ–Є—П —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–Њ–≤ –Є –∞–њ–Њ–±–µ–ї–Ї–∞ –РI, —З—В–Њ –Ј–∞–Љ–µ–і–ї—П–µ—В –њ—А–Њ—Ж–µ—Б—Б—Л –∞–Ї—Ж–µ–њ—Ж–Є–Є –Є–Ј–±—Л—В–Ї–∞ –•–° –Є–Ј –Ї–ї–µ—В–Њ–Ї –њ–µ—А–Є—Д–µ—А–Є–Є –Є —Б—В–µ–љ–Ї–Є —Б–Њ—Б—Г–і–∞. –Р—В–µ—А–Њ–≥–µ–љ–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П, –≤—Л—П–≤–ї—П–µ–Љ—Л–µ –≤ —Б–Є—Б—В–µ–Љ–µ –њ—А—П–Љ–Њ–≥–Њ –Є –Њ–±—А–∞—В–љ–Њ–≥–Њ —В—А–∞–љ—Б–њ–Њ—А—В–∞ –•–° –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є, –Є–≥—А–∞—О—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ —Г —В—Г—З–љ–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ.
–Р–У –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ 2,9 —А–∞–Ј–∞ —З–∞—Й–µ [49]. –£ 80% –Љ—Г–ґ—З–Є–љ –Є 61% –ґ–µ–љ—Й–Є–љ, –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤–Њ –§—А–∞–Љ–Є–љ–≥–µ–Љ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –Є–Љ–µ–љ–љ–Њ –љ–∞—А–∞—Б—В–∞–љ–Є–µ –Ь–Ґ –±—Л–ї–Њ –њ—А–Є—З–Є–љ–Њ–є —А–∞–Ј–≤–Є—В–Є—П –Р–У. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –Ь–Ґ –љ–∞ 5% –≤ —В–µ—З–µ–љ–Є–µ 4 –ї–µ—В –њ–Њ–≤—Л—И–∞–ї–Њ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –њ–Њ—П–≤–ї–µ–љ–Є—П –Р–У –љ–∞ 30%. –†–∞–Ј–≤–Є—В–Є–µ –Р–У –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є –љ–∞–њ—А—П–Љ—Г—О —Б–≤—П–Ј–∞–љ–Њ —Б –≥–Є–њ–µ—А–≤–Њ–ї–µ–Љ–Є–µ–є, –Ј–∞–і–µ—А–ґ–Ї–Њ–є –љ–∞—В—А–Є—П, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П, –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (–°–Э–°) –Є —А–µ–љ–Є–љ-–∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ-–∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (–†–Р–Р–°), –≥–Є–њ–µ—А–њ—А–Њ–і—Г–Ї—Ж–Є–µ–є –ї–µ–њ—В–Є–љ–∞ –Є –≥–Є–њ–µ—А–Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є–µ–є, –≤–µ–і—Г—Й–µ–є –Ї –Ш–†. –Э–µ–і–∞–≤–љ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Р–У, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–∞—П –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, —Б–Њ–Њ—В–љ–Њ—Б–Є—В—Б—П —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞. –Я—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є —Б–Њ–Ј–і–∞—О—В—Б—П –≤—Б–µ —Г—Б–ї–Њ–≤–Є—П –і–ї—П —А–∞–Ј–≤–Є—В–Є—П –≠–Ф, —З—В–Њ –љ–∞—А—Г—И–∞–µ—В –±–∞–ї–∞–љ—Б –Љ–µ–ґ–і—Г –Є–Ј–≤–µ—Б—В–љ—Л–Љ –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—В–Њ—А–Њ–Љ –Њ–Ї—Б–Є–і–Њ–Љ –∞–Ј–Њ—В–∞ –Є –Љ–Њ—Й–љ—Л–Љ –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–Њ–Љ —Н–љ–і–Њ—В–µ–ї–Є–љ–Њ–Љ-1.
–Я–Њ—В–µ–љ—Ж–Є—А–Њ–≤–∞–љ–Є–µ –љ–µ–≥–∞—В–Є–≤–љ—Л—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–є –Њ–ґ–Є—А–µ–љ–Є—П –Є –Р–У –Ј–∞–Љ–µ—В–љ–Њ –љ–∞—А—Г—И–∞–µ—В —Б—В—А—Г–Ї—В—Г—А—Г –Є —Д—Г–љ–Ї—Ж–Є—О —Б–µ—А–і—Ж–∞: —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М –њ—А–µ–і- –Є –њ–Њ—Б—В–љ–∞–≥—А—Г–Ј–Ї–Є –љ–∞ —Б–µ—А–і—Ж–µ, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г –ї–Є—Ж —Б –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ—Л–Љ —Б—В–∞–ґ–µ–Љ (>15 –ї–µ—В) –Њ–ґ–Є—А–µ–љ–Є—П; –≤–Њ–Ј—А–∞—Б—В–∞–µ—В —А–Є—Б–Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Б–Љ–µ—И–∞–љ–љ–Њ–є —Д–Њ—А–Љ—Л –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–У–Ы–Ц).
–Э–∞—А–∞—Б—В–∞–љ–Є–µ –Ь–Ґ —Б–Њ–њ—А—П–ґ–µ–љ–Њ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Њ–±—К–µ–Љ–∞ —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–µ–є –Ї—А–Њ–≤–Є –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –њ—А–µ–і–љ–∞–≥—А—Г–Ј–Ї–Є –љ–∞ –Ы–Ц. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –љ–∞–≥—А—Г–Ј–Ї–Є –і–∞–≤–ї–µ–љ–Є–µ–Љ –љ–∞ —Б–µ—А–і—Ж–µ. –Я—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–Њ —А–Њ—Б—В—Г –Ь–Ґ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —Б–µ—А–і–µ—З–љ—Л–є –≤—Л–±—А–Њ—Б. –Я—А–Є —В–∞–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П—Е –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є –Љ–Њ–ґ–љ–Њ –Њ–ґ–Є–і–∞—В—М —А–Њ—Б—В–∞ –Љ–∞—Б—Б—Л –Љ–Є–Њ–Ї–∞—А–і–∞. –Т–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –У–Ы–Ц –≤–Њ–Ј—А–∞—Б—В–∞–µ—В —Б 5,5% —Г –ї–Є—Ж —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Ь–Ґ –і–Њ 29,9% – —Г –ї–Є—Ж —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ. –Я—А–Є—Б–Њ–µ–і–Є–љ–µ–љ–Є–µ –Ї –Њ–ґ–Є—А–µ–љ–Є—О –Р–У –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –У–Ы–Ц –±–Њ–ї–µ–µ —З–µ–Љ –≤ 4 —А–∞–Ј–∞.
–Т —З–µ–Љ –Њ–њ–∞—Б–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –У–Ы–Ц? –°–µ–≥–Њ–і–љ—П –У–Ы–Ц —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї –Њ–і–Є–љ –Є–Ј —Д–∞–Ї—В–Њ—А–Њ–≤ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ –°–°–†, –≤–µ–і—Г—Й–µ–≥–Њ –Ї —А–∞–Ј–≤–Є—В–Є—О —В–∞–Ї–Є—Е –≥—А–Њ–Ј–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і—Ж–∞, –Ї–∞–Ї —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М (–•–°–Э), –љ–∞—А—Г—И–µ–љ–Є–µ —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞ –Є –≤–љ–µ–Ј–∞–њ–љ–∞—П —Б–µ—А–і–µ—З–љ–∞—П —Б–Љ–µ—А—В—М. –Я–Њ –і–∞–љ–љ—Л–Љ –Ъ–Њ—А–љ–µ–ї—М—Б–Ї–Њ–≥–Њ –Є –§—А–∞–Љ–Є–љ–≥–µ–Љ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Є –У–Ы–Ц —А–Є—Б–Ї –°–°–Ю –њ–Њ–≤—Л—И–∞–ї—Б—П –≤ 2–4 —А–∞–Ј–∞ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –≤–Њ–Ј—А–∞—Б—В–∞, –њ–Њ–ї–∞ –Є –і—А—Г–≥–Є—Е –§–† [50, 51]. –Я—П—В–Є–ї–µ—В–љ—П—П –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –њ—А–Є –Р–У, —Б–Њ—З–µ—В–∞—О—Й–µ–є—Б—П —Б –У–Ы–Ц, —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ —Г –Љ—Г–ґ—З–Є–љ 35%, —Г –ґ–µ–љ—Й–Є–љ – 20%, —Г –њ–Њ–ґ–Є–ї—Л—Е – 50% [50, 51].
–Ы—О–±–Њ–є –њ–∞—Ж–Є–µ–љ—В, —Б—В—А–∞–і–∞—О—Й–Є–є –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Ь–Ґ –Є–ї–Є –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, –љ—Г–ґ–і–∞–µ—В—Б—П –≤ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–Љ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –≤–µ–ї–Є—З–Є–љ—Л –°–°–† –і–ї—П –≤—Л—А–∞–±–Њ—В–Ї–Є —Б—В—А–∞—В–µ–≥–Є–Є –µ–≥–Њ –≤–µ–і–µ–љ–Є—П. –° —Г—З–µ—В–Њ–Љ —А–∞—Б—И–Є—А–µ–љ–Є—П –љ–∞—И–Є—Е –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–є –Њ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Њ–ґ–Є—А–µ–љ–Є—П –Є –µ–≥–Њ –≤–Ї–ї–∞–і–∞ –≤ —А–∞–Ј–≤–Є—В–Є–µ –°–°–Ч –њ—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –≤–µ–ї–Є—З–Є–љ—Л –°–°–† —Б–ї–µ–і—Г–µ—В —Г—З–Є—В—Л–≤–∞—В—М –љ–µ —В–Њ–ї—М–Ї–Њ —Е–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є (–љ–∞–њ—А–Є–Љ–µ—А, —Г—А–Њ–≤–µ–љ—М –•–°, –Р–Ф, –Ї—Г—А–µ–љ–Є–µ, –њ–Њ–ї –њ–Њ —И–Ї–∞–ї–µ SCORE), –љ–Њ –Є –љ–Њ–≤—Л–µ –Љ–∞—А–Ї–µ—А—Л (—А–Є—Б. 2).
–Ю–ґ–Є—А–µ–љ–Є–µ, –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј –Є –Ш–С–°
–Ю–ґ–Є—А–µ–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ –Љ–Њ–і–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ –§–† —А–∞–Ј–≤–Є—В–Є—П –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –љ–Є–Љ: –Ш–С–°, –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —В–Є–њ–∞. –Ш —Н—В–Њ —Б–ї–µ–і—Г—О—Й–Є–є —Н—В–∞–њ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –Ї–Њ–љ—В–Є–љ—Г—Г–Љ–∞ –±–Њ–ї—М–љ–Њ–≥–Њ —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ.
–Я–∞—В–Њ–≥–µ–љ–µ–Ј –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–є —Б–Њ–±–Њ–є –Ї–ї–∞—Б—В–µ—А –ї–Є–њ–Є–і–љ—Л—Е, –њ—А–Њ—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е, –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е, –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е, –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е, –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Є –∞–љ—В—А–Њ–њ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤, –∞ —В–∞–Ї–ґ–µ —Д–∞–Ї—В–Њ—А–Њ–≤ –≤–љ–µ—И–љ–µ–є —Б—А–µ–і—Л (–љ–∞–њ—А–Є–Љ–µ—А, –Љ–∞–ї–Њ–њ–Њ–і–≤–Є–ґ–љ—Л–є –Њ–±—А–∞–Ј –ґ–Є–Ј–љ–Є).
–Ъ –љ–∞–Є–±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л–Љ —Д–∞–Ї—В–Њ—А–∞–Љ, –Є–љ–Є—Ж–Є–Є—А—Г—О—Й–Є–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є, –Њ—В–љ–Њ—Б—П—В: –Є–Ј–±—Л—В–Њ–Ї –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–≥–Њ –Є —Н–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ –ґ–Є—А–∞, –Є–љ–і–µ–Ї—Б —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є (–Ш–†), –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –∞–і–Є–њ–Њ–љ–µ–Ї—В–Є–љ–∞, –њ–Њ–≤—Л—И–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –∞–і–Є–њ–Њ–Ї–Є–љ–Њ–≤ –Є —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤, –≥–Є–њ–µ—А–Ї–Њ–∞–≥—Г–ї—П—Ж–Є—О, –Р–У, –≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є—О, –і–µ—Д–µ–Ї—В –Љ–µ–ґ–њ—А–µ–і—Б–µ—А–і–љ–Њ–є –њ–µ—А–µ–≥–Њ—А–Њ–і–Ї–Є (–Ф–Ы–Я). –Ю–ґ–Є—А–µ–љ–Є–µ –њ—А–Њ–≤–Њ—Ж–Є—А—Г–µ—В –њ–Њ—П–≤–ї–µ–љ–Є–µ –≠–Ф, –Ї–Њ—В–Њ—А–∞—П –≤–љ–Њ—Б–Є—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–є –≤–Ї–ї–∞–і –≤ —А–∞–Ј–≤–Є—В–Є–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ –љ–∞ —А–∞–љ–љ–µ–є —Б—В–∞–і–Є–Є –µ–≥–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П.
–Ю–ґ–Є—А–µ–љ–Є–µ (–Њ—Б–Њ–±–µ–љ–љ–Њ –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–µ) — –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–є –Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г–µ–Љ—Л–є –§–† —А–∞–Ј–≤–Є—В–Є—П –Ш–С–°. –Ґ–∞–Ї, —А–Є—Б–Ї –Ш–С–° –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Nurses` Health Study, –≤ –Ї–Њ—В–Њ—А–Њ–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л –Љ–µ–і—Б–µ—Б—В—А—Л, —Г–≤–µ–ї–Є—З–Є–≤–∞–ї—Б—П –≤ 2 —А–∞–Ј–∞ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞ –Є –≤ 3 —А–∞–Ј–∞ — –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є [52]. –†–µ–Ј—Г–ї—М—В–∞—В—Л –њ–∞—В–Њ–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б –∞–љ–∞–ї–Є–Ј–Њ–Љ 1260 —Б–ї—Г—З–∞–µ–≤ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –Ї–Њ—А–Њ–љ–∞—А–љ—Л–є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј —Г –ї–Є—Ж —Б —В–Њ–ї—Й–Є–љ–Њ–є –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є —Б–Ї–ї–∞–і–Ї–Є –±–Њ–ї–µ–µ 3 —Б–Љ –≤—Б—В—А–µ—З–∞–ї—Б—П –≤ 2 —А–∞–Ј–∞ —З–∞—Й–µ, —З–µ–Љ —Г —В–µ—Е, —Г –Ї–Њ–≥–Њ —Н—В–∞ —Б–Ї–ї–∞–і–Ї–∞ –±—Л–ї–∞ –Љ–µ–љ—М—И–µ [53].
–Я—А–Є–±–∞–≤–Ї–∞ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –љ–∞ 5–8 –Ї–≥ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–∞—Б—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ш–Ь –Є —Б–Љ–µ—А—В–Є –Њ—В –Ш–С–° –љ–∞ 25%. –Ъ–Њ—А–Њ–љ–∞—А–љ–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤ 2 —А–∞–Ј–∞ –њ—А–Є –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є –Ш–Ь–Ґ ≧27 –Ї–≥/–Љ2 –Є –≤ 4,5 —А–∞–Ј–∞ – –њ—А–Є –Ш–Ь–Ґ ≧30 –Ї–≥/–Љ2. –Т–Ї–ї–∞–і –Њ–ґ–Є—А–µ–љ–Є—П (–њ–Њ –≤–µ–ї–Є—З–Є–љ–µ –Ш–Ь–Ґ) –≤ —Б—В—А—Г–Ї—В—Г—А—Г —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Њ—В –Ш–С–° —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е –Љ—Г–ґ—З–Є–љ — 14,9%, –∞ —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е –ґ–µ–љ—Й–Є–љ — 47,7%.
–†–∞–Ј–≤–Є—В–Є—О —В—А–Њ–Љ–±–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –љ–∞ —Д–Њ–љ–µ –Ш–С–°, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є—П —Ж–µ–ї–Њ–≥–Њ —А—П–і–∞ —В—А–Њ–Љ–±–Њ–≥–µ–љ–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤: –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Д–Є–±—А–Є–љ–Њ–≥–µ–љ–∞ –Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є VII —Д–∞–Ї—В–Њ—А–∞; —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Ш–Ґ–Р–Я-1 –Є –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–љ–Њ—Б—В—М —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤. –†–∞–Ј–≤–Є—В–Є–µ –Ш–Ь —Г –±–Њ–ї—М–љ—Л—Е —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –≤–љ–Њ—Б–Є—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–є –≤–Ї–ї–∞–і –≤ –њ—А–Њ—Ж–µ—Б—Б—Л —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–°–Э) –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –і–Њ–ї–ґ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Є —Б–љ–Є–ґ–µ–љ–Є—П –Ь–Ґ.
–Ю–ґ–Є—А–µ–љ–Є–µ –Є –љ–∞—А—Г—И–µ–љ–Є—П —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞
–•–∞—А–∞–Ї—В–µ—А–љ—Л–µ –і–ї—П –Њ–ґ–Є—А–µ–љ–Є—П –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –≤–Є–і–µ –≥–Є–њ–µ—А–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —В–Є–њ–∞ —Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є —Б–µ—А–і—Ж–∞ –Љ–Њ–≥—Г—В –Ј–∞–њ—Г—Б–Ї–∞—В—М –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л, –њ—А–Є–≤–Њ–і—П—Й–Є–µ –Ї –і–Є–ї–∞—В–∞—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Ї —А–∞–Ј–≤–Є—В–Є—О –§–Я [54]. –Ю–ґ–Є—А–µ–љ–Є–µ – –Њ–і–Є–љ –Є–Ј –Ј–љ–∞—З–Є–Љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П –§–Я [55]. –Э–∞–ї–Є—З–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ (–У–Ы–Ц) —Г —В—Г—З–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —З–∞—Б—В—Л–Љ —А–∞–Ј–≤–Є—В–Є–µ–Љ –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л—Е —Н–Ї—В–Њ–њ–Є—З–µ—Б–Ї–Є—Е —А–Є—В–Љ–Њ–≤ [54].
–°—А–µ–і–Є –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≠–Ъ–У, –≤—Б—В—А–µ—З–∞—О—Й–Є—Е—Б—П –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є, –≤—Л–і–µ–ї—П—О—В: –њ–Њ–≤—Л—И–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л —Б–µ—А–і–µ—З–љ—Л—Е —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є, —Г–і–ї–Є–љ–µ–љ–љ—Л–є –Є–љ—В–µ—А–≤–∞–ї PR, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –і–Є—Б–њ–µ—А—Б–Є–Є P-–Ј—Г–±—Ж–∞, —Г–і–ї–Є–љ–µ–љ–љ—Л–є –Є–љ—В–µ—А–≤–∞–ї QRS, –≤—Л—Б–Њ–Ї–Є–є –Є–ї–Є –љ–Є–Ј–Ї–Є–є –≤–Њ–ї—М—В–∞–ґ QRS, —Г–і–ї–Є–љ–µ–љ–љ—Л–є –Є–љ—В–µ—А–≤–∞–ї QT, –і–µ–њ—А–µ—Б—Б–Є—О ST –Є –і—А. [56]. –†–∞–Ј–≤–Є–≤–∞—О—Й–Є–µ—Б—П —Г —В—Г—З–љ—Л—Е –±–Њ–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ–≥–Њ —А–Є—В–Љ–∞ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В —А–Є—Б–Ї —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Ю–ґ–Є—А–µ–љ–Є–µ –Є –°–Э
–Ч–∞–Ї–ї—О—З–Є—В–µ–ї—М–љ—Л–є —Н—В–∞–њ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –Ї–Њ–љ—В–Є–љ—Г—Г–Љ–∞ –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ – –њ—А–Є—Б–Њ–µ–і–Є–љ–µ–љ–Є–µ –Ї –Є–Љ–µ—О—Й–Є–Љ—Б—П –њ–∞—В–Њ–ї–Њ–≥–Є—П–Љ (–Ш–С–°, –Р–У) —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –°–Э. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –°–Э – –Њ–і–љ–∞ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –њ—А–Є—З–Є–љ —Б–Љ–µ—А—В–Є —В—Г—З–љ–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ. –Я—А–Є —Н—В–Њ–Љ –љ–µ–ї—М–Ј—П –Є—Б–Ї–ї—О—З–Є—В—М –Є —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ—Л–є –≤–Ї–ї–∞–і –Њ–ґ–Є—А–µ–љ–Є—П –≤ —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–µ—А–і—Ж–∞, –њ—А–Є–≤–Њ–і—П—Й–Є–µ –Ї –љ–∞—А—Г—И–µ–љ–Є—О –µ–≥–Њ —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є —Д—Г–љ–Ї—Ж–Є–є.
–Т –Њ—Б–љ–Њ–≤–µ —В–∞–Ї–Є—Е —Б–µ—А—М–µ–Ј–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, –ї–µ–ґ–∞—В –Ї–∞–Ї –њ–µ—А–≤–Є—З–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –µ–≥–Њ –ґ–Є—А–Њ–≤–Њ–є –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–Є, —В–∞–Ї –Є –≤—В–Њ—А–Є—З–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Њ–±—К–µ–Љ–∞ —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–µ–є –Ї—А–Њ–≤–Є, —Б–µ—А–і–µ—З–љ–Њ–≥–Њ –≤—Л–±—А–Њ—Б–∞ –Є –≥–Є–њ–µ—А–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–µ–є—А–Њ–≥—Г–Љ–Њ—А–∞–ї—М–љ—Л—Е —Б–Є—Б—В–µ–Љ.
–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–є «–њ–∞—А–∞–і–Њ–Ї—Б –Њ–ґ–Є—А–µ–љ–Є—П» –≤ —Б–≤—П–Ј–Є —Б –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–Љ —Д–∞–Ї—В–Њ–Љ –њ–Њ–Ј–Є—В–Є–≤–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –Њ–ґ–Є—А–µ–љ–Є—П –љ–∞ –њ—А–Њ–≥–љ–Њ–Ј –±–Њ–ї—М–љ—Л—Е —Б –°–Э. –Ґ—Г—З–љ—Л–µ –±–Њ–ї—М–љ—Л–µ, —Б—В—А–∞–і–∞—О—Й–Є–µ –°–Э, –Є–Љ–µ–ї–Є –њ–∞—А–∞–і–Њ–Ї—Б–∞–ї—М–љ–Њ –±–Њ–ї–µ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є, —З–µ–Љ –њ–∞—Ж–Є–µ–љ—В—Л —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Ь–Ґ –Є —В–µ–Љ –±–Њ–ї–µ–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б –љ–Є–Ј–Ї–Њ–є –Ь–Ґ (–Ї–∞—Е–µ–Ї—Б–Є–µ–є). –Т –і–∞–љ–љ–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є —А–µ—З—М –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –Є–і–µ—В –Њ–± —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –њ–Њ–і–Ї–Њ–ґ–љ–Њ-–ґ–Є—А–Њ–≤–Њ–є –Ї–ї–µ—В—З–∞—В–Ї–Є.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –Њ—А–ї–Є—Б—В–∞—В–∞ –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є
–Ю—Б–љ–Њ–≤–љ—Л–µ –Ј–∞–і–∞—З–Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Њ–ґ–Є—А–µ–љ–Є—П – —Н—В–Њ –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –љ–µ–њ—А–∞–≤–Є–ї—М–љ–Њ–≥–Њ –Њ–±—А–∞–Ј–∞ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–∞, –Є—Б–њ—А–∞–≤–ї–µ–љ–Є–µ –љ–∞—А—Г—И–µ–љ–љ–Њ–≥–Њ –њ–Є—Й–µ–≤–Њ–≥–Њ —Б—В–µ—А–µ–Њ—В–Є–њ–∞, —Б–љ–Є–ґ–µ–љ–Є–µ –≥–ї–∞–≤–µ–љ—Б—В–≤—Г—О—Й–µ–є —А–Њ–ї–Є –њ–Є—Й–µ–≤–Њ–є –Љ–Њ—В–Є–≤–∞—Ж–Є–Є, –ї–Є–Ї–≤–Є–і–∞—Ж–Є—П –љ–µ–њ—А–∞–≤–Є–ї—М–љ—Л—Е —Б–≤—П–Ј–µ–є –Љ–µ–ґ–і—Г —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ –і–Є—Б–Ї–Њ–Љ—Д–Њ—А—В–Њ–Љ –Є –њ—А–Є–µ–Љ–Њ–Љ –њ–Є—Й–Є.
–Я–µ—А–≤–Є—З–љ–∞—П —Ж–µ–ї—М – —Б–љ–Є–ґ–µ–љ–Є–µ –Ь–Ґ –љ–∞ 10% (5–10 –Ї–≥) –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б., —З—В–Њ —Г–ґ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Њ—В –≤—Б–µ—Е –њ—А–Є—З–Є–љ –љ–∞ 20%, —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є – –љ–∞ 9%, –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є – –љ–∞ 37% –Є —Б–Љ–µ—А—В–Є, —Б–≤—П–Ј–∞–љ–љ–Њ–є —Б –і–Є–∞–±–µ—В–Њ–Љ, –љ–∞ 44% [57].
–Я–∞—Ж–Є–µ–љ—В–∞–Љ —Б –Ш–Ь–Ґ –±–Њ–ї–µ–µ 30 –Ї–≥/–Љ2 –Є–ї–Є —Б –Ш–Ь–Ґ –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ 27,0–29,9 –Ї–≥/–Љ2 —Б –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–Љ–Є –Є–ї–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є (–°–Ф, –Р–У, –Ф–Ы–Я) —Б–ї–µ–і—Г–µ—В –љ–∞–Ј–љ–∞—З–∞—В—М —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О —В–µ—А–∞–њ–Є—О. –≠—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—В—М –Њ–њ—В–Є–Љ–∞–ї—М–љ—Г—О –≤–µ–ї–Є—З–Є–љ—Г –Ь–Ґ –њ–∞—Ж–Є–µ–љ—В–∞ –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є.
–Ы–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞, –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–µ –і–ї—П —Б–љ–Є–ґ–µ–љ–Є—П –Ь–Ґ, –і–Њ—Б—В–Є–≥–∞—О—В —Н—В–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Є –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—В –љ–∞ —А–∞–Ј–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –Є –њ—Г—В–Є. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–љ–Њ–≥–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Б–љ–Є–ґ–∞—О—Й–Є—Е –Ь–Ґ, –±—Л–ї–Њ –љ–µ—Г–і–∞—З–љ—Л–Љ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Є–Ј-–Ј–∞ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –љ–µ–≥–∞—В–Є–≤–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б–Є—Б—В–µ–Љ—Г.
–Ґ–∞–Ї, –њ—А–µ–њ–∞—А–∞—В —А–Є–Љ–Њ–љ–∞–±–∞–љ—В – —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В —Н–љ–і–Њ–Ї–∞–љ–љ–∞–±–Є–љ–Њ–Є–і–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ – –љ–∞ —Д–Њ–љ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –Ь–Ґ –Є —Г–ї—Г—З—И–µ–љ–Є—П –њ—А–Њ—Д–Є–ї—П –Ї–∞—А–і–Є–Њ–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї –њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞, —З—В–Њ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ –Є–Ј—К—П—В–Є—П –µ–≥–Њ —Б —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ —А—Л–љ–Ї–∞ (—А–µ–Ј—Г–ї—М—В–∞—В—Л 4-—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –і–≤–Њ–є–љ—Л—Е —Б–ї–µ–њ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є) [57].
–Э–µ–њ—А–Њ—Б—В–∞—П —Б–Є—В—Г–∞—Ж–Є—П —Б–ї–Њ–ґ–Є–ї–∞—Б—М –≤–Њ–Ї—А—Г–≥ –і—А—Г–≥–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞, —Б–љ–Є–ґ–∞—О—Й–µ–≥–Њ –≤–µ—Б, – —Б–Є–±—Г—В—А–∞–Љ–Є–љ–∞ – –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –Њ–±—А–∞—В–љ–Њ–≥–Њ –Ј–∞—Е–≤–∞—В–∞ —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞ –Є –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ–∞ –њ—А–µ—Б–Є–љ–∞–њ—В–Є—З–µ—Б–Ї–Њ–є –Љ–µ–Љ–±—А–∞–љ–Њ–є. –°–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ —Б–Є–±—Г—В—А–∞–Љ–Є–љ–∞ –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –Є–Љ–µ–љ–љ–Њ –љ–∞ –љ–µ–є—А–Њ–љ–∞–ї—М–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А—Л –≥–Є–њ–Њ—В–∞–ї–∞–Љ—Г—Б–∞. –°–ї–Њ–ґ–љ–Њ—Б—В—М —И–Є—А–Њ–Ї–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–љ–Є–ґ–∞—О—Й–Є—Е –Ь–Ґ —З–µ—А–µ–Ј —Ж–µ–љ—В—А–∞–ї—М–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –Є—Е –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–Љ–Є –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–Љ–Є —П–≤–ї–µ–љ–Є—П–Љ–Є, –Є —Б–Є–±—Г—В—А–∞–Љ–Є–љ –љ–µ —Б—В–∞–ї –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ. –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–µ –∞–≥–µ–љ—В—Б—В–≤–Њ –њ–Њ –ї–µ–Ї–∞—А—Б—В–≤–∞–Љ (EMEA) –∞–љ–љ—Г–ї–Є—А–Њ–≤–∞–ї–Њ —В–Њ—А–≥–Њ–≤—Г—О –ї–Є—Ж–µ–љ–Ј–Є—О –љ–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б–Є–±—Г—В—А–∞–Љ–Є–љ–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—А–µ–і—Б—В–≤–∞, —Б–љ–Є–ґ–∞—О—Й–µ–≥–Њ –Ь–Ґ. –Я–Њ–≤–Њ–і–Њ–Љ –Ї —Н—В–Њ–Љ—Г –њ–Њ—Б–ї—Г–ґ–Є–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П SCOUT (Sibutramin Cardiovascular Outcome), –≤–Ї–ї—О—З–∞–≤—И–µ–≥–Њ 10 744 –њ–∞—Ж–Є–µ–љ—В–∞ [58–60].
–°–µ–≥–Њ–і–љ—П —Б–Є–±—Г—В—А–∞–Љ–Є–љ –∞–±—Б–Њ–ї—О—В–љ–Њ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ –њ—А–Є –Ш–С–°, —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–Є, –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–Љ –Ш–Ь, –Є–љ—Б—Г–ї—М—В–µ –Є–ї–Є —В—А–∞–љ–Ј–Є—В–Њ—А–љ–Њ–є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –∞—В–∞–Ї–µ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–µ, –љ–∞—А—Г—И–µ–љ–Є—П—Е —А–Є—В–Љ–∞, –°–Э, –љ–µ–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–є –Р–У (–∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ (–Р–Ф) –≤—Л—И–µ 145/90 –Љ–Љ —А—В. —Б—В.), —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –°–Э, –њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –Є –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є—П—Е, —В. –µ. –њ—А–Є —В–µ—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е, –Ї–Њ—В–Њ—А—Л–µ —З–∞—Б—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—В —В—Г—З–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –њ—А–µ–њ–∞—А–∞—В –њ–Њ–Љ–Є–Љ–Њ –њ—А–Њ–±–ї–µ–Љ –њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞ –њ—А–Њ–≤–Њ—Ж–Є—А—Г–µ—В –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Р–Ф, —А–Њ—Б—В —З–∞—Б—В–Њ—В—Л —Б–µ—А–і–µ—З–љ—Л—Е —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є –Є –љ–∞—А—Г—И–µ–љ–Є—П —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б–Є–±—Г—В—А–∞–Љ–Є–љ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ –±–Њ–ї—М—И–Є–љ—Б—В–≤—Г –±–Њ–ї—М–љ—Л—Е —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ. –Ґ–µ–Љ –±–Њ–ї–µ–µ, —З—В–Њ, —Б–Њ–≥–ї–∞—Б–љ–Њ –њ–Њ—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О –њ—А–∞–≤–Є—В–µ–ї—М—Б—В–≤–∞ –†–§ –Њ—В 29 –і–µ–Ї–∞–±—А—П 2007 –≥. вДЦ 964, «—Б–Є–±—Г—В—А–∞–Љ–Є–љ, –∞ —В–∞–Ї–ґ–µ –µ–≥–Њ —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –∞–љ–∞–ї–Њ–≥–Є, –Њ–±–ї–∞–і–∞—О—Й–Є–µ —Б—Е–Њ–ґ–Є–Љ –њ—Б–Є—Е–Њ–∞–Ї—В–Є–≤–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ», –Ј–∞—З–Є—Б–ї–µ–љ—Л –≤ —Б–њ–Є—Б–Њ–Ї —Б–Є–ї—М–љ–Њ–і–µ–є—Б—В–≤—Г—О—Й–Є—Е –Є —П–і–Њ–≤–Є—В—Л—Е –≤–µ—Й–µ—Б—В–≤ [61].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –µ–і–Є–љ—Б—В–≤–µ–љ–љ–Њ –і–Њ—Б—В—Г–њ–љ—Л–Љ –Є –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤ –ї–µ—З–µ–љ–Є–Є —И–Є—А–Њ–Ї–Њ–≥–Њ –Ї—А—Г–≥–∞ –±–Њ–ї—М–љ—Л—Е —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, –Њ—Б–Њ–±–µ–љ–љ–Њ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–Љ —Б –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ–Є –§–†, –Є–ї–Є –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є, –Є–ї–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є, —П–≤–ї—П–µ—В—Б—П –њ—А–µ–њ–∞—А–∞—В –Њ—А–ї–Є—Б—В–∞—В 120 –Љ–≥ (–Ъ—Б–µ–љ–Є–Ї–∞–ї, —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–∞—П –Ї–Њ–Љ–њ–∞–љ–Є—П «–§. –•–Њ—Д—Д–Љ–∞–љ–љ – –Ы—П –†–Њ—И –Ы—В–і.», –®–≤–µ–є—Ж–∞—А–Є—П).
–Ю—А–ї–Є—Б—В–∞—В – –њ—А–µ–њ–∞—А–∞—В, –і–µ–є—Б—В–≤—Г—О—Й–Є–є –≤ –њ—А–µ–і–µ–ї–∞—Е –Ц–Ъ–Ґ –±–µ–Ј –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Ж–µ–љ—В—А–∞–ї—М–љ—Г—О –љ–µ—А–≤–љ—Г—О —Б–Є—Б—В–µ–Љ—Г, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Ј–±–µ–ґ–∞—В—М —А–∞–Ј–≤–Є—В–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–∞ –њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –≥–Њ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і—Ж–∞ [62]. –Ю–љ –њ–Њ–і–∞–≤–ї—П–µ—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –ґ–µ–ї—Г–і–Њ—З–љ—Л—Е –Є –њ–∞–љ–Ї—А–µ–∞—В–Є—З–µ—Б–Ї–Є—Е –ї–Є–њ–∞–Ј, —З—В–Њ —В–Њ—А–Љ–Њ–Ј–Є—В –≥–Є–і—А–Њ–ї–Є–Ј –Є –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –Њ–Ї–Њ–ї–Њ 30% –њ–Є—Й–µ–≤–Њ–≥–Њ –ґ–Є—А–∞ –њ—А–Є –њ—А–Є–µ–Љ–µ –њ—А–µ–њ–∞—А–∞—В–∞ 120 –Љ–≥ 3 —А./—Б—Г—В. –Ґ. –Ї. –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –њ–Є—Й–Є —Г—Б–Є–ї–Є–≤–∞–µ—В—Б—П —Б–µ–Ї—А–µ—Ж–Є—П –ї–Є–њ–∞–Ј, –Њ—А–ї–Є—Б—В–∞—В —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Є–љ–Є–Љ–∞—В—М –≤–Њ –≤—А–µ–Љ—П –µ–і—Л –і–ї—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –ґ–Є—А–Њ–≤. –Я–Њ—Б–ї–µ –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞ –µ–≥–Њ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –±—Л—Б—В—А–Њ –њ—А–µ–Ї—А–∞—Й–∞–µ—В—Б—П, –∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–Є–њ–∞–Ј—Л –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П. –Ф–∞–ґ–µ –≤ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј–∞—Е –Њ—А–ї–Є—Б—В–∞—В –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –і—А—Г–≥–Є–µ —Д–µ—А–Љ–µ–љ—В—Л –Ц–Ъ–Ґ (–≤–Ї–ї—О—З–∞—П –∞–Љ–Є–ї–∞–Ј—Г, —В—А–Є–њ—Б–Є–љ, —Е–Є–Љ–Њ—В—А–Є–њ—Б–Є–љ –Є —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і—Л). –Ю—З–µ–љ—М –≤–∞–ґ–љ–Њ, —З—В–Њ –Њ—А–ї–Є—Б—В–∞—В —В–Њ—А–Љ–Њ–Ј–Є—В –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –њ–Є—Й–µ–≤–Њ–≥–Њ –•–° –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —Г–Љ–µ–љ—М—И–µ–љ–Є—П –Ь–Ґ [63].
–Ъ –і–Њ—Б—В–Њ–Є–љ—Б—В–≤–∞–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –Љ–Њ–ґ–љ–Њ –Њ—В–љ–µ—Б—В–Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б–Є—Б—В–µ–Љ–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Њ–љ –љ–µ –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П –≤ –Ї—А–Њ–≤—М (–і–µ–є—Б—В–≤—Г–µ—В –Љ–µ—Б—В–љ–Њ), –љ–µ –љ–∞–Ї–∞–њ–ї–Є–≤–∞–µ—В—Б—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є, –Њ—В–ї–Є—З–∞–µ—В—Б—П –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –љ–µ –Ј–љ–∞—З–Є–Љ—Л–Љ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ–Љ —Б –і—А—Г–≥–Є–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–∞–Љ–Є. –Я–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Њ—А–ї–Є—Б—В–∞—В–∞ —Б–≤—П–Ј–∞–љ—Л —Б –њ–Њ–≥—А–µ—И–љ–Њ—Б—В—М—О –≤ –і–Є–µ—В–µ – —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ–Љ –ґ–Є—А–љ–Њ–є –њ–Є—Й–Є, –∞ –љ–µ —Б —Б–∞–Љ–Є–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –Ї–∞–Ї —В–∞–Ї–Њ–≤—Л–Љ. –Ф–Є—Б–Ї–Њ–Љ—Д–Њ—А—В –љ–∞ —Д–Њ–љ–µ –Њ—А–ї–Є—Б—В–∞—В–∞, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ—А–µ—Е–Њ–і—П—Й–Є–є, –Њ–љ –Њ–±—Л—З–љ–Њ –њ—А–µ–Ї—А–∞—Й–∞–µ—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е –љ–µ–і–µ–ї—М —В–µ—А–∞–њ–Є–Є –њ—А–Є –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–Є –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –ґ–Є—А–∞ –і–Њ 30% –Њ—В –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є —Б—Г—В–Њ—З–љ–Њ–≥–Њ —А–∞—Ж–Є–Њ–љ–∞. –Э–∞–њ—А–Њ—В–Є–≤, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Њ—А–ї–Є—Б—В–∞—В–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞—В—М —Г –њ–∞—Ж–Є–µ–љ—В–∞ –љ–Њ–≤—Л–µ –љ–∞–≤—Л–Ї–Є –њ—А–∞–≤–Є–ї—М–љ–Њ–≥–Њ –њ–Є—Й–µ–≤–Њ–≥–Њ –њ–Њ–≤–µ–і–µ–љ–Є—П –Є –љ–∞—Ж–µ–ї–Є–≤–∞–µ—В –µ–≥–Њ –љ–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Б—В–Є–ї—П —Б–≤–Њ–µ–є –ґ–Є–Ј–љ–Є –Є –њ—А–∞–≤–Є–ї—М–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ.
–Ф–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Ъ—Б–µ–љ–Є–Ї–∞–ї–∞ (–Њ—А–ї–Є—Б—В–∞—В 120 –Љ–≥) –њ–Њ–ї—Г—З–µ–љ—Л –≤ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е (–±–Њ–ї–µ–µ 100 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г 30 —В—Л—Б. –њ–∞—Ж–Є–µ–љ—В–Њ–≤) —А–∞–Ј–ї–Є—З–љ–Њ–є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є (–Њ—В 7 –Љ–µ—Б. –Є –і–Њ 4 –ї–µ—В) [64, 65]. –Ъ—Б–µ–љ–Є–Ї–∞–ї – –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –і–ї—П —Б–љ–Є–ґ–µ–љ–Є—П –≤–µ—Б–∞ —В–µ–ї–∞, –≤–ї–Є—П–љ–Є–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –Є–Ј—Г—З–∞–ї–Њ—Б—М –≤ —В–µ—З–µ–љ–Є–µ 4 –ї–µ—В –µ–≥–Њ –љ–µ–њ—А–µ—А—Л–≤–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞. –Р–љ–∞–ї–Є–Ј –Ї—А—Г–њ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, –≤ —В. —З. —Б–Њ—З–µ—В–∞—О—Й–Є–Љ—Б—П —Б –Ї–∞—А–і–Є–Њ–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є –§–† –Є —Б–Њ—Б—В–Њ—П–љ–Є—П–Љ–Є (n>19 000), – –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –•–•L (Xenical Extra Large), X-PERT (Xenical Prospective Evaluation in Real Practice Treatment) –Є XENDOS (Xenical in the prevention of Diabetes in Obese Subjects), –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –њ—А–Є–µ–Љ –Њ—А–ї–Є—Б—В–∞—В–∞ –≤ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –і–Њ–Ј–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В —Б–љ–Є–ґ–µ–љ–Є–µ –Ь–Ґ –љ–∞ 5% –Є –±–Њ–ї–µ–µ –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —Г 73–87% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –∞ –љ–∞ 10% – —Г 41–56% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [66, 67]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є XENDOS –љ–∞ —Д–Њ–љ–µ 4-–ї–µ—В–љ–µ–≥–Њ –њ—А–Є–µ–Љ–∞ –Њ—А–ї–Є—Б—В–∞—В–∞ —Г–і–∞–ї–Њ—Б—М –і–Њ–±–Є—В—М—Б—П —Б–љ–Є–ґ–µ–љ–Є—П –Ь–Ґ –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 6,9 –Ї–≥, –∞ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є XXL –≤ —В–µ—З–µ–љ–Є–µ 6–9 –Љ–µ—Б. – –љ–∞ 10,8 –Ї–≥ [64, 68, 69].
–Я—А–Є –ї–µ—З–µ–љ–Є–Є –Њ—А–ї–Є—Б—В–∞—В–Њ–Љ –і–ї—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –Ь–Ґ –љ–µ —В—А–µ–±—Г–µ—В—Б—П —А–µ–Ј–Ї–Є—Е –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–є –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є —Б—Г—В–Њ—З–љ–Њ–≥–Њ –њ–Є—Й–µ–≤–Њ–≥–Њ —А–∞—Ж–Є–Њ–љ–∞, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ–Њ—В–µ—А—П –Ь–Ґ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Њ–і–Є–љ–∞–Ї–Њ–≤–∞ –љ–∞ —Д–Њ–љ–µ —А–∞–Ј–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П –Ї–∞–ї–Њ—А–Є–є–љ–Њ—Б—В–Є –њ–Є—Й–Є. –Э–∞–Є–±–Њ–ї–µ–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ь–Ґ –љ–∞ —Д–Њ–љ–µ –Њ—А–ї–Є—Б—В–∞—В–∞ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –≤ –њ–µ—А–≤—Л–µ 3 –Љ–µ—Б. –ї–µ—З–µ–љ–Є—П (—А–Є—Б. 3). –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ–Њ—В–µ—А—П –Ь–Ґ –љ–∞ 5% –Є –±–Њ–ї–µ–µ –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ –Ј–∞ 3 –Љ–µ—Б. – –њ—А–µ–і–Є–Ї—В–Њ—А –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ—Л—Е –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –ї–µ—З–µ–љ–Є—П –Њ–ґ–Є—А–µ–љ–Є—П. –Ґ–µ—А–∞–њ–Є—П –Њ—А–ї–Є—Б—В–∞—В–Њ–Љ —В—Г—З–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —В–∞–Ї–ґ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–Љ–µ–љ—М—И–∞–ї–∞ –Њ–Ї—А—Г–ґ–љ–Њ—Б—В—М —В–∞–ї–Є–Є – –Ї—А–Є—В–µ—А–Є–є –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–≥–Њ –Њ–ґ–Є—А–µ–љ–Є—П – –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 8 —Б–Љ —З–µ—А–µ–Ј 1 –≥–Њ–і [64, 69].
–Ъ—Б–µ–љ–Є–Ї–∞–ї (–Њ—А–ї–Є—Б—В–∞—В 120 –Љ–≥) –Њ–Ї–∞–Ј—Л–≤–∞–ї –Љ–љ–Њ–≥–Њ–≥—А–∞–љ–љ–Њ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —А–∞–Ј–љ—Л–µ —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є–µ –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ –±–Њ–ї—М–љ–Њ–≥–Њ —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ. –Ю–і–љ–Њ –Є–Ј —П–≤–љ—Л—Е –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –Њ—А–ї–Є—Б—В–∞—В–∞ – –µ–≥–Њ –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–µ –њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–µ –Є –њ—А–µ–≤–µ–љ—В–Є–≤–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є XXL, –≤—Л–њ–Њ–ї–љ–µ–љ–љ–Њ–Љ –≤ —А–µ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ, —Е–Њ—А–Њ—И–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Ъ—Б–µ–љ–Є–Ї–∞–ї–∞: —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –∞—В–µ—А–Њ–≥–µ–љ–љ—Л—Е –ї–Є–њ–Є–і–Њ–≤ (–Њ–±—Й–µ–≥–Њ –•–° –Є –Ґ–У) –Є –•–° –Ы–Я–Э–Я –Ї–∞–Ї –њ—А–Є –љ–Њ—А–Љ–Њ–ї–Є–њ–Є–і–µ–Љ–Є–Є, —В–∞–Ї –Є –њ—А–Є –∞—В–µ—А–Њ–≥–µ–љ–љ–Њ–є –Ф–Ы–Я, –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –і–Є–µ—В–Є—З–µ—Б–Ї–Є—Е –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–є –≤ –і–Є–µ—В–µ –Є —Б—В–µ–њ–µ–љ–Є —Б–љ–Є–ґ–µ–љ–Є—П –Ь–Ґ (–і–ї—П –•–° –Ы–Я–Э–Я) (—А–Є—Б. 4) [69]. –Я—А–Є —Н—В–Њ–Љ –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Њ—А–ї–Є—Б—В–∞—В–∞ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ 4 –ї–µ—В –µ–≥–Њ –њ—А–Є–µ–Љ–∞ (–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ XENDOS) [64]. –Ю–±—А–∞—Й–∞–µ—В –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ –Ј–љ–∞—З–Є–Љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ–Њ–≥–Њ –•–° –Ы–Я–Т–Я (–≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 11,1%) –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є XXL.
–Р–љ–∞–ї–Є–Ј —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є XXL, X-PERT –Є XENDOS –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ —В–µ—А–∞–њ–Є—П –Ъ—Б–µ–љ–Є–Ї–∞–ї–Њ–Љ (–Њ—А–ї–Є—Б—В–∞—В 120 –Љ–≥ 3 —А./—Б—Г—В) –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–∞–µ—В —Г—А–Њ–≤–љ–Є –Р–Ф (—А–Є—Б. 5). –Ю—Б–Њ–±–Њ –Ј–∞–Љ–µ—В–љ—Л–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Б—В—А–∞–і–∞—О—Й–Є—Е –Р–У. –Ч–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Њ—А–ї–Є—Б—В–∞—В–∞ –Њ—В —Б—В–µ–њ–µ–љ–Є —Б–љ–Є–ґ–µ–љ–Є—П –Ь–Ґ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г–µ—В –≤–∞–ґ–љ–Њ—Б—В—М –Ї–Њ–љ—В—А–Њ–ї—П –Ь–Ґ –Є –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П –њ–Њ—В—А–µ–±–ї—П–µ–Љ—Л—Е —Б –њ–Є—Й–µ–є –ґ–Є—А–Њ–≤ –і–ї—П –Ї–Њ–љ—В—А–Њ–ї—П –Р–У.
–°–љ–Є–ґ–µ–љ–Є–µ –Ї–∞—А–і–Є–Њ–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ —Г —В—Г—З–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Њ—А–ї–Є—Б—В–∞—В–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ—Г—В–µ–Љ —Г–ї—Г—З—И–µ–љ–Є—П –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ —Г–≥–ї–µ–≤–Њ–і–Њ–≤: —Г–Љ–µ–љ—М—И–µ–љ–Є—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Є–љ—Б—Г–ї–Є–љ–∞ –Є –≥–ї—О–Ї–Њ–Ј—Л –љ–∞—В–Њ—Й–∞–Ї –Є –њ–Њ–≤—Л—И–µ–љ–Є—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —В–Ї–∞–љ–µ–є –Ї –Є–љ—Б—Г–ї–Є–љ—Г, –≤ —В. —З. –њ—А–Є –љ–∞–ї–Є—З–Є–Є –°–Ф (—А–Є—Б. 6). –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є —Н—В–Њ –≤—Л—А–∞–ґ–∞–µ—В—Б—П –≤ —Б–љ–Є–ґ–µ–љ–Є–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –°–Ф –љ–∞ 37% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ —Г –≤—Б–µ—Е –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е, –∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–∞—А—Г—И–µ–љ–љ–Њ–є —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В—М—О –Ї –≥–ї—О–Ї–Њ–Ј–µ – –љ–∞ 45% (—А–Є—Б. 7).
–Я—А–Њ–±–ї–µ–Љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –Ь–Ґ, –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –Р–Ф, –Ї–Њ—А—А–µ–Ї—Ж–Є–Є —Г—А–Њ–≤–љ—П –ї–Є–њ–Є–і–Њ–≤ –Є –≥–ї—О–Ї–Њ–Ј—Л –Ї—А–Њ–≤–Є, –њ—А–Њ—В–µ–Ї—Ж–Є–Є –Њ—А–≥–∞–љ–Њ–≤-–Љ–Є—И–µ–љ–µ–є —Б —Ж–µ–ї—М—О –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –љ–Є–Ј–Ї–Њ–≥–Њ –Ї–∞—А–і–Є–Њ–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ —Г —В—Г—З–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М —Г—Б–њ–µ—И–љ–Њ —А–µ—И–µ–љ–∞ –њ—А–Є –њ—А–∞–≤–Є–ї—М–љ–Њ–Љ –≤—Л–±–Њ—А–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є —Б—В—А–∞—В–µ–≥–Є–Є. –Ф–∞–љ–љ–∞—П —Б—В—А–∞—В–µ–≥–Є—П –і–Њ–ї–ґ–љ–∞ –Њ—Б–љ–Њ–≤—Л–≤–∞—В—М—Б—П –љ–∞ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –љ–µ–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ (–і–Є–µ—В—Л, —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є) –Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ – –Њ—А–ї–Є—Б—В–∞—В–∞, –Ї–Њ—В–Њ—А—Л–є –і–Њ–Ї–∞–Ј–∞–ї —Б–≤–Њ—О —Е–Њ—А–Њ—И—Г—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є.



–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Т–Ю–Ч. –Ю–ґ–Є—А–µ–љ–Є–µ –Є –Є–Ј–±—Л—В–Њ—З–љ—Л–є –≤–µ—Б. –Ш–љ—Д–Њ—А–Љ–∞—Ж–Є–Њ–љ–љ—Л–є –±—О–ї–ї–µ—В–µ–љ—М N1. °311. –Ь–∞—А—В 2013. http://www.who.int/mediacentre/factsheets/fs311/ru/index.html.
2. Frayn K.N. Metabolic regulation. A human perspective. Blackwell Publishing Company 2nd edition. 2003.
3. Fruhbeck G., Gomez-Ambrosi J., Muruzabal F., Burrell M. The adipocyte: a model for integration of endocrine and metabolic signaling in energy metabolism regulation // Am. J. Physiol. Endocrinol. Metab. 2001. Vol. 280, –†.827–847.
4. Iacobellis G., Corradi D., Sharma A.M. Epicardial adipose tissue: anatomic, biomolecular and clinical relationships with the heart // Nat Clin Pract Cardiovasc Med. 2005. Vol. 2. –†. 536–543.
5. Sacks H.S., Fain J.N. Human epicardial adipose tissue: a review // Am Heart J. 2007. Vol. 153. –†. 907–917.
6. Moore K.L., Persaud T.N. The developing human. Clinically oriented embryology. 7th ed. Philadelphia, PA: Saunders 2003. –†. 189.
7. Malavazos A.E., Ermetici F., Cereda E. et al. Epicardial fat thickness: relationship with plasma visfatin and plasminogen activator inhibitor-1 levels in visceral obesity // Nutr Metab Cardiovasc Dis. 2008. Vol. 18 (8). –†. 523–530.
8. Corradi D., Maestri R., Callegari S. et al. The ventricular epicardial fat is related to the myocardial mass in normal, ischemic and hypertrophic hearts // Cardiovasc Pathol. 2004. Vol. 13. –†. 313–316.
9. Baker A.R., Silva N.F., Quinn D.W. et al. Human epicardial adipose tissue expresses a pathogenic profile of adipocytokines in patients with cardiovascular disease // Cardiovasc Diabetol. 2006. Vol. 13. –†. 1.
10. Kremen J., Dolinkova M., Krajickova J. et al. Increased subcutaneous and epicardial adipose tissue production of proinflammatory cytokines in cardiac surgery patients: possible role in postoperative insulin resistance // J Clin Endocrinol Metab. 2006. Vol. 91. –†. 4620–4627.
11. Iacobellis G., Ribaudo M.C., Assael F. et al. Echocardiographic epicardial adipose tissue is related to anthropometric and clinical parameters of metabolic syndrome: a new indicator of cardiovascular risk // J Clin Endocrinol Metab. 2003. Vol. 88. –†. 5163–5168.
12. Chandron M., Phillips S.F., Ciaraidi T., Henry R.R Adiponectin: more than just another fat cell hormone? // Diabetes Care 2003. Vol. 26. –†. 2442–2450.
13. Shuldier A., Yang R., Gong D.-W. Resistin, obesity, and insulin resistance – the emerging role of the adipocyte as an endocrine organ // N. Engl.J.Med. 2001. Vol. 345. –†. 1345–1346.
14. Mazurek T., Zhang L., Zalewski A. et al. Human epicardial adipose tissue is a source of inflammatory mediators // Circulation. 2003. Vol. 108. –†. 2460–2466.
15. Silaghi A., Achard V., Paulmyer-Lacroix O. et al. Expression of adrenomedullin in human epicardial adipose tissue: role of coronary status // Am J Physiol Endocrinol Metab. 2007. Vol. 293. –†. 1443–1450.
16. Iacobellis G., Pistilli D., Gucciardo M. et al. Adiponectin expression in human epicardial adipose tissue in vivo is lower in patients with coronary artery disease // Cytokine. 2005. Vol. 29. –†. 251–255.
17. Kremen J., Dolinkova M., Krajickova J. et al. Increased subcutaneous and epicardial adipose tissue production of proinflammatory cytokines in cardiac surgery patients: possible role in postoperative insulin resistance // J Clin Endocrinol Metab. 2006. Vol. 91. –†. 4620–4627.
18. Iacobellis G., Ribaudo M.C., Zappaterreno A. et al. Relation between epicardial adipose tissue and left ventricular mass // Am J Cardiol. 2004. Vol. 94. –†. 1084–1087.
19. Iacobellis G., Pond C.M., Sharma A.M. Different ‘‘weight’’ of cardiac and general adiposity in predicting left ventricle morphology // Obesity (Silver Spring). 2006. Vol. 14. –†. 1679–1684.
20. Shirani J., Roberts W.C. Clinical, electrocardiographic and morphologic features of massive fatty deposits (“lipomatous hypertrophy”) in the atrial septum // J Am Coll Cardiol. 1993. Vol. 22. –†. 226–238.
21. Shirani J., Berezowski K., Roberts W.C. Quantitative measurement of normal and excessive (coradiposum) subepicardial adipose tissue, its clinical significance, and its effect on electrocardiographic QRS voltage // Am J Cardiol. 1995. Vol. 76. –†. 414–418.
22. Iacobellis G., Gao Y.J., Sharma A.M. Do cardiac and perivascular adipose tissue play a role in atherosclerosis? // Curr Diab Rep. 2008. Vol. 8. –†. 20–24.
23. –І—Г–Љ–∞–Ї–Њ–≤–∞ –У.–Р., –Т–µ—Б–µ–ї–Њ–≤—Б–Ї–∞—П –Э.–У., –У—А–Є—Ж–µ–љ–Ї–Њ –Ю.–Т. –Є –і—А. –≠–њ–Є–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–µ –Њ–ґ–Є—А–µ–љ–Є–µ –Ї–∞–Ї –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–є –Љ–∞—А–Ї–µ—А –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ // –Ъ–∞—А–і–Є–Њ—Б–Њ–Љ–∞—В–Є–Ї–∞. 2012. вДЦ 4. –°. 38–42.
24. Nelson M.R., Mookadam F., Thota V. Epicardial Fat: An Additional Measurement for Subclinical Atherosclerosis and Cardiovascular Risk Stratification // J Am Soc Echocardiogr. 2011. Vol. 24 (3). –†. 339–345.
25. Pracon R., Kruk M., Kepka C. Epicardial Adipose Tissue Radiodensity Is Independently Related to Coronary Atherosclerosis // Circ J. 2011. Vol. 75 (2). –†. 391–397.
26. Reiner L., Mazzoleni A., Rodriguez F.L. Statistical analysis of the epicardial fat weight in human hearts // AMA Arch Pathol. 1955. Vol. 60. –†. 369–373.
27. Eroglu S., Sade L.E., Yildirir A. et al. Epicardial adipose tissue thickness by echocardiography is a marker for the presence and severity of coronary artery disease // Nutr Metab Cardiovasc Dis. 2009. Vol. 19. –†. 211–217.
28. Sade L.E., Eroglu S., Bozbas H. et al. Relation between epicardial fat thickness and coronary flow reserve in women with chest pain and angiographically normal coronary arteries // Atherosclerosis. 2009. Vol. 204. –†. 580–585.
29. Ahn S.G., Lim H.S., Joe D.Y. et al. Relationship of epicardial adipose tissue by echocardiography to coronary artery disease // Heart. 2008. Vol. 94. –†. 7.
30. Iacobellis G., Ribaudo M.C., Assael F. et al. Echocardiographic epicardial adipose tissue is related to anthropometric and clinical parameters of metabolic syndrome: a new indicator of cardiovascular risk // J Clin Endocrinol Metab. 2003. Vol. 88. –†. 5163–5168.
31. Iacobellis G., Singh N., Wharton S., Sharma A.M. Substantial changes in epicardial fat thickness after weight loss in severely obese subjects // Obesity (Silver Spring). 2008. Vol. 16. –†. 1693–1697.
32. Willens H.J., Byers P., Chirinos J.A. et al. Effects of weight loss after bariatric surgery on epicardial fat measured using echocardiography // Am J Cardiol. 2007. Vol. 99. –†. 1242–1245.
33. Kim M.K., Tomita T., Kim M.J. et al. Aerobic exercise training reduces epicardial fat in obese men // J Appl Physiol. 2009. Vol. 106. –†. 5–11.
34. Iacobellis G., Sharma A.M. Epicardial adipose tissue as new cardio-metabolic risk marker and potential therapeutic target in the metabolic syndrome // Curr Pharm Des. 2007. Vol. 13. –†. 2180–2184.
35. Mahabadi A.A., Massaro J.M., Rosito G.A. et al. Association of pericardial fat, intrathoracic fat, and visceral abdominal fat with cardiovascular disease burden: the Framingham Heart Study // Eur Heart J. 2009. Vol. 30. –†. 850–856.
36. Montani J.P., Carroll J.F., Dwyer T.M. et al. Ectopic fat storage in heart, blood vessels and kidneys in the pathogenesis of cardiovascular diseases // Int J Obes Relat Metab Disord. 2004. Vol. 28 (Suppl 4). –†. 58–65.
37. Despres J.P., Lemieux I. Abdominal obesity and metabolic syndrome // Nature. 2006. Vol. 444. –†. 881–887.
38. Jeong J.W., Jeong M.H., Yun K.H. et al. Echocardiographic epicardial fat thickness and coronary artery disease // Circ J. 2007. Vol. 71. –†. 536–539.
39. Taguchi R., Takasu J., Itani Y. et al. Pericardial fat accumulation in men as a risk factor for coronary artery disease // Atherosclerosis. 2001 Vol. 157. –†. 203–209.
40. Ding J., Kritchevsky S.B., Harris T.B. et al. The association of pericardial fat with calcified coronary plaque // Obesity (Silver Spring). 2008. Vol. 16. –†. 1914–1919.
41. Ding J., Hsu F.-C., Harris T.B. et al. The association of pericardial fat with incident coronary heart disease: the Multi-Ethnic Study of Atherosclerosis (MESA) // Am J Clin Nutr. 2009. Vol. 90. –†. 499–504.
42. Rosito G.A., Massaro J.M., Hoffmann U. et al. Pericardial fat, visceral abdominal fat, cardiovascular disease risk factors, and vascular calcification in a community-based sample: the Framingham Heart Study // Circulation. 2008. Vol. 117. –†. 605–613.
43. Thanassoulis G. Massaro J.M., O’Donnell C.J. –µt al. Pericardial Fat is Associated with Prevalent Atrial Fibrillation: The Framingham Heart Study Circ Arrhythm Electrophysiol. 2010 August 1. Vol. 3(4). –†. 345–350.
44. Sawaya S.E., Rajawat Y.S., Rami T.G. –µt al. Downregulation of connexin40 and increased prevalence of atrial arrhythmias in transgenic mice with cardiac-restricted overexpression of tumor necrosis factor // Am J Physiol Heart Circ Physiol. 2007. Vol. 292. –†. 1561–1567.
45. Marcus G.M., Whooley M.A., Glidden D.V. –µt al. Interleukin-6 and atrial fibrillation in patients with coronary artery disease: Data from the Heart and Soul Study // American Heart Journal. 2008. Vol. 155. –†. 303–309.
46. Tselentakis E.V., Woodford E., Chandy J. –µt al. Inflammation Effects on the Electrical Properties of Atrial Tissue and Inducibility of Postoperative Atrial Fibrillation // Journal of Surgical Research. 2006. Vol. 135. –†. 68–75.
47. Scherlag B.J., Po S. The intrinsic cardiac nervous system and atrial fibrillation // Curr Opin Cardiol. 2006. Vol. 21. –†. 51–54.
48. Brown C., Higgins M., Donato K. et al. Body mass index and the prevalence of hypertension and dyslipidemia // Obes.Res. 2000. Vol. 8. –†. 605–619.
49. Vasan R.S., Larson M.G., Leip E.P. et al. Assessment of frequency of progression to hypertension in non-hypertensive participants in the Framingham Heart Study: cohort study // Lancet. 2001. Vol. 358. –†. 1682–1686.
50. Koren M., Richard B., Devereux M. et al. Relation of left ventricular mass and geometry tomorbidity and mortality in uncomplicated essential hypertension // Ann Intern Med. 1991. Vol. 114. –†. 345–352.
51. Levy D., Garrison R., Savage D. et al. Prognostic implications of echocardiographically-determined left ventricular mass in the Framingham Heart Study // N Engl J Med. 1990. Vol. 322. –†. 1561–1566.
52. Willet W., Manson J., Stampfer M. et al. Weight, weight change, and coronary heart disease in women. Risk within the normal weight range // JAMA.1995. Vol. 273. –†. 461–465.
53. Alexander J.K. Obesity and coronary heart disease. In: Alpert M.A., Alexander J.K. eds. The Heart and Lung in Obesity. Armonk, NY // Futura. 1998. –†. 213–238.
54. Messerli F.H., Nunez B.D., Ventura H.O., Snyder D.W. Overweight and sudden death. Increased ventricular ectopy in cardiopathy of obesity // Arch. Intern. Med. 1987. Vol. 147. –†. 1725–1728.
55. Wanahita N., Messerli F.H., Bangalore S. et al. Atrial fibrillation and obesity--results of a meta-analysis // Am Heart J. 2008. Vol. 155. –†. 310–315.
56. Duru M., Seyfeli E., Kuvandik G., et al. Effect of weight loss on P wave dispersion in obese subjects // Obesity (Silver Spring). 2006. Vol. 14. –†. 1378–1382.
57. –≠–ї–µ–Ї—В—А–Њ–љ–љ—Л–є —А–µ—Б—Г—А—Б www.emea.europa.eu Volume 2, Issue 4 November 2008 from MHRA and CHM.
58. W. Philip T. James. Effect of Sibutramine on Cardiovascular Outcomes // N Engl J Med. 2010. –†. 905-917.
59. FDA Memorandum to the File NDA 20-632 –Њ—В 04.10.2010.
60. EMA Outcome of a procedure under Article 107 of Directive 2001/83/EC –Њ—В 06.08.2010.
61. –≠–ї–µ–Ї—В—А–Њ–љ–љ—Л–є —А–µ—Б—Г—А—Б http://www.rg.ru/2008/01/16/veshestva-dok.html –Њ—В 03.08.2012.
62. Hubert H.B., Feinleib M., Mcnamara P.M. et al. Obesity as an independent risk factor for cardiovascular disease: a 26-year follow-up of participant in the Framingham study // Circulation. 1983. Vol. 67. –†. 968–977.
63. Zhi J., Melia A.T., Guerciolini R. et al. Retrospective population-based analysis of the dose-response (fecal fat excretion) relationship of orlistat in normal and obese volunteers // Clin Pharmacol Ther. 1994. Vol. 56. –†. 82–85.
64. Torgerson J.S. et al. Xenical in prevention of diabetes in obese subjects (XENDOS) Study // Diabetes Care. 2004 Jan. Vol. 27 (1). –†. 155–161.
65. –≠–ї–µ–Ї—В—А–Њ–љ–љ—Л–є —А–µ—Б—Г—А—Б http://www.drugs.com/clinical_trials/new-datd-show-xenical-significantly-reduces-cardiovascular-risk-more-than-doubles-weight-loss-702.html last access online 14.11.11.
66. Mittendorfer B., Ostlund R.E. Jr., Patterson B.W., Klein S. Orlistat inhibits dietary cholesterol absorption // Obes Res. 2001. Vol. 9 (10). –†. 599–604.
67. –С—Г—В—А–Њ–≤–∞ –°.–Р. –Ґ–µ—А–∞–њ–Є—П –Њ–ґ–Є—А–µ–љ–Є—П: –≤–ї–Є—П–љ–Є–µ –Ю—А–ї–Є—Б—В–∞—В–∞ (–Ъ—Б–µ–љ–Є–Ї–∞–ї–∞) –љ–∞ –Ї–∞—А–і–Є–Њ–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ // –Ю–ґ–Є—А–µ–љ–Є–µ –Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ. 2008. вДЦ 3 (16). –°. 1–4.
68. Toplak H., Ziegler O., Keller U. et al X-PERT: weight reduction with orlistat in jbese subjects receiving a mildly or moderately reduced-energy diet. Early response to treatment predicts weigt maintenance // Diab Obes Metab. 2005. Vol. 7. –†. 699–706.
69. Wirth A. Reduction of body weight and co-morbidities by orlistat: The XXL – Primary Health Care Trial // Diab Obes Metab. 2005. Vol. 7. –†. 21–27.












