Проблема увеличения числа эффективных лекарственных препаратов, которые должен принимать кардиологический больной для максимального улучшения прогноза, становится актуальной для всех стран мира. Более широкое использование генерических аналогов оригинальных препаратов, так называемых дженериков, считается одним из эффективных подходов к снижению затрат на лечение [1]. Исходная цена дженериков обычно меньше, чем оригинальных препаратов, и цены на такие препараты увеличиваются медленнее по сравнению с оригинальными [2].
Дженерики химически эквивалентны оригинальным препаратам по активному компоненту препарата, но могут различаться по таким характеристикам, как цвет или размер таблеток, инертному связывающему веществу и наполнителям, а также по особенностям технологического процесса изготовления [3]. В соответствии с существующими правилами для подтверждения безопасности и эффективности применения дженериков достаточно установление их биоэквивалентности [4]. Впервые такой порядок одобрения в отношении использования дженериков был закреплен в 1984 г. в США законом Hatch–Waxman Act [5]. Биоэквивалентность может быть установлена на основании оценки максимальной концентрации препарата в крови, времени достижения такой концентрации, а также по площади под кривой, отражающей изменение концентрации в крови в зависимости от времени.
Тем не менее врачи нередко высказывают сомнения, обеспечивает ли биоэквивалентность дженериков и оригинальных препаратов эквивалентность терапевтического эффекта, то есть влияния их применения на определенные физиологические показатели, например, частоту сердечных сокращений, уровень артериального давления, клинически значимые лабораторные показатели и частоту развития некоторых неблагоприятных исходов [6–8]. Высказывается также мнение о том, что применение дженериков может быть менее эффективно и безопасно по сравнению с оригинальными препаратами [9].
В то же время результаты мета–анализа небольших рандомизированных клинических испытаний, в ходе которых сравнивалось влияние оригинальных препаратов и их генерических аналогов на косвенные показатели, в целом не подтвердили гипотезу о различиях в эффективности оригинальных препаратов и дженериков [10]. В частности, в ходе выполнения двух исследований не было отмечено статистически значимых различий в эффективности приема оригинального клопидогрела Плавикса и его генерического аналога [11,12].
В настоящее время длительное применение двойной антиагрегантной терапии показано довольно широкому кругу больных с острым коронарным синдромом (ОКС), как с подъемом сегмента ST, так и в его отсутствие; коронарное стентирование с имплантацией стентов с лекарственным покрытием [13,14]. Применение менее дорогостоящих дженериков клопидогрела представляется одним из возможных подходов к увеличению степени соблюдения предписанного режима терапии. В связи с этим можно полагать обоснованным проведение небольших клинических исследований по сравнительной оценке терапевтической эквивалентности оригинального клопидогрела и его генерических аналогов.
Цель исследования
Сравнить влияние приема оригинального клопидогрела (Плавикс, Sanofi–Winthrop) и генерического аналога клопидогрела Лопирела (Актавис ЛТД MT) на степень подавления агрегации тромбоцитов.
Схема исследования
Проспективное открытое рандомизированное исследование; продолжительность наблюдения – 7 дней.
Материал и методы исследования
В исследование включались мужчины и женщины в возрасте от 18 до 75 лет, госпитализировавшиеся в палату интенсивной терапии отделения неотложной кардиологии для больных инфарктом миокарда НИИ скорой помощи им Н.В. Склифосовского с диагнозом ОКС (с подъемом или без подъема сегмента ST), у которых были показания для выполнения чрескожных вмешательств на коронарных артериях (ЧВКА).
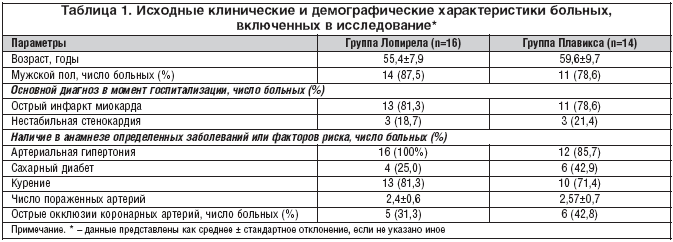
Критерии исключения: противопоказания для выполнения неотложного ЧВКА; выполнение тромболитической терапии на догоспитальном этапе; наличие тяжелых заболеваний печени и почек; противопоказания к применению ацетилсалициловой кислоты и/или клопидогрела; признаки кровотечения. Подробно исходные клинические и демографические характеристики представлены в таблице 1.
Методы статистического анализа. Анализ данных выполняли в зависимости от фактически применявшегося лечения. Полученные результаты представляли в виде среднего ± стандартного отклонения. Сравнение исходных характеристик больных между группами выполняли с помощью критерия χ2. Для сравнения степени подавления агрегации тромбоцитов на фоне приема исследуемых препаратов использовали критерий t Стьюдента для независимых выборок. Статистически значимыми считали различия при p<0,05 для двустороннего критерия. Все виды статистического анализа проводили с помощью пакета программ SPSS Statistics версия 17.0.
Критерии оценки. Основной: различие между группами по степени подавления агрегации тромбоцитов через 6 и 24 ч после приема нагрузочной дозы клопидогрела 600 мг, а также через 7 дней приема клопидогрела по 75 мг/сут. Дополнительный: частота развития таких неблагоприятных исходов, как развитие инфаркта миокарда, тромбоза стентов и любого кровотечения.
Вмешательство. После первичного обследования больных рандомизированно распределяли в группу приема Лопирела и группу приема Плавикса. До выполнения ЧВКА в обеих группах больные принимали исследуемый препарат по 600 мг (нагрузочная доза), а затем продолжали прием в поддерживающей дозе 75 мг 1 раз в сутки. Другие лекарственные препараты применялись в соответствии с современными рекомендациями. Все больные принимали ацетилсалициловую кислоту (нагрузочная доза 125–250 мг на до госпитальном этапе, затем поддерживающая доза 100 мг 1 раз в сутки), гепарин (внутривенно болюсно по 4000 Ед на догоспитальном этапе и в ходе выполнения ЧВКА до 10 000 Ед). Кроме того, больные по показаниям принимали ингибиторы ангиотензинпревращающего фермента, β–блокаторы, антагонисты кальция и статины.
Агрегация тромбоцитов определялась методом светопропускания на аппарате «Биола–220LA» до приема исследуемого препарата, через 6 и 24 ч после приема, а затем через 7 сут после рандомизации. В качестве индуктора агрегации использовался раствор аденозиндифосфата (АДФ) в концентрации 20 мкмоль/л. Забор цельной венозной крови для анализа агрегации тромбоцитов проводили в вакуумные пробирки с цитратом натрия, исследование выполняли в течение 1 часа после забора крови.
Для получения бедной тромбоцитами плазмы кровь центрифугировали в течение 15 мин при скорости вращения 3000 оборотов в минуту. Для получения богатой тромбоцитами плазмы кровь центрифугировали в течение 7 мин при скорости вращения 1000 оборотов в минуту. Светопропускная способность бедной тромбоцитами плазмы принималась за 100%. В богатую тромбоцитами плазму добавлялся индуктор агрегации (раствор АДФ) и проводилась запись изменения светопропускной способности. За конечное значение агрегации принималось значение светопропускной способности плазмы через 5 мин после добавления индуктора (АДФ в концентрации 20 мкмоль/л). Светопропускная способность плазмы до приема исследуемого препарата принималось за 100%. Степень подавления агрегации тромбоцитов рассчитывали по ее изменению в сравнении с исходной в процентах.
Больные считались устойчивыми к действию клопидогрела при снижении агрегации тромбоцитов менее чем на 10% от исходного уровня.
Результаты
В группу Лопирела и группу Плавикса было включено 16 и 14 больных соответственно.
В целом группы были сопоставимы по основным исходным клиническим и демографическим характеристикам (см таблицу 1). В группе Плавикса по сравнению с группой Лопирела было статистически незначимо больше больных сахарным диабетом (42,9 и 25,0% соответственно). В обеих группах все больные принимали исследуемый препарат в точном соответствии с протоколом в течение всего периода наблюдения.
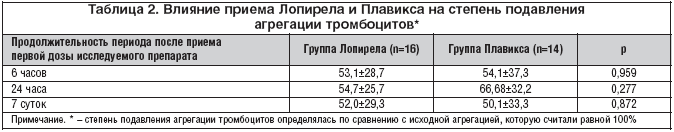
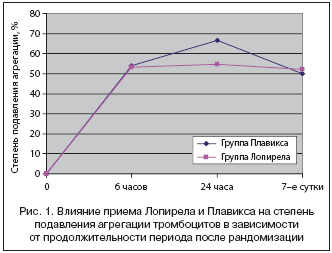
В группе Плавикса и группе Лопирела агрегация тромбоцитов после приема нагрузочной дозы исследуемого препарата (600 мг) через 6 часов в среднем снизилась на 54,1±37,3 и 53,1±28,7% соотв., через 24 ч – на 66,7±32,2 и 54,7±25,7% соответственно, а через 7 суток – на 50,1±33,3 и 52,0±29,3 соответственно. Все различия агрегации тромбоцитов между группами через 6 и 24 ч, а также 7 сут после приема исследуемого препарата не достигали статистической значимости; p>0,05 для всех показателей (табл. 2 и рис. 1).
Устойчивость к действию клопидогрела в каждой группе отмечалась у одного больного. У больного, принимавшего Лопирел, устойчивость к действию исследуемого препарата отмечалась через 24, а у больного, принимавшего Плавикс – через 7 суток после приема первой дозы.
Несмотря на то, что небольшой размер выборки не позволял надежно оценивать клиническую эффективность препаратов, неблагоприятные клинические исходы учитывались, как дополнительные показатели. В ходе наблюдения не отмечено случаев развития инфаркта миокарда и любого кровотечения. В группе Плавикса отмечался один случай развития тромбоза стента на 6–е сутки после выполнения ЧВКА. Тромбоз стента сопровождался подъемом сегмента ST на ЭКГ и повышением концентрации биомаркеров повреждения миокарда. Больному потребовалось экстренное повторное ЧВКА, в ходе которого был восстановлен кровоток в просвете ранее стентированной коронарной артерии. Подавление агрегации тромбоцитов у этого больного через 6 ч, 24 ч и 7 суток после приема исследуемого препарата достигало 24,4; 64,3 и 27,8% соответственно. Такие показатели у этого больного через 6 ч и 7 суток были меньше средней степени подавления агрегации тромбоцитов в соответствующие временные точки по сравнению с таковой у всех участников исследования (в целом степень подавления агрегации тромбоцитов через 6 ч и 7 суток в среднем у всех участников исследования достигала 53,6±32,5 и 51±30,7%, соответственно). Таким образом, хотя формально степень подавления агрегации тромбоцитов у этого больного не соответствовала резистентности к действию клопидогрела, нельзя исключить, что недостаточное подавление агрегации могло повлиять на развитие тромбоза стента. В группе Лопирела клинически значимых исходов не зарегистрировано.
Выводы
Не отмечено статистически значимых различий по степени подавления агрегации тромбоцитов при приеме Плавикса и Лопирела у больных с острым коронарным синдромом, которым выполнялось первичное ЧВКА. Выявленная тенденция к более выраженному подавлению агрегации тромбоцитов через 24 часа после приема Плавикса по сравнению с приемом Лопирела могла быть случайной и не сопровождалась увеличением частоты развития клинически значимых осложнений.
Обсуждение
В ходе небольшого открытого рандомизированного клинического исследования не выявлено статистически значимых различий между приемом оригинального клопидогрела Плавикса и его генерического аналога Лопирела у больных с ОКС, которым выполнялось ЧВКА.
В ходе наблюдения применение Лопирела не сопровождалось развитием неблагоприятных клинических исходов. Следует, однако, отметить, что исследование не обладало достаточной статистической мощностью для оценки частоты развития таких исходов. Оценка роли выявленных в ходе исследования статистически незначимых различий между группой Лопирела и группой Плавикса затруднена, поскольку в целом имеется большая вариабельность действия клопидогрела. Результаты многих исследований позволяют предположить, что вариабельность образования активного метаболита и его недостаточное количество становятся основными причинами вариабельности ответной реакции на клопидогрел и устойчивости к его действию [15]. Вариабельность образования активного метаболита объясняют следующими причинами: 1) вариабельностью или ограниченностью всасывания в кишечнике, которое может зависеть от полиморфизма гена ABCB1 [16,17]; 2) функциональной вариабельностью активности изоферментов Р450 за счет лекарственных взаимодействий и других факторов; 3) полиморфизмом единственного нуклеотида специфических генов, кодирующих изоферменты CYP450 [18,19]. Однако какой бы ни была причина вариабельности, в любом случае она затрудняет как оценку эффективности применения разных режимов терапии клопидогрелом, так и сравнение разных препаратов клопидогрела.
Результаты данного исследования в целом совпадают с данными, полученными в ходе выполнения других исследований по сравнительной оценке эффективности оригинального клопидогрела и его генерических аналогов [11,12] с включением примерно такого же числа участников и со сходной продолжительностью наблюдения. Однако в отличие от данного исследования в ранее выполненные исследования по сравнительной оценке оригинального клопидогрела и его генерического аналога не включались пациенты с ОКС. В то же время очевидно, что оценка эффективности применения клопидогрела особенно важна именно в ранний период применения препарата у пациентов с ОКС, поскольку при длительной терапии вариабельность антиагрегантного действия становится менее выраженной, а клинические последствия недостаточного подавления активности тромбоцитов менее значимыми.
Применение дженериков клопидогрела становится актуальным, учитывая расширение показаний к длительному применению двойной антиагрегантной терапии у достаточно широкого круга широкого больных с ИБС. В такой ситуации применение эффективных дженериков остается единственной возможностью для снижения расходов на лечение больных. Так, результаты обсервационного исследования, выполненного в США, свидетельствовали о том, что в целом более широкое использование дженериков позволит сократить расходы на здравоохранение примерно на 5,9 млрд. долларов, что составляет примерно 11% расходов на лекарственные препараты в этой стране [1].
К ограничениям данного исследования следует отнести небольшое число включенных в него больных и распределение больных в группы без использования слепого метода. Первое из этих ограничений предполагается преодолеть за счет продолжения исследования по сравнительной оценке эффективности применения Лопирела и Плавикса у больных с острым коронарным синдромом с включением большего числа больных. В связи с этим полученные в ходе данного исследования результаты следует рассматривать как предварительные.
Несмотря на то, что формально для использования дженериков в клинической практике не требуется подтверждение их терапевтической эквивалентности, выполнение исследований по сравнительной оценке оригинальных препаратов и их генерических аналогов по влиянию хотя бы на косвенные показатели представляется обоснованным, особенно в случае применения соответствующих препаратов у больных с высоким риском развития неблагоприятного исхода.
Литература
1. Haas J.S., Phillips K.A., Gerstenberger E.P., Seger A.C. Potential Savings from Substituting Generic Drugs for Brand–Name Drugs: Medical Expenditure Panel Survey, 1997–2000. Ann Intern Med 2005;142:891–897.
2. Prescription Drug Trends–A Chartbook Update. Menlo Park, CA: Henry J. Kaiser Family Foundation; 2001.
3. Strom B.L. Generic drug substitution revisited. N Engl J Med 1987;316(23):1456–1462.
4. Nightingale S.L. From the Food and Drug Administration. JAMA. 1998;279:645.
5. 21 CFR §320.1, 2000.
6. Shrank W., Cox E., Fischer M.A., et al. Patient perceptions of generic medications. Health Aff 2009; 28:546–556.
7. Banahan B.F., Bonnarens J.K., Bentley J.P. Generic substitution of NTI drugs. Formulary 1998;33:1082–1096.
8. Gaither C., Kirking D., Ascione F., Welage L. Consumers’ views on generic medications. J Am Pharm Assoc 2001;41:729–736.
9. Saul S., Berenson A. Maker of Lipitor digs in to fight generic rival. New York Times. Nov 3, 2007:A1.
10. Kesselheim A.S., Misono A.S., Lee J.L., et al. Clinical equivalence of generic and brand–name drugs used in cardiovascular disease: a systematic review and meta–analysis. JAMA 2008;300:2514–2526.
11. Ashraf T., Ahmed M., Talpur M.S., et al. Competency profile of locally manufactured clopidogrel Lowplat and foreign manufactured clopidogrel Plavix in patients of suspected ischemic heart disease. J Pak Med Assoc 2005;55:443–448.
12. Rao T.R., Usha P.R., Naidu M.U., et al. Bioequivalence and tolerability study of two brands of clopidogrel tablets, using inhibition of platelet aggregation and pharmacodynamic measures. Curr Ther Res Clin Exp 2003;64:685–696.
13. The Task Force for the Diagnosis and Treatment of Non–ST–Segment Elevation Acute Coronary Syndromes of the European Society of Cardiology. Guidelines for the diagnosis and treatment of non–ST–segment elevation acute coronary syndromes. Eur Heart J 2007:28:1598–1660.
14. The Task Force on the management of ST–segment elevation acute myocardial infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with persistent ST–segment elevation. Eur Heart J 2008;29:2909–2945.
15. Angiolillo D.J., Fernandez–Ortiz A., Bernardo E., et al. High clopidogrel loading dose during coronary stenting: effects on drug response and interindividual variability. Eur Heart J 2004;25:1903–1910.
16. Simon T., Verstuyft C., Mary–Karuse M., et al., on behalf of French Registry of Acute ST–Elevation and Non–ST–Elevation Myocardial Infarction (FAST–MI) Investigators. Genetic determinants of response to clopidogrel and cardiovascular events. N Engl J Med 2009;360:363–375.
17. Collet J.P., Silvain J., Landivier A., et al. Dose effect of clopidogrel reloading in patients already on 75–mg maintenance dose: the Reload with Clopidogrel Before Coronary Angioplasty in Subjects Treated Long Term with Dual Antiplatelet Therapy (RELOAD) study. Circulation 2008;118:1225–1233.
18. Gurbel P.A., Antonino M.J., Tantry U.S. Recent developments in clopidogrel pharmacology and their relation to clinical outcomes. Expert Opin Drug Metab Toxicol 2009;5:989–1004.
19. Marin F., Gonzalez–Conejero R., Capranzano P., et al. Pharmacogenetics in cardiovascular antithrombotic therapy. J Am Coll Cardiol 2009;54:1041–1057.












