Неясно, что имеют в виду авторы под неконтролируемым диабетом, почему при этом статины должны назначаться с осторожностью и в чем эта осторожность должна проявляться. В то же время постоянно подчеркивается, что частота назначений статинов лицам, имеющим показания к их применению, далека от идеальной. При этом применяемые дозы статинов зачастую слишком малы, чтобы обеспечить достижение целевых уровней общего холестерина и холестерина липопротеидов низкой плотности (ЛПНП), рекомендуемых для больных СД 2 типа.
В связи с этим, по мнению большинства экспертов, необходимо всеми средствами способствовать увеличению частоты применения статинов и повышению используемых доз для достижения целевых уровней липидов в крови.
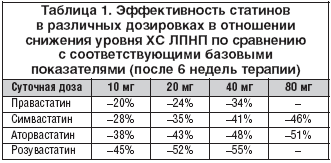
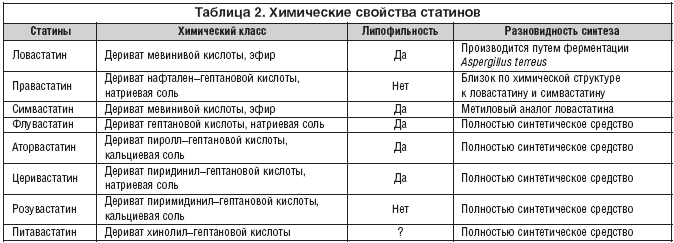
Многолетний клинический опыт применения статинов показал, что степень снижения уровня липидов в крови в значительной мере зависит от дозы применяемого лекарственного средства (табл. 1) и от конкретного типа статина (табл. 2).
В результате применение высоких и максимальных доз статинов стало достаточно популярным средством для достижения целевых уровней липидов в крови, в том числе у больных СД 2 типа.
Доказательства, полученные в результате клинических исследований, создали статинам общепринятую репутацию эффективных и безопасных гиполипидемических препаратов, несмотря на наличие таких побочных эффектов, как повышение уровня печеночных ферментов и явления рабдомиолиза.
Повышенная частота фатального рабдомиолиза, обнаруженная при применении церивастатина по сравнению с другими статинами, продемонстрировала очевидный факт того, что клиническая эффективность и безопасность не одинаковы у различных препаратов, относящихся к классу статинов [Kjekshus J. et al., 2007]. Совсем недавно стало ясно, что для больных СД 2 типа это может иметь особое значение.
Нужно сказать, что аторвастатин наиболее часто упоминается при обсуждении случаев неблагоприятного воздействия статинов на показатели углеводного обмена как у больных СД, так и у лиц, не страдавших ранее этим заболеванием.
Уже экспериментальные данные отметили особое влияние аторвастатина на показатели углеводного обмена [Kanda et al., 2003]. Было обнаружено, что введение аторвастатина в течение 6 мес. крысам с стрептозоцин–индуцированным диабетом значительно ухудшает у них показатели перорального глюкозотолерантного теста. Клинические результаты применения аторвастатина при этом оказались достаточно неоднородными.
В 2003 г., сразу после начала клинического применения аторвастатина, независимые группы японских исследователей описали случаи декомпенсации СД при применении этого препарата [Ninori et al., 2003; Murakami et al., 2003], о 8 подобных клинических случаях сообщалось и позднее [Sasaki et al., 2006]. Был описан также случай СД, который развился после приема аторвастатина [Ohmura C. et al., 2005]. Тогда возникшая гипергликемия была купирована благодаря назначению инсулина и отмене аторвастатина, однако гипергликемия вновь появилась при применении правастатина.
Другая группа японских исследователей оценила 3–месячное влияние применения 10 мг/сут. аторвастатина на показатели углеводного обмена у 76 больных СД 2 типа [Takano et al., 2006]. По данным этих исследователей, у больных, получавших аторвастатин, случайный уровень глюкозы крови возрос с 147±50 до 177±70 мг/дл. Соответственно концентрация HbA1c в крови при приеме аторвастатина изменилась с 6,8±0,9 до 7,2±1,1%. Отмеченное повышение показателей было статистически достоверным.
В исследовании J–CLAS (1999), оценивавшем влияние применения 5–20 мг/сут. аторвастатина на показатели углеводного обмена у 287 больных с уровнем холестерина >220 мг/дл, было отмечено нарастание уровня глюкозы в крови до показателей выше нормы, особенно в первый год проведения терапии. При этом было отмечено также повышение уровня HbA1c в крови.
В 2010 г. были опубликованы данные рандомизированного плацебо–контролируемого исследования, в котором оценивалось влияние 2–месячной терапии аторвастатином в дозах 10, 20, 40 и 80 мг/день на уровень инсулина, глюкозы, гликированного гемоглобина, липопротеинов и апопротеина В в плазме крови по сравнению с плацебо у больных с гиперхолестеринемией [Koh К.К. et al., 2010].
Аторвастатин в дозах 10, 20, 40 и 80 мг значительно снижал уровень холестерина ЛПНП (39, 47, 52 и 56% соответственно) и уровень аполипопротеина В (33, 37, 42 и 46% соответственно) как по сравнению с исходным уровнем (все p<0,001), так и по сравнению с плацебо (p<0,001). При этом аторвастатин в дозах 10, 20, 40 и 80 мг достоверно повышал тощаковый уровень инсулина плазмы (средние изменения: 25, 42, 31 и 45% соответственно) и уровень гликированного гемоглобина (2, 5, 5 и 5% соответственно) по сравнению с исходным уровнем (все p<0,05) или плацебо (p=0,0009 для инсулина и p=0,008 для гликированного гемоглобина). Кроме того, аторвастатин в дозах 10, 20, 40 и 80 мг снижал чувствительность к инсулину (1, 3, 3 и 4% соответственно) по сравнению с исходным уровнем (p=0,312, p=0,008, p<0,001 и p=0,008 соответственно) или с плацебо (p=0,033). Таким образом, несмотря на значительное снижение уровня холестерина ЛПНП и аполипопротеина В, терапия аторвастатином повышала тощаковый уровень инсулина и гликированного гемоглобина на фоне повышения инсулинорезистентности и нарастания случайной гликемии у больных с гиперхолестеринемией.
Было отмечено также, что применение аторвастатина у больных, перенесших трансплантацию почек, может ухудшить их показатели углеводного обмена и способствовать развитию посттрансплантационного СД [Nacasch et al., 2009].
Необходимо отметить, что не все исследователи обнаруживали ухудшение углеводного обмена на фоне применения аторвастатина. Анализируя 11 опубликованных исследований, в которых приведены результаты влияния на глюкозу и HbA1c в крови при применении статинов у больных СД [Sasaki J. et al., 2006], авторы обнаружили относительно разнородные результаты. В 9 из этих исследований был использован аторвастатин, причем в 8 исследованиях – в дозе от 5 до 10 мг/сут. Исследования включали небольшое количество больных – от 14 до 180 человек. Все исследования были достаточно кратковременными, и только одно из них продолжалось в течение 1 года.
Анализируя подобный материал, авторы не смогли отметить существенного влияния аторвастатина на глюкозу и HbA1c в крови. Ряд европейских исследователей также не всегда могли обнаружить статистически значимые сдвиги углеводного обмена при применении аторвастатина. Так, при оценке в течение 3,3 года влияния небольших доз аторвастатина (10 мг/сут.) по сравнению с плацебо на показатели углеводного обмена у 10 305 больных артериальной гипертонией в исследовании The Anglo–Scandinavian Cardiac Outcomes Trial (ASCOT–LLA, 2003) не было отмечено различий в частоте развития СД между группами сравнения. Индекс риска для аторвастатина по сравнению с плацебо составлял 1,15 (95% доверительный интервал (ДИ) – от 0,91 до 1,44).
Применение такой же небольшой суточной дозы аторвастатина в течение 4 лет у больных СД 2 типа также не выявило по сравнению с плацебо какого–либо неблагоприятного воздействия на течение диабета (CARDS, 2004).
Тем не менее в рекомендациях, вкладываемых в упаковки аторвастатина в Японии, упоминается о его неблагоприятном воздействии на толерантность к глюкозе по сравнению с другими статинами [Takano et al., 2006].
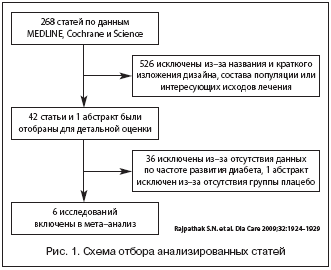
Признание существования подобного рода клинической проблемы привело к проведению специализированных исследований. В 2009 г. рядом американских исследователей был проведен обширный и тщательно систематизированный мета–анализ, посвященный влиянию статинов на показатели углеводного обмена. Он основывался на данных MEDLINE и баз данных Cochrane для рандомизированных клинических исследований, использующих такие ключевые слова, как «сахарный диабет», «статины», «ингибиторы ГМГ–СоА–редуктазы», «правастатин», «аторвастатин», «ловастатин», «симвастатин», «церивастатин», «розувастатин» и «флувастатин». Для повышения чувствительности исследования работы, отвечавшие соответствующим требованиям, были перекрестно проверены с помощью индекса научного цитирования (SCI). Были просмотрены также недавно опубликованные материалы национальных и международных конгрессов, встреч и конференций, проанализированы источники информации в сети Интернет (www.cardiosource.com, www.google.com, www.clinicaltrialresults.org, www.theheart.org, www.tctmd.com). Исследователи также связывались с экспертами в изучаемой области. В случаях обнаружения материалов клинических исследований статинов, в которых отсутствовали данные о развитии диабета, уточняли информацию у авторов. Таким образом, данный мета–анализ включил в себя все рандомизированные плацебо–контролируемые исследования, которые описывали случаи возникновения СД 2 типа при использовании статинов.
Учитывались результаты исследований как первичной, так и вторичной сердечно–сосудистой профилактики, но исключались данные регистров и других нерандомизированных исследований, а также исследований, в которых участвовали лица, ранее страдавшие СД или в которых один статин сравнивался с другим. Кроме того, исключались работы, где одно липидснижающее средство заменялось на другое или добавлялось к статинам. Исследования, анализировавшие влияние статинов на неклинические исходы, в которых данные о СД присутствовали, в анализ не включались, как и исследования, посвященные специализированным некардиоваскулярным популяциям.
Главной целью исследования было выяснение вопроса о частоте вновь развивающегося СД при применении статинов. В связи с тем, что эта формулировка диагноза не была унифицирована, отдельно оговаривались различные интерпретации в каждом трайле. Допускалось использование выражения «вновь развившийся сахарный диабет по данным врача или больного».
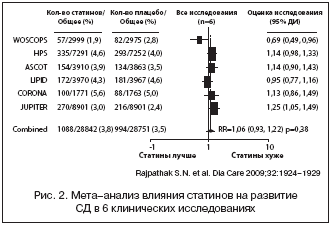
В результате 6 клинических исследований отвечали всем критериям включения (рис. 1). В них участвовало 57 593 рандомизированных пациента (с применением статинов – 28 842 и с применением плацебо – 28 751).
Исследования (WOSCOPS, ASCOT) представляли собой работы, направленные на первичное предотвращение ССО. Остальные три (the Heart Protection Study [HPS], the Long–Term Intervention with Pravastatin in Ischemic Disease [LIPID], the Controlled Rosuvastatin Multinational Study in Heart Failure [CORONA]) исследования были связаны со вторичной профилактикой ССО.
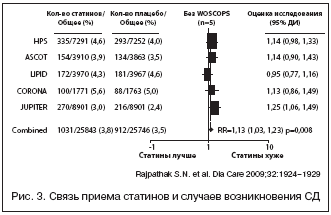
Первичный анализ этих исследований показал, что применение статинов снижает риск развития ССЗ от 8 до 44%. Всего в 6 исследованиях было зафиксировано развитие 2082 случаев СД (рис. 2). В 4 из этих исследований не было обнаружено взаимосвязи между приемом статинов и риском СД, в одном (WOSCOPS) наблюдался статистически значимый протективный эффект статинов в отношении СД (RR 0,70 [95% CI 0,5–0,99]; p=0,042), и в одном (JUPITER) отмечалась значительная положительная связь между приемом статина и развитием СД (1,25 [1,05–1,49]; p=0,01). При совместном анализе всех включенных 6 исследований была обнаружена существенная гетерогенность материала, связанная в первую очередь с результатами WOSCOPS.
В то же время при исключении из анализа данных WOSCOPS оставшиеся исследования продемонстрировали отсутствие достоверной гетерогенности включенного материала и выявили небольшую, но статистически значимую связь нарастания частоты возникновения СД при назначении статинов, независимо от их вида и употребляемой дозы (рис. 3).
В данном мета–анализе было показано, что возраст и пол больных ассоциируются с повышенным риском статин–индуцированного СД, особенно у женщин.
В 2010 г. был опубликован еще один мета–анализ 13 клинических исследований, включавший более 90 000 участников, среди которых было 4275 больных СД 2 типа. 2226 из них в течение 4 лет получали статины, а 2052 – не получали препараты данной группы. Оказалось, что риск развития впервые выявленного СД при получении статинов особенно выражен у больных пожилого возраста. Риск этот был абсолютно реален, но относительно невысок. Так, один дополнительный случай заболевания СД 2 типа за 4 года приема статинов развивался при лечении 255 больных, не страдавших исходно подобной патологией [Sattar, 2010].
Одним из возможных объяснений полученных данных является предположение о том, что наряду с протективным эффектом в отношении ССО статины могут влиять на нормальный обмен углеводов [Sasaki et al., 2006]. При сравнении различных статинов между собой по степени воздействия на показатели углеводного обмена были обнаружены следующие факты. В крупномасштабном рандомизированном контролируемом исследовании Pravastatin or Atorvastatin Evaluation in Myocardial Infarction (PROVE–IT), результаты которого были изложены в 2004 г. на ежегодном съезде Американской ассоциации сердца, было впервые проведено сравнение влияния на показатели гликемического контроля двух статинов: аторвастатина и правастатина. Исследование включало в себя 4162 больных с острым коронарным синдромом, которые были рандомизированы для получения интенсивной липидснижающей терапии в виде 80 мг/сут. аторвастатина или 40 мг/сут. правастатина.
По сравнению с лицами, получавшими правастатин, больные, получавшие аторвастатин, имели более высокий риск увеличения HbA1c >6,0% при исходном HbA1c <6,0% вне зависимости от отсутствия или наличия СД; суммарный риск составлял 1,84 (95% ДИ – 1,52–2,22). Это могло указывать на то, что аторвастатин увеличивает риск нарушений углеводного обмена больше, чем правастатин.
К схожим выводам пришел и ряд других исследователей. Так, сравнивая влияние аторвастатина и правастатина в течение 3–х мес. на показатели глюкозы и HbA1c у 67 больных СД 2 типа, Osaki et al. (2005) обнаружил достоверно более частое повышение указанных показателей у лиц, находящихся на терапии аторвастатином. По сути, аналогичные результаты были получены и в исследовании Takano et al. в 2006 г. Одним из возможных объяснений полученных данных является предположение о том, что степень влияния статинов на показатели углеводного обмена связана с их гидро– и липидофильностью [Sasaki et al., 2006].
Большинство статинов: ловастатин, симвастатин, флувастатин, аторвастатин относятся к группе липофильных, т.е. гидрофобных веществ. Правастатин – это гидрофильный статин; розувастатин (Мертенил, «Гедеон Рихтер») – статин, обладающий очень низкой степенью липофильности, по сути, гидрофильное вещество.
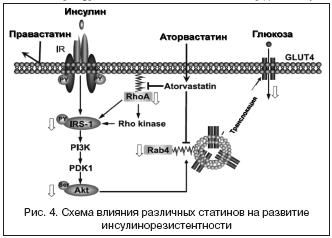
Как липофильные, так и гидрофильные статины могут проникать через внешнюю мембрану гепатоцитов, содержащую специфические транспортеры для них, и подавлять активность ГМГ–СоА–редуктазы, снижая синтез холестерина в печеночных клетках [Ichihara et al., 2002; Yamazaki et al., 1993]. В то же время гидрофильные статины не в состоянии проникать через другие мембраны экстрапеченочных тканей, тогда как липофильные статины могут сделать это достаточно легко. В результате аторвастатин и правастатин одинаково эффективны в снижении концентрации холестерина в крови и по–разному воздействуют на экстрапеченочные ткани (рис. 4). В результате липофильные статины имеют возможность оказывать тормозящее влияние на процессы внутриклеточной передачи сигнала инсулина, приводя к снижению экспрессии ГЛЮТ–4 и дисрегулируя ГЛЮТ–1 в жировой ткани [Takaguri et al., 2008]. Это способствует снижению инсулин–зависимого транспорта глюкозы в клетку и чувствительности к инсулину, что может вызвать возникновение нарушений толерантности к глюкозе.
Возможно также, что инсулинорезистентность, связанная со статинами, может привести к угнетению биосинтеза изопреноида – промежуточного продукта в создании холестерина. Кроме того, статины могут прямо влиять на секрецию инсулина, воздействуя на β–клетку поджелудочной железы путем угнетения глюкозостимулируемого увеличения свободного цитоплазматического кальция и L–каналов для этого иона. Показано, однако, что снижение секреции инсулина происходит в основном при применении высоких доз липофильных, но не гидрофильных статинов по механизму угнетения ГМГ–СоА или цитотоксичности.
Еще одна возможность обострения СД при применении статинов связана с их воздействием на лиц с высоким риском развития диабета. Так, в исследовании «Юпитер» 77% лиц, у которых развился СД под воздействием статинов, ранее имели нарушенную толерантность к глюкозе. Имеется значительное количество наблюдений, выявивших большую подверженность больных СД повреждающему воздействию статинов на углеводный обмен [Sukhija et al., 2009].
Безусловно, статины и СД требуют дальнейших углубленных исследований. Ясно одно: статины достоверно уменьшают ССО СД 2 типа; при их применении необходимо стремиться достигнуть целевых параметров липидемии: холестерин ЛПНП должен быть менее 100 мг/дл, а при наличии ИБС – менее 70 мг/дл. Положительный эффект очевиден, однако обязательно нужно контролировать уровень глюкозы в крови и помнить, что у пожилых людей, женщин и лиц с высоким риском развития СД 2 типа специфическая настороженность при применении статинов крайне необходима.
Желательно использовать гидрофильные статины, например розувастатин (Мертенил). В настоящее время они являются самыми безопасными в отношении возможной дисрегуляции углеводного обмена, особенно при СД. Так, Мертенил обладает хорошим профилем переносимости и безопасности, что позволяет рекомендовать его пациентам с сердечно–сосудистой патологией и СД. Мертенил зарегистрирован в России в дозировках 5, 10, 20 и 40 мг, благодаря чему возможен оптимальный подбор терапии в различных клинических ситуациях.
Парадокс – ситуация, реально существующая, но традиционно воспринимаемая как маловероятная и поэтому лишенная практического значения. К счастью, врачи часто меняют свои взгляды, если это служит пользе больных.
Литература
1. Ohmura C., Watada H., Hirose T., Tanaka Y., Kawamori R. Acute onset and worsening of diabetes concurrent with administration of statins // Endocr J, 2005; 52:369–372.
2. Sabatine M.S., Wiviott S.D., Morrow D.A., McCabe C.H., Canon C.P. High dose atorvastatin associated with worse glycemic control: A PROVE–IT TIMI 22 Substudy // Circulation, 2004; 110(Suppl I):S834.
3. Sever P.S., Dahlof B., Poulter N.R., Wedel H., Beevers G., Caulfield M., Collins R., Kueldsen S.E., Krisinsson A., McInnes G.T., Nieminen M., O`Brien E., Ostergren J. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower–than–average cholesterol concentrations, in the anglo–scandinavial cardiac outcomes trial. Lipid lowering arm (ASCOT–LLA): a multicentre randomized controlled trial // Lancet, 2003; 361: 1149–1158.
4. Colhoun H.M., Betteridge D.J., Durrington P.N., Hitman G.A., neil HAW, Livingstone S.J., Thomason M.J., Mackness M.I., Charlton–Menys V., Fuller J.H. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomized placebo–controlled trial // Lancet, 2004; 364:685–696.
5. Osaki F., Ikeda S., Suehiro T., Ota K., Ui K., Kunon Y., Hashimoto K. Effect of statins on glucose metabolism (in Japanese, with title translated by the authors) // Jpn J Clin Exp Med, 2005; 82:359–363.
6. Takano T., Yamakawa T., Takahashi M., Kimura M., Okamura A. Influences of Statins on Glucose Tolerance in Patients with Type 2 Diabetes Mellitus // J Atheroscler thromb, 2006; 13:95–100.
7. Kanda M., Satoh K., Ichihara K. Effects of Atorvastatin and Pravastatin on Glucose Tolerance in Diabetic Rats Mildly Induced by Streptozotocin // Biol Pharm Bull, 2003; 26:1681–1684.
8. Stalenhoef F.F.H., Ballantyne C.M., Sarti C., Murin J., Tonstad S., Rose H., Wilpshaar W. A COmparative study with rosuvastatin in subjects with METabolic Syndrome: results of the COMETS study // Eur Heart J 2005, 26 (24): 2664–2672.
9. Freeman D.J., Norrie J., Sattar N., Neely R.D.G., Cobbe S.M., Ford I., Isles C., Lorimer A.R., Macfarlane P.W., McKillop J.H., Packard C.J., Shepherd J., Gaw A. Pravastatin and the Development of Diabetes Mellitus. Evidence for a Protective Treatment Effect in the West of Scotland Coronary Prevention Study // Circulation. 2001;103:357–362.
10. Sasaki J., Iwashita M., Kono S., Takahashi M., Kimura M., Okamura A. Statins: beneficial or adverse for glucose metabolism // J Atheroscler Thromb 2006;13:123–129.
11. Rajpathak S.N., Kumbhani D.J., Crandall J., Barzilai N., Alderman M., Ridker P.M. Statin Therapy and Risk of Developing Type 2 Diabetes: A Meta–Analysis // Diabetes Care, 2009, vol. 32, no. 10, 1924–1929.
12. Nacasch N., Korzets Z. Worsening of hyperglycemia due to atorvastatin in renal transplant patients // NDT Plus, 2009, 2: 392–394.
13. Koh K.K., Quon M.J., Han S.H., Lee Y., Kim S.J., Shin E.K. Atorvastatin Causes Insulin Resistance and Increases Ambient Glycemia in Hypercholesterolemic Patients // J Am Coll Cardiol, 2010; 55:1209–1216.
14. Takaguri A., Satoh K., Itagaki M., Tokumitsu Y., Ichihara K. Effects of Atorvastatin and Pravastatin on Signal Transduction related to Glucose Uptake in 3T3L1 Adipocytes // J Pharmacol Sci, 2008, 107, 80–89.












