–Ъ–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є–Љ–Є —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–•–°–Э) —П–≤–ї—П—О—В—Б—П –Њ–і—Л—И–Ї–∞, –Њ—В–µ–Ї–Є, —Г—В–Њ–Љ–ї—П–µ–Љ–Њ—Б—В—М/—Г—Б—В–∞–ї–Њ—Б—В—М. –Ч–∞–і–µ—А–ґ–Ї–∞ –ґ–Є–і–Ї–Њ—Б—В–Є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, –њ–µ—А–µ–≥—А—Г–Ј–Ї–∞ –Њ–±—К–µ–Љ–Њ–Љ –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –Њ—В–µ—З–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Є–≤–Њ–і—П—В –Ї –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –Є –ї–µ—В–∞–ї—М–љ—Л–Љ –Є—Б—Е–Њ–і–∞–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э (—А–Є—Б. 1) [1, 2].
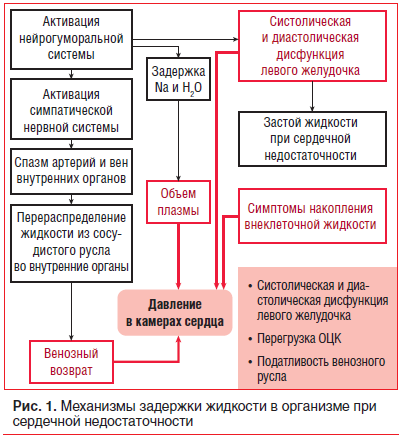
–Ю–і—Л—И–Ї–∞ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ –≤—Л—Б–Њ–Ї–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –≤ –ї–µ–≤–Њ–Љ –ґ–µ–ї—Г–і–Њ—З–Ї–µ (–Ы–Ц), –Ј–∞—Б—В–Њ—П –Ї—А–Њ–≤–Є –≤ –≤–µ–љ–Њ–Ј–љ–Њ–Љ —А—Г—Б–ї–µ –Љ–∞–ї–Њ–≥–Њ –Ї—А—Г–≥–∞ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П, –њ—А–Є–≤–Њ–і—П—Й–µ–≥–Њ –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –≥–∞–Ј–Њ–Њ–±–Љ–µ–љ–∞ –≤ –ї–µ–≥–Ї–Є—Е –Є —А–∞–Ј–і—А–∞–ґ–µ–љ–Є—О –і—Л—Е–∞—В–µ–ї—М–љ–Њ–≥–Њ —Ж–µ–љ—В—А–∞. –Я–Њ—П–≤–ї–µ–љ–Є—О –Њ–і—Л—И–Ї–Є —В–∞–Ї–ґ–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –Є–Ј–±—Л—В–Њ—З–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ґ–Є–і–Ї–Њ—Б—В–Є –≤ —Б–µ—А–Њ–Ј–љ—Л—Е –њ–Њ–ї–Њ—Б—В—П—Е (–±—А—О—И–љ–Њ–є, –њ–ї–µ–≤—А–∞–ї—М–љ–Њ–є), —З—В–Њ –Ј–∞—В—А—Г–і–љ—П–µ—В —Н–Ї—Б–Ї—Г—А—Б–Є—О –ї–µ–≥–Ї–Є—Е. –£ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –±–Њ–ї—М–љ—Л—Е –Њ–і—Л—И–Ї–∞ –Љ–Њ–ґ–µ—В –љ–Њ—Б–Є—В—М –њ—А–Є—Б—В—Г–њ–Њ–Њ–±—А–∞–Ј–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А, –њ–µ—А–µ—Е–Њ–і—П –≤ –њ—А–Є—Б—В—Г–њ —Г–і—Г—И—М—П, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ–Њ –љ–Њ—З–∞–Љ (–њ–∞—А–Њ–Ї—Б–Є–Ј–Љ–∞–ї—М–љ–∞—П –љ–Њ—З–љ–∞—П –Њ–і—Л—И–Ї–∞). –Я—А–Є—З–Є–љ–∞–Љ–Є –µ–µ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —Б–ї—Г–ґ–∞—В –±—Л—Б—В—А–Њ–µ –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Г—Е—Г–і—И–µ–љ–Є–µ —Б–Њ–Ї—А–∞—В–Є—В–µ–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ –Ы–Ц, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ –њ—А–Є—В–Њ–Ї–∞ –Ї—А–Њ–≤–Є –Ї —Б–µ—А–і—Ж—Г –Є –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –Ј–∞—Б—В–Њ–є –≤ –Љ–∞–ї–Њ–Љ –Ї—А—Г–≥–µ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П. –Ю–і—Л—И–Ї–∞ –њ—А–Є –љ–∞–Ї–ї–Њ–љ–µ —В—Г–ї–Њ–≤–Є—Й–∞ –≤–њ–µ—А–µ–і (–±–µ–љ–і–Њ–њ–љ–Њ—Н) –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 30 —Б (–Њ–±—Л—З–љ–Њ –њ—А–Є —Б–љ—П—В–Є–Є –Є–ї–Є –љ–∞–і–µ–≤–∞–љ–Є–Є –Њ–±—Г–≤–Є) —П–≤–ї—П–µ—В—Б—П –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є—П –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ –≤–Њ–Ј–≤—А–∞—В–∞ –Є –љ–∞–њ–Њ–ї–љ–µ–љ–Є—П –ї–µ–≤—Л—Е –Њ—В–і–µ–ї–Њ–≤ —Б–µ—А–і—Ж–∞, –њ—А–∞–≤–Њ–≥–Њ –њ—А–µ–і—Б–µ—А–і–Є—П, –Ј–∞–Ї–ї–Є–љ–Є–≤–∞–љ–Є—П –ї–µ–≥–Њ—З–љ—Л—Е –Ї–∞–њ–Є–ї–ї—П—А–Њ–≤, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г –ї–Є—Ж —Б –Є—Б—Е–Њ–і–љ–Њ –≤—Л—Б–Њ–Ї–Є–Љ –і–∞–≤–ї–µ–љ–Є–µ–Љ –љ–∞–њ–Њ–ї–љ–µ–љ–Є—П –Ї–∞–Љ–µ—А —Б–µ—А–і—Ж–∞ [3, 4].
–Э–∞—А—П–і—Г —Б –Њ–і—Л—И–Ї–Њ–є –љ–µ—А–µ–і–Ї–Њ –±–Њ–ї—М–љ—Л—Е c –•–°–Э –±–µ—Б–њ–Њ–Ї–Њ–Є—В –љ–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ—Л–є –Ї–∞—И–µ–ї—М, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є–є –≤ –≥–Њ—А–Є–Ј–Њ–љ—В–∞–ї—М–љ–Њ–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –≤ –љ–Њ—З–љ–Њ–µ –≤—А–µ–Љ—П –Є–ї–Є –њ–Њ—Б–ї–µ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Є. –Х–≥–Њ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –і–ї–Є—В–µ–ї—М–љ—Л–Љ –Ј–∞—Б—В–Њ–µ–Љ –Ї—А–Њ–≤–Є –≤ –ї–µ–≥–Ї–Є—Е, –Њ—В–µ–Ї–Њ–Љ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –±—А–Њ–љ—Е–Њ–≤ –Є —А–∞–Ј–і—А–∞–ґ–µ–љ–Є–µ–Љ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –Ї–∞—И–ї–µ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Я–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–µ –Њ—В–µ–Ї–Є –љ–∞ —А–∞–љ–љ–Є—Е —Н—В–∞–њ–∞—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –ї–Њ–Ї–∞–ї–Є–Ј—Г—О—В—Б—П –≤ –Њ–±–ї–∞—Б—В–Є —Б—В–Њ–њ, –ї–Њ–і—Л–ґ–µ–Ї –Є –њ–Њ—П–≤–ї—П—О—В—Б—П –≤–Њ –≤—В–Њ—А–Њ–є –њ–Њ–ї–Њ–≤–Є–љ–µ –і–љ—П –њ–Њ—Б–ї–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–µ–±—Л–≤–∞–љ–Є—П –≤ –≤–µ—А—В–Є–Ї–∞–ї—М–љ–Њ–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є, –∞ –њ–Њ –Љ–µ—А–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –•–°–Э —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ—П—О—В—Б—П –љ–∞ –Њ–±–ї–∞—Б—В—М –≥–Њ–ї–µ–љ–µ–є, –±–µ–і–µ—А, –њ–Њ—П—Б–љ–Є—Ж—Л, –Ї—А–µ—Б—В—Ж–∞, —Г–≤–µ–ї–Є—З–Є–≤–∞—П—Б—М –Ї –≤–µ—З–µ—А—Г.
–Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –Њ—В–µ—З–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞
–° —Ж–µ–ї—М—О –Њ–±–ї–µ–≥—З–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є —Б–љ–Є–ґ–µ–љ–Є—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Ј–∞—Б—В–Њ—П –ґ–Є–і–Ї–Њ—Б—В–Є —Б–Њ–≥–ї–∞—Б–љ–Њ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л–Љ –Є –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –љ–∞–Ј–љ–∞—З–∞—В—М –і–Є—Г—А–µ—В–Є–Ї–Є. –≠—В–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ—П—О—В—Б—П –∞–±—Б–Њ–ї—О—В–љ–Њ –љ–∞ –≤—Б–µ –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —Д—А–∞–Ї—Ж–Є–Є –≤—Л–±—А–Њ—Б–∞ –Ы–Ц (–§–Т–Ы–Ц) [1, 5, 6].–Я—А–Є –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є –і–Є—Г—А–µ—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –і–ї—П —Г–≤–µ–ї–Є—З–µ–љ–Є—П –і–Є—Г—А–µ–Ј–∞ –Є –њ—А–µ–Њ–і–Њ–ї–µ–љ–Є—П —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ—Б—В–Є –Ї —В–Є–∞–Ј–Є–і–љ—Л–Љ –Є –њ–µ—В–ї–µ–≤—Л–Љ –і–Є—Г—А–µ—В–Є–Ї–∞–Љ –і–Њ–±–∞–≤–ї—П—О—В –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л –Љ–Є–љ–µ—А–∞–ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (–Р–Ь–Ъ–†), –Ї–Њ—В–Њ—А—Л–µ –љ–∞–Ј–љ–∞—З–∞—О—В –≤ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј–∞—Е (150вАУ300 –Љ–≥/—Б—Г—В) –≤ —В–µ—З–µ–љ–Є–µ 1вАУ3 –љ–µ–і. –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є.
–Т –њ–µ—А–Є–Њ–і –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Р–Ь–Ъ–† –њ—А–Є–Љ–µ–љ—П—О—В –≤ –љ–µ–±–Њ–ї—М—И–Є—Е –і–Њ–Ј–∞—Е (12,5вАУ50,0 –Љ–≥/—Б—Г—В) –≤ –Ї–∞—З–µ—Б—В–≤–µ –љ–µ–є—А–Њ–≥—Г–Љ–Њ—А–∞–ї—М–љ—Л—Е –Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –±–Њ–ї–µ–µ –њ–Њ–ї–љ–Њ –±–ї–Њ–Ї–Є—А—Г—О—В —А–µ–љ–Є–љ-–∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ-–∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤—Г—О —Б–Є—Б—В–µ–Љ—Г (–†–Р–Р–°) –Є —В–µ–Љ —Б–∞–Љ—Л–Љ —Г–ї—Г—З—И–∞—О—В —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –њ—А–Њ–≥–љ–Њ–Ј –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е —Б –•–°–Э [1, 5, 7] (—А–Є—Б. 2).
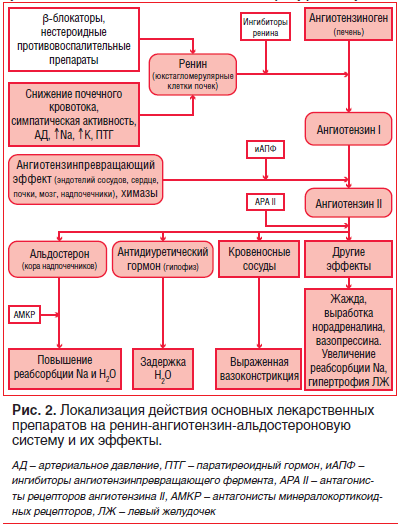
–≠—Д—Д–µ–Ї—В—Л –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞
–Р–ї—М–і–Њ—Б—В–µ—А–Њ–љ —Б–µ–Ї—А–µ—В–Є—А—Г–µ—В—Б—П –≤ –Ї–ї—Г–±–Њ—З–Ї–Њ–≤–Њ–є –Ј–Њ–љ–µ –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤, —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В —А–µ–∞–±—Б–Њ—А–±—Ж–Є—О –љ–∞—В—А–Є—П –Є —Н–Ї—Б–Ї—А–µ—Ж–Є—О –Ї–∞–ї–Є—П –≤ –њ–Њ—З–µ—З–љ—Л—Е –Ї–∞–љ–∞–ї—М—Ж–∞—Е, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ—В–љ–Њ—Б–Є—В—М –µ–≥–Њ –Ї –Љ–Є–љ–µ—А–∞–ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–Љ –≥–Њ—А–Љ–Њ–љ–∞–Љ. –Ч–∞ —Б—З–µ—В —Б–љ–Є–ґ–µ–љ–Є—П –њ–µ—А—Д—Г–Ј–Є–Є –њ–Њ—З–µ–Ї, –њ–Њ–≤—Л—И–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II –Є –∞–і—А–µ–љ–Њ–Ї–Њ—А—В–Є–Ї–Њ—В—А–Њ–њ–љ–Њ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞ —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В—Б—П –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞. –Я—А–Є –•–°–Э —Г—А–Њ–≤–µ–љ—М –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –Љ–Њ–ґ–µ—В –і–Њ—Б—В–Є–≥–∞—В—М 300 –љ–≥/–і–ї, —З—В–Њ –≤ 60 —А–∞–Ј –≤—Л—И–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, –љ–∞–±–ї—О–і–∞–µ–Љ—Л—Е –≤ –љ–Њ—А–Љ–µ (5вАУ15 –љ–≥/–і–ї) [8].
–Р–ї—М–і–Њ—Б—В–µ—А–Њ–љ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –Ј–∞–і–µ—А–ґ–Ї–µ –љ–∞—В—А–Є—П –Є –≤–Њ–і—Л –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, —А–∞–Ј–≤–Є—В–Є—О –≥–Є–њ–µ—А–≤–Њ–ї–µ–Љ–Є–Є –Є –Ј–∞—Б—В–Њ—О –ґ–Є–і–Ї–Њ—Б—В–Є. –Ъ —В–Њ–Љ—Г –ґ–µ –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ —П–≤–ї—П–µ—В—Б—П —Д–∞–Ї—В–Њ—А–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ —Д–Є–±—А–Њ–Ј–∞ вАФ –Њ–і–љ–Њ–≥–Њ –Є–Ј –≤–∞–ґ–љ–µ–є—И–Є—Е —Н–ї–µ–Љ–µ–љ—В–Њ–≤ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П —Б–µ—А–і—Ж–∞ –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –•–°–Э. –≠—Д—Д–µ–Ї—В—Л –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ —А–µ–∞–ї–Є–Ј—Г—О—В—Б—П –Ј–∞ —Б—З–µ—В –Љ–Њ–і—Г–ї—П—Ж–Є–Є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤ –≤ –Ї–ї–µ—В–Ї–µ –њ—А–Є —Б–≤—П–Ј—Л–≤–∞–љ–Є–Є —Б –Љ–Є–љ–µ—А–∞–ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л–Љ–Є –≤ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е –Ї–∞–љ–∞–ї—М—Ж–µ–≤ –њ–Њ—З–µ–Ї –Є –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤, –∞ —В–∞–Ї–ґ–µ –≤ –љ–µ—Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е –≥–Є–њ–њ–Њ–Ї–∞–Љ–њ–∞, —Н–љ–і–Њ—В–µ–ї–Є—П –Є –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е —Б–µ—А–і—Ж–∞. –Т–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ —Б –Љ–Є–љ–µ—А–∞–ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, —Г—Б–Є–ї–µ–љ–Є—О —В—А–Њ–Љ–±–Њ–Ј–∞, —Б–љ–Є–ґ–µ–љ–Є—О —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–∞–µ–љ—Б–∞, –±–∞—А–Њ—А–µ—Ж–µ–њ—В–Њ—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є, –Љ–Є–Њ–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–Љ—Г –Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–Љ—Г —Д–Є–±—А–Њ–Ј—Г [9, 10]. –Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Б—В–Є–Љ—Г–ї—П—Ж–Є—П –Љ–Є–љ–µ—А–∞–ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О —Г—А–Њ–≤–љ—П –Љ–∞—В—А–Є—З–љ–Њ–≥–Њ –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ –Њ—Б—В–µ–Њ–њ–Њ–љ—В–Є–љ–∞, —Г—Б–Є–ї–Є–≤–∞—О—Й–µ–≥–Њ —Д–Є–±—А–Њ–Ј –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї—Г—О –і–Є—Б—Д—Г–љ–Ї—Ж–Є—О –Љ–Є–Њ–Ї–∞—А–і–∞ [11].
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤—Б–µ –±–Њ–ї—М—И–µ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –њ—А–Є–≤–ї–µ–Ї–∞—О—В –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л, –ї–µ–ґ–∞—Й–Є–µ –≤ –Њ—Б–љ–Њ–≤–µ –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–µ–≥–Њ –≤ –Ї—А–Њ–≤–Є –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –ї–Є–њ–Є–і–Њ–≤. –Р–і–Є–њ–Њ–Ј–љ–∞—П —В–Ї–∞–љ—М —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В —Б–µ–Ї—А–µ—Ж–Є—О –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞, –Ї–Њ—В–Њ—А—Л–є, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –Њ–њ–Њ—Б—А–µ–і—Г–µ—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї—Г –∞–і–Є–њ–Њ—Ж–Є—В–Њ–≤, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—П –∞–і–Є–њ–Њ–≥–µ–љ–µ–Ј—Г –Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—О [12]. –Я–Њ–Љ–Є–Љ–Њ —Н—В–Њ–≥–Њ, —Б—Г—Й–µ—Б—В–≤—Г—О—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є–µ –Њ –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–µ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є –≤—Л—Б–Њ–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –љ–∞ —Д—Г–љ–Ї—Ж–Є—О –њ–Њ—З–µ–Ї —Б –і–∞–ї—М–љ–µ–є—И–µ–є –њ—А–Њ—В–µ–Є–љ—Г—А–Є–µ–є [13].
–Э–∞–Ї–∞–њ–ї–Є–≤–∞–µ—В—Б—П –≤—Б–µ –±–Њ–ї—М—И–µ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤ –≤ –њ–Њ–ї—М–Ј—Г —В–Њ–≥–Њ, —З—В–Њ –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ –Љ–Њ–ґ–µ—В –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞—В—М –Є —Г—Б—Г–≥—Г–±–ї—П—В—М –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –Є–љ–≥–Є–±–Є—В–Њ—А—Л –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–њ—А–µ–≤—А–∞—Й–∞—О—Й–µ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ (–Є–Р–Я–§) –Є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II (–Р–†–Р II) —Г–Љ–µ–љ—М—И–∞—О—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ, –њ—А–Є –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –љ–µ—А–µ–і–Ї–Њ –љ–∞–±–ї—О–і–∞–µ—В—Б—П —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–є ¬Ђ—Н—Д—Д–µ–Ї—В —Г—Б–Ї–Њ–ї—М–Ј–∞–љ–Є—П –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞¬ї –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –і–Њ–Ј—Л –Є–Р–Я–§ –Є –Р–†–Р II. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ, —З—В–Њ —Н—В–Њ—В —Д–µ–љ–Њ–Љ–µ–љ –Њ–±—К—П—Б–љ—П–µ—В—Б—П —Б–Є–љ—В–µ–Ј–Њ–Љ –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –љ–µ —В–Њ–ї—М–Ї–Њ –≤ –Ї–ї—Г–±–Њ—З–Ї–Њ–≤–Њ–є –Ј–Њ–љ–µ –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤, –љ–Њ –Є –Ї–ї–µ—В–Ї–∞–Љ–Є —Н–љ–і–Њ—В–µ–ї–Є—П –Є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–∞–Љ–Є, –љ–∞ –Ї–Њ—В–Њ—А—Л–µ –љ–µ –≤–ї–Є—П—О—В —Н—В–Є –≥—А—Г–њ–њ—Л –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Т —Н—В–Њ–є —Б–≤—П–Ј–Є —Б—В–∞–љ–Њ–≤–Є—В—Б—П –≤–њ–Њ–ї–љ–µ –Њ—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞ –±–Њ–ї–µ–µ –њ–Њ–ї–љ–∞—П –±–ї–Њ–Ї–∞–і–∞ –≤—Л—А–∞–±–Њ—В–Ї–Є –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–∞ –і–ї—П —Г–Љ–µ–љ—М—И–µ–љ–Є—П —А–Є—Б–Ї–∞ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Њ—А–≥–∞–љ–Њ–≤-–Љ–Є—И–µ–љ–µ–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Б –•–°–Э.
–≠—Д—Д–µ–Ї—В—Л –Р–Ь–Ъ–†
–Я–Њ –і–∞–љ–љ—Л–Љ –њ–Њ—Б–ї–µ–і–љ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Р–Ь–Ъ–† —Г–Љ–µ–љ—М—И–∞—О—В –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ—Л–є –Є –њ–µ—А–Є–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–є —Д–Є–±—А–Њ–Ј –Љ–Є–Њ–Ї–∞—А–і–∞ –Є –µ–≥–Њ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ, –≥–Є–њ–µ—А—В—А–Њ—Д–Є—О –Ы–Ц, –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ—Л–є —Б—В—А–µ—Б—Б –Є —Г–ї—Г—З—И–∞—О—В —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О. –С–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –Р–Ь–Ъ–† —П–≤–ї—П–µ—В—Б—П –Є —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ —Д–∞—В–∞–ї—М–љ—Л—Е –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л—Е –Є –љ–∞–і–ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞, –≤–Ї–ї—О—З–∞—П —Д–Є–±—А–Є–ї–ї—П—Ж–Є—О –њ—А–µ–і—Б–µ—А–і–Є–є. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ, —Н—В–Њ—В —Н—Д—Д–µ–Ї—В –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –Ї–∞–Ї –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–µ–Љ –≥–Є–њ–Њ–Ї–∞–ї–Є–µ–Љ–Є–Є, —В–∞–Ї –Є –∞–љ—В–Є—Д–Є–±—А–Њ—В–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ [14].–Ь–µ—В–∞–∞–љ–∞–ї–Є–Ј 11 –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ –Њ—Ж–µ–љ–Ї–µ —Н—Д—Д–µ–Ї—В–Њ–≤ –Р–Ь–Ъ–† –љ–∞ —Б—В—А—Г–Ї—В—Г—А—Г –Є —Д—Г–љ–Ї—Ж–Є—О –Ы–Ц —Б —Г—З–∞—Б—В–Є–µ–Љ 942 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э, —Б–Њ—Е—А–∞–љ–µ–љ–љ–Њ–є –§–Т–Ы–Ц –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц –≤—Л—П–≤–Є–ї –Ј–љ–∞—З–Є–Љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є N-—В–µ—А–Љ–Є–љ–∞–ї—М–љ–Њ–≥–Њ –њ—А–Њ–њ–µ–њ—В–Є–і–∞ –Њ–±—Й–µ–≥–Њ –њ—А–Њ–Ї–Њ–ї–ї–∞–≥–µ–љ–∞ —В–Є–њ–∞ III (–і–Є–љ–∞–Љ–Є–Ї–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ -0,90 –≥/–ї, —А<0,001). –Р–љ–∞–ї–Њ–≥–Є—З–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –°-—В–µ—А–Љ–Є–љ–∞–ї—М–љ–Њ–≥–Њ –њ—А–Њ–њ–µ–њ—В–Є–і–∞ –Њ–±—Й–µ–≥–Њ –њ—А–Њ–Ї–Њ–ї–ї–∞–≥–µ–љ–∞ —В–Є–њ–∞ I –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –≤ —Ж–µ–ї–Њ–Љ –њ–Њ –≥—А—Г–њ–њ–µ –≤ –Њ–±–Њ–±—Й–µ–љ–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ (–і–Є–љ–∞–Љ–Є–Ї–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ -17,6 –љ–≥/–Љ–ї, —А=0,01). –°–њ—Г—Б—В—П 6 –Љ–µ—Б. –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П –Р–Ь–Ъ–† –Њ—В–Љ–µ—З–µ–љ–Њ —Г–ї—Г—З—И–µ–љ–Є–µ –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Ы–Ц —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —З—В–Њ –≤—Л—А–∞–ґ–∞–ї–Њ—Б—М –≤ —Б–љ–Є–ґ–µ–љ–Є–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П E/e є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –Ї–Њ–љ—В—А–Њ–ї—П (–і–Є–љ–∞–Љ–Є–Ї–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ -1,68, —А<0,001) [15].
–Т –і—А—Г–≥–Њ–Љ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–µ –±—Л–ї–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ –≤–ї–Є—П–љ–Є–µ –Р–Ь–Ъ–† –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є (–Њ—В–љ–Њ—И–µ–љ–Є–µ —И–∞–љ—Б–Њ–≤ 0,83) –Є —Г–ї—Г—З—И–µ–љ–Є–µ –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Ы–Ц —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э –Є —Б–Њ—Е—А–∞–љ–µ–љ–љ–Њ–є –§–Т–Ы–Ц, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞ [16].
–Ю—Б–љ–Њ–≤–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–Є –Р–Ь–Ъ–† вАФ —Б–њ–Є—А–Њ–љ–Њ–ї–∞–Ї—В–Њ–љ –Є —Н–њ–ї–µ—А–µ–љ–Њ–љ (–Њ—В–љ–Њ—Б—П—В—Б—П –Ї –≥—А—Г–њ–њ–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А—М) –±—Л–ї–Є –Є–Ј—Г—З–µ–љ—Л –≤ –Ї—А—Г–њ–љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е.
–Ф—А—Г–≥–Њ–є –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—М –Р–Ь–Ъ–†, –Ї–∞–ї–Є—П –Ї–∞–љ—А–µ–љ–Њ–∞—В, –≤–≤–Њ–і–Є—В—Б—П –Ї–∞–Ї –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ, —В–∞–Ї –Є —Н–љ—В–µ—А–∞–ї—М–љ–Њ (–≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б—В—А–∞–љ–∞—Е). –Р–љ—В–Є—А–µ–Љ–Њ–і–µ–ї–Є—А—Г—О—Й–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ –Ї–∞–ї–Є—П –Ї–∞–љ—А–µ–љ–Њ–∞—В–∞ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –ї–µ–≥–Ї–Є–Љ —В–µ—З–µ–љ–Є–µ–Љ –•–°–Э –њ–Њ—Б–ї–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–≥–Њ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞, –љ–Њ –≤ –Ї—А—Г–њ–љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Н—В–Њ—В –њ—А–µ–њ–∞—А–∞—В –љ–µ –Є–Ј—Г—З–∞–ї–Є. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –Ї–∞–ї–Є—П –Ї–∞–љ—А–µ–љ–Њ–∞—В, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В —Б–њ–Є—А–Њ–љ–Њ–ї–∞–Ї—В–Њ–љ–∞ –Є —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞, —А–µ–ґ–µ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –њ—А–Є –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е —Б –•–°–Э.
–Я—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—М 3-–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л—Е –Р–Ь–Ъ–† вАФ —Д–Є–љ–µ—А–µ–љ–Њ–љ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є–Ј—Г—З–∞–µ—В—Б—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є FINESSE-HF (Finerenone Trial to Investigate Efficacy and Safety to Eplerenone in Patients with Heart Failure) –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б —Н–њ–ї–µ—А–µ–љ–Њ–љ–Њ–Љ —Г –±–Њ–ї–µ–µ —З–µ–Љ 3600 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э –Є –љ–Є–Ј–Ї–Њ–є –§–Т–Ы–Ц, —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ (–°–Ф) 2 —В–Є–њ–∞ –Є/–Є–ї–Є —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О –њ–Њ—З–µ–Ї [17, 18].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Р–Ь–Ъ–† –Њ—В–љ–µ—Б–µ–љ—Л –Ї –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –љ–∞—А—П–і—Г —Б –Є–Р–Я–§ –Є ќ≤-–∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є (–С–Р–С) –і–ї—П –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –•–°–Э IIвАУIV —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–ї–∞—Б—Б–∞ (–§–Ъ) —Б —Ж–µ–ї—М—О —Б–љ–Є–ґ–µ–љ–Є—П —А–Є—Б–Ї–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –Є –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ (–Ї–ї–∞—Б—Б I, —Б—В–µ–њ–µ–љ—М –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ—Б—В–Є –Р).
–Ь–µ—Б—В–Њ —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Р–Ь–Ъ–† —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ –њ—А–Є –•–°–Э —Б –љ–Є–Ј–Ї–Њ–є –§–Т–Ы–Ц
–Т –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–µ –і–≤–Њ–є–љ–Њ–µ —Б–ї–µ–њ–Њ–µ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ EPHESUS (Epleronone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study) [19], –Ї–Њ—В–Њ—А–Њ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ 674 —Ж–µ–љ—В—А–∞—Е 37 —Б—В—А–∞–љ –Љ–Є—А–∞ —Б —Г—З–∞—Б—В–Є–µ–Љ 6632 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (3319 вАФ –≥—А—Г–њ–њ–∞ –њ—А–Є–µ–Љ–∞ —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞, 3313 вАФ –≥—А—Г–њ–њ–∞ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є), –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞, c –§–Т–Ы–Ц вЙ§40% –Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –Ј–∞—Б—В–Њ—П. –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 64 –≥–Њ–і–∞, 71% вАФ –Љ—Г–ґ—З–Є–љ—Л, —Б—А–µ–і–љ—П—П –§–Т–Ы–Ц 33%, –≤—А–µ–Љ—П –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ —А–∞–Ј–≤–Є—В–Є—П –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ 7,3 –і–љ—П, —Б—А–µ–і–љ–Є–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П –Ј–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є 16 –Љ–µ—Б. (–Њ—В 0 –і–Њ 33 –Љ–µ—Б.).–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–µ –≤–Ї–ї—О—З–∞–ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Г—А–Њ–≤–љ–µ–Љ –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ –±–Њ–ї–µ–µ 2,5 –Љ–≥/–і–ї –Є–ї–Є –Ї–∞–ї–Є—П –±–Њ–ї–µ–µ 5 –Љ–Љ–Њ–ї—М/–ї. –Ъ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞ 3вАУ14-–µ —Б—Г—В –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –і–Њ–±–∞–≤–ї—П–ї–Є —Н–њ–ї–µ—А–µ–љ–Њ–љ –≤ c—А–µ–і–љ–µ–є —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј–µ 43 –Љ–≥. –Т–∞–ґ–љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ —Д–Њ–љ–µ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –≤–Ї–ї—О—З–∞–≤—И–µ–є –Є–Р–Я–§ –Є–ї–Є –Р–†–Р II (87%), –С–Р–С (75%), –і–Є—Г—А–µ—В–Є–Ї–Є (60%) –Є, –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є, —А–µ–њ–µ—А—Д—Г–Ј–Є–Њ–љ–љ—Г—О —В–µ—А–∞–њ–Є—О.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ EPHESUS –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤—Л—Б–Њ–Ї–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Р–Ь–Ъ–† —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц –Є –•–°–Э –њ–Њ—Б–ї–µ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Њ —Б–љ–Є–ґ–µ–љ–Є—О –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 15%, —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 17%, –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є —Б–Љ–µ—А—В–Є –љ–∞ 21%. –С—Л–ї–Њ –і–Њ—Б—В–Є–≥–љ—Г—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —Б—Г–Љ–Љ–∞—А–љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –љ–∞ 13%.
–Т –і–≤–Њ–є–љ–Њ–Љ —Б–ї–µ–њ–Њ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є EMPHASIS-HF [20] III —Д–∞–Ј—Л –њ—А–Є–љ—П–ї–Є —Г—З–∞—Б—В–Є–µ 2737 –±–Њ–ї—М–љ—Л—Е –≤ –≤–Њ–Ј—А–∞—Б—В–µ 55 –ї–µ—В –Є —Б—В–∞—А—И–µ —Б –•–°–Э II –§–Ъ (–њ–Њ NYHA) –Є –§–Т–Ы–Ц –љ–µ –±–Њ–ї–µ–µ 35%. –≠–њ–ї–µ—А–µ–љ–Њ–љ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–ї–Є –≤ –љ–∞—З–∞–ї—М–љ–Њ–є –і–Њ–Ј–µ 25 –Љ–≥/—Б—Г—В (1-—П –≥—А—Г–њ–њ–∞) —Б —В–Є—В—А–∞—Ж–Є–µ–є –і–Њ 50 –Љ–≥/—Б—Г—В —З–µ—А–µ–Ј 4 –љ–µ–і. –љ–∞ —Д–Њ–љ–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Є–Р–Я–§, –Р–†–Р II –Є –С–Р–С –≤ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ–є –і–Њ–Ј–µ. –У—А—Г–њ–њ—Г –Ї–Њ–љ—В—А–Њ–ї—П —Б–Њ—Б—В–∞–≤–Є–ї–Є –±–Њ–ї—М–љ—Л–µ, –њ–Њ–ї—Г—З–∞–≤—И–Є–µ –њ–ї–∞—Ж–µ–±–Њ. –Я—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ—Л–є –∞–љ–∞–ї–Є–Ј —З–µ—А–µ–Ј 21 –Љ–µ—Б. –Њ—В –љ–∞—З–∞–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї –Ј–љ–∞—З–Є–Љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є –Њ—В —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –њ—А–Є—З–Є–љ –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є, —З—В–Њ –њ–Њ—Б–ї—Г–ґ–Є–ї–Њ –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (—В–∞–±–ї. 1).
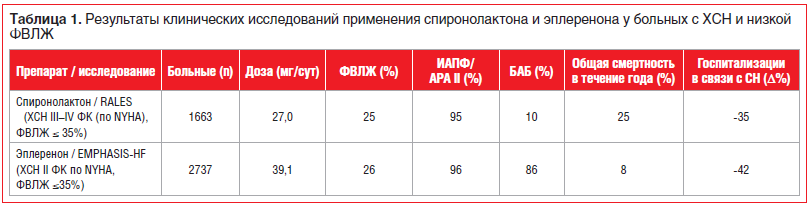
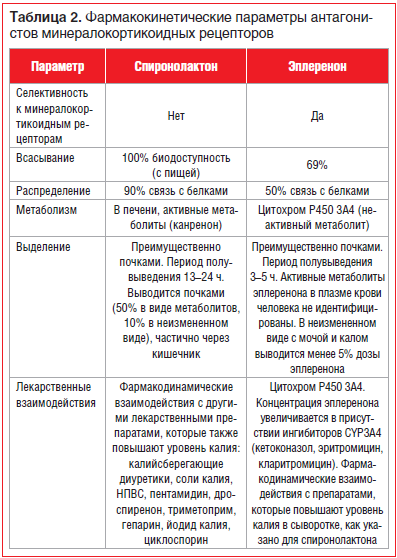
–°–њ–Є—А–Њ–љ–Њ–ї–∞–Ї—В–Њ–љ, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞, —П–≤–ї—П–µ—В—Б—П –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–Љ –Љ–Є–љ–µ—А–∞–ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (–Р–Ь–Ъ–†) –Є –Є–Љ–µ–µ—В –≤—Л—Б–Њ–Ї—Г—О —В—А–Њ–њ–љ–Њ—Б—В—М –Ї –∞–љ–і—А–Њ–≥–µ–љ–љ—Л–Љ –Є –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–Њ–≤—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ, –њ—А–Є–≤–Њ–і—П –Ї —В–∞–Ї–Є–Љ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–Љ —Н—Д—Д–µ–Ї—В–∞–Љ, –Ї–∞–Ї –≥–Є–љ–µ–Ї–Њ–Љ–∞—Б—В–Є—П –Є –Є–Љ–њ–Њ—В–µ–љ—Ж–Є—П —Г –Љ—Г–ґ—З–Є–љ, –∞ —В–∞–Ї–ґ–µ –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞ —Г –ґ–µ–љ—Й–Є–љ. –Ъ –њ—А–Є–Љ–µ—А—Г, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є RALES –≥–Є–љ–µ–Ї–Њ–Љ–∞—Б—В–Є—П —А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї–∞—Б—М —Г 10% –Љ—Г–ґ—З–Є–љ, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е —Б–њ–Є—А–Њ–љ–Њ–ї–∞–Ї—В–Њ–љ.
–°–µ–ї–µ–Ї—В–Є–≤–љ—Л–є –Р–Ь–Ъ–† —Н–њ–ї–µ—А–µ–љ–Њ–љ (–љ–∞–њ—А–Є–Љ–µ—А, –њ—А–µ–њ–∞—А–∞—В –≠—Б–њ–Є—А–Њ) –Є–Љ–µ–µ—В –±–Њ–ї—М—И—Г—О —В—А–Њ–њ–љ–Њ—Б—В—М –Ї –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Њ–≤—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ, –∞ –µ–≥–Њ –∞—Д—Д–Є–љ–љ–Њ—Б—В—М –Ї –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–Њ–≤—Л–Љ –Є –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤—Л–Љ —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ –≤ 100 –Є 1000 —А–∞–Ј –љ–Є–ґ–µ, —З–µ–Љ —Г —Б–њ–Є—А–Њ–љ–Њ–ї–∞–Ї—В–Њ–љ–∞, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Н—В–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ —А–µ–≥–Є—Б—В—А–Є—А—Г—О—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–µ–ґ–µ. –†—П–і –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї –Ї–µ—В–Њ–Ї–Њ–љ–∞–Ј–Њ–ї, —А–Є—В–Њ–љ–∞–≤–Є—А, –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ, —Н—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ, –≤–µ—А–∞–њ–∞–Љ–Є–ї, –і–Є–≥–Њ–Ї—Б–Є–љ, —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ, –∞ —В–∞–Ї–ґ–µ –≥—А–µ–є–њ—Д—А—Г—В–Њ–≤—Л–є —Б–Њ–Ї –Љ–Њ–≥—Г—В —Г–≤–µ–ї–Є—З–Є—В—М –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ –≤ –Ї—А–Њ–≤–Є –Є–Ј-–Ј–∞ –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–µ—А–Љ–µ–љ—В–Њ–≤ CYP3–Р4, —З—В–Њ —Б–ї–µ–і—Г–µ—В —Г—З–Є—В—Л–≤–∞—В—М –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –і–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ (—В–∞–±–ї. 2).
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ–Є —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ–Њ–≥–Њ —Д–Є–±—А–Њ–Ј–∞ –Љ–Є–Њ–Ї–∞—А–і–∞, –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞, —Г–ї—Г—З—И–µ–љ–Є–µ–Љ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є, —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –∞–≥—А–µ–≥–∞—Ж–Є–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј –Є —Б–Є–Љ–њ–∞—В–Њ–∞–і—А–µ–љ–∞–ї–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л. –Т–∞–ґ–љ–Њ –Є–Љ–µ—В—М –≤ –≤–Є–і—Г, —З—В–Њ –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ —Б–≤—П–Ј—Л–≤–∞–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ —Б–Њ —Б–≤–Њ–Є–Љ–Є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –≤ –Љ–Є–Њ–Ї–∞—А–і–µ, –Љ–∞–Ї—А–Њ—Д–∞–≥–∞—Е, –љ–Њ –Є —Б —Д–Є–±—А–Њ–±–ї–∞—Б—В–∞–Љ–Є. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Н—В–Њ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Г—Б–Є–ї–Є–≤–∞—О—В—Б—П —Б–Є–љ—В–µ–Ј –Є –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ —В–Є–њ–∞ III, —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—О –ґ–µ—Б—В–Ї–Њ—Б—В–Є –Љ–Є–Њ–Ї–∞—А–і–∞, —А–∞–Ј–≤–Є—В–Є—О –њ–µ—А–Є–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–≥–Њ –Є –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ–Њ–≥–Њ —Д–Є–±—А–Њ–Ј–∞, —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—О –Љ–Є–Њ–Ї–∞—А–і–∞ –Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ —А—Г—Б–ї–∞. –£—Е—Г–і—И–µ–љ–Є–µ –≤–∞–Ј–Њ–Љ–Њ—В–Њ—А–љ–Њ–≥–Њ —А–µ–Ј–µ—А–≤–∞ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤, –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї –≥–Є–±–µ–ї–Є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤, —Г—Б–Ї–Њ—А—П—П –њ—А–Њ—Ж–µ—Б—Б —Д–Є–±—А–Њ–Ј–∞, –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –Є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є.
–†–∞–љ–љ–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Р–Ь–Ъ–† –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–Њ –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞, —В. –Ї. –Р–Ь–Ъ–† –Њ–±–ї–∞–і–∞—О—В –і–Њ–Ї–∞–Ј–∞–љ–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –Ј–∞–Љ–µ–і–ї—П—В—М —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ –Љ–Є–Њ–Ї–∞—А–і–∞ –Ы–Ц. –Т —Н—В–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ –Є–Ј-–Ј–∞ –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ [21].
–Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ –њ–Њ–±–Њ—З–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ —П–≤–ї—П–µ—В—Б—П –≥–Є–њ–µ—А–Ї–∞–ї–Є–µ–Љ–Є—П. –Я–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П EPHESUS, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц –њ–Њ—Б–ї–µ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞, –њ—А–Є–Љ–µ–љ—П–≤—И–Є—Е —Н–њ–ї–µ—А–µ–љ–Њ–љ, –≥–Є–њ–µ—А–Ї–∞–ї–Є–µ–Љ–Є—П (6 –Љ–Љ–Њ–ї—М/–ї –Є –±–Њ–ї–µ–µ) –≤—Л—П–≤–ї—П–ї–∞—Б—М –≤ 1,6% —Б–ї—Г—З–∞–µ–≤, –њ—А–Є —Н—В–Њ–Љ —З–∞—Б—В–Њ—В–∞ –≥–Є–њ–Њ–Ї–∞–ї–Є–µ–Љ–Є–Є (3,5 –Љ–Љ–Њ–ї—М/–ї –Є –Љ–µ–љ–µ–µ) —Б–љ–Є–Ј–Є–ї–∞—Б—М –љ–∞ 4,9%.
–У–Є–њ–µ—А–Ї–∞–ї–Є–µ–Љ–Є—П —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ –њ–Њ–±–Њ—З–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ —В–µ—А–∞–њ–Є–Є –±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –†–Р–Р–°, –≤–Ї–ї—О—З–∞—П –Р–Ь–Ъ–†. –°—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –≥–Є–њ–µ—А–Ї–∞–ї–Є–µ–Љ–Є–Є —П–≤–ї—П—О—В—Б—П —А–∞—Б—З–µ—В–љ–∞—П —Б–Ї–Њ—А–Њ—Б—В—М –Ї–ї—Г–±–Њ—З–Ї–Њ–≤–Њ–є —Д–Є–ї—М—В—А–∞—Ж–Є–Є (–°–Ъ–§) <45 –Љ–ї/–Љ–Є–љ/1,73–Љ2 –Є/–Є–ї–Є —Г—А–Њ–≤–µ–љ—М –Ї–∞–ї–Є—П >4,5 –Љ–Љ–Њ–ї—М/–ї –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є –і–ї—П –і–∞–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї –і–Њ–Ј—Л –і–Є—Г—А–µ—В–Є–Ї–∞ [22]. –Т —В–∞–Ї–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е –≥–Є–њ–µ—А–Ї–∞–ї–Є–µ–Љ–Є—П –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ —П–≤–ї—П–µ—В—Б—П –љ–µ—А–µ–і–Ї–Є–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ–Љ —В–µ—А–∞–њ–Є–Є –±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є –†–Р–Р–° –Є —З–∞—Б—В–Њ–є –њ—А–Є—З–Є–љ–Њ–є –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –ї–µ—З–µ–љ–Є—П –Є–ї–Є –ґ–µ –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Б—Г–±–Њ–њ—В–Є–Љ–∞–ї—М–љ—Л—Е –і–Њ–Ј –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –°–Є—В—Г–∞—Ж–Є—П –Њ—Б–ї–Њ–ґ–љ—П–µ—В—Б—П —В–µ–Љ, —З—В–Њ –Є–Љ–µ–љ–љ–Њ –±–ї–Њ–Ї–∞—В–Њ—А—Л –†–Р–Р–° –і–Њ–Ї–∞–Ј–∞–ї–Є —Б–≤–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ c–љ–Є–ґ–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є (–≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 15вАУ30%), —З–∞—Б—В–Њ—В—Л –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –Є –љ–∞ –Ј–∞–Љ–µ–і–ї–µ–љ–Є–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –њ–Њ—З–µ—З–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э [23вАУ25].
–Э–µ –≤—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б –•–°–Э –њ—А–Є–љ–Є–Љ–∞—О—В –Є–Р–Я–§/–Р–†–Р II –Є –ї–Є—И—М –Њ–Ї–Њ–ї–Њ 25вАУ45% –Є–Ј –љ–Є—Е –њ—А–Є–љ–Є–Љ–∞—О—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –≤ –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л—Е —Ж–µ–ї–µ–≤—Л—Е –і–Њ–Ј–∞—Е, –∞ 10% –њ—А–µ–Ї—А–∞—Й–∞—О—В –Є—Е –њ—А–Є–µ–Љ. –Я–∞—Ж–Є–µ–љ—В—Л —Б –•–°–Э –Є –љ–Є–Ј–Ї–Њ–є –§–Т–Ы–Ц —В–∞–Ї–ґ–µ –љ–µ –≤ –њ–Њ–ї–љ–Њ–є –Љ–µ—А–µ –њ—А–Є–Љ–µ–љ—П—О—В –Р–Ь–Ъ–†, –∞ –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—О –і–Њ—Б—В–Є–≥–∞–µ—В –ї–Є—И—М 50%. –Я–Њ –і–∞–љ–љ—Л–Љ T. Thorvaldsen et al., –≤ 2012 –≥. –њ—А–Є–љ–Є–Љ–∞–ї–Є –Р–Ь–Ъ–† 52% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В 43% –≤ 2002 –≥. (—А<0,001), –љ–Њ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Г—О —В–µ–љ–і–µ–љ—Ж–Є—О, –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—О –Њ—Б—В–∞–µ—В—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є [26]. –Э–Є–Ј–Ї–∞—П –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—О –Њ–±—К—П—Б–љ—П–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ–Љ –≥–Є–њ–µ—А–Ї–∞–ї–Є–µ–Љ–Є–Є –Є —Б–љ–Є–ґ–µ–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–µ–є –њ–Њ—З–µ–Ї, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–Љ –°–Ф –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О –њ–Њ—З–µ–Ї. –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П EMPHASIS-HF –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –Р–Ь–Ъ–†, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є —Н–њ–ї–µ—А–µ–љ–Њ–љ, —Б–Њ—Е—А–∞–љ—П—О—В —Б–≤–Њ—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Є —Г—А–Њ–≤–љ–µ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –Ї–∞–ї–Є—П –і–Њ 5,5 –Љ–Љ–Њ–ї—М/–ї. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ, –њ–Њ–ї—М–Ј–∞ —В–µ—А–∞–њ–Є–Є —Н–њ–ї–µ—А–µ–љ–Њ–љ–Њ–Љ –њ–µ—А–µ–≤–µ—И–Є–≤–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –≥–Є–њ–µ—А–Ї–∞–ї–Є–µ–Љ–Є–Є [27]. –≠—В–Є –і–∞–љ–љ—Л–µ –ї–µ–≥–ї–Є –≤ –Њ—Б–љ–Њ–≤—Г —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –њ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є—О –і–Њ–Ј—Л –Р–Ь–Ъ–† —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ъ–§<30 –Љ–ї/–Љ–Є–љ/1,73 –Љ2 –Є–ї–Є —Г—А–Њ–≤–љ–µ–Љ –Ї–∞–ї–Є—П >5,5 –Љ–Љ–Њ–ї—М/–ї –Є –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—О –њ—А–Є–µ–Љ–∞ –Р–Ь–Ъ–† –њ—А–Є –°–Ъ–§<20 –Љ–ї/–Љ–Є–љ/1,73 –Љ2 –Є–ї–Є –њ—А–Є —Г—А–Њ–≤–љ–µ –Ї–∞–ї–Є—П >6 –Љ–Љ–Њ–ї—М/–ї [1]. –Т—Л—И–µ—Б–Ї–∞–Ј–∞–љ–љ–Њ–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Ї–Њ–љ—В—А–Њ–ї—П —Г—А–Њ–≤–љ—П –Ї–∞–ї–Є—П –≤ –Ї—А–Њ–≤–Є –Є —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Р–Ь–Ъ–† –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П, –≤–Њ–Ј—А–∞—Б—В–∞ –њ–∞—Ж–Є–µ–љ—В–∞ –Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є.
–Р–љ–∞–ї–Є–Ј –њ–Њ–і–≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э, –љ–Є–Ј–Ї–Њ–є –§–Т–Ы–Ц, II –§–Ъ (–њ–Њ NYHA) –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є EMPHASIS-HF –≤—Л—П–≤–Є–ї –≥—А—Г–њ–њ—Г —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –≥–Є–њ–µ—А–Ї–∞–ї–Є–µ–Љ–Є–Є, –Ї–Њ—В–Њ—А–∞—П –≤–Ї–ї—О—З–∞–µ—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≤–Њ–Ј—А–∞—Б—В–µ —Б—В–∞—А—И–µ 75 –ї–µ—В —Б —Г—А–Њ–≤–љ–µ–Љ –°–Ъ–§<60 –Љ–ї/–Љ–Є–љ, –°–Ф –Є –Р–Ф>123 –Љ–Љ —А—В. —Б—В. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л —А–Є—Б–Ї–∞ –њ—А–Є–µ–Љ —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О —Г—А–Њ–≤–љ—П –Ї–∞–ї–Є—П >5,5 –Љ–Љ–Њ–ї—М/–ї, –Њ–і–љ–∞–Ї–Њ —Г—А–Њ–≤–µ–љ—М –Ї–∞–ї–Є—П >6,0 –Љ–Љ–Њ–ї—М/–ї –љ–µ –љ–∞–±–ї—О–і–∞–ї—Б—П –љ–Є —Г –Њ–і–љ–Њ–≥–Њ –Є–Ј –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤–Ї–ї—О—З–∞—П –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–Њ –њ–Њ–≤–Њ–і—Г –≥–Є–њ–µ—А–Ї–∞–ї–Є–µ–Љ–Є–Є, –њ—А–µ–Ї—А–∞—В–Є–≤—И–Є—Е –њ—А–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –Є–Ј-–Ј–∞ –≥–Є–њ–µ—А–Ї–∞–ї–Є–µ–Љ–Є–Є –Є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–Њ –њ–Њ–≤–Њ–і—Г –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї [28]. –Р–≤—В–Њ—А—Л —Б–і–µ–ї–∞–ї–Є –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ, —З—В–Њ —Н–њ–ї–µ—А–µ–љ–Њ–љ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Б–љ–Є–ґ–∞–µ—В —З–∞—Б—В–Њ—В—Г –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –њ–Њ –њ–Њ–≤–Њ–і—Г –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ–є –•–°–Э –Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–µ —В–Њ–ї—М–Ї–Њ –≤ –Є–Ј—Г—З–∞–µ–Љ–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–Њ –Є –≤ –≥—А—Г–њ–њ–µ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –≥–Є–њ–µ—А–Ї–∞–ї–Є–µ–Љ–Є–Є.
–Т –Ї—А—Г–њ–љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ (EPHESUS, EMPHASUS-HF) –љ–µ –±—Л–ї–Њ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –ї–µ—В–∞–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –≥–Є–њ–µ—А–Ї–∞–ї–Є–µ–Љ–Є–Є.
–Ґ–∞–Ї –Ї–∞–Ї —Н–њ–ї–µ—А–µ–љ–Њ–љ —П–≤–ї—П–µ—В—Б—П –≤—Л—Б–Њ–Ї–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ –Р–Ь–Ъ–†, —В–Њ –≥–Є–љ–µ–Ї–Њ–Љ–∞—Б—В–Є—П –≤–Њ–Ј–љ–Є–Ї–∞–µ—В —А–µ–і–Ї–Њ (–Љ–µ–љ–µ–µ —З–µ–Љ —Г 1% –њ–∞—Ж–Є–µ–љ—В–Њ–≤). –°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є EPHESUS –Є EMPHASIS-HF –≥–Є–љ–µ–Ї–Њ–Љ–∞—Б—В–Є—П —А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї–∞—Б—М —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ —Г 0,5 –Є —Г 0,7% –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е —Н–њ–ї–µ—А–µ–љ–Њ–љ –Љ—Г–ґ—З–Є–љ. –Р—Д—Д–Є–љ–љ–Њ—Б—В—М —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ –Ї —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤ –≤ 370 —А–∞–Ј –љ–Є–ґ–µ, —З–µ–Љ —Г —Б–њ–Є—А–Њ–љ–Њ–ї–∞–Ї—В–Њ–љ–∞, –Є –і–∞–ґ–µ –њ—А–Є –њ—А–Є–µ–Љ–µ –≤—Л—Б–Њ–Ї–Њ–є –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В –љ–µ —Б–≤—П–Ј—Л–≤–∞–µ—В—Б—П —Б —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–∞ –Є –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–Њ–≤.
–Я—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–∞ —Б –•–°–Э –≥–Є–љ–µ–Ї–Њ–Љ–∞—Б—В–Є–Є —Б–ї–µ–і—Г–µ—В –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ —Б—Г—Й–µ—Б—В–≤—Г–µ—В —А—П–і –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –њ–Њ–≤—Л—И–∞—О—Й–Є—Е —А–Є—Б–Ї –µ–µ —А–∞–Ј–≤–Є—В–Є—П, –∞ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э вАФ —Н—В–Њ –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б—В–∞—А—И–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ [29]. –Ш–љ–∞–Ї—В–Є–≤–∞—Ж–Є—П —Б—В–µ—А–Њ–Є–і–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –≤ –њ–µ—З–µ–љ–Є, –њ–Њ—З–Ї–∞—Е –Є, —А–µ–ґ–µ, –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ. –Э–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П —Н—В–Є—Е –Њ—А–≥–∞–љ–Њ–≤ –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –љ–∞—А—Г—И–µ–љ–Є—О –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ —Б—В–µ—А–Њ–Є–і–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ –Є –њ–Њ–≤—Л—Б–Є—В—М –Є—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –≤ –Ї—А–Њ–≤–Є. –Я–Њ–Љ–Є–Љ–Њ —Н—В–Њ–≥–Њ, –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –Љ–Њ–ґ–µ—В –љ–∞–±–ї—О–і–∞—В—М—Б—П –њ—А–Є –њ—А–Є–µ–Љ–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е —Н—Б—В—А–Њ–≥–µ–љ—Л –Є –Њ–±–ї–∞–і–∞—О—Й–Є—Е —Н—Д—Д–µ–Ї—В–∞–Љ–Є —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –Є–ї–Є –∞–љ—В–Є–∞–љ–і—А–Њ–≥–µ–љ–Њ–≤: –≥–µ–љ–Є—Б—В–µ–Є–љ–∞, 8-–њ—А–µ–љ–Є–ї–љ–∞—А–Є–љ–≥–µ–љ–Є–љ–∞ –Є –і—А. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–∞—А–Ї–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤, –∞–Љ—Д–µ—В–∞–Љ–Є–љ–∞, –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –Љ–µ–і–ї–µ–љ–љ—Л—Е –Ї–∞–ї—М—Ж–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤, –і–Є–∞–Ј–µ–њ–∞–Љ–∞, –љ–∞–њ–µ—А—Б—В—П–љ–Ї–Є, —Е–Њ—А–Є–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–Њ–љ–∞–і–Њ—В—А–Њ–њ–Є–љ–∞, –Є–Р–Я–§, –Є–Ј–Њ–љ–Є–∞–Ј–Є–і–∞, –Ї–µ—В–Њ–Ї–Њ–љ–∞–Ј–Њ–ї–∞, –Љ–µ—В–Є–ї–і–Њ–њ—Л, –Љ–µ—В—А–Њ–љ–Є–і–∞–Ј–Њ–ї–∞, —В—А–Є—Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Є—Е –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В–Њ–≤ —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В –≤—Л–Ј–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ –≥–Є–љ–µ–Ї–Њ–Љ–∞—Б—В–Є–Є. –≠—В–Є –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –≤ –њ–Њ–ї—М–Ј—Г –≤—Л–±–Њ—А–∞ —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є.
–Ь–µ—Б—В–Њ —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ –њ—А–Є –•–°–Э —Б —Б–Њ—Е—А–∞–љ–µ–љ–љ–Њ–є –§–Т–Ы–Ц
–Я–Њ—Б–Ї–Њ–ї—М–Ї—Г —Б—Г—Й–µ—Б—В–≤—Г—О—В –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э –Є –љ–Є–Ј–Ї–Њ–є –§–Т–Ы–Ц, —В–Њ –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤–Њ–њ—А–Њ—Б –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ —Г –ї–Є—Ж —Б –•–°–Э –Є —Б–Њ—Е—А–∞–љ–µ–љ–љ–Њ–є –§–Т–Ы–Ц.–Т —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–Є –•–°–Э —Б —Б–Њ—Е—А–∞–љ–µ–љ–љ–Њ–є –§–Т–Ы–Ц вАФ —Н—В–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –Ј–∞—З–∞—Б—В—Г—О –Ј–∞—В—А—Г–і–љ–Є—В–µ–ї—М–љ–Њ –≤—Л–і–µ–ї–Є—В—М –≤–µ–і—Г—Й—Г—О –њ—А–Є—З–Є–љ—Г –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Є –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є. –Т—Б–µ–≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л –Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Љ–Њ–≥—Г—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞—В—М –Є –Љ–µ–љ—П—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –Ї–∞—А—В–Є–љ—Г, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—П —А–∞–Ј–≤–Є—В–Є—О —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л—Е —Д–µ–љ–Њ—В–Є–њ–Њ–≤.
–Т –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –•–°–Э —Б —Б–Њ—Е—А–∞–љ–µ–љ–љ–Њ–є –§–Т–Ы–Ц –Ј–∞–і–µ–є—Б—В–≤–Њ–≤–∞–љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤. –Т–∞–ґ–љ–∞—П —А–Њ–ї—М –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В —Б–Є—Б—В–µ–Љ–љ–Њ–Љ—Г –≤–Њ—Б–њ–∞–ї–µ–љ–Є—О, —Д–Є–±—А–Њ–Ј—Г –Є –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ–Њ–Љ—Г —Б—В—А–µ—Б—Б—Г. –£ –Љ–љ–Њ–≥–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞—А—Г—И–∞–µ—В—Б—П –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–∞—П —Д—Г–љ–Ї—Ж–Є—П –Ы–Ц, –њ–Њ–≤—Л—И–∞–µ—В—Б—П –ґ–µ—Б—В–Ї–Њ—Б—В—М –Ы–Ц –Ј–∞ —Б—З–µ—В —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Њ—В–ї–Њ–ґ–µ–љ–Є—П –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ –Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –±–µ–ї–Ї–Њ–≤ —Ж–Є—В–Њ—Б–Ї–µ–ї–µ—В–∞ –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤, —Б–љ–Є–ґ–∞–µ—В—Б—П —Б—В–µ–њ–µ–љ—М —А–µ–ї–∞–Ї—Б–∞—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ –Є –µ–≥–Њ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є–є —А–µ–Ј–µ—А–≤, –њ–Њ–≤—Л—И–∞–µ—В—Б—П –љ–µ–є—А–Њ–≥—Г–Љ–Њ—А–∞–ї—М–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М [30]. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ –≤–Њ–≤–ї–µ—З–µ–љ –≤–Њ –Љ–љ–Њ–≥–Є–µ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ –≤–Є–і–Є—В—Б—П –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ —Г —Н—В–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —З—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В —А—П–і –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [31]. –Т —В–µ—З–µ–љ–Є–µ 24 –Љ–µ—Б. –љ–∞–±–ї—О–і–∞–ї–Є—Б—М 303 –њ–∞—Ж–Є–µ–љ—В–∞ (249 –Љ—Г–ґ—З–Є–љ) —Б —Б–Њ—Е—А–∞–љ–µ–љ–љ–Њ–є –§–Т–Ы–Ц –≤ –≤–Њ–Ј—А–∞—Б—В–µ 58¬±11 –ї–µ—В, —Г –Ї–Њ—В–Њ—А—Л—Е –љ–∞ 7-–є –і–µ–љ—М –њ–Њ—Б–ї–µ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —Г—А–Њ–≤–µ–љ—М –Љ–∞—В—А–Є–Ї—Б–љ–Њ–є –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј—Л-9 (–Ь–Ь–Я-9). –Я–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 2 –≥—А—Г–њ–њ—Л: –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е —Н–њ–ї–µ—А–µ–љ–Њ–љ (n=201) –≤ –і–Њ–Ј–µ 25 –Љ–≥/—Б—Г—В –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ—Г—О –≥—А—Г–њ–њ—Г (n=102). –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ –љ–µ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–Њ—Б—М —Б —Г–ї—Г—З—И–µ–љ–Є–µ–Љ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –≤ —Ж–µ–ї–Њ–Љ –њ–Њ –≥—А—Г–њ–њ–µ (—А=0,132), –Њ–і–љ–∞–Ї–Њ –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є—Б—Е–Њ–і–љ–Њ –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –Ь–Ь–Я-9 (—А=0,005) –њ—А–Њ–≥–љ–Њ–Ј –±—Л–ї –ї—Г—З—И–µ, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Ь–Ь–Я-9 —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ—Б–ї–µ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ —Б —Б–Њ—Е—А–∞–љ–µ–љ–љ–Њ–є –§–Т–Ы–Ц –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є–і–µ–љ—В–Є—Д–Є–Ї–∞—В–Њ—А–∞ —В–Њ–є —З–∞—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е –њ—А–Є–µ–Љ —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –њ—А–Њ–≥–љ–Њ–Ј–Њ–Љ [32вАУ37].
–Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ—В —Г–±–µ–і–Є—В–µ–ї—М–љ—Л—Е –і–∞–љ–љ—Л—Е –Њ –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е –Ї–ї–∞—Б—Б–Њ–≤ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л—Е –њ—А–Є –•–°–Э —Б —Б–Њ—Е—А–∞–љ–µ–љ–љ–Њ–є –§–Т–Ы–Ц, –Љ–Њ–ґ–љ–Њ –љ–∞–і–µ—П—В—М—Б—П, —З—В–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –њ—А–Њ—Ж–µ—Б—Б —Д–Є–±—А–Њ–Ј–∞ –њ–Њ–Љ–Њ–ґ–µ—В —Г–ї—Г—З—И–Є—В—М —Д—Г–љ–Ї—Ж–Є—О –Ї–∞—А–і–Є–Њ–Љ–Є–Њ—Ж–Є—В–Њ–≤ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤—Л—Б–Њ–Ї–∞—П —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞, —Е–Њ—А–Њ—И–∞—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Є –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—О, –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–∞—П –±–∞–Ј–∞, –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—Й–∞—П —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є, –њ–Њ–Ј–≤–Њ–ї—П—О—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М —Н–њ–ї–µ—А–µ–љ–Њ–љ (–љ–∞–њ—А–Є–Љ–µ—А, –њ—А–µ–њ–∞—А–∞—В –≠—Б–њ–Є—А–Њ) –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤—Л–±–Њ—А–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э, –≤ —В. —З. –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б—В–∞—А—И–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Б –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ–Њ–є –Ї–Њ–Љ–Њ—А–±–Є–і–љ–Њ—Б—В—М—О.–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —Н–њ–ї–µ—А–µ–љ–Њ–љ–∞ –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ–Ј–≤–Њ–ї–Є—В —Б–њ–∞—Б—В–Є 0,5 –ґ–Є–Ј–љ–Є –≤ –≥–Њ–і –Є 0,4 –ґ–Є–Ј–љ–Є вАФ –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –≤—Л—Б–Њ–Ї–Њ–≥–Њ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є, —З—В–Њ –њ–Њ–Ї–∞–Ј–∞–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –∞–љ–∞–ї–Є–Ј–∞ Z. Ademi et al., –Ї–Њ—В–Њ—А—Л–µ –Є–Ј—Г—З–Є–ї–Є —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ —Б—В–Њ–Є–Љ–Њ—Б—В–Є –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П —Н–њ–ї–µ—А–µ–љ–Њ–љ–Њ–Љ (–≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ–ї–∞—Ж–µ–±–Њ) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э вАФ —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П EMPHASIS-HF –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 10 –ї–µ—В [38].












