–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є–љ–≥–Є–±–Є—В–Њ—А—Л –У–Ь–У––Ъ–Њ–Р–—А–µ–і—Г–Ї—В–∞–Ј—Л (c—В–∞—В–Є–љ—Л) —П–≤–ї—П—О—В—Б—П –љ–µ–Њ—В—К–µ–Љ–ї–µ–Љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ –≤ –њ–µ—А–≤–Є—З–љ–Њ–є –Є –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (–°–°–Ч). –Ю–і–љ–∞–Ї–Њ –і–∞–љ–љ—Л–µ –њ–Њ –Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–•–°–Э) –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л –Є —В—А–µ–±—Г—О—В —Г—В–Њ—З–љ–µ–љ–Є—П, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –±–Њ–ї—М–љ—Л–µ –•–°–Э —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є –Є—Б–Ї–ї—О—З–∞–ї–Є—Б—М –Є–Ј –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –Ї—А—Г–њ–љ–Њ–Љ–∞—Б—И—В–∞–±–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б–Њ —Б—В–∞—В–Є–љ–∞–Љ–Є [1]. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –і–Њ –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –ї–Є—И—М –љ–µ–±–Њ–ї—М—И–Є–µ –Є –љ–µ–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О —Б—В–∞—В–Є–љ–Њ–≤ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э, –≤ –Ј–∞—А—Г–±–µ–ґ–љ–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ –Њ–±—Б—Г–ґ–і–∞—О—В—Б—П —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–і–њ–Њ—Б—Л–ї–Ї–Є –Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ, –љ–µ –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є–µ –Є—Б–Ї–ї—О—З–Є—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Є—Е –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П. –Ґ–∞–Ї, –≤ —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Њ—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Ш–С–°, –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –±–Њ–ї–µ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [2].
–•–Њ–ї–µ—Б—В–µ—А–Є–љ –Є –•–°–Э
–У–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є—П –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –Њ–±—Й–µ–Є–Ј–≤–µ—Б—В–љ—Л–Љ —Д–∞–Ї—В–Њ—А–∞–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ш–С–°, –∞ —В–∞–Ї–ґ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Њ—В —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –Ю–і–љ–∞–Ї–Њ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–∞—П –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–µ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —В—П–ґ–µ–ї—Л–Љ–Є –Њ—Б—В—А—Л–Љ–Є –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –≤—Л—П–≤–ї–µ–љ–∞ –Њ–±—А–∞—В–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ–∞—П –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є –≤–љ—Г—В—А–Є–±–Њ–ї—М–љ–Є—З–љ–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –Є –Њ—Б—В—А—Л–Љ–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–Љ–Є—Б—П –Ї–∞—Е–µ–Ї—Б–Є–µ–є [3–8].
–Я–Њ –і–∞–љ–љ—Л–Љ –§—А–∞–Љ–Є–љ–≥–µ–Љ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є—П —П–≤–ї—П–µ—В—Б—П —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –•–°–Э [9], —З—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П –і–∞–љ–љ—Л–Љ–Є –Є –і—А—Г–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [10–12]. –Ю–і–љ–∞–Ї–Њ –њ—А–Є –і–µ—В–∞–ї—М–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –§—А–∞–Љ–Є–љ–≥–µ–Љ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ–∞—П –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О —Г –±–Њ–ї—М–љ—Л—Е –і–Њ 40 –ї–µ—В, –љ–µ–Ј–љ–∞—З–Є–Љ–∞—П – —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ 50–70––ї–µ—В–љ–µ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –Є –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–∞—П —Г –±–Њ–ї—М–љ—Л—Е 80 –ї–µ—В –Є —Б—В–∞—А—И–µ [13]. –Я—А–Є —Н—В–Њ–Љ —Е–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –•–°–Э –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Б—В–∞—В–Є–љ—Л –≤–µ—Б—М–Љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [14]. –Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Њ–њ–Є—Б–∞–љ–∞ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є –Є—Б—Е–Њ–і–Њ–Љ –•–°–Э. –Т 1998 –≥–Њ–і—Г D.I. Vredevoe —Б —Б–Њ–∞–≤—В. –±—Л–ї–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ –Ј–љ–∞—З–Є–Љ–∞—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Љ–µ–ґ–і—Г –љ–Є–Ј–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є –≤—Л—Б–Њ–Ї–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О —Г –±–Њ–ї—М–љ—Л—Е —В—П–ґ–µ–ї–Њ–є –•–°–Э –љ–µ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ [15]. –Я–Њ –і–∞–љ–љ—Л–Љ –і—А—Г–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –љ–∞–њ—А–Њ—В–Є–≤, –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї—Б—П —Б –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э –Ї–∞–Ї –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є, —В–∞–Ї –Є –љ–µ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є [2,16–20]. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ ROC––∞–љ–∞–ї–Є–Ј–∞ –њ–Њ—А–Њ–≥–Њ–≤–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –њ—А–Є –Њ—Ж–µ–љ–Ї–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –±–Њ–ї—М–љ—Л—Е –•–°–Э –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є T.B. Horwich —Б —Б–Њ–∞–≤—В. —Б–Њ—Б—В–∞–≤–Є–ї–Њ 4,9 –Љ–Љ–Њ–ї—М/–ї (—Б 70% —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –њ—А–µ–і—Б–Ї–∞–Ј–∞–љ–Є—П —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –≤ —В–µ—З–µ–љ–Є–µ 5 –ї–µ—В) [2], –∞ –≤ —А–∞–±–Њ—В–µ M. Rauchhaus —Б —Б–Њ–∞–≤—В. – 5,2 –Љ–Љ–Њ–ї—М/–ї (—Б 80% —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –Є 63% —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О –њ—А–µ–і—Б–Ї–∞–Ј–∞–љ–Є—П —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –≤ —В–µ—З–µ–љ–Є–µ –≥–Њ–і–∞) [16]. –Я—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –Њ–±—Й–µ–≥–Њ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –љ–∞ 1 –Љ–Љ–Њ–ї—М/–ї –љ–Є–ґ–µ –њ–Њ—А–Њ–≥–Њ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М –≤–Њ–Ј—А–∞—Б—В–∞–ї–∞ –љ–∞ 25%. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є M. Christ —Б —Б–Њ–∞–≤—В. —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ–Њ–є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ–њ–∞—В–Є–µ–є —Г—А–Њ–≤–µ–љ—М —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –љ–µ —П–≤–ї—П–ї—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є, –∞ —Б–ї—Г–ґ–Є–ї –ї–Є—И—М –Љ–∞—А–Ї–µ—А–Њ–Љ —В—П–ґ–µ—Б—В–Є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є [21].
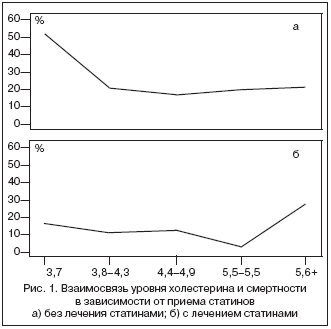
–Я–Њ–і–Њ–±–љ–Њ–µ —П–≤–ї–µ–љ–Є–µ «–њ–µ—А–µ–≤–µ—А–љ—Г—В–Њ–є» —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є–Є –•–°–Э –Њ—В–Љ–µ—З–∞–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –і–ї—П —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞, –љ–Њ –Є –і–ї—П —В–∞–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, –Ї–∞–Ї –Є–љ–і–µ–Ї—Б –Љ–∞—Б—Б—Л —В–µ–ї–∞ –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –Р–Ф [22]. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤—Л—И–µ—Г–Ї–∞–Ј–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О —А–Њ–ї–Є —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –≤ –њ—А–Њ–≥–љ–Њ–Ј–µ –•–°–Э —П–≤–ї—П—О—В—Б—П –Њ–±—Б–µ—А–≤–∞—Ж–Є–Њ–љ–љ—Л–Љ–Є –Є –љ–µ –Њ–±–ї–∞–і–∞—О—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є —Ж–µ–љ–љ–Њ—Б—В—М—О. –Э–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞, –Ї–∞–Ї –Є –Ї–∞—Е–µ–Ї—Б–Є—П, –Љ–Њ–ґ–µ—В –±—Л—В—М –Љ–∞—А–Ї–µ—А–Њ–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –љ–∞—А—Г—И–µ–љ–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–µ–є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Є —В—П–ґ–µ–ї–Њ–≥–Њ –Њ–±—Й–µ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э [23]. –Ґ–∞–Ї, –љ–µ–і–∞–≤–љ–Њ –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –≤—Л—Б–Њ–Ї–∞—П —Б—В–µ–њ–µ–љ—М –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–Љ –Љ–∞—А–Ї–µ—А–Њ–Љ –љ—Г—В—А–Є—В–Є–≤–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ – –њ—А–µ–∞–ї—М–±—Г–Љ–Є–љ–Њ–Љ —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э, –љ–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е —Б—В–∞—В–Є–љ—Л (r=0,84, p<0,001) [24]. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ–∞—Ж–Є–µ–љ—В—Л —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –њ—А–Є –•–°–Э –Љ–Њ–≥—Г—В –њ—А–µ–і—Б—В–∞–≤–ї—П—В—М —Б–Њ–±–Њ–є –Њ—В–і–µ–ї—М–љ—Г—О –њ–Њ–і–≥—А—Г–њ–њ—Г, –Є–Љ–µ—О—Й—Г—О –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Є–ї–Є –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є, –Ј–∞—Й–Є—Й–∞—О—Й–Є–µ –Є—Е –Њ—В –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є–Є. –Т—Б–µ –≤—Л—И–µ–њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ–Њ–µ –љ–µ –Є—Б–Ї–ї—О—З–∞–µ—В —В–Њ–≥–Њ, —З—В–Њ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ –Є –њ—А–Є –•–°–Э —П–≤–ї—П–µ—В—Б—П –њ—А–Њ–∞—В–µ—А–Њ–≥–µ–љ–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –і–∞–ї—М–љ–µ–є—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –і–ї—П —Г—В–Њ—З–љ–µ–љ–Є—П —А–Њ–ї–Є —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –•–°–Э (–Љ–∞—А–Ї–µ—А –Є–ї–Є –њ—А–Є—З–Є–љ–∞/—Б–ї–µ–і—Б—В–≤–Є–µ). –Ф–Њ –Ј–∞–≤–µ—А—И–µ–љ–Є—П —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ —Б–њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б—В–∞—В–Є–љ–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э –≤–Њ–њ—А–Њ—Б –Њ–± –Є—Е –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Њ—Б—В–∞–µ—В—Б—П –Њ—В–Ї—А—Л—В—Л–Љ. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –±–ї–∞–≥–Њ—В–≤–Њ—А–љ—Г—О –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є–Є –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –±–Њ–ї—М–љ—Л—Е –•–°–Э, –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–µ–≤–∞–ї–Є—А—Г–µ—В —В–Њ—З–Ї–∞ –Ј—А–µ–љ–Є—П, —Б–Њ–≥–ї–∞—Б–љ–Њ –Ї–Њ—В–Њ—А–Њ–є –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Б—В–∞—В–Є–љ–Њ–≤ —В–∞–Ї–Є–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –Њ–њ—А–∞–≤–і–∞–љ–Њ –Є –љ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–Љ—Г —А–µ–Ј—Г–ї—М—В–∞—В—Г. –Р –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л–µ –і–∞–љ–љ—Л–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П —Б—В–∞—В–Є–љ–Њ–≤ –њ—А–Є –•–°–Э –Љ–Њ–≥—Г—В –Њ–±—К—П—Б–љ—П—В—М—Б—П —А–∞–Ј–ї–Є—З–Є–µ–Љ –Љ–µ–ґ–і—Г –Є—Б—В–Є–љ–љ—Л–Љ –Є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ –љ–Є–Ј–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞. –°–њ—А–∞–≤–µ–і–ї–Є–≤–Њ—Б—В—М –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ —Г—В–≤–µ—А–ґ–і–µ–љ–Є—П –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П –і–∞–љ–љ—Л–Љ–Є –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Њ–±—Б–µ—А–≤–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г 900 –±–Њ–ї—М–љ—Л—Е –•–°–Э, –≤ –Ї–Њ—В–Њ—А–Њ–Љ «–њ–µ—А–µ–≤–µ—А–љ—Г—В–∞—П» –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О –Њ—В–Љ–µ—З–∞–ї–∞—Б—М —В–Њ–ї—М–Ї–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Б—В–∞—В–Є–љ—Л [25]. –Я—А–Є —Н—В–Њ–Љ –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є —Б—В–∞—В–Є–љ–∞–Љ–Є –њ—А–Њ—Б–ї–µ–ґ–Є–≤–∞–ї–∞—Б—М –њ—А—П–Љ–∞—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О, –Ї–∞–Ї –њ—А–Є –Ш–С–° (—А–Є—Б. 1).
–Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П Val–HeFT, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–∞–Є–±–Њ–ї—М—И–µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –њ—А–Є —В–µ—А–∞–њ–Є–Є —Б—В–∞—В–Є–љ–∞–Љ–Є –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –љ–∞–Є–Љ–µ–љ—М—И–Є–Љ –Є—Б—Е–Њ–і–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ [26].
–Т–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л
–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П
—Б—В–∞—В–Є–љ–Њ–≤ –њ—А–Є –•–°–Э
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ–±—Б—Г–ґ–і–∞—О—В—Б—П —В—А–Є –Њ—Б–љ–Њ–≤–љ—Л–µ –≥–Є–њ–Њ—В–µ–Ј—Л –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П —Б—В–∞—В–Є–љ–Њ–≤: —Н–љ–і–Њ—В–Њ–Ї—Б–Є–љ – –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤–∞—П, —Г–±–Є—Е–Є–љ–Њ–љ–Њ–≤–∞—П –Є —Б–µ–ї–µ–љ–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤–∞—П.
–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э –≤—Л—П–≤–ї—П–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤, —З—В–Њ –Љ–Њ–ґ–µ—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—В—М—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П —Н–љ–і–Њ—В–Њ–Ї—Б–Є–љ–Њ–≤ [27]. –¶–Є—А–Ї—Г–ї–Є—А—Г—О—Й–Є–µ –≤ –Ї—А–Њ–≤–Є –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і—Л, –љ–∞—Б—Л—Й–µ–љ–љ—Л–µ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–Њ–Љ –Є —В—А–Є–≥–ї–Є—Ж–µ—А–Є–і–∞–Љ–Є, —П–≤–ї—П—О—В—Б—П –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ–Є –∞–Ї—Ж–µ–њ—В–Њ—А–∞–Љ–Є —Н–љ–і–Њ—В–Њ–Ї—Б–Є–љ–Њ–≤. –Ю–љ–Є –Њ–±–ї–∞–і–∞—О—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О —Б–≤—П–Ј—Л–≤–∞—В—М –Є –љ–µ–є—В—А–∞–ї–Є–Ј–Њ–≤–∞—В—М –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –ї–Є–њ–Њ–њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і—Л (–Ы–Я–°). –Ы–Я–° —П–≤–ї—П—О—В—Б—П –Љ–Њ—Й–љ—Л–Љ–Є —Б—В–Є–Љ—Г–ї—П—В–Њ—А–∞–Љ–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–Є–Љ–Є –Є–Љ–Љ—Г–љ–љ–Њ–Ї–Њ–Љ–њ–µ—В–µ–љ—В–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–љ–Є –∞–Ї—В–Є–≤–Є—А—Г—О—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ї–∞—А–і–Є–Њ–і–µ–њ—А–µ—Б—Б–Є–≤–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ –њ—А–Є –•–°–Э. M. Rauchaus —Б —Б–Њ–∞–≤—В. –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є–ї–Є, —З—В–Њ –≤ —Б–≤—П–Ј–Є —Б –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–Њ–≤ –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ —П–≤–ї—П–µ—В—Б—П –њ—А–Є–Ј–љ–∞–Ї–Њ–Љ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –•–°–Э [28]. –£ –±–Њ–ї—М–љ—Л—Е –•–°–Э –≤ —Б—В–∞–і–Є–Є –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –≤—Л—П–≤–ї—П–µ—В—Б—П –Є–Љ–Љ—Г–љ–љ–∞—П –∞–Ї—В–Є–≤–∞—Ж–Є—П, —Б—А–∞–≤–љ–Є–Љ–∞—П —Б —В–∞–Ї–Њ–≤–Њ–є –њ—А–Є —Б–µ–њ—Б–Є—Б–µ –Є —Ж–Є—А—А–Њ–Ј–µ –њ–µ—З–µ–љ–Є [27]. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э –Њ—В–Љ–µ—З–∞—О—В—Б—П —Н–њ–Є–Ј–Њ–і—Л —Н–љ–і–Њ—В–Њ–Ї—Б–µ–Љ–Є–Є, –∞ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Љ–Њ–ґ–µ—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –Ы–Я–° [28]. –°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ–Њ–є –≥–Є–њ–Њ—В–µ–Ј–µ –њ—А–∞–Ї—В–Є–Ї–∞ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —Б—В–∞—В–Є–љ–Њ–≤ –±–Њ–ї—М–љ—Л–Љ –Ш–С–° –Є –•–°–Э –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ –і–Њ–ї–ґ–љ–∞ —А–∞–Ј–ї–Є—З–∞—В—М—Б—П.
–Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Ј–∞ —Б—З–µ—В –њ–Њ–і–∞–≤–ї–µ–љ–Є—П —Б–Є–љ—В–µ–Ј–∞ –Љ–µ–≤–∞–ї–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –њ—А–Є —В–µ—А–∞–њ–Є–Є —Б—В–∞—В–Є–љ–∞–Љ–Є —Б–љ–Є–ґ–∞–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М —Г–±–Є—Е–Є–љ–Њ–љ–∞ [29,30]. –£–±–Є—Е–Є–љ–Њ–љ —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ –Ј–≤–µ–љ–Њ–Љ —Ж–µ–њ–Є –њ–µ—А–µ–љ–Њ—Б–∞ —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤ –Є —Г—З–∞—Б—В–≤—Г–µ—В –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Р–Ґ–§. –£–±–Є—Е–Є–љ–Њ–љ —В–∞–Ї–ґ–µ –Њ–±–ї–∞–і–∞–µ—В –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є. –Ю—В—З–∞—Б—В–Є —Н—В–∞ –≥–Є–њ–Њ—В–µ–Ј–∞ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П –і–∞–љ–љ—Л–Љ–Є –Њ –і–µ—Д–Є—Ж–Є—В–µ —Г–±–Є—Е–Є–љ–Њ–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э, –љ–∞—А–∞—Б—В–∞—О—Й–µ–Љ –њ–Њ –Љ–µ—А–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [31]. –°–љ–Є–ґ–∞—П —Г—А–Њ–≤–µ–љ—М —Г–±–Є—Е–Є–љ–Њ–љ–∞, —Б—В–∞—В–Є–љ—Л —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ —В–µ—З–µ–љ–Є–µ –•–°–Э. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–Њ—Е–Њ–і–Є—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ –Њ—Ж–µ–љ–Ї–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Г–±–Є—Е–Є–љ–Њ–љ–∞ –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є –•–°–Э [32].
–Я–Њ–і–∞–≤–ї–µ–љ–Є–µ —Б–Є–љ—В–µ–Ј–∞ –Љ–µ–≤–∞–ї–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л —В–∞–Ї–ґ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Є–Ј–Њ–њ–µ–љ—В–µ–љ–Є–ї––њ–Є—А–Њ—Д–Њ—Б—Д–∞—В–∞, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –і–ї—П –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Б–µ–ї–µ–љ–Њ—Ж–Є—Б—В–µ–Є–љ–Њ–≤–Њ–є–—В–†–Э–Ъ, –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г—О—Й–µ–є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –≤—Б–µ—Е —Б–µ–ї–µ–љ–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤ [33]. –Ч–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —Б–µ–ї–µ–љ–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤ –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ in vitro —Б –ї–Њ–≤–∞—Б—В–∞—В–Є–љ–Њ–Љ [34].
–Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л
—Б—В–∞—В–Є–љ–Њ–≤ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –•–°–Э
–†–µ–Ј–µ—А–≤ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–≤—П–Ј–∞–љ –Є –Њ–±—А–∞—В–љ–Њ –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї–µ–љ —Г—А–Њ–≤–љ—О —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ [35,36]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–∞ —Д–Њ–љ–µ –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Њ—В–Љ–µ—З–µ–љ–Њ —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ [37]. –Я–Њ–Љ–Є–Љ–Њ –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П, —Б—В–∞—В–Є–љ—Л —В–∞–Ї–ґ–µ –≤–ї–Є—П—О—В –љ–∞ –Є–Ј–Њ–њ—А–µ–љ–Њ–Є–і–љ—Л–µ –њ—А–Њ–і—Г–Ї—В—Л –±–Є–Њ—Б–Є–љ—В–µ–Ј–∞ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –Є—Е –њ–ї–µ–є–Њ—В—А–Њ–њ–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л.
–≠–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О –±–Њ–ї—М–љ—Л—Е –•–°–Э [38]. –Я—А–Є —Н—В–Њ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П —Н–љ–і–Њ—В–µ–ї–Є—П –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –∞—А—В–µ—А–Є–є —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —Г—А–Њ–≤–љ—П —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ [39]. –Ъ–ї—О—З–µ–≤—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є—П –њ—А–Є –•–°–Э —П–≤–ї—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є –Њ–Ї—Б–Є–і–∞ –∞–Ј–Њ—В–∞. –£–ї—Г—З—И–µ–љ–Є–µ —Н–љ–і–Њ—В–µ–ї–Є–є––Ј–∞–≤–Є—Б–Є–Љ–Њ–є –≤–∞–Ј–Њ–Љ–Њ—В–Њ—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є —Б–Њ—Б—Г–і–Њ–≤ –Ј–∞ —Б—З–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є N0–—Б–Є–љ—В–∞–Ј—Л (–µNOS) —П–≤–ї—П–µ—В—Б—П —Е–Њ—А–Њ—И–Њ –Є–Ј—Г—З–µ–љ–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ —Б—В–∞—В–Є–љ–Њ–≤ [40,41]. –°—В–∞—В–Є–љ—Л —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М NO –Ј–∞ —Б—З–µ—В —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є –Љ–†–Э–Ъ eNOS, —Г–Љ–µ–љ—М—И–µ–љ–Є—П –њ—А–Њ–і—Г–Ї—Ж–Є–Є –∞–Ї—В–Є–≤–љ—Л—Е —Д–Њ—А–Љ –Ї–Є—Б–ї–Њ—А–Њ–і–∞, —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Ї–∞–≤–µ–Њ–ї–Є–љ–∞–1 –Є –њ—А–µ–њ—П—В—Б—В–≤–Њ–≤–∞–љ–Є—П —В—А–∞–љ—Б–ї–Њ–Ї–∞—Ж–Є–Є Rho––±–µ–ї–Ї–∞ –Ї –Ї–ї–µ—В–Њ—З–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ–µ, –≥–і–µ –Њ–љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М eNOS [42]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б—В–∞—В–Є–љ—Л —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М Akt––њ—А–Њ—В–µ–Є–љ–Ї–Є–љ–∞–Ј—Л –Є —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –±–µ–ї–Ї–∞ —В–µ–њ–ї–Њ–≤–Њ–≥–Њ —И–Њ–Ї–∞ (HSP–90), —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ —Г–≤–µ–ї–Є—З–Є–≤–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М eNOS. –Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ–Њ–Ї–∞–Ј–∞–љ–∞ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Ж–µ—А–Є–≤–∞—Б—В–∞—В–Є–љ–∞, —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ–∞, –њ—А–∞–≤–∞—Б—В–∞—В–Є–љ–∞ –Є –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞ —Г–ї—Г—З—И–∞—В—М —Д—Г–љ–Ї—Ж–Є—О —Н–љ–і–Њ—В–µ–ї–Є—П –њ—А–Є –•–°–Э [43–47]. –Т–Њ–Ј–і–µ–є—Б—В–≤–Є–µ —Б—В–∞—В–Є–љ–Њ–≤ –љ–∞ –∞–љ–≥–Є–Њ–≥–µ–љ–µ–Ј —В–µ—Б–љ–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –µNOS –Є –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В —Г –Љ—Л—И–µ–є —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ —Н—В–Њ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ [48]. –≠—В–Є –і–∞–љ–љ—Л–µ –Љ–Њ–≥—Г—В –Њ–±—К—П—Б–љ–Є—В—М –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ —Б—В–∞—В–Є–љ–Њ–≤ –љ–∞ –њ–ї–Њ—В–љ–Њ—Б—В—М –Ї–∞–њ–Є–ї–ї—П—А–Њ–≤ –Є —Д—Г–љ–Ї—Ж–Є—О —Б–Њ—Б—Г–і–Њ–≤ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э. –Я–Њ–Љ–Є–Љ–Њ –∞–Ї—В–Є–≤–∞—Ж–Є–Є eNOS, —Б—В–∞—В–Є–љ—Л —Б–љ–Є–ґ–∞—О—В –њ—А–Њ–і—Г–Ї—Ж–Є—О –Љ–Њ—Й–љ–Њ–≥–Њ –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ —Н–љ–і–Њ—В–µ–ї–Є–љ–∞–1 [49].
–Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –љ–µ–є—А–Њ–≥—Г–Љ–Њ—А–∞–ї—М–љ—Л–Љ–Є —Б–Є—Б—В–µ–Љ–∞–Љ–Є, —Г—З–∞—Б—В–≤—Г—О—Й–Є–Љ–Є –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –•–°–Э, —П–≤–ї—П—О—В—Б—П –†–Р–Р–° –Є –°–Р–°. –Я—А–Є –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є–Є –њ–Њ–≤—Л—И–∞–µ—В—Б—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—П –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ I —В–Є–њ–∞, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г—Б–Є–ї–µ–љ–Є—О –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II (–Р–Ґ II). –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ї–Њ—А–Њ–љ–∞—А–љ—Л–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ —Б—В–∞—В–Є–љ—Л –±–ї–Њ–Ї–Є—А—Г—О—В –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–љ—Л–є —Н—Д—Д–µ–Ї—В –Р–Ґ II [50].
–Я–Њ–Љ–Є–Љ–Њ –†–Р–Р–°, —Б—В–∞—В–Є–љ—Л —В–∞–Ї–ґ–µ —А–µ–≥—Г–ї–Є—А—Г—О—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –°–Р–°. –Я—А–Є –і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ–Њ–є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ–њ–∞—В–Є–Є –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є —Б—В–∞—В–Є–љ–∞–Љ–Є —Б–љ–Є–ґ–∞–µ—В—Б—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –°–Р–° –Є –Ј–∞–Љ–µ–і–ї—П–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є. –°—В–∞—В–Є–љ—Л –Є–љ–≥–Є–±–Є—А—Г—О—В –∞–Ї—В–Є–≤–∞—Ж–Є—О ?––∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є –Ј–∞–Љ–µ–і–ї—П—О—В –њ—А–Њ—Ж–µ—Б—Б—Л –∞–њ–Њ–њ—В–Њ–Ј–∞ [51].
–Ч–∞ —Б—З–µ—В –±–ї–Њ–Ї–Є—А–Њ–≤–∞–љ–Є—П —Б–Є–љ—В–µ–Ј–∞ –Љ–µ–≤–∞–ї–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л —Б—В–∞—В–Є–љ—Л —Г–Љ–µ–љ—М—И–∞—О—В –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —Д–Є–±—А–Њ–Ј–∞ –Є –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ [52,53]. –Т —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ 6––Љ–µ—Б—П—З–љ–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–µ–є –њ—А–∞–≤–∞—Б—В–∞—В–Є–љ —Б–љ–Є–ґ–∞–ї –Љ–∞—Б—Б—Г –Љ–Є–Њ–Ї–∞—А–і–∞ –Ы–Ц –љ–∞ 13% [54].
–Т–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Ы–Ц –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–Є –•–°–Э –Є–≥—А–∞—О—В –Љ–∞—В—А–Є—З–љ—Л–µ –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј—Л (–Ь–Ь–Я). –Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б—В–∞—В–Є–љ—Л –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–ї–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Ь–Ь–Я, —З—В–Њ –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї –Ј–∞–Љ–µ–і–ї–µ–љ–Є—О —Д–Є–±—А–Њ–Ј–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –•–°–Э [55,56].
–°—В–∞—В–Є–љ—Л –Ј–∞–Љ–µ–і–ї—П—О—В –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є –Є –Ј–∞ —Б—З–µ—В —Н—В–Њ–≥–Њ —Б–љ–Є–ґ–∞—О—В —З–∞—Б—В–Њ—В—Г –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є. –Т —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є –±–ї—П—И–Ї–Є –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј —Б—В–∞—В–Є–љ–Њ–≤ [57]. –Ґ–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Б—В–∞—В–Є–љ—Л —Г–Љ–µ–љ—М—И–∞—О—В –Ј–Њ–љ—Г –љ–µ–Ї—А–Њ–Ј–∞ –њ—А–Є –Є–љ—Д–∞—А–Ї—В–µ –Љ–Є–Њ–Ї–∞—А–і–∞ –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞ –њ—А–Є –∞–љ–≥–Є–Њ–њ–ї–∞—Б—В–Є–Ї–µ [58].
–Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —В–µ—А–∞–њ–Є—П —Б—В–∞—В–Є–љ–∞–Љ–Є —Б–љ–Є–ґ–∞–µ—В —З–∞—Б—В–Њ—В—Г –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Љ–µ—А—Ж–∞—В–µ–ї—М–љ–Њ–є –∞—А–Є—В–Љ–Є–Є, —П–≤–ї—П—О—Й–µ–є—Б—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–Љ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э [59,60].
–°–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –Љ–∞—А–Ї–µ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, —З—В–Њ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –≤—Л—Б–Њ–Ї–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О [61–63]. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Б—В–∞—В–Є–љ–Њ–≤ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –•–°–Э –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–ї—Г—З—И–µ–љ–Є—О —Б–Њ–Ї—А–∞—В–Є—В–µ–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ –Є —Г–≥–љ–µ—В–µ–љ–Є—О –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П [64,65].
–°—В–∞—В–Є–љ—Л –њ—А–Є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є —Б–њ–Њ—Б–Њ–±–љ—Л —Б–љ–Є–ґ–∞—В—М —Г—А–Њ–≤–µ–љ—М –Љ–Њ–ї–µ–Ї—Г–ї –∞–і–≥–µ–Ј–Є–Є ICAM–1 –Є VCAM–1, –°–†–С, –Ш–Ы–6 –Є —Д–∞–Ї—В–Њ—А–∞ –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є–a (–§–Э–Ю–a) [66–68].
–•–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –і–ї—П —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є —Е–∞—А–∞–Ї—В–µ—А–љ–Њ —Б–Њ—Б—В–Њ—П–љ–Є–µ –≥–Є–њ–µ—А–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є [69]. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ –Є –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ —Б–њ–Њ—Б–Њ–±–љ—Л —Б–љ–Є–ґ–∞—В—М —Г—А–Њ–≤–µ–љ—М –∞–Ї—В–Є–≤–∞—Ж–Є–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, –∞–љ—В–Є—В—А–Њ–Љ–±–Є–љ–∞ III –Є V —Д–∞–Ї—В–Њ—А–∞ [46,70].
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –Њ—Ж–µ–љ–Ї–µ
—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б—В–∞—В–Є–љ–Њ–≤ –њ—А–Є –•–°–Э
–≠–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Т —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –±—Л–ї–Є –њ–Њ–Ї–∞–Ј–∞–љ—Л –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л —Б—В–∞—В–Є–љ–Њ–≤ –њ—А–Є –•–°–Э. –Э–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є —Ж–µ—А–Є–≤–∞—Б—В–∞—В–Є–љ–Њ–Љ –Њ—В–Љ–µ—З–µ–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Ы–Ц –њ–Њ—Б–ї–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–≥–Њ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ [71]. –Т –Љ–Њ–і–µ–ї–Є –•–°–Э –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Д–ї—Г–≤–∞—Б—В–∞—В–Є–љ–∞ –≤ —А–∞–љ–љ–Є–µ —Б—А–Њ–Ї–Є –њ–Њ—Б–ї–µ –Є–љ—Д–∞—А–Ї—В–∞ –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є [72]. –§–ї—Г–≤–∞—Б—В–∞—В–Є–љ –љ–µ —В–Њ–ї—М–Ї–Њ –Ј–∞–Љ–µ–і–ї—П–ї —А–∞–Ј–≤–Є—В–Є–µ –і–Є–ї–∞—В–∞—Ж–Є–Є –Ы–Ц, –љ–Њ –Є —Б–љ–Є–ґ–∞–ї –Ї–Њ–љ–µ—З–љ–Њ–µ –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ, –∞ —В–∞–Ї–ґ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї —Д—А–∞–Ї—Ж–Є—О –≤—Л–±—А–Њ—Б–∞ (–§–Т) –Ы–Ц.
–Ю–і–љ–∞–Ї–Њ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г —Е–Њ–Љ—П–Ї–Њ–≤ —Б –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ–є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ–њ–∞—В–Є–µ–є –ї–Њ–≤–∞—Б—В–∞—В–Є–љ –≤—Л–Ј—Л–≤–∞–ї —Б–љ–Є–ґ–µ–љ–Є–µ –Љ–µ–і–Є–∞–љ—Л –≤—А–µ–Љ–µ–љ–Є –≤—Л–ґ–Є–≤–∞–љ–Є—П —Б 89 –і–Њ 30 –і–љ–µ–є [73].
–Т –Љ–Њ–і–µ–ї–Є –•–°–Э —Г —Б–Њ–±–∞–Ї —В–µ—А–∞–њ–Є—П —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ–Њ–Љ –≤ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј–∞—Е –≤ —В–µ—З–µ–љ–Є–µ —В—А–µ—Е –Љ–µ—Б—П—Ж–µ–≤ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–∞—Б—М –Њ–±—А–∞—В–љ—Л–Љ —А–∞–Ј–≤–Є—В–Є–µ–Љ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Ы–Ц –љ–∞ —Д–Њ–љ–µ —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П –§–Э–Ю–a –Є MMP–2 [74].
–†–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ –∞–љ–∞–ї–Є–Ј—Л
–Т–≤–Є–і—Г –Њ—В—Б—Г—В—Б—В–≤–Є—П –і–∞–љ–љ—Л—Е —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ —Б–њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї—А—Г–њ–љ–Њ–Љ–∞—Б—И—В–∞–±–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ –Њ—Ж–µ–љ–Ї–µ —Н—Д—Д–µ–Ї—В–Њ–≤ —Б—В–∞—В–Є–љ–Њ–≤ –њ—А–Є –•–°–Э –Њ—Б–Њ–±—Л–є –Є–љ—В–µ—А–µ—Б –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —А–µ–Ј—Г–ї—М—В–∞—В—Л —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –∞–љ–∞–ї–Є–Ј–Њ–≤. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CARE –њ—А–∞–≤–∞—Б—В–∞—В–Є–љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–∞–ї –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –±–Њ–ї—М–љ—Л—Е —Б –љ–Є–Ј–Ї–Њ–є –§–Т –Ы–Ц, –Њ–і–љ–∞–Ї–Њ –≤ —Н—В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–µ –≤–Ї–ї—О—З–∞–ї–Є—Б—М –њ–∞—Ж–Є–µ–љ—В—Л —Б –•–°–Э –Є –§–Т –Ы–Ц<25% [75]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є ELITE II —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–є –∞–љ–∞–ї–Є–Ј –≤—Л—П–≤–Є–ї —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –•–°–Э –њ—А–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є —Б—В–∞—В–Є–љ–Њ–≤ [76]. –Я–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П 4S –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –•–°–Э –Є –Є–љ—Д–∞—А–Ї—В–Њ–Љ –Љ–Є–Њ–Ї–∞—А–і–∞ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –њ—А–Є–≤–µ–ї–Њ –Ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г –Ј–∞–Љ–µ–і–ї–µ–љ–Є—О –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [77]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є PROSPER –Њ—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М —Н—Д—Д–µ–Ї—В—Л –њ—А–∞–≤–∞—Б—В–∞—В–Є–љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –Є–Ј —Н—В–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є—Б–Ї–ї—О—З–∞–ї–Є—Б—М –њ–∞—Ж–Є–µ–љ—В—Л —Б –•–°–Э III–IV –§–Ъ, –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –≤ —Б–≤—П–Ј–Є —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –•–°–Э –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–Љ –Ї–∞–Ї –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е —Б—В–∞—В–Є–љ—Л, —В–∞–Ї –Є –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ.
–Я–Њ –і–∞–љ–љ—Л–Љ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ Heart Protection Study, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Г—З–∞—Б—В–≤–Њ–≤–∞–ї–Њ –±–Њ–ї–µ–µ 20 —В—Л—Б. –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ –Є–ї–Є –њ–ї–∞—Ж–µ–±–Њ, –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (RR 0,81, –Ф–Ш 0,59–1,1, —А=0,2) –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –≤ —Б–≤—П–Ј–Є —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Є–ї–Є –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ —Б–Љ–µ—А—В–µ–ї—М–љ—Л–Љ –Є—Б—Е–Њ–і–Њ–Љ –•–°–Э (RR 0,86, –Ф–Ш 0,75–1, p=0,05) [78]. –Ю–і–љ–∞–Ї–Њ –≤–∞–ґ–љ—Л–Љ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ–Љ Heart Protection Study —П–≤–ї—П–ї–Њ—Б—М —В–Њ, —З—В–Њ –њ—А–Є –≤–Ї–ї—О—З–µ–љ–Є–Є –≤ —Н—В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ –±—Л–ї–Њ –•–°–Э.
–Я—А–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П PRAISE (Prospective Randomized Amlodipine Survival Evaluation), —Ж–µ–ї—М—О –Ї–Њ—В–Њ—А–Њ–≥–Њ —П–≤–ї—П–ї–∞—Б—М –Њ—Ж–µ–љ–Ї–∞ –≤–ї–Є—П–љ–Є—П —В–µ—А–∞–њ–Є–Є —Б—В–∞—В–Є–љ–∞–Љ–Є –љ–∞ —Б–Љ–µ—А—В–љ–Њ—Б—В—М 1153 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —В—П–ґ–µ–ї–Њ–є –•–°–Э (III–IV –§–Ъ, –§–Т<30%) –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –Є –љ–µ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Њ—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ c—В–∞—В–Є–љ—Л –њ—А–Є–љ–Є–Љ–∞–ї–Є –ї–Є—И—М 12% –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ю–і–љ–∞–Ї–Њ, –њ–Њ –і–∞–љ–љ—Л–Љ –Љ–љ–Њ–≥–Њ—Д–∞–Ї—В–Њ—А–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞, –њ—А–Є–µ–Љ —Б—В–∞—В–Є–љ–Њ–≤ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї—Б—П —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 62% [79].
–Р–љ–∞–ї–Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П OPTIMAAL —В–∞–Ї–ґ–µ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є (–љ–∞ 26,1%) –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є —Б—В–∞—В–Є–љ–∞–Љ–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э, —А–∞–Ј–≤–Є–≤—И–µ–є—Б—П –њ–Њ—Б–ї–µ –Њ—Б—В—А–Њ–≥–Њ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ [80].
–Т —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П Val–HeFT, –≤–Ї–ї—О—З–∞–≤—И–µ–Љ –±–Њ–ї–µ–µ 5000 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э, –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б—В–∞—В–Є–љ–Њ–≤ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 19% [81]. –Я—А–Є —Н—В–Њ–Љ –≤ –љ–∞–Є–±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є —Н—Д—Д–µ–Ї—В —Б—В–∞—В–Є–љ–Њ–≤ –њ—А–Њ—П–≤–ї—П–ї—Б—П —Г –±–Њ–ї—М–љ—Л—Е —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–µ–є –•–°–Э.
–°–Њ–≤—Б–µ–Љ –љ–µ–і–∞–≤–љ–Њ –±—Л–ї–Є –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –∞–љ–∞–ї–Є–Ј–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П SCD–HeFT, –њ—А–Њ–≤–Њ–і–Є–≤—И–µ–≥–Њ—Б—П —Г 2521 –њ–∞—Ж–Є–µ–љ—В–∞ —Б –•–°–Э –Є –§–Т<35% [82]. –Я—А–Є —Н—В–Њ–Љ –і–Њ–ї—П –±–Њ–ї—М–љ—Л—Е, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е —Б—В–∞—В–Є–љ—Л, —Б–Њ—Б—В–∞–≤–Є–ї–∞ 47%. –Ф–ї–Є—В–µ–ї—М–љ—Л–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П (–Љ–µ–і–Є–∞–љ–∞ 45,5 –Љ–µ—Б—П—Ж–µ–≤) –њ–Њ–Ј–≤–Њ–ї–Є–ї –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞—В—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є —Г –±–Њ–ї—М–љ—Л—Е, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е —Б—В–∞—В–Є–љ—Л (–±–Њ–ї–µ–µ 30%), –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —Н—В–Є–Њ–ї–Њ–≥–Є–Є –•–°–Э. –С–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ —В–µ—А–∞–њ–Є–Є —Б—В–∞—В–Є–љ–∞–Љ–Є –љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –њ—А–Њ—Б–ї–µ–ґ–Є–≤–∞–ї–Њ—Б—М –і–∞–ґ–µ —Г –±–Њ–ї—М–љ—Л—Е —Б –Є–Љ–њ–ї–∞–љ—В–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –Ї–∞—А–і–Є–Њ–≤–µ—А—В–µ—А–∞–Љ–Є––і–µ—Д–Є–±—А–Є–ї–ї—П—В–Њ—А–∞–Љ–Є.
–Т 2006 –≥. –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –∞–љ–∞–ї–Є–Ј–∞ –±–Њ–ї–µ–µ 50 —В—Л—Б. –Є—Б—В–Њ—А–Є–є –±–Њ–ї–µ–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б—В–∞—А—И–µ 65 –ї–µ—В, –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –Њ—Б–љ–Њ–≤–љ—Л–Љ –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ –•–°–Э. –Ґ–µ—А–∞–њ–Є—П —Б—В–∞—В–Є–љ–∞–Љ–Є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–∞—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ—Б–ї–µ –≤—Л–њ–Є—Б–Ї–Є –љ–∞ 20% –≤ —В–µ—З–µ–љ–Є–µ –≥–Њ–і–∞ –Є —В—А–µ—Е –ї–µ—В –њ–Њ—Б–ї–µ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –њ–Њ –≤–Њ–Ј—А–∞—Б—В—Г, –њ–Њ–ї—Г, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ –Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є —В–µ—А–∞–њ–Є–Є [83]. –Ы—О–±–Њ–њ—Л—В–љ–Њ, —З—В–Њ –љ–∞–Є–±–Њ–ї—М—И–Є–є —Н—Д—Д–µ–Ї—В –њ—А–Є —В–µ—А–∞–њ–Є–Є —Б—В–∞—В–Є–љ–∞–Љ–Є –Њ—В–Љ–µ—З–∞–ї—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–∞–Є–Љ–µ–љ—М—И–Є–Љ —Г—А–Њ–≤–љ–µ–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ (–Љ–µ–љ–µ–µ 200 –Љ–≥/–і–ї). –Ы–µ—З–µ–љ–Є–µ —Б—В–∞—В–Є–љ–∞–Љ–Є –±—Л–ї–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –µ–µ —Н—В–Є–Њ–ї–Њ–≥–Є–Є.
–Т —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г 551 –њ–∞—Ж–Є–µ–љ—В–∞ —Б —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –Ы–Ц —В–µ—А–∞–њ–Є—П —Б—В–∞—В–Є–љ–∞–Љ–Є –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–∞—Б—М —Б –ї—Г—З—И–Є–Љ –њ—А–Њ–≥–љ–Њ–Ј–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ –≥–Њ–і–∞ (91% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б 72%, —А<0,001) [84]. –Ґ–∞–Ї–ґ–µ –њ–Њ–ї—Г—З–µ–љ—Л –і–∞–љ–љ—Л–µ –Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–Љ –≤–ї–Є—П–љ–Є–Є —В–µ—А–∞–њ–Є–Є —Б—В–∞—В–Є–љ–∞–Љ–Є –љ–∞ –њ—А–Њ–≥–љ–Њ–Ј —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О [85].
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –і–∞–љ–љ—Л—Е 126 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О (–§–Т<20%) –Њ—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ —В–µ—А–∞–њ–Є—П —Б—В–∞—В–Є–љ–∞–Љ–Є —З–µ—А–µ–≤ 2,5 –≥–Њ–і–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П –њ—А–Є–≤–µ–ї–∞ –Ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г —Г–ї—Г—З—И–µ–љ–Є—О –њ—А–Њ–≥–љ–Њ–Ј–∞ —Г –±–Њ–ї—М–љ—Л—Е –Ш–С–°, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Г –±–Њ–ї—М–љ—Л—Е c –љ–µ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–µ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–≥–Њ —Г–ї—Г—З—И–µ–љ–Є—П –њ—А–Њ–≥–љ–Њ–Ј–∞ –љ–µ –њ—А–Њ–Є–Ј–Њ—И–ї–Њ (—А–Є—Б. 2) [86].
–Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤—Б–µ –≤—Л—И–µ–њ—А–Є–≤–µ–і–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–ї—Г—З–µ–љ—Л –≤ —Е–Њ–і–µ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –∞–љ–∞–ї–Є–Ј–Њ–≤, –Є —Н—В–Њ –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –Љ–µ—А–µ —Б–љ–Є–ґ–∞–µ—В –Є—Е –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ—Г—О —Ж–µ–љ–љ–Њ—Б—В—М. –£—З–Є—В—Л–≤–∞—П –Њ–±—А–∞—В–љ—Г—О –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О –±–Њ–ї—М–љ—Л—Е –•–°–Э, –Њ–њ–Є—Б–∞–љ–љ—Г—О —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е —Б—В–∞—В–Є–љ—Л, –Љ–Њ–ґ–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –≤–ї–Є—П–љ–Є–µ —Б—В–∞—В–Є–љ–Њ–≤ –љ–∞ —Б–Љ–µ—А—В–љ–Њ—Б—В—М –±–Њ–ї—М–љ—Л—Е –Њ–±—К—П—Б–љ—П–µ—В—Б—П –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є–µ–є –і–Њ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П (—З—В–Њ –≤–Њ –Љ–љ–Њ–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –љ–µ –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Б—В–∞—В–Є–љ—Л –≤–Њ –≤—А–µ–Љ—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Є–љ–Є–Љ–∞–ї–Є –Є—Е –Є –і–Њ –µ–≥–Њ –љ–∞—З–∞–ї–∞.
–Я—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Ф–∞–љ–љ—Л–µ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б—В–∞—В–Є–љ–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э –љ–µ–Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л. –Т –Њ–і–љ–Њ–Љ –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г—З–∞—Б—В–≤–Њ–≤–∞–ї–Є –±–Њ–ї—М–љ—Л–µ —Б –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ–Њ–є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ–њ–∞—В–Є–µ–є. 51 –њ–∞—Ж–Є–µ–љ—В –њ–Њ–ї—Г—З–∞–ї –ї–Є–±–Њ —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ (10 –Љ–≥ –≤ —Б—Г—В–Ї–Є), –ї–Є–±–Њ –њ–ї–∞—Ж–µ–±–Њ –≤ —В–µ—З–µ–љ–Є–µ 14 –љ–µ–і–µ–ї—М [64]. –Т –≥—А—Г–њ–њ–µ —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ–∞ —Г 39,1% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–Љ–µ—З–µ–љ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –§–Ъ –•–°–Э –Є —Г 4,3% —Г–≤–µ–ї–Є—З–µ–љ–Є–µ, –∞ –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ – —Г 16% —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Є —Г 12% —Г–≤–µ–ї–Є—З–µ–љ–Є–µ (—А<0,01 –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є). –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –§–Т –Ы–Ц –≤ –≥—А—Г–њ–њ–µ —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ–∞ (—Б 34 –і–Њ 41%) –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –≥—А—Г–њ–њ—Л –њ–ї–∞—Ж–µ–±–Њ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —В–µ—А–∞–њ–Є—П —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ–Њ–Љ –њ—А–Є–≤–µ–ї–∞ –Ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –§–Э–Ю–?, –Ш–Ы–6 –Є –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –љ–∞—В—А–Є–є—Г—А–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–µ–њ—В–Є–і–∞ (–Ь–Э–Я).
–Т –і—А—Г–≥–Њ–Љ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –і–≤–Њ–є–љ–Њ–Љ —Б–ї–µ–њ–Њ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ–Њ–є –Ї–∞—А–і–Є–Њ–Љ–Є–Њ–њ–∞—В–Є–µ–є –љ–∞–Ј–љ–∞—З–∞–ї—Б—П —Ж–µ—А–Є–≤–∞—Б—В–∞—В–Є–љ (0,4 –Љ–≥) –Є–ї–Є –њ–ї–∞—Ж–µ–±–Њ [87]. –Т –≥—А—Г–њ–њ–µ —Б—В–∞—В–Є–љ–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–ї—Г—З—И–Є–ї–Њ—Б—М –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ґ–∞–Ї–ґ–µ –Њ—В–Љ–µ—З–∞–ї–∞—Б—М —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –§–Т –Ы–Ц –Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О —Д—Г–љ–Ї—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є—П.
–Т –Њ—В–Ї—А—Л—В–Њ–Љ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ 12––љ–µ–і–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Д–ї—Г–≤–∞—Б—В–∞—В–Є–љ–∞ —Г 40 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э (20 —Б –Ш–С–° –Є 20 —Б –Ф–Ъ–Ь–Я) –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —Б—А–µ–і–љ–µ–≥–Њ –§–Ъ –•–°–Э (—Б 2,25±0,5 –і–Њ 1,8±0,6, p=0,003 –≤ –≥—А—Г–њ–њ–µ –Ш–С–° –Є —Б 2,05±0,4 –і–Њ 1,65±0,6, p=0,005 –≤ –≥—А—Г–њ–њ–µ –Ф–Ъ–Ь–Я) [88]. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М —А–Њ—Б—В–Њ–Љ –§–Т –Ы–Ц (—Б 29±4% –і–Њ 31±5%, p=0,001 –≤ –≥—А—Г–њ–њ–µ –Ш–С–° –Є —Б 30±5% –і–Њ 33±5%, p=0,01 –≤ –≥—А—Г–њ–њ–µ –Ф–Ъ–Ь–Я). –Ч–љ–∞—З–Є–Љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, –≤–Ї–ї—О—З–∞—П –°–†–С, –Ь–Э–Я, –Ш–Ы–6 –Є –§–Э–Ю–?, –љ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –≤ –≥—А—Г–њ–њ–µ –Ш–С–°.
–Э–∞–њ—А–Њ—В–Є–≤, –≤ 6––Љ–µ—Б—П—З–љ–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г 40 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э (88,5% —Б –Ф–Ъ–Ь–Я) —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ –љ–µ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–µ —В–Њ–ї—М–Ї–Њ –љ–∞ –њ–∞—А–∞–Љ–µ—В—А—Л —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Ы–Ц, –љ–Њ –Є –љ–∞ —Г—А–Њ–≤–µ–љ—М –Љ–∞—А–Ї–µ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П (–§–Э–Ю–?, –Ш–Ы–6, –°–†–С), –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ–∞, —Н–љ–і–Њ—В–µ–ї–Є–љ–∞–1 –Є –Ь–Э–Я [89]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є —Б–≤—П–Ј—Л–≤–∞—О—В –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ–∞ –Ї–∞–Ї —Б —Н—В–Є–Њ–ї–Њ–≥–Є–µ–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —В–∞–Ї –Є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, —Б–Њ —Б–ї–Є—И–Ї–Њ–Љ –≤—Л—Б–Њ–Ї–Є–Љ–Є –µ–≥–Њ –і–Њ–Ј–∞–Љ–Є (40 –Љ–≥). –Ы—О–±–Њ–њ—Л—В–љ–Њ, —З—В–Њ —В–∞–Ї–ґ–µ –љ–µ—Г—Б–њ–µ—И–љ—Л–Љ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М 12––љ–µ–і–µ–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–Њ–Љ –≤ –і–Њ–Ј–µ 80 –Љ–≥ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ф–Ъ–Ь–Я [90].
–Я—А–Є —Н—В–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ 12––Љ–µ—Б—П—З–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Г 108 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ф–Ъ–Ь–Я –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞ –≤ –і–Њ–Ј–µ 20 –Љ–≥ –љ–∞ –§–Т –Ы–Ц (—Б 33±0,05 –і–Њ 0,37±0,04 p=0,01) –Є –ї–Є–љ–µ–є–љ—Л—Е —А–∞–Ј–Љ–µ—А–Њ–≤ –Ы–Ц, –∞ —В–∞–Ї–ґ–µ –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ (–°–†–С, –§–Э–Ю–?, –Ш–Ы–6) [91].
–Т –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —П–њ–Њ–љ—Б–Ї–Є—Е —Г—З–µ–љ—Л—Е –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–Њ–Љ –≤ –і–Њ–Ј–µ 10 –Љ–≥ —Г 38 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–°–Э [92]. –Ґ–µ—А–∞–њ–Є—П –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ —В—А–µ—Е –ї–µ—В –њ—А–Є–≤–µ–ї–∞ –Ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–Љ—Г —А–Њ—Б—В—Г –§–Т –Ы–Ц —Б 33,2±7,4% –і–Њ 39,1±12,1% (p=0,01) –љ–∞—А—П–і—Г —Б —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –ї–Є–љ–µ–є–љ—Л—Е —А–∞–Ј–Љ–µ—А–Њ–≤ –Ы–Ц, –∞ —В–∞–Ї–ґ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –Ь–Э–Я. –Т –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –Њ—В–Љ–µ—З–∞–ї–∞—Б—М –Њ–±—А–∞—В–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞. –£–ї—Г—З—И–µ–љ–Є–µ –Ї–ї–Є–љ–Є–Ї–Њ–—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Љ–µ–љ—М—И–µ–є —З–∞—Б—В–Њ—В–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Є –њ–Њ–≤—В–Њ—А–љ—Л—Е –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –≤ –≥—А—Г–њ–њ–µ –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞ (16%) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–Њ–є (42%).
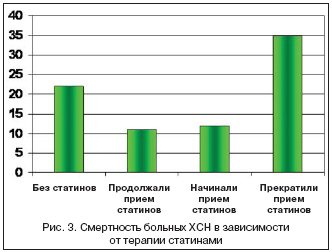
–Т –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –Њ–±—Б–µ—А–≤–∞—Ж–Є–Њ–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г 900 –±–Њ–ї—М–љ—Л—Е –•–°–Э –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ –Є–ї–Є –љ–∞—З–∞–ї–Њ —В–µ—А–∞–њ–Є–Є —Б—В–∞—В–Є–љ–∞–Љ–Є –њ—А–Є–≤–Њ–і–Є—В –Ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –≤ —В–µ—З–µ–љ–Є–µ –і–≤—Г—Е–ї–µ—В–љ–µ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Б—В–∞—В–Є–љ—Л (11,0, 11,9 –Є 22% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, p<0,01) [25]. –Ю–і–љ–∞–Ї–Њ –љ–∞–Є–±–Њ–ї—М—И–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М –±—Л–ї–∞ –Њ—В–Љ–µ—З–µ–љ–∞ –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ—А–µ–Ї—А–∞—В–Є–≤—И–Є—Е –њ—А–Є–µ–Љ —Б—В–∞—В–Є–љ–Њ–≤ (34,8%, p<0,05 –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –≥—А—Г–њ–њ–Њ–є –±–µ–Ј –ї–µ—З–µ–љ–Є—П —Б—В–∞—В–Є–љ–∞–Љ–Є) (—А–Є—Б. 3).
–Т –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –≤–Ї–ї—О—З–∞–≤—И–µ–Љ 88 –±–Њ–ї—М–љ—Л—Е –•–°–Э –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ —Б –§–Т<40%, –≤ –≤–Њ–Ј—А–∞—Б—В–µ –љ–µ —Б—В–∞—А—И–µ 75 –ї–µ—В, –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ–∞ –≤ —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј–µ 20 –Љ–≥ –≤ –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –•–°–Э –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б—П—Ж–µ–≤ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–∞—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Г–ї—Г—З—И–µ–љ–Є–µ–Љ –Ї–ї–Є–љ–Є–Ї–Њ–—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е –•–°–Э –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —Б—В–∞–і–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Ґ–µ—А–∞–њ–Є—П —Б–Є–Љ–≤–∞—Б—В–∞—В–Є–љ–Њ–Љ –њ—А–Є–≤–µ–ї–∞ –Ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ –Є –љ–µ–є—А–Њ–≥–Њ—А–Љ–Њ–љ–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–6 (—Б 16,0 (10,0–30,0) –і–Њ 10,0 –њ–≥/–Љ–ї (7,6–16,0), p<0,05) –Є –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ II (—Б 10,0 (7,6–16,0) –і–Њ 4,8 (3,8–6,0), p<0,05), —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –≤–ї–Є—П–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є —Д—Г–љ–Ї—Ж–Є—О —Н–љ–і–Њ—В–µ–ї–Є—П —Г –±–Њ–ї—М–љ—Л—Е –•–°–Э.
–Ш–Ј–Љ–µ–љ–µ–љ–Є–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –ї–Є–љ–µ–є–љ—Л—Е –Є –Њ–±—К–µ–Љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≤–љ—Г—В—А–Є—Б–µ—А–і–µ—З–љ–Њ–є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є (–Ъ–Ф–†, –Ъ–°–†, –Ъ–Ф–Ю, –Ъ–°–Ю, –Є–љ–і–µ–Ї—Б —Б—Д–µ—А–Є—З–љ–Њ—Б—В–Є), —Г–ї—Г—З—И–µ–љ–Є–µ–Љ –≥–µ–Њ–Љ–µ—В—А–Є–Є –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞ –Є –µ–≥–Њ —Б–Њ–Ї—А–∞—В–Є–Љ–Њ—Б—В–Є (–§–Т –Ы–Ц —Б 38% (31–40%) –і–Њ 42% (35–45%), p<0,05).
–Т –љ–µ–і–∞–≤–љ–Њ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є TNT, –≤–Ї–ї—О—З–∞–≤—И–µ–Љ 10001 –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Ш–С–°, —Б—А–∞–≤–љ–Є–≤–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М 80 –Љ–≥ –Є 10 –Љ–≥ –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞. –Э–∞–Ј–љ–∞—З–µ–љ–Є–µ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞ –њ—А–Є–≤–µ–ї–Њ –Ї —Б–љ–Є–ґ–µ–љ–Є—О –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –њ–Њ –њ–Њ–≤–Њ–і—Г –•–°–Э –љ–∞ 26% (HR 0,74 [0,59–0,94], p=0,01) [93].
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —А–∞–Ј—А–Њ–Ј–љ–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е, –і–Њ –љ–µ–і–∞–≤–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –µ—Й–µ –љ–µ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –Ї—А—Г–њ–љ–Њ–Љ–∞—Б—И—В–∞–±–љ–Њ–≥–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –Њ—Ж–µ–љ–Ї–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б—В–∞—В–Є–љ–Њ–≤ –њ—А–Є –•–°–Э. –Т –і–µ–Ї–∞–±—А–µ 2007 –≥. –±—Л–ї–Є –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ—Л –њ–µ—А–≤—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П CORONA (Controlled Rosuvastain Multinational Trial in Heart Failure), –≤–Ї–ї—О—З–∞–≤—И–µ–≥–Њ 5011 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –•–°–Э –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ [94].
–Ъ–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —П–≤–ї—П–ї–∞—Б—М —Б–Љ–µ—А—В—М –Њ—В —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є–ї–Є –љ–µ—Д–∞—В–∞–ї—М–љ—Л–є –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞/–њ—А–Є—Б—В—Г–њ —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–Є (–≤—А–µ–Љ—П –і–Њ –њ–µ—А–≤–Њ–≥–Њ —Б–Њ–±—Л—В–Є—П). –Т–Њ–њ—А–µ–Ї–Є –Њ–ґ–Є–і–∞–љ–Є—П–Љ —В–µ—А–∞–њ–Є—П —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ 32,8 –Љ–µ—Б—П—Ж–µ–≤ –љ–µ –њ—А–Є–≤–µ–ї–∞ –Ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –Ї–∞–Ї –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Є, —В–∞–Ї –Є –µ–µ —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е [95]. –Я—А–Є —Н—В–Њ–Љ –ї–µ—З–µ–љ–Є–µ —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ–Њ–Љ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —З–Є—Б–ї–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –њ–Њ –ї—О–±—Л–Љ –њ—А–Є—З–Є–љ–∞–Љ, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ, –∞ —В–∞–Ї–ґ–µ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –•–°–Э (—А–Є—Б. 4).
–°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ—Б—В–∞–≤–Є–ї 73 –≥–Њ–і–∞, –Њ–і–љ–∞–Ї–Њ –±–Њ–ї–µ–µ 40% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Є –≤ –≤–Њ–Ј—А–∞—Б—В–µ —Б—В–∞—А—И–µ 75 –ї–µ—В. –Ф–∞–љ–љ—Л–є —Д–∞–Ї—В –Є –Њ—З–µ–љ—М –∞–Ї—В–Є–≤–љ–∞—П —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–∞—П —В–µ—А–∞–њ–Є—П –•–°–Э (–±–Њ–ї–µ–µ 90% –±–Њ–ї—М–љ—Л—Е –њ–Њ–ї—Г—З–∞–ї–Є –Є–љ–≥–Є–±–Є—В–Њ—А—Л –Р–Я–§ –Є–ї–Є –±–ї–Њ–Ї–∞—В–Њ—А—Л —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Ї –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ—Г II, –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В—Л –Є –і–Є—Г—А–µ—В–Є–Ї–Є), –њ–Њ –Љ–љ–µ–љ–Є—О —А—П–і–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є, –љ–µ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є –≤ –њ–Њ–ї–љ–Њ–є –Љ–µ—А–µ –њ–Њ–Ї–∞–Ј–∞—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Б—В–∞—В–Є–љ–Њ–≤ –њ—А–Є –•–°–Э.
–Т –µ—Й–µ –Њ–і–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ GISSI, –њ—А–Њ—Е–Њ–і—П—Й–µ–µ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П, –≤–Ї–ї—О—З–µ–љ—Л –Њ–Ї–Њ–ї–Њ 7 —В—Л—Б. –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –≤ –≥—А—Г–њ–њ—Л, –Ї–Њ—В–Њ—А—Л–µ –±—Г–і—Г—В –њ–Њ–ї—Г—З–∞—В—М —А–Њ–Ј—Г–≤–∞—Б—В–∞—В–Є–љ –Є–ї–Є –њ–ї–∞—Ж–µ–±–Њ [96]. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В CORONA –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ GISSI –≤–Ї–ї—О—З–µ–љ—Л –њ–∞—Ж–Є–µ–љ—В—Л –Ї–∞–Ї —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є, —В–∞–Ї –Є –љ–µ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –•–°–Э. –Ъ–Њ–љ–µ—З–љ—Л–Љ–Є —В–Њ—З–Ї–∞–Љ–Є —Н—В–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —П–≤–ї—П—О—В—Б—П –Њ–±—Й–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М –Є–ї–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є —Б –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–µ–є –≤ —Б–≤—П–Ј–Є —Б —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л —Н—В–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –і–µ—В–∞–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П CORONA, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –њ—А–µ–і–Њ—Б—В–∞–≤—П—В –±–Њ–ї–µ–µ —В–Њ—З–љ—Л–є –Њ—В–≤–µ—В –љ–∞ –≤–Њ–њ—А–Њ—Б –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —Б—В–∞—В–Є–љ–Њ–≤ –±–Њ–ї—М–љ—Л–Љ –•–°–Э.


–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. van der Harst P., Voors A.A., van Gilst W.H., Bo?hm M., van Veldhuisen D.J. Statins in the treatment of chronic heart failure: A systematic review. PLoS Med, 2006, 3(8): e333. 1403–13.
2. Rauchhaus M., Clark A.L., Doehner W., Davos C., Bolger A., Sharma R., Coats A.J., Anker S.D. The relationship between cholesterol and survival in patients with chronic heart failure. J Am Coll Cardiol 2003; 43:1933–40.
3. Iribarren C. Cohort study of serum total cholesterol and in–hospital incidence of infectious diseases. Epidemiol Infect 1998; 121:335–47.
4. Pacelli F. Prognosis in intra–abdominal infections. Multivariate analysis on 604 patients. Arch Surg 1996; 131:641–5.
5. Onder G., Landi F., Volpato S., Fellin R., Carbonin P., Gambassi G. et al. Serum cholesterol levels and in–hospital mortality in the elderly. Am J Med 2003; 115:265–71.
6. Weverling–Rijnsburger A.W.E., Blauw G.J., Lagaay A.M., Knook D.L., Meinders A.E., Westendorp R.G.J. Total cholesterol and risk of mortality in the oldest old. Lancet 1997; 350:1119–23.
7. Corti M.C., Guralnik J.M., Salive M.E., Harris T., Ferrucci L., Glynn R.J. et al. Clarifying the Direct Relation between Total Cholesterol Levels and Death from Coronary Heart Disease in Older Persons. Ann Intern Med 1997; 126:753–60.
8. Schatz I.J., Masaki K., Yano K., Chen R., Rodriguez B.L., Curb J.D. Cholesterol and all–cause mortality in elderly people from the Honolulu Heart Program: a cohort study. Lancet 2001; 358:351–5.
9. Kannel W.B. Epidemiology of heart failure. Am Heart J 1991; 121:951–7.
10. Hoffman R.M. Modifiable risk factors for incident heart failure in the coronary artery surgery study. Arch Intern Med 1994; 154:417–23.
11. Wilhelmsen L. Heart failure in the general population of men—morbidity, risk factors and prognosis. J Intern Med 2001; 249:253–61.
12. Coughlin S.S. Predictors of mortality from idiopathic dilated cardiomyopathy in 356,222 men screened for the Multiple Risk Factor Intervention Trial. Am J Epidemiol 1994; 139:166–72.
13. Kronmal R.A. Total serum cholesterol levels and mortality risk as a function of age. A report based on the Framingham data. Arch Intern Med 1993; 153:1065–73.
14. Mungall M.M., Gaw A. Statin therapy in the elderly. Curr Opin Lipidol, 2004, 15:453–457.
15. Vredevoe D.L., Woo M.A., Doering L.V., Brecht M.L., Hamilton M.A., Fonarow G.C. Skin test anergy in advanced heart failure secondary to either ischemic or idiopathic dilated cardiomyopathy. Am J Cardiol 1998; 82:323–8.
16. Horwich T.B., Hamilton M.A., Maclellan W.R., Fonarow G.C. Low serum total cholesterol is associated with marked increase in mortality in advanced heart failure. J Card Fail 2002; 8:216–24.
17. Mozaffarian D., Nye R., Levy W.C. Statin therapy is associated with lower mortality among patients with severe heart failure. Am J Cardiol 2004; 93:1124–9.
18. Rauchhaus M., Koloczek V., Volk H., Kemp M., Niebauer J., Francis D.P. et al. Inflammatory cytokines and the possible immunological role for lipoproteins in chronic heart failure. Int J Cardiol 2000; 76:125–33.
19. Richartz B.M., Radovancevic B., Frazier O.H., Vaughn W.K., Taegtmeyer H. Low serum cholesterol levels predict high perioperative mortality in patients supported by a left–ventricular assist system. Cardiology 1998; 89:184–8.
20. Rosolova H., Cech J., Simon J., Spinar J., Jandova R.,Widimsky sen J. et al. Short to long term mortality of patients hospitalised with heart failure in the Czech Republica report from the EuroHeart Failure Survey. Eur J Heart Fail 2005; 7:780–3.
21. Christ M., Klima T., Grimm W., Mueller H.H., Maisch B. Prognostic significance of serum cholesterol levels in patients with idiopathic dilated cardiomyopathy. Eur Heart J 2006; 27:691–9.
22. Kalantar–Zadeh K., Block G., Horwich T., Fonarow G.C. Reverse epidemiology of conventional cardiovascular risk factors in patients with chronic heart failure. J Am Coll Cardiol 2004; 43:1439–44.
23. Anker S.D., Chua T.P., Ponikowski P., Harrington D., Swan J.W., Kox W.J. et al. Hormonal Changes and Catabolic/Anabolic Imbalance in Chronic Heart Failure and Their Importance for Cardiac Cachexia. Circulation 1997; 96:526–34.
24. Araujo J.P. et al. Cholesterol—A marker of nutritional status in mild to moderate heart failure. Int J Cardiol, 2007, doi:10.1016/j.ijcard.2007.05.026.
25. Loh P.H. et al. The effects of initiation or continuation of statin therapy on cholesterol level and all–cause mortality after the diagnosis of left ventricular systolic dysfunction Am Heart J 2007; 153:537–44.
26. Krum H. et al. Statins and symptomatic chronic systolic heart failure: A post–hoc analysis of 5010 patients enrolled in Val–HeFT. Int J Cardiol 2007, 119:48–53.
27. Niebauer J., Volk H.D., Kemp M., Dominguez M., Schumann R.R., Rauchhaus M. et al. Endotoxin and immune activation in chronic heart failure: a prospective cohort study. Lancet 1999; 353:1838–42.
28. Rauchhaus M., Coats A.J., Anker S.D. The endotoxin–lipoprotein hypothesis. Lancet 2000; 356:930–3.
29. Rundek T., Naini A., Sacco R., Coates K., DiMauro S. Atorvastatin decreases the coenzyme Q10 level in the blood of patients at risk for cardiovascular disease and stroke. Arch Neurol 2004; 61:889–92.
30. Watts G.F. Plasma coenzyme Q (ubiquinone) concentrations in patients treated with simvastatin. J Clin Pathol 1993; 46:1055–7
31. Pepe S. et al. Coenzyme Q10 in cardiovascular disease. Mitochondrion 2007; 7: 154–167.
32. Mortensen S.A. Overview on coenzyme Q10 as adjunctive therapy in chronic heart failure. Rationale, design and end–points of “Qsymbio”— a multinational trial. Biofactors 2003; 18:79–89.
33. Moosmann B., Behl C. Selenoprotein synthesis and side–effects of statins. Lancet 2004; 363:892–4.
34. Warner G.J., Berry M.J., Moustafa M.E., Carlson B.A., Hatfield D.L., Faust J.R. Inhibition of selenoprotein synthesis by selenocysteine tRNA [Ser]Sec lacking isopentenyladenosine. J Biol Chem 2000; 275:28110–9.
35. Yokoyama I., Ohtake T., Momomura S., Nishikawa J., Sasaki Y., Omata M. Reduced coronary flow reserve in hypercholesterolemic patients without overt coronary stenosis. Circulation 1996; 94:3232–8.
36. Kaufmann P.A., Gnecchi–Ruscone T., Schafers K.P., Luscher T.F., Camici P.G. Low density lipoprotein cholesterol and coronary microvascular dysfunction in hypercholesterolemia. J Am Coll Cardiol 2000; 36:103–9.
37. Baller D., Notohamiprodjo G., Gleichmann U., Holzinger J., Weise R., Lehmann J. Improvement in coronary flow reserve determined by positron emission tomography after 6 months of cholesterol–lowering therapy in patients with early stages of coronary atherosclerosis. Circulation 1999; 99:2871–5.
38. Katz S.D., Hryniewicz K., Hriljac I., Balidemaj K., Dimayuga C., Hudaihed A. et al. Vascular endothelial dysfunction and mortality risk in patients with chronic heart failure. Circulation. 2005; 111:310–314.
39. Chong A.Y., Blann A.D., Patel J., Freestone B., Hughes E., Lip G.Y. Endothelial dysfunction and damage in congestive heart failure: relation of flow–mediated dilation to circulating endothelial cells, plasma indexes of endothelial damage, and brain natriuretic peptide. Circulation 2004; 110:1794–8.
40. Rikitake Y., Liao J.K. Rho GTPases, statins, and nitric oxide. Circ Res 2005; 97:1232–5.
41. Asselbergs F.W., van der Harst P., Jessurun G.A.J., Tio R.A., van Gilst W.H. Clinical impact of vasomotor function assessment and the role of ACE–inhibitors and statins. Vascul Pharmacol 2005; 42:125–40.
42. Tousoulis D. et al. Statins in heart failure. Beyond the lipid lowering effect Int J Cardiol 2007; 115:144–150.
43. Bates K., Ruggeroli C.E., Goldman S., Gaballa M.A. Simvastatin restores endothelial NO–mediated vasorelaxation in large arteries after myocardial infarction. Am J Physiol Heart Circ Physiol 2002; 283:H768–75.
44. Trochu J.N., Mital S., Zhang X. et al. Preservation of NO production by statins in the treatment of heart failure. Cardiovasc Res 2003; 60:250–8.
45. Takayama T., Wada A., Tsutamoto T. et al. Contribution of vascular NAD(P)H oxidase to endothelial dysfunction in heart failure and the therapeutic effects of HMG–CoA reductase inhibitor. Circ J 2004; 68: 1067–75.
46. Tousoulis D., Antoniades C., Bosinakou E. et al. Effects of atorvastatin on reactive hyperaemia and the thrombosis–fibrinolysis system in patients with heart failure. Heart 2005; 91:27–31.
47. Strey C.H., Young J.M., Molyneux S.L. et al. Endothelium–ameliorating effects of statin therapy and coenzyme Q10 reductions in chronic heart failure. Atherosclerosis 2005; 179:201–6.
48. Landmesser U., Engberding N., Bahlmann F.H., Schaefer A., Wiencke A., Heineke A. et al. Statin–induced improvement of endothelial progenitor cell mobilization, myocardial neovascularization, left ventricular function, and survival after experimental myocardial infarction requires endothelial nitric oxide synthase. Circulation 2004; 110:1933–9.
49. Hernandez–Perera O., Perez–Sala D., Navarro–Antolin J. et al. Effects of the 3–hydroxy–3–methylglutaryl–CoA reductase inhibitors, atorvastatin and simvastatin, on the expression of endothelin–1 and endothelial nitric oxide synthase in vascular endothelial cells. J Clin Invest 1998; 101:2711–9.
50. van der Harst P., Wagenaar L.J., Buikema H., Voors A.A., Plokker H.W., Morshuis W.J. et al. Effect of intensive versus moderate lipid lowering on endothelial function and vascular responsiveness to angiotensin ii in stable coronary artery disease. Am J Cardiol 2005; 96:1361–4.
51. Ito M., Adachi T., Pimentel D.R., Ido Y., Colucci W.S. Statins inhibit {beta}–adrenergic receptor–stimulated apoptosis in adult rat ventricular myocytes via a Rac1–dependent mechanism. Circulation 2004; 110:412–8.
52. Liao J.K. Statin therapy for cardiac hypertrophy and heart failure. J Investig Med 2004; 52:248–53.
53. Delbosc S., Cristol J.P., Descomps B., Mimran A., Jover B. Simvastatin prevents angiotensin II–induced cardiac alteration and oxidative stress. Hypertension 2002; 40:142–7.
54. Lee T.M., Chou T.F., Tsai C.H. Association of pravastatin and left ventricular mass in hypercholesterolemic patients: role of 8–isoprostaglandin f2alpha formation. J Cardiovasc Pharmacol 2002; 40 (6):868–74.
55. Bellosta S., Via D., Canavesi M., Pfister P., Fumagalli R., Paoletti R. et al. HMG–CoA reductase inhibitors reduce MMP–9 secretion by macrophages. Arterioscler Thromb Vasc Biol 1998; 18:1671–8.
56. Furman C., Copin C., Kandoussi M., Davidson R., Moreau M., McTaggiart F. et al. Rosuvastatin reduces MMP–7 secretion by human monocyte–derived macrophages: potential relevance to atherosclerotic plaque stability. Atherosclerosis 2004; 174:93–8.
57. Lima J.A., Desai M.Y., Steen H., Warren W.P., Gautam S., Lai S. Statininduced cholesterol lowering and plaque regression after 6 months of magnetic resonance imaging–monitored therapy. Circulation 2004; 110:2336–41.
58. Pasceri V., Patti G., Nusca A., Pristipino C., Richichi G., Di Sciascio G. ARMYDA Investigators. Randomized trial of atorvastatin for reduction of myocardial damage during coronary intervention: results from the ARMYDA (Atorvastatin for Reduction of MYocardial Damage during Angioplasty) study. Circulation. 2004 Aug 10; 110(6): 674–8.
59. Young–Xu Y., Jabbour S., Goldberg R., Blatt C.M., Graboys T., Bilchik B., Ravid S. Usefulness of statin drugs in protecting against atrial fibrillation in patients with coronary artery disease. Am J Cardiol. 2003; 92: 1379–1383.
60. Mosterd A., Cost B., Hoes A.W., de Bruijne M.C., Deckers J.W., Hofman A., Grobbee D.E. The prognosis of heart failure in the general population: the Rotterdam Study. Eur Heart J. 2001; 22:1318 –1327.
61. Feldman A.M., Combes A., Wagner D., Kadakomi T., Kubota T., You Li Y. et al. The role of tumor necrosis factor in the pathophysiology of heart failure. J Am Coll Cardiol 2000; 35:537–44.
62. Kapadia S. The role of cytokines in the failing human heart. Cardiol Clin 1998; 16:645.
63. Blum A., Miller H. Pathophysiological role of cytokines in congestive heart failure. Annu Rev Med 2001; 52:15–27.
64. Node K., Fujita M., Kitakaze M., Hori M., Liao J.K. Short–term statin therapy improves cardiac function and symptoms in patients with idiopathic dilated cardiomyopathy. Circulation 2003; 108:839–43.
65. van der Harst P., Voors A.A., Van Veldhuisen D.J. Short–term statin therapy and cardiac function and symptoms in patients with idiopathic dilated cardiomyopathy. Circulation 2004; 109:e34.
66. Rezaie–Majd A., Prager G.W., Bucek R.A. et al. Simvastatin reduces the expression of adhesion molecules in circulating monocytes from hypercholesterolemic patients. Arterioscler Thromb Vasc Biol 2003; 23 (3):397–403.
67. Zapolska–Downar D., Siennicka A., Kaczmarczyk M., Kolodziej B., Naruszewicz M. Simvastatin modulates TNFalpha–induced adhesion molecules expression in human endothelial cells. Life Sci 2004;75 (11):1287–302.
68. Tousoulis D., Antoniades C., Bosinakou E. et al. Effects of atorvastatin on reactive hyperemia and inflammatory process in patients with congestive heart failure. Atherosclerosis 2005;178(2):359–63.
69. Lip G.Y., Gibbs C.R. Does heart failure confer a hypercoagulable state? Virchow’s triad revisited. J Am Coll Cardiol. 1999 Apr;33(5):1424–6.
70. Schafer A., Fraccarollo D., Eigenthaler M. et al. Rosuvastatin reduces platelet activation in heart failure: role of NO bioavailability. Arterioscler Thromb Vasc Biol 2005; 25(5):1071–7.
71. Bauersachs J., Galuppo P., Fraccarollo D., Christ M., Ertl G. Improvement of left ventricular remodeling and function by hydroxymethylglutaryl coenzyme a reductase inhibition with cerivastatin in rats with heart failure after myocardial infarction. Circulation 2001;104:982–5.
72. Hayashidani S., Tsutsui H., Shiomi T., Suematsu N., Kinugawa S., Ide T. et al. Fluvastatin, a 3–hydroxy–3–methylglutaryl coenzyme A reductase inhibitor, attenuates left ventricular remodeling and failure after experimental myocardial infarction. Circulation 2002; 105: 868–73.
73. Marz W., Siekmeier R., Muller H.M., Wieland H., Gross W., Olbrich H.G. Effects of lovastatin and pravastatin on the survival of hamsters with inherited cardiomyopathy. J Cardiovasc Pharmacol Ther 2000; 5:275–9.
74. Zaca V. et al. Chronic Monotherapy With Rosuvastatin Prevents Progressive Left Ventricular Dysfunction and Remodeling in Dogs With Heart Failure. J Am Coll Cardiol 2007; 50:551–7.
75. Sacks F.M., Pfeffer M.A., Moye L.A., Rouleau J.L., Rutherford J.D., Cole T.G. et al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. N Engl J Med 1996; 335:1001–9.
76. Segal R., Pitt B., Poole–Wilson P., Sharma D., Bradstreet D.C., Ikeda L.S. Effects of HMG–CoA reductase inhibitors (statins) in patients with heart failure. Eur J Heart Fail 2000; 2(Suppl 2): 96.
77. Kjekshus J., Pedersen T.R., Olsson A.G., Faergeman O., Pyorala K. The effects of simvastatin on the incidence of heart failure in patients with coronary heart disease. J Card Fail 1997; 3:249–54.
78. The effects of cholesterol lowering with simvastatin on cause–specific mortality and on cancer incidence in 20,536 high–risk people: a randomised placebo–controlled trial BMC Med 2005, 3:6.
79. Mozaffarian D., Nye R., Levy W.C. Statin therapy is associated with lower mortality among patients with severe heart failure. Am J Cardiol 2004; 93:1124–9.
80. Hognestad A., Dickstein K., Myhre E., Snapinn S., Kjekshus J. Effect of combined statin and beta–blocker treatment on one–year morbidity and mortality after acute myocardial infarction associated with heart failure. Am J Cardiol 2004; 93:603–6.
81. Krum H. et al. Statins and symptomatic chronic systolic heart failure: A post–hoc analysis of 5010 patients enrolled in Val–HeFT. Int J Cardiol 2007, 119:48–53.
82. Dickinson M.G. Statin use was associated with reduced mortality in both ischemic and nonischemic cardiomyopathy and in patients with implantable defibrillators: Mortality data and mechanistic insights from the Sudden Cardiac Death in Heart Failure Trial (SCD–HeFT) Am Heart J 2007; 153:573–8
83. Foody J.M. Statins and Mortality Among Elderly Patients Hospitalized With Heart Failure Circulation. 2006;113:1086–1092.
84. Horwich T., MacLellan W., Fonarow G. Statin therapy is associated with improved survival in ischemic and non–ischemic heart failure. J Am Coll Cardiol. 2004; 43:642–648.
85. Fukuta H., Sane D.C., Brucks S., Little W.C. Statin therapy may be associated with lower mortality in patients with diastolic heart failure. Circulation. 2005; 112:357–363.
86. Martinez–Selles M. Statin use and prognosis in patients with advanced heart failure Int J Cardiol, 2007; 118:135–137.
87. Laufs U., Wassmann S., Schackmann S., Heeschen C., Bohm M., Nickenig G. Beneficial effects of statins in patients with non–ischemic heart failure. Z Kardiol 2004; 93:103–8.
88. Gurgun C. et al. The effects of short term statin treatment on left ventricular function and inflammatory markers in patients with chronic heart failure. Int J Cardiol 2007, [Epub ahead of print] doi:10.1016/j.ijcard.2006.11.152.
89. Krum H. et al. Double–Blind, Randomized, Placebo–Controlled Study of High–Dose HMG CoA Reductase Inhibitor Therapy on Ventricular Remodeling, Pro–Inflammatory Cytokines and Neurohormonal Parameters in Patients With Chronic Systolic Heart Failure J Cardiac Fail 2007;13:1–7.
90. Bleske B.E. et al. Neutral Effect on Markers of Heart Failure, Inflammation, Endothelial Activation and Function, and Vagal Tone After High–Dose HMG–CoA Reductase Inhibition in Non–Diabetic Patients With Non–Ischemic Cardiomyopathy and Average Low–Density Lipoprotein Level J Am Coll Cardiol 2006; 47:338–41.
91. Sola S. Atorvastatin Improves Left Ventricular Systolic Function and Serum Markers of Inflammation in Nonischemic Heart Failure. J Am Coll Cardiol 2006; 47: 332–7.
92. Yamada T. et al. Long–term effect of atorvastatin on neurohumoral activation and cardiac function in patients with chronic heart failure: A prospective randomized controlled study Am Heart J 2007; 153:1055.e1–1055.e8.
93. LaRosa J.C., Grundy S.M., Waters D.D., Shear C., Barter P., Fruchart J.C. et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005; 352:1425–35.
94. Kjekshus J., Dunselman P., Blideskog M., Eskilson C., Hjalmarson A., McMurray J.V. et al. A statin in the treatment of heart failure? Controlled rosuvastatin multinational study in heart failure (CORONA): study design and baseline characteristics. Eur J Heart Fail 2005; 7:1059–69.
95. Kjekshus J. Rosuvastatin in Older Patients with Systolic Heart Failure. N Engl J Med 2007;357.
96. Tavazzi L., Tognoni G., Franzosi M.G., Latini R., Maggioni A.P., Marchioli R. et al. Rationale and design of the GISSI heart failure trial: a large trial to assess the effects of n–3 polyunsaturated fatty acids and rosuvastatin in symptomatic congestive heart failure. Eur J Heart Fail 2004; 6:635–41.












