–Ф–Њ–Ї–∞–Ј–∞–љ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –†–Р–Р–° –і–ї—П —А–∞–Ј–≤–Є—В–Є—П –њ–Њ—А–∞–ґ–µ–љ–Є—П —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є, –Ї–∞–Ї –Њ—А–≥–∞–љ–∞––Љ–Є—И–µ–љ–Є –Р–У, –Њ–њ—А–µ–і–µ–ї—П–µ—В –Є–љ—В–µ—А–µ—Б –Ї –∞–љ–≥–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–Љ —Б–≤–Њ–є—Б—В–≤–∞–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –±–ї–Њ–Ї–Є—А—Г—О—Й–Є—Е —Н—В—Г —Б–Є—Б—В–µ–Љ—Г.
–С–Њ–ї—М—И–Є–љ—Б—В–≤—Г –±–Њ–ї—М–љ—Л—Е –Р–У –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –Р–Ф —В—А–µ–±—Г–µ—В—Б—П –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П. –Ф–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –±–ї–Њ–Ї–∞—В–Њ—А–∞ –†–Р–Р–° –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–Љ –Ї–∞–ї—М—Ж–Є—П (–Р–Ъ) –љ–µ —В–Њ–ї—М–Ї–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г—Б–Є–ї–µ–љ–Є—О –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞, –љ–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ–±–Є—В—М—Б—П —Б–Є–љ–µ—А–≥–Є–Ј–Љ–∞ –Њ—А–≥–∞–љ–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л—Е —Б–≤–Њ–є—Б—В–≤ –і–≤—Г—Е –Ї–ї–∞—Б—Б–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Э–∞–њ—А–Є–Љ–µ—А, –∞–Љ–ї–Њ–і–Є–њ–Є–љ, –Њ–і–Є–љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≥—А—Г–њ–њ—Л –Р–Ъ, –Њ–±–ї–∞–і–∞–µ—В —А—П–і–Њ–Љ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤: —Г–Љ–µ–љ—М—И–∞–µ—В –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ—Л–є —Б—В—А–µ—Б—Б, —В–Њ–ї—Й–Є–љ—Г –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –Є–љ—В–Є–Љ–∞––Љ–µ–і–Є–∞, —А–Є–≥–Є–і–љ–Њ—Б—В—М –∞—А—В–µ—А–Є–є, –њ–Њ–і–∞–≤–ї—П–µ—В –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Љ–∞—В—А–Є–Ї—Б–љ–Њ–є –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–∞–Ј—Л–1 –Є –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–ї–Є—В–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М, –њ–Њ–≤—Л—И–∞–µ—В —Н–Ї—Б–њ—А–µ—Б—Б–Є—О eNOS. –≠—В–Є —Н—Д—Д–µ–Ї—В—Л –Њ–Ї–∞–Ј—Л–≤–∞—О—В –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –љ–∞ –Њ—А–≥–∞–љ—Л––Љ–Є—И–µ–љ–Є.
–Т –њ—А–µ–і–ї–∞–≥–∞–µ–Љ–Њ–Љ –≤–∞—И–µ–Љ—Г –≤–љ–Є–Љ–∞–љ–Є—О –Њ–±–Ј–Њ—А–µ —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–љ—Л –і–∞–љ–љ—Л–µ –Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –±–ї–Њ–Ї–∞—В–Њ—А –†–Р–Р–°/–і–Є–≥–Є–і—А–Њ–њ–Є—А–Є–і–Є–љ–Њ–≤—Л–є –Р–Ъ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —А–∞–Ј–љ—Л—Е –Њ—В–і–µ–ї–Њ–≤ —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А—Г—Б–ї–∞.
–Ь–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–µ —А—Г—Б–ї–Њ
–Ь–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–µ —А—Г—Б–ї–Њ – –Љ–µ–ї—М—З–∞–є—И–∞—П —Б—В—А—Г–Ї—В—Г—А–љ–Њ–—Д—Г–љ–Ї—Ж–Є–љ–∞–ї—М–љ–∞—П –µ–і–Є–љ–Є—Ж–∞ —Б–Є—Б—В–µ–Љ—Л –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П, –≥–і–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ –Љ–µ–ґ–і—Г —В–Њ–Ї–Њ–Љ –Ї—А–Њ–≤–Є –Є —А–∞–±–Њ—В–Њ–є —В–Ї–∞–љ–Є, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–µ–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є–µ –Ї–ї–µ—В–Њ—З–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є. –Ю—Б–љ–Њ–≤–љ–∞—П —Ж–µ–њ—М —А–µ–≥—Г–ї—П—Ж–Є–Є –≤ —Б–Є—Б—В–µ–Љ–µ –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є –≤–Ї–ї—О—З–∞–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є—О –Є–ї–Є —Г–≥–љ–µ—В–µ–љ–Є–µ –≥–ї–∞–і–Ї–Є—Е –Љ–Є–Њ—Ж–Є—В–Њ–≤ –Є –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –≥–µ–Њ–Љ–µ—В—А–Є–Є –Ї–∞–њ–Є–ї–ї—П—А–љ–Њ–≥–Њ —А—Г—Б–ї–∞ –≤ –Њ—В–≤–µ—В –љ–∞ –љ–µ–є—А–Њ–≥—Г–Љ–Њ—А–∞–ї—М–љ—Л–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П –≥–Є–і—А–∞–≤–ї–Є—З–µ—Б–Ї–Њ–µ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ, —Б–ї–µ–і—Б—В–≤–Є–µ–Љ —З–µ–≥–Њ —П–≤–ї—П–µ—В—Б—П –Є–љ—В–µ–љ—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Є–ї–Є –Њ—Б–ї–∞–±–ї–µ–љ–Є–µ –Ї–∞–њ–Є–ї–ї—П—А–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Є–ї–Є —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ —В—А–∞–љ—Б—Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є. –Э–∞—А—Г—И–µ–љ–Є–µ –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –Ї–ї—О—З–µ–≤–Њ–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –њ–Њ–≤—Л—И–µ–љ–Є—П –Њ–±—Й–µ–≥–Њ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П (–Ю–Я–°–°) –њ—А–Є –Р–У. –†–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–≥–Њ —А—Г—Б–ї–∞ –њ—А–Є –Р–У –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –≥–Є–њ–µ—А—В—А–Њ—Д–Є–µ–є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –њ—А–Њ—Б–≤–µ—В–∞ —Б–Њ—Б—Г–і–∞, –Њ–±–ї–Є—В–µ—А–∞—Ж–Є–µ–є —Б–Њ—Б—Г–і–Њ–≤, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А—Г—О—Й–Є—Е –Ї–∞–њ–Є–ї–ї—П—А–Њ–≤ – —А–∞—А–µ—Д–Є–Ї–∞—Ж–Є–Є [1,2]. –≠–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В —Б—Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞—В—М –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ —В–Њ–Љ, —З—В–Њ –і–Є—Д—Д—Г–Ј–љ–∞—П —Б–Є—Б—В–µ–Љ–љ–∞—П —А–∞—А–µ—Д–Є–Ї–∞—Ж–Є—П –Љ–Є–Ї—А–Њ—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А—Г—Б–ї–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є –Р–У [3,4].
–Т –Њ—Б–љ–Њ–≤–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–≥–Њ —А—Г—Б–ї–∞ –ї–µ–ґ–Є—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –≥–Є–њ–µ—А—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞—А—В–µ—А–Є–Њ–ї –љ–∞ –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–љ—Л–µ —Б—В–Є–Љ—Г–ї—Л, —Б–ї–µ–і—Б—В–≤–Є–µ–Љ –Ї–Њ—В–Њ—А–Њ–є —Б—В–∞–љ–Њ–≤–Є—В—Б—П –Є—Е —Б–њ–∞–Ј–Љ –≤–њ–ї–Њ—В—М –і–Њ –њ–Њ–ї–љ–Њ–≥–Њ –Ј–∞–Ї—А—Л—В–Є—П, —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ–Ї—Б–Є–і–∞ –∞–Ј–Њ—В–∞ [5].
–° —Ж–µ–ї—М—О –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–≥–Њ —А—Г—Б–ї–∞ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П —А—П–і –Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е (–±–Є–Њ–њ—Б–Є—П –њ–Њ–і–Ї–Њ–ґ–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є –Ї–ї–µ—В—З–∞—В–Ї–Є) –Є –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е (–ї–∞–Ј–µ—А–љ–∞—П –і–Њ–њ–њ–ї–µ—А–Њ–≤—Б–Ї–∞—П —Д–ї–Њ—Г–Љ–µ—В—А–Є—П, –Ї–∞–њ–Є–ї–ї—П—А–љ–∞—П –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—П, —Б–њ–µ–Ї—В—А–Њ–Љ–µ—В—А–Є—П, –Є–Ј–Њ—В–Њ–њ–љ—Л–µ –Љ–µ—В–Њ–і—Л –Є –і—А.) –Љ–µ—В–Њ–і–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–Њ—В–Њ—А—Л—Е –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Љ–µ—А–µ –Њ–≥—А–∞–љ–Є—З–µ–љ–Њ. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є –љ–∞–Є–±–Њ–ї–µ–µ –њ—А–Є–Љ–µ–љ–Є–Љ—Л–Љ –Љ–∞—А–Ї–µ—А–Њ–Љ –Љ–Є–Ї—А–Њ—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П —П–≤–ї—П–µ—В—Б—П –Њ—Ж–µ–љ–Ї–∞ –Љ–Є–Ї—А–Њ–∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є–Є. –Ь–Є–Ї—А–Њ–∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є—П (–Ь–Р–£) – —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–є —Д–∞–Ї—В–Њ—А –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –Є –њ–Њ—З–µ—З–љ–Њ–≥–Њ –њ—А–Њ–≥–љ–Њ–Ј–∞, –∞ —В–∞–Ї–ґ–µ –≤–∞–ґ–љ—Л–є –Ї—А–Є—В–µ—А–Є–є –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ–Њ—З–Є –љ–∞ –љ–∞–ї–Є—З–Є–µ –Ь–Р–£ —П–≤–ї—П–µ—В—Б—П –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Р–У [6–8]. –Э–∞–ї–Є—З–Є–µ –Ь–Р–£ —П–≤–ї—П–µ—В—Б—П –њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –†–Р–Р–°.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є the MicroAlbuminuria Reduction with VALsartan (MARVAL) —Г 332 –±–Њ–ї—М–љ—Л—Е –°–Ф 2 —В–Є–њ–∞ –Є –Ь–Р–£ –Є–Ј—Г—З–∞–ї–Њ—Б—М –≤–ї–Є—П–љ–Є–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –≤ –і–Њ–Ј–µ 80 –Љ–≥ –њ—А–Њ—В–Є–≤ –∞–Љ–ї–Њ–і–Є–њ–Є–љ–∞ –≤ –і–Њ–Ј–µ 5 –Љ–≥ –љ–∞ –≤–µ–ї–Є—З–Є–љ—Г —Н–Ї—Б–Ї—А–µ—Ж–Є–Є –±–µ–ї–Ї–∞ —Б –Љ–Њ—З–Њ–є –≤ —В–µ—З–µ–љ–Є–µ 24 –љ–µ–і–µ–ї—М [9]. –Я—А–Є –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є–Є –Р–Ф —Н–Ї—Б–Ї—А–µ—Ж–Є—П –∞–ї—М–±—Г–Љ–Є–љ–∞ –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ —Б–љ–Є–Ј–Є–ї–∞—Б—М –љ–∞ 44%, –≤ –≥—А—Г–њ–њ–µ –∞–Љ–ї–Њ–і–Є–њ–Є–љ–∞ – –љ–∞ 8%. –Ф–Њ–ї—П –±–Њ–ї—М–љ—Л—Е, –і–Њ—Б—В–Є–≥—И–Є—Е —Г—А–Њ–≤–љ—П –љ–Њ—А–Љ–Њ–∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є–Є, –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ (29,9%) –±—Л–ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ —В–∞–Ї–Њ–≤–Њ–є –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –∞–Љ–ї–Њ–і–Є–њ–Є–љ–∞ (14,5%). –°–љ–Є–ґ–µ–љ–Є–µ —Н–Ї—Б–Ї—А–µ—Ж–Є–Є –∞–ї—М–±—Г–Љ–Є–љ–∞ —Б –Љ–Њ—З–Њ–є –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –љ–∞—З–Є–љ–∞–ї–Њ—Б—М —Г–ґ–µ —Б –њ–µ—А–≤—Л—Е –љ–µ–і–µ–ї—М –ї–µ—З–µ–љ–Є—П –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –і–Њ–Ј—Л 80 –Љ–≥/—Б—Г—В.
–Т —П–њ–Њ–љ—Б–Ї–Њ–Љ –Њ—В–Ї—А—Л—В–Њ–Љ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є SMART [10] —Г –±–Њ–ї—М–љ—Л—Е —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ 2 —В–Є–њ–∞ –Є –Ь–Р–£ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ—В–љ–Њ—И–µ–љ–Є–µ –∞–ї—М–±—Г–Љ–Є–љ/–Ї—А–µ–∞—В–Є–љ–Є–љ –≤ –Љ–Њ—З–µ –≤ –≥—А—Г–њ–њ–µ –ї–µ—З–µ–љ–Є—П –≤–∞–ї—Б–∞—А—В–∞–љ–Њ–Љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–Ј–Є–ї–Њ—Б—М –љ–∞ 32%, –∞ –≤ –≥—А—Г–њ–њ–µ –ї–µ—З–µ–љ–Є—П –∞–Љ–ї–Њ–і–Є–њ–Є–љ–Њ–Љ – —Г–≤–µ–ї–Є—З–Є–ї–Њ—Б—М –љ–∞ 18%; –і–Њ–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї –Њ—В–Љ–µ—З–µ–љ —А–µ–≥—А–µ—Б—Б –Ь–Р–£, –±—Л–ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї—М—И–µ –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –∞–Љ–ї–Њ–і–Є–њ–Є–љ–Њ–Љ.
–°–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –Є –∞–Љ–ї–Њ–і–Є–њ–Є–љ–∞ –њ—А–Є–≤–Њ–і–Є—В—М –Ї —Б–љ–Є–ґ–µ–љ–Є—О –Ь–Р–£ –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е –Р–У –±–µ–Ј —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞ —Б 1–2 —Б—В–∞–і–Є–µ–є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є –њ–Њ—З–µ–Ї: –і–Њ–±–∞–≤–ї–µ–љ–Є–µ –∞–Љ–ї–Њ–і–Є–њ–Є–љ–∞ –Ї —В–µ—А–∞–њ–Є–Є –≤–∞–ї—Б–∞—А—В–∞–љ–Њ–Љ –њ—А–Є–≤–µ–ї–Є –Ї –і–∞–ї—М–љ–µ–є—И–µ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –Ь–Р–£ [11].
–Р—А—В–µ—А–Є–Є —Б—А–µ–і–љ–µ–≥–Њ –Ї–∞–ї–Є–±—А–∞
–Ф–ї—П —Б–Њ—Б—Г–і–Њ–≤ –Љ—Л—И–µ—З–љ–Њ–≥–Њ –Є –Љ—Л—И–µ—З–љ–Њ–—Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ —В–Є–њ–∞ –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –њ—А–Є –Р–У —П–≤–ї—П–µ—В—Б—П –≥–Є–њ–µ—А—В—А–Њ—Д–Є—П —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є, –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –Ї–Њ—В–Њ—А–Њ–є —Г –±–Њ–ї—М–љ—Л—Е –Р–У —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –≤—Л–њ–Њ–ї–љ–µ–љ–Є–µ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–Њ–љ–љ—Л—Е –∞—А—В–µ—А–Є–є —Б –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ —В–Њ–ї—Й–Є–љ—Л –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ «–Є–љ—В–Є–Љ–∞––Љ–µ–і–Є–∞» (–Ґ–Ш–Ь). –°–Њ–љ–љ—Л–µ –∞—А—В–µ—А–Є–Є —З–∞—Б—В–Њ –љ–∞–Ј—Л–≤–∞—О—В «–Њ–Ї–љ–Њ–Љ», –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є–Љ —Г–≤–Є–і–µ—В—М —А–∞–љ–љ–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞. –Я—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Ґ–Ш–Ь —Б–Њ–љ–љ—Л—Е –∞—А—В–µ—А–Є–є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —А–Є—Б–Ї–∞ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Є—Б—Е–Њ–і–Њ–≤ —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –і–Њ–Ї—Г–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–Њ. –Ф–∞–љ–љ—Л–µ –†–Њ—В—В–µ—А–і–∞–Љ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ґ–Ш–Ь –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є (–Њ—В 0,75 –і–Њ 0,91 –Љ–Љ) —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –њ–µ—А–≤–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ –≤ 4,8 —А–∞–Ј–∞, –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ –Њ—В –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ (–Љ—Г–ґ—Б–Ї–Њ–є –њ–Њ–ї, –≤–Њ–Ј—А–∞—Б—В, –Љ–∞—Б—Б–∞ —В–µ–ї–∞, –Ї—Г—А–µ–љ–Є–µ, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В –Є –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є—П). –≠—В–Њ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М —Б–њ—А–∞–≤–µ–і–ї–Є–≤–Њ –Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –њ–µ—А–≤–Њ–≥–Њ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ [12]. –Р–љ–∞–ї–Є–Ј –і–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П Atherosclerosis Risk in Communities (ARIC), –Њ—Е–≤–∞—В—Л–≤–∞–≤—И–µ–≥–Њ 15 —В—Л—Б. —З–µ–ї–Њ–≤–µ–Ї, –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї, —З—В–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ґ–Ш–Ь –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –Њ—В 0,6 –і–Њ 1 –Љ–Љ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —А–Њ—Б—В–Њ–Љ —З–∞—Б—В–Њ—В—Л –Ш–С–° —Г –Љ—Г–ґ—З–Є–љ –≤ 4,3 —А–∞–Ј–∞, —Г –ґ–µ–љ—Й–Є–љ – –≤ 19,5 —А–∞–Ј–∞ [13].
–¶–µ–љ–љ–Њ—Б—В—М —Б–љ–Є–ґ–µ–љ–Є—П –Р–Ф per se –і–ї—П —Г–Љ–µ–љ—М—И–µ–љ–Є—П –Ґ–Ш–Ь –±—Л–ї–∞ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В–Є—А–Њ–≤–∞–љ–∞ –≤ –њ–Є–ї–Њ—В–љ–Њ–Љ –Њ–і–љ–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤ —А–∞–Љ–Ї–∞—Е –њ—А–Њ–≥—А–∞–Љ–Љ—Л SHEP —Г 129 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–є –Р–У: —А–µ–≥—А–µ—Б—Б –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Њ—В–Љ–µ—З–∞–ї—Б—П —В–Њ–ї—М–Ї–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–Ї—В–Є–≤–љ—Г—О —В–µ—А–∞–њ–Є—О. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –±—Л–ї–Є –њ–Њ–Ї–∞–Ј–∞–љ—Л –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П —Б–љ–Є–ґ–µ–љ–Є—П –Р–Ф per se [14].
–Р–љ—В–∞–≥–Њ–љ–Є—Б—В—Л –Ї–∞–ї—М—Ж–Є—П –Є –±–ї–Њ–Ї–∞—В–Њ—А—Л –†–Р–Р–° –Њ–±–ї–∞–і–∞—О—В –Њ–±—И–Є—А–љ–Њ–є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –±–∞–Ј–Њ–є –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –Є—Е —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Ј–∞–Љ–µ–і–ї—П—В—М –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –Њ—Ж–µ–љ–Є–≤–∞–µ–Љ—Л–µ –њ–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О –Ґ–Ш–Ь [14–20].
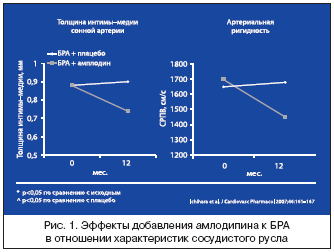
–Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є—П –±–ї–Њ–Ї–∞—В–Њ—А–∞ –†–Р–Р–° –Є –Р–Ъ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –Њ–±–ї–∞–і–∞–µ—В –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ґ–Ш–Ь, —З–µ–Љ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ–Є. –Т –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ 50 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–У, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –±–ї–Њ–Ї–∞—В–Њ—А –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (–С–†–Р, –≤–∞–ї—Б–∞—А—В–∞–љ, –ї–Њ–Ј–∞—А—В–∞–љ –Є–ї–Є –Ї–∞–љ–і–µ—Б–∞—А—В–∞–љ), –і–Њ–±–∞–≤–ї–µ–љ–Є–µ –∞–Љ–ї–Њ–і–Є–њ–Є–љ–∞ –≤ —В–µ—З–µ–љ–Є–µ 12 –Љ–µ—Б—П—Ж–µ–≤ –ї–µ—З–µ–љ–Є—П –њ—А–Є–≤–µ–ї–Њ –Ї –і–∞–ї—М–љ–µ–є—И–µ–Љ—Г —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Ґ–Ш–Ь —Б 0,88±0,08 –і–Њ 0,75±0,06 –Љ–Љ (—А–Є—Б. 1) –±–µ–Ј –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Р–Ф –њ–Њ –і–∞–љ–љ—Л–Љ —Б—Г—В–Њ—З–љ–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є—П –Р–Ф [21].
–Р–Њ—А—В–∞ –Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–µ –Р–Ф
–Ч–љ–∞—З–µ–љ–Є–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф –і–ї—П —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –∞–Ї—В–Є–≤–љ–Њ –Є–Ј—Г—З–∞–µ—В—Б—П [22,23]. –°–Ї–Њ—А–Њ—Б—В—М —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—П –њ—Г–ї—М—Б–Њ–≤–Њ–є –≤–Њ–ї–љ—Л (–°–†–Я–Т) –Љ–µ–ґ–і—Г —Б–Њ–љ–љ–Њ–є –Є –±–µ–і—А–µ–љ–љ–Њ–є –∞—А—В–µ—А–Є–µ–є —Б—З–Є—В–∞–µ—В—Б—П «–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ» –Њ—Ж–µ–љ–Ї–Є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –∞–Њ—А—В—Л. –Ч–љ–∞—З–µ–љ–Є–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є, –Њ—Ж–µ–љ–µ–љ–љ–Њ–є –њ–Њ –°–†–Я–Т, –і–ї—П —А–Є—Б–Ї–∞ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –≤ —А—П–і–µ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Ї–∞–Ї —Г –±–Њ–ї—М–љ—Л—Е –Р–У, —В–∞–Ї –Є –≤ –Њ–±—Й–µ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є. –Э–∞—З–Є–љ–∞—П —Б 2007 –≥., –Њ—Ж–µ–љ–Ї–∞ –°–†–Я–Т –Љ–µ–ґ–і—Г —Б–Њ–љ–љ–Њ–є –Є –±–µ–і—А–µ–љ–љ–Њ–є –∞—А—В–µ—А–Є–µ–є —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б —Ж–µ–ї—М—О –≤—Л—П–≤–ї–µ–љ–Є—П –њ–Њ—А–∞–ґ–µ–љ–Є—П –Њ—А–≥–∞–љ–Њ–≤––Љ–Є—И–µ–љ–µ–є –њ—А–Є –Р–У [6,7,24]. –° –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В—М—О —В–µ—Б–љ–Њ —Б–≤—П–Ј–∞–љ–Њ –Є–Ј—Г—З–µ–љ–Є–µ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф, –і–ї—П –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤ —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–µ –њ—А–µ–і—Б–Ї–∞–Ј—Л–≤–∞—О—Й–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —Г—А–Њ–≤–љ–µ–Љ –Р–Ф, —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –Є–Ј–Љ–µ—А—П–µ–Љ—Л–Љ –љ–∞ —Г—А–Њ–≤–љ–µ –њ–ї–µ—З–µ–≤–Њ–є –∞—А—В–µ—А–Є–Є [23].
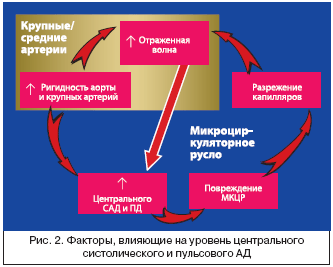
–Я–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—П —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ (–∞–Њ—А—В–∞–ї—М–љ–Њ–≥–Њ) –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П. –Т —Г—А–Њ–≤–µ–љ—М –∞–Њ—А—В–∞–ї—М–љ–Њ–≥–Њ –Р–Ф –≤–љ–Њ—Б—П—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–є –≤–Ї–ї–∞–і –Є —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ –∞–Њ—А—В—Л (–°–†–Я–Т), –Є —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А—Г—Б–ї–∞ – –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Є—Б—В–Њ—З–љ–Є–Ї–∞ –Њ—В—А–∞–ґ–µ–љ–љ—Л—Е –≤–Њ–ї–љ. –Э–∞ –∞–Љ–њ–ї–Є—В—Г–і—Г –Њ—В—А–∞–ґ–µ–љ–љ–Њ–є –≤–Њ–ї–љ—Л, –њ–Њ–Љ–Є–Љ–Њ —А–Є–≥–Є–і–љ–Њ—Б—В–Є –∞–Њ—А—В—Л, –≤–ї–Є—П–µ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –∞—А—В–µ—А–Є–є —Б—А–µ–і–љ–µ–≥–Њ –Ї–∞–ї–Є–±—А–∞ (–Ґ–Ш–Ь) –Є –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–≥–Њ —А—Г—Б–ї–∞ (—А–Є—Б. 2). –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–µ –Р–Ф —П–≤–ї—П–µ—В—Б—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Њ–є, –Є–љ—В–µ–≥—А–Є—А—Г—О—Й–µ–є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —А–∞–Ј–љ—Л—Е –Њ—В–і–µ–ї–∞—Е —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А—Г—Б–ї–∞. –Ч–љ–∞—З–µ–љ–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П –Є –≤ –љ–µ–і–∞–≤–љ–Њ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е [25–28], —З—В–Њ –Њ–њ—А–µ–і–µ–ї—П–µ—В –Є–љ—В–µ—А–µ—Б –Ї –Є–Ј—Г—З–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Њ–≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –Є—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–є.
–°–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –†–Р–Р–° –Є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ –Ї–∞–ї—М—Ж–Є—П –њ—А–Є–≤–Њ–і–Є—В—М –Ї –Њ–±—А–∞—В–љ–Њ–Љ—Г —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—О –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–≥–Њ —А—Г—Б–ї–∞ –Є –∞—А—В–µ—А–Є–є –Љ—Л—И–µ—З–љ–Њ–—Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ —В–Є–њ–∞, –Є—Е –≤–∞–Ј–Њ–і–Є–ї–∞—В–Є—А—Г—О—Й–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ –і–µ–ї–∞—О—В —Н—В—Г –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є–≤–ї–µ–Ї–∞—В–µ–ї—М–љ–Њ–є.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ ASCOT–CAF–Х (Conduit Artery Function Evaluation) —Б—В–∞–ї–Њ –≤–∞–ґ–љ—Л–Љ —Н—В–∞–њ–Њ–Љ –≤ –Є–Ј—Г—З–µ–љ–Є–Є —Н—Д—Д–µ–Ї—В–Њ–≤ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф [29]. –Т —Н—В—Г —З–∞—Б—В—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П ASCOT –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ 2199 –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –±–ї–Њ–Ї–∞—В–Њ—А –†–Р–Р–°/–∞–Љ–ї–Њ–і–Є–њ–Є–љ –Є–ї–Є b––±–ї–Њ–Ї–∞—В–Њ—А/—В–Є–∞–Ј–Є–і–љ—Л–є –і–Є—Г—А–µ—В–Є–Ї. –Я—А–Є –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї–µ –Ј–∞ —Г—А–Њ–≤–љ–µ–Љ –Р–Ф –≤ –њ–ї–µ—З–µ–≤–Њ–є –∞—А—В–µ—А–Є–Є —Г —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П ASCOT–CAFE —А–∞—Б—З–µ—В–љ–Њ–µ —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –Є –њ—Г–ї—М—Б–Њ–≤–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ –≤ –∞–Њ—А—В–µ –±—Л–ї–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –љ–Є–ґ–µ –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –ї–µ—З–µ–љ–Є–µ –±–ї–Њ–Ї–∞—В–Њ—А–Њ–Љ –†–Р–Р–°/–Р–Ъ. –Ю—В—Б—Г—В—Б—В–≤–Є–µ —А–∞–Ј–ї–Є—З–Є–є –≤ —Н—Д—Д–µ–Ї—В–∞—Е —А–µ–ґ–Є–Љ–Њ–≤ —В–µ—А–∞–њ–Є–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –°–†–Я–Т –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–і–µ–ї–∞—В—М –≤—Л–≤–Њ–і, —З—В–Њ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф –±—Л–ї–Њ –і–Њ—Б—В–Є–≥–љ—Г—В–Њ –Ј–∞ —Б—З–µ—В —А–∞–Ј–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –Њ—В—А–∞–ґ–µ–љ–љ–Њ–є –≤–Њ–ї–љ—Л. –Р—Г–≥–Љ–µ–љ—В–∞—Ж–Є–Њ–љ–љ—Л–є –Є–љ–і–µ–Ї—Б, –Њ—В—А–∞–ґ–∞—О—Й–Є–є –њ—А–Њ—Ж–µ–љ—В –њ—А–Є—А–Њ—Б—В–∞ –°–Р–Ф –Ј–∞ —Б—З–µ—В –≤–Њ–ї–љ—Л –Њ—В—А–∞–ґ–µ–љ–Є—П, –±—Л–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї—М—И–µ –љ–∞ 6,5% (95% –Ф–Ш 5,8–7,3–Ц p<0,0001) –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є, –Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–є –љ–∞ b––±–ї–Њ–Ї–∞—В–Њ—А–µ/—В–Є–∞–Ј–Є–і–љ–Њ–Љ –і–Є—Г—А–µ—В–Є–Ї–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –±–ї–Њ–Ї–∞—В–Њ—А–Њ–Љ –†–Р–Р–°/–Р–Ъ. –†–∞–Ј–ї–Є—З–Є—П —Н—Д—Д–µ–Ї—В–Њ–≤ —А–µ–ґ–Є–Љ–Њ–≤ —В–µ—А–∞–њ–Є–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф –Њ–±—Б—Г–ґ–і–∞–ї–Є—Б—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ–і–љ–Њ–≥–Њ –Є–Ј –Њ–±—К—П—Б–љ–µ–љ–Є–є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П ASCOT–BPLA, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –±–ї–Њ–Ї–∞—В–Њ—А–Њ–Љ –†–Р–Р–°/–Р–Ъ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–∞ —Б–≤–Њ–Є –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б–љ–Є–ґ–µ–љ–Є—П –Њ–±—Й–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞–і –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–µ–є b––±–ї–Њ–Ї–∞—В–Њ—А/—В–Є–∞–Ј–Є–і–љ—Л–є –і–Є—Г—А–µ—В–Є–Ї [30].
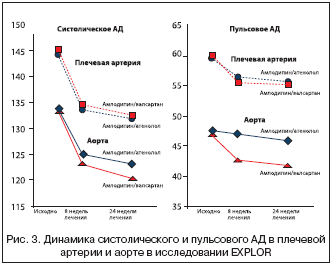
–Я–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –і–Є–≥–Є–і—А–Њ–њ–Є—А–Є–і–Є–љ–Њ–≤–Њ–≥–Њ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞ –Ї–∞–ї—М—Ж–Є—П —Б –±–ї–Њ–Ї–∞—В–Њ—А–Њ–Љ –†–Р–Р–° –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф –±—Л–ї–Њ –њ–Њ–ї—Г—З–µ–љ–Њ –Є –≤ –і—А—Г–≥–Њ–Љ –Љ—Г–ї—М—В–Є—Ж–µ–љ—В—А–Њ–≤–Њ–Љ, –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є EXPLOR [31,32]. –Т —Н—В–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є 393 –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Р–У, –љ–µ–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–є –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –∞–Љ–ї–Њ–і–Є–њ–Є–љ–Њ–Љ 5 –Љ–≥/—Б—Г—В., –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –≤ –≥—А—Г–њ–њ—Л –∞–Љ–ї–Њ–і–Є–њ–Є–љ/–≤–∞–ї—Б–∞—А—В–∞–љ 5/80 –Љ–≥/—Б—Г—В. –Є–ї–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –∞–Љ–ї–Њ–і–Є–њ–Є–љ–∞ –Є –∞—В–µ–љ–Њ–ї–Њ–ї–∞ 5/50 –Љ–≥/—Б—Г—В. –Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є—П –∞–Љ–ї–Њ–і–Є–њ–Є–љ–∞ –Є –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–∞—Б—М –≤ –≤–Є–і–µ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –≠–Ї—Б—Д–Њ—А–ґ. –І–µ—А–µ–Ј 8 –љ–µ–і–µ–ї—М –њ–Њ—Б–ї–µ –њ–µ—А–µ–≤–Њ–і–∞ –љ–∞ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Г—О —В–µ—А–∞–њ–Є—О –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Г–≤–µ–ї–Є—З–Є–ї–Є—Б—М –і–Њ –∞–Љ–ї–Њ–і–Є–њ–Є–љ/–≤–∞–ї—Б–∞—А—В–∞–љ 10/160 –Љ–≥ –Є–ї–Є –∞–Љ–ї–Њ–і–Є–њ–Є–љ/–∞—В–µ–љ–Њ–ї–Њ–ї 10/100 –Љ–≥. –Я–µ—А–≤–Є—З–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –±—Л–ї–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф, –≤—В–Њ—А–Є—З–љ—Л–Љ–Є – –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –њ—Г–ї—М—Б–Њ–≤–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, –Є–љ–і–µ–Ї—Б–∞ –∞—Г–≥–Љ–µ–љ—В–∞—Ж–Є–Є, –°–†–Я–Т. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї–µ–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –≤ –≥—А—Г–њ–њ–µ, –њ–Њ–ї—Г—З–∞—О—Й–µ–є –≤–∞–ї—Б–∞—А—В–∞–љ/–∞–Љ–ї–Њ–і–Є–њ–Є–љ (–13,7±1,15 –Љ–Љ —А—В.—Б—В., —А<0,0001), —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –∞—В–µ–љ–Њ–ї–Њ–ї/–∞–Љ–ї–Њ–і–Є–њ–Є–љ (–9,7±1,1 –Љ–Љ —А—В.—Б—В., —А<0,0001) –њ—А–Є —А–∞–≤–љ–Њ–Љ —Н—Д—Д–µ–Ї—В–µ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Р–Ф –≤ –њ–ї–µ—З–µ–≤–Њ–є –∞—А—В–µ—А–Є–Є (—А–Є—Б. 3). –†–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є —Б–Њ—Б—В–∞–≤–Є–ї–Є 4,0 –Љ–Љ —А—В.—Б—В., —А=0,013. –¶–µ–љ—В—А–∞–ї—М–љ–Њ–µ –њ—Г–ї—М—Б–Њ–≤–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ —В–∞–Ї–ґ–µ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–Њ —Б–љ–Є–ґ–∞–ї–Њ—Б—М –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞/–∞–Љ–ї–Њ–і–Є–њ–Є–љ–∞, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –∞—В–µ–љ–Њ–ї–Њ–ї–∞/–∞–Љ–ї–Њ–і–Є–њ–Є–љ–∞: —А–∞–Ј–ї–Є—З–Є–µ –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є —Б–Њ—Б—В–∞–≤–Є–ї–Њ 3,7 –Љ–Љ —А—В.—Б—В., —А<0,0001. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –∞–Љ–ї–Њ–і–Є–њ–Є–љ/–≤–∞–ї—Б–∞—А—В–∞–љ –±—Л–ї–∞ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б–љ–Є–ґ–µ–љ–Є—П –Є–љ–і–µ–Ї—Б–∞ –њ—А–Є—А–Њ—Б—В–∞ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф: —А–∞–Ј–ї–Є—З–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б–Њ—Б—В–∞–≤–Є–ї–Є 6,5% –≤ –њ–Њ–ї—М–Ј—Г –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –±–ї–Њ–Ї–∞—В–Њ—А –†–Р–Р–°/–∞–љ—В–∞–≥–Њ–љ–Є—Б—В –Ї–∞–ї—М—Ж–Є—П. –°–љ–Є–ґ–µ–љ–Є–µ –°–†–Я–Т —Б–Њ—Б—В–∞–≤–Є–ї–Њ 0,95 –Љ/—Б –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –∞—В–µ–љ–Њ–ї–Њ–ї–∞ –і–Њ–±–∞–≤–ї–µ–љ–Є–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –њ—А–Є–≤–µ–ї–Њ –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –∞–Љ–њ–ї–Є—Д–Є–Ї–∞—Ж–Є–Є –Я–Ф – —Д–µ–љ–Њ–Љ–µ–љ—Г, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ–Љ—Г –Ј–∞ —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф.
–Ф–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є—П –Љ–µ–ґ–і—Г —Н—Д—Д–µ–Ї—В–∞–Љ–Є –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –°–†–Я–Т –Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф, –љ–∞–±–ї—О–і–∞–≤—И–∞—П—Б—П –≤–Њ –Љ–љ–Њ–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е (–≤ —В–Њ–Љ —З–Є—Б–ї–µ ASCOT–CAFE –Є EXPLOR), –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–±—К—П—Б–љ–µ–љ–∞ —В–µ–Љ, —З—В–Њ –°–†–Я–Т —П–≤–ї—П–µ—В—Б—П –Р–Ф––Ј–∞–≤–Є—Б–Є–Љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ –Є —А–µ–ґ–Є–Љ—Л –ї–µ—З–µ–љ–Є—П —Б —А–∞–≤–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –љ–∞ —Г—А–Њ–≤–µ–љ—М —Б—А–µ–і–љ–µ–≥–Њ –Р–Ф –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –љ–∞–≥—А—Г–Ј–Ї–Є –љ–∞ —Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б—В–µ–љ–Ї—Г, –Ї–Њ—В–Њ—А–∞—П, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –Є –Њ–њ—А–µ–і–µ–ї—П–µ—В –µ–µ —А–Є–≥–Є–і–љ–Њ—Б—В—М. –Ф–Є–љ–∞–Љ–Є–Ї–∞ –ґ–µ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф, –Ї–∞–Ї –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –≤—Л—И–µ, –Ј–∞–≤–Є—Б–Є—В –љ–µ —В–Њ–ї—М–Ї–Њ –Њ—В –Є–Ј–Љ–µ–љ–µ–љ–Є—П –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є, –љ–Њ –Є –Њ—В —Н—Д—Д–µ–Ї—В–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ —А—Г—Б–ї–∞.
–Т –Ї–Њ–љ—В–µ–Ї—Б—В–µ —Б—А–∞–≤–љ–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Њ–≤ –і–≤—Г—Е –љ–∞–Є–±–Њ–ї–µ–µ –∞–Ї—В–Є–≤–љ–Њ –Є–Ј—Г—З–∞–µ–Љ—Л—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–є –С–†–Р – —Б —В–Є–∞–Ј–Є–і–љ—Л–Љ –і–Є—Г—А–µ—В–Є–Ї–Њ–Љ –Є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–Љ –Ї–∞–ї—М—Ж–Є—П – –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В—Б—П –Є–љ—В–µ—А–µ—Б–љ—Л–Љ–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П J–CORE [33], –≤ –Ї–Њ—В–Њ—А–Њ–Љ –њ–∞—Ж–Є–µ–љ—В—Л —Б –Р–У, –љ–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–є –љ–∞ —Д–Њ–љ–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Њ–ї–Љ–µ—Б–∞—А—В–∞–љ–Њ–Љ 20 –Љ–≥, —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–ї–Є—Б—М –і–ї—П –і–Њ–±–∞–≤–ї–µ–љ–Є—П –≥–Є–і—А–Њ—Е–ї–Њ—А–Њ—В–Є–Ј–Є–і–∞ 12,5 –Љ–≥ –Є–ї–Є –і–Є–≥–Є–і—А–Њ–њ–Є—А–Є–і–Є–љ–Њ–≤–Њ–≥–Њ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞ –Ї–∞–ї—М—Ж–Є—П –∞–Ј–µ–ї–љ–Є–і–Є–њ–Є–љ–∞ 16 –Љ–≥. –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ–µ—А–Є–Њ–і–∞ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б–Њ—Б—В–∞–≤–Є–ї–∞ 24 –љ–µ–і–µ–ї–Є. –І–µ—А–µ–Ј 24 –љ–µ–і–µ–ї–Є —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф –≤ –њ–ї–µ—З–µ–≤–Њ–є –∞—А—В–µ—А–Є–Є –±—Л–ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ—Л –Ї–∞–Ї –њ–Њ –і–∞–љ–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–Ј–Љ–µ—А–µ–љ–Є—П, —В–∞–Ї –Є –њ–Њ –і–∞–љ–љ—Л–Љ —Б—Г—В–Њ—З–љ–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є—П (–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ 131,7 –Љ–Љ —А—В.—Б—В. –≤ –≥—А—Г–њ–њ–µ –±–ї–Њ–Ї–∞—В–Њ—А –†–Р–Р–°/–Р–Ъ –Є 134,4 –Љ–Љ —А—В.—Б—В. –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П, —Б—А–µ–і–љ–µ—Б—Г—В–Њ—З–љ–Њ–µ 130,2 –Є 130,9 –Љ–Љ —А—В.—Б—В. —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ). –Ю–і–љ–∞–Ї–Њ —Г—А–Њ–≤–µ–љ—М —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф –≤ –∞–Њ—А—В–µ –±—Л–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–∞ 5,2 –Љ–Љ —А—В.—Б—В. –љ–Є–ґ–µ –≤ –≥—А—Г–њ–њ–µ –±–ї–Њ–Ї–∞—В–Њ—А –†–Р–Р–° /–Р–Ъ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –±–ї–Њ–Ї–∞—В–Њ—А –†–Р–Р–°/–Ґ–Ф.
–Я—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Њ–≤–Њ–і—П—Й–µ–≥–Њ—Б—П –≤ –љ–∞—И–µ–є –Ї–ї–Є–љ–Є–Ї–µ –љ–∞ –±–∞–Ј–µ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є «–Э–µ–Є–љ–≤–∞–Ј–Є–≤–љ–Њ–є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є» —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ –±–Њ–ї—М–љ—Л—Е —Б –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є –Р–У (n=14, —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 47,5 –≥–Њ–і–∞), –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ–µ—А–µ–≤–Њ–і –±–Њ–ї—М–љ—Л—Е —Б –Р–У, –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–є –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —В–µ–ї–Љ–Є—Б–∞—А—В–∞–љ 80 –Љ–≥/–≥–Є–і—А–Њ—Е–ї–Њ—А–Њ—В–Є–∞–Ј–Є–і 12,5 –Љ–≥ (–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Р–Ф 132,5±4,2/83,5±3,2 –Љ–Љ —А—В.—Б—В. –Є –Р–Ф –њ—А–Є —Б–∞–Љ–Њ–Ї–Њ–љ—В—А–Њ–ї–µ 129,6±5,0/80,4±4,8 –Љ–Љ —А—В.—Б—В.), –љ–∞ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ—Г—О –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –≤–∞–ї—Б–∞—А—В–∞–љ 160 –Љ–≥/–∞–Љ–ї–Њ–і–Є–њ–Є–љ 10 –Љ–≥ (–≠–Ї—Б—Д–Њ—А–ґ) —З–µ—А–µ–Ј 12 –љ–µ–і–µ–ї—М —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ–Љ –Ї–Њ–љ—В—А–Њ–ї—П –Р–Ф –њ–Њ –і–∞–љ–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–Ј–Љ–µ—А–µ–љ–Є—П (134,1±6,2/84,7±4,1 –Љ–Љ —А—В.—Б—В.) –Є —Б–∞–Љ–Њ–Ї–Њ–љ—В—А–Њ–ї—П (128,9±6,1/82,9±5,2 –Љ–Љ —А—В.—Б—В.). –Я—А–Є —Н—В–Њ–Љ –Њ—В–Љ–µ—З–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф —Б–Њ 123,3±5,3 –і–Њ 119,1±4,6 –Љ–Љ —А—В.—Б—В., –Є–љ–і–µ–Ї—Б–∞ –њ—А–Є—А–Њ—Б—В–∞ —Б 23,5±7,1 –і–Њ 20,2±6,5%, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –∞–Љ–њ–ї–Є—Д–Є–Ї–∞—Ж–Є–Є –Я–Ф —Б–Њ 134,5±10,2 –і–Њ 140,6±11,4%. –Т–∞–ґ–љ–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –њ–µ—А–µ—Е–Њ–і –љ–∞ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –С–†–Р/–і–Є–≥–Є–і—А–Њ–њ–Є—А–Є–і–Є–љ–Њ–≤—Л–є –Р–Ъ –њ—А–Є–≤–µ–ї –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Г–ґ–µ –і–Њ—Б—В–Є–≥–љ—Г—В—Л–Љ —А–∞–љ–µ–µ –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –Р–Ф. –Э–∞–Є–±–Њ–ї–µ–µ –≤–µ—А–Њ—П—В–љ—Л–Љ –Њ–±—К—П—Б–љ–µ–љ–Є–µ–Љ –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–∞—П –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–∞—П –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є—П, –і–Њ—Б—В–Є–≥–љ—Г—В–∞—П –њ—А–Є –њ–µ—А–µ—Е–Њ–і–µ –љ–∞ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О, —Б–Њ–і–µ—А–ґ–∞—Й—Г—О –і–Є–≥–Є–і—А–Њ–њ–Є—А–і–Є–љ–Њ–≤—Л–є –Р–Ъ.
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –љ–∞–Љ–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В –≤–Ј–∞–Є–Љ–љ–Њ–µ —Г—Б–Є–ї–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Њ–≤ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –†–Р–Р–° –Є –і–Є–≥–Є–і—А–Њ–њ–Є—А–Є–і–Є–љ–Њ–≤—Л—Е –Р–Ъ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –і–ї—П —Б–љ–Є–ґ–µ–љ–Є—П —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф. –Т —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –і–≤–Њ–є–љ–Њ–Љ —Б–ї–µ–њ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –≤–ї–Є—П–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–є —А–∞–Ј–љ—Л—Е –Ї–ї–∞—Б—Б–Њ–≤ –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е –Ш–°–Р–У (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 68 –ї–µ—В) –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –њ—Г–ї—М—Б–Њ–≤–Њ–є –≤–Њ–ї–љ—Л –Є–Љ–µ–љ–љ–Њ –±–ї–Њ–Ї–∞—В–Њ—А –†–Р–Р–° (–12 –Љ–Љ —А—В.—Б—В.) –Є –і–Є–≥–Є–і—А–Њ–њ–Є—А–Є–і–Є–љ–Њ–≤—Л–є –Р–Ъ (–23 –Љ–Љ —А—В.—Б—В.) –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ–Є –і–ї—П —Б–љ–Є–ґ–µ–љ–Є—П —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Р–Ф, –Њ–њ–µ—А–µ–і–Є–≤ —В–Є–∞–Ј–Є–і–љ—Л–є –і–Є—Г—А–µ—В–Є–Ї (–11 –Љ–Љ —А—В.—Б—В.) –Є b––∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А (–6 –Љ–Љ —А—В.—Б—В.) [34].
–Ф–∞–љ–љ—Л–µ –Њ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–Љ —Н—Д—Д–µ–Ї—В–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –С–†–Р/–Р–Ъ, —З–µ–Љ –С–†–Р/–Ґ–Ф, –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –Є –Ї–Њ–ї–ї–µ–≥–∞–Љ–Є –Є–Ј –Т–Њ–ї–≥–Њ–≥—А–∞–і—Б–Ї–Њ–≥–Њ –У–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ –£–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ [35]. –Т –Њ—В–Ї—А—Л—В–Њ–Љ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–У, –љ–∞—А—Г—И–µ–љ–љ–Њ–є —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В—М—О –Ї –≥–ї—О–Ї–Њ–Ј–µ –Є –≤—Л—Б–Њ–Ї–Њ–є —Б–Ї–Њ—А–Њ—Б—В—М—О —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—П –њ—Г–ї—М—Б–Њ–≤–Њ–є –≤–Њ–ї–љ—Л (–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –°–Р–Ъ–°–Х–°) —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–∞—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –∞–Љ–ї–Њ–і–Є–њ–Є–љ/–≤–∞–ї—Б–∞—А—В–∞–љ 5/80 –Љ–≥ (–≠–Ї—Б—Д–Њ—А–ґ) –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≤ —В–µ—З–µ–љ–Є–µ 12 –љ–µ–і–µ–ї—М –Њ–Ї–∞–Ј–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–µ–µ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –ї–Њ–Ј–∞—А—В–∞–љ/–≥–Є–і—А–Њ—Е–ї–Њ—А–Њ—В–Є–∞–Ј–Є–і 50/12,5 –Љ–≥ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Р–Ф –≤ –њ–ї–µ—З–µ–≤–Њ–є –∞—А—В–µ—А–Є–Є –Є —Б–љ–Є–ґ–µ–љ–Є—П –°–†–Я–Т –љ–∞ –Ї–∞—А–Њ—В–Є–і–љ–Њ–—Д–µ–Љ–Њ—А–∞–ї—М–љ–Њ–Љ —Г—З–∞—Б—В–Ї–µ (—Б 13,1±2,1 –і–Њ 10,7±1,6 –Љ/—Б –≤ –≥—А—Г–њ–њ–µ –∞–Љ–ї–Њ–і–Є–њ–Є–љ/–≤–∞–ї—Б–∞—А—В–∞–љ –Є —Б 12,9±2,2 –і–Њ 11,3±1,6 –Љ/—Б –≤ –≥—А—Г–њ–њ–µ –ї–Њ–Ј–∞—А—В–∞–љ/–≥–Є–і—А–Њ—Е–ї–Њ—А–Њ—В–Є–∞–Ј–Є–і). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ —Н—В–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї—М—И–µ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–Њ—В–Њ–Ї––Ј–∞–≤–Є—Б–Є–Љ–Њ–є –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–Є –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–Љ –Ї–∞–ї—М—Ж–Є—П, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–µ–µ –Њ –±–Њ–ї–µ–µ –Њ—В—З–µ—В–ї–Є–≤–Њ–Љ —Г–ї—Г—З—И–µ–љ–Є–Є —Д—Г–љ–Ї—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є—П.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —А–µ–Ј—Г–ї—М—В–∞—В—Л —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є —Б–Њ–≥–ї–∞—Б—Г—О—В—Б—П —Б –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–Љ–Є –і–∞–љ–љ—Л–Љ–Є –Њ –≤—Л—Б–Њ–Ї–Њ–Љ –∞–љ–≥–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–Љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –±–ї–Њ–Ї–∞—В–Њ—А–∞ –†–Р–Р–° –Є –Р–Ъ.
–Я–Њ–Љ–Є–Љ–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –њ—А–Є–≤–Њ–і–Є—В—М –Ї —А–µ–≥—А–µ—Б—Б—Г —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –∞–Њ—А—В—Л, –Ї–Њ—В–Њ—А–Њ–µ –Њ—В—А–∞–ґ–∞–µ—В —Б–љ–Є–ґ–µ–љ–Є–µ –°–†–Я–Т –љ–∞ –Ї–∞—А–Њ—В–Є–і–љ–Њ––±–µ–і—А–µ–љ–љ–Њ–Љ —Г—З–∞—Б—В–Ї–µ, –Є–Љ–µ—О—В—Б—П —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –Є –і–∞–љ–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Њ –Ј–∞—Й–Є—В–љ—Л—Е —Н—Д—Д–µ–Ї—В–∞—Е –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —П–≤–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –∞–Њ—А—В–∞–ї—М–љ–Њ–є —Б—В–µ–љ–Ї–Є. –Э–∞ –Љ–Њ–і–µ–ї–Є –∞–љ–µ–≤—А–Є–Ј–Љ—Л –∞–Њ—А—В—Л —Г –Ї—А—Л—Б —В–µ—Б—В–Є—А–Њ–≤–∞–ї–∞—Б—М –≥–Є–њ–Њ—В–µ–Ј–∞ –Њ —В–Њ–Љ, —З—В–Њ –±–ї–Њ–Ї–∞–і–∞ —Н—Д—Д–µ–Ї—В–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II –њ—А–Є –≤–≤–µ–і–µ–љ–Є–Є –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –љ–∞ –њ—А–Њ—Ж–µ—Б—Б—Л –∞—В–µ—А–Њ–≥–µ–љ–µ–Ј–∞, –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –∞–љ–µ–≤—А–Є–Ј–Љ—Л –∞–Њ—А—В—Л [36]. –Т–≤–µ–і–µ–љ–Є–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Ј–∞–Љ–µ–і–ї—П–ї–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ —Н–ї–∞—Б—В–∞–Ј––Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –∞–љ–µ–≤—А–Є–Ј–Љ—Л –±—А—О—И–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –∞–Њ—А—В—Л, –њ–Њ–і–∞–≤–ї—П–ї–Њ –∞–Ї—В–Є–≤–∞—Ж–Є—О —П–і–µ—А–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ kappa–B. –Т–∞–ї—Б–∞—А—В–∞–љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–Љ–µ–љ—М—И–∞–ї –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є—О —Б—В–µ–љ–Ї–Є –∞–Њ—А—В—Л –Љ–∞–Ї—А–Њ—Д–∞–≥–∞–Љ–Є, –∞ —В–∞–Ї–ґ–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї –∞–і–≥–µ–Ј–Є–Є–1 –Є –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–∞–Ј 1 –Є 9 —В–Є–њ–∞. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –ї–µ—З–µ–љ–Є–µ –≤–∞–ї—Б–∞—А—В–∞–љ–Њ–Љ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –і–µ—Б—В—А—Г–Ї—Ж–Є–Є —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –≤–Њ–ї–Њ–Ї–Њ–љ –∞–Њ—А—В–∞–ї—М–љ–Њ–є —Б—В–µ–љ–Ї–Є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л —Н—В–Њ–є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–є —А–∞–±–Њ—В—Л –Љ–Њ–≥—Г—В –Њ–±—К—П—Б–љ—П—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ –і–≤—Г—Е –љ–µ–і–∞–≤–љ–Є—Е —П–њ–Њ–љ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е JIKEI Heart Study –Є KYOTO Heart Study –≤ –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е –Р–У –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ [37,38].
–Т JIKEI Heart Study [37] 3081 –њ–∞—Ж–Є–µ–љ—В –±—Л–ї —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ –і–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –≤–∞–ї—Б–∞—А—В–∞–љ–∞ 40–160 –Љ–≥ –Є–ї–Є —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –љ–µ –≤–Ї–ї—О—З–∞—О—Й–µ–є –С–†–Р. –Т –≥—А—Г–њ–њ–µ –љ–∞–±–ї—О–і–µ–љ–Є—П 67% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–ї—Г—З–∞–ї–Є –Р–Ъ, 35% – –Є–Р–Я–§, 32% – b––±–ї–Њ–Ї–∞—В–Њ—А, 10% – –і–Є—Г—А–µ—В–Є–Ї. –Ф–Њ–±–∞–≤–ї–µ–љ–Є–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ (–љ–∞ 39%) —Б–љ–Є–Ј–Є–ї–Њ —А–Є—Б–Ї –њ–µ—А–≤–Є—З–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Є (—Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є), –љ–∞ 40% – —А–Є—Б–Ї –Є–љ—Б—Г–ї—М—В–∞, –љ–∞ 65% – —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–Є –Є –љ–∞ 47% – —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ 80%––µ —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ —А–∞—Б—Б–ї–Њ–µ–љ–Є—П –∞–Њ—А—В—Л –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–Њ–є (–Ю–† 0,19, 95% –Ф–Ш 0,04–0,94, p=0,0293).
–Т KYOTO HEART STUDY [38] –±—Л–ї–Њ –Њ—Ж–µ–љ–µ–љ–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –љ–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М –њ—А–Є –њ—А–Є—Б–Њ–µ–і–Є–љ–µ–љ–Є–Є –µ–≥–Њ –Ї —Б—В–∞–љ–і–∞—А—В–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О –Р–У –≤ –≥—А—Г–њ–њ–∞—Е –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞. –Я–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –≤ –≥—А—Г–њ–њ—Г –њ—А–Є–µ–Љ–∞ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –Є–ї–Є –њ—А–µ–њ–∞—А–∞—В–∞, –љ–µ –Њ—В–љ–Њ—Б—П—Й–µ–≥–Њ—Б—П –Ї –С–†–Р (55% – –Р–Ъ, 20% – –Є–Р–Я–§, 18% – b––±–ї–Њ–Ї–∞—В–Њ—А—Л). –Т–∞–ї—Б–∞—А—В–∞–љ –љ–∞–Ј–љ–∞—З–∞–ї—Б—П –≤ –і–Њ–Ј–µ 40–160 –Љ–≥/—Б—Г—В. –Т –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –њ–µ—А–≤–Є—З–љ–Њ–є —В–Њ—З–Ї–Є (–≤–њ–µ—А–≤—Л–µ –≤–Њ–Ј–љ–Є–Ї—И–µ–µ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–µ –Є–ї–Є —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–µ —Б–Њ–±—Л—В–Є–µ –Є–ї–Є —Г—Е—Г–і—И–µ–љ–Є–µ —В–µ—З–µ–љ–Є—П –Є–Љ–µ—О—Й–Є—Е—Б—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є) –љ–∞ 45% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –І–∞—Б—В–Њ—В–∞ —А–∞—Б—Б–ї–Њ–µ–љ–Є—П –∞–љ–µ–≤—А–Є–Ј–Љ—Л –∞–Њ—А—В—Л –±—Л–ї–∞ –љ–∞ 40% –љ–Є–ґ–µ –≤ –≥—А—Г–њ–њ–µ –≤–∞–ї—Б–∞—А—В–∞–љ–∞, –Њ–і–љ–∞–Ї–Њ —Н—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –љ–µ –±—Л–ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ –≤–≤–Є–і—Г –Љ–∞–ї–Њ–≥–Њ —З–Є—Б–ї–∞ —Б–Њ–±—Л—В–Є–є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Н—В–Є –і–≤–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є –≤—Л—Б–Њ–Ї–Є–є –∞–љ–≥–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї –≤–∞–ї—Б–∞—А—В–∞–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е –Р–У –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞. –Я—А–Є —Н—В–Њ–Љ –±–Њ–ї–µ–µ —З–µ–Љ –≤ –њ–Њ–ї–Њ–≤–Є–љ–µ —Б–ї—Г—З–∞–µ–≤ –≤–∞–ї—Б–∞—А—В–∞–љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –Р–Ъ.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Я—А–Є –Р–У —Б–Њ—Б—Г–і–Є—Б—В–Њ–µ —А—Г—Б–ї–Њ –њ–Њ—А–∞–ґ–∞–µ—В—Б—П –љ–∞ –≤—Б–µ–Љ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є – –Њ—В –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ –і–Њ –∞–Њ—А—В—Л. –Т–∞—А–Є–∞–љ—В—Л —Б–≤—П–Ј–∞–љ–љ–Њ–≥–Њ —Б –Р–У —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А—Г—Б–ї–∞ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—В—А—Г–Ї—В—Г—А—Л —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є. –Р–Ї—В–Є–≤–∞—Ж–Є—П —В–Ї–∞–љ–µ–≤–Њ–є –†–Р–Р–° —П–≤–ї—П–µ—В—Б—П –Ї–ї—О—З–µ–≤—Л–Љ –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є—П —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А—Г—Б–ї–∞. –Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є—П –±–ї–Њ–Ї–∞—В–Њ—А–∞ –†–Р–Р–° —Б –і–Є–≥–Є–і—А–Њ–њ–Є—А–Є–і–Є–љ–Њ–≤—Л–Љ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–Љ –Ї–∞–ї—М—Ж–Є—П –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ—Г—О –Ј–∞—Й–Є—В—Г —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є –љ–∞ –≤—Б–µ–Љ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А—Г—Б–ї–∞ –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –Њ—В —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –і–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Levy BI, Duriez M, Samuel JL. Coronary microvasculature alteration in hypertensive rats. Effect of treatment with a diuretic and an ACE inhibitor. Am J Hypertens. 2001;14:7–13.
2. Serne EH, Gans ROB, ter Maaten JC, Tangelder GJ, Donker AJM, Stehouwer CDA. Impaired skin capillary recruitment in essential hypertension is caused by both functional and structural capillary rarefaction. Hypertension. 2001;38:238–242.
3. Levy BI, Ambrosio G, Pries AR, Struijker–Boudier HAJ. Microcirculation in hypertension–a new target for treatment? Circulation. 2001;104: 735–740.
4. Struyker–Boudier HA, le Noble JL, Slaaf DW, Smits JF, Tangelder GJ. Microcirculatory changes in cremaster muscle during early spontaneous hypertension in the rat. J Hypertens. 1988;6(suppl):S185–S187.
5. Panza JA, Garcia CE, Kilcoyne CM, Quyyumi AA, Cannon RO, 3rd. Impaired endothelium–dependent vasodilation in patients with essential hypertension. Evidence that nitric oxide abnormality is not localized to a single signal transduction pathway. Circulation. 1995;91:1732–1738.
6. Mancia G, De Backer G, Dominiczak A, et al. 2007 Guidelines for the Management of Arterial Hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens 2007;25:1105-87
7. –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є—О –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є. –†–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –Т—Б–µ—А–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Њ–≤ –Є –†–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –њ–Њ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є. –Ъ–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П —В–µ—А–∞–њ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ 2008; 7(6), –Я—А–Є–ї–Њ–ґ–µ–љ–Є–µ 2. http://www.scardio.ru/downloads/c4m0i222
8. –§—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–Њ—З–µ–Ї –Є –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А–Є—Б–Ї–∞. –†–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –Т—Б–µ—А–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Њ–≤ –Є –Э–∞—Г—З–љ–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –љ–µ—Д—А–Њ–ї–Њ–≥–Њ–≤ –†–Њ—Б—Б–Є–Є. –Ъ–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П —В–µ—А–∞–њ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ 2008; 7 (6), –Я—А–Є–ї–Њ–ґ–µ–љ–Є–µ 3 http://www.scardio.ru/downloads/c4m0i228
9. Viberti G. Microalbuminuria Reduction With Valsartan in Patients With Type 2 Diabetes Mellitus: A Blood Pressure – Independent Effect. Wheeldon and for the Microalbuminuria Reduction With VALsartan (MARVAL) Study Investigators.Circulation 2002; 106: 672–8
10. The Shiga Microalbuminuria Reduction Trial (SMART) Group. Reduction of Microalbuminuria in Patients with Type 2 Diabetes. Diabetes Care; 2007:30,6:1581–1583.
11. Kaneshiro Y, Ichihara A, Sakoda M, Kurauchi–Mito A, Kinouchi K, Itoh H. Add–on benefits of amlodipine and thiazide in nondiabetic chronic kidney disease stage 1/2 patients treated with valsartan. Kidney Blood Press Res. 2009;32(1):51-8.
12. Bots M.L., Hoes A.W., Koudstaal P.J. et al. Common carotid intima%media thickness and risk of stroke and myocardial infarction. The Rotterdam Study. Circulation 1997;96:1432-1437
13. Burke GL, Evans GW, Riley WA, Sharrett AR, Howard G, Barnes RW, ef al. for the ARIC Study Group: Arterial wall thickness is associated with prevalent cardiovascular diseases in middle%aged adults. The Atherosclerosis Risk in Communities (ARIC) study. Stroke 1995; 26:386-391].
14. Zanchetti A. Trials investigating the antiatherosclerotic effects of antihypertensive drugs. J Hypertens 1996; 14 (suppl 2):S77-S81
15. Lonn E. M., Yusuf S., Dzavik V. et al. Effects of Ramipril and Vitamin E on Atherosclerosis : The Study to Evaluate Carotid Ultrasound Changes in Patients Treated With Ramipril and Vitamin E (SECURE). Circulation 2001 103: 919-925
16. Pitt B., Byington R., Furberg C.D et al. for the PREVENT investigators. Effect of amlodipine on the progression of atherosclerosis and the occurrence of clinical events. Circulation 2000; 102:1503
17. Borhani N, Mercuri M, Borhani P, Buckalew V, Canossa Terris M, Carr A, er al. Final outcome results of the Multicenter Isradipine Diuretic Atherosclerosis Study (MIDAS). A randomized controlled trial. JAMA 1996; 276:785-791.
18. Zanchetti A, Agabiti Rosei E, Daipalu C, et al, for the Verapamil in Hypertension and Atherosclerosis Study (VHAS) Investigators. The Verapamil in Hypertension and Atherosclerosis Study (VHAS): results of long term randomized treatment with either verapamil or chlorthalidone on carotid intima–media thickness. J Hypertens 1998; 16: 1667-1676.
19. Simon A.,Gariepy J, Moyse D, Levenson J. Differential Effects of Nifedipine and Co–Amilozide on the Progression of Early Carotid Wall Changes. Circulation 2001;103:2949
20. Zanchetti A, Bond MG, Hennig M, et al. Calcium antagonist lacidipine slows down progression of asymptomatic carotid atherosclerosis: principal results of the European Lacidipine Study on Atherosclerosis (ELSA), a randomized, double–blind, long–term trial. Circulation. 2002 Nov 5;106(19):2422-7.
21. Ichihara A, Kaneshiro Y, Sakoda M, Takemitsu T, Itoh H.Add–on amlodipine improves arterial function and structure in hypertensive patients treated with an angiotensin receptor blocker. J Cardiovasc Pharmacol. 2007;49(3):161-6.
22. Laurent S, Cockcroft J, Van Bortel L, Boutouyrie P, Giannattasio C, Hayoz D, Pannier B, et al. for the European Network for Non–invasive Investigation of Large Arteries. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 2006;27:2588 –2605.
23. Williams –Т., Lacy P.C. Central aortic pressure and clinical outcomes. J Hypertens 2009, 27:1123–1125
24. Mancia G, Laurent S, Agabiti–Rosei E et al. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document. J Hypertens 2009, 27:2121-2158
25. Sehestedt T, Jeppesen J, Hansen TW, Rasmussen S, Wachtell K, Ibsen H, Torp–Pedersen C, Olsen MH. Which markers of subclinical organ damage to measure in individuals with high normal blood pressure? J Hypertens 2009; 27:1165–1171.
26. Inoue M, Maeda R, Kawakami H, Shokawa T, Yamamoto H, Ito C, Sasaki H. Aortic pulse wave velocity predicts cardiovascular mortality in middle–aged and elderly Japanese men. Circ J 2009; 73:549–553.
27. Jankowski P, Kawecka–Jaszcz K, Czarnecka D, Brzozowska–Kiszka M, Styczkiewicz K, Loster M, Kloch–Badelek M, Wilinski J, Curylo AM, Dudek D, Aortic blood pressure and survival study group. Pulsatile but not steady component of blood pressure predicts cardiovascular events in coronary patients. Hypertension 2008; 51:848–855.
28. Wang KL, Cheng HM, Chuang SY, Spurgeon HA, Ting CT, Lakatta EG, Yin FCP, Chou P, Chen CH. Central or peripheral systolic or pulse pressure: which best relates to target organs and future mortality? J Hypertens 2009; 27:461–467
29. Williams B, Lacy PS, Thom SM, Cruickshank K, Stanton A, Collier D, Hughes AD, Thurston H, O’Rourke M; CAFE Investigators; Anglo–Scandinavian Cardiac Outcomes Trial Investigators; CAFE Steering Committee and Writing Committee. Differential Impact of Blood Pressure–Lowering Drugs on Central Aortic Pressure and Clinical Outcomes Principal Results of the Conduit Artery Function Evaluation (CAFE) Study. Circulation. 2006; 113(9):1213-25.
30. Dahlof B., Sever P.S., Poulter N.R. et al. Prevention of cardiovascular events with an attihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo–Scandinavian Cardiac Outcomes Trial–Blood Pressure Lowering Arm (ASCOT–BPLA): A multicentre randomised controlled trial. Lancet. 2005; 366: 895–906.
31. Boutouyrie P, Achouba A, Trunet P, Laurent S and for the EXPLOR Trialist Group. Amlodipine–Valsartan Combination Decreases Central Systolic Blood Pressure More Effectively Than the Amlodipine–Atenolol Combination. The EXPLOR Study. Hypertension. 2010 Apr 19. [Epub ahead of print]
32. Boutouyrie P, Achouba A, Laurent S o behalf of EXPLOR Investigator Group. The single–pill combination of valsartan–amlodipine decreases central systolic blood pressure more effectively than atenolol–amlodipine in 393 hypertensives: The EXPLOR Study. Journal of Hypertension. 2009 Vol 27 (suppl. 4): S326
33. Matsui Y, Eguchi K, O’Rourke MF, Ishikawa J, Miyashita H, Shimada K, Kario K. Differential Effects Between a Calcium Channel Blocker and a Diuretic When Used in Combination With Angiotensin II Receptor Blocker on Central Aortic Pressure in Hypertensive Patients. Hypertension. 2009;54:716-723.
34. Mackenzie IS, McEniery CM, Dhakam Z et al. Comparison of the effects of antihypertensive agents on central blood pressure and arterial stiffness in isolated systolic hypertension. Hypertension. 2009;54:409-413
35. –Э–µ–і–Њ–≥–Њ–і–∞ –°.–Т. —Б —Б–Њ–∞–≤—В. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –≠–Ї—Б—Д–Њ—А–ґ –Є –µ–≥–Њ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б —Д–ї—Г–≤–∞—Б—В–∞—В–Є–љ–Њ–Љ –≤ —Г–ї—Г—З—И–µ–љ–Є–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Н–ї–∞—Б—В–Є—З–љ–Њ—Б—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є –Є –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. Consilium Medicum, 2009, 11(5), 37-42.
36. Fujiwara Y, Shiraya S, Miyake T, Yamakawa S, Aoki M, Makino H, Nishimura M, Morishita R. Inhibition of experimental abdominal aortic aneurysm in a rat model by the angiotensin receptor blocker valsartan. Int J Mol Med. 2008 Dec;22(6):703-8.
37. Mochizuki S, et al. Valsartan in a Japanese population with hypertension and other cardiovascular disease (Jikei Heart Study). Lancet 2007; 369: 1431–39
38. Sawada T, Yamada H, Dahlof B, Matsubara H. for the KYOTO HEART Study Group. Effects of valsartan on morbidity and mortality in uncontrolled hypertensive patients with high cardiovascular risks: KYOTO HEART Study. European Heart Journal 2009 Oct; 30(20):2461-9. Epub 2009 Aug 31












