В 95% случаев речь идет о гипертонической болезни (эссенциальная АГ), в то время как симптоматическая АГ выявляется только у 5% больных, то есть является вторичной: при поражениях почечных артерий, феохромоцитоме, синдроме Кона, синдроме и болезни Иценко–Кушинга и др. Эссенциальная АГ является мультифакторным расстройством, в развитии которого играют роль генетические, демографические факторы и факторы окружающей среды. Комплексная природа механизмов регуляции АД затрудняет выявление патологической системы, имеющей основное значение в изменениях АД и поражении органов–мишеней, в частности головного мозга [3].
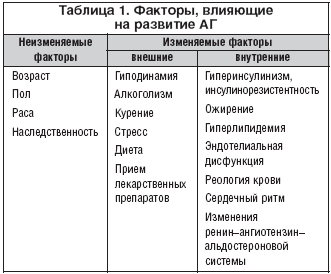
Показано значение в развитии предрасположенности к повышению АД как внешних (курение, алкоголизм, стресс и т.д.), так и внутренних (например, развитие инсулинорезистентности) факторов (табл. 1).
Рассматривая внешние и внутренние факторы, ответственные за развитие АГ, можно определить направления для профилактического и лечебного воздействия как на АГ, так и на ее осложнения, такие, как например, гипертензивная энцефалопатия (ГЭ). Воздействие на внешние факторы возможно только при мотивации больного на борьбу с АГ. К сожалению, способность и желание больных изменить образ жизни для устранения основных внешних факторов, влияющих на АГ, крайне низки [4]. Как в России, так и в мире, число больных, контролирующих АД, невелико: если во Франции, Греции, Германии, Испании и США АД контролируют 30–35,7% больных, то в Канаде, Чехии, Польше, Индии и России эта величина не превышает 9–16% [5].
Причин низкой приверженности больных к гипотензивной терапии множество:
• плохая переносимость гипотензивных препаратов;
• низкая дисциплинированность больных;
• высокая стоимость лекарств;
• психологические факторы (нежелание принимать препараты пожизненно);
• недостаточная осведомленность об осложнениях АГ и цели приема препаратов;
• уже имеющийся когнитивный дефицит – снижение памяти (забывают принимать препарат), рассеянность (нерегулярность приема лекарств), снижение критики к своему состоянию;
• гипотензивные препараты не устраняют многих неврологических симптомов (головокружение, головная боль, неустойчивость при ходьбе, тревожность, раздражительность), характерных для поражения головного мозга при АГ.
При этом систематические нарушения в приеме гипотензивной терапии или вовсе отказ от нее приводят к снижению эффективности лечения и усугублению АГ и, как следствие, прогрессированию ее осложнений [6].
Одним из основных факторов риска развития АГ является ожирение, которое в ряде стран уже достигло масштабов эпидемии [7]. Наличие ожирения неизбежно влечет за собой повышение риска развития инсулинорезистентности и сахарного диабета [8]. При ожирении имеет место нарушение микроциркуляции, так как различные биологически активные соединения, которые производит жировая ткань, влияют на функцию сосудов и чувствительность к инсулину [9]. Было показано, что микрососудистая дисфункция влияет на инсулинопосредованную утилизацию глюкозы и периферическое сосудистое сопротивление, что способствует развитию инсулинорезистентности и АГ соответственно [10,11].
Микроциркуляторное русло включает в себя артериолы, капилляры и венулы – сосуды, реагирующие в норме на увеличение внутреннего давления сужением, диаметр которых <150 мкм.
Наиболее важные функции микроциркуляторного русла:
• регулирование тканевой перфузии для обеспечения надлежащей доставки питательных веществ, кислорода и гормонов;
• избегание значительных колебаний гидростатического давления на капиллярном уровне;
• регулирование периферического сосудистого сопротивления и тем самым АД в целом [12].
Различные механизмы саморегуляции (системные, региональные, метаболические и мышечные) определяют микрососудистые функции. В частности, эндотелиальные клетки (формирующие внутреннюю выстилку микрососудов) играют центральную роль в переводе циркулирующих в крови факторов (например, гормонов, жирных кислот, питательных веществ) в сосудорасширяющие (оксид азота, простагландины) и сосудосуживающие (например, эндотелин–1) факторы [13,14].
АГ характеризуется наличием как функциональных, так структурных изменений в микроциркуляторном русле, включающих нарушения сосудистой регуляции, увеличение соотношения стенка–просвет (in wall–to–lumen ratio) в мелких артериях, а также структурным и функциональным капиллярным разрежением [15,16]. Недавние исследования также показали нарушения инсулинопосредованной NO–зависимой вазодилатации в моделях гипертонии у животных [17].
Хорошо известным фактом является то, что микрососудистые изменения могут быть вторичными по отношению к устойчивому повышению АД [18], с другой стороны, существуют доказательства того, что микрососудистые изменения могут быть причиной, а не следствием гипертонии [11 ]. Было показано, что микрососудистые нарушения обнаруживают уже на ранних стадиях развития спонтанной гипертонии у крыс (SHR), а предотвращение окислительного стресса при помощи антиоксидантов не только замедляет процесс уменьшения количества капилляров, но также предотвращает развитие возрастзависимой АГ [19,20]. Уменьшение количества капилляров наблюдается у пациентов с установленной АГ, у лиц с пограничной АГ, семейной предрасположенностью к гипертонии, даже если у них выявляют нормальное АД. В свою очередь, наличие микрососудистой дисфункции на фоне АГ может напрямую снижать поступление инсулина и глюкозы в скелетные мышцы, что приводит к снижению чувствительности к инсулину [11,21].
Вследствие АГ происходит поражение сердца, сосудов, почек, головного мозга. Одно из наиболее опасных осложнений АГ – острое нарушение мозгового кровообращения. Как впервые возникший, так и повторный инсульт является непосредственной причиной смерти в 57% случаев в ранние сроки и в 14% наблюдений – в отдаленном периоде [22].
При наблюдении в течение 10 лет за группой мужчин с АГ установлено, что смертность от ишемической болезни сердца (ИБС) и мозговых инсультов за этот период увеличивается более чем в 2 раза (с 2,0 до 4,6 на 1000 мужчин). Для развития хронической и острой ишемии головного мозга большое значение имеют пороговые величины АД — систолического (САД) и диастолического (ДАД). При увеличении САД до 140 мм рт.ст. не прослеживается изменения частоты возникновения хронической и острой ишемии мозга, тогда как при САД выше 140 мм рт.ст. отмечается увеличение частоты цереброваскулярной патологии. САД выше 160 мм рт.ст. сочетается с резким увеличением частоты развития сосудистой мозговой недостаточности, в том числе со смертностью от инсульта. Уровень ДАД 95 мм рт.ст. и выше связан с ростом цереброваскулярной заболеваемости. При этом повышение ДАД на каждые 5 мм рт.ст. сопровождается удвоением показателя смертности от мозгового инсульта [23].
В современной неврологии очень остро стоит вопрос хронического поражения головного мозга вследствие АГ, в частности гипертонической энцефалопатии (ГЭ).
Термин «гипертоническая энцефалопатия» был предложен еще в конце 50–х годов XX столетия учеными Института неврологии Г.А. Максудовым и Е.В. Шмидтом, он определяет неуклонно прогрессирующее поражение вещества головного мозга, которое связано с плохо контролируемым повышением АД, ведущее к хронической ишемии мозга.
Среди факторов риска развития ГЭ выделяют следующие: неконтролируемая АГ, гипертонические кризы, высокая вариабельность АД, высокая ночная гипертензия, чрезмерное снижение АД, включая ятрогенное [24].
В течении ГЭ можно выделить три стадии.
При I стадии в клинике доминируют субъективные нарушения в виде общей слабости и утомляемости, эмоциональной лабильности, нарушений сна, снижения памяти и внимания, головных болей. Неврологическая симптоматика не формирует отчетливые неврологические синдромы, а представлена анизорефлексией, дискоординацией, симптомами орального автоматизма. Нарушения памяти, праксиса и гнозиса удается выявить, как правило, только при проведении специальных тестов.
При II стадии становится больше субъективных жалоб, а неврологическая симптоматика уже может быть разделена на отчетливые синдромы (пирамидный, дискоординаторный, амиостатический, дисмнестический), причем обычно доминирует какой–то один неврологический синдром. Профессиональная и социальная адаптация больных снижается.
При III стадии нарастает неврологическая симптоматика, появляются отчетливый псевдобульбарный синдром, иногда пароксизмальные состояния (в том числе эпилептические припадки), выраженные когнитивные нарушения приводят к нарушению социальной и бытовой адаптации, полной потере работоспособности. Таким образом, ГЭ в конечном итоге приводит к формированию сосудистой деменции, как правило, ее субкортикального варианта [25].
При АГ происходят следующие патоморфологические изменения в сосудах головного мозга: плазматическое и геморрагическое пропитывание, некроз стенки сосудов с ее последующим истончением, адаптивное утолщение стенок экстрацеребральных сосудов. При ГЭ наблюдается раннее поражение преимущественно белого вещества головного мозга, представляющее собой деструкцию миелина центральных проводников, которое имеет типичную картину при компьютерной (снижение интенсивности сигнала) и магнитно–резонансной томографии (повышение интенсивности сигнала) [26]. Характерные изменения выявляются обычно в зонах терминального кровоснабжения, особо чувствительных к колебаниям АД, т.е. в околовентрикулярных участках головного мозга, и называются лейкоареозом [27,28]. При неконтролируемой АГ происходит прогрессирование описанных процессов в белом веществе, феномен корково–подкоркового разобщения (в белом веществе локализуются проводящие волокна), нарушаются интеллектуально–мнестические функции и в итоге развивается сосудистая деменция («субкортикальная артериолосклеротическая энцефалопатия», или болезнь Бинсвангера). В исследовании ARIC было показано, что подобные изменения белого вещества головного мозга встречаются в группе пациентов с АГ в 2 раза чаще, чем у людей с нормальным давлением, а у больных с неконтролируемой АГ по сравнению с пациентами с адекватным контролем АГ – в 1,5 раза чаще. Нередко такие изменения протекают без клинической симптоматики. Продолжительность бессимптомной фазы может быть различной и определяется наличием других факторов риска [29].
При АГ интенсивно прогрессирует атеросклероз. Нарушаются структурно–функциональные свойства эритроцитов и тромбоцитов – ухудшается их способность к деформации, повышается гематокрит, увеличивается вязкость крови, что, в свою очередь, приводит к нарушению микроциркуляции. Патоморфологические, а также единичные клинические исследования венозной системы головного мозга при АГ свидетельствуют о выраженных нарушениях вплоть до облитерации венозных синусов мозга. В этом случае говорят об энцефалопатии смешанного генеза: гипертонической и атеросклеротической [30,31].
Важным следствием изменений структуры сосудистой стенки является нарушение ауторегуляции мозгового кровообращения – способности поддерживать стабильный кровоток при колебаниях среднего системного АД в пределах от 60 до 150–170 мм рт.ст. [32]. В результате развивается гипоксия, представляющая собой несоответствие между потребностью тканей в кислороде и его доставкой.
На всех стадиях ГЭ к лечению основного заболевания – АГ, необходимо добавлять препараты, улучшающие мозговой кровоток и метаболизм нервной ткани, а также препараты, действующие на внутренние факторы, способные повлиять на прогрессирование энцефалопатии. С целью предупреждения нарастания атеросклеротического процесса необходима нормализация жирового обмена: снижение индекса массы тела, диета с низким содержанием жира, назначение статинов (симвастатина, правастатина). С целью улучшения реологических свойств крови необходимо назначение антиагрегантов (ацетилсалициловая кислота, тиклопидин, клопидогрел, дипиридамол). На всех стадиях ГЭ целесообразно применение препаратов, воздействующих на сосудистую стенку, то есть ангиопротекторов, способных влиять на микроциркуляцию, так как именно нарушения в микроциркуляторном русле провоцируют развитие инсулинорезистентности и усугубляют течение АГ. Здесь следует отметить препарат Докси–Хем (кальция добезилат – 500 мг в капсуле), который снижает повышенную проницаемость сосудов, увеличивает резистентность стенок капилляров, улучшает микроциркуляцию и дренажную функцию лимфатических сосудов, умеренно снижает агрегацию тромбоцитов и вязкость крови, повышает эластичность мембраны эритроцитов. Все эти эффекты реализуются через увеличение активности кининов плазмы. Докси–Хем назначают при микроангиопатиях, связанных с различными сердечно–сосудистыми и обменными заболеваниями, в частности при АГ, ожирении, сахарном диабете, инсулинорезистентности, а также при венозной недостаточности различной степени выраженности. Принимают Докси–Хем внутрь, не разжевывая, во время еды по 500 мг 3 раза в сутки в течение 2–3 нед., затем дозу снижают до 500 мг 1 раз в сутки. Возможно назначение препарата по 500 мг 3 раза в сутки в течение 4–6 мес., затем суточную дозу снижают до 500 мг 1 раз в сутки. Такая схема лечения предпочтительна при наличии микроангиопатии.
ГЭ – тяжелое прогрессирующее заболевание, угрожающее развитием инсультов и приводящее в конечном итоге к сосудистой деменции. Своевременно начатое лечение, влияющее на основные патогенетические механизмы развития ГЭ, может на долгие годы сохранить профессиональную, социальную и бытовую адаптацию больного и продлить его жизнь.
Литература
1. Шальнова С.А., Деев А.Д., Вихирева О.В. и соавт. Распространенность артериальной гипертонии в России: информированность, лечение, контроль // Профилактика заболеваний и укрепление здоровья. – 2001. – № 2. – С. 3–7.
2. Кобалава Ж.Д., Моисеев В.С., Котовская Ю.В. Артериальная гипертония: ключи к диагностике и лечению. Руководство для врачей. – М., 2009. – 864 с.
3. Oparil S., Zaman A., Calhoun D. A. Pathogenesis of arterial hypertension // Ann. Intern. Med. 2003; 139: 7617–776
4. Румянцева С.А.,Свищева С.П.,Кузнецов О.Р., Силина Е.В. Проблемы профилактики ишемии мозга у больных с сердечно–сосудистыми заболеваниями. Взгляд невролога // Атмосфера. Нервные болезни. – 2009. – № 2. – С. 3–6.
5. Firmann M., Mayor V. et al. The CoLaus study: a population–based study to investigate the epidemiology and genetic determinants of cardiovascular risk factors and metabolic syndrome // BMC Cardiovasc. Disord. – 2008. – Vol. 17. – P. 8–6.
6. Федотова А.В., Миронова О.П., Карпов Ф.А., Федин А.И. Комплексная коррекция артериальной гипертензии и когнитивных нарушений у больных с гипертонической энцефалопатией. Результаты многоцентрового исследования «Легенда» // Атмосфера. Нервные болезни. – 2009. – № 4. – С. 22–28.
7. Flegal K.M., Carroll M.D., Ogden C.L., Johnson C.L. Prevalence and trends in obesity among US adults, 1999–2000 // JAMA. – 2002. – Vol. 288. – P. 1723–1727.
8. Reaven G.M. Banting lecture Role of insulin resistance in human disease // Diabetes.– 1988. –Vol. 37. – P.1595–1607.
9. Jongh R.T., Serne E.H., Ijzerman R.G. et al. Impaired microvascular function in obesity: implications for obesity–associated microangiopathy, hypertension, and insulin resistance // Circulation. – 2004. – Vol. 109. – P.2529–2535.
10. Serne E.H., Gans R.O., Maaten J.C. et al. Capillary recruitment is impaired in essential hypertension and relates to insulin’s metabolic and vascular actions // Cardiovasc. Res.– 2001. – Vol. 49. – P.161–168.
11. Noon J.P., Walker B.R., Webb D.J. et al. Impaired microvascular dilatation and capillary rarefaction in young adults with a predisposition to high blood pressure // J. Clin. Invest.– 1997. – Vol. 99. – P. 1873–1879.
12. Levy B.I., Ambrosio G., Pries A.R., Struijker–Boudier H.A. Microcirculation in hypertension: a new target for treatment? // Circulation. – 2001. – Vol. 104. – P.735–740.
13. Verdant C., Backer D. How monitoring of the microcirculation may help us at the bedside // Curr. Opin. Crit. Care. – 2005. – Vol.11. – P.240–244.
14. Feletou M., Kohler R., Vanhoutte P.M. Endothelium–derived vasoactive factors and hypertension: possible roles in pathogenesis and as treatment targets // Curr. Hypertens. Rep.– 2010. – Vol. 12. – P. 267–275.
15. Levy B.I., Schiffrin E.L., Mourad J.J. et al. Impaired tissue perfusion: a pathology common to hypertension, obesity, and diabetes mellitus // Circulation. – 2008. – Vol. 118. – P. 968–976.
16. Versari D., Daghini E., Virdis A. et al. Endothelium–dependent contractions and endothelial dysfunction in human hypertension // Br. J. Pharmacol. – 2009. – Vol.157. – P. 527–536.
17. Li R., Zhang H., Wang W. et al. Vascular insulin resistance in prehypertensive rats: role of PI3–kinase/Akt/eNOS signaling // Eur. J. Pharmacol. – 2010. – Vol. 628. – P.140–147.
18. Ungvari Z., Csiszar A., Kaminski P.M. et al. Chronic high pressure–induced arterial oxidative stress: involvement of protein kinase C–dependent NAD(P)H oxidase and local renin–angiotensin system // Am. J. Pathol. – 2004. – Vol. 165. – Vol. 219–226.
19. Kobayashi N., DeLano F.A., Schmid–Schonbein G.W. Oxidative stress promotes endothelial cell apoptosis and loss of microvessels in the spontaneously hypertensive rats // Arterioscler. Thromb. Vasc. Biol. – 2005. – Vol. 25. – P.2114–2121.
20. Nabha L., Garbern J.C., Buller C.L., Charpie J.R. Vascular oxidative stress precedes high blood pressure in spontaneously hypertensive rats // Clin. Exp. Hypertens. – 2005. – Vol.27. – P.71–82.
21. Antonios T.F., Singer D.R., Markandu N.D. et al. Rarefaction of skin capillaries in borderline essential hypertension suggests an early structural abnormality // Hypertension. – 1999. – Vol. 34. – P. 655–658.
22. Hartmann A., Rundek T., Mast H. et al. Mortality and causes of death after first ishemic stroke: the Northern Manhatten Stroke Study // Neurology. – 2001. – Vol. 57 (11). – P. 2000–2005.
23. Жуковский Г.С., Константинов В.В., Варламова Т.А., Капустина А.В. Артериальная гипертония: эпидемиологическая ситуация в России и других странах // Русский медицинский журнал. – 1997. – № 5(9). – С. 537–558.
24. Ганнушкина И.В., Лебедева Н.В. Гипертоническая энцефалопатия. – М., 1987. – 224 с.
25. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. – М., 2001. – 327 c.
26. Верещагин Н.В., Моргунов В.А., Гулевская Т.С. Патология головного мозга при атеросклерозе и артериальной гипертонии. – М.: Медицина, 1977. – 228 с.
27. Гулевская Т.С., Людковская И.Г. Артериальная гипертония и патология белого вещества головного мозга // Архив патологии. – 1992. – Т. 54, № 2. – С. 53–59.
28. Wakita H., Tomimoto H., Akiguchi I. et al. Axonal damage and demyelination in the white matter after chronic cerebral hypoperfusion in the rat // Brain. Res. – 2002. – Vol. 924(1). – P. 63–70.
29. Cicconetti P. et al. Event–related potentials in the elderly with new mild hypertension // Clin. Exp. Hypertens. – 2000. – Vol. 22(6). – P. 583–593.
30. Шмидт Е.В., Лунев Д.К., Верещагин Н.В. Сосудистые заболевания головного и спинного мозга. – М., 1976. – С. 231–234.
31. Болезни нервной системы / Под ред. Н.Н. Яхно, Д.Р. Штульмана. – 2–е изд., перераб. и дополн. – М., 2002. – С. 231–302.
32. Strandgaard S. Autoregulation of cerebral blood flow in hypertensive patients: the modifying influence of prolonged antihypertensive treatment on the tolerance to acute, drug–induced hypotension // Circulation. – 1976. – Vol. 53. – P. 720–727.
33. Котова О.В., Акарачкова Е.С. Гипертензивная энцефалопатия: патогенез и общие принципы профилактики // Фарматека. – 2010. – № 12(206). – С. 66–71.












