Репаративный процесс включает механизмы гемостаза, воспаления, пролиферации, ремоделирования и их регуляцию с участием цитокинов. Заживление раны представляет собой единый активный динамический процесс, который начинается с момента повреждения и заканчивается восстановлением целостности ткани. При этом восстановительные процессы хотя и имеют строгую последовательность, могут протекать одновременно и обычно накладываются по времени один на другой [1–4]. Особенно это выражено при хронических ранах (рис. 1).
В процесс заживления последовательно включаются различные механизмы, однако имеются значительные различия во вкладе каждого механизма в зависимости от типа раны. Понимание механизмов восстановления целостности ткани, содействие им и поддержание оптимальной раневой среды позволяет клиницисту более эффективно проводить лечение ран.
Фаза воспаления начинается немедленно после повреждения ткани. Характеризуется типичными сосудистыми реакциями в краях раны: вазоконстрикцией, которая сменяется через 10–15 мин. вазодилатацией, выходом форменных элементов крови в зону повреждения, выпадением фибрина и инфильтрацией окружающих тканей с отграничением зоны повреждения. Сразу же в рану начинают перемещаться лейкоциты. В первые 24 ч в ране преобладают полиморфонуклеарные лейкоциты, а в течение последующих нескольких дней активируются клетки фагоцитоза. В отсутствие значительного бактериального загрязнения макрофаги быстро замещают полиморфонуклеарные лейкоциты как доминирующий тип клетки в этой фазе. Лимфоциты также появляются в ранах в небольшом числе в течение фазы воспаления. Но их роль более значительна при хроническом воспалении.
При нормальном заживлении процесс очищения раны обычно продолжается несколько дней, но при обильном загрязнении или хроническом течении он значительно удлиняется. Даже небольшое количество поврежденных, некротических, ишемизированных или инфицированных тканей ведет к постоянному и чрезмерному ответу активированных лейкоцитов. Субстраты, выделяемые ими, продолжают разрушать внеклеточную матрицу, поддерживают воспаление и задерживают заживление.
В фазе воспаления основные задачи лечения: борьба с инфекцией, адекватное дренирование, ускорение процесса очищения раны, уменьшение системных проявлений воспалительной реакции [4].
Макрофаги играют ведущую роль в воспалительной фазе заживления. Их роль не ограничена фагоцитозом. Они наряду с тромбоцитами являются источником более чем 30 различных цитокинов, которые регулируют большинство последующих процессов заживления раны. При дегрануляции тромбоцитов высвобождаются факторы роста, которые улучшают заживление ран посредством аутокринного и паракринного механизмов. К ним относятся: тромбоцитарный фактор роста (platelet derived growth factor (PDGF)), тромбоцитарный фактор ангиогенеза (platelet derived angiogenesis factor (PDAF)), трансформирующий фактор роста β (transforming growth factor–β (TGFβ)), инсулиноподобный фактор роста (insulin–like growth factor (IGF)), тромбоцитарный фактор роста эндотелиальных клеток (platelet derived endothelial cell growth factor (PD–ECGF)), эпидермальный фактор роста (epidermal growth factor (EGF)), фактор роста фибробластов (fibroblast growth factor (FGF)), тромбоспондин и остеонектин. Эти факторы стимулируют продукцию внеклеточного матрикса, быстрое увеличение числа фибробластов и ангиогенез [5].
Процессы регенерации начинаются с формирования фибриновой матрицы и фибронектина. Уже в первые 10 ч с момента повреждения начинается синтез коллагена, который становится основной структурой в матрице ран и в дальнейшем придает прочность образующемуся рубцу. Образование коллагена достигает максимума к 5–7–му дню, а затем постепенно снижается. К 3–му дню появляются фибробласты и становятся доминирующим типом клеток в эту фазу. Цитокины, выделенные макрофагами, одновременно стимулируют пролиферацию сосудов. Разрастание капилляров внутри ткани обеспечивает фибробласты кислородом и питательными веществами, обеспечивает быстрый рост клеток и поддерживает производство постоянной матрицы раны. Постепенно уменьшаются экссудация и отек, грануляционная ткань со дна раны заполняет весь дефект. Грануляционная ткань содержит много новообразованных сосудов и практически не иннервирована. При нормальном течении раневого процесса поверхность гранулирующих ран яркая, «сочная», при перевязках отмечаются высокая контактная кровоточивость и незначительная болезненность.
Фаза пролиферации в среднем продолжается 2–4 нед. Ее продолжительность зависит от величины раневого дефекта и морфологии поврежденных тканей. В этой фазе заживления основные задачи лечения – продолжение борьбы с инфекцией, защита грануляционной ткани и стимуляция процессов репарации [4].
Фаза эпителизации и ремоделирования. Накопление коллагена в пределах раны достигает максимума в течение 2–3 нед. после повреждения. При нормальном течении раневого процесса уменьшаются капиллярная плотность и число фибробластов. Рана теряет розовый цвет и становится прогрессивно бледной. Коллаген подвергается постоянному ремоделированию. Сразу после формирования рубца начинается его перестройка – происходят образование эластических волокон и развитие новой фиброзной сети, а содержание воды в рубцовой ткани снижается.
Эпителизация раны начинается одновременно с образованием грануляционной ткани. Данный процесс регулируется действием эпидермального хейлона – контактного ингибитора пролиферации. Эпидермис является барьером, защищающим от потери воды, позволяя другим клеткам тела жить в жидкой окружающей среде, а также барьером для бактерий. Вновь развившиеся эпителиальные клетки непрочно присоединены к дерме, легко повреждаются при перевязке и требуют защиты, а полная эпителизация наступает в течение 7–10 дней [2,4].
Бактерии, белковый экссудат из капилляров и некротические ткани значительно задерживают эпителизацию. Отсроченная эпителизация приводит к более глубокому и длительному воспалительному процессу и тем самым способствует формированию грубого или гипертрофического рубца. Эпителизация – процесс миграции кератоцитов, который происходит от краев раны со скоростью 1–2 мм в сутки. Хронические раны быстрее, чем 1 см в месяц, эпителизируются редко, т.е. язва голени диаметром 2 см требует для заживления около 2 мес.
В фазе эпитализации и реорганизации рубца основные задачи лечения – ускорение роста эпителия и защита раны от повреждений.
Заключительная фаза заживления раны в зависимости от морфологии тканей продолжается от нескольких недель до года. Формирующиеся рубцы никогда не достигают степени прочности нормальной ткани. Их прочность повышается в течение 6 мес. и более и в конце концов достигает 70% прочности нормальной кожи.
Описанное течение раневого процесса характерно для ран, явившихся результатом одномоментного внешнего воздействия повреждающего фактора. При длительном или постоянном неблагоприятном воздействии раневой процесс приобретает хроническое течение. Обычно таково течение синдрома диабетической стопы (СДС), пролежней, венозных трофических язв голени и ишемических язв. Для подобных патологических состояний характерно наличие признаков сразу всех 3 фаз раневого процесса. Дно хронической раны одновременно покрыто фибрином и грануляциями, возможно наличие участков некроза и гнойного отделяемого; грануляции обычно вялые и бледные, края раны и ткани вокруг уплотнены; часто имеет место краевая эпителизация.
Патофизиология хронических ран сложна и разнообразна, но все они имеют одну общую особенность – длительно протекающее воспаление, которое приводит к обширному повреждению ткани и препятствует заживлению.
Определение понятия
«хроническая рана»
Единого определения понятия «хроническая рана» до сих пор не существует. Можно встретить термины «длительно не заживающая рана», «проблемная» или «сложная» рана, «трофическая язва» (различного генеза). Одни только трофические язвы нижних конечностей по этиологическому фактору могут быть венозными, артериальными, на фоне диабетической нейропатии и ангиопатии, гипертоническими (синдром Марторелла), при системных заболеваниях (болезни крови, обмена веществ, коллагенозы, васкулиты – например, ливедо–васкулит), нейротрофическими, рубцово–трофическими, фагеденическими (прогрессирующая эпифасциальная гангрена); застойными (на фоне НК), пиогенными, специфическими и инфекционными, малигнизированными (новообразования кожи), при токсическом эпидермальном некролизе Лайелла, при врожденных пороках развития сосудистой системы – ангиодисплазиях, лучевыми, артифициальными, развившимися вследствие воздействия физических факторов [6].
Единого временного критерия определения хронической раны также нет. Одни авторы хронической считают рану, существующую более 4 нед. без признаков активного заживления; исключение составляют обширные раневые дефекты с признаками активной репарации [7].
Другие авторы считают хронической рану, незаживающую при адекватном лечении в течение 6 нед. [8,9]. Так, в 1983 г. группа шотландских исследователей под руководством J. Dale дала определение хронической трофической язвы нижней конечности как «...открытой раны на голени или стопе, не заживающей более 6 недель».
Есть мнение, что хронической следует считать рану, не заживающую в течение 8 нед. [2,10].
Согласно определению специального заседания Европейского общества репарации тканей (Сardiff, Wales, сентябрь 1996), «хронической следует считать рану, не заживающую в течение периода, который является нормальным для ран подобного типа или локализации». Также существует мнение, что длительно незаживающая рана – это рана, репарация которой нарушена из–за неблагоприятных фоновых состояний [11].
Классификация хронических ран
Практически повсеместно приняты следующие классификации трех основных патологий (хроническая почечная недостаточность (ХВН), хроническая артериальная недостаточность (ХАН), СДС), приводящих на определенной стадии к образованию хронических трофических язв нижних конечностей в подавляющем большинстве случаев, – суммарно более 90% всех трофических язв нижних конечностей:
– классификация хронической венозной недостаточности СЕАР,
– классификация облитерирующих заболеваний периферических артерий по Фонтейну–Покровскому,
– степень выраженности поражения тканей при СДС [Wagner F.W., 1979].
Кроме того, используются классификация диабетических язв Техасского университета и классификация язвенных дефектов у больных с СДС PEDIS (The Consensus of diabetic foot Supplement, Amsterdam, 2003) и др. [3,6].
Дополнительно могут быть использованы классификации, описывающие глубину язвенного дефекта и его площадь. По глубине различают:
– поверхностную язву (эрозию) в пределах дермы (I степень);
– язву, достигающую подкожной клетчатки (II степень);
– язву, пенетрирующую до фасции или субфасциальных структур (мышцы, сухожилия, связки, кости), в полость суставной сумки или сустава (III степень);
по площади:
– малые – площадью до 5 см2;
– средние – от 5 до 20 см2;
– обширные (гигантские) – свыше 50 см2.
Существует общепринятая классификация пролежней:
– I стадия – устойчивое покраснение кожи, не проходящее после прекращения давления; кожные покровы не нарушены;
– II стадия – стойкая гиперемия кожи; отслойка эпидермиса; поверхностное нарушение целостности кожных покровов (в виде потертости, пузыря или плоского кратера);
– III стадия – разрушение (некроз) кожных покровов вплоть до мышечного слоя с проникновением в мышцу; могут быть жидкие выделения из раны;
– IV стадия – поражение (некроз) всех мягких тканей; наличие полости, в которой видны сухожилия и/или костные образования.
В 1986 г. D.R. Knighton была предложена классификация хронических ран:
– I стадия – поверхностные раны (поражение эпидермиса и дермы);
– II стадия – глубокие раны (поражение подкожно–жировой клетчатки);
– III стадия – поражение фасций;
– IV стадия – поражение мышц;
– V стадия – поражение сухожилий, связок и костей;
– VI стадия – поражение органов и тканей полостей туловища [12].
В 2004 г. опубликована система оценки хронических ран MEASURE [3,13], включающая в себя ключевые параметры, используемые при оценке и лечении таких ран: М (Measure) – измерение раны (длина, ширина, глубина и площадь), Е (Exudate) – экссудат (количество и качество), A (Appearance) – внешний вид (раневое ложе, тип ткани и количество), S (Suffering) – болевой синдром (характер и интенсивность боли), U (Undermining) – деструкция (наличие или отсутствие), R (Reevaluate) – наблюдение (регулярный контроль всех параметров), Е (Edge) – край (состояние краев раны и окружающей кожи).
Как правило, условиями формирования хронической раны являются повторяющаяся травма (например, нейропатические язвы стоп у больных СД), ишемия, наличие хронической персистирующей местной инфекции, избыточная продукция протеаз в ране и сниженная активность факторов роста [7].
Лечение хронических ран
Лечение хронических ран представляет собой крайне сложную клиническую проблему и требует устранения повреждающих факторов, улучшения регионарного венозного и артериального кровообращения. Если повреждающие факторы не устранены, то хронические раны даже при интенсивном лечении длительно не заживают, а после заживления часто рецидивируют. Лечение хронических ран должно быть максимально атравматичным и соответствовать принципу, принятому всеми современными хирургами: «Не вводите в рану то, что не ввели бы в собственный глаз» [4].
Подходы к лечению хронических ран весьма разнообразны. Признанными следует считать:
• сформулированную в 2002 г. теорию «Wound Bed Preparation» [Falanga V., 2002]. «Wound Bed Preparation» – стратегию обработки основания раны с целью перевода хронической раны в острую и удаления как некротического компонента, состоящего из некротической ткани, так и фенотипически измененных клеток края и основания раны и продуцируемого ими экссудата; имеется несколько пересмотров и уточнений стратегии, однако в целом она актуальна и сегодня [14];
• принцип заживления ран во влажной среде [Moist Wound Healing, G.D. Winter, 1962] и систему TIME (Международный консультативный совет по лечению ран, 2003): T (Tissue) – удаление нежизнеспособных, в том числе некротизированных тканей; I (Infection) – подавление инфекции; M (Moisture) – контроль уровня влажности (раневой экссудации); E (Edge) – стимуляция репаративных процессов и/или эпителизации [15].
Дебридмент может быть:
– хирургическим (некрэктомия),
– механическим (например, технология Debrisoft или Shave–терапия),
– физическим (гидрохирургическая обработка, ультразвуковая кавитация, обработка аргон–плазменными или воздушно–плазменными потоками, высокоэнергетическим лазерным излучением),
– химическим (различные препараты, содержащие протеолитические ферменты),
– биологическим (личинки зеленых мух – Larval therapy).
Также рекомендовано промывание ран с использованием принципа «пульсирующей струи», применение охлажденного озонированного физиологического раствора или гипербарически оксигенизированных растворов антисептиков.
Подавление инфекции и воспаления осуществляется за счет местной и системной антибактериальной и противовоспалительной терапии, использования антисептиков и описанных выше физических методов воздействия. Следует избегать применения концентрированных антисептиков (йод–повидон, перекись водорода, гипохлорид натрия и др.), традиционно используемых при острых ранах: в условиях хронической раны они не только уничтожают микроорганизмы, но и оказывают цитотоксическое действие, повреждая грануляционную ткань.
Так, аэрационная и инстилляционная озонотерапия сопровождается рядом эффектов, такими как:
– антимикробный, фунгицидный и противовирусный;
– противовоспалительное и иммуномоделирующее действие;
– усиление микроциркуляции;
– улучшение реологических свойств крови;
– нормализация процессов перекисного окисления липидов и антиоксидантной защиты;
– увеличение оксигенации крови и уменьшение тканевой гипоксии.
При промывании охлажденным раствором местная гипотермия сопровождается обезболивающим и противоотечным эффектами. Раневой диализ гипербарически оксигенизированными растворами приводит к активному удалению некротоксинов, стабилизации тканевого дыхания и стимуляции процессов пролиферации. Обработка воздушно–плазменными потоками (рис. 2) сопровождается бесконтактным «выпариванием» некротизированных тканей, тотальным бактерицидным эффектом, стимуляцией утилизации кислорода в тканях, эндотелий–протективным действием и стимуляцией роста соединительной ткани [6].
Контроль уровня влажности в ранах обеспечивается за счет применения современных интерактивных перевязочных средств [3,4,7,11,16,17], а также использования метода локального отрицательного давления.
Метод лечения ран отрицательным давлением (Negative Pressure Wound Treatment, NPWT), или вакуум–ассистированные повязки (Vacuum–assisted closure, VAC–терапия), занимает особое место в лечении хронических ран. Он широко используется в разных странах, а в последние годы – и в России [18–27]. Целесообразность и эффективность применения метода основаны на его прямых и опосредованных эффектах:
– активное удаление избыточного раневого отделяемого;
– сохранение баланса влажной раневой среды;
– стимуляция неоангиогенеза;
– ускорение деконтаминации тканей раны;
– устранение местного интерстициального отека;
– усиление локального кровообращения;
– деформация раневого ложа, стимуляция пролиферации;
– уменьшение площади и объема раневого дефекта;
– усиление оксигенации тканей;
– профилактика госпитальных раневых инфекций;
– усиление эффекта общего медикаментозного лечения;
– сокращение затрат и сроков лечения больных (рис. 3) [25].
С целью стимуляции репаративных процессов в хронических ранах предложено много методов и средств. Широко используются гипербарическая оксигенация [28], ультрафиолетовое и инфракрасное облучение, электробинт, стимулирующий репаративные процессы за счет слабых токов; криогенная стимуляция «углекислотным снегом» [29]; низкоэнергетический лазер и квантовая терапия (рис. 2) – сочетание эффектов лазерного, магнитного и инфракрасного излучений (противовоспалительный, сосудорасширяющий, противоотечный, спазмолитический, обезболивающий и биостимулирующий) [6].
Использование метаболитотропных препаратов в лечении хронических ран различной этиологии и их сочетание с другими препаратами и методами также приводят к стимуляции репаративных процессов. Описано применение антиоксидантов; средств, влияющих на липидный и белковый обмен; депротеинизированного дерината крови телят (Актовегин); комбинированное использование АТФ, андекалина, румалона, церебролизина и лидазы; широко применяются препараты провитамина В5 декспантенола и гиалуроновой кислоты, метилурацила, хитозана и др. [30,31].
Развитие биотехнологий в последние годы привело к созданию нового направления в решении проблем заживления ран. Коллагенсодержащие препараты используются в различных областях медицины как самостоятельный фактор стимуляции регенерации тканей. Коллаген является одним из наиболее перспективных биоматериалов, широко применяемых в мировой медицинской практике. Коллаген I типа, полученный из кожи крупного рогатого скота, по своему составу и структуре максимально приближен к человеческому коллагену. Признано, что бычий коллаген является наиболее безопасным и биосовместимым материалом [32,33]. Основное преимущество и отличие отечественного препарата Коллост от других аналогичных материалов на основе коллагена заключается в том, что в данном препарате используется нативный нереконструированный коллаген I типа. В нем сохранена трехспиральная структура волокна, он имеет более высокие показатели стабильности и является матрицей для направленной тканевой регенерации (рис. 4). Это позволяет использовать препарат Коллост не только как обычный микроимплантат, но и с целью активизации синтеза собственного коллагена [34–37].
Богатая тромбоцитами аутоплазма (БоТП) – источник факторов роста, которые привлекают в область повреждения прогениторные клетки и стимулируют их пролиферативную активность [5]. На современном этапе использование БоТП для ускорения роста кости и мягких тканей стало настоящим прорывом в стоматологии, травматологии, спортивной медицине, косметологии и хирургии, при лечении облысения. Это одно из направлений тканевой инженерии и клеточной терапии [38–41]. Наиболее широко БоТП используется для заполнения больших костных дефектов в челюстно–лицевой хирургии. БоТП может применяться совместно с костным материалом, наноситься на принимающее ложе перед применением костного материала, поверх него или использоваться в качестве биологической мембраны [5,42,43]. Доказана эффективность БоТП для ускорения заживления мягких тканей и эпителизации. Использование БоТП показано при пересадке свободного соединительнотканного трансплантата, манипуляциях со слизисто–надкостничным лоскутом и наращивании мягких тканей при косметических вмешательствах в полости рта [44,45].
После активного внедрения данного метода в стоматологию БоТП стала применяться в ортопедии и травматологии. Наиболее широко данный метод используется при острой травме для стимуляции остеогенеза в комбинации с остеосинтезом, а также при лечении артрозов [36,46]. Разработан метод стимуляции неоангиогенеза в ишемизированных тканях нижней конечности с помощью БоТП [47]. В настоящее время имеется ряд публикаций, посвященных применению БоТП в лечении хронических ран (рис. 5). Результаты исследований позволили сделать вывод о том, что применение БоТП в комплексном лечении трофических язв голени венозной этиологии обеспечивает широкий спектр местных и системных лечебных эффектов, улучшает результаты, позволяет значительно сократить сроки лечения и быстрее повысить качество жизни, что является экономически важным аспектом [47,48].
Существуют препараты местного действия, содержащие факторы роста, однако их эффективность ниже, а стоимость – значительно выше, чем у БоТП.
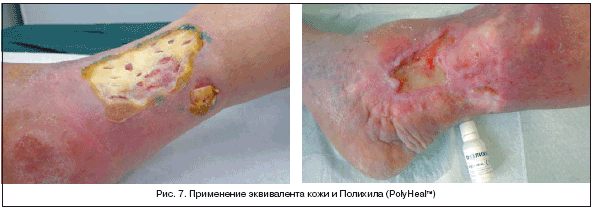
Из клеточных технологий, помимо использования стволовых клеток, были предложены методики культивирования кератиноцитов на коллагеновом геле, эпидермальных клеток на культуре фибробластов, создание «живого эквивалента кожи» и комбинированных субстратов (Apligraf – аллофибробласты на коллагеновом гелевом матриксе и культивированные кератиноциты), двухслойной «искусственной кожи» – силиконовая пленка и биодеградирующая мембрана из коллагена и хондроититин–6–сульфата (Integra), «культивируемые эпидермальные аутотрансплантаты» (Epicell, Epidex, Myskin), суспензия культивируемых аутогенных кератиноцитов (ReCell), аллофибробласты на кремний–органической основе, продукты на основе бесклеточной аллогенной дермы (AlloDerm) и др. [49].
Израильскими учеными предложена технология CureXcell – местная цитокиновая терапия путем внесения суспензии донорских лейкоцитов в рану.
Новым и уникальным направлением в биотехнологии лечения хронических ран будет препарат Nexagon, проходящий в настоящее время клинические испытания в различных странах, механизм действия которого заключается в инактивации «тормозящего» репаративные процессы в ране белка.
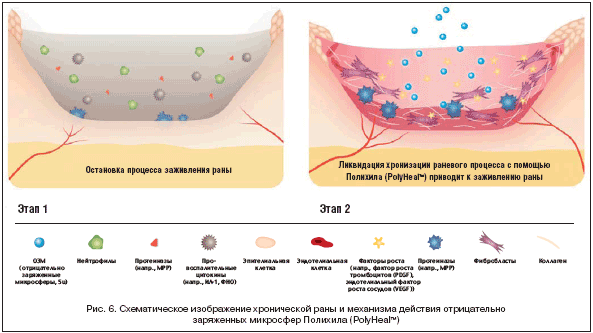
Уникальным следует считать и разработанное в Израиле средство для местного лечения хронических ран Полихил (PolyHealтм). Данную методику трудно отнести к чисто физическому, биологическому или лекарственному методам воздействия – ее принцип «мультидисциплинарен», его скорее можно причислить к биофизическим методам. Полихил (PolyHealтм) состоит из отрицательно заряженных полистирольных микросфер в среде Игла в модификации Дульбекко (DMEM) и не содержит каких–либо лекарственных или биологических препаратов. Механизм действия обусловлен реализацией контакта отрицательно заряженных микросфер с мембранами клеток, что приводит к стимуляции клеточной пролиферации (рис. 6, 7). Эффект связан с активизацией собственных макрофагов, фибробластов, эндотелиальных клеток и кератиноцитов, уменьшением числа нейтрофилов и снижением уровня провоспалительных цитокинов, а также с усилением локальных механизмов защиты, высвобождением факторов роста, стимуляцией синтеза коллагена, ангиогенеза и эпителизации. Ряд проведенных исследований (1 рандомизированное проспективное двойное слепое контролируемое и 3 открытых исследования) показал высокую эффективность и безопасность данного метода в лечении хронических и трудно заживающих ран: на 75% рана заполнилась грануляционной тканью у 65% пациентов, и до 40% сократилась площадь поверхность раны в течение 4–х недель терапии, а также более чем у 30% пациентов раны закрылись самостоятельно. Полихил (PolyHealтм) показан для терапии ран различной этиологии: хронических венозных, нейропатических, артериальных и смешанных, а также пролежней, посттравматических и постоперационных с вовлечением или без костей, сухожилий, связок и/или инородного материала [50-52].
Заключение
Известно, что любой метод наиболее эффективен в руках его автора. Однако ознакомление с широким спектром методик и их освоение позволят каждому специалисту приобрести собственный опыт, найти индивидуальный подход к каждому пациенту и к любой хронической ране, а также, возможно, разработать и новые технологии.
![Рис. 1. Основные временные физиологические проявления раневого процесса [4]](/data/articles/Image/t21/n5/282-1.gif)
![Рис. 2. Обработка хронической раны воздушно–плазменными потоками (а) и квантовая терапия [б]](/data/articles/Image/t21/n5/282-2.gif)



Литература
1. Раны и раневая инфекция. Руководство для врачей. / Под ред. М.И. Кузина, Б.М. Костючонок. М.: Медицина, 1990. 592 с.
2. Абаев Ю.К. Биология заживления острой и хронической раны // Мед. новости. 2003. № 6. С. 3–10.
3. Токмакова А.Ю., Страхова Г.Ю., Галстян Г.Р. Современная концепция ведения больных с хроническими ранами и сахарным диабетом // Сахарный диабет. 2005. № 1.
4. Кузнецов Н.А., Никитин В.Г. Щадящие хирургические вмешательства и интерактивные повязки в лечении инфицированных ран // Consilium medicum. Хирургия. 2006. Т. 8. № 2.
5. Чекалина Е.Н. Роль тромбоцитарного концентрата в восстановлении и регенерации тканей // Дентал Юг. 2005. № 3(32). С. 23.
6. Оболенский В.Н., Родоман Г.В., Никитин В.Г., Карев М.А. Трофические язвы нижних конечностей – обзор проблемы // РМЖ. 2009. Т. 17. № 25 (364). С. 1647–1662.
7. Храмилин В.Н. Современные аспекты местного лечения хронических ран нижних конечностей у больных сахарным диабетом // Научно–практический медицинский журнал ЭНЦ РАМН. 2005. № 4.
8. Fowler E. Chronic wounds: an overview // Chronic wound care / Edited by D. Krasner. Health Management Publications, Inc. King of Prussia, Pennsylvania. 1990. P. 12–18.
9. Klein L.K., lies R.L. Topical treatment for chronic wounds: an overview // Chronic wound care / Edited by D. Krasner. Health Management Publications, Inc. King of Prussia, Pennsylvania. 1990. P. 263–265.
10. Robson M. C. Wound infection: a failure of wound healing caused by an imbalance of bacteria / M. C. Robson // Surg. Clin. North. Am. 1997. Vol. 77. P. 637–650.
11. Бобровников А.Э., Крутиков М.Г., Лагвилова М.Г., Алексеев А.А. Остаточные длительно существующие ожоговые раны: определение и особенности лечения // Комбустиология. 2010. № 40.
12. Knighton D.R., Fiegel V.D., Ciresi K.F., Austin L.L., Butler E.L. Classification and treatment of chronic nonhealing wounds // Ann. Surg. 1986. Vol. 204. P. 322–330.
13. Keast D.H., Bowering K., Evans A.W., MacKean G., Burrows C., D'Souza L. MEASURE: A proposed assessment framework for developing best practice recommendations for wound assessment // Wound Rep Reg. 2004. № 12. Р. 1–17.
14. Sibbald R.G., Goodman L., Woo K.Y., Krasner D.L., Smart H., Tariq G., Ayello E.A., Burnell R.E., Keast D.H., Mayer D., Norton L., Salcido R. Special Considerations in Wound Bed Preparation 2011: an update // Wound Care Canada. Vol. 10. № 2. P. 20–35.
15. Schultz G.S., Sibbald R.G., Falanga V., Ayello E.A., Dowsett C., Harding K., Romanelli M., Stacey M.C., Teot L., Vanscheidt W. Wound bed preparation: a systematic approach to wound management // Wound Rep Reg. 2003. № 11. Р. 1–28.
16. Chaby G., Senet P., Veneau M. et al. Dressings for acute and chronic wounds. A systematic review // Arch Dermatol. 2007. № 143. Р. 1297–1304.
17. Palfreyman S., Nelson E.A., Michaels J.A. Dressings for venous leg ulcers: systematic review and meta–analysis // BMJ. 2007. № 335. Р. 244.
18. Saxena V., Hwang C.W., Huang S., Eichbaum Q., Ingber D., Orgill D.P. Vacuum–assisted closure: Microdeformations of wounds and cell proliferation // Plast. Reconstr. Surg. 2004. 114 (5). Р. 1086–1096.
19. Armstrong D., Lavery L. Negative pressure wound therapy after partial diabetic foot amputation: a multicentre, randomised controlled trial // Lancet. 2005. № 366. Р. 1704–10.
20. Shirakawa M., Isseroff R.R. Topical negative pressure devices: Use for enhancement of healing chronic wounds // Arch. Dermatol. 2005. № 141. Р. 1449–1453.
21. The Theory and Practice of Vacuum Therapy / Edited by C. Willy. Germany. 2006. 405 p.
22. Andros G., Armstrong D.G., Attinger C. et al. Consensus statement on negative pressure wound therapy for the management of diabetic foot wounds // Vasc. Dis Manage. 2006. Suppl., July.
23. Ларичев А.Б., Антонюк А.В., Кузьмин B.C. Вакуум–терапия в лечении хронических ран (методическое пособие для врачей). Ярославль, 2007. 43 с.
24. Bergan J., Shortell C. Venous ulcers. – Elsevier Academic Press publications. 2007. Section II. Chapter 9. P. 105–112.
25. Оболенский В.Н., Никитин В.Г., Кузнецов Н.А. Вакуум–ассистированное лечение венозных трофических язв нижних конечностей // Флебология. 2011. № 2. Т. 5. С. 58–63.
26. Othman D. Negative Pressure Wound Therapy Literature Review of Efficacy, Cost Effectiveness, and Impact on Patients' Quality of Life in Chronic Wound Management and Its Implementation in the United Kingdom // Plast Surg Int. 2012. Р. 374–398.
27. Schintler M.V. Negative pressure therapy: theory and practice // Diabetes Metab Res Rev. 2012 Feb. Vol. 28. Suppl 1. Р. 72–77.
28. Ефуни С.Н. Руководство по гипербарической оксигенации. М., Медицина, 1986.
29. Курганский К.Н., Климин В.Л. Использование криогенной стимуляции в лечении хронических ран: Материалы 68–й Межд. научной итоговой студ. конф. / под ред. В.В. Новицкого Томск, 2009.
30. Звягинцева Т.В., Халин И.В. Метаболитотропная терапия хронических ран. Харьков, 2011. 183 с.
31. Гусева С.Л., Макарова Н.Н., Трухова В.В., Хисматов Р.Р. Актовегин в лечении трофических язв нижних конечностей венозной этиологии // РМЖ. 2008. Т. 16. № 29.
32. Fagien S. Facial soft–tissue augmentation with injactable autologous and allogeneic human tissue collagen matrix (autologen and dermalogen) // Plast. Reconstr Surg. 2000. Vol. 105 (1). Р. 362–373.
33. Кольман Я., Рём К.Г. Наглядная биохимия // М.: Мир, 2004. 469 с.
34. Лоран О.Б., Серегин А.В., Синякова Л.А., Дементьева А.В., Твердохлебов Н.Е. Хирургическая коррекция мочевых свищей у женщин с использованием биоматериала «Коллост»: Материалы 2–го регионального научного форума «Мать и дитя». Сочи, 28–30 апреля 2008 г. С. 171.
35. Нестеренко В.Г., Кубанова А.А., Сафоян А.А., Суслов А.П., Забненкова О.В., Нестеренко С.В. Нативный нереконструированный коллаген «Коллост» – физиологическая матрица для коррекции дефектов кожи. Санкт–Петербургский институт красоты, ГУ НИИЭМ им. Н.Ф. Гамалеи РАМН, Москва: Тезисы 2–го форума медицины и красоты НАДК. М., 2009.
36. Склянчук Е.Д. Стимуляция остеогенеза в комплексном лечении посттравматических нарушений костной регенерации: Дис. ... докт. мед. наук. М., 2009. 260 с.
37. Шестаков И.А. Применение препарата «Коллост» для профилактики несостоятельности толстокишечных анастомозов: Дис. ... канд. мед. наук. М., 2009. 98 с.
38. Andrae J., Gallini R., Betsholtz C // Genes Dev. 2008. Vol. 22. № 10. P.1276–1312.
39. Калмыкова Н.В., Скоробогатая Е.В., Берестовой М.А., Кругляков П.В., Эстрина М.А., Афанасьев Б.В., Полынцев Д.Г. // Клеточные технологии в биологии и медицине. 2011. № 2. С.114–117.
40. Мазуров А.В. Физиология и патология тромбоцитов. М.: Литтерра, 2011. С. 10–56.
41. Delgado J.J., Sánchez E., Baro M., Reyes R., Evora C., Delgado A. // J Mater Sci Mater Med. 2012. Vol. 29. № 8. P.1903–1912.
42. Marx R.E., Carlson E.R., Eichstaedt R.M. et al. Platelet–rich plasma. Growth factor enhancement for bone grafts // Oral Surg Oral Med Oral Pathol Oral Radial Endod. 1998. № 85. Р. 638–646.
43. Anitua E., Andia I., Ardanza B., Nurden P., Nurden AT. Autologousplatelets as a source of proteinsforhealingand tissue regeneration // ThrombHaemost. 2004. Vol. 91 (1). Р. 4–15.
44. Pertungaro P.S. Применение богатой тромбоцитами плазмы с факторами роста (аутогенный тромбоцитарный гель) // Dental–Market. 2002. № 6. С. 26–29.
45. Тачалов В.В. Особенности проведения гигиены полости рта в комплексном лечении заболеваний пародонта после хирургического вмешательства с использованием богатой тромбоцитами плазмы аутокрови: Дис. ... канд. мед. наук. 2010. 141 с.
46. Самодай В.Г., Брехов В.Л., Гайдуков В.Е., Рыльков М.И., Федорищев А.П.
Использование богатой тромбоцитами аутоплазмы в хирургическом лечении дефектов костной ткани с нарушением непрерывности кости // Системный анализ и управление в биомедицинских системах. 2007. Т.6. № 2. С. 493–495.
47. Драгунов А.Г., Александров Ю.В., Поляков С.В., Григорьев В.М., Порфирьева М.В., Масленникова Е.А. Использование обогащенной тромбоцитами плазмы при лечении ишемии нижних конечностей // Ангиология и сосудистая хирургия. 2008. № 4. С. 17–19.
48. Оболенский В.Н., Ермолова Д.А. Применение тромбоцитарных факторов роста и коллагеновых биопрепаратов в лечении больных с хроническими трофическими язвами различной этиологии // Хирургия. 2012. № 5 (42). С. 42–47.
49. Смирнов С.В., Жирикова Е.А., Сычевский М.В. Применение биотехнологий в лечении ожоговых ран: проблемы и перспективы (обзор литературы) // Неотложная медицинская помощь. 2011. № 1. С. 32–35.
50. Ritter M., Rosenblat G., Maretski S., Lazarovich A., Tendler M., Faitelberg, Shamovski V. Role of Polyheal microsphers in wound healing in subjects with chronic ulcers // WUWHS. 2004.
51. Kogan L. Polyheal–1 for the treatment of recalcitrant diabetic foot ulcers: a preliminary report // WUWHS. 2004.
52. Govrin G., Kogan L., Luger E., Tamir J., Zelig G., Shafir R. New Method for Treating Hard–To–Heal Wounds: Clinical Experience with Charged Polystyrene Microsphers // Wounds UK. 2010. Vol 6. № 4. P. 52–61.












