–Т —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е 30 –ї–µ—В –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –њ–Њ–Є—Б–Ї—Г –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤, –Њ—Ж–µ–љ–Ї–µ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Є –≤–ї–Є—П–љ–Є—П –љ–∞ –Є–Љ–Љ—Г–љ–љ—Г—О –Є –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Г—О —Д—Г–љ–Ї—Ж–Є–Є –≤ –Љ–Њ–і–µ–ї—М–љ—Л—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞—Е –љ–∞ —А–∞–Ј–љ—Л—Е —Г—А–Њ–≤–љ—П—Е –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –Є —З–µ–ї–Њ–≤–µ–Ї–∞ –≤ –љ–Њ—А–Љ–µ –Є –њ—А–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –Ъ–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –њ–Є—В–∞–љ–Є—П, –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Ї–Њ—В–Њ—А—Л—Е –љ–∞ –Є–Љ–Љ—Г–љ–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –љ–∞—А—П–і—Г —Б –і—А—Г–≥–Є–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л, –Є–Ј—Г—З–µ–љ—Л –Ї–∞–Ї –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ, —В–∞–Ї –Є –≤ –Ї–ї–Є–љ–Є–Ї–µ –Є —Б–Њ—Б—В–∞–≤–Є–ї–Є –Њ—Б–љ–Њ–≤—Г –≥—А—Г–њ–њ—Л —Б–Љ–µ—Б–µ–є –і–ї—П –≠–Я, –љ–∞–Ј–≤–∞–љ—Л—Е –Є–Љ–Љ—Г–љ–љ—Л–Љ–Є (—Б—В—А–µ—Б—Б–Њ—А–љ—Л–Љ–Є, –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–Є–Љ–Є, –њ–Њ–≤—Л—И–∞—О—Й–Є–Љ–Є –Є–Љ–Љ—Г–љ–Є—В–µ—В). –Я–Є—В–∞—В–µ–ї—М–љ–∞—П –њ–Њ–і–і–µ—А–ґ–Ї–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Н—В–Є–Љ–Є —Б–Љ–µ—Б—П–Љ–Є –±—Л–ї–∞ –љ–∞–Ј–≤–∞–љ–∞ –Є–Љ–Љ—Г–љ–Њ–њ–Є—В–∞–љ–Є–µ–Љ. –Э–∞—А—П–і—Г —Б —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ–Є –њ–Є—В–∞–љ–Є—П –≤ —Б–Њ—Б—В–∞–≤ –Є–Љ–Љ—Г–љ–љ—Л—Е —Б–Љ–µ—Б–µ–є –≤–Ї–ї—О—З–µ–љ—Л —Б–Њ–µ–і–Є–љ–µ–љ–Є—П —Б –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–Љ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—Й–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –Ъ –љ–Є–Љ –Њ—В–љ–Њ—Б—П—В—Б—П —Б–Љ–µ—Б–Є, –≤–Ї–ї—О—З–∞—О—Й–Є–µ –∞—А–≥–Є–љ–Є–љ, –Њ–Љ–µ–≥–∞–3 –ґ–Є—А–љ—Л–µ –Ї–Є—Б–ї–Њ—В—Л, –†–Э–Ъ. –Т –љ–Є—Е –Љ–Њ–ґ–µ—В –±—Л—В—М —Г–≤–µ–ї–Є—З–µ–љ–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л—Е –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Є –Љ–Є–љ–µ—А–∞–ї–Њ–≤.
–Ь–µ—Е–∞–љ–Є–Ј–Љ—Л –і–µ–є—Б—В–≤–Є—П
–Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Є–Љ–Љ—Г–љ–Њ–њ–Є—В–∞–љ–Є—П
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Д—Г–љ–і–∞–Љ–µ–љ—В–∞–ї—М–љ–Њ–є –љ–∞—Г–Ї–Є —А–∞—Б–Ї—А—Л–ї–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–є –Ї–∞–ґ–і–Њ–≥–Њ –Є–Ј –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Є–Љ–Љ—Г–љ–Њ–њ–Є—В–∞–љ–Є—П [1]. –Ґ–∞–Ї, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —А–Њ–ї—М —Б–њ–µ—Ж–Є–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є–Љ–Љ—Г–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї (–Љ–Є–µ–ї–Њ–Є–і–љ—Л—Е —Б—Г–њ—А–µ—Б—Б–Њ—А–Њ–≤), –Ї–Њ—В–Њ—А–∞—П –Ј–∞–Ї–ї—О—З–∞–ї–∞—Б—М –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –∞—А–≥–Є–љ–Є–љ–Њ–Љ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ –і–ї—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є T––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤. –Ь–Є–µ–ї–Њ–Є–і–љ—Л–µ –Ї–ї–µ—В–Ї–Є–—Б—Г–њ—А–µ—Б—Б–Њ—А—Л —Б–њ–Њ—Б–Њ–±–љ—Л –њ—А–Є–≤–µ—Б—В–Є –Ї —Б–Њ—Б—В–Њ—П–љ–Є—О —В—П–ґ–µ–ї–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞ –∞—А–≥–Є–љ–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є –≤–ї–Є—П–µ—В –љ–∞ –њ—А–Њ–і—Г–Ї—Ж–Є—О –Њ–Ї—Б–Є–і–∞ –∞–Ј–Њ—В–∞ –Є –њ–Њ–≤—А–µ–ґ–і–∞–µ—В –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є—О. –Ш–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–Є–µ –і–Є–µ—В—Л, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –∞—А–≥–Є–љ–Є–љ –Є –Њ–Љ–µ–≥–∞–3 –ґ–Є—А–љ—Л–µ –Ї–Є—Б–ї–Њ—В—Л, –њ—А–µ–Њ–і–Њ–ї–µ–≤–∞—О—В —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є–є —Н—Д—Д–µ–Ї—В –Љ–Є–µ–ї–Њ–Є–і–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б—Г–њ—А–µ—Б—Б–Њ—А–Њ–≤.
–Э—Г–Ї–ї–µ–Њ—В–Є–і—Л –†–Э–Ъ —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В –Њ–±—Й–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤, –Є—Е –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О, —Г–ї—Г—З—И–∞—О—В —Д—Г–љ–Ї—Ж–Є—О —В–Є–Љ—Г—Б–∞. –Ю–Љ–µ–≥–∞–3 –ґ–Є—А–љ—Л–µ –Ї–Є—Б–ї–Њ—В—Л – —Н–є–Ї–Њ–Ј–∞–њ–µ–љ—В–∞–µ–љ–Њ–≤–∞—П (–≠–ЯE) –Є –і–Њ–Ї–Њ–Ј–∞–≥–µ–Ї—Б–∞–µ–љ–Њ–≤–∞—П (–Ф–У–Х) –Ј–∞–Љ–µ—Й–∞—О—В –Њ–Љ–µ–≥–∞–6 –ґ–Є—А–љ—Л–µ –Ї–Є—Б–ї–Њ—В—Л –≤ –Љ–µ–Љ–±—А–∞–љ–∞—Е –Є–Љ–Љ—Г–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї. –≠—В–Њ—В —Н—Д—Д–µ–Ї—В —Г–Љ–µ–љ—М—И–∞–µ—В —Б–Є—Б—В–µ–Љ–љ–Њ–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ —З–µ—А–µ–Ј —Б–Є–љ—В–µ–Ј –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л—Е –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Љ–µ–љ–µ–µ –∞–Ї—В–Є–≤–љ—Л—Е –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –Є –ї–µ–є–Ї–Њ—В—А–Є–µ–љ–Њ–≤. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –≠–ЯE –Є –Ф–У–Х (—А—Л–±–Є–є –ґ–Є—А) –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –љ–Є–Ј–Ї–Њ—Г—А–Њ–≤–љ–µ–≤—Г—О —А–µ–≥—Г–ї—П—Ж–Є—О —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є —П–і–µ—А–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ –Ї–∞–њ–њ–∞ B (–ѓ–§–Ъ–С), –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—Л –∞–і–≥–µ–Ј–Є–Є 1 (–Т–Ъ–Ь–Р–1), –Є –Х–—Б–µ–ї–µ–Ї—В–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є —Б–љ–Є–ґ–∞–µ—В –њ—А–Є–ї–Є–њ–∞–љ–Є–µ –љ–µ–є—В—А–Њ—Д–Є–ї–∞ –Ї —Б—В–µ–љ–Ї–µ —Б–Њ—Б—Г–і–∞ –Є –µ–≥–Њ —В—А–∞–љ—Б—Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Г—О –Љ–Є–≥—А–∞—Ж–Є—О, —З–µ–Љ –Љ–Њ–і—Г–ї–Є—А—Г—О—В —Б–Є—Б—В–µ–Љ–љ–Њ–µ –Є –Љ–µ—Б—В–љ–Њ–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ.
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≠–ЯE –Є –Ф–У–Х –њ–Њ–Љ–Њ–≥–∞—О—В —Б—В–∞–±–Є–ї–Є–Ј–Є—А–Њ–≤–∞—В—М –Љ–Є–Њ–Ї–∞—А–і –Є –њ–Њ–љ–Є–Ј–Є—В—М —Г—А–Њ–≤–µ–љ—М –∞—А–Є—В–Љ–Є–є —Б–µ—А–і—Ж–∞, —Б–љ–Є–Ј–Є—В—М –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Њ—Б—В—А–Њ–≥–Њ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–≥–Њ –і–Є—Б—В—А–µ—Б—Б–—Б–Є–љ–і—А–Њ–Љ–∞ (–Ю–†–Ф–°), —Г–Љ–µ–љ—М—И–Є—В—М –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П —Б–µ–њ—Б–Є—Б–∞.
–У–ї—Г—В–∞–Љ–Є–љ, —П–≤–ї—П—П—Б—М —Г—Б–ї–Њ–≤–љ–Њ –Ј–∞–Љ–µ–љ–Є–Љ–Њ–є –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В–Њ–є, –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Г—О –Ј–∞—Й–Є—В—Г, –Є–Љ–Љ—Г–љ–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О, —Б–Є–љ—В–µ–Ј –±–µ–ї–Ї–Њ–≤ —В–µ–њ–ї–Њ–≤–Њ–≥–Њ —И–Њ–Ї–∞, –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –∞–Ј–Њ—В—Б–±–µ—А–µ–≥–∞—О—Й–Є–є —Н—Д—Д–µ–Ї—В. –Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ: –≥–ї—Г—В–∞–Љ–Є–љ —Г—З–∞—Б—В–≤—Г–µ—В –≤ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –Љ–љ–Њ–≥–Є—Е –≥–µ–љ–Њ–≤ [2].
–Ф–Њ–±–∞–≤–ї–µ–љ–Є–µ —Б–µ–ї–µ–љ–∞, –∞—Б–Ї–Њ—А–±–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–≤–Є—В–∞–Љ–Є–љ C) –Є –≤–Є—В–∞–Љ–Є–љ–∞ –Х —Г—Б–Є–ї–Є–≤–∞–µ—В –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Г—О –Ј–∞—Й–Є—В—Г.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤ –Љ–Є—А–µ –Є–Љ–µ–µ—В—Б—П –±–Њ–ї–µ–µ 8 —Б–Љ–µ—Б–µ–є –і–ї—П –Є–Љ–Љ—Г–љ–Њ–њ–Є—В–∞–љ–Є—П. –Ю–і–љ–∞–Ї–Њ —Б–Љ–µ—Б—М—О —Б –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –і–Њ–Ї–∞–Ј–∞–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П –љ–∞ —Н—В–∞–њ–µ –ї–µ—З–µ–љ–Є—П –≤ –Ю–†–Ш–Ґ –Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –Њ—В–і–µ–ї–µ–љ–Є—П—Е —П–≤–ї—П–µ—В—Б—П —Б–Љ–µ—Б—М –Ш–Љ–њ–∞–Ї—В (–Э–µ—Б—В–ї–µ). –Ю–± —Н—В–Њ–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–Њ—Б–ї—Г–ґ–Є–≤—И–Є—Е –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П 80 –њ—Г–±–ї–Є–Ї–∞—Ж–Є–є, –±–Њ–ї–µ–µ 40 –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –≤–Ї–ї—О—З–∞—О—В –і–∞–љ–љ—Л–µ –Њ –≤–ї–Є—П–љ–Є–Є —Б–Љ–µ—Б–Є –Ш–Љ–њ–∞–Ї—В –љ–∞ –Ї–Њ–љ–µ—З–љ—Л–є —А–µ–Ј—Г–ї—М—В–∞—В –ї–µ—З–µ–љ–Є—П.
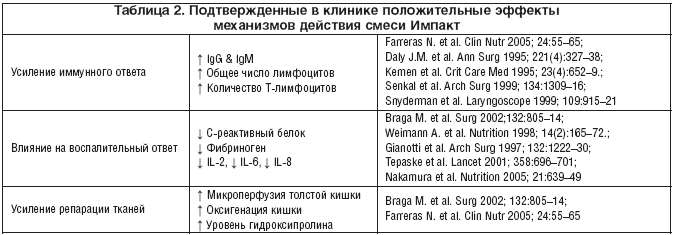
–Т —В–∞–±–ї–Є—Ж–µ 1 –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –Њ—Б–љ–Њ–≤–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –і–µ–є—Б—В–≤–Є—П –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ —Б–Љ–µ—Б–Є –Ш–Љ–њ–∞–Ї—В –Є –Є—Е —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≤ —Б–Љ–µ—Б—П—Е –Ш–Љ–њ–∞–Ї—В –і–ї—П –Њ—А–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –Є –≠–Я.
–Т–ї–Є—П–љ–Є–µ –Ш–Љ–њ–∞–Ї—В–∞ –љ–∞ –Є–Љ–Љ—Г–љ–љ—Л–є
–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –Њ—В–≤–µ—В –Є —А–µ–њ–∞—А–∞—Ж–Є—О —В–Ї–∞–љ–µ–є
–Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –Ш–Љ–њ–∞–Ї—В–∞ –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–ї—Б—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ–Љ –µ–≥–Њ –і–µ–є—Б—В–≤–Є—П –љ–∞:
• –Є–Љ–Љ—Г–љ–љ—Л–є –Њ—В–≤–µ—В – –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–Њ–≤ G –Є –Ь, –Њ–±—Й–µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –Є –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤;
• –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –Њ—В–≤–µ—В – —Б–љ–Є–ґ–µ–љ–Є–µ –°–—А–µ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ –±–µ–ї–Ї–∞, —Д–Є–±—А–Є–љ–Њ–≥–µ–љ–∞, —Г—А–Њ–≤–љ–µ–є –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–Њ–≤ 2, 6, 8;
• —А–µ–њ–∞—А–∞—Ж–Є—О —В–Ї–∞–љ–µ–є: —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є –Є –Њ–Ї—Б–Є–≥–µ–љ–∞—Ж–Є–Є, –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–Є–і—А–Њ–Ї—Б–Є–њ—А–Њ–ї–Є–љ–∞ (—В–∞–±–ї. 2).
–†–µ–Ј—Г–ї—М—В–∞—В—Л –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є
–Є –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–Њ–≤ –њ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—О
—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ш–Љ–њ–∞–Ї—В–∞ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ
–Ч–љ–∞—З–Є—В–µ–ї—М–љ–∞—П —З–∞—Б—В—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е, –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Т —З–Є—Б–ї–µ —Н—В–Є—Е –њ—Г–±–ї–Є–Ї–∞—Ж–Є–є –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј—Л, –Њ–±–Њ–±—Й–Є–≤—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є:
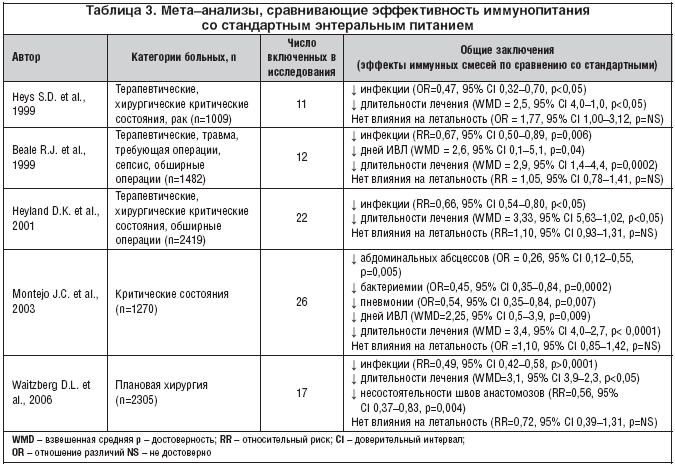
1. –Ь–µ—В–∞––∞–љ–∞–ї–Є–Ј 12 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤—Л—Б–Њ–Ї–Њ–≥–Њ —Г—А–Њ–≤–љ—П (750 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ – –Є–Љ–Љ—Г–љ–Њ–њ–Є—В–∞–љ–Є–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б 732 –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є – –Ї–Њ–љ—В—А–Њ–ї—М – –њ–Є—В–∞–љ–Є–µ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ–Є —Б–Љ–µ—Б—П–Љ–Є) —Г —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е, —В—А–∞–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї –Њ —Б–љ–Є–ґ–µ–љ–Є–Є –≤—А–µ–Љ–µ–љ–Є –љ–∞—Е–Њ–ґ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ –Ш–Т–Ы –љ–∞ 2,6 —Б—Г—В–Њ–Ї, —Б—А–Њ–Ї–Њ–≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –љ–∞ 3 —Б—Г—В–Њ–Ї, —А–Є—Б–Ї–∞ –њ–Њ—П–≤–ї–µ–љ–Є—П –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –љ–∞ 30% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є —Б—В–∞–љ–і–∞—А—В–љ—Г—О —Б–Љ–µ—Б—М [3].
2. –Ь–µ—В–∞––∞–љ–∞–ї–Є–Ј [4] 11 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (1009 –±–Њ–ї—М–љ—Л—Е) –њ–Њ–і—В–≤–µ—А–і–Є–ї —Б–љ–Є–ґ–µ–љ–Є–µ —Б–µ—А—М–µ–Ј–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є –≤—А–µ–Љ–µ–љ–Є —Б—В–∞—Ж–Є–Њ–љ–∞—А–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е –Є –±–Њ–ї—М–љ—Л—Е —А–∞–Ї–Њ–Љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–Є–µ–Љ–Њ–Љ —Б—В–∞–љ–і–∞—А—В–љ—Л—Е —Б–Љ–µ—Б–µ–є.
3. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±–Ј–Њ—А–∞ 26 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є Montejo et al. (2003) [5] –њ—А–Є—И–ї–Є –Ї –Ј–∞–Ї–ї—О—З–µ–љ–Є—О –Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–Љ –≤–ї–Є—П–љ–Є–Є —Б–Љ–µ—Б–Є –Ш–Љ–њ–∞–Ї—В –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ–Є —Б–Љ–µ—Б—П–Љ–Є –љ–∞ —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞: –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –∞–±—Б—Ж–µ—Б—Б–Њ–≤ –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є, –≥–Њ—Б–њ–Є—В–∞–ї—М–љ—Л—Е –њ–љ–µ–≤–Љ–Њ–љ–Є–є, –±–∞–Ї—В–µ—А–Є–µ–Љ–Є–Є, –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є –≤–µ–љ—В–Є–ї—П—Ж–Є–Є –ї–µ–≥–Ї–Є—Е, –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П.
4. Heyland et al. (2001) [6] –≤ –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–µ, –Њ–±—К–µ–і–Є–љ–Є–≤—И–µ–Љ 22 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–Љ–Љ—Г–љ–љ—Л—Е —Н–љ—В–µ—А–∞–ї—М–љ—Л—Е —Б–Љ–µ—Б–µ–є —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ –≠–Я —Г 2419 —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е, —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–±—И–Є—А–љ—Л–Љ–Є –Њ–њ–µ—А–∞—Ж–Є—П–Љ–Є, –љ–∞—Е–Њ–і–Є–≤—И–Є—Е—Б—П –љ–∞ –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є –≤–µ–љ—В–Є–ї—П—Ж–Є–Є –ї–µ–≥–Ї–Є—Е, –њ—А–Є—И–ї–Є –Ї –Ј–∞–Ї–ї—О—З–µ–љ–Є—О –Њ —Б–љ–Є–ґ–µ–љ–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –Њ–± –Њ—В—Б—Г—В—Б—В–≤–Є–Є –≤–ї–Є—П–љ–Є—П –љ–∞ –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Є–Љ–Љ—Г–љ–Њ–њ–Є—В–∞–љ–Є—П. –Э–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Є–Љ–Љ—Г–љ–Њ–њ–Є—В–∞–љ–Є–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е —Б —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є.
5. Waitzberg et al. (2006) [7] –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є 17 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≥–і–µ —Б–Љ–µ—Б—М –Ш–Љ–њ–∞–Ї—В –њ—А–Є–Љ–µ–љ—П–ї–∞—Б—М –і–Њ –Є –њ–Њ—Б–ї–µ –њ–ї–∞–љ–Њ–≤–Њ–є —Е–Є—А—Г—А–≥–Є–Є, –Є –Є–Ј—Г—З–∞–ї–Њ—Б—М –µ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–Њ–љ–µ—З–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П. –Т 10 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б—А–∞–≤–љ–Є–≤–∞–ї–Њ—Б—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б–Љ–µ—Б–Є –Ш–Љ–њ–∞–Ї—В –њ–µ—А–µ–і –Њ–њ–µ—А–∞—Ж–Є–µ–є —Б –њ–µ—А–Є–Њ–њ–µ—А–∞—В–Є–≤–љ—Л–Љ –≤ –њ–ї–∞–љ–Њ–≤–Њ–є —Е–Є—А—Г—А–≥–Є–Є –Є –≤ 7 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е – –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ. –Т 14 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Њ—Ж–µ–љ–Ї–∞ –Ш–Љ–њ–∞–Ї—В–∞ –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Њ–Њ–њ–µ—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –љ–∞ –Ц–Ъ–Ґ. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ш–Љ–њ–∞–Ї—В–∞ –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г (39–61%) —Б–Њ–Ї—А–∞—Й–µ–љ–Є—О –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є —Б—А–Њ–Ї–Њ–≤ –ї–µ—З–µ–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ (–≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 2 –і–љ—П). –Э–µ—Б–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ—Б—В—М —И–≤–Њ–≤ –∞–љ–∞—Б—В–Њ–Љ–Њ–Ј–Њ–≤ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ш–Љ–њ–∞–Ї—В–∞ –≤—Б—В—А–µ—З–∞–ї–∞—Б—М –љ–∞ 48%, –∞ –≤–љ—Г—В—А–Є–±—А—О—И–љ—Л–µ –∞–±—Б—Ж–µ—Б—Б—Л – –љ–∞ 57% —А–µ–ґ–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Њ–њ–µ—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –љ–∞ –Ц–Ъ–Ґ (—А–Є—Б. 1), –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –њ–µ—А–µ–і –Њ–њ–µ—А–∞—Ж–Є–µ–є 500–1000 –Љ–ї –µ–ґ–µ–і–љ–µ–≤–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 5–7 –і–љ–µ–є –њ–µ—А–µ–і –Њ–њ–µ—А–∞—Ж–Є–µ–є. –≠—В–Њ —Г–ї—Г—З—И–∞–ї–Њ —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П –њ—А–Є –њ–ї–∞–љ–Њ–≤–Њ–є —Е–Є—А—Г—А–≥–Є–Є –≤ —Ж–µ–ї–Њ–Љ –Є —Е–Є—А—Г—А–≥–Є–Є –Ц–Ъ–Ґ, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є.
–Ь–µ—В–∞––∞–љ–∞–ї–Є–Ј—Л, —Б—А–∞–≤–љ–Є–≤–∞—О—Й–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є–Љ–Љ—Г–љ–Њ–њ–Є—В–∞–љ–Є—П —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ —Н–љ—В–µ—А–∞–ї—М–љ—Л–Љ –њ–Є—В–∞–љ–Є–µ–Љ, –њ—А–µ–і—Б—В–∞–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 3.
–≠–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М
Strickland et al. (2005) [8], –Є—Б–њ–Њ–ї—М–Ј—Г—П –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –±–∞–Ј—Л –і–∞–љ–љ—Л—Е 126 –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є—Е –Ї–ї–Є–љ–Є–Ї (–±–Њ–ї–µ–µ 1 –Љ–ї–љ. –±–Њ–ї—М–љ—Л—Е), —Г—Б—В–∞–љ–Њ–≤–Є–ї–Є –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Г—О —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–Љ–Љ—Г–љ–љ—Л—Е –і–Є–µ—В –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±—Й–µ–≥–Њ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є–Љ–Љ—Г–љ–Њ–њ–Є—В–∞–љ–Є—П —Б–љ–Є–ґ–∞–ї–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є —Б—А–Њ–Ї–Є —Б—В–∞—Ж–Є–Њ–љ–∞—А–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –љ–∞ 9,7 –і–љ–µ–є, —З—В–Њ —Н–Ї–Њ–љ–Њ–Љ–Є–ї–Њ 2066 $ –љ–∞ –Њ–і–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞, —Г —В—А–∞–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –љ–∞ 688 $ –Є 308 $ (—А–Є—Б. 2).
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Farber M. et al. [9] —Б—А–∞–≤–љ–Є–≤–∞–ї–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ш–Љ–њ–∞–Ї—В–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ —Б –≥—А—Г–њ–њ–Њ–є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ –њ–Є—В–∞–љ–Є–µ–Љ. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–ї—Г—З–∞–µ–≤ –љ–Њ–Ј–Њ–Ї–Њ–Љ–Є–∞–ї—М–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ш–Љ–њ–∞–Ї—В (12%), –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ (52%, p<0,01). –Я–Њ–Ї–∞–Ј–∞–љ–∞ —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О –і–љ–µ–є –њ—А–µ–±—Л–≤–∞–љ–Є—П –љ–∞ –Ш–Т–Ы –Є –≤ –Ю–†–Ш–Ґ. –≠—В–Є —А–∞–Ј–ї–Є—З–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є —Б–љ–Є–Ј–Є—В—М —Б—В–Њ–Є–Љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –љ–∞ $ 193 500.
–Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –≤ —Ж–µ–ї–Њ–Љ –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ш–Љ–њ–∞–Ї—В–∞ –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–Љ—Г –Ї–Њ–љ–µ—З–љ–Њ–Љ—Г —А–µ–Ј—Г–ї—М—В–∞—В—Г (—Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ —Б—А–Њ–Ї–Њ–≤ –ї–µ—З–µ–љ–Є—П –Є –µ–≥–Њ —Б—В–Њ–Є–Љ–Њ—Б—В–Є) —Г —И–Є—А–Њ–Ї–Њ–≥–Њ –Ї–Њ–љ—В–Є–љ–≥–µ–љ—В–∞ –±–Њ–ї—М–љ—Л—Е: –њ–Њ—Б–ї–µ —Н–Ї—Б—В—А–µ–љ–љ—Л—Е –Є –њ–ї–∞–љ–Њ–≤—Л—Е —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є, –њ–Њ—Б–ї–µ —В—А–∞–≤–Љ—Л – –Њ–ґ–Њ–≥–Є, —З–µ—А–µ–њ–љ–Њ––Љ–Њ–Ј–≥–Њ–≤–∞—П —В—А–∞–≤–Љ–∞, –њ—А–Њ–љ–Є–Ї–∞—О—Й–Є–µ —А–∞–љ–µ–љ–Є—П, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е, —Б —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О, –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є –≤–µ–љ—В–Є–ї—П—Ж–Є–µ–є –ї–µ–≥–Ї–Є—Е, –њ—А–Є —Б–µ–њ—Б–Є—Б–µ –ї–µ–≥–Ї–Њ–є –Є —Б—А–µ–і–љ–µ–є —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є, –Љ–∞—Б—Б–Є–≤–љ—Л—Е —А–∞–љ–∞—Е.
–Я—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є
–°–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–≥–Њ –Ю–±—Й–µ—Б—В–≤–∞ –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л (SCCM) –Є –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –Є —Н–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П (ASPEN) 2009 –≥. [10], –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ—Л–Љ –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ю–†–Ш–Ґ, –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –≤ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е, –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–Є–µ —Н–љ—В–µ—А–∞–ї—М–љ—Л–µ —Б–Љ–µ—Б–Є, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –∞—А–≥–Є–љ–Є–љ, –≥–ї—Г—В–∞–Љ–Є–љ, –љ—Г–Ї–ї–µ–Є–љ–Њ–≤—Л–µ –Ї–Є—Б–ї–Њ—В—Л, –Њ–Љ–µ–≥–∞–3 –ґ–Є—А–љ—Л–µ –Ї–Є—Б–ї–Њ—В—Л –Є –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В—Л (–њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–ї–∞—Б—М —Б–Љ–µ—Б—М –Ш–Љ–њ–∞–Ї—В), –і–Њ–ї–ґ–љ—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –і–ї—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –≥—А—Г–њ–њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤: –Љ–∞—Б—Б–Є–≤–љ–∞—П –њ–ї–∞–љ–Њ–≤–∞—П —Е–Є—А—Г—А–≥–Є—П, —В—А–∞–≤–Љ–∞, –Њ–ґ–Њ–≥–Є, —А–∞–Ї –≥–Њ–ї–Њ–≤—Л –Є —И–µ–Є –Є —Г –Ї—А–Є—В–Є—З–µ—Б–Ї–Є –±–Њ–ї—М–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є –≤–µ–љ—В–Є–ї—П—Ж–Є–Є –ї–µ–≥–Ї–Є—Е, —Б –њ—А–µ–і–Њ—Б—В–µ—А–µ–ґ–µ–љ–Є–µ–Љ —Г –±–Њ–ї—М–љ—Л—Е —Б —В—П–ґ–µ–ї—Л–Љ —Б–µ–њ—Б–Є—Б–Њ–Љ. –Ф–ї—П —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ю–†–Ш–Ґ: —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –Ї–ї–∞—Б—Б–∞ A, –і–ї—П —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ю–†–Ш–Ґ – –Ї–ї–∞—Б—Б–∞ –Т.
–Ю–і–љ–∞–Ї–Њ –і–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–≥–Њ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Њ—В –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–Є—Е —Б–Љ–µ—Б–µ–є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ–±–µ—Б–њ–µ—З–Є—В—М –њ–∞—Ж–Є–µ–љ—В—Г –љ–µ –Љ–µ–љ–µ–µ 50–65% –Њ—В —Ж–µ–ї–µ–≤—Л—Е –њ–Њ—В—А–µ–±–љ–Њ—Б—В–µ–є –≤ —Н–љ–µ—А–≥–Є–Є (–Ї–ї–∞—Б—Б C) [10].
–Т –≥–ї–∞–≤–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –Ю–±—Й–µ—Б—В–≤–∞ –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –Є —Н–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П (–ХSPEN) 2006 –≥. [11], –њ–Њ—Б–≤—П—Й–µ–љ–љ–Њ–є –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Є–Љ–Љ—Г–љ–Њ–њ–Є—В–∞–љ–Є—П –њ—А–Є –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е, –≥–Њ–≤–Њ—А–Є—В—Б—П –Њ —В–Њ–Љ, —З—В–Њ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–Є–µ —Б–Љ–µ—Б–Є, –Њ–±–Њ–≥–∞—Й–µ–љ–љ—Л–µ –∞—А–≥–Є–љ–Є–љ–Њ–Љ, –љ—Г–Ї–ї–µ–Є–љ–Њ–≤—Л–Љ–Є –Ї–Є—Б–ї–Њ—В–∞–Љ–Є, –Њ–Љ–µ–≥–∞–3 –ґ–Є—А–љ—Л–Љ–Є –Ї–Є—Б–ї–Њ—В–∞–Љ–Є –ї—Г—З—И–µ —Б—В–∞–љ–і–∞—А—В–љ—Л—Е –Є –і–Њ–ї–ґ–љ—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П
– —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є –њ–ї–∞–љ–Њ–≤–Њ–є —Е–Є—А—Г—А–≥–Є–Є –Ц–Ъ–Ґ (–Ї–ї–∞—Б—Б A) (—Б–Љ. –љ–Є–ґ–µ)
– —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–µ–њ—Б–Є—Б–Њ–Љ —Б—А–µ–і–љ–µ–є —В—П–ґ–µ—Б—В–Є (APACHE<15) (–Ї–ї–∞—Б—Б B)
– —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —В—А–∞–≤–Љ–Њ–є (–Ї–ї–∞—Б—Б A)
– –љ–µ–ї—М–Ј—П —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–Є–µ —Б–Љ–µ—Б–Є –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–ґ–Њ–≥–∞–Љ–Є –Є–Ј––Ј–∞ –љ–µ–і–Њ—Б—В–∞—В–Ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є
–Я–∞—Ж–Є–µ–љ—В—Л –Ю–†–Ш–Ґ –≤ –Ї—А–∞–є–љ–µ —В—П–ґ–µ–ї–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є, –Ї–Њ—В–Њ—А—Л–µ –љ–µ –њ–µ—А–µ–љ–Њ—Б—П—В –≤–≤–µ–і–µ–љ–Є–µ –±–Њ–ї–µ–µ —З–µ–Љ 700 –Љ–ї —Н–љ—В–µ—А–∞–ї—М–љ–Њ–є —Б–Љ–µ—Б–Є –≤ —Б—Г—В–Ї–Є, –љ–µ –і–Њ–ї–ґ–љ—Л –њ–Њ–ї—Г—З–∞—В—М –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—О—Й—Г—О —Б–Љ–µ—Б—М, –Њ–±–Њ–≥–∞—Й–µ–љ–љ—Г—О –∞—А–≥–Є–љ–Є–љ–Њ–Љ, –љ—Г–Ї–ї–µ–Њ—В–Є–і–∞–Љ–Є –Є –Њ–Љ–µ–≥–∞–3 –ґ–Є—А–љ—Л–Љ–Є –Ї–Є—Б–ї–Њ—В–∞–Љ–Є (–Ї–ї–∞—Б—Б B)
–°–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –ХSPEN 2006 –≥. –і–ї—П —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е [12] –Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е [13] –±–Њ–ї—М–љ—Л—Е –Є–Љ–Љ—Г–љ–Њ–њ–Є—В–∞–љ–Є–µ —Б–ї–µ–і—Г–µ—В –њ—А–Њ–≤–Њ–і–Є—В—М –њ–∞—Ж–Є–µ–љ—В–∞–Љ –њ–Њ—Б–ї–µ –Љ–∞—Б—Б–Є–≤–љ—Л—Е –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є (—Н–Ј–Њ—Д–∞–≥–Њ—Н–Ї—В–Њ–Љ–Є—П, –≥–∞—Б—В—А—Н–Ї—В–Њ–Љ–Є—П, –њ–∞–љ–Ї—А–µ–∞—В–Њ–і—Г–Њ–і–µ–љ—Н–Ї—В–Њ–Љ–Є—П) –њ–Њ –њ–Њ–≤–Њ–і—Г —А–∞–Ї–∞ –≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, –њ–Њ—Б–ї–µ —В—П–ґ–µ–ї–Њ–є —В—А–∞–≤–Љ—Л (–Ї–ї–∞—Б—Б –Р). –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –љ–∞—З–Є–љ–∞—В—М –њ–Є—В–∞–љ–Є–µ –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Љ–µ—Б—М—О –Ј–∞ 5–7 –і–љ–µ–є –і–Њ –Њ–њ–µ—А–∞—Ж–Є–Є –Є –њ—А–Њ–і–Њ–ї–ґ–∞—В—М –≤ —В–µ—З–µ–љ–Є–µ 5–7 –і–љ–µ–є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є (–Ї–ї–∞—Б—Б –°).
–£–±–µ–і–Є—В–µ–ї—М–љ—Л–µ –Њ–±–Њ–±—Й–µ–љ–Є—П –Њ –±–Њ–ї—М—И–µ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ш–Љ–њ–∞–Ї—В–∞ (–Њ—А–∞–ї—М–љ–Њ–≥–Њ –Є —Н–љ—В–µ—А–∞–ї—М–љ–Њ–≥–Њ) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ–Є —Б–Љ–µ—Б—П–Љ–Є –≤ –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —А–∞–Ї–Њ–Љ –ґ–µ–ї—Г–і–Ї–∞, –њ–Є—Й–µ–≤–Њ–і–∞, –Њ–њ—Г—Е–Њ–ї—П–Љ–Є –≥–Њ–ї–Њ–≤—Л –Є —И–µ–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –°. Mariette [14] –Є S. Magnusson [15]. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–Љ–µ—Б–Є –Ш–Љ–њ–∞–Ї—В –і–Њ –Є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–Њ–Ї—А–∞—Й–µ–љ–Є—О –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є –≤—А–µ–Љ–µ–љ–Є –ї–µ—З–µ–љ–Є—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Є–Ј–ї–Њ–ґ–µ–љ–љ–Њ–≥–Њ –≤—Л—И–µ (–љ–∞—Г—З–љ–Њ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–µ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б–Њ–≥–ї–∞—Б–љ–Њ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ, –≤—Л–њ–Њ–ї–љ—П–µ–Љ—Л–Љ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –њ–Њ—Б–ї–µ–і–љ–Є—Е 15 –ї–µ—В, –∞ —В–∞–Ї–ґ–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є—Е –Є –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є) —Б–Љ–µ—Б—М –Ш–Љ–њ–∞–Ї—В –Љ–Њ–ґ–љ–Њ —Б—З–Є—В–∞—В—М –ї—Г—З—И–µ–є –Є –Њ—В–і–∞—В—М –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –њ–Є—В–∞—В–µ–ї—М–љ–Њ–є –њ–Њ–і–і–µ—А–ґ–Ї–Є –±–Њ–ї—М–љ—Л—Е —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П –≤ –њ—А–µ–і–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ, –њ–µ—А–Є–Њ–і–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–љ–Є–є –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ—Л—Е —Г—А–Њ–≤–љ–µ–є –Ї –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–Љ–µ—Б–Є –Ш–Љ–њ–∞–Ї—В –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–∞–µ—В —З–Є—Б–ї–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —Г–Љ–µ–љ—М—И–∞–µ—В –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–µ–±—Л–≤–∞–љ–Є—П –≤ –Ю–†–Ш–Ґ –Є —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ, –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–Њ–Ї—А–∞—Й–∞–µ—В –Ј–∞—В—А–∞—В—Л –љ–∞ –ї–µ—З–µ–љ–Є–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ–Є —Б–Љ–µ—Б—П–Љ–Є —Г –±–Њ–ї—М–љ—Л—Е —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П. –Я–Є—В–∞–љ–Є–µ —Б–Љ–µ—Б—М—О –Ш–Љ–њ–∞–Ї—В –і–Њ–ї–ґ–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –Ї–∞–Ї —Г –±–Њ–ї—М–љ—Л—Е —Б –њ–Њ–љ–Є–ґ–µ–љ–љ—Л–Љ —Б—В–∞—В—Г—Б–Њ–Љ –њ–Є—В–∞–љ–Є—П, —В–∞–Ї –Є —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ. –≠—В–Є–Љ –±–Њ–ї—М–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≠–Я –Ј–∞ 5–7 –і–љ–µ–є –і–Њ –Є –≤ —В–µ—З–µ–љ–Є–µ 7 –і–љ–µ–є –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є (1000 –Ї–Ї–∞–ї/—Б—Г—В). –Т—Б–µ–Љ —Н—В–Є–Љ –Ї–∞—В–µ–≥–Њ—А–Є—П–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–Љ—Г–љ–Њ–њ–Є—В–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –≤ –Ю–†–Ш–Ґ. –Ш–Љ–њ–∞–Ї—В –Љ–Њ–ґ–µ—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–µ–њ—Б–Є—Б–Њ–Љ —Б—А–µ–і–љ–µ–є —В—П–ґ–µ—Б—В–Є (APACHE<15) –Є —Б —В—А–∞–≤–Љ–∞–Љ–Є.
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–∞–ї–Є—З–Є–µ –ґ–Є–і–Ї–Њ–є —Д–Њ—А–Љ—Л —Б–Љ–µ—Б–Є –і–ї—П –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —И–Є—А–Њ–Ї–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –Ш–Љ–њ–∞–Ї—В –њ–Њ–ї–Є–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –±–Њ–ї—М–љ—Л–Љ –і–ї—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –њ–Є—В–∞—В–µ–ї—М–љ–Њ–є –њ–Њ–і–і–µ—А–ґ–Ї–Є (–Ј–∞–ґ–Є–≤–ї–µ–љ–Є–µ —А–∞–љ, –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –Є–Љ–Љ—Г–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є) –≤ –њ–µ—А–Є–Њ–і —А–µ–Ї–Њ–љ–≤–∞–ї–µ—Б—Ж–µ–љ—Ж–Є–Є –Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –љ–∞—Е–Њ–і—П—Й–Є–Љ—Б—П –љ–∞ –і–Њ–Љ–∞—И–љ–µ–Љ –ї–µ—З–µ–љ–Є–Є.


![–†–Є—Б. 2. –≠–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є–Љ–Љ—Г–љ–Њ–њ–Є—В–∞–љ–Є—П [Strickland A. et al. JPEN 2005]](/data/articles/Image/t18/n29/1794-4.gif)
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Santora R, Kozar RA. Molecular mechanisms of pharmaconutrients. //World J Surg. 2009.–V.–33.–N9.–p.1815–21
2. Curi R, Newsholme P., Procopio J. Et al. Glutamine, gene expression, and cell function.// Frontiers in Bioscicnce . 2007; V. 12, 1. p, 344–357
3. Heys SD, Walker LG, Smith I, Eremin O. Enteral nutritional supplementation with key nutrients in patients with critical illness and cancer: a meta–analysis of randomized controlled clinical trials. Ann Surg. 1999; V. 229:467–477.
4. Beale RJ, Bryg DJ, Bihari DJ. Immunonutrition in the critically ill: a systematic review of clinical outcome. Crit Care Med. 1999; V.27: 2799–2805.
5. Montejo JC, Zarazaga A, Lopez–Martinez J, et al. Immunonutrition in the intensive care unit: a systematic review and consensus statement. Clin Nutr. 2003;22:221–233.
6. Heyland DK, Novak F, Drover JW, Jain M, Su X, Suchner U. Should immunonutrition become routine in critically ill patients? A systematic review of the evidence. JAMA. 2001; V.286:944–953.
7. Waitzberg DL, Saito H, Plank LD, et al. Postsurgical infections are reduced with specialized nutrition support. World J Surg. 2006;30:1592–1604
8. Strickland A, Brogan A, Krauss J et al. Is the of specialized nutritional formulations a cost–effective strategy? A National Database Evaluation. JPEN 2005; V.29 (90001): S81–S91.
9. Farber M.S., Moses K., Korn M.. Reducing costs and patient morbidity in the enterally fed intensive care unit patient. JPEN 2005; V.29(1 Suppl): S62–S69.
10. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) / McClave S.A., Martindale R. G., Vanek V. W., McCarthy M., Roberts P., Taylor B., Ochoa J.B., Napolitano L., Cresci G., the A.S.P.E.N. Board of Directors, and the American College of Critical Care Medicine // JPEN . 2009. – V. – 33, N – 3. – p 277–316
11. ESPEN Guidelines on Enteral Nutrition: Intensive care./ Kreymann K.G., Berger M.M., Deutz N.E.P. et al. // Clinical Nutrition –2006 – V. –25, p. 210–223
12. ESPEN Guidelines on Enteral Nutrition: Surgery including Organ Transplantation / Weimann A., Braga M., Harsanyic L. et al// Clinical Nutrition – 2006– V. –25, 224–244
13. ESPEN Guidelines on Enteral Nutrition: Non–surgical oncology/Arends J., Bodoky G., Bozzetti F. et al. Clinical Nutrition– 2006– V. –, 245–259
14. Mariette –°. Nutrition therapy in surgical oncology // Satellite Symposium Proceedings from the 15 Congress of ESSO Bordeaux, September 16, 2010, p.–1–2
15. Magnusson S. Role of Nutrition in the head and neck cancer. // Satellite Symposium Proceedings from the 15 Congress of ESSO Bordeaux, September 16, 2010, p.–2–3












