–Я–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–Љ –і–∞–љ–љ—Л–Љ, –њ—А–Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –±–Њ–ї–µ–µ 20 –ї–µ—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –њ–Њ—А–∞–ґ–µ–љ–Є—П –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –њ—А–µ–≤—Л—И–∞–µ—В 80%, –∞ 40–70% –≤—Б–µ—Е –љ–µ—В—А–∞–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –∞–Љ–њ—Г—В–∞—Ж–Є–є –њ—А–Њ–Є–Ј–≤–Њ–і—П—В—Б—П —Г –±–Њ–ї—М–љ—Л—Е –і–Є–∞–±–µ—В–Њ–Љ, –њ—А–Є —Н—В–Њ–Љ –±–ї–Є–ґ–∞–є—И–∞—П –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–∞—П –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –њ—А–µ–≤—Л—И–∞–µ—В 20% [5,12,13]. –Т 85% —Б–ї—Г—З–∞–µ–≤ –∞–Љ–њ—Г—В–∞—Ж–Є—П–Љ –њ—А–µ–і—И–µ—Б—В–≤—Г—О—В —П–Ј–≤—Л [2,6]. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М —П–Ј–≤ —Б—В–Њ–њ—Л —Б—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е –°–Ф –≤ —А–∞–Ј–≤–Є—В—Л—Е —Б—В—А–∞–љ–∞—Е —Б–Њ—Б—В–∞–≤–ї—П–µ—В 4–10%. –•–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –њ–Њ –њ–Њ–≤–Њ–і—Г –≥–љ–Њ–є–љ–Њ––љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –љ–∞ —Д–Њ–љ–µ –°–Ф–° –љ–µ–Є–Ј–±–µ–ґ–љ–Њ –њ—А–Є–≤–Њ–і—П—В –Ї –њ–Њ—П–≤–ї–µ–љ–Є—О —А–∞–љ–µ–≤—Л—Е –Є —П–Ј–≤–µ–љ–љ—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤ —Б—В–Њ–њ—Л —А–∞–Ј–ї–Є—З–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є, –≥–ї—Г–±–Є–љ—Л –Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–≤–Є—В–Є—О —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –њ–Њ–≤—В–Њ—А–љ—Л—Е —В—А–∞–≤–Љ–∞—В–Є—З–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є. –Ф–ї–Є—В–µ–ї—М–љ–Њ–µ —В–µ—З–µ–љ–Є–µ, –≤—Л—Б–Њ–Ї–∞—П —Б—В–µ–њ–µ–љ—М –Є–љ–≤–∞–ї–Є–і–Є–Ј–∞—Ж–Є–Є –Є –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є –≤—Л–≤–Њ–і—П—В –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –°–Ф–° –љ–∞ —Г—А–Њ–≤–µ–љ—М –≤–∞–ґ–љ–µ–є—И–µ–є –Љ–µ–і–Є–Ї–Њ–—Б–Њ—Ж–Є–∞–ї—М–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ—Л, —В—А–µ–±—Г—О—Й–µ–є —А–∞–Ј—А–∞–±–Њ—В–Ї–Є –Є–љ–љ–Њ–≤–∞—Ж–Є–Њ–љ–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П [5,6,10,13].
–£–ї—Г—З—И–µ–љ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —А–∞–љ–µ–≤—Л—Е –Є —П–Ј–≤–µ–љ–љ—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤ —Б—В–Њ–њ—Л –њ—А–Є –°–Ф –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Б–≤—П–Ј—Л–≤–∞—О—В —Б –њ—А–µ–і–µ–ї—М–љ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ–Љ –Њ–њ–Њ—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є. –Я–Њ –і–∞–љ–љ—Л–Љ –ї–Є—В–µ—А–∞—В—Г—А—Л, –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П –Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–Љ –ї–µ—З–µ–љ–Є–Є —А–∞–љ–µ–≤—Л—Е –Є–ї–Є —П–Ј–≤–µ–љ–љ—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤ —Б—В–Њ–њ—Л —П–≤–љ–Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–∞. –°—Г—Й–µ—Б—В–≤—Г—О—В –Њ—В–і–µ–ї—М–љ—Л–µ —А–∞–±–Њ—В—Л, –≥–і–µ –Њ–њ–Є—Б–∞–љ—Л –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Б–њ–Њ—Б–Њ–±—Л –Ї–Њ–ґ–љ–Њ––њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є, –Ї–∞–Ї –≤ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–є, —В–∞–Ї –Є –Ј–∞—А—Г–±–µ–ґ–љ–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ, –±–µ–Ј –і–µ—В–∞–ї—М–љ–Њ–≥–Њ —А–∞–Ј–±–Њ—А–∞ —В–µ—Е–љ–Є—З–µ—Б–Ї–Є—Е –∞—Б–њ–µ–Ї—В–Њ–≤ —Б–∞–Љ–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є, —З–µ—В–Ї–Њ –љ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ—Л –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –Њ–њ–µ—А–∞—Ж–Є–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –≤–µ–і–µ–љ–Є—П —В–∞–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е, –љ–µ—В –њ–Њ–ї–љ—Л—Е –і–∞–љ–љ—Л—Е –Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –ї–µ—З–µ–љ–Є—П, –љ–µ –Њ–њ–Є—Б–∞–љ—Л —Б–њ–Њ—Б–Њ–±—Л –ї–µ—З–µ–љ–Є—П —А–∞–Ј–≤–Є–≤—И–Є—Е—Б—П —А–∞–љ–љ–Є—Е –Є–ї–Є –њ–Њ–Ј–і–љ–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є [5,7,9,10].
–¶–µ–ї—М—О –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В—Л —П–≤–ї—П–µ—В—Б—П —Г–ї—Г—З—И–µ–љ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –ї–µ—З–µ–љ–Є—П —А–∞–љ–µ–≤—Л—Е –Є —П–Ј–≤–µ–љ–љ—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤, —А–∞–Ј–≤–Є–≤—И–Є—Е—Б—П —Г –±–Њ–ї—М–љ—Л—Е –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –ї–µ—З–µ–љ–Є—П –≥–љ–Њ–є–љ–Њ––љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є –≥–∞–љ–≥—А–µ–љ–Њ–Ј–љ–Њ––Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –њ—А–Є –°–Ф–°, —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ–ґ–љ–Њ––њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є.
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Т –љ–∞—Б—В–Њ—П—Й–µ–є —А–∞–±–Њ—В–µ –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П 275 –±–Њ–ї—М–љ—Л—Е —Б —А–∞–љ–µ–≤—Л–Љ–Є –Є —П–Ј–≤–µ–љ–љ—Л–Љ–Є –і–µ—Д–µ–Ї—В–∞–Љ–Є, —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–≤—И–Є–Љ–Є—Б—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –ї–µ—З–µ–љ–Є—П –≥–љ–Њ–є–љ–Њ––љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –°–Ф–°, –Ї–Њ—В–Њ—А—Л–µ –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –љ–∞ –ї–µ—З–µ–љ–Є–Є –≤ –Њ—В–і–µ–ї–µ–љ–Є–Є –≥–љ–Њ–є–љ–Њ–є —Е–Є—А—Г—А–≥–Є–Є –У–Ъ–С вДЦ 15 –Є–Љ. –Ю.–Ь. –§–Є–ї–∞—В–Њ–≤–∞ —Б 2002 –њ–Њ 2007 –≥. –Т–Њ–Ј—А–∞—Б—В –±–Њ–ї—М–љ—Л—Е –≤–∞—А—М–Є—А–Њ–≤–∞–ї –Њ—В 15 –і–Њ 85 –ї–µ—В, —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –±–Њ–ї—М–љ—Л—Е – 56,7±8,4 –ї–µ—В. –°–Ф I —В–Є–њ–∞ —Б—В—А–∞–і–∞–ї–Њ 22 –±–Њ–ї—М–љ—Л—Е (8,0%), –°–Ф II —В–Є–њ–∞ – 253 –±–Њ–ї—М–љ—Л—Е (92,0%). –Я—А–µ–Њ–±–ї–∞–і–∞–ї –ґ–µ–љ—Б–Ї–Є–є –Ї–Њ–љ—В–Є–љ–≥–µ–љ—В – 62,2%. –Т–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ–љ—Л–є –°–Ф –љ–∞–±–ї—О–і–∞–ї–Є —Г 16 –±–Њ–ї—М–љ—Л—Е (11,85%). –Ф–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П —А–µ—В–Є–љ–Њ–њ–∞—В–Є—П –Є–ї–Є –љ–µ—Д—А–Њ–њ–∞—В–Є—П, –Є—Е —Б–Њ—З–µ—В–∞–љ–Є–µ –≤—Л—П–≤–ї–µ–љ—Л —Г 100% –±–Њ–ї—М–љ—Л—Е. –°–Њ–њ—Г—В—Б—В–≤—Г—О—Й–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П –≤ –≤–Є–і–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Б–µ—А–і—Ж–∞ (–Ш–С–°), —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є (–¶–Т–С), –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Њ–њ–Њ—А–љ–Њ––і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞, –Њ–ґ–Є—А–µ–љ–Є—П –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —Г 85% –±–Њ–ї—М–љ—Л—Е.
–£—Б–ї–Њ–≤–љ–Њ –≤—Б–µ –±–Њ–ї—М–љ—Л–µ –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 2 –≥—А—Г–њ–њ—Л:
1 –≥—А—Г–њ–њ–∞ (–Њ—Б–љ–Њ–≤–љ–∞—П) – –±–Њ–ї—М–љ—Л–µ, –Ї–Њ—В–Њ—А—Л–Љ –≤—Л–њ–Њ–ї–љ—П–ї–Є—Б—М —А–∞–Ј–ї–Є—З–љ—Л–µ –≤–Є–і—Л –Ї–Њ–ґ–љ–Њ––њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є (135 –њ–∞—Ж–Є–µ–љ—В–Њ–≤);
2 –≥—А—Г–њ–њ–∞ (–Ї–Њ–љ—В—А–Њ–ї—М–љ–∞—П) – 140 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е –Ј–∞–Ї—А—Л—В–Є–µ —А–∞–љ–µ–≤–Њ–≥–Њ –Є/–Є–ї–Є —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ –Ј–∞ —Б—З–µ—В —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–≥–Њ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П.
–Т –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –љ–∞–±–ї—О–і–µ–љ–Є–є —Б–Њ—Б—В–∞–≤–Є–ї–Є 163 –њ–∞—Ж–Є–µ–љ—В–∞ (59,27%) —Б –љ–µ–є—А–Њ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ–Њ–є –°–Ф–°, –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–∞—П —Д–Њ—А–Љ–∞ –≤—Б—В—А–µ—З–∞–ї–∞—Б—М —Г 112 (40,73% –љ–∞–±–ї—О–і–µ–љ–Є–є). –£ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –±–Њ–ї—М–љ—Л—Е —А–∞–љ–µ–≤—Л–µ –і–µ—Д–µ–Ї—В—Л —А–∞–Ј–≤–Є–ї–Є—Б—М –њ–Њ—Б–ї–µ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ (–≤ –Њ—Б–љ–Њ–≤–љ–Њ–є – 115 (85,18%) –Є 123 (87,85%) –±–Њ–ї—М–љ—Л—Е –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–∞—Е).
–•–Є—А—Г—А–≥–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ –≥–љ–Њ–є–љ–Њ–≥–Њ –Њ—З–∞–≥–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ —Г 29 (21,48%) –±–Њ–ї—М–љ—Л—Е –њ–Њ –њ–Њ–≤–Њ–і—Г —Д–ї–µ–≥–Љ–Њ–љ—Л —А–∞–Ј–ї–Є—З–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є –њ–ї–Њ—Й–∞–і–Є. –£ 23 (17,04%) –±–Њ–ї—М–љ—Л—Е –≤—Л–њ–Њ–ї–љ–µ–љ—Л —Н–Ї–Ј–∞—А—В–Є–Ї—Г–ї—П—Ж–Є–Є –Њ–і–љ–Њ–≥–Њ –Є–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –њ–∞–ї—М—Ж–µ–≤, —А–µ–Ј–µ–Ї—Ж–Є–Є –Ї–Њ—Б—В–µ–є —Б—В–Њ–њ—Л –њ–Њ –њ–Њ–≤–Њ–і—Г –Њ—Б—В–µ–Њ–Љ–Є–µ–ї–Є—В–∞ –њ–∞–ї—М—Ж–µ–≤, –њ–ї—О—Б–љ–µ–≤—Л—Е –Ї–Њ—Б—В–µ–є. –£ 26 (19,26%) –±–Њ–ї—М–љ—Л—Е –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–∞ —Н–Ї–Ј–∞—А—В–Є–Ї—Г–ї—П—Ж–Є—П –Њ–і–љ–Њ–≥–Њ –Є–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –њ–∞–ї—М—Ж–µ–≤ –њ–Њ –њ–Њ–≤–Њ–і—Г –≥–∞–љ–≥—А–µ–љ—Л. –Я–ї–∞–љ—В–∞—А–љ—Л–µ —П–Ј–≤—Л –Є —П–Ј–≤—Л –Ї—Г–ї—М—В–µ–є —Б—В–Њ–њ—Л –Є–Љ–µ–ї–Є—Б—М —Г 20 (14,81%) –±–Њ–ї—М–љ—Л—Е.
–Я–Њ –≥–ї—Г–±–Є–љ–µ –Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–Њ F.W. Wagner (1981) —Б 3––є —Б—В–µ–њ–µ–љ—М—О –љ–∞–±–ї—О–і–∞–ї–Є—Б—М 51 –±–Њ–ї—М–љ–Њ–є (37,78%), —Б IV —Б—В–µ–њ–µ–љ—М—О – 41 (30,37%) –±–Њ–ї—М–љ–Њ–є, –≤—В–Њ—А–Њ–є —Б—В–µ–њ–µ–љ—М—О – 38 (28,15%), —Б –њ–µ—А–≤–Њ–є —Б—В–µ–њ–µ–љ—М—О – 5 (3,7%) –±–Њ–ї—М–љ—Л—Е.
–Я–ї–Њ—Й–∞–і—М —А–∞–љ–µ–≤–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞ –≤–∞—А—М–Є—А–Њ–≤–∞–ї–∞ –Њ—В 2 –і–Њ 120 —Б–Љ2. C—А–µ–і–љ—П—П –њ–ї–Њ—Й–∞–і—М —А–∞–љ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 36,64±14,7 —Б–Љ2. –£ 21 (15,55%) –њ–∞—Ж–Є–µ–љ—В–∞ —А–∞–љ–µ–≤—Л–µ –і–µ—Д–µ–Ї—В—Л —А–∞—Б–њ–Њ–ї–∞–≥–∞–ї–Є—Б—М –љ–∞ —В–Њ—А—Ж–µ–≤–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Б—В–Њ–њ—Л, –≤ –њ—П—В–Њ—З–љ–Њ–є –Њ–±–ї–∞—Б—В–Є – —Г 5 (3,70%) –±–Њ–ї—М–љ—Л—Е; –љ–∞ –Љ–µ–і–Є–∞–ї—М–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є – —Г 11 (8,15%) –±–Њ–ї—М–љ—Л—Е; –љ–∞ –ї–∞—В–µ—А–∞–ї—М–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є – —Г 14 (10,37%) –±–Њ–ї—М–љ—Л—Е; –љ–∞ –њ–Њ–і–Њ—И–≤–µ–љ–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є – —Г 8 (5,93%) –±–Њ–ї—М–љ—Л—Е; –љ–∞ —В—Л–ї–µ —Б—В–Њ–њ—Л – —Г 22 (16,29%) –±–Њ–ї—М–љ—Л—Е. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –і–µ—Д–µ–Ї—В–Њ–≤ –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Њ–±–ї–∞—Б—В–µ–є —Б—В–Њ–њ—Л –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г 54 (40,0%) –±–Њ–ї—М–љ—Л—Е. –Ш–Ј––Ј–∞ —Б–ї–Њ–ґ–љ–Њ–є –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л —Б—В–Њ–њ—Л —А–∞–љ–µ–≤—Л–µ –і–µ—Д–µ–Ї—В—Л –њ–Њ—Б–ї–µ –њ–µ—А–≤–Є—З–љ–Њ–є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–Є –љ–∞ —Б—В–Њ–њ–µ –њ—А–Є –°–Ф–° –Є–Љ–µ—О—В —Б–ї–Њ–ґ–љ—Г—О —Д–Њ—А–Љ—Г, –≥–ї—Г–±–Є–љ—Г. –Т —А–∞–љ—Г –≤—Л—Б—В—Г–њ–∞—О—В –Ї–Њ—Б—В–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А—Л, —Б—Г—Б—В–∞–≤—Л, —Б—Г—Е–Њ–ґ–Є–ї–Є—П, —З—В–Њ –Њ—З–µ–љ—М –≤–∞–ґ–љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –њ—А–Є –≤—Л–±–Њ—А–µ —Б–њ–Њ—Б–Њ–±–∞ –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є.
–С–Њ–ї—М–љ—Л–µ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–∞—Е –њ–Њ —В–Є–њ—Г –°–Ф–°, —Б—А–Њ–Ї–∞–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –њ–Њ–ї—Г, –≤–Њ–Ј—А–∞—Б—В—Г, –≤–Є–і—Г –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –њ–ї–Њ—Й–∞–і–Є –Є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є —А–∞–љ–µ–≤–Њ–≥–Њ –Є–ї–Є —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –і–µ—Д–µ–Ї—В–Њ–≤, —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л.
–Я–µ—А–µ–і —А–µ—И–µ–љ–Є–µ–Љ –≤–Њ–њ—А–Њ—Б–∞ –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–є –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–µ –±–Њ–ї—М–љ—Л–Љ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —В–Є–њ–∞–Љ–Є –°–Ф–°, –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Њ—Ж–µ–љ–Ї–Є –Њ–±—Й–µ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П, —В—П–ґ–µ—Б—В–Є –°–Ф, –Љ—Л –њ—А–Њ–≤–Њ–і–Є–ї–Є —Б–ї–µ–і—Г—О—Й–Є–µ –Љ–µ—В–Њ–і—Л –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
1. –Ю–±—К–µ–Ї—В–Є–≤–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ —В–µ—З–µ–љ–Є—П —А–∞–љ–µ–≤–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ (—Ж–≤–µ—В –Ї–Њ–ґ–љ—Л—Е –ї–Њ—Б–Ї—Г—В–Њ–≤, –Ї—А–∞–µ–≤ —А–∞–љ—Л, –Ї–Њ–љ—Д–Є–≥—Г—А–∞—Ж–Є—П –Є –њ–ї–Њ—Й–∞–і—М —А–∞–љ–µ–≤–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞, –≥–ї—Г–±–Є–љ–∞ —А–∞–љ—Л, —Е–∞—А–∞–Ї—В–µ—А –Њ—В–і–µ–ї—П–µ–Љ–Њ–≥–Њ, –њ–∞–ї—М–њ–∞—В–Њ—А–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –ї–Њ—Б–Ї—Г—В–Њ–≤, –љ–∞–њ—А—П–ґ–µ–љ–Є—П —В–Ї–∞–љ–µ–є, —Ж–Є—Д—А–Њ–≤–∞—П —Д–Њ—В–Њ–≥—А–∞—Д–Є—П).
2. –Ю—Ж–µ–љ–Ї–∞ –Љ–∞–Ї—А–Њ– –Є –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є (–ї–∞–Ј–µ—А–љ–∞—П –і–Њ–њ–њ–ї–µ—А–Њ–≤—Б–Ї–∞—П —Д–ї–Њ—Г–Љ–µ—В—А–Є—П (–Ы–Ф–§), —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–∞—П –і–Њ–њ–њ–ї–µ—А–Њ–≥—А–∞—Д–Є—П (–£–Ч–Ф–У –і–∞—В—З–Є–Ї 16 –У—Ж), –Є–Ј–Љ–µ—А–µ–љ–Є–µ —В—А–∞–љ—Б–Ї—Г—В–∞–љ–љ–Њ–≥–Њ –љ–∞–њ—А—П–ґ–µ–љ–Є—П –Ї–Є—Б–ї–Њ—А–Њ–і–∞ (–Ґ—Б–†–Ю2), –і—Г–њ–ї–µ–Ї—Б–љ–Њ–µ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ –∞—А—В–µ—А–Є–є, –њ–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—П —Б–Њ—Б—Г–і–Њ–≤ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є.
3. –С–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ, —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ, –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —А–∞–љ–µ–≤–Њ–≥–Њ –Є–ї–Є —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞.
–Ф–ї—П –Њ—Ж–µ–љ–Ї–Є —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М:
– –њ–ї–∞–љ–Є–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ (–Њ—Ж–µ–љ–Ї–∞ –њ–ї–Њ—Й–∞–і–Є –Є –≥–ї—Г–±–Є–љ—Л –њ–Њ—А–∞–ґ–µ–љ–Є—П);
– –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —А–∞–љ–µ–≤–Њ–≥–Њ –Њ—В–і–µ–ї—П–µ–Љ–Њ–≥–Њ, –≤–Ї–ї—О—З–∞—О—Й–µ–µ –≤ —Б–µ–±—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Е–∞—А–∞–Ї—В–µ—А–∞, –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л –Ї –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ.
–Ю–±—Й–Є–Љ–Є –њ—А–Є–љ—Ж–Є–њ–∞–Љ–Є –ї–µ—З–µ–љ–Є—П –љ–∞ —Н—В–∞–њ–µ –≥–љ–Њ–є–љ–Њ––љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –њ—А–Є –°–Ф–° —П–≤–ї—П—О—В—Б—П: —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ –≥–љ–Њ–є–љ–Њ––љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—З–∞–≥–∞ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–є –Є—И–µ–Љ–Є–Є, –Ї–Њ—В–Њ—А–∞—П –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –≤–∞–Ј–Њ–∞–Ї—В–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–і–µ–Ї—Б—В—А–∞–љ, –∞–ї–њ—А–Њ—Б—В–∞–і–Є–ї, –њ–µ–њ—В–Њ–Ї—Б–Є—Д–Є–ї–ї–Є–љ); –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є—П –°–Ф (–Є–љ—Б—Г–ї–Є–љ–Њ—В–µ—А–∞–њ–Є—П –њ—А–Њ—Б—В—Л–Љ–Є –Є –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –Є–љ—Б—Г–ї–Є–љ–∞–Љ–Є –њ–Њ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–Љ —Б—Е–µ–Љ–∞–Љ), –∞–і–µ–Ї–≤–∞—В–љ–∞—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є—П —Б —Г—З–µ—В–Њ–Љ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л, –Љ–µ—Б—В–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –Є–љ—В–µ—А–∞–Ї—В–Є–≤–љ—Л—Е –њ–Њ–≤—П–Ј–Њ–Ї; —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П —Б —Г—З–µ—В–Њ–Љ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є [3,5,7]. –Ф–ї—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –њ–Њ—Б–ї–µ–і–µ–є—Б—В–≤–Є–є –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–Њ—Б—В–µ–Њ–∞—А—В—А–Њ–њ–∞—В–Є–Є –њ—А–Є–Љ–µ–љ—П—О—В –і–≤–Є–≥–∞—В–µ–ї—М–љ—Г—О —А–∞–Ј–≥—А—Г–Ј–Ї—Г —Б—В–Њ–њ—Л, –Ї–Њ—В–Њ—А–∞—П –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ—Б—В–µ–ї—М–љ–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Њ—А—В–µ–Ј–Њ–≤ (–ї–Њ–љ–≥–µ—В), –Ї–Њ—Б—В—Л–ї–µ–є, —Г–Љ–µ–љ—М—И–∞—О—Й–Є—Е –љ–∞–≥—А—Г–Ј–Ї—Г –љ–∞ —Б—В–Њ–њ—Г –њ—А–Є —Е–Њ–і—М–±–µ, –Ї—А–µ—Б–ї–∞––Ї–∞—В–∞–ї–Ї–Є –Є –і—А.
–Т –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є –ї—О–±—Л—Е —Д–Њ—А–Љ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —Б—В–Њ–њ—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –њ—А–µ–њ–∞—А–∞—В –Р–Ї—В–Њ–≤–µ–≥–Є–љ. –Я–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –Р–Ї—В–Њ–≤–µ–≥–Є–љ–∞ –Ї–ї–µ—В–Ї–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —В–Ї–∞–љ–µ–є —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –Є –≥–ї—О–Ї–Њ–Ј—Л, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ–≤—Л—И–µ–љ–Є—О —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –Ї–ї–µ—В–Њ–Ї –Є –Є–љ—В–µ–љ—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Є—Е –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ [2,13]. –С–Њ–ї—М–љ—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –µ–ґ–µ–і–љ–µ–≤–љ—Л–µ –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–µ –Є–љ—Д—Г–Ј–Є–Є –Р–Ї—В–Њ–≤–µ–≥–Є–љ–∞ (1000 –Љ–≥) –≤ —В–µ—З–µ–љ–Є–µ 10 —Б—Г—В–Њ–Ї —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –њ—А–Є–µ–Љ–Њ–Љ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л –њ—А–µ–њ–∞—А–∞—В–∞ (1000 –Љ–≥/—Б—Г—В.) –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 20–30 –і–љ–µ–є.
–£ 22 –±–Њ–ї—М–љ—Л—Е (27,5%) —Б –љ–µ–є—А–Њ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ–Њ–є –°–Ф–° –і–ї—П –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–є –Є—И–µ–Љ–Є–Є –љ–Є–ґ–љ–µ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –≤—Л–њ–Њ–ї–љ–µ–љ—Л —А–µ–Ї–Њ–љ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–µ —Б–Њ—Б—Г–і–Є—Б—В—Л–µ –Њ–њ–µ—А–∞—Ж–Є–Є. –£ 4 –±–Њ–ї—М–љ—Л—Е –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–∞ —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є—П —Б–Њ—Б—Г–і–Њ–≤ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –њ—Г—В–µ–Љ –±–∞–ї–ї–Њ–љ–љ–Њ–є –∞–љ–≥–Є–Њ–њ–ї–∞—Б—В–Є–Ї–Є, —Г 5 –±–Њ–ї—М–љ—Л—Е – —Б—В–µ–љ—В–Є—А–Њ–≤–∞–љ–Є–µ –њ–Њ—А–∞–ґ–µ–љ–љ—Л—Е –∞—А—В–µ—А–Є–є, —Г 11 –±–Њ–ї—М–љ—Л—Е –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Є —А–µ–Ї–Њ–љ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –љ–∞ —Б–Њ—Б—Г–і–∞—Е —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ—Л—Е –њ—А–Њ—В–µ–Ј–Њ–≤ –Є–ї–Є –∞—Г—В–Њ–≤–µ–љ—Л, —Г 2 –±–Њ–ї—М–љ—Л—Е – –∞—А—В–µ—А–Є–∞–ї–Є–Ј–∞—Ж–Є—О –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞. –Я–Њ—Б–ї–µ —Б—В–∞–±–Є–ї—М–љ–Њ–≥–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –≤—Л–њ–Њ–ї–љ—П–ї–Є –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –љ–∞ –ї–Є–Ї–≤–Є–і–∞—Ж–Є—О –≥–љ–Њ–є–љ–Њ––љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –љ–∞ —Б—В–Њ–њ–µ. –Я—А–Є —В—П–ґ–µ–ї—Л—Е –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є—П—Е —Г 5 –±–Њ–ї—М–љ—Л—Е —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є—П –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є —Б–Њ—З–µ—В–∞–ї–Є —Б –і–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –Є–љ—Д—Г–Ј–Є—П–Љ–Є –∞–љ–∞–ї–Њ–≥–Њ–≤ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞ –Х1 (–∞–ї–њ—А–Њ—Б—В–∞–і–Є–ї), —Б—Г–ї–Њ–і–µ–Ї—Б–Є–і–∞, –њ–µ–љ—В–Њ–Ї—Б–Є—Д–Є–ї–ї–Є–љ–∞.
–Т—Б–µ —Н—В–∞–њ—Л —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –≤–Ї–ї—О—З–∞—О—В –≤ —Б–µ–±—П —Н–ї–µ–Љ–µ–љ—В—Л, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є. –£—З–Є—В—Л–≤–∞—П —Б–ї–Њ–ґ–љ—Г—О –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї—Г—О —Б—В—А—Г–Ї—В—Г—А—Г —Б—В–Њ–њ—Л, –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ —А–∞–Ј—А–µ–Ј–Њ–≤ –њ–ї–∞–љ–Є—А–Њ–≤–∞–ї–Є —Б —Г—З–µ—В–Њ–Љ –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П —В–Ї–∞–љ–µ–є, –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –≥–љ–Њ–є–љ–Њ––љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—З–∞–≥–∞, –њ–µ—А—Б–њ–µ–Ї—В–Є–≤ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е –ї–Њ—Б–Ї—Г—В–Њ–≤ –і–ї—П –Ј–∞–Ї—А—Л—В–Є—П –Њ–±—А–∞–Ј—Г—О—Й–Є—Е—Б—П —А–∞–љ–µ–≤—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤. –†–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –Њ–±—А–∞–±–Њ—В–Њ–Ї –љ–∞ —Б—В–Њ–њ–µ —П–≤–ї—П–µ—В—Б—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –Њ–±—И–Є—А–љ—Л—Е —А–∞–љ–µ–≤—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤, –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—О—Й–Є—Е –µ–µ –∞—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ—Б—В—М, –≤–Њ–Ј¬–Љ–Њ–ґ–љ–Њ—Б—В—М —А–µ–Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є—П –≤–љ—Г—В—А–Є–≥–Њ—Б–њ–Є—В–∞–ї—М–љ—Л–Љ–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞–Љ–Є –Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –ї–Њ–Ї–∞–ї—М–љ—Л—Е –Є –Њ–±—Й–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –£ –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Є –Њ—В–Ї—А—Л—В–Њ–µ –≤–µ–і–µ–љ–Є–µ —А–∞–љ—Л –і–Њ –њ–Њ–ї–љ–Њ–≥–Њ —Б—В–Є—Е–∞–љ–Є—П —П–≤–ї–µ–љ–Є–є –Њ—Б—В—А–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ–≥–Њ –≥—А–∞–љ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ –ї–Њ–ґ–∞. –Ф–ї—П –ї–µ—З–µ–љ–Є—П —А–∞–љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Є–љ—В–µ—А–∞–Ї—В–Є–≤–љ—Л–µ –њ–Њ–≤—П–Ј–Ї–Є, –љ–µ —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤. –Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤, —Б —Г—З–µ—В–Њ–Љ —Д–∞–Ј—Л —А–∞–љ–µ–≤–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, –њ—А–Є–Љ–µ–љ—П–ї–Є –њ—А–µ–њ–∞—А–∞—В—Л –Є–Ј –≥—А—Г–њ–њ—Л –≥–Є–і—А–Њ–≥–µ–ї–µ–є –Є –≥–Є–і—А–Њ–Ї–Њ–ї–ї–Њ–Є–і–Њ–≤, –∞–ї—М–≥–Є–љ–∞—В—Л, –±–Є–Њ–і–µ–≥—А–∞–і–Є—А—Г–µ–Љ—Л–µ —А–∞–љ–µ–≤—Л–µ –њ–Њ–Ї—А—Л—В–Є—П –љ–∞ –Њ—Б–љ–Њ–≤–µ –Ї–Њ–ї–ї–∞–≥–µ–љ–∞, —Б–µ—В—З–∞—В—Л–µ —А–∞–љ–µ–≤—Л–µ –њ–Њ–Ї—А—Л—В–Є—П.
–Я–Њ—Б–ї–µ –њ–Њ–ї–љ–Њ–≥–Њ –Њ—З–Є—Й–µ–љ–Є—П —А–∞–љ–µ–≤–Њ–≥–Њ –Є–ї–Є —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞ –≤–Њ II —Б—В–∞–і–Є–Є —А–∞–љ–µ–≤–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ –њ—А–Є –°–Ф–° —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –Ј–∞–≤–µ—А—И–Є—В—М –≤—Л–њ–Њ–ї–љ–µ–љ–Є–µ–Љ —А–µ–Ї–Њ–љ—Б—В—А—Г–Ї—В–Є–≤–љ–Њ––≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є. –Т –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–Љ –ї–µ—З–µ–љ–Є–Є –Ї–Њ–ґ–љ–Њ––њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –љ–∞ —Б—В–Њ–њ–µ –Є–Љ–µ—О—В –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, —В–∞–Ї –Ї–∞–Ї –Њ—В –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ–≥–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –і–µ—Д–µ–Ї—В–∞ —В–Ї–∞–љ–µ–є –Ј–∞–≤–Є—Б–Є—В –Њ–њ–Њ—А–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Є –і—А—Г–≥–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –љ–Є–ґ–љ–µ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є, –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е.
–Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –Ї–Њ–ґ–љ–Њ––њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є –љ–∞ —Б—В–Њ–њ–µ —Г –±–Њ–ї—М–љ—Л—Е —Б –°–Ф–° –Њ–±—Л—З–љ–Њ –±—Л–≤–∞–µ—В —Б–≤—П–Ј–∞–љ–∞ —Б –і–ї–Є—В–µ–ї—М–љ—Л–Љ, –Є–љ–Њ–≥–і–∞ –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ —Б–њ–Њ–љ—В–∞–љ–љ—Л–Љ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є–µ–Љ —П–Ј–≤–µ–љ–љ—Л—Е –Є —А–∞–љ–µ–≤—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤ [3,7,9,10]. –Ю–і–љ–Њ–є –Є–Ј –њ—А–Є—З–Є–љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —В–∞–Ї—В–Є–Ї–Є –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –≤ –њ–Њ–ї—М–Ј—Г –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є —П–≤–ї—П–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ –±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–Љ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є–Є —А–∞–љ (—Д–ї–µ–≥–Љ–Њ–љ—Л, –Њ—Б—В–µ–Њ–Љ–Є–µ–ї–Є—В–∞, –≥–љ–Њ–є–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–∞—А—В—А–Є—В–∞ –њ–ї—О—Б–љ–µ–—Д–∞–ї–∞–љ–≥–Њ–≤–Њ–≥–Њ —Б–Њ—З–ї–µ–љ–µ–љ–Є—П –Є –і—А.), –∞ —В–∞–Ї–ґ–µ –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ–≥–Њ –њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Б—В–Њ–њ–Њ–є –њ—А–Є –љ–∞–ї–Є—З–Є–Є —А–∞–љ–µ–≤–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞. –Я—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–љ–Є–Є –і–µ—Д–µ–Ї—В–∞ —Б—В–Њ–њ—Л –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –≤—Л—Б–Њ–Ї–Њ–є –∞–Љ–њ—Г—В–∞—Ж–Є–Є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є.
–Я–Њ –љ–∞—И–µ–Љ—Г –Љ–љ–µ–љ–Є—О, –Ї–Њ–ґ–љ–∞—П –њ–ї–∞—Б—В–Є–Ї–∞ –њ—А–Є –°–Ф–° –њ–Њ–Ї–∞–Ј–∞–љ–∞ –≤—Б–µ–≥–і–∞, –Ї–Њ–≥–і–∞ –љ–µ—В –Њ–±—Й–Є—Е –Є –Љ–µ—Б—В–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –Њ–ґ–Є–і–∞–љ–Є–µ –±–Њ–ї–µ–µ –±—Л—Б—В—А–Њ–≥–Њ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П —А–∞–љ–µ–≤–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞ –Є –Љ–µ–љ—М—И–µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ —Б–њ–Њ–љ—В–∞–љ–љ—Л–Љ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є–µ–Љ —А–∞–љ—Л.
–Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –Ї–Њ–ґ–љ–Њ––њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є –њ—А–Є –°–Ф–° –Њ–≥—А–∞–љ–Є—З–µ–љ—Л, —В–∞–Ї –Ї–∞–Ї –љ–µ –≤—Б–µ–≥–і–∞ —Г–і–∞–µ—В—Б—П –Ї—Г–њ–Є—А–Њ–≤–∞—В—М —П–≤–ї–µ–љ–Є—П –Є—И–µ–Љ–Є–Є, —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П —А–Є—Б–Ї —А–µ—Ж–Є–і–Є–≤–∞ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –≤ –Њ–±–ї–∞—Б—В–Є –і–µ—Д–µ–Ї—В–∞. –Э–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ–Є —Г—Б–ї–Њ–≤–Є—П–Љ–Є –і–ї—П –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є —П–≤–ї—П—О—В—Б—П:
• —Б—В–∞–±–Є–ї—М–љ–Њ–µ –Њ–±—Й–µ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–Њ–ї—М–љ–Њ–≥–Њ, –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є—П –°–Ф –Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є;
• —Б—В–Њ–є–Ї–Њ–µ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ —П–≤–ї–µ–љ–Є–є –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–є –Є—И–µ–Љ–Є–Є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є (–Ґ—Б—А–Ю2 –±–Њ–ї–µ–µ 30 –Љ–Љ —А—В.—Б—В., –Ы–Ф–§ –љ–µ –Љ–µ–љ–µ–µ 1–1,2 –њ—Д. –µ–і., –ї–Њ–і—Л–ґ–µ—З–љ–Њ––њ–ї–µ—З–µ–≤–Њ–є –Є–љ–і–µ–Ї—Б (–Ы–Я–Ш) ≤0,4);
• –Њ—В—Б—Г—В—Б—В–≤–Є–µ –љ–µ–Ї—А–Њ–Ј–Њ–≤ –≤ —А–∞–љ–µ, –≥–љ–Њ–є–љ–Њ–≥–Њ —Н–Ї—Б—Б—Г–і–∞—В–∞;
• –љ–∞–ї–Є—З–Є–µ —П—А–Ї–Є—Е, —Б–Њ—З–љ—Л—Е –≥—А–∞–љ—Г–ї—П—Ж–Є–є;
• –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ –њ–µ—А–Є—Д–Њ–Ї–∞–ї—М–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є –Њ—В–µ–Ї–∞ –≤ –Њ–±–ї–∞—Б—В–Є —А–∞–љ—Л;
• –Њ–±—Б–µ–Љ–µ–љ–µ–љ–љ–Њ—Б—В—М —А–∞–љ—Л –Љ–Є–Ї—А–Њ—Д–ї–Њ—А–Њ–є <105 –Ъ–Ю–Х/–ї.
–Э–∞ –≤—Л–±–Њ—А —Б–њ–Њ—Б–Њ–±–∞ –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є –≤–ї–Є—П—О—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Д–∞–Ї—В–Њ—А–Њ–≤: —А–∞–Ј–Љ–µ—А –Є —Д–Њ—А–Љ–∞ —А–∞–љ–µ–≤–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞, –µ–≥–Њ –≥–ї—Г–±–Є–љ–∞, –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є—П, —Б–Њ—Б—В–∞–≤ —В–Ї–∞–љ–µ–є —А–∞–љ–µ–≤–Њ–≥–Њ –ї–Њ–ґ–∞, —В—П–ґ–µ—Б—В—М –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є, –Њ–±—Й–µ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–Њ–ї—М–љ–Њ–≥–Њ.
–Я–µ—А–µ–і –≤—Л–њ–Њ–ї–љ–µ–љ–Є–µ–Љ –Ї–Њ–ґ–љ–Њ––њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —В—Й–∞—В–µ–ї—М–љ–Њ –Є–Ј—Г—З–Є—В—М —Б–Њ—Б—В–Њ—П–љ–Є–µ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П –Ї–Њ–ґ–љ—Л—Е –ї–Њ—Б–Ї—Г—В–Њ–≤, –Њ–Ї—А—Г–ґ–∞—О—Й–Є—Е –Љ—П–≥–Ї–Є—Е —В–Ї–∞–љ–µ–є, –Њ—Ж–µ–љ–Є—В—М –≥–Њ—В–Њ–≤–љ–Њ—Б—В—М —А–∞–љ—Л –Ї –њ–µ—А–µ–Љ–µ—Й–µ–љ–Є—О –Є —Б–Љ–µ—Й–µ–љ–Є—О –Ї–Њ–ґ–љ–Њ–≥–Њ –ї–Њ—Б–Ї—Г—В–∞, —В–∞–Ї –Ї–∞–Ї –њ—А–Є —А–Њ—В–∞—Ж–Є–Є –Є–ї–Є —В—А–∞–Ї—Ж–Є–Є –ї–Њ—Б–Ї—Г—В–Њ–≤ –≤–µ–ї–Є–Ї–∞ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –Љ–Є–Ї—А–Њ—В—А–Њ–Љ–±–Њ–Ј–Њ–≤, –Є—И–µ–Љ–Є–Є, —З—В–Њ –Љ–Њ–ґ–µ—В –Њ—В—А–∞–Ј–Є—В—М—Б—П –љ–∞ –њ—А–Є–ґ–Є–≤–ї—П–µ–Љ–Њ—Б—В–Є —В–Ї–∞–љ–µ–є. –Я—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є —П–≤–ї—П—О—В—Б—П:
• –Њ–±—Й–µ–µ —В—П–ґ–µ–ї–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–Њ–ї—М–љ–Њ–≥–Њ, —Б–≤—П–Ј–∞–љ–љ–Њ–µ —Б–Њ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –Њ–њ—Г—Е–Њ–ї—П–Љ–Є IV —Б—В–µ–њ–µ–љ–Є, –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–µ–є –Њ—Б–љ–Њ–≤–љ–Њ–є –Є–ї–Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Є –і—А.;
• –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —А–∞–љ–µ –Є –Њ–Ї—А—Г–ґ–∞—О—Й–Є—Е —В–Ї–∞–љ—П—Е.
–Т –љ–∞—И–µ–є –њ—А–∞–Ї—В–Є–Ї–µ –Љ—Л –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –њ—А–Є–Љ–µ–љ—П–ї–Є —Б–ї–µ–і—Г—О—Й–Є–µ –≤–Є–і—Л –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є:
• –њ–ї–∞—Б—В–Є–Ї–∞ –Љ–µ—Б—В–љ—Л–Љ–Є —В–Ї–∞–љ—П–Љ–Є (—Б–Љ–µ—Й–µ–љ–Є–µ–Љ, –≤–Ј–∞–Є–Љ–Њ–њ–µ—А–µ–Љ–µ—Й–µ–љ–Є–µ–Љ –Ї–Њ–ґ–љ—Л—Е –ї–Њ—Б–Ї—Г—В–Њ–≤, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –ї–Њ—Б–Ї—Г—В–Њ–≤ —Б «—Г—В–Є–ї—М–љ–Њ–≥–Њ» –њ–∞–ї—М—Ж–∞, –Љ–µ—В–Њ–і –і–Њ–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —В–Ї–∞–љ–µ–≤–Њ–≥–Њ —А–∞—Б—В—П–ґ–µ–љ–Є—П, —А–Њ—В–∞—Ж–Є–Њ–љ–љ—Л–µ –Ї–Њ–ґ–љ—Л–µ –ї–Њ—Б–Ї—Г—В—Л, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –њ–ї–∞—Б—В–Є–Ї–∞ –њ–Њ –Ч–Є–Љ–∞–љ–Є––Ю—Б–±–Њ—А–љ—Г, V–Y –њ–ї–∞—Б—В–Є–Ї–∞ –њ–Њ –Ф–Є—Д—Д–µ–љ–±–∞—Е—Г –Є –і—А.;
• —Б–≤–Њ–±–Њ–і–љ–∞—П –і–µ—А–Љ–∞—В–Њ–Љ–љ–∞—П –њ–ї–∞—Б—В–Є–Ї–∞ —А–∞—Б—Й–µ–њ–ї–µ–љ–љ—Л–Љ –Ї–Њ–ґ–љ—Л–Љ –ї–Њ—Б–Ї—Г—В–Њ–Љ – –∞—Г—В–Њ–і–µ—А–Љ–Њ–њ–ї–∞—Б—В–Є–Ї–∞ (–Р–Ф–Я);
• –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П –Ї–Њ–ґ–љ–∞—П –њ–ї–∞—Б—В–Є–Ї–∞ (–Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –њ–ї–∞—Б—В–Є–Ї–Є –Љ–µ—Б—В–љ—Л–Љ–Є —В–Ї–∞–љ—П–Љ–Є —Б–Њ —Б–≤–Њ–±–Њ–і–љ–Њ–є –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Њ–є).
–Я–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –Ї –њ–ї–∞—Б—В–Є–Ї–µ –Љ–µ—Б—В–љ—Л–Љ–Є —В–Ї–∞–љ—П–Љ–Є —П–≤–ї—П—О—В—Б—П: —А–∞–љ–∞, –і–љ–Њ–Љ –Ї–Њ—В–Њ—А–Њ–є —П–≤–ї—П—О—В—Б—П –Ї–Њ—Б—В–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А—Л, —Б—Г—Б—В–∞–≤—Л, —Б—Г—Е–Њ–ґ–Є–ї–Є—П, —Д–∞—Б—Ж–Є–Є; –і–µ—Д–µ–Ї—В—Л –≤ –Њ–±–ї–∞—Б—В–Є –Њ–њ–Њ—А–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Б—В–Њ–њ—Л –Є –≤ –Љ–µ—Б—В–∞—Е, –њ–Њ–і–≤–µ—А–≥–∞—О—Й–Є—Е—Б—П –љ–∞–Є–±–Њ–ї—М—И–µ–Љ—Г –і–∞–≤–ї–µ–љ–Є—О. –Ф–∞–љ–љ—Л–є –≤–Є–і –њ–ї–∞—Б—В–Є–Ї–Є –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –њ—А–Є –ї—О–±–Њ–є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Ј–∞–Ї—А—Л—В–Є—П —А–∞–љ–µ–≤—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤ —Б–Љ–µ—Й–µ–љ–Є–µ–Љ, –≤–Ј–∞–Є–Љ–Њ–њ–µ—А–µ–Љ–µ—Й–µ–љ–Є–µ–Љ –Є–ї–Є —А–Њ—В–∞—Ж–Є–µ–є –Ї–Њ–ґ–љ–Њ––ґ–Є—А–Њ–≤—Л—Е –ї–Њ—Б–Ї—Г—В–Њ–≤ —Б—В–Њ–њ—Л —Б –∞–і–∞–њ—В–∞—Ж–Є–µ–є —В–Ї–∞–љ–µ–є —И–≤–∞–Љ–Є –±–µ–Ј —З—А–µ–Ј–Љ–µ—А–љ–Њ–≥–Њ (–Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–≥–Њ) –љ–∞—В—П–ґ–µ–љ–Є—П. –Ю–љ–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–∞ –Њ–і–љ–Њ–Љ–Њ–Љ–µ–љ—В–љ–Њ –Є–ї–Є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —А–∞—Б—В—П–ґ–µ–љ–Є—П —В–Ї–∞–љ–µ–є. –Я–ї–∞—Б—В–Є–Ї–∞ –Љ–µ—Б—В–љ—Л–Љ–Є —В–Ї–∞–љ—П–Љ–Є –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–∞ —Г 59 –±–Њ–ї—М–љ—Л—Е (43,70%). –Ш–Ј –љ–Є—Е —Г 50 –±–Њ–ї—М–љ—Л—Е –њ–ї–∞—Б—В–Є–Ї–µ –њ–Њ–і–≤–µ—А–≥–љ—Г—В—Л –і–µ—Д–µ–Ї—В—Л, —А–∞–Ј–≤–Є–≤—И–Є–µ—Б—П –њ–Њ—Б–ї–µ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–Є —Б—В–Њ–њ—Л —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ –Њ–±—К–µ–Љ–∞. –£ 9 –±–Њ–ї—М–љ—Л—Е –њ–ї–∞—Б—В–Є–Ї–∞ –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–∞ –њ–Њ –њ–Њ–≤–Њ–і—Г –њ–ї–∞–љ—В–∞—А–љ—Л—Е —П–Ј–≤ –Є–ї–Є —П–Ј–≤—Л –Ї—Г–ї—М—В–Є —Б—В–Њ–њ—Л.
–Ф–ї—П —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –њ–ї–∞–љ—В–∞—А–љ—Л—Е —П–Ј–≤ –Љ—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Њ–і–љ–Њ– –Є–ї–Є –і–≤—Г–і–Њ–ї—М—З–∞—В—Л–є —А–Њ—В–∞—Ж–Є–Њ–љ–љ—Л–є –Ї–Њ–ґ–љ–Њ–—Д–∞—Б—Ж–Є–∞–ї—М–љ—Л–є –њ–Њ–і–Њ—И–≤–µ–љ–љ—Л–є –ї–Њ—Б–Ї—Г—В –њ–Њ –Ч–Є–Љ–∞–љ–Є––Ю—Б–±–Њ—А–љ—Г —Г 5 –±–Њ–ї—М–љ—Л—Е, –њ–ї–∞—Б—В–Є–Ї—Г —Б–і–≤–Є–ґ–љ—Л–Љ–Є V–Y –ї–Њ—Б–Ї—Г—В–∞–Љ–Є —Б—В–Њ–њ—Л –њ–Њ –Ш.–§. –Ф–Є—Д—Д–µ–љ–±–∞—Е—Г – —Г 4 –±–Њ–ї—М–љ—Л—Е. –Т —Е–Њ–і–µ –Њ–њ–µ—А–∞—Ж–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Є—Б—Б–µ–Ї–∞—В—М —А—Г–±—Ж–Њ–≤—Л–µ —В–Ї–∞–љ–Є, —Г—З–∞—Б—В–Ї–Є –≥–Є–њ–µ—А–Ї–µ—А–∞—В–Њ–Ј–∞, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –њ–ї–Њ—Й–∞–і–Є –і–µ—Д–µ–Ї—В–∞. –Т —Б–≤—П–Ј–Є —Б –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О –Љ–µ—Б—В–љ–Њ–≥–Њ –њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –њ—А–Є –њ–ї–∞—Б—В–Є–Ї–µ –і–∞–љ–љ—Л–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–є —А–∞–Ј–Љ–µ—А –і–µ—Д–µ–Ї—В–∞ –љ–µ –і–Њ–ї–ґ–µ–љ –њ—А–µ–≤—Л—И–∞—В—М 4 —Б–Љ –≤ –і–Є–∞–Љ–µ—В—А–µ. –Я—А–Є –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–Љ –Њ—Б—В–µ–Њ–∞—А—В—А–Є—В–µ –њ—А–Њ–Є–Ј–≤–Њ–і—П—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Г—О —А–µ–Ј–µ–Ї—Ж–Є—О –њ–ї—О—Б–љ–µ—Д–∞–ї–∞–љ–≥–Њ–≤–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞. –Ф–ї—П –ї–µ—З–µ–љ–Є—П —П–Ј–≤ —В–Њ—А—Ж–µ–≤–Њ–є –Њ–±–ї–∞—Б—В–Є –Ї—Г–ї—М—В–Є –њ–ї–∞—Б—В–Є–Ї—Г –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–Њ –≤—Л–њ–Њ–ї–љ—П—В—М —Б –њ–Њ–Љ–Њ—Й—М—О –њ–Њ–ї–љ–Њ—Б–ї–Њ–є–љ–Њ–≥–Њ –Ї–Њ–ґ–љ–Њ––ґ–Є—А–Њ–≤–Њ–≥–Њ –ї–Њ—Б–Ї—Г—В–∞, –≤–Ј—П—В–Њ–≥–Њ –Є —А–Њ—В–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б –љ–µ–Њ–њ–Њ—А–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Б—В–Њ–њ—Л. –£ 9 (6,66%) –±–Њ–ї—М–љ—Л—Е –≤—Л–њ–Њ–ї–љ—П–ї–Є –≤–Ј–∞–Є–Љ–Њ–њ–µ—А–µ–Љ–µ—Й–µ–љ–Є–µ –Ї–Њ–ґ–љ—Л—Е –ї–Њ—Б–Ї—Г—В–Њ–≤ (—В—А–µ—Г–≥–Њ–ї—М–љ–Њ–є –Є–ї–Є —В—А–∞–њ–µ—Ж–Є–µ–≤–Є–і–љ–Њ–є —Д–Њ—А–Љ—Л) —Б –љ–µ–Њ–њ–Њ—А–љ—Л—Е –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–µ–є –њ–Њ –Р.–Р. –Ы–Є–Љ–±–µ—А–≥—Г.
–Т —Б–ї—Г—З–∞–µ –љ–∞—В—П–ґ–µ–љ–Є—П –Љ–Њ–±–Є–ї–Є–Ј–Њ–≤–∞–љ–љ—Л—Е –ї–Њ—Б–Ї—Г—В–Њ–≤ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —Н–Ї–Њ–љ–Њ–Љ–љ–Њ–µ —А–µ–Ј–µ—Ж–Є—А–Њ–≤–∞–љ–Є–µ –њ–ї—О—Б–љ–µ–≤—Л—Е –Є –і—А—Г–≥–Є—Е –Ї–Њ—Б—В–µ–є, —З—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –ї—Г—З—И—Г—О –∞–і–∞–њ—В–∞—Ж–Є—О –ї–Њ—Б–Ї—Г—В–Њ–≤ –і—А—Г–≥ –Ї –і—А—Г–≥—Г, –Њ–±–ї–µ–≥—З–∞–µ—В –њ–Њ–ї–љ–Њ–µ –Ј–∞–Ї—А—Л—В–Є–µ —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –Є–ї–Є —А–∞–љ–µ–≤–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞. –Ъ –і–∞–љ–љ–Њ–є –Љ–∞–љ–Є–њ—Г–ї—П—Ж–Є–Є –њ—А–Є—И–ї–Њ—Б—М –њ—А–Є–±–µ–≥–љ—Г—В—М —Г 40 –±–Њ–ї—М–љ—Л—Е. –Я—А–Є –љ–∞–ї–Є—З–Є–Є –≥–ї—Г–±–Њ–Ї–Є—Е —А–∞–љ —Г 12 –±–Њ–ї—М–љ—Л—Е –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–∞ —В–∞–Љ–њ–Њ–љ–∞–і–∞ —А–∞–љ–µ–≤–Њ–є –њ–Њ–ї–Њ—Б—В–Є –і–µ—Н–њ–Є—В–µ–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Ї–Њ–ґ–љ–Њ––ґ–Є—А–Њ–≤—Л–Љ –ї–Њ—Б–Ї—Г—В–Њ–Љ.
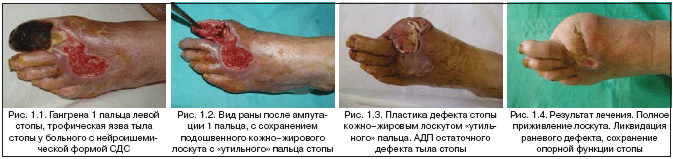
–£ 8 (5,92%) –±–Њ–ї—М–љ—Л—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Ї–Њ–ґ–љ–Њ––ґ–Є—А–Њ–≤–Њ–є –ї–Њ—Б–Ї—Г—В «—Г—В–Є–ї—М–љ–Њ–≥–Њ» –њ–∞–ї—М—Ж–∞, —Г–і–∞–ї–µ–љ–љ–Њ–≥–Њ –њ—А–Є –њ–µ—А–≤–Є—З–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є—П—Е –њ–Њ –њ–Њ–≤–Њ–і—Г –Њ—Б—В–µ–Њ–Љ–Є–µ–ї–Є—В–∞ –њ–∞–ї—М—Ж–∞ –Є–ї–Є –Њ—Б—В–µ–Њ–∞—А—В—А–Є—В–∞ –њ–ї—О—Б–љ–µ—Д–∞–ї–∞–љ–≥–Њ–≤–Њ–≥–Њ —Б–Њ—З–ї–µ–љ–µ–љ–Є—П (—А–Є—Б 1.1–1.4).
–£ 28 –±–Њ–ї—М–љ—Л—Е (20,74%) –Љ—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –Р–Ф–Я. –Я–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –Ї –Р–Ф–Я —Б–ї—Г–ґ–∞—В:
• –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є—П –і–µ—Д–µ–Ї—В–∞ –љ–∞ –љ–µ–Њ–њ–Њ—А–љ—Л—Е –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—П—Е —Б—В–Њ–њ—Л;
• –Њ–±—И–Є—А–љ—Л–µ –Є –ї–Њ–Ї–∞–ї—М–љ—Л–µ –і–µ—Д–µ–Ї—В—Л —Б—В–Њ–њ—Л –њ—А–Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є—Е –Ј–∞–Ї—А—Л—В–Є—П –Љ–µ—Б—В–љ—Л–Љ–Є —В–Ї–∞–љ—П–Љ–Є;
• –Њ—Б—В–∞—В–Њ—З–љ—Л–µ –і–µ—Д–µ–Ї—В—Л –њ—А–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б–њ–Њ—Б–Њ–±–∞—Е –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є.
–Ф–ї—П –Ј–∞–Ї—А—Л—В–Є—П —А–∞–љ–µ–≤–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞ –ї–Њ—Б–Ї—Г—В –Њ–±—Л—З–љ–Њ –±—А–∞–ї–Є —Б –њ–µ—А–µ–і–љ–µ–ї–∞—В–µ—А–∞–ї—М–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –±–µ–і—А–∞ –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є. –Ґ–Њ–ї—Й–Є–љ–∞ –ї–Њ—Б–Ї—Г—В–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 0,4–0,5 –Љ–Љ. –Ь—Л –њ—А–µ–і–њ–Њ—З–Є—В–∞–µ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –љ–µ–њ–µ—А—Д–Њ—А–Є—А–Њ–≤–∞–љ–љ—Л–є –Ї–Њ–ґ–љ—Л–є –ї–Њ—Б–Ї—Г—В, –Ї–Њ—В–Њ—А—Л–є –Њ—В–ї–Є—З–∞–µ—В—Б—П –ї—Г—З—И–Є–Љ –Ї–∞—З–µ—Б—В–≤–Њ–Љ –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є—П, –љ–µ –і–∞–µ—В –≥—А—Г–±—Л—Е —А—Г–±—Ж–Њ–≤, —Б–љ–Є–ґ–∞–µ—В —А–Є—Б–Ї –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є—П —А–∞–љ–µ–≤–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞. –Ъ–Њ–ґ–љ—Л–є –ї–Њ—Б–Ї—Г—В –њ–Њ–і—И–Є–≤–∞–µ—В—Б—П –Ї –Ї—А–∞—П–Љ —А–∞–љ—Л. –Ъ–Њ–Љ–њ—А–µ—Б—Б–Є—П –ї–Њ—Б–Ї—Г—В–∞ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В—Б—П —А–∞—Б—В—П–≥–Є–≤–∞—О—Й–Є–Љ–Є—Б—П –ї–Є–≥–∞—В—Г—А–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –Ј–∞—В—П–≥–Є–≤–∞—О—В –љ–∞–і –њ–Њ–≤—П–Ј–Ї–Њ–є, –њ—А–Њ–њ–Є—В–∞–љ–љ–Њ–є —А–∞—Б—В–≤–Њ—А–∞–Љ–Є –∞–љ—В–Є—Б–µ–њ—В–Є–Ї–∞. –Я—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ –љ–∞ –ї–Њ—Б–Ї—Г—В –љ–∞–Ї–ї–∞–і—Л–≤–∞—О—В –∞—В—А–∞–≤–Љ–∞—В–Є—З–љ—Л–µ —Б–µ—В—З–∞—В—Л–µ —А–∞–љ–µ–≤—Л–µ –њ–Њ–Ї—А—Л—В–Є—П. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—Ж–µ–љ–Є–≤–∞—О—В –љ–∞ 3–5––µ —Б—Г—В–Ї–Є.
–Т —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –≤—Л–±–Њ—А —Б–≤–Њ–±–Њ–і–љ–Њ–є –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Њ–±—Й–Є–Љ —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, —Г –±–Њ–ї—М–љ—Л—Е —Б —В—П–ґ–µ–ї—Л–Љ –°–Ф –Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є –љ–µ—А–µ–і–Ї–Њ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Ј–∞–Ї—А—Л–≤–∞—В—М —А–∞–љ—Г –љ–∞–Є–±–Њ–ї–µ–µ –њ—А–Њ—Б—В—Л–Љ –Є –Љ–µ–љ–µ–µ —В—А–∞–≤–Љ–∞—В–Є—З–љ—Л–Љ —Б–њ–Њ—Б–Њ–±–Њ–Љ, –Ї–∞–Ї–Є–Љ —П–≤–ї—П–µ—В—Б—П –Р–Ф–Я.
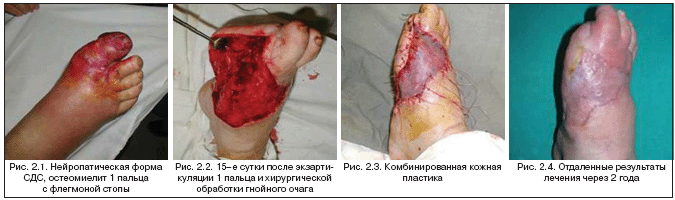
–£ 47 –±–Њ–ї—М–љ—Л—Е (34,81%) —Б –Њ–±—И–Є—А–љ—Л–Љ–Є –і–µ—Д–µ–Ї—В–∞–Љ–Є —Б—В–Њ–њ—Л –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П –Ї–Њ–ґ–љ–∞—П –њ–ї–∞—Б—В–Є–Ї–∞. –Я–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –Ї –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–µ —П–≤–ї—П—О—В—Б—П –і–µ—Д–µ–Ї—В—Л —Б—В–Њ–њ—Л –њ—А–Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є—Е –Ј–∞–Ї—А—Л—В–Є—П —В–Њ–ї—М–Ї–Њ –Љ–µ—Б—В–љ—Л–Љ–Є —В–Ї–∞–љ—П–Љ–Є. –Ю–њ–Њ—А–љ—Л–µ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Б—В–Њ–њ—Л, –Ї–Њ—Б—В–љ—Л–µ –Є —Б—Г—Б—В–∞–≤–љ—Л–µ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ј–∞–Ї—А—Л–≤–∞—О—В –Љ–Њ–±–Є–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ–Є –Ї–Њ–ґ–љ–Њ––ґ–Є—А–Њ–≤—Л–Љ–Є –Є–ї–Є –Ї–Њ–ґ–љ–Њ–—Д–∞—Б—Ж–Є–∞–ї—М–љ—Л–Љ–Є –Љ–µ—Б—В–љ—Л–Љ–Є —В–Ї–∞–љ—П–Љ–Є. –Я—А–Є –љ–µ–і–Њ—Б—В–∞—В–Ї–µ —Б–Њ–±—Б—В–≤–µ–љ–љ—Л—Е —В–Ї–∞–љ–µ–є —Б—В–Њ–њ—Л –Њ—Б—В–∞—В–Њ—З–љ—Л–µ –і–µ—Д–µ–Ї—В—Л –љ–µ–Њ–њ–Њ—А–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ј–∞–Ї—А—Л–≤–∞—О—В –љ–µ–њ–µ—А—Д–Њ—А–Є—А–Њ–≤–∞–љ–љ—Л–Љ —А–∞—Б—Й–µ–њ–ї–µ–љ–љ—Л–Љ –Ї–Њ–ґ–љ—Л–Љ –ї–Њ—Б–Ї—Г—В–Њ–Љ (—А–Є—Б 2.1–2.4).
–Я–Њ –ї–Є—В–µ—А–∞—В—Г—А–љ—Л–Љ –і–∞–љ–љ—Л–Љ [3,7,9,10], —Б–∞–Љ—Л–Љ —Б–ї–Њ–ґ–љ—Л–Љ –і–ї—П –њ–ї–∞—Б—В–Є–Ї–Є —П–≤–ї—П—О—В—Б—П –Њ–±—И–Є—А–љ—Л–µ –і–µ—Д–µ–Ї—В—Л –љ–∞ –Њ–њ–Њ—А–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Б—В–Њ–њ—Л. –Э–∞–Є–±–Њ–ї–µ–µ –∞–і–µ–Ї–≤–∞—В–љ—Л–є –Љ–µ—В–Њ–і –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є – —Б–≤–Њ–±–Њ–і–љ–∞—П –њ–µ—А–µ—Б–∞–і–Ї–∞ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ —В–Ї–∞–љ–µ–є –љ–∞ –Љ–Є–Ї—А–Њ—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –∞–љ–∞—Б—В–Њ–Љ–Њ–Ј–∞—Е –Є–ї–Є –≤—А–µ–Љ–µ–љ–љ–Њ–є –њ–Є—В–∞—О—Й–µ–є –љ–Њ–ґ–Ї–µ. –Я—А–Є –°–Ф–° –і–∞–љ–љ—Л–µ –Њ–њ–µ—А–∞—Ж–Є–Є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —А–µ–і–Ї–Њ, —З—В–Њ —Б–Њ–њ—А—П–ґ–µ–љ–Њ —Б —З–∞—Б—В—Л–Љ —А–∞–Ј–≤–Є—В–Є–µ–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б —В—А–Њ–Љ–±–Њ–Ј–Њ–Љ –њ–Є—В–∞—О—Й–Є—Е —Б–Њ—Б—Г–і–Њ–≤ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –љ–µ–Ї—А–Њ–Ј–Њ–Љ –Є –Њ—В—В–Њ—А–ґ–µ–љ–Є–µ–Љ –ї–Њ—Б–Ї—Г—В–∞. –Т –љ–∞—И–µ–є –њ—А–∞–Ї—В–Є–Ї–µ –Њ–і–љ–Њ–Љ—Г –Є–Ј –±–Њ–ї—М–љ—Л—Е —Б –Њ–±—И–Є—А–љ–Њ–є —В—А–Њ—Д–Є—З–µ—Б–Ї–Њ–є —П–Ј–≤–Њ–є –њ—П—В–Њ—З–љ–Њ–є –Њ–±–ї–∞—Б—В–Є –њ–Њ—Б–ї–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–є —Д–ї–µ–≥–Љ–Њ–љ—Л –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –њ–ї–∞—Б—В–Є–Ї–∞ –Љ–µ–і–Є–∞–ї—М–љ—Л–Љ –Є–Ї—А–Њ–љ–Њ–ґ–љ—Л–Љ –Ї–Њ–ґ–љ–Њ–—Д–∞—Б—Ж–Є–∞–ї—М–љ—Л–Љ –ї–Њ—Б–Ї—Г—В–Њ–Љ –Ї–Њ–љ—В—А–ї–∞—В–µ—А–∞–ї—М–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –љ–∞ –≤—А–µ–Љ–µ–љ–љ–Њ–є –њ–Є—В–∞—О—Й–µ–є –љ–Њ–ґ–Ї–µ (–Є—В–∞–ї—М—П–љ—Б–Ї–∞—П –Ї–Њ–ґ–љ–∞—П –њ–ї–∞—Б—В–Є–Ї–∞).
–Э–∞ –њ–µ—А–≤–Њ–Љ —Н—В–∞–њ–µ –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–∞ –Љ–Њ–±–Є–ї–Є–Ј–∞—Ж–Є—П –ї–Њ—Б–Ї—Г—В–∞ –Є –µ–≥–Њ –∞–і–∞–њ—В–∞—Ж–Є—П –Ї —П–Ј–≤–µ–љ–љ–Њ–Љ—Г –і–µ—Д–µ–Ї—В—Г —Б —Д–Є–Ї—Б–∞—Ж–Є–µ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –≤ –∞–њ–њ–∞—А–∞—В–µ –Ш–ї–Є–Ј–∞—А–Њ–≤–∞. –Э–∞ –≤—В–Њ—А–Њ–Љ —Н—В–∞–њ–µ —З–µ—А–µ–Ј 3 –љ–µ–і–µ–ї–Є –њ–Њ—Б–ї–µ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–є —В—А–µ–љ–Є—А–Њ–≤–Ї–Є –љ–Њ–ґ–Ї–Є –ї–Њ—Б–Ї—Г—В–∞ –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–Њ –µ–≥–Њ –Њ—В—Б–µ—З–µ–љ–Є–µ –Є –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–∞—П –∞–і–∞–њ—В–∞—Ж–Є—П –Ї –Ї—А–∞—П–Љ —А–∞–љ—Л. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –і–∞–љ–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –Њ—В–Љ–µ—З–µ–љ–Њ –њ–Њ–ї–љ–Њ–µ –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є–µ –ї–Њ—Б–Ї—Г—В–∞, —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ –Њ–њ–Њ—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є —Б—В–Њ–њ—Л —Д–Є–Ј–Є—З–µ—Б–Ї–∞—П –Є —Б–Њ—Ж–Є–∞–ї—М–љ–∞—П —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є—П –њ–∞—Ж–Є–µ–љ—В–∞ (—А–Є—Б. 3.1–3.3).
–Ч–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 5 –ї–µ—В –љ–∞–Љ–Є –±—Л–ї–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–Њ 135 –Ї–Њ–ґ–љ–Њ––њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є —Г –±–Њ–ї—М–љ—Л—Е —Б —П–Ј–≤–µ–љ–љ—Л–Љ–Є –Є —А–∞–љ–µ–≤—Л–Љ–Є –і–µ—Д–µ–Ї—В–∞–Љ–Є –њ—А–Є –°–Ф–° (—Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –Њ—В—А–∞–ґ–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 1).
–Ю–њ–Є—А–∞—П—Б—М –љ–∞ –њ–Њ–ї—Г—З–µ–љ–љ—Л–є —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є–є –Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–є –Љ–∞—В–µ—А–Є–∞–ї, –љ–∞–Љ–Є –≤—Л–і–µ–ї–µ–љ—Л –Њ—Б–љ–Њ–≤–љ—Л–µ –њ—А–∞–≤–Є–ї–∞ —В–µ—Е–љ–Є–Ї–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є –њ—А–Є –°–Ф–°:
• –њ–Њ–ї–љ–Њ–µ –Є—Б—Б–µ—З–µ–љ–Є–µ –≥—А–∞–љ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–є –Є —А—Г–±—Ж–Њ–≤–Њ–є —В–Ї–∞–љ–Є –≤ –Њ–±–ї–∞—Б—В–Є —А–∞–љ–µ–≤–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞, —Г–і–∞–ї–µ–љ–Є–µ –Ї–Њ–ґ–љ—Л—Е —Г—З–∞—Б—В–Ї–Њ–≤ –≥–Є–њ–µ—А–Ї–µ—А–∞—В–Њ–Ј–∞;
• —В—Й–∞—В–µ–ї—М–љ—Л–є, –љ–Њ —Й–∞–і—П—Й–Є–є –≥–µ–Љ–Њ—Б—В–∞–Ј;
• –∞–і–µ–Ї–≤–∞—В–љ–Њ–µ –і—А–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ —А–∞–љ—Л (–њ—А–Є –љ–∞–ї–Є—З–Є–Є –Њ—Б—В–∞—В–Њ—З–љ—Л—Е –њ–Њ–ї–Њ—Б—В–µ–є);
• –њ–Њ—Б–ї–Њ–є–љ–Њ–µ —Г—И–Є–≤–∞–љ–Є–µ —А–∞–љ—Л —Б –ї–Є–Ї–≤–Є–і–∞—Ж–Є–µ–є –Њ—Б—В–∞—В–Њ—З–љ—Л—Е –њ–Њ–ї–Њ—Б—В–µ–є –њ—Г—В–µ–Љ –љ–∞–ї–Њ–ґ–µ–љ–Є—П –≥–ї—Г–±–Њ–Ї–Є—Е —И–≤–Њ–≤ —А–∞—Б—Б–∞—Б—Л–≤–∞—О—Й–Є–Љ–Є—Б—П –љ–Є—В—П–Љ–Є –љ–∞ –∞—В—А–∞–≤–Љ–∞—В–Є—З–љ–Њ–є –Є–≥–ї–µ;
• –њ—А–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Ј–∞–њ–Њ–ї–љ–µ–љ–Є–µ –њ–Њ–ї–Њ—Б—В–µ–є –і–µ—Н–њ–Є—В–µ–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–Љ –ґ–Є—А–Њ–≤—Л–Љ –ї–Њ—Б–Ї—Г—В–Њ–Љ;
• –∞–і–∞–њ—В–∞—Ж–Є—П –Ї–Њ–ґ–љ—Л—Е –ї–Њ—Б–Ї—Г—В–Њ–≤ –±–µ–Ј —З—А–µ–Ј–Љ–µ—А–љ–Њ–≥–Њ –љ–∞—В—П–ґ–µ–љ–Є—П —В–Ї–∞–љ–µ–є;
• –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј–µ–Ї—Ж–Є–Є –Ї–Њ—Б—В–µ–є —Б—В–Њ–њ—Л –і–ї—П –±–µ—Б–њ—А–µ–њ—П—В—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ј–∞–Ї—А—Л—В–Є—П —А–∞–љ–µ–≤—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤ –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є –≤—Л–≥–Њ–і–љ–Њ–є —Д–Њ—А–Љ—Л —Б—В–Њ–њ—Л;
• –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Ј–∞–Ї—А—Л—В–Є—П –Њ–њ–Њ—А–љ—Л—Е –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–µ–є —Б—В–Њ–њ—Л, –Ї–Њ—Б—В–љ–Њ–—Б—Г—Б—В–∞–≤–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А, —Б—Г—Е–Њ–ґ–Є–ї–Є–є –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ—Л–Љ–Є –≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ–Є –ї–Њ—Б–Ї—Г—В–∞–Љ–Є;
• –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –і–ї—П –∞—Г—В–Њ–і–µ—А–Љ–Њ–њ–ї–∞—Б—В–Є–Ї–Є –љ–µ–њ–µ—А—Д–Њ—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–Њ–ґ–љ—Л—Е –ї–Њ—Б–Ї—Г—В–Њ–≤, —В—Й–∞—В–µ–ї—М–љ–Њ —Д–Є–Ї—Б–Є—А—Г–µ–Љ—Л—Е –Ї –Ї—А–∞—П–Љ —А–∞–љ–µ–≤–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞ —И–≤–∞–Љ–Є.
–°–Њ–±–ї—О–і–µ–љ–Є–µ –і–∞–љ–љ—Л—Е –њ—А–∞–≤–Є–ї –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Ј–±–µ–ґ–∞—В—М –±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Я–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–µ –≤–µ–і–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е. –Я–Њ—Б–ї–µ –Ї–Њ–ґ–љ–Њ––њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є, —Б —Г—З–µ—В–Њ–Љ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л. –Ф–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Љ–Є–Ї—А–Њ—В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –≤ –Љ–Њ–±–Є–ї–Є–Ј–Њ–≤–∞–љ–љ—Л—Е –Ї–Њ–ґ–љ—Л—Е –ї–Њ—Б–Ї—Г—В–∞—Е –љ–∞–Ј–љ–∞—З–∞–ї–Є –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –≥–µ–њ–∞—А–Є–љ—Л, —Б—Г–ї–Њ–і–µ–Ї—Б–Є–і, –Р–Ї—В–Њ–≤–µ–≥–Є–љ. –Ф–ї—П –Ј–∞—Й–Є—В—Л —Б–≤–Њ–±–Њ–і–љ–Њ–њ–µ—А–µ—Б–∞–ґ–µ–љ–љ—Л—Е –Ї–Њ–ґ–љ—Л—Е –ї–Њ—Б–Ї—Г—В–Њ–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –∞—В—А–∞–≤–Љ–∞—В–Є—З–љ—Л–µ –њ–Њ–≤—П–Ј–Ї–Є —Б —А–∞–љ–µ–≤—Л–Љ–Є —Б–µ—В—З–∞—В—Л–Љ–Є –њ–Њ–Ї—А—Л—В–Є—П–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –ї–µ–≥–Ї–Њ –Љ–Њ–і–µ–ї–Є—А—Г—О—В—Б—П –љ–∞ —А–∞–љ–µ, –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Ј–∞—Й–Є—Й–∞—П –µ–µ –Њ—В –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –Є–љ—Д–µ–Ї—Ж–Є–Є, –≤—Л—Б—Л—Е–∞–љ–Є—П –Є –і—А—Г–≥–Є—Е –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤. –І–∞—Б—В–Њ—В–∞ —Б–Љ–µ–љ—Л –њ–Њ–≤—П–Ј–Ї–Є – 1 —А–∞–Ј –≤ 3–7 –і–љ–µ–є. –Э–∞ —И–≤—Л –Њ–±—Л—З–љ–Њ –љ–∞–Ї–ї–∞–і—Л–≤–∞–ї–Є —Б–∞–ї—Д–µ—В–Ї–Є, –њ—А–Њ–њ–Є—В–∞–љ–љ—Л–µ 1%––Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ –њ–Њ–≤–Є–і–Њ–љ––є–Њ–і–∞, –њ–Њ–ї–Є–≥–µ–Ї—Б–∞–љ–Є–і–∞ –Є–ї–Є «–Я—А–Њ–љ—В–Њ—Б–∞–љ–∞». –Я–µ—А–µ–≤—П–Ј–Ї–Є –≤ –њ–µ—А–≤—Л–µ 3–5 —Б—Г—В–Њ–Ї –≤—Л–њ–Њ–ї–љ—П–ї–Є –µ–ґ–µ–і–љ–µ–≤–љ–Њ. –Я—А–Є –і–Њ–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ —В–Ї–∞–љ–µ–≤–Њ–Љ —А–∞—Б—В—П–ґ–µ–љ–Є–Є —В—А–∞–Ї—Ж–Є–Є –ї–Њ—Б–Ї—Г—В–Њ–≤ –љ–Є—В—П–Љ–Є –Њ–±—Л—З–љ–Њ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Є —З–µ—А–µ–Ј –і–µ–љ—М.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–Њ–ґ–љ–Њ––њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е
–≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –њ—А–Є –°–Ф–°
–Я—А–Є –Њ—Ж–µ–љ–Ї–µ –±–ї–Є–ґ–∞–є—И–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є –Ј–∞–ґ–Є–≤–ї–µ–љ–Є–µ —А–∞–љ –њ–µ—А–≤–Є—З–љ—Л–Љ –љ–∞—В—П–ґ–µ–љ–Є–µ–Љ –Њ—В–Љ–µ—З–µ–љ–Њ —Г 82 (76,63%) –Є–Ј 107 –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–Љ –љ–∞ —А–∞–љ—Л –љ–∞–ї–Њ–ґ–µ–љ—Л —И–≤—Л. –Т —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ —А–∞–љ–µ–≤—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –≤—Б—В—А–µ—З–∞–ї–Є—Б—М —Г 22 (20,56%) –±–Њ–ї—М–љ—Л—Е. –Ю–љ–Є –њ—А–Њ—В–µ–Ї–∞–ї–Є –≤ –≤–Є–і–µ —З–∞—Б—В–Є—З–љ–Њ–≥–Њ (4 –±–Њ–ї—М–љ—Л—Е) –Є–ї–Є –њ–Њ–ї–љ–Њ–≥–Њ (3 –±–Њ–ї—М–љ—Л—Е) –љ–∞–≥–љ–Њ–µ–љ–Є—П —А–∞–љ—Л. –†–∞—Б—Е–Њ–ґ–і–µ–љ–Є–µ –Ї—А–∞–µ–≤ —А–∞–љ—Л –≤—Л—П–≤–ї–µ–љ–Њ —Г 5 (4,67%) –±–Њ–ї—М–љ—Л—Е, –Ї—А–∞–µ–≤–Њ–є –љ–µ–Ї—А–Њ–Ј –Ї–Њ–ґ–Є –Њ—В–Љ–µ—З–∞–µ—В—Б—П —Г 6 (5,6%) –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї–љ—Л–є –љ–µ–Ї—А–Њ–Ј –Ї–Њ–ґ–љ–Њ–≥–Њ –ї–Њ—Б–Ї—Г—В–∞ –љ–∞–±–ї—О–і–∞–ї–Є —Г 3 (2,8%) –±–Њ–ї—М–љ—Л—Е. –£ 1 (0,93%) –±–Њ–ї—М–љ–Њ–≥–Њ —А–∞–Ј–≤–Є–ї–∞—Б—М —Д–ї–µ–≥–Љ–Њ–љ–∞ —Б—В–Њ–њ—Л. –Т —Б–ї—Г—З–∞–µ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –љ–µ–Ї—А–Њ–Ј–∞ –і–ї—П –±–Њ–ї–µ–µ –±—Л—Б—В—А–Њ–≥–Њ –µ–≥–Њ –Њ—В—В–Њ—А–ґ–µ–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Є –њ–µ—А–µ–≤—П–Ј–Ї–Є —Б —А–∞—Б—В–≤–Њ—А–∞–Љ–Є –∞–љ—В–Є—Б–µ–њ—В–Є–Ї–∞, –љ–∞–Ј–љ–∞—З–∞–ї–Є —Д–Є–Ј–Є–Њ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ, –њ—А–µ–њ–∞—А–∞—В—Л, —Г–ї—Г—З—И–∞—О—Й–Є–µ –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є—О. –Я–Њ–≤—В–Њ—А–љ–∞—П –њ–ї–∞—Б—В–Є–Ї–∞ –Љ–µ—Б—В–љ—Л–Љ–Є —В–Ї–∞–љ—П–Љ–Є –Є–ї–Є –Р–Ф–Я –њ–Њ–љ–∞–і–Њ–±–Є–ї–∞—Б—М 8 (7,47%) –±–Њ–ї—М–љ—Л–Љ. –£ –Њ—Б—В–∞–ї—М–љ—Л—Е –±–Њ–ї—М–љ—Л—Е —А–∞–љ—Л –Ј–∞–ґ–Є–ї–Є —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ –≤ —Б—А–Њ–Ї–Є –Њ—В 10 –і–Њ 22 –і–љ–µ–є.
–Я—А–Є –љ–∞–≥–љ–Њ–µ–љ–Є–Є —А–∞–љ—Л –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–Є —Б–љ—П—В–Є–µ –Ї–Њ–ґ–љ—Л—Е —И–≤–Њ–≤, —А–∞–Ј–≤–µ–і–µ–љ–Є–µ –Ї—А–∞–µ–≤ —А–∞–љ—Л, —Б–∞–љ–∞—Ж–Є—О —Б –љ–∞–ї–Њ–ґ–µ–љ–Є–µ–Љ –њ–Њ–≤—П–Ј–Њ–Ї —Б –∞–ї—М–≥–Є–љ–∞—В–љ—Л–Љ–Є —А–∞–љ–µ–≤—Л–Љ–Є –њ–Њ–Ї—А—Л—В–Є—П–Љ–Є. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —А–∞–љ–µ–≤—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Њ–±—А–∞–Ј–Њ–≤—Л–≤–∞–ї–Є—Б—М –Њ—В–Ї—А—Л—В—Л–µ —А–∞–љ—Л –њ–ї–Њ—Й–∞–і—М—О –Њ—В 1 –і–Њ 20 —Б–Љ2 (–≤ —Б—А–µ–і–љ–µ–Љ 5,5±1,8 —Б–Љ2). –Я–Њ—Б–ї–µ —А–∞–Ј–≤–Є—В–Є—П –≥–љ–Њ–є–љ–Њ––љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Є—Е —А–∞–љ–µ–≤—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г 17 (12,59%) –±–Њ–ї—М–љ—Л—Е —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–ї–Є—Б—М –≤—В–Њ—А–Є—З–љ—Л–µ –і–µ—Д–µ–Ї—В—Л. –£ 9 (5,18%) –±–Њ–ї—М–љ—Л—Е —А–∞–љ–µ–≤—Л–µ –і–µ—Д–µ–Ї—В—Л –Ј–∞–ґ–Є–ї–Є —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ –Ј–∞ 15,0±4,2 —Б—Г—В–Њ–Ї. 5 (4,67%) –±–Њ–ї—М–љ—Л–Љ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М –њ–Њ–≤—В–Њ—А–љ–∞—П –Ї–Њ–ґ–љ–∞—П –њ–ї–∞—Б—В–Є–Ї–∞ –Љ–µ—Б—В–љ—Л–Љ–Є —В–Ї–∞–љ—П–Љ–Є, 3 (2,22%) –±–Њ–ї—М–љ—Л–Љ –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–∞ –Р–Ф–Я.
–Я–Њ–ї–љ–Њ–µ –њ—А–Є–ґ–Є–≤–ї–µ–љ–Є–µ —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –Ї–Њ–ґ–љ–Њ–≥–Њ –ї–Њ—Б–Ї—Г—В–∞ –Њ—В–Љ–µ—З–µ–љ–Њ —Г 52 (82,53%) –Є–Ј 63 –±–Њ–ї—М–љ—Л—Е. –Ы–Є–Ј–Є—Б –і–Њ 50% –њ–ї–Њ—Й–∞–і–Є –Ї–Њ–ґ–Є –≤—Л—П–≤–ї–µ–љ —Г 8 (12,69%) –±–Њ–ї—М–љ—Л—Е, –ї–Є–Ј–Є—Б –±–Њ–ї—М—И–µ 50% –њ–ї–Њ—Й–∞–і–Є –ї–Њ—Б–Ї—Г—В–∞ –≤—Л—П–≤–ї–µ–љ —Г 3 (4,76%) –±–Њ–ї—М–љ—Л—Е.
–Э–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–µ —В–µ—З–µ–љ–Є–µ —А–∞–љ–µ–≤–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ —Б –њ–Њ–ї–љ—Л–Љ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є–µ–Љ —А–∞–љ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г 102 (75,55%) –±–Њ–ї—М–љ—Л—Е. –£ 33 (24,44%) –±–Њ–ї—М–љ—Л—Е –≤–Њ–Ј–љ–Є–Ї–ї–Є —А–∞–Ј–ї–Є—З–љ—Л–µ —А–∞–љ–µ–≤—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П.
–Ы–µ—В–∞–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –њ–Њ—Б–ї–µ –Ї–Њ–ґ–љ–Њ––њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М.
–Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ —А–∞–љ—Л –њ–Њ—Б–ї–µ –њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є –Ј–∞–ґ–Є–ї–Є –Ј–∞ 17,0±3,2 —Б—Г—В–Њ–Ї, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ —Н—В–Є —Б—А–Њ–Ї–Є –±—Л–ї–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї—М—И–µ – 55,0±8,3 –і–љ–µ–є. –Т –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –љ–µ –Ј–∞–ґ–Є–ї–Є –і–µ—Д–µ–Ї—В—Л —Г 15 (10,71%) –±–Њ–ї—М–љ—Л—Е.
–Я—А–Є –Њ—Ж–µ–љ–Ї–µ –Њ—В–і–∞–ї–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ —Г 84 (68,29%) –Є–Ј 123 (–≤—Б–µ–≥–Њ 135) –±–Њ–ї—М–љ—Л—Е –≤ —Б—А–Њ–Ї–Є –Њ—В 6 –Љ–µ—Б—П—Ж–µ–≤ –і–Њ 6 –ї–µ—В –Њ—В–Љ–µ—З–µ–љ–Њ –њ–Њ–ї–љ–Њ–µ –Є–ї–Є —З–∞—Б—В–Є—З–љ–Њ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –Њ–њ–Њ—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є —Б—В–Њ–њ—Л. –£ 6 (4,87%) –Њ–њ–µ—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –±–Њ–ї—М–љ—Л—Е –≤–Њ–Ј–љ–Є–Ї–ї–∞ —П–Ј–≤–∞ –≤ –Њ–±–ї–∞—Б—В–Є –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ —А—Г–±—Ж–∞, —А–µ—Ж–Є–і–Є–≤ –њ–ї–∞–љ—В–∞—А–љ–Њ–є —П–Ј–≤—Л –Њ—В–Љ–µ—З–µ–љ —Г 7 (5,69%) –±–Њ–ї—М–љ—Л—Е. –£ 8 (6,5%) –±–Њ–ї—М–љ—Л—Е –≤—Л—П–≤–ї–µ–љ–∞ —Б–≤–Є—Й–µ–≤–∞—П —Д–Њ—А–Љ–∞ –Њ—Б—В–µ–Њ–Љ–Є–µ–ї–Є—В–∞ –њ–ї—О—Б–љ–µ–≤—Л—Е –Ї–Њ—Б—В–µ–є, —Г 4 (3,25%) –±–Њ–ї—М–љ—Л—Е —А–∞–Ј–≤–Є–ї–∞—Б—М –≥–∞–љ–≥—А–µ–љ–∞ –њ–∞–ї—М—Ж–µ–≤ –Є–ї–Є —Б—В–Њ–њ—Л.
–Я—А–Њ–≥–љ–Њ–Ј –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –±–ї–∞–≥–Њ–њ—А–Є—П—В–µ–љ –њ—А–Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е —П–Ј–≤–∞—Е: —Б–Њ—Б—В–∞–≤–ї—П–µ—В 70%, –њ–Њ —Б–≤–Њ–і–љ—Л–Љ –і–∞–љ–љ—Л–Љ I.D.F. Bulletin (1993), –Є –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –Њ—В 50 –і–Њ 70% –≤ —Б–ї—Г—З–∞–µ —А–∞–Ј—А–µ—И–µ–љ–Є—П –љ–µ–є—А–Њ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Є—Е —П–Ј–≤ —Б—В–Њ–њ –ї–µ—З–Є—В—Б—П –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ, –Є —Б—А–µ–і–љ–Є–µ —Б—А–Њ–Ї–Є –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П –≤ –ї—Г—З—И–µ–Љ —Б–ї—Г—З–∞–µ —Б–Њ—Б—В–∞–≤–ї—П—О—В 6–14 –љ–µ–і. [8]. –Т –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –≤ –®–≤–µ—Ж–Є–Є Walsh C.H. et al. (1996), –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —А–µ—Ж–Є–і–Є–≤–Њ–≤ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Є—Е —П–Ј–≤ –њ–Њ—Б–ї–µ –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П – —З–µ—А–µ–Ј 1 –≥–Њ–і, 3 –Є 5 –ї–µ—В –Њ–љ —Б–Њ—Б—В–∞–≤–Є–ї —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 44, 61 –Є 70% [1,12,15]. –Ю—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–µ —Б–ї—Г—З–∞–Є —В—А–µ–±—Г—О—В –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –Њ—В 30–40 –і–љ–µ–є –і–Њ 2 –Љ–µ—Б—П—Ж–µ–≤ –≤ —Б–ї—Г—З–∞—П—Е –ї–µ—З–µ–љ–Є—П —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –∞–Љ–њ—Г—В–∞—Ж–Є–µ–є [15].
–Я–Њ–≤—В–Њ—А–љ–∞—П –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є—П –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–∞—Б—М 47 (33,57%) –±–Њ–ї—М–љ—Л–Љ –≤ —Б–≤—П–Ј–Є —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (—Д–ї–µ–≥–Љ–Њ–љ—Л, –≥–∞–љ–≥—А–µ–љ—Л, –Њ—Б—В–µ–Њ–Љ–Є–µ–ї–Є—В–∞), —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є – 17 (12,59%) –±–Њ–ї—М–љ—Л–Љ. –Т —Б–≤—П–Ј–Є —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —В—П–ґ–µ–ї—Л—Е –≥–љ–Њ–є–љ–Њ––љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є –≥–∞–љ–≥—А–µ–љ–Њ–Ј–љ–Њ––Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –љ–∞ —Б—В–Њ–њ–µ –≤—Л—Б–Њ–Ї–∞—П –∞–Љ–њ—Г—В–∞—Ж–Є—П –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–∞—Б—М 15 (10,71%) –±–Њ–ї—М–љ—Л–Љ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ. –Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –њ–Њ –њ–Њ–≤–Њ–і—Г –і–∞–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–Њ 10 (8,1%) –±–Њ–ї—М–љ—Л—Е, –∞ –∞–Љ–њ—Г—В–∞—Ж–Є—П –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –≤—Л–њ–Њ–ї–љ–µ–љ–∞ 5 (4,06%) –±–Њ–ї—М–љ—Л–Љ.
–Т –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ 85,4% –±–Њ–ї—М–љ—Л—Е –∞–Ї—В–Є–≤–љ–Њ –њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М —Б—В–Њ–њ–Њ–є, –∞ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ 52,3% –±—Л–ї–Є –ї–Є—И–µ–љ—Л —Н—В–Њ–є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є.
–Ы–µ—В–∞–ї—М–љ–Њ—Б—В—М –≤ –Њ—В–і–∞–ї–µ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ 8,57%, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є 3,25%. –°–Љ–µ—А—В—М –љ–∞—Б—В—Г–њ–Є–ї–∞ —Г 5 –±–Њ–ї—М–љ—Л—Е –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –°–Ф, –Њ—В –Ш–С–° —Г 4 –±–Њ–ї—М–љ—Л—Е, –¶–Т–С – —Г 3 –±–Њ–ї—М–љ—Л—Е.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –ї–µ—З–µ–љ–Є–µ —П–Ј–≤–µ–љ–љ—Л—Е –Є —А–∞–љ–µ–≤—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤ —Б—В–Њ–њ—Л, —А–∞–Ј–≤–Є–≤—И–Є—Е—Б—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —В—П–ґ–µ–ї—Л—Е –≥–љ–Њ–є–љ–Њ––љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –љ–∞ —Д–Њ–љ–µ –°–Ф–°, –њ—А–Є –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є —А–∞–љ–µ–≤–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є –ґ–µ–ї–∞—В–µ–ї—М–љ–Њ –Ј–∞–≤–µ—А—И–Є—В—М –Ј–∞–Ї—А—Л—В–Є–µ–Љ –і–µ—Д–µ–Ї—В–∞, –Њ—В–і–∞–≤–∞—П –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ —В–Њ–Љ—Г –Є–ї–Є –Є–љ–Њ–Љ—Г —Б–њ–Њ—Б–Њ–±—Г –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є. –Т—Л–±–Њ—А –Љ–µ—В–Њ–і–∞ –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є –Ј–∞–≤–Є—Б–Є—В –Њ—В –Њ–±—Й–µ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ, –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є, –≥–ї—Г–±–Є–љ—Л, —Д–Њ—А–Љ—Л —А–∞–љ–µ–≤–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞. –Т—Л–њ–Њ–ї–љ–µ–љ–Є–µ –Ї–Њ–ґ–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ —Б–њ–Њ–љ—В–∞–љ–љ—Л–Љ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є–µ–Љ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤ –±–Њ–ї–µ–µ –Ї–Њ—А–Њ—В–Ї–Є–µ —Б—А–Њ–Ї–Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В—М –Њ–њ–Њ—А–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є; —А–µ–Ј–Ї–Њ —Б–Њ–Ї—А–∞—В–Є—В—М —З–Є—Б–ї–Њ –Њ—В–і–∞–ї–µ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —Г–Љ–µ–љ—М—И–Є—В—М –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –∞–Љ–њ—Г—В–∞—Ж–Є–є, –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Њ–±—Й–µ–≥–Њ –ї–µ—З–µ–љ–Є—П, —З—В–Њ —Б–Њ–Ј–і–∞–µ—В –њ—А–µ–і–њ–Њ—Б—Л–ї–Ї–Є –і–ї—П —Б–Ї–Њ—А–µ–є—И–µ–є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –Є —Б–Њ—Ж–Є–∞–ї—М–љ–Њ–є —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Є –±–Њ–ї—М–љ–Њ–≥–Њ –Є –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ –њ—А–Є–≤–Њ–і–Є—В –Ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –Ј–∞—В—А–∞—В –љ–∞ –ї–µ—З–µ–љ–Є–µ.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Р—Б—В–∞—Е–Њ–≤–∞ –Ш.–Э. –Ь–∞–ї—Л–µ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞. // –•–Є—А—Г—А–≥–Є—П.–2001.– 12.––°.34–37.
2. –У—Г—А—М–µ–≤–∞ –Ш.–Т. –°–Є–љ–і—А–Њ–Љ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —Б—В–Њ–њ—Л —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П —Б—В–∞–љ–і–∞—А—В–Њ–≤ –Љ—Г–ї—М—В–Є–і–Є—Б—Ж–Є–њ–ї–Є–љ–∞—А–љ–Њ–є –њ–Њ–Љ–Њ—Й–Є //–°—В–∞–љ–і–∞—А—В—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –≤ –≥–љ–Њ–є–љ–Њ–є —Е–Є—А—Г—А–≥–Є–Є. –Ь–∞—В–µ—А–Є–∞–ї—Л –љ–∞—Г—З.––њ—А–∞–Ї—В. –Ъ–Њ–љ—Д.,–Ь–Њ—Б–Ї–≤–∞,23–24 –Њ–Ї—В.2001.
3. –У–Њ—А—О–љ–Њ–≤ –°.–Т., –†–Њ–Љ–∞—И–Њ–≤ –Ф.–Т., –С—Г—В–Є–≤—Й–µ–љ–Ї–Њ –Ш.–Р. «–У–љ–Њ–є–љ–∞—П —Е–Є—А—Г—А–≥–Є—П» –Р—В–ї–∞—Б // –Ь. «–С–Є–љ–Њ–Љ» 2004–≥. – 556—Б.
4. –Ф–µ–і–Њ–≤ –Ш.–Ш. –°–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В: –њ–∞—В–Њ–≥–µ–љ–µ–Ј, –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П, –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Є –ї–µ—З–µ–љ–Є–µ: –Я–Њ—Б–Њ–±–Є–µ –і–ї—П –≤—А–∞—З–µ–є /–Ш.–Ш. –Ф–µ–і–Њ–≤, –Ь.–Ш. –С–∞–ї–∞–±–Њ–ї–Ї–Є–љ, –Х.–Ь. –Ъ–ї–µ–±–∞–љ–Њ–≤–∞ –Є –і—А. – –Ь., 2003. – 170—Б.
5. –Ф–µ–і–Њ–≤ –Ш.–Ш., –У–∞–ї—Б—В—П–љ –У.–†., –Ґ–Њ–Ї–Љ–∞–Ї–Њ–≤–∞ –Р.–Ѓ., –£–і–Њ–≤–Є—З–µ–љ–Ї–Њ –Ю.–Т. –°–Є–љ–і—А–Њ–Љ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —Б—В–Њ–њ—Л. –Я–Њ—Б–Њ–±–Є–µ –і–ї—П –≤—А–∞—З–µ–є. –Ь–Њ—Б–Ї–≤–∞, 2003. –°.112.
6. –Ф–µ–і–Њ–≤ –Ш.–Ш. –°–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В– –њ—А–Њ–±–ї–µ–Љ–∞ XXI// –Т—А–∞—З.–2000.–вДЦ1.––°.4–5.
7. –Ч–µ–Љ–ї—П–љ–Њ–є –Р.–С. «–°–Є–љ–і—А–Њ–Љ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —Б—В–Њ–њ—Л. –Ъ–ї–Є–љ–Є–Ї–∞, –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞, –ї–µ—З–µ–љ–Є–µ» // –і–Њ–Ї—В. –Ь–µ–і. –Э–∞—Г–Ї. – –Ь – 2003. – –° 26–47.
8. –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–µ —Б–Њ–≥–ї–∞—И–µ–љ–Є–µ –њ–Њ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —Б—В–Њ–њ–µ:– –Ь.: –Ш–Ј–і––≤–Њ «–С–µ—А–µ–≥», 2000.–96 —Б.
9. –Э–Є–Ї–Є—В–Є–љ –У.–Ф. , –Ъ–∞—А—В–∞—И–µ–≤ –Ш.–Я., –†–∞–Ї –Р.–Т., –Р–≤–µ—А—О—И–Ї–Є–љ –Р.–Т. –Є –і—А. –Я–ї–∞—Б—В–Є—З–µ—Б–Ї–∞—П —Е–Є—А—Г—А–≥–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Є –љ–µ–є—А–Њ—В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е —П–Ј–≤ / –°–∞–љ–Ї—В––Я–µ—В–µ—А–±—Г—А–≥ 2001– –°. 131–165.
10. –°–≤–µ—В—Г—Е–Є–љ –Р.–Ь., –Ч–µ–Љ–ї—П–љ–Њ–є –Р.–С. –Ъ–Њ–Љ–ї–µ–Ї—Б–љ–Њ–µ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ –≥–љ–Њ–є–љ–Њ––љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Є—Е —Д–Њ—А–Љ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–є —Б—В–Њ–њ—Л.// –Ш–Ј–±—А–∞–љ–љ—Л–є –Ї—Г—А—Б –ї–µ–Ї—Ж–Є–є –њ–Њ –≥–љ–Њ–є–љ–Њ–є —Е–Є—А—Г—А–≥–Є–Є –Ь.2007 – –°. 153–171.
11. –Ґ–Њ–Ї–Љ–∞–Ї–Њ–≤–∞ –Р.–Ѓ., –Ь—Л—Б–Ї–Є–љ–∞ –Э.–Р., –Р—А–±—Г–Ј–Њ–≤–∞ –Ь.–Ш. –§–Є–Ј–Є–Њ–ї–Њ–≥–Є—П —А–µ–њ–∞—А–∞—Ж–Є–Є —В–Ї–∞–љ–µ–є —Г –±–Њ–ї—М–љ—Л—Е —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є —П–Ј–≤–∞–Љ–Є –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є. –Р–Ї—В—Г–∞–ї—М–љ—Л–µ –≤–Њ–њ—А–Њ—Б—Л –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞, –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –њ–Њ—А–∞–ґ–µ–љ–Є–є –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є —Г –±–Њ–ї—М–љ—Л—Е —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ. –°–±–Њ—А–љ–Є–Ї –ї–µ–Ї—Ж–Є–є –і–ї—П –≤—А–∞—З–µ–є. –Я–Њ–і —А–µ–і–∞–Ї—Ж–Є–µ–є –њ—А–Њ—Д. –Р–љ—Ж–Є—Д–µ—А–Њ–≤–∞ –Ь.–С. – –Ь–Њ—Б–Ї–≤–∞, 2003. – –°. 75–94.
12. Jaeger K.H., Leybold K., Mittenzwei H., et al. // Arzneim–Forsch (Drug Research) – 1965 – Vol.15 – P.750–754.
13. Levin M. Management of the Diabetic Foot: Preventing Amputation. // South Med. J.– 2002. –Vol.95.– вДЦ1.– P. 10–20.
14. Reiber G.E. The Epidemiology of the Diabetic Foot Problems. Diabetic Medicine Supple 1 1996;13 (1):6–11.
15. Walsh CH. A healed ulcer: what now? Diab. Med Supple 1 1996;13:58–60.












