–Ч–∞—В—А–∞—В—Л –љ–∞ –ї–µ—З–µ–љ–Є–µ —Б–њ–∞–µ—З–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –≤–µ—Б—М–Љ–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л. –Т –°–®–Р –µ–ґ–µ–≥–Њ–і–љ–Њ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –±–Њ–ї–µ–µ 300 —В—Л—Б. —Б–ї—Г—З–∞–µ–≤ —Б–њ–∞–µ—З–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є, –≤ 1% —Б–ї—Г—З–∞–µ–≤ –≤—Л–њ–Њ–ї–љ—П–µ—В—Б—П –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ, –≤ 3% вАУ —Н–Ї—Б—В—А–µ–љ–љ–∞—П –ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є—П. 33% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–≤—В–Њ—А–љ–Њ –Њ–±—А–∞—Й–∞—О—В—Б—П –≤ –Љ–µ–і—Г—З—А–µ–ґ–і–µ–љ–Є—П –≤ —Б—А–µ–і–љ–Є–µ —Б—А–Њ–Ї–Є –Њ—В 2 –і–Њ 10 –ї–µ—В. –°—В–Њ–Є–Љ–Њ—Б—В—М –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П —Б–њ–∞–µ—З–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –≤ 2001 –≥. –≤ –°–®–Р –і–Њ—Б—В–Є–≥–ї–∞ 5 –±–Є–ї–ї–Є–Њ–љ–Њ–≤ –і–Њ–ї–ї–∞—А–Њ–≤ [6, 9].
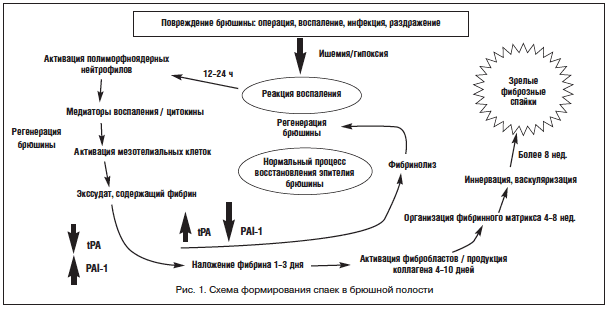
–°–Њ–≥–ї–∞—Б–љ–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П–Љ, –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є —Н—В–Є–Њ–њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Б–њ–∞–µ–Ї —Б—З–Є—В–∞—О—В—Б—П –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ –Љ–µ–Ј–Њ—В–µ–ї–Є—П –±—А—О—И–Є–љ—Л –Є —А–∞–Ј–≤–Є—В–Є–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П —Б –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ–Љ –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ–Њ–є —Д–∞–Ј—Л [12, 15]. –С–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–µ —А–∞–≤–љ–Њ–≤–µ—Б–Є–µ –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ—П–Љ–Є —В–Ї–∞–љ–µ–≤–Њ–≥–Њ –∞–Ї—В–Є–≤–∞—В–Њ—А–∞ –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞ (–∞–љ–≥–ї. tissue plasminogen activator, tPA) –Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –∞–Ї—В–Є–≤–∞—В–Њ—А–∞ –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞ (–∞–љ–≥–ї. plasminogen activator inhibitor 1, PAI-1) –≤ –Њ–±–ї–∞—Б—В–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–љ–Њ–є –±—А—О—И–Є–љ—Л —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ–µ–є—И–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –µ–µ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П –Є–ї–Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Б–њ–∞–µ–Ї (—А–Є—Б. 1).
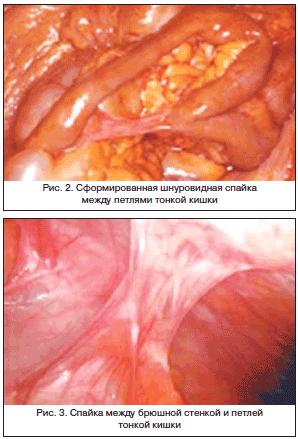
–Я–Њ–ї–љ–Њ–µ —А–∞—Б—Б–∞—Б—Л–≤–∞–љ–Є–µ —Д–Є–±—А–Є–љ–∞ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ—А–µ–Њ–±–ї–∞–і–∞—О—Й–µ–≥–Њ –і–µ–є—Б—В–≤–Є—П tPA –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–µ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є–µ –±—А—О—И–Є–љ—Л. –Э–µ–њ–Њ–ї–љ–Њ–µ —А–∞—Б—Б–∞—Б—Л–≤–∞–љ–Є–µ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є—П –Є–љ–≥–Є–±–Є—А—Г—О—Й–µ–≥–Њ –і–µ–є—Б—В–≤–Є—П PAI-1 –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞—В—М—Б—П –Њ—В–ї–Њ–ґ–µ–љ–Є—П–Љ —Д–Є–±—А–Є–љ–∞, —П–≤–ї—П—О—Й–µ–≥–Њ—Б—П –Љ–∞—В—А–Є—Ж–µ–є –і–ї—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Є —Б–Њ–Ј—А–µ–≤–∞–љ–Є—П —Б–њ–∞–µ–Ї [7]. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ —Б–Є–Љ–њ—В–Њ–Љ–љ—Л–є —Б–њ–∞–µ—З–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –љ–∞–±–ї—О–і–∞–µ—В—Б—П –≤ –љ–Є–ґ–љ–Є—Е —Н—В–∞–ґ–∞—Е –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Є –Љ–µ–ґ–і—Г –њ–µ—В–ї—П–Љ–Є —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є –Є —Б–∞–ї—М–љ–Є–Ї–Њ–Љ –Є–ї–Є –±—А—О—И–љ–Њ–є —Б—В–µ–љ–Ї–Њ–є [11, 18]. –Э–∞ —А–Є—Б—Г–љ–Ї–∞—Е 2, 3 –њ–Њ–Ї–∞–Ј–∞–љ–Њ, –Ї–∞–Ї –≤—Л–≥–ї—П–і—П—В —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ—Л–µ —Б–њ–∞–є–Ї–Є.
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ 10 –ї–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤–Њ–Ј—А–Њ—Б –Є–љ—В–µ—А–µ—Б –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –Ї –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —Б–њ–∞–µ—З–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –±—А—О—И–Є–љ—Л. B.M. Pijman et al. –≤—Л–і–µ–ї–Є–ї–Є 4 –≥—А—Г–њ–њ—Л –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є –њ–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —Б–њ–∞–µ—З–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є [10]:
1. –£–Љ–µ–љ—М—И–µ–љ–Є–µ —В—А–∞–≤–Љ—Л –±—А—О—И–Є–љ—Л.
2. –°–љ–Є–ґ–µ–љ–Є–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є –≤ –Ј–Њ–љ–µ –Њ–њ–µ—А–∞—Ж–Є–Є.
3. –£–Љ–µ–љ—М—И–µ–љ–Є–µ –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є –≤—Л–њ–∞–і–µ–љ–Є—П —Д–Є–±—А–Є–љ–∞ –≤ —Б–≤–Њ–±–Њ–і–љ–Њ–є –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є.
4. –Ю—В–≥—А–∞–љ–Є—З–µ–љ–Є–µ –Є–ї–Є —А–∞–Ј–Њ–±—Й–µ–љ–Є–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–љ—Л—Е —Б–µ—А–Њ–Ј–љ—Л—Е –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–µ–є –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ —Б–Њ–Ј–і–∞–љ–Є—П –Ј–∞—Й–Є—В–љ—Л—Е –±–∞—А—М–µ—А–Њ–≤ –љ–∞ –Љ–µ–Ј–Њ—В–µ–ї–Є–Є.
–Ю–і–љ–Є–Љ –Є–Ј –Љ–µ—В–Њ–і–Њ–≤ –Ј–∞—Й–Є—В—Л –±—А—О—И–Є–љ—Л –Њ—В —Б–њ–∞–µ–Ї —П–≤–ї—П–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ—А–Њ—В–Є–≤–Њ—Б–њ–∞–µ—З–љ—Л—Е –±–∞—А—М–µ—А–Њ–≤ [13, 16]. –Я–Њ –∞–≥—А–µ–≥–∞—В–љ–Њ–Љ—Г —Б–Њ—Б—В–Њ—П–љ–Є—О –њ—А–Њ—В–Є–≤–Њ—Б–њ–∞–µ—З–љ—Л–µ –±–∞—А—М–µ—А—Л –Љ–Њ–ґ–љ–Њ –Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А–Њ–≤–∞—В—М —Б–ї–µ–і—Г—О—Й–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ:
1. –У–∞–Ј—Л (–≤–Њ–Ј–і—Г—Е, –Ї–Є—Б–ї–Њ—А–Њ–і, –≥–µ–ї–Є–є –Є –і—А.).
2. –Р—Н—А–Њ–Ј–Њ–ї–Є (–ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –≤–Ј–≤–µ—Б–Є).
3. –Ц–Є–і–Ї–Њ—Б—В–Є (–і–µ–Ї—Б—В—А–∞–љ—Л, –≥–µ–Љ–Њ–і–µ–Ј, —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є —А–∞—Б—В–≤–Њ—А –Є –і—А.).
4. –У–µ–ї–Є (–≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞, –Ї–∞—А–±–Њ–Ї—Б–Є–Љ–µ—В–Є–ї—Ж–µ–ї–ї—О–ї–Њ–Ј–∞, —Д–Њ—Б—Д–Њ—В–Є–і–Є–ї—Е–Њ–ї–Є–љ, —Д–Є–±—А–Є–љ–Њ–≤—Л–є –Ї–ї–µ–є –Є –і—А.).
5. –Ґ–≤–µ—А–і—Л–µ –≤–µ—Й–µ—Б—В–≤–∞:
- –њ–ї–µ–љ–Ї–Є;
- –Љ–µ–Љ–±—А–∞–љ—Л;
- —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–µ —Г—Б—В—А–Њ–є—Б—В–≤–∞.
–Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ —Б–њ–Є—Б–Њ–Ї –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤: –Њ—В–Ї—А—Л—В—Л—Е –Є –ї–∞–њ–∞—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є—Е вАУ –љ–∞ –Њ—А–≥–∞–љ–∞—Е –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Њ–≤–Њ–і–Є—В—М –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г —Б–њ–∞–µ—З–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞:
- –≤—Б–µ –Њ–њ–µ—А–∞—Ж–Є–Є –љ–∞ –Њ—А–≥–∞–љ–∞—Е –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П —Б—А–µ–і–Є–љ–љ–∞—П –ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –і–Њ—Б—В—Г–њ–∞;
- –∞–њ–њ–µ–љ–і—Н–Ї—В–Њ–Љ–Є—П;
- –≤—Б–µ –≤–Є–і—Л –Њ–њ–µ—А–∞—Ж–Є–є –љ–∞ –љ–Є—Б—Е–Њ–і—П—Й–µ–є –Є –њ—А—П–Љ–Њ–є –Ї–Є—И–Ї–µ;
- —А–µ–Ј–µ–Ї—Ж–Є—П –ґ–µ–ї—Г–і–Ї–∞;
- –Њ–њ–µ—А–∞—Ж–Є–Є –њ–Њ –њ–Њ–≤–Њ–і—Г —А–∞–љ–µ–љ–Є–є –Є —В—А–∞–≤–Љ –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є;
- —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є–µ –Њ–њ–µ—А–∞—Ж–Є–Є –љ–∞ –Њ—А–≥–∞–љ–∞—Е –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є;
- –∞–і–≥–µ–Ј–Є–Њ–ї–Є–Ј–Є—Б;
- –Њ–њ–µ—А–∞—Ж–Є–Є –њ–Њ –њ–Њ–≤–Њ–і—Г –Ю–Ъ–Э;
- –≥–µ—А–љ–Є–Њ–њ–ї–∞—Б—В–Є–Ї–∞.
–Я—А–Є –≤—Б–µ—Е —Н—В–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞—Е –Њ–њ—А–∞–≤–і–∞–љ–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–Њ—В–Є–≤–Њ—Б–њ–∞–µ—З–љ—Л—Е –Љ–µ–Љ–±—А–∞–љ. –Т —Е–Њ–і–µ –Њ–њ–µ—А–∞—Ж–Є–Є –Њ–љ–Є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –±–∞—А—М–µ—А–∞, —А–∞–Ј–і–µ–ї—П—О—Й–µ–≥–Њ —Б–Њ–њ—А–Є–Ї–∞—Б–∞—О—Й–Є–µ—Б—П –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Њ–≤ –Є —В–Ї–∞–љ–µ–є –љ–∞ —Г—З–∞—Б—В–Ї–∞—Е –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Є –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞, –≥–і–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —А–∞–Ј–≤–Є—В–Є–µ —Б–њ–∞–µ—З–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –Т –і–∞–љ–љ–Њ–є —Б—В–∞—В—М–µ –Њ–±–Њ–±—Й–µ–љ –њ–µ—А–≤—Л–є –Њ–њ—Л—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —А–∞—Б—Б–∞—Б—Л–≤–∞—О—Й–µ–є—Б—П –њ—А–Њ—В–Є–≤–Њ—Б–њ–∞–µ—З–љ–Њ–є –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л –Ъ–Њ–ї–У–Р–†–Р, –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ–Њ–є –і–ї—П –Є–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –Є–Љ–њ–ї–∞–љ—В–∞—Ж–Є–Є, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–љ–Њ–є –Є–љ—В—А–∞–∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є. –Э–Є–ґ–µ –њ—А–Є–≤–µ–і–µ–љ—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Љ–µ—А—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Љ–µ–Љ–±—А–∞–љ—Л –Ъ–Њ–ї–У–Р–†–Р —Б —Ж–µ–ї—М—О –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —Б–њ–∞–µ—З–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ вДЦ 1
–Ю–њ–µ—А–Є—А—Г—О—Й–Є–є —Е–Є—А—Г—А–≥: –Р.–У. –Ь–∞–ї—Л–≥–Є–љ (–Ь–С–£–Ч –У–Ъ–С вДЦ 6. I —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –Њ—В–і–µ–ї–µ–љ–Є–µ, –≥. –І–µ–ї—П–±–Є–љ—Б–Ї).
–Я–∞—Ж–Є–µ–љ—В –§., 64 –≥–Њ–і–∞, –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–є —Б –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ: –ґ–µ–ї—З–љ–Њ–Ї–∞–Љ–µ–љ–љ–∞—П –±–Њ–ї–µ–Ј–љ—М (–Ц–Ъ–С), —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є –Ї–∞–ї—М–Ї—Г–ї–µ–Ј–љ—Л–є —Е–Њ–ї–µ—Ж–Є—Б—В–Є—В, —Е–Њ–ї–µ–і–Њ—Е–Њ–ї–Є—В–Є–∞–Ј, –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–∞—П –≤–µ–љ—В—А–∞–ї—М–љ–∞—П –≥—А—Л–ґ–∞ –њ–Њ—Б–ї–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–≥–Њ –њ–∞–љ–Ї—А–µ–∞—В–Є—В–∞ —Б –∞–±–і–Њ–Љ–Є–љ–Є–Ј–∞—Ж–Є–µ–є –Є –Љ–∞—А—Б—Г–њ–Є–∞–ї–Є–Ј–∞—Ж–Є–µ–є –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л. –Ю–њ—А–µ–і–µ–ї–µ–љ—Л –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О. –Ш–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ: –≤ –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є —Г–Љ–µ—А–µ–љ–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —Б–њ–∞–µ—З–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –њ–Њ—Б–ї–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –љ–∞ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј–µ. –Я–Њ—Б–ї–µ –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –Љ–∞–љ–Є–њ—Г–ї—П—Ж–Є–Є –љ–∞ –ґ–µ–ї—З–љ—Л—Е –њ—А–Њ—В–Њ–Ї–∞—Е –љ–∞ –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ—Г—О –Ї–Є—И–Ї—Г (–Ф–Я–Ъ) —Г–ї–Њ–ґ–µ–љ–∞ –Љ–µ–Љ–±—А–∞–љ–∞ –Ъ–Њ–ї–У–Р–†–Р (—А–Є—Б. 4) –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–њ–∞–µ—З–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ —Н—В–Њ–є –Њ–±–ї–∞—Б—В–Є, –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Б—А–∞—Й–µ–љ–Є–є –Љ–µ–ґ–і—Г –ї–Њ–ґ–µ–Љ –ґ–µ–ї—З–љ–Њ–≥–Њ –њ—Г–Ј—Л—А—П –Є –Ф–Я–Ъ. –Ф–∞–ї–µ–µ –≤—Л–њ–Њ–ї–љ–µ–љ —Б–ї–µ–і—Г—О—Й–Є–є —Н—В–∞–њ –Њ–њ–µ—А–∞—Ж–Є–Є вАУ –≤–µ–љ—В—А–∞–ї—М–љ–Њ–µ –≥—А—Л–ґ–µ—Б–µ—З–µ–љ–Є–µ —Б –њ–ї–∞—Б—В–Є–Ї–Њ–є –і–µ—Д–µ–Ї—В–∞ –∞–њ–Њ–љ–µ–≤—А–Њ–Ј–∞ –њ—А–Њ–ї–µ–љ–Њ–≤—Л–Љ —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Њ–Љ. –Я–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л–є –њ–µ—А–Є–Њ–і –њ—А–Њ—В–µ–Ї–∞–ї –±–µ–Ј –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Я–∞—А–µ–Ј –Ї–Є—И–µ—З–љ–Є–Ї–∞ —А–∞–Ј—А–µ—И–Є–ї—Б—П –љ–∞ 3-–Є —Б—Г—В. –Я–∞—Ж–Є–µ–љ—В –≤—Л–њ–Є—Б–∞–љ –љ–∞ 9-–µ —Б—Г—В.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ вДЦ 2
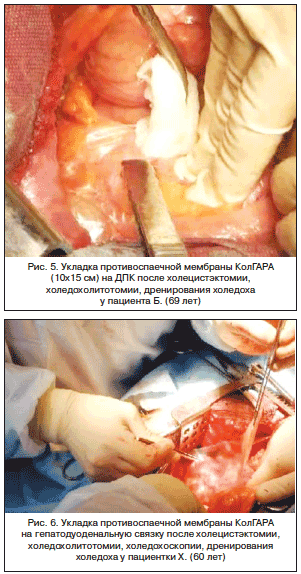
–Ю–њ–µ—А–Є—А—Г—О—Й–Є–є —Е–Є—А—Г—А–≥: –Э.–Т. –Ъ–∞—А–Љ–∞–Ј–Њ–≤–∞ (–Ь–С–£–Ч –У–Ъ–С вДЦ 6, I —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –Њ—В–і–µ–ї–µ–љ–Є–µ, –≥. –І–µ–ї—П–±–Є–љ—Б–Ї).
–Я–∞—Ж–Є–µ–љ—В –С., 69 –ї–µ—В, –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ —Б –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ: –Ц–Ъ–С, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є –Ї–∞–ї—М–Ї—Г–ї–µ–Ј–љ—Л–є —Е–Њ–ї–µ—Ж–Є—Б—В–Є—В, —Е–Њ–ї–µ–і–Њ—Е–Њ–ї–Є—В–Є–∞–Ј, –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–∞—П –ґ–µ–ї—В—Г—Е–∞, —Е–Њ–ї–∞–љ–≥–Є—В. –Ю–њ—А–µ–і–µ–ї–µ–љ—Л –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї —В—А–∞–љ—Б—А–µ–Ї—В–∞–ї—М–љ–Њ–є –ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є–Є, —Е–Њ–ї–µ—Ж–Є—Б—В—Н–Ї—В–Њ–Љ–Є–Є, —Е–Њ–ї–µ–і–Њ—Е–Њ–ї–Є—В–Њ—В–Њ–Љ–Є–Є, —Е–Њ–ї–µ–і–Њ—Е–Њ—Б–Ї–Њ–њ–Є–Є, –і—А–µ–љ–Є—А–Њ–≤–∞–љ–Є—О —Е–Њ–ї–µ–і–Њ—Е–∞ –њ–Њ –Т–Є—И–љ–µ–≤—Б–Ї–Њ–Љ—Г. –Т–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ –љ–∞—З–∞—В–Њ –Є–Ј –Љ–Є–љ–Є-–і–Њ—Б—В—Г–њ–∞ –≤ —Б–≤—П–Ј–Є —Б —В–µ—Е–љ–Є—З–µ—Б–Ї–Є–Љ–Є —В—А—Г–і–љ–Њ—Б—В—П–Љ–Є, —А–∞–Ј—А–µ–Ј –њ–µ—А–µ–і–љ–µ–є –±—А—О—И–љ–Њ–є —Б—В–µ–љ–Ї–Є –њ—А–Њ–і–ї–µ–љ –Ї–љ–Є–Ј—Г. –Я–Њ—Б–ї–µ –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П —Е–Њ–ї–µ—Ж–Є—Б—В—Н–Ї—В–Њ–Љ–Є–Є, —Е–Њ–ї–µ–і–Њ—Е–Њ–ї–Є—В–Њ—В–Њ–Љ–Є–Є, –і—А–µ–љ–Є—А–Њ–≤–∞–љ–Є—П —Е–Њ–ї–µ–і–Њ—Е–∞, –≤—Л–≤–µ–і–µ–љ–Є—П –і—А–µ–љ–∞–ґ–µ–є —З–µ—А–µ–Ј –њ—А–Њ–Ї–Њ–ї—Л –±—А—О—И–љ–Њ–є —Б—В–µ–љ–Ї–Є –љ–∞ –Ф–Я–Ъ —Г–ї–Њ–ґ–µ–љ–∞ –Љ–µ–Љ–±—А–∞–љ–∞ –Ъ–Њ–ї–У–Р–†–Р 10—Е15 —Б–Љ (—А–Є—Б. 5) –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —Б–њ–∞–µ–Ї –≤ –Њ–±–ї–∞—Б—В–Є –Њ–њ–µ—А–∞—Ж–Є–Є, –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —Б—А–∞—Й–µ–љ–Є–є –Љ–µ–ґ–і—Г –ї–Њ–ґ–µ–Љ –ґ–µ–ї—З–љ–Њ–≥–Њ –њ—Г–Ј—Л—А—П –Є –Ф–Я–Ъ, –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є –Ф–Я–Ъ. –Ь–µ–Љ–±—А–∞–љ–∞ –љ–µ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–∞—Б—М, —Г–Ї–ї–∞–і—Л–≤–∞–ї–∞—Б—М –љ–∞ –Ф–Я–Ъ —Б–Љ–Њ—З–µ–љ–љ—Л–Љ–Є –≤ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–Љ–Є –Є —В—Г–њ—Д–µ—А–Њ–Љ. –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –Ј–∞—В—А–∞—В—Л –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є —Б–Њ—Б—В–∞–≤–Є–ї–Є 20вАУ30 —Б. –Я–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л–є –њ–µ—А–Є–Њ–і –њ—А–Њ—В–µ–Ї–∞–ї –±–µ–Ј –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ вДЦ 3
–Ю–њ–µ—А–Є—А—Г—О—Й–Є–є —Е–Є—А—Г—А–≥: –Р.–У. –°–∞—Г—В–Ї–Є–љ (–Ь–С–£–Ч –У–Ъ–С вДЦ 6, I —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –Њ—В–і–µ–ї–µ–љ–Є–µ, –≥. –І–µ–ї—П–±–Є–љ—Б–Ї).
–Я–∞—Ж–Є–µ–љ—В–Ї–∞ –•., 60 –ї–µ—В, –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ —Б –±–Њ–ї–µ–≤—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –≤ –њ—А–∞–≤–Њ–Љ –њ–Њ–і—А–µ–±–µ—А—М–µ. –Я–Њ –і–∞–љ–љ—Л–Љ –£–Ч–Ш, –Љ—Г–ї—М—В–Є—Б–њ–µ–Ї—В—А–∞–ї—М–љ–Њ–є –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є вАУ –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ –љ–∞ —А–∞–Ї –ґ–µ–ї—З–љ–Њ–≥–Њ –њ—Г–Ј—Л—А—П. –Ю–њ—А–µ–і–µ–ї–µ–љ—Л –љ–µ–Њ—В–ї–Њ–ґ–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О. –Т–Њ –≤—А–µ–Љ—П –Њ–њ–µ—А–∞—Ж–Є–Є: –Њ—Б—В—А—Л–є —Е–Њ–ї–µ—Ж–Є—Б—В–Є—В –≤ –њ–ї–Њ—В–љ–Њ–Љ –Є–љ—Д–Є–ї—М—В—А–∞—В–µ, –Є–љ—Д–Є–ї—М—В—А–Є—А–Њ–≤–∞–љ–∞ –≥–µ–њ–∞—В–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–∞—П —Б–≤—П–Ј–Ї–∞. –Ш–љ—Д–Є–ї—М—В—А–∞—В —А–∞–Ј–і–µ–ї–µ–љ, –≤—Л–њ–Њ–ї–љ–µ–љ—Л —Е–Њ–ї–µ—Ж–Є—Б—В—Н–Ї—В–Њ–Љ–Є—П, —Е–Њ–ї–µ–і–Њ—Е–Њ–ї–Є—В–Њ—В–Њ–Љ–Є—П, —Е–Њ–ї–µ–і–Њ—Е–Њ—Б–Ї–Њ–њ–Є—П, –і—А–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ —Е–Њ–ї–µ–і–Њ—Е–∞ –њ–Њ –Т–Є—И–љ–µ–≤—Б–Ї–Њ–Љ—Г. –° —Г—З–µ—В–Њ–Љ –љ–∞–ї–Є—З–Є—П –њ–ї–Њ—В–љ–Њ–≥–Њ –Є–љ—Д–Є–ї—М—В—А–∞—В–∞, –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —Б–њ–∞–µ–Ї –љ–∞ –Ф–Я–Ъ, –љ–∞ –≥–µ–њ–∞—В–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ—Г—О —Б–≤—П–Ј–Ї—Г —Г–ї–Њ–ґ–µ–љ–∞ –Љ–µ–Љ–±—А–∞–љ–∞ –Ъ–Њ–ї–У–Р–†–Р, –Ї–Њ—В–Њ—А–∞—П –љ–µ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–∞—Б—М, –љ–µ —Б–Љ–µ—Й–∞–ї–∞—Б—М (—А–Є—Б. 6). –Ф–∞–љ–љ–∞—П –Љ–∞–љ–Є–њ—Г–ї—П—Ж–Є—П –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –±–µ–Ј –Ї–∞–Ї–Є—Е-–ї–Є–±–Њ —В–µ—Е–љ–Є—З–µ—Б–Ї–Є—Е —В—А—Г–і–љ–Њ—Б—В–µ–є –≤ —В–µ—З–µ–љ–Є–µ 40 —Б.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ вДЦ 4
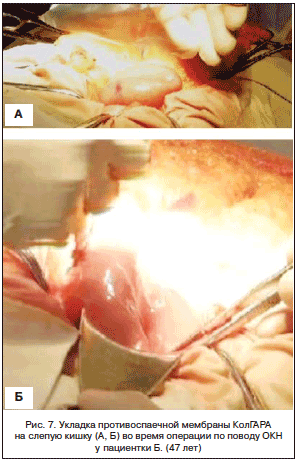
–Ю–њ–µ—А–Є—А—Г—О—Й–Є–є —Е–Є—А—Г—А–≥: –Р.–Э. –Ь–∞–ї—Л–≥–Є–љ (–Ь–С–£–Ч –У–Ъ–С вДЦ 6, I —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –Њ—В–і–µ–ї–µ–љ–Є–µ, –≥. –І–µ–ї—П–±–Є–љ—Б–Ї).
–Я–∞—Ж–Є–µ–љ—В–Ї–∞ –С., 47 –ї–µ—В. –Я–Њ—Б—В—Г–њ–Є–ї–∞ –≤ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –Њ—В–і–µ–ї–µ–љ–Є–µ —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ: –Ю–Ъ–Э. –Т –∞–љ–∞–Љ–љ–µ–Ј–µ: –Љ–љ–Њ–≥–Њ –ї–µ—В –љ–∞–Ј–∞–і –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –∞–њ–њ–µ–љ–і—Н–Ї—В–Њ–Љ–Є—П. –Т —В–µ—З–µ–љ–Є–µ —Б—Г—В–Њ–Ї –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ—Л–µ –Љ–µ—А–Њ–њ—А–Є—П—В–Є—П –±–µ–Ј —Н—Д—Д–µ–Ї—В–∞. –Ю–њ—А–µ–і–µ–ї–µ–љ—Л –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О —З–µ—А–µ–Ј –ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є—З–µ—Б–Ї–Є–є –і–Њ—Б—В—Г–њ. –Ш–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ: —Б–њ–∞–є–Ї–Є –≤ –њ—А–∞–≤–Њ–є –њ–Њ–і–≤–Ј–і–Њ—И–љ–Њ–є –Њ–±–ї–∞—Б—В–Є, —Б—В–∞–≤—И–Є–µ –њ—А–Є—З–Є–љ–Њ–є –Ю–Ъ–Э. –°–њ–∞–є–Ї–Є —А–∞—Б—Б–µ—З–µ–љ—Л, –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В—М –Ї–Є—И–Ї–Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞. –Э–∞ —Б–ї–µ–њ—Г—О –Ї–Є—И–Ї—Г —Г–ї–Њ–ґ–µ–љ–∞ –Љ–µ–Љ–±—А–∞–љ–∞ –Ъ–Њ–ї–У–Р–†–Р 10—Е15 —Б–Љ –і–ї—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —Б–њ–∞–µ–Ї. –Ь–µ–Љ–±—А–∞–љ–∞ –љ–µ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–∞—Б—М (—А–Є—Б. 7). –Т –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –љ–µ –±—Л–ї–Њ. –Я–∞—А–µ–Ј –Ї–Є—И–µ—З–љ–Є–Ї–∞ —А–∞–Ј—А–µ—И–Є–ї—Б—П –љ–∞ 3-–Є —Б—Г—В.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ вДЦ 5
–Ю–њ–µ—А–Є—А—Г—О—Й–Є–є —Е–Є—А—Г—А–≥: –Т.–Я. –Р–Ї–Є–Љ–Њ–≤ (–У–С–Ю–£ –Т–Я–Ю ¬Ђ–°–µ–≤–µ—А–Њ-–Ч–∞–њ–∞–і–љ—Л–є –≥–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ—Л–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–є —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В –Є–Љ. –Ь–µ—З–љ–Є–Ї–Њ–≤–∞¬ї –Ь–Ч –†–§, –≥. –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥).
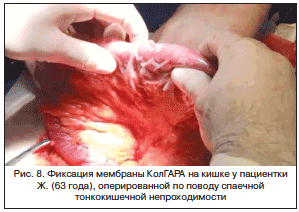
–Я–∞—Ж–Є–µ–љ—В–Ї–∞ –Ц., 63 –≥–Њ–і–∞, –њ–Њ—Б—В—Г–њ–Є–ї–∞ –≤ —Н–Ї—Б—В—А–µ–љ–љ–Њ–Љ –њ–Њ—А—П–і–Ї–µ —Б –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ: —Б–њ–∞–µ—З–љ–∞—П —В–Њ–љ–Ї–Њ–Ї–Є—И–µ—З–љ–∞—П –љ–µ–њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В—М. –Т –∞–љ–∞–Љ–љ–µ–Ј–µ: –≤ 2008 –≥. вАУ —А–µ–Ј–µ–Ї—Ж–Є—П —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є –њ–Њ –њ–Њ–≤–Њ–і—Г —Г—Й–µ–Љ–ї–µ–љ–љ–Њ–є –њ–∞—Е–Њ–≤–Њ–є –≥—А—Л–ґ–Є. –Ю–њ–µ—А–Є—А–Њ–≤–∞–љ–∞ –њ–Њ—Б–ї–µ –њ–Њ–њ—Л—В–Ї–Є –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П: –≤—Л–њ–Њ–ї–љ–µ–љ—Л –ї–∞–њ–∞—А–Њ—В–Њ–Љ–Є—П, –∞–і–≥–µ–Ј–Є–Њ–ї–Є–Ј–Є—Б, –љ–∞–Ј–Њ–≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ–∞—П –Є–љ—В—Г–±–∞—Ж–Є—П. –Я—А–Њ–≤–µ–і–µ–љ–∞ –Є–Љ–њ–ї–∞–љ—В–∞—Ж–Є—П 2 –њ–ї–∞—Б—В–Є–љ –њ—А–Њ—В–Є–≤–Њ—Б–њ–∞–µ—З–љ–Њ–≥–Њ –±–∞—А—М–µ—А–∞ –Ъ–Њ–ї–У–Р–†–Р (—А–Є—Б. 8) –њ–Њ—Б–ї–µ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б–Љ–∞—З–Є–≤–∞–љ–Є—П —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ вДЦ 6
–Ю–њ–µ—А–Є—А—Г—О—Й–Є–є —Е–Є—А—Г—А–≥: –Р.–Э. –Р–ї–µ—И–Є–љ (–У–£–Ч ¬Ђ–У–Њ—А–Њ–і—Б–Ї–∞—П –±–Њ–ї—М–љ–Є—Ж–∞ вДЦ 9¬ї, –≥. –Ґ—Г–ї–∞).
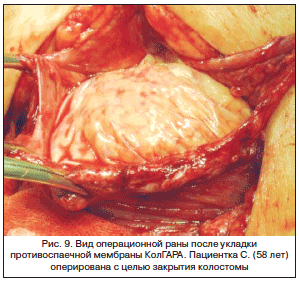
–Я–∞—Ж–Є–µ–љ—В–Ї–∞ C., 58 –ї–µ—В. –У–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П вАУ –≤–љ—Г—В—А–Є–±—А—О—И–љ–Њ–≥–Њ –Ј–∞–Ї—А—Л—В–Є—П –і–≤—Г—Б—В–≤–Њ–ї—М–љ–Њ–є –Ї–Њ–ї–Њ—Б—В–Њ–Љ—Л. –Т –∞–љ–∞–Љ–љ–µ–Ј–µ: –Њ–њ–µ—А–∞—Ж–Є—П –њ–Њ –њ–Њ–≤–Њ–і—Г –њ–µ—А—Д–Њ—А–∞—Ж–Є–Є –і–Є–≤–µ—А—В–Є–Ї—Г–ї–∞ —Б–Є–≥–Љ–Њ–≤–Є–і–љ–Њ–є –Ї–Є—И–Ї–Є, –і–Є—Д—Д—Г–Ј–љ–Њ–≥–Њ —А–∞–Ј–ї–Є—В–Њ–≥–Њ –њ–µ—А–Є—В–Њ–љ–Є—В–∞. –Э–∞–ї–Њ–ґ–µ–љ–∞ –і–≤—Г—Б—В–≤–Њ–ї—М–љ–∞—П —Б–Є–≥–Љ–Њ—Б—В–Њ–Љ–∞. –Т—Л–њ–Њ–ї–љ–µ–љ–∞ –Њ–њ–µ—А–∞—Ж–Є—П: –Ј–∞–Ї—А—Л—В–Є–µ –Ї–Њ–ї–Њ—Б—В–Њ–Љ—Л, –њ–Њ–≥—А—Г–ґ–µ–љ–Є–µ —Б–Є–≥–Љ–Њ–≤–Є–і–љ–Њ–є –Ї–Є—И–Ї–Є –≤ –±—А—О—И–љ—Г—О –њ–Њ–ї–Њ—Б—В—М. –Ш–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ: –Љ–∞—Б—Б–Є–≤–љ—Л–µ —Б–њ–∞–є–Ї–Є –≤–Њ–Ї—А—Г–≥ –Ї–Њ–ї–Њ—Б—В–Њ–Љ—Л. –° —Ж–µ–ї—М—О –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —Б–њ–∞–µ—З–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –њ–Њ—Б–ї–µ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ —Н—В–∞–њ–∞ –Њ–њ–µ—А–∞—Ж–Є–Є –≤ –Њ–±–ї–∞—Б—В–Є –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ —Г–ї–Њ–ґ–µ–љ–∞ –њ—А–Њ—В–Є–≤–Њ—Б–њ–∞–µ—З–љ–∞—П –Љ–µ–Љ–±—А–∞–љ–∞ –Ъ–Њ–ї–У–Р–†–Р (—А–Є—Б. 9).
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ вДЦ 7
–Ю–њ–µ—А–Є—А—Г—О—Й–Є–є —Е–Є—А—Г—А–≥: –°.–Т. –†—Л–±–љ–Є–Ї–Њ–≤. –Р—Б—Б–Є—Б—В–µ–љ—В: –Х.–Р. –Ь–∞–ї–Є–љ–Њ–≤—Б–Ї–∞—П (–У–С–£–Ч –Ъ–Ю ¬Ђ–Ю–Ъ–Я–¶ –Є–Љ. –Ы.–Р. –†–µ—И–µ—В–Њ–≤–Њ–є¬ї, –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Њ—В–і–µ–ї–µ–љ–Є–µ, –≥. –Ъ–µ–Љ–µ—А–Њ–≤–Њ).
–Я–∞—Ж–Є–µ–љ—В–Ї–∞ –£., 30 –ї–µ—В. –Т —В–µ—З–µ–љ–Є–µ 11 –ї–µ—В —Б—В—А–∞–і–∞–ї–∞ –±–µ—Б–њ–ї–Њ–і–Є–µ–Љ –њ—А–Є —А–µ–≥—Г–ї—П—А–љ–Њ–є –њ–Њ–ї–Њ–≤–Њ–є –ґ–Є–Ј–љ–Є –≤ –±—А–∞–Ї–µ –±–µ–Ј –Ї–Њ–љ—В—А–∞—Ж–µ–њ—Ж–Є–Є. –Я–Њ—Б–ї–µ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ—Б—В—Г–њ–Є–ї–∞ –≤ –Њ—В–і–µ–ї–µ–љ–Є–µ –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –ї–∞–њ–∞—А–Њ—Б–Ї–Њ–њ–Є–Є, –≥–Є—Б—В–µ—А–Њ—Б–Ї–Њ–њ–Є–Є. –Т—Л–њ–Њ–ї–љ–µ–љ—Л –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ –Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ: –ї–∞–њ–∞—А–Њ—Б–Ї–Њ–њ–Є—П, –і–≤—Г—Е—Б—В–Њ—А–Њ–љ–љ–Є–є —Б–∞–ї—М–њ–Є–љ–≥–Њ–Њ–≤–∞—А–Є–Њ–ї–Є–Ј–Є—Б, —Г—В–µ—А–Њ–ї–Є–Ј–Є—Б, –і–≤—Г—Е—Б—В–Њ—А–Њ–љ–љ—П—П —Б–∞–ї—М–њ–Є–љ–≥–Њ—Б—В–Њ–Љ–Є—П, —Е—А–Њ–Љ–Њ—В—Г–±–∞—Ж–Є—П. –Т—Л—П–≤–ї–µ–љ —Б–њ–∞–µ—З–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б IIIвАУIV —Б—В–∞–і–Є–Є –≤ –њ–Њ–ї–Њ—Б—В–Є –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞. –Э–∞ –Ј–∞–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ–Љ —Н—В–∞–њ–µ –Њ–њ–µ—А–∞—Ж–Є–Є –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –Љ–∞—В–Њ—З–љ—Л—Е —В—А—Г–± —А–∞–Ј–Љ–µ—Й–µ–љ–∞ –њ—А–Њ—В–Є–≤–Њ—Б–њ–∞–µ—З–љ–∞—П –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤–∞—П –Љ–µ–Љ–±—А–∞–љ–∞ –Ъ–Њ–ї–У–Р–†–Р 9—Е9 —Б–Љ (—А–Є—Б. 10). –Я—А–Њ–≤–µ–і–µ–љ–∞ —Д–Є–Ї—Б–∞—Ж–Є—П –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤–Њ–≥–Њ –±–∞—А—М–µ—А–∞ –Ї –Љ–∞—В–Њ—З–љ—Л–Љ —В—А—Г–±–∞–Љ —И–≤–∞–Љ–Є —Б –Є–љ—В—А–∞–Ї–Њ—А–њ–Њ—А–∞–ї—М–љ—Л–Љ –љ–∞–ї–Њ–ґ–µ–љ–Є–µ–Љ —Г–Ј–ї–Њ–≤.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ вДЦ 8
–Ю–њ–µ—А–Є—А—Г—О—Й–Є–є —Е–Є—А—Г—А–≥: –Э.–Х. –°–Љ–Є—А–љ–Њ–≤–∞ (–У–С–£–Ч –Р–Ю –Р–Ю–Ф–Ъ–С –Ф–•–Ю, –≥. –С–ї–∞–≥–Њ–≤–µ—Й–µ–љ—Б–Ї).
–Я–∞—Ж–Є–µ–љ—В –Ф., 15 –ї–µ—В. –У–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –ї–∞–њ–∞—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–є –±–Є–Њ–њ—Б–Є–Є —Б–µ–ї–µ–Ј–µ–љ–Ї–Є –Є –њ–µ—З–µ–љ–Є –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ –≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –±–Є–Њ–њ—В–∞—В–∞ —Б —Ж–µ–ї—М—О –Є—Б–Ї–ї—О—З–µ–љ–Є—П –±–Њ–ї–µ–Ј–љ–Є –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П. –Т—Л–њ–Њ–ї–љ–µ–љ–Њ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–µ –њ–Њ—Б–Њ–±–Є–µ: –ї–∞–њ–∞—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–∞—П –±–Є–Њ–њ—Б–Є—П –њ–µ—З–µ–љ–Є –Є —Б–µ–ї–µ–Ј–µ–љ–Ї–Є. –Т —Б–≤—П–Ј–Є —Б –љ–Є–Ј–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ —Г –њ–∞—Ж–Є–µ–љ—В–∞ (99—Е109/–ї –Ј–∞ —Б—З–µ—В —П–≤–ї–µ–љ–Є—П –≥–Є–њ–µ—А—Б–њ–ї–µ–љ–Є–Ј–Љ–∞), —Б–њ–ї–µ–љ–Њ–Љ–µ–≥–∞–ї–Є–µ–є —Б –љ–∞–ї–Є—З–Є–µ–Љ —А–∞—Б—И–Є—А–µ–љ–љ—Л—Е —Б—В—А–Њ–Љ–∞–ї—М–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤, –љ–µ—Г—Б—В–Њ–є—З–Є–≤—Л–Љ –Є–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л–Љ –≥–µ–Љ–Њ—Б—В–∞–Ј–Њ–Љ –≤ –Ј–Њ–љ–µ –±–Є–Њ–њ—Б–Є–Є —Б–µ–ї–µ–Ј–µ–љ–Ї–Є –Є–Љ–µ–ї—Б—П –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–њ–∞–µ—З–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –Ф–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —Б–њ–∞–µ–Ї –Ј–Њ–љ–∞ –±–Є–Њ–њ—Б–Є–Є —Б–µ–ї–µ–Ј–µ–љ–Ї–Є –±—Л–ї–∞ —Г–Ї—А—Л—В–∞ –Љ–µ–Љ–±—А–∞–љ–Њ–є –Ъ–Њ–ї–У–Р–†–Р (—А–Є—Б. 11). –Ь–µ–Љ–±—А–∞–љ–∞ –љ–µ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–ї–∞—Б—М —И–≤–∞–Љ–Є. –° —Ж–µ–ї—М—О –Ї–Њ–љ—В—А–Њ–ї—П –≥–µ–Љ–Њ—Б—В–∞–Ј–∞ –≤ –ї–µ–≤—Л–є –±–Њ–Ї–Њ–≤–Њ–є –Ї–∞–љ–∞–ї –љ–∞ 1-–µ —Б—Г—В —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –і—А–µ–љ–∞–ґ. –Э–∞ 3-–Є —Б—Г—В –њ–∞—Ж–Є–µ–љ—В –≤—Л–њ–Є—Б–∞–љ –і–Њ–Љ–Њ–є –±–µ–Ј –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Б–ї—Г—З–∞–є вДЦ 9
–Ю–њ–µ—А–Є—А—Г—О—Й–Є–є —Е–Є—А—Г—А–≥: –Ф.–Ь. –І—Г–њ–Ї–Њ (–Ф–•–Ю –Ъ–Ъ–Ъ–¶–Ю–Ь–Ф, –і–µ—В—Б–Ї–Њ–µ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –Њ—В–і–µ–ї–µ–љ–Є–µ, –≥. –Ъ—А–∞—Б–љ–Њ—П—А—Б–Ї).
–Я–∞—Ж–Є–µ–љ—В –Ь., 1 –≥–Њ–і. –Т –њ–µ—А–Є–Њ–і–µ –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ—Б—В–Є –Њ–њ–µ—А–Є—А–Њ–≤–∞–љ –њ–Њ –њ–Њ–≤–Њ–і—Г –∞—В—А–µ–Ј–Є–Є –њ—А—П–Љ–Њ–є –Ї–Є—И–Ї–Є: –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –њ—А–Њ–Љ–µ–ґ–љ–Њ—Б—В–љ–∞—П –њ—А–Њ–Ї—В–Њ–њ–ї–∞—Б—В–Є–Ї–∞. –Ч–∞–ґ–Є–≤–ї–µ–љ–Є–µ —А–∞–љ—Л вАУ –≤—В–Њ—А–Є—З–љ—Л–Љ –љ–∞—В—П–ґ–µ–љ–Є–µ–Љ. –Т –Њ–±–ї–∞—Б—В–Є –Њ–њ–µ—А–∞—Ж–Є–Є –≤ –њ—А–Њ–Љ–µ–ґ–љ–Њ—Б—В–Є —А–∞–Ј–≤–Є–ї—Б—П —А—Г–±—Ж–Њ–≤—Л–є —Б—В–µ–љ–Њ–Ј. –С–µ—Б–њ–Њ–Ї–Њ—П—В –і–ї–Є—В–µ–ї—М–љ—Л–µ –Ј–∞–њ–Њ—А—Л. –Т—Л–њ–Њ–ї–љ–µ–љ–∞ –Њ–њ–µ—А–∞—Ж–Є—П: –±—А—О—И–љ–Њ-–њ—А–Њ–Љ–µ–ґ–љ–Њ—Б—В–љ–∞—П –њ—А–Њ–Ї—В–Њ–њ–ї–∞—Б—В–Є–Ї–∞ —Б –Є—Б—Б–µ—З–µ–љ–Є–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ —А—Г–±—Ж–∞ –∞–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–∞–љ–∞–ї–∞ –Є –њ—А—П–Љ–Њ–є –Ї–Є—И–Ї–Є —Б –ї–∞–њ–∞—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–є –∞—Б—Б–Є—Б—В–µ–љ—Ж–Є–µ–є –њ–Њ Georgeson вАУ Swenson. –Ю–њ–µ—А–∞—Ж–Є—П –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М –≤ 2 —Н—В–∞–њ–∞:
1. –С—А—О—И–љ–Њ–є —Н—В–∞–њ. –Я–Њ–і —Н–љ–і–Њ—В—А–∞—Е–µ–∞–ї—М–љ—Л–Љ –љ–∞—А–Ї–Њ–Ј–Њ–Љ –њ–Њ—Б–ї–µ –Њ–±—А–∞–±–Њ—В–Ї–Є –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–Њ–ї—П —А–∞—Б—В–≤–Њ—А–Њ–Љ –∞–љ—В–Є—Б–µ–њ—В–Є–Ї–∞ –≤ –Њ–±–ї–∞—Б—В–Є –љ–∞–і –њ—Г–њ–Ї–Њ–Љ –њ—Г—В–µ–Љ –њ—Г–љ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П —В—А–Њ–∞–Ї–∞—А–∞ (4 –Љ–Љ) –љ–∞–ї–Њ–ґ–µ–љ –њ–љ–µ–≤–Љ–Њ–њ–µ—А–Є—В–Њ–љ–µ—Г–Љ, –≤ –±—А—О—И–љ—Г—О –њ–Њ–ї–Њ—Б—В—М –≤–≤–µ–і–µ–љ–∞ –≤–Є–і–µ–Њ—Б–Є—Б—В–µ–Љ–∞. –Т –њ—А–∞–≤–Њ–Љ –Є –ї–µ–≤–Њ–Љ –Њ—В–і–µ–ї–∞—Е –ґ–Є–≤–Њ—В–∞ –љ–∞ —Г—А–Њ–≤–љ–µ –њ—Г–њ–Ї–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л 2 –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е —В—А–Њ–∞–Ї–∞—А–∞ –њ–Њ 3 –Љ–Љ –і–ї—П –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–≤. –Я—А–Є —А–µ–≤–Є–Ј–Є–Є –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –≤—Л—П–≤–ї–µ–љ—Л —Б–њ–∞–µ—З–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –≤ –Њ–±–ї–∞—Б—В–Є –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞, —А–∞–Ј–і–µ–ї–µ–љ–Є–µ —Б–њ–∞–µ–Ї, –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Б—В–µ–љ–Њ—В–Є—З–µ—Б–Ї–Њ–µ —А–∞—Б—И–Є—А–µ–љ–Є–µ —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є —Б –њ–ї–Њ—В–љ—Л–Љ–Є –±–µ–ї–µ—Б–Њ–≤–∞—В–Њ–≥–Њ —Ж–≤–µ—В–∞ —Б—В–µ–љ–Ї–∞–Љ–Є. –Т—Л–њ–Њ–ї–љ–µ–љ–∞ –Љ–Њ–±–Є–ї–Є–Ј–∞—Ж–Є—П —Б–Є–≥–Љ–Њ–≤–Є–і–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є –і–Њ –њ—А—П–Љ–Њ–є –Ї–Є—И–Ї–Є.
2. –Я—А–Њ–Љ–µ–ґ–љ–Њ—Б—В–љ—Л–є —Н—В–∞–њ. –Т—Л—А–∞–ґ–µ–љ–љ—Л–µ –≥—А—Г–±—Л–µ —А—Г–±—Ж–Њ–≤—Л–µ —Ж–Є—А–Ї—Г–ї—П—А–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ–±–ї–∞—Б—В–Є –∞–љ–∞–ї—М–љ–Њ–≥–Њ –Њ—В–≤–µ—А—Б—В–Є—П, –∞–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–∞–љ–∞–ї–∞, –њ—А—П–Љ–Њ–є –Ї–Є—И–Ї–Є –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –і–Њ 5 —Б–Љ. –° –±–Њ–ї—М—И–Є–Љ–Є —В–µ—Е–љ–Є—З–µ—Б–Ї–Є–Љ–Є —В—А—Г–і–љ–Њ—Б—В—П–Љ–Є –њ—А–Њ–≤–µ–і–µ–љ–Њ –Є—Б—Б–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ —А—Г–±—Ж–∞. –І–µ—А–µ–Ј –Ј–∞–і–љ–µ–њ—А–Њ—Е–Њ–і–љ–Њ–µ –Њ—В–≤–µ—А—Б—В–Є–µ –њ—А–Њ–≤–µ–і–µ–љ—Л –љ–Є–Ј–≤–µ–і–µ–љ–Є–µ –Є —Н–≤–∞–≥–Є–љ–∞—Ж–Є—П –і–Є—Б—В–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–Њ–≤ —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є –љ–∞—А—Г–ґ—Г —Б —А–µ–Ј–µ–Ї—Ж–Є–µ–є —А–∞—Б—И–Є—А–µ–љ–љ–Њ–≥–Њ —А–µ–Ї—В–Њ—Б–Є–≥–Љ–Њ–Є–і–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ —Б –љ–∞–ї–Њ–ґ–µ–љ–Є–µ–Љ –Њ—В–і–µ–ї—М–љ—Л—Е —Д–Є–Ї—Б–Є—А—Г—О—Й–Є—Е —И–≤–Њ–≤ –љ–∞ —Б–µ—А–Њ–Ј–љ–Њ-–Љ—Л—И–µ—З–љ—Л–є —Б–ї–Њ–є –љ–Є–Ј–≤–µ–і–µ–љ–љ–Њ–є –Ї–Є—И–Ї–Є –Є –Њ–±–Њ—А–∞—З–Є–≤–∞–љ–Є–µ–Љ –љ–Є–Ј–≤–µ–і–µ–љ–љ–Њ–≥–Њ —Г—З–∞—Б—В–Ї–∞ —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є –њ—А–Њ—В–Є–≤–Њ—Б–њ–∞–µ—З–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ–Њ–є –Ъ–Њ–ї–У–Р–†–Р (—А–Є—Б. 12), —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –∞–љ–∞–ї—М–љ–Њ–є —А–Њ–Ј–µ—В–Ї–Є.
–У–µ–Љ–Њ—Б—В–∞–Ј –њ–Њ —Е–Њ–і—Г –Њ–њ–µ—А–∞—Ж–Є–Є. –°–∞–љ–∞—Ж–Є—П –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є, —А–∞—Б–њ—А–∞–≤–ї–µ–љ–Є–µ –њ—А–Њ—В–Є–≤–Њ—Б–њ–∞–µ—З–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л –Ъ–Њ–ї–У–Р–†–Р –≤ –Њ–±–ї–∞—Б—В–Є –њ–µ—А–µ—Е–Њ–і–љ–Њ–є —Б–Ї–ї–∞–і–Ї–Є (—А–Є—Б. 13). –£–і–∞–ї–µ–љ–Є–µ –Є–Ј –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–≤ –Є –≥–∞–Ј–∞. –Р—Б–µ–њ—В–Є—З–µ—Б–Ї–Є–µ –њ–Њ–≤—П–Ј–Ї–Є –љ–∞ –Њ–±–ї–∞—Б—В—М –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е —А–∞–љ.
–Т –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –љ–∞–±–ї—О–і–µ–љ–Є—П—Е –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є—П—Е (–≤ —В. —З. —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є—Е) –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е —В–µ—Е–љ–Є—З–µ—Б–Ї–Є—Е —Б–ї–Њ–ґ–љ–Њ—Б—В–µ–є –Њ–±—А–∞—Й–µ–љ–Є—П —Б –њ—А–Њ—В–Є–≤–Њ—Б–њ–∞–µ—З–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ–Њ–є –Ъ–Њ–ї–У–Р–†–Р, –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –µ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ. –Ь–µ–Љ–±—А–∞–љ–∞ –Ъ–Њ–ї–У–Р–†–Р –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–∞ –і–ї—П –Њ–і–љ–Њ—А–∞–Ј–Њ–≤–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Є –љ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–Њ–≤—В–Њ—А–љ–Њ —Б—В–µ—А–Є–ї–Є–Ј–Њ–≤–∞–љ–∞. –Х–µ –љ–µ —Б–ї–µ–і—Г–µ—В –њ–Њ–Љ–µ—Й–∞—В—М –≤ –ї–Є–љ–Є—О —И–≤–∞ –њ—А–Є –Ј–∞—И–Є–≤–∞–љ–Є–Є –Ї—А–∞–µ–≤ –Ї–Њ–ґ–љ–Њ–є —А–∞–љ—Л –≤–Њ –Є–Ј–±–µ–ґ–∞–љ–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П –њ—А–Њ—Ж–µ—Б—Б–∞ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П, –љ–µ–ї—М–Ј—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –Ї–Њ–ї–ї–∞–≥–µ–љ—Г. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–µ–Љ–±—А–∞–љ—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П–Љ–Є –љ–µ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Њ, –Њ–і–љ–∞–Ї–Њ –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ, —Б –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ–Љ —З–Є—Б–ї–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –љ–∞–±–ї—О–і–µ–љ–Є–є, –њ–Њ—В—А–µ–±—Г–µ—В —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Љ–µ–Љ–±—А–∞–љ—Л –Ъ–Њ–ї–У–Р–†–Р –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–љ—В–Є–∞–і–≥–µ–Ј–Є–≤–љ–Њ–≥–Њ —Б—А–µ–і—Б—В–≤–∞ –њ–Њ–Ї–∞–Ј–∞–ї –µ–µ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Є–љ—В—А–∞–∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є—П—Е. –Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –њ—А–Њ—В–Є–≤–Њ—Б–њ–∞–µ—З–љ–Њ–≥–Њ –±–∞—А—М–µ—А–∞ –Ъ–Њ–ї–У–Р–†–Р —П–≤–ї—П—О—В—Б—П:
- —Г–і–Њ–±—Б—В–≤–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –±–∞—А—М–µ—А–∞, —А–∞–Ј–і–µ–ї—П—О—Й–µ–≥–Њ —Б–Њ–њ—А–Є–Ї–∞—Б–∞—О—Й–Є–µ—Б—П –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Њ–≤ –Є —В–Ї–∞–љ–µ–є –љ–∞ —Г—З–∞—Б—В–Ї–∞—Е –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Є –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞, –≥–і–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —А–∞–Ј–≤–Є—В–Є–µ —Б–њ–∞–µ—З–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞;
- –њ—А–Њ–њ–Є—В—Л–≤–∞–љ–Є–µ –Љ–µ–Љ–±—А–∞–љ—Л —Н–Ї—Б—Б—Г–і–∞—В–Њ–Љ, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —З–µ–≥–Њ –Њ–љ–∞ –ї–µ–≥–Ї–Њ –∞–і–∞–њ—В–Є—А—Г–µ—В—Б—П –Ї —Д–Њ—А–Љ–µ –Њ—А–≥–∞–љ–∞ –Є–ї–Є –Њ–±–ї–∞—Б—В–Є, –≥–і–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П;
- —А–∞—Б—Б–∞—Б—Л–≤–∞–љ–Є–µ –±–∞—А—М–µ—А–∞ —Б —В–µ—З–µ–љ–Є–µ–Љ –≤—А–µ–Љ–µ–љ–Є, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є —Г–і–∞–ї—П—В—М –Љ–µ–Љ–±—А–∞–љ—Г;
- –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ї–∞–Ї –њ—А–Є –Њ—В–Ї—А—Л—В—Л—Е, —В–∞–Ї –Є –њ—А–Є –ї–∞–њ–∞—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є—Е —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞—Е;
- –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–њ–∞–µ–Ї –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–є –љ–∞ –ґ–µ–ї—З–љ—Л—Е –њ—Г—В—П—Е, –ґ–µ–ї—Г–і–Ї–µ –Є –Ф–Я–Ъ, —В–Њ–љ–Ї–Њ–є –Є —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–∞—Е;
- –Њ—В—Б—Г—В—Б—В–≤–Є–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є —Д–Є–Ї—Б–∞—Ж–Є–Є —И–Њ–≤–љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ –Є–ї–Є —Б—В–µ–њ–ї–µ—А–Њ–Љ, –ї–µ–≥–Ї–∞—П —Д–Є–Ї—Б–∞—Ж–Є—П –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–≤, —Б–Љ–Њ—З–µ–љ–љ—Л—Е —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ;
- –≤—А–µ–Љ—П –Є–љ—В—А–∞–∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є —Г–Ї–ї–∞–і–Ї–Є –Љ–µ–Љ–±—А–∞–љ—Л –њ—А–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —Е–Є—А—Г—А–≥–Є–Є вАУ –Њ—В 1 –і–Њ 3 –Љ–Є–љ;
- –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ, –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –Љ–Њ—В–Њ—А–љ–Њ-—Н–≤–∞–Ї—Г–∞—В–Њ—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞ –≤ —Б—В–∞–љ–і–∞—А—В–љ—Л–µ —Б—А–Њ–Ї–Є –љ–∞ 3-–Є —Б—Г—В.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–Њ—В–Є–≤–Њ—Б–њ–∞–µ—З–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л –љ–∞ –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤–Њ–є –Њ—Б–љ–Њ–≤–µ вАУ —В–µ—Е–љ–Є—З–µ—Б–Ї–Є –љ–µ—Б–ї–Њ–ґ–љ—Л–є —Б–њ–Њ—Б–Њ–± –Є–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–њ–∞–µ—З–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є, –Ї–Њ—В–Њ—А—Л–є –Љ–Њ–ґ–µ—В –±—Л—В—М —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ –њ—А–Є —А–∞–Ј–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞—Е –љ–∞ –Њ—А–≥–∞–љ–∞—Е –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Є –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞.
–Ю—В–і–∞–ї–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–Њ—В–Є–≤–Њ—Б–њ–∞–µ—З–љ—Л—Е –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤—Л—Е –±–∞—А—М–µ—А–Њ–≤ –µ—Й–µ –њ—А–µ–і—Б—В–Њ–Є—В –Њ—Ж–µ–љ–Є—В—М. –Ю–і–љ–∞–Ї–Њ —Б–µ–≥–Њ–і–љ—П —Г–ґ–µ –µ—Б—В—М –Њ—Б–љ–Њ–≤–∞–љ–Є—П —Б—З–Є—В–∞—В—М –њ–µ—А–≤—Л–є –Њ–њ—Л—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л –≤ –њ–Њ–ї–Њ—Б—В–љ–Њ–є —Е–Є—А—Г—А–≥–Є–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ –Є —Г–±–µ–і–Є—В—М—Б—П –≤ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –µ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Б —Ж–µ–ї—М—О –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Б–њ–∞–µ—З–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є.