Успех лечения хронического и/или хронически рецидивирующего заболевания (ХРЗ), в т.ч. онкологической природы, зависит от того, на какой стадии выявлены характерные признаки патологии. Выявление признаков патологии на доклинической стадии позволит применять превентивные методы лечения и с большой вероятностью приведет к предотвращению развития патологии в тот период, когда комплекс ключевых патологических сдвигов является еще обратимым. Ведь не секрет, что традиционный осмотр тканевых участков в белом свете не позволяет выявлять патологический процесс на ранних стадиях, поэтому приветствуются приемы, позволяющие видеть масштабнее, глубже и точнее.
К числу таких методов принадлежат эндоскопия высокого разрешения и способы, улучшающие качество визуализации очага, такие как осмотр в узком спектре светового потока (режим NBI (Narrow Band Imaging)), осмотр в режиме компьютерной обработки изображения (FICE (Fuji Intelligent Cromo Endoscopy)), который имитирует осмотр в узком спектре светового потока с разными длинами волн.
Не менее успешно в практике применяется аутофлуоресценция, задача которой – выявление патологических очагов путем использования природных свойств эндогенных флуорофоров поглощать видимый свет. Благодаря аутофлуоресцентной эндоскопии становится возможным:
1) видеть тонкие различия в толщине слизистой оболочки и фиксировать динамику концентраций гемоглобина;
2) отслеживать процесс распределения и накопления флуорофора в ткани;
3) давать оценку особенностям микроокружения пораженного участка, что способствует более точному определению его границ.
Метод успешно оптимизирован для раннего выявления рака легких, желудка и толстой кишки, однако полученной в ходе использования данной технологии информации не всегда достаточно для верификации конечного диагноза.
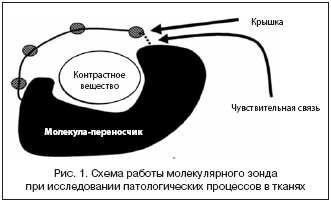
Намного более специфичным и информативным для протеомных (белковых) каскадов, которые часто составляют ключевой объект исследования, является метод молекулярной визуализации, базовые инструменты которого – молекулярные зонды.
Молекулярная визуализация
как технологическая платформа
эндоскопии
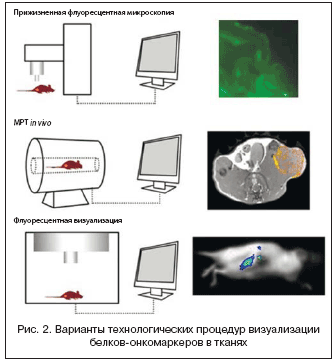
Ранняя диагностика рака – это ключ к его эффективному лечению. На поверхности раковой клетки в процессе развития опухоли экспрессируется большое количество белков (опухолево-специфические мембрано-ассоциированные антигены (МААГ)). Именно они наиболее информативны, поскольку позволяют выявить заболевание на той стадии, когда последующее и своевременное лечение все еще максимально эффективно (рис. 2).
Молекулярная визуализация как технологическая платформа способна к выявлению и отражению в естественных условиях большинства происходящих в клетках и тканях биологических процессов на клеточном и/или субклеточном уровнях в зависимости от участка, куда осуществляется доставка экспрессируемых опухолевыми клетками белков (онкопротеинов). Идея метода заключается в следующем: доставленный к исследуемому органу (адресно/таргетно) молекулярный зонд связывается с интересующим нас белком, специфичным для пораженного участка ткани (например, МААГ), а флуоресцентная метка позволяет визуализировать место локализации этого белка и, соответственно, сам пораженный участок.
Непростой задачей является конструирование самого зонда, специфичного к конкретному белку. Эта задача имеет разные способы решения в зависимости от типа зонда. В идеале молекулярный зонд должен удовлетворять следующим требованиям:
– быть высокоспецифичным в отношении биологической мишени, подавать оптический сигнал только при наличии заболевания и иметь интенсивность оптического сигнала на поверхности патологического очага выше, чем от микроокружения;
– обладать быстрой кинетикой связывания (в минутах);
– иметь возможность связывания с флуоресцентным агентом с большой выборкой цветов;
– иметь приемлемую рыночную цену.
В настоящее время можно выделить следующие основные типы платформ молекулярных зондов:
1. Антитела (АТ) – это γ-глобулины (IgG), высокоспецифичные к конкретным антигенам (АГ) – мишеням, их можно пометить большим количеством флуоресцентных красителей. АТ разработаны для ряда особых молекулярных мишеней, таких как рецептор человеческого эпидермального фактора роста 2-го типа (HER2), рецептор эпидермального фактора роста (EGFR) и др.
Недостатками вышеуказанной платформы являются:
– иммуногенность – непрогнозируемые риски развития иммунных реакций, в особенности при повторном использовании;
– длительный период полураспада;
– дороговизна производства.
К данной группе можно отнести также аффитела (аffibodies) – молекулы, имитирующие природные АТ и представляющие однодоменные белки. Их преимуществами в сравнении с антителами являются меньшие размеры, что позволяет осуществлять оперативное проникновение зонда и, соответственно, проводить быструю локализацию патологического процесса; более быстрая очистка ткани от остатков применяемых зондов-конструкций. Применимость зондов на основе аффител показана на опытах in vivo при обнаружении опухолей, продуцирующих избыточное количество HER2.
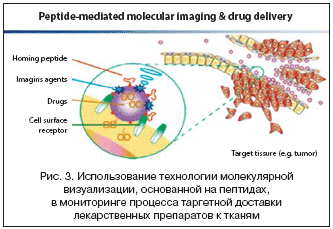
2. Пептиды – это короткие цепочки аминокислот, которые успешно отбираются в рамках задач современной биотехнологии, в т.ч. при конструировании полипептидных библиотек. Процесс отбора специфичных (по связыванию) пептидов – задача сложная. Хотя способность пептидных фрагментов прикрепляться к мишеням, как правило, ограничена (по сравнению с АТ), пептиды намного меньше в размерах, их проще пометить при помощи флуоресцентного красителя, у них более управляемая кинетика связывания и минимальная иммуногенность (рис. 3).
3. Аптамеры – это олигонуклеотид, способный специфически связываться с молекулой-мишенью, отобранный в результате многократных циклов ПЦР-синтеза случайных последовательностей нуклеотидов с последующей селекцией тех фрагментов, которые имеют наибольшее сродство к мишени. При работе с аптамерами в емкость с анализируемым белком помещаются случайные нуклеотидные последовательности (фрагменты ДНК), а затем тот фрагмент, с которым данный белок связался, подвергается селекции. Отобранные таким образом по принципу аффинности фрагменты ДНК многократно амплифицируются, причем на каждом этапе отбираются только те фрагменты, которые связываются с белком наиболее прочно. И так до тех пор, пока не будет выявлен фрагмент ДНК, который связывается с целевым белком с максимальной степенью аффинности. Такой фрагмент и используется в качестве аптамерной платформы для молекулярного зонда. В настоящее время такая конструкция разработана с высокой степенью специфичности в отношении клеток колоректального рака линий DLD-1 и HCT116, однако ее эффективность продемонстрирована пока лишь в лабораторных условиях.
В сравнении с антителами аптамеры, как и пептиды, имеют малые размеры, что способствует быстрому проникновению к целевым клеткам и их маркировке, а также быстрому выведению из нецелевых тканей, соответственно более контрастной маркировке патологического очага. На основе аптамерной платформы возможно создание активируемых зондов, которые генерируют флуоресценцию только после вхождения в контакт с мишенью. Активируемые зонды – это «умные» зонды, лишенные способности светиться в свободном состоянии, но способные к генерации флуоресценции после вступления в контакт с целевой клеткой. Применение активируемых зондов позволит уменьшить время проведения исследования, т.к. нет необходимости ждать выведение молекулярного зонда из нецелевых тканей. Значительно повысится контрастность изображения, т.к. окрашиваться будут только целевые клетки. Из недостатков следует отметить сложность в производстве и высокую стоимость данных зондов.
Молекулярные зонды и методы
молекулярной визуализации
в клинической онкодиагностике
Как сказано выше, молекулярные зонды специфичны к определенным категориям белков, в т.ч. опухолево-ассоциированным. Поскольку канцерогенез – многошаговый процесс, результатом которого является множество мутаций и альтераций, изучая клинические образцы, можно выявлять ключевые гены (генотипирование) и соответствующие им последовательности белков (фенотипирование), которые играют важную роль в процессах канцерогенеза. Переведя эту категорию белков в разряд потенциальных мишеней для молекулярных зондов, можно визуализировать малейшие изменения, происходящие в тканях пациента на самых разных стадиях того или иного типового патологического процесса (рис. 4).
Следует при этом заметить, что амплификация генов (для справки: амплификация – процесс образования дополнительных копий) играет существенную роль в прогрессировании многих типов опухолей, результатом чего является повышенная экспрессия и самих белков, и кодирующих эти белки мРНК. Факт амплификации может быть установлен методом ПЦР или методом скрининга на мононуклеотидные полиморфизмы (SNP1).
Перспективы молекулярной
визуализации и эндоскопии с точки зрения предиктивно-превентивной
и персонифицированной медицины
Среди разнообразия микробиочипов биочипы, в частности на основе ДНК, могут быть использованы для определения наличия несбалансированной экспрессии генов, например при раке пищевода. В свою очередь белки, соответствующие этим сверхэкспрессируемым (overexpressed) генам, могут быть определены по имеющимся базам данных. Далее белки могут быть отобраны в качестве мишеней и идентифицированы на поверхности клеток методами молекулярной визуализации.
Современной медицине необходимы новые, усовершенствованные, высокоинформативные, более надежные и прогрессивные методы визуализации. То есть методы того поколения, которое может быть использовано как для выявления заболевания на ранней стадии, так и для непосредственного лечения, применяемые в качестве инструментов предиктивно-превентивной и персонифицированной медицины (ПППМ). В этом плане меченные молекулярные зонды позволяют определять точную локализацию и даже границы патологического процесса на самых ранних (в т.ч. доклинических) стадиях развития. А выявляемый на таких стадиях типовой патологический процесс дает врачу-клиницисту реальную возможность провести своевременное и эффективное лечение, следуя принципам терапевтической фармакопревенции, с одной стороны, подавляя процесс в самом начале его развития, с другой, и гарантируя пациенту эффективную профилактику и мониторинг с последующим ободряющим пациента прогнозом.
Вполне естественно и закономерно, что в сфере ПППМ молекулярные зонды получат также широкое применение, позволив проводить высокоинформативную визуализацию интересующих врача-диагноста патологических мишеней у конкретных пациентов с конкретным диагнозом заболевания и на конкретной стадии, включая стадию доклинической диагностики. Такого рода терапия будет назначаться в соответствии с локализацией визуализированных границ опухоли. Станет возможным и профилактическое отслеживание рецидивов.
В области реконструктивно-пластической микрохирургии методы молекулярной визуализации позволят наблюдать динамику восстановления пациента в раннем и позднем послеоперационных периодах.
Во время любого оперативного вмешательства возможно инфицирование. В этом плане молекулярная визуализация облегчает лечащему врачу задачу своевременной идентификации очага воспаления (в т.ч. скрытого), что отвечает задачам ПППМ.
Не подлежит сомнению, что молекулярная визуализация относится к категории инновационных технологий, существенно расширяющих границы традиционной эндоскопии, т.к. помогает врачу-диагносту видеть скрытые патоморфологические сдвиги в пределах весьма конкретных участков тканей. Вооружая технологические платформы разрабатываемого метода адекватными для поставленных целей и задач молекулярными зондами (например, пептидными), нацеленными на идентификацию специализированных клеточных рецепторов, врач получает доступ к уникальным возможностям эндоскопии будущего. В качестве примера следует упомянуть о возможности высокоинформативных протоколов скрининга уникальных паттернов экспрессии онкопротеинов, дающих врачу бесценную диагностическую и прогностическую информацию о наличии в организме подозреваемого лица или лица из группы риска доклинических признаков рака или признаков, иллюстрирующих стадию латенции инфекционного воспаления с явной угрозой хронизации.
Метод молекулярной визуализации применим сегодня лишь при использовании высокоспециализированных моделей эндоскопов. Открытым остается вопрос о возможности реализации этого метода при использовании капсульной эндоскопии.
Возможности молекулярной визуализации как инновационной оптической технологии не ограничены известными мишенями: такого рода технология может в перспективе применяться и в работе с серией новых молекулярных и клеточных мишеней по мере их идентификации и характеристики в структурах генома и протеома. Молекулярная визуализация позволит исследователям и врачам более точно определять риски возникновения ракового заболевания у каждого конкретного пациента, обосновывать постановку доклинического диагноза заболевания и вести разработку курсов не только традиционной, но и превентивной терапии. Фундамент последней, кстати, и составит данные не только гистологической каноники, но и геномных и протеомных исследований, требуемых в рамках принципов и задач ПППМ.
Уже сейчас эндоскопия является мощным инструментом визуализации полых органов. Так, новейшие микросканеры, позволяющие выстраивать трехмерное изображение исследуемого органа, в сочетании с методами аутофлуоресцентной эндоскопии позволяют визуализировать патологические очаги, невидимые врачу при традиционном оптическом исследовании, дают мощный толчок новому направлению эндоскопии – молекулярной визуализации. В силу того, что природные свойства тканей таят в себе огромный объем информации, молекулярные модели изображения клеток и тканей в естественных условиях позволят выделять локализацию очага, предоставляя врачу информацию об индивидуальной тактике лечения конкретного пациента с конкретной формой патологии на конкретной стадии заболевания. Очевидно, что будущее эндоскопии стоит за персонализированным подходом к диагностике и лечению в рамках программ по управлению собственным здоровьем, т.е., по сути, в рамках нового и перспективного направления в структуре здравоохранения – ПППМ.
1 SNP/single-nucleotide polymorphism – вариабельность в последовательности ДНК отдельных нуклеотидов, являющихся для каждого индивидуума уникальными









.gif)



