В настоящее время в медицине получила широкое распространение концепция «сердечно–сосудистого континуума», впервые высказанная V. Dzau и E. Braunwald в 1991 г. Сердечно–сосудистый континуум представляет собой непрерывную цепь взаимосвязанных изменений в сердечно–сосудистой системе – от воздействия факторов риска через постепенное возникновение и прогрессирование ССЗ до развития терминального поражения сердца и смертельного исхода [3–5]. Так, согласно результатам исследований, проведенных в ГНИЦ профилактической медицины, ССЗ и факторы риска, их обусловливающие, в изолированном виде встречаются только в 10–15% случаев. Среди пациентов, страдающих артериальной гипертонией (АГ), 15% имеют ее сочетание с нарушением липидного обмена или ожирением, тогда как сочетание трех и более факторов риска встречается у 64% пациентов [4].
Стоит вспомнить, что еще А.Л. Мясников в 1965 г. в монографии «Гипертоническая болезнь и атеросклероз» писал: «Гипертоническая болезнь, атеросклероз и связанная с ними коронарная недостаточность – вот суровая триада болезней, в наибольшей мере поражающая современное человечество».
Среди нейрогуморальных факторов, определяющих развитие и прогрессирование ССЗ и формирование сердечно–сосудистого континуума, одна из центральных ролей принадлежит активации ренин–ангиотензин–альдостероновой системы (РААС), которая прослеживается практически на всех этапах сердечно–сосудистого континуума [6–8].
Слово «ренин» прозвучало впервые в Москве в августе 1897 г. в Большом театре на XII Международном конгрессе врачей в докладе «Niere und Kreislauf» («Почка и кровообращение») из уст профессора Стокгольмского Каролинского университета Роберта Тигерштедта. Р. Тигерштедт совместно со студентом (Per Gustav Bergman) установил, что внутривенное введение кролику водного экстракта коркового слоя почки сильно повышает давление крови. Авторы заключили, что почка вырабатывает суживающий сосуды белок, и назвали его «ренин». Это оказалось первой ступенью исследований РААС, хотя сам ренин был выделен и идентифицирован гораздо позже.
В 1934 г. Harry Goldblatt с сотрудниками наблюдал повышение артериального давления (АД) у собак после пережатия почечной артерии, этот эффект связали с активацией выработки ренина. В 1935 г., практически одновременно, поисками ренина занялись 2 исследовательские группы: Page, Helmer и Kohlstaedt в Индианаполисе (США) и Braun–Menendez, Fasciola и Leloir в Буэнос–Айресе (Аргентина). К 1939 г. и те и другие показали, что сам по себе выделяемый почками ренин вазопрессорной активностью не обладает, а является субстратом для выработки истинно гипертензивной субстанции. Выделяемое почками вещество оказалось ферментом, запускающим каскад реакций, приводящих к появлению вазоактивного октапептида (цепочки из 8 аминокислот). Это вещество ученые из США обозначили как angiotonin, аргентинские исследователи назвали его hypertensin. В 1958 г. октапептид получил знакомое нам гибридное название «ангиотензин II», была сформулирована концепция о функционировании РААС.
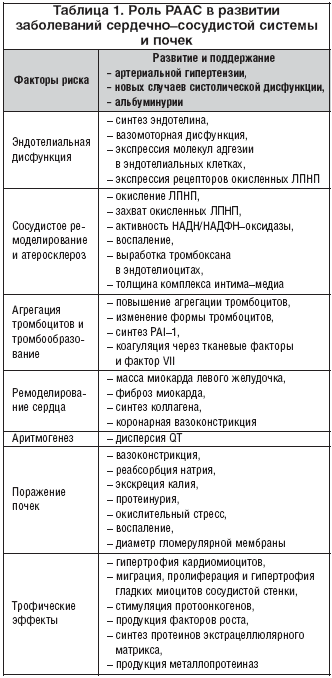
Согласно современным представлениям, РААС представляет собой уникальную регуляторную систему, в которой активный эффектор ангиотензин II вырабатывается в межклеточном пространстве путем последовательного протеолитического расщепления его предшественников. Роль РААС в развитии заболеваний сердечно–сосудистой системы и почек отражена в таблице 1.
Предшественником ангиотензина II является ангиотензиноген – биологически инертный глобулин, синтезируемый в основном в печени [9]. Концентрация ангиотензина в крови практически стабильна. Ренин, представляющий собой кислую протеазу, выделяется в кровь юкстагломерулярным аппаратом почек в виде прогормона – проренина, на долю которого приходится до 70–90% всего иммунореактивного ренина в плазме крови. Недавно описаны рецепторы проренина, их роль уточняется. Ренин может также выделяться некоторыми другими тканями (мозгом, сердцем, сосудами). Он воздействует на ангиотензин и отщепляет от него несколько концевых фрагментов, что приводит к образованию ангиотензина I или ангиотензинов (1–10). Именно этот процесс является скорость–лимитирующим во всем каскаде образования активных метаболитов РААС. Ангиотензин I обладает биологической активностью и может действовать как вазоконстриктор. Ангиотензинпревращающий фермент представляет собой экзопептидазу, локализованную на мембранах различных клеток (эндотелиальных, эпителиоцитов проксимальных почечных канальцев, нейроэпителиоцитов) и в некотором количестве – в плазме крови. Ангиотензинпревращающий фермент отщепляет от ангиотензина I концевой дипептид, конвертируя ангиотензин I в ангиотензин II или ангиотензин (1–8) – главный эффектор РААС. Кроме того, ангиотензинпревращающий фермент метаболизирует брадикинин и калликреин до неактивных метаболитов [10]. Под воздействием эндопептидаз, найденных в мозге и почках, из ангиотензина II образуются ангиотензин III и ангиотензин IV. Последний, вероятно, действует в мозге совместно с ангиотензином II и способствует повышению АД [11].
Общепризнано, что большинство физиологических эффектов ангиотензина II опосредуются через стимуляцию рецепторов AT1, в частности, такие эффекты, как вазоконстрикция и повышение АД; реабсорбция натрия в почечных канальцах и кишечнике; стимуляция синтеза альдостерона; ремоделирование сосудистой стенки и миокарда (пролиферация и миграция клеток гладкой мускулатуры, гиперплазия интимы, гипертрофия и фиброз миокарда); активация симпатико–адреналовой системы (центральная на пресинаптическом уровне и периферическая в надпочечниках); повышение чувствительности барорецепторов; высвобождение аргинина и вазопрессина; задержка воды в организме; усиление гликогенолиза и глюконеогенеза; высвобождение ренина; вазоконстрикция приносящих, и в еще большей степени выносящих, артериол почечных клубочков, сокращение мезангиальных клеток и снижение почечного кровотока.
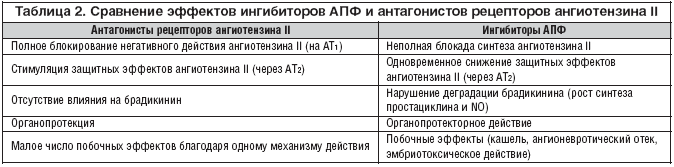
Эффекты ангиотензина II в организме можно нивелировать двумя путями: изменить его синтез (например, применением ингибиторов АПФ) или блокировать его эффекты, которые осуществляются за счет связывания ангиотензина II с широко распространенными в организме специфическими мембранными рецепторами: тип 1 (АТ1–рецепторы) и тип 2 (АТ2–рецепторы), каждый из которых регулирует в клетках разнонаправленные процессы. В настоящее время для эффективного противодействия негативным влияниям РААС используются три группы препаратов: ингибиторы АПФ, блокаторы рецепторов к ангиотензину II и альдостероновые антагонисты. При этом многими кардиологами и клиническими фармакологами, исходя из особенностей клинико–фармакологической характеристики и оптимального профиля безопасности, отдается несомненное предпочтение сартанам (табл. 2) [1–5].
Первым блокатором рецепторов ангиотензина II был синтезированный в 1969 г. саралазин – пептидное соединение, близкое по структуре к ангиотензину II [D. Pals и соавт.]. Саралазин блокировал прессорное действие ангиотензина II и понижал тонус периферических сосудов, уменьшал содержание альдостерона в плазме, снижал АД. Однако к середине 1970–х гг. опыт применения саралазина показал, что он обладает свойствами частичного агониста и в ряде случаев дает плохо прогнозируемый эффект (в виде чрезмерной гипотензии или гипертензии). При этом хороший гипотензивный эффект проявлялся при состояниях, сопряженных с высоким уровнем ренина, тогда как на фоне низкого уровня ангиотензина II или при быстрой инъекции АД повышалось. В связи с наличием агонистических свойств, а также ввиду сложности синтеза и необходимости парентерального введения широкого практического применения саралазин не получил.
В начале 1990–х гг. был синтезирован первый непептидный селективный антагонист рецепторов ангиотензина II, эффективный при приеме внутрь – лозартан, получивший практическое применение в качестве антигипертензивного средства. В дальнейшем были созданы другие непептидные антагонисты рецепторов ангиотензина II – валсартан (Нортиван), ирбесартан, кандесартан, телмисартан и эпросартан. В настоящее время группа антагонистов рецепторов ангиотензина II представлена несколькими подгруппами, различающимися по химической структуре (табл. 3). При этом лозартан и кандесартан являются пролекарствами и действуют через свои активные метаболиты, образующиеся после превращения в печени, остальные препараты являются непосредственно активными формами.
Клиническая фармакокинетика и фармакодинамика. Нортиван конкурентно блокирует рецепторы ангиотензина II (подтип АТ1), расположенные в сосудах, сердце, почках, мозге, легких и коре надпочечников; подавляет все опосредованные через АТ1–рецепторы эффекты ангиотензина II, в том числе вазоконстрикцию и секрецию альдостерона. Уменьшает гипертрофию миокарда у больных АГ. Не влияет на содержание общего холестерина, триглицеридов, глюкозы и мочевой кислоты. Антигипертензивный эффект развивается в течение 2 ч после приема однократной дозы, достигает максимума через 4–6 ч и продолжается до 24 ч. При регулярном применении стойкое снижение АД наступает через 2–4 нед. Быстро всасывается из ЖКТ. Биодоступность составляет 10–35% (в среднем – 25%). Cmax достигается через 2–4 ч. Прием пищи уменьшает AUC на 40% и Cmax на 50% без изменения эффективности. Связывание с белками плазмы (в основном с альбумином) – 94–97%. Объем распределения – 17 л. Небольшая часть (20%) биотрансформируется с образованием неактивного метаболита (валерил 4–гидрокси–валсартан), а основная – экскретируется в неизмененном виде преимущественно с фекалиями (70%) и мочой (30%). Т1/2 – около 9 ч. AUC и Cmax увеличиваются у пациентов пожилого возраста (старше 65 лет) на 70 и 35% соответственно.
Клиническая эффективность. Данные многоцентровых клинических исследований, организованных с соблюдением всех методологических принципов доказательной медицины, а также отдельные небольшие исследования показали высокую эффективность валсартана при АГ, хронической сердечной недостаточности (ХСН), почечной патологии и некоторых других заболеваниях, ассоциированных с негативным воздействием РААС [12–14].
Антигипертензивная эффективность. Несомненно, что основным гемодинамическим эффектом Нортивана является вазодилатация и, следовательно, снижение АД. Снижение АД при применении Нортивана не сопровождается увеличением частоты сердечных сокращений (ЧСС). Нортиван проявляет гипотензивный эффект при приеме 1 раз/сут. и обеспечивает контроль АД на протяжении 24 ч.
Выраженный антигипертензивный эффект валсартана F.H. Messerly [15] объясняет по меньшей мере 7 механизмами: ингибированием прямого вазоконстрикторного действия ангиотензина II; снижением активности симпатической нервной системы; уменьшением канальцевой реабсорбции натрия; снижением выработки альдостерона; снижением активности РААС в мозгу; стимуляцией синтеза простациклина; антипролиферативным действием (обратное развитие ремоделированных сосудов).
Результаты ряда метаанализов показывают высокую антигипертензивную активность валсартана, вполне сравнимую с активностью других антигипертензивных препаратов, при этом валсартан снижает АД равномерно в течение суток [16]. Отмена препарата не вызывает развития рикошетной АГ, гипотония первой дозы также отсутствует. Антигипертензивный эффект становится очевидным в течение 2 нед. приема препарата, максимум действия наступает в срок от 3 до 6 нед. лечения. Препарат хорошо переносится пациентами пожилого возраста [17]. В недавно опубликованном метаанализе исследований по валсартану в сравнении с другими представителями класса антагонистов рецепторов ангиотензина II отмечено достоверное превосходство препарата в дозах 160 и 320 мг над лозартаном 100 мг по способности снижать систолическое АД (САД) и диастолическое АД (ДАД) при сопоставимом с действием остальных сартанов антигипертензивном эффекте [18].
Эффективность валсартана при изолированной систолической АГ изучалась в исследовании Val–Syst в сравнении с амлодипином. В исследовании Val–Syst (The Efficacy and Safety of Valsartan Versus Amlodipine in Elderly Patients With Isolated Systolic Hypertension) изучались гипотензивная эффективность и переносимость валсартана и амлодипина у больных с изолированной систолической АГ. Из 421 пациента в возрасте от 60 до 80 лет 208 принимали валсартан и 213 – амлодипин. После 2 нед. приема плацебо больные рандомизировались для приема 80 мг валсартана или 5 мг амлодипина в сутки. Через 8 нед. при неэффективности доза препаратов удваивалась, еще через 8 нед. при необходимости добавлялся гидрохлоротиазид в дозе 12,5 мг/сут. После этого лечение продолжалось еще в течение 12 нед. По данным амбулаторного измерения в обеих группах регистрировалась одинаковая степень снижения АД. При этом в группе амлодипина регистрировалось больше нежелательных явлений, самым частым из которых было появление периферических отеков [19]. У 164 больных в данном исследовании для контроля эффективности терапии проводилось суточное мониторирование АД (у 79 – из группы валсартана и 85 – из группы амлодипина). Оба препарата достоверно и в равной степени снижали и дневное, и ночное АД. При терапии амлодипином отмечалось некоторое увеличение ЧСС, а при терапии валсартаном – снижение этого параметра. Среди 138 больных с хорошим ответом на гипотензивную терапию (респондеров) валсартан в большей степени, чем амлодипин, снижал АД в дневное время. Различия в эффективности препаратов в ночное время были менее значимы [20].
Более масштабные данные получены в ходе открытого многоцентрового рандомизированного испытания Val–MARC по оценке влияния снижения АД на концентрацию С–реактивного белка у 1668 больных с АГ II степени [21]. Применение валсартана в дозе 160–320 мг обеспечило снижение CАД и ДАД на 18 и 9 мм рт.ст. соответственно. Причем антигипертензивный эффект валсартана проявился, начиная с очень низких дозировок (20–40 мг/сут.), и возрастал по мере увеличения дозы. При этом снижение АД на фоне приема валсартана в дозировке 80–320 мг происходит с сохранением нормального суточного ритма.
Антигипертензивная активность валсартана также доказана в нескольких исследованиях, проведенных в РФ. Так, В.И. Подзолковым, В.А. Булатовым, А.В. Вигдорчиком [22] представлены результаты проспективного многоцентрового наблюдательного исследования антигипертензивной эффективности, переносимости и приверженности лечению валсартаном в качестве моно– или комбинированной терапии у курящих в сравнении с некурящими пациентами с АГ. В исследовании приняли участие 114 врачей из 81 медицинского учреждения России. В исследование были включены 650 пациентов, средний возраст которых составил 53,9±0,4 года. Оценка эффективности терапии проводилась по снижению САД и ДАД у курящих в сравнении с некурящими пациентами. Начальная доза валсартана составляла 80 мг 1 раз/сут. и могла быть увеличена по решению врача для достижения целевого уровня АД (максимальная суточная доза валсартана – 320 мг). Допускалось также назначение комбинации валсартана с гидрохлоротиазидом. Также мог быть добавлен амлодипин (5–10 мг) или любой другой антигипертензивный препарат. Было отмечено значимое снижение САД и ДАД в каждой группе между 1–м и 5–м визитами. Среднее снижение САД в группе курящих пациентов составило 37,5 мм рт.ст. (р<0,01), в группе некурящих пациентов – 37,6 мм рт.ст. (р<0,01). Среднее снижение ДАД в группе курящих пациентов составило 18,5 мм рт.ст. (р<0,01), в группе некурящих пациентов – 15,9 мм рт.ст. (р<0,01). При этом не было выявлено значимых различий динамики САД и ДАД между группами. Тем самым были продемонстрированы одинаковая антигипертензивная эффективность и безопасность валсартана в виде монотерапии и в составе комбинированной терапии у курящих в сравнении с некурящими пациентами с АГ.
Кардиопротективный эффект. Способность валсартана уменьшать выраженность гипертрофии левого желудочка (ЛЖ) при АГ доказана в ряде исследований [23,24]. Так, в сравнительном исследовании с амлодипином было отмечено, что при одинаковом снижении АД масса миокарда ЛЖ в группе валсартана достоверно уменьшалась на 16%, а в группе амлодипина – лишь на 1,2%, причем недостоверно [25].
В исследованиях Val–PREST и VALVACE показано, что терапия валсартаном уменьшает риск развития рестенозов и повторных вмешательств у пациентов, перенесших транслюминальную баллонную ангиопластику коронарных артерий [26,27].
В исследовании же VALIANT (Valsartan in Acute Myocardial Infarction Trial) изучено влияние валсартана на течение острого ИМ. Доказано, что монотерапия валсартаном в дозе 160 мг 2 раза/сут. оказалась такой же эффективной в лечении постинфарктных больных с дисфункцией ЛЖ и/или сердечной недостаточностью, как и монотерапия каптоприлом в дозе 50 мг 3 раза/сут., ценность применения которого в подобной ситуации была доказана ранее [28].
Валсартан также уменьшает риск развития новых случаев фибрилляции предсердий у пациентов с АГ и ХСН (исследование Val–HeFT) [29].
Валсартан стал первым сартаном, зарегистрированным для лечения больных с ХСН. Двойное слепое рандомизированное клиническое исследование Valsartan in Heart Failure Trial (Val–HeFT) было проведено на 5010 больных с ХСН II, III и IV функциональных классов (ФК) по классификации Нью–Йоркской кардиологической ассоциации (NYHA) в 300 центрах 16 стран. Больные получали рекомендуемую терапию, к которой [29,30] был добавлен либо валсартан в стартовой дозе 40–80 мг с последующим увеличением до 160 мг 2 раза/сут., либо плацебо. Валсартан значительно, с высокой статистической значимостью снижал комбинированный показатель общей смертности и заболеваемости у больных с ХСН (–13,3%, р=0,009). Еще более специфичным является снижение показателя госпитализации по причине ХСН (–27,5%, р< 0,001). Отмечено достоверное улучшение качества жизни больных (р=0,005). Препарат замедлял прогрессирование заболевания, что подтверждается значимым улучшением (р<0,001) ФК по классификации NYHA, рекомендованной к использованию Международным и Европейским обществами кардиологов для определения тяжести недостаточности кровообращения. Наиболее выраженные клинические эффекты отмечались в группе из 366 больных, не получавших по причине непереносимости иАПФ: смертность от всех причин была на 33,1% ниже по сравнению с группой плацебо.
Влияние на развитие цереброваскулярных событий. Длительно текущая АГ, ассоциированная с различными факторами риска, в свою очередь является фактором риска развития цереброваскулярных событий. Применение сартанов обладает доказанной эффективностью в профилактике цереброваскулярных событий. Так, при анализе когорты больных (лица пожилого возраста, страдающие АГ), включенных в исследование SCOPE, показано снижение частоты нефатальных инсультов при применении сартанов [31,32]. Снижение риска цереброваскулярных эпизодов при применении сартанов доказано также в исследовании MOSES [33], в которое были включены 1,5 тыс. больных с АГ с эпизодом цереброваскулярного события. При среднем сроке наблюдения около 2,5 года и одинаковом контроле за уровнем АД риск развития кардиоваскулярных событий оказался достоверно меньше у больных, получавших лечение сартанами.
Нефропротективное действие. К преимуществам сартанов относится также их доказанный нефропротективный эффект, важнейшим компонентом которого является антипротеинурическое действие, доказанное в исследовании ROADMAP (Randomized Olmesartan and Diabetes Microalbuminuria Prevention), целью которого была демонстрация способности сартанов увеличивать период, предшествующий появлению микроальбуминурии (МАУ) у больных СД 2–го типа. Первичной конечной точкой исследования была продолжительность периода, предшествующего появлению МАУ (показателем, по которой ее определяли, было соотношение альбумин/ креатинин мочи); почечные и сердечно–сосудистые исходы анализировали в виде вторичных конечных точек. Благоприятный нефропротективный эффект сартанов (использовался ольмесартан) значимо не зависел от исходных уровней АД, степени компенсации СД 2–го типа, исходного состояния функции почек [34].
Нефропротективное действие сартанов доказано также в исследованиях MARVAL и SMART. Так, в исследовании MARVAL (the MicroAlbuminuria Reduction with VALsartan) у 332 больных СД 2–го типа с МАУ изучалось влияние валсартана в дозе 80 мг в сравнении с амлодипином в дозе 5 мг на величину экскреции белка с мочой в течение 24 нед. [35]. В результате при одинаковом снижении АД в обеих группах уровень экскреции альбумина в группе валсартана снизился на 44%, а в группе амлодипина – лишь на 8%.Численность больных, достигших уровня нормоальбуминурии на фоне приема валсартана (29,9%), была достоверно выше таковой на фоне приема амлодипина (14,5%).
Антипротеинурическая эффективность валсартана при АГ и СД 2–го типа получила подтверждение и в японском открытом сравнительном исследовании SMART [36]. Было показано, что при одинаковой антигипертензивной эффективности отношение альбумин/ креатинин в моче в группе лечения валсартаном достоверно снизилось на 32%, а в группе лечения амлодипином – увеличилось на 18%. Доля пациентов, у которых отмечена ремиссия или регрессия МАУ, была достоверно больше в группе валсартана в сравнении с группой амлодипина.
Данные о влиянии различных дозировок валсартана на уровень протеинурии у пациентов с АГ и СД 2–го типа получены в исследовании DROP [37]. Пациентов рандомизировали в 3 группы, в которых валсартан назначался в одной из дозировок – 160, 320 или 640 мг/сут. Показано достоверное снижение уровня экскреции альбумина при применении препарата в дозе 160 мг на 36%, а в дозах 320 и 640 мг – на 44 и 48% соответственно. Доля пациентов, достигших нормальных значений уровня экскреции альбумина (<20 мкг/мин.), составила 12,4% в группе, получавшей 160 мг валсартана, 19,2% – дозу 320 мг и 24,3% – дозу 640 мг.
Метаболические эффекты. Доказанным является уменьшение заболеваемости СД у пациентов, получающих сартаны в качестве антигипертензивного средства или в комплексной терапии ХСН (исследование VALUE) [38]. В данное исследование были включены более 15 тыс. больных АГ в возрасте старше 50 лет с высоким сердечно–сосудистым риском, которым назначали лечение на основе либо валсартана, либо амлодипина. Обе схемы терапии были эффективны в снижении АД, хотя отмечалось несколько большее снижение в группе амлодипина с различием между группами 1,5/1,3 мм рт.ст. после 1 года лечения. При 5–летнем наблюдении частота развития основных сердечно–сосудистых событий (первичная конечная точка) составила 10,4% в группе амлодипина и 10,6% – в группе валсартана (различие недостоверно). Среди вторичных конечных точек в группе амлодипина было достоверно меньше случаев ИМ, отмечалась тенденция к уменьшению количества случаев фатальных и нефатальных нарушений мозгового кровообращения, в то время как благодаря применению валсартана уменьшилось количество госпитализаций в связи с развитием сердечной недостаточности. Дополнительные преимущества, которые были получены в исследовании VALUE с помощью схем терапии валсартаном и амлодипином, стали основой для создания комбинации этих двух высокоэффективных и хорошо переносимых препаратов в виде многоцелевой терапии.
Установлено, что при приеме валсартана улучшается чувствительность периферических тканей к глюкозе у пациентов с АГ [39]. Также в настоящее время показано, что сартаны обладают отчетливым гипоурикемическим эффектом. Валсартан стоит на 2–м месте по влиянию на уровень мочевой кислоты (80–160 мг/сут.). Важно, что урикозурический эффект сохраняется и при их сочетанном применении с мочегонными средствами, благодаря чему предупреждается вызываемое диуретиками повышение уровня мочевой кислоты в крови [40,41].
Еще одним свойством валсартана является благоприятное влияние на половую функцию у сексуально активных мужчин с АГ. По данным перекрестного исследования сексуальной функции у 94 мужчин в возрасте 40–49 лет с АГ с применением валсартана и карведилола в течение 4 мес., показано, что в группах, в которых применялись валсартан и карведилол, был достигнут одинаковый уровень контроля АД, но прием валсартана привел к увеличению показателя сексуальной активности на 33%, тогда как на фоне приема карведилола этот показатель снизился на 59% [42]. Благоприятный эффект валсартана на состояние сексуальной функции у лиц с АГ объяснялся улучшением эндотелиальной функции, блокированием ремоделирования микроциркуляторных сосудов в кавернозных телах, прямым вазодилатирующим эффектом.
Благоприятное влияние валсартана на сексуальную сферу жизни пациентов с АГ доказано также результатами российского исследования с включением 650 пациентов (средний возраст – 53,9 года). Изучение влияния терапии валсартаном в дозах 80–320 мг/сут. на сексуальную функцию проводили у 312 пациентов (мужчин и женщин) с использованием специальной анкеты. Через 12 нед. лечения уменьшилась доля пациентов без сексуальной активности – с 22 до 16% (р<0,05) и возросло число пациентов, удовлетворенных сексуальной жизнью, – с 11 до 25% (р<0,01) [43].
Показаниями к приему Нортивана являются АГ, ХСН (II–IV ФК по классификации NYHA) в составе комплексной терапии, повышение выживаемости пациентов с острым ИМ, осложненным левожелудочковой недостаточностью и/или систолической дисфункцией ЛЖ, при наличии стабильных показателей гемодинамики.
Самое главное преимущество Нортивана, ведущего препарата из группы сартанов, – это, несомненно, его уникальная переносимость. Противопоказания для приема Нортивана единичны: гиперчувствительность, беременность (категория действия на плод по FDA– D), кормление грудью. Редки и побочные эффекты. Сартаны значительно реже, чем другие классы антигипертензивных препаратов, вызывают гипотензию и коллаптоидные реакции. Нортиван не влияет на сердечный ритм, бронхиальную проходимость, эректильную функцию в отличие от β–адреноблокаторов. Для Нортивана не характерны возникающие при применении ингибиторов АПФ сухой кашель, ангионевротический отек, почечные осложнения. Редко могут возникать диарея, тошнота, абдоминальная боль, повышение активности печеночных трансаминаз, анемия и снижение гематокрита. Следует соблюдать осторожность при назначении данного препарата больным с дефицитом натрия и/или выраженным снижением объема циркулирующей крови, билатеральным стенозом почечных артерий или стенозом почечной артерии единственной почки (необходим контроль концентрации креатинина и азота мочевины в сыворотке), выраженным нарушением функции почек (клиренс креатинина менее 10 мл/мин.), тяжелым нарушением функции печени, билиарным циррозом, обструкцией желчевыводящих путей, при сопутствующем применении калийсберегающих диуретиков, препаратов калия или калийсодержащих добавок.
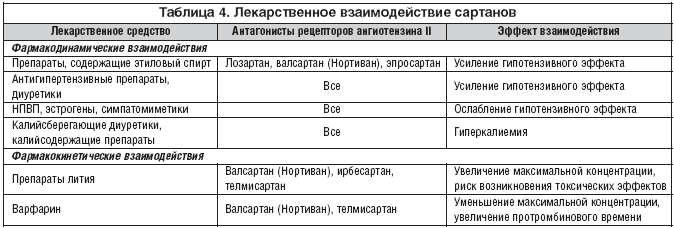
Лекарственное взаимодействие. Нортиван усиливает (взаимно) гипотензивный эффект диуретиков. Калийсберегающие диуретики, а также препараты, содержащие калий, повышают риск развития гиперкалиемии. Фармакокинетические взаимодействия наблюдаются с препаратами лития, варфарином, дигоксином (табл. 4).
Заключение. Таким образом, назначение Нортивана (валсартан, компания «Гедеон Рихтер») является залогом успешного лечения целого ряда ССЗ, учитывая уникальный спектр эффектов и хорошую переносимость данного препарата, а также патогенетически обоснованную необходимость фармакологической коррекции нарушений в ренин–ангиотензиновой системе. Назначение Нортивана снижает вероятность сердечно–сосудистых событий, улучшает качество жизни больных, является оптимальным с позиции стоимости и эффективности.

Литература
1. Белоусов Ю.Б. Клиническая эффективность и безопасность ирбесартана у больных мягкой и умеренной артериальной гипертонией. Результаты многоцентрового исследования // Кардиология. 2000. № 7. С. 4–8.
2. Оганов Р.Г., Масленникова Г.Я. Демографическая ситуация и сердечно–сосудистые заболевания в России: пути решения проблем // Кардиоваскулярная тер. и профилакт. 2007. № 6. (8). С. 7–14.
3. Шальнова С.А., Деев А.Д. Характеристика пациентов высокого риска. Результаты эпидемиологической части научно–образовательной программы ОСКАР // Кардиоваскулярная тер. и профилакт. 2006. № 6. С. 58–63.
4. Мамедов М.Н., Чепурина Н.А. Суммарный сердечно–сосудистый риск: от теории до практики. М.: Д–р Редди’с, 2008. С. 39.
5. Kannel W.B., Dawler T.R., Mac Gee D.L. Perspectives on systolic hypertension: the Framingham Study // Circulation. 1985. Vol. 61. P. 1179–1182.
6. Косарев В.В., Бабанов С.А., Вербовой А.Ф. Справочник клинического фармаколога. Ростов–на–Дону: Феникс, 2011. 478 с.
7. Крюков Н.Н., Качковский М.А. Справочник терапевта. Ростов–на–Дону: Феникс, 2011. 446 с.
8. Щукин Ю.В., Рябов А.Е. Хроническая ишемическая болезнь сердца в пожилом и старческом возрасте. Пособие для врачей. Самара: Волга – Бизнес, 2008. 44 с.
9. Кукес В.Г., Семенов А.В., Сычев Д.А. Проблемы взаимодействия лекарственных средств в кардиологической практике: антигипертензивные и гиполипидемические препараты // РМЖ. 2006. № 20. С. 1423–1428.
10. Илларионова Т.С., Стуров Н.В., Чельцов В.В. Препараты, применяемые для лечения гипертонической болезни // РМЖ. Т. 15. № 28. С. 2124–2130.
11. Оганов Р.Г., Масленникова Г.Я., Шальнова С.А., Деев А.Д. Значение сердечно–сосудистых и других неинфекционных заболеваний для здоровья населения России // Профилактика заболеваний и укрепление здоровья. 2002. № 2. С. 3–7.
12. Gansevoort R.T., de Zeeuw, Shahinfar S. et al. Effect of the angiotensin II antagonist losartan in hypertensive patients with renal disease // J Hypertens. 1994. Vol. 12. Р.37–42.
13. Lucius R., Galliant S., Busche S. et al. Beyond blood pressure: new roles for angiotensin II // Cell Mol Life Sci. 1999. Vol. 56. P. 1008–1019.
14. Dahlof B., Devereux R.B., Kjeldsen S. et al. for the LIFE Study group. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol // Lancet. 2002. Vol. 359. Р. 995–1003.
15. Messerly F.H. The ABCs of Antihypertensive Therapy. Second Edition. Lippincott Williams. 2000. P. 325.
16. Mann J., Julius S. The Valsartan Antihypertensive Long–term Use Evaluation trial of cardiovascular events in hypertension // Blood Press. 1998. Vol. 7. Р. 176–183.
17. Heran B.S., Wong M.M., Heran I.K. et al. Blood pressure lowering efficacy of angiotensin receptor blockers for primary hypertension (Review) // Cochrane Database Syst Rev. 2008. Vol. 8 (4). CD003822.
18. Viberti G., Wheeldon N.M. Microalbuminuria reduction with valsartan in patients with type 2 diabetes mellitus // Circulation. 2002. Vol. 6. Р. 672–678.
19. Malacco E., Vari N., Capuano V. et al. A randomized, double–blind, active–controlled, parallel–group comparison of valsartan and amlodipine in the treatment of isolated systolic hypertension in elderly patients: the Val–Syst study // Clin Ther. 2003. Vol. 25. Р. 2765–2780.
20. Palatini P., Mugellini A., Spagnuolo V. et al. Comparison of the effects on 24–h ambulatory blood pressure of valsartan and amlodipine, alone or in combination with a low–dose diuretic, in elderly patients with isolated systolic hypertension (Val–syst Study) // Blood Press Monit. 2004. Vol. 9. Р. 91–97.
21. Ridker P.M., Danielson E., Rifai N., Glynn R.J. for the Val–MARC Investigators. Valsartan, blood pressure reduction and C–reactive protein. Primary Report of the Val–MARC Trial // Hypertension. 2006. Vol. 48. Р. 1–7.
22. Подзолков В.И., Булатов В.А., Вигдорчик А.В. Антигипертензивная эффективность валсартана у курящих в сравнении с некурящими пациентами с артериальной гипертензией: первые результаты российского многоцентрового открытого исследования // РФК. 2010. № 1. С. 29–36.
23. Mutlu H., Ozhan H., Okcun B. et al. The Efficacy of Valsartan in Essential Hypertension and its Effects on Left Ventricular Hypertrophy // Blood Pressure. 2002. Vol. 11. 53–55.
24. Thurmann P.A., Kenedi P., Schmidt A. et al. Influence of the angiotensin II antagonist valsartan on left ventricular hypertrophy in patients with essential hypertension // Circulation. 1998. Vol. 98. Р. 2037–2042.
25. Yasunari et al. // JACC. 2004. Vol. 43. Р. 2116–2212.
26. Peters S., Gotting B., Trummel M. et al. Valsartan for prevention of restenosis after stenting of type B2/C lesions: the VAL–PREST trial // J Invasive Cardiol. 2001. Vol. 13. Р. 93–97.
27. Peters S., Trummel M., Meyners W. et al. Valsartan versus ACE inhibition after bare metal stent implantation–results of the VALVACE trial // Int J Cardiol. 2005. Vol. 98. Р. 331–335.
28. McMurray J., Solomon S., Pieper K. et al. The Effect of Valsartan, Captopril, or Both on Atherosclerotic Events After Acute Myocardial Infarction. An Analysis of the Valsartan in Acute Myocardial Infarction Trial (VALIANT) // J Am Coll Cardiol. 2006. Vol. 47. Р. 726–733.
29. Maggioni A.P., Latini R., Carson P.E. et al. Valsartan reduces the incidence of atrial fibrillation in patients with heart failure: results from the Valsartan Heart Failure Trial (Val–HeFT) // Am Heart J. 2005. Vol. 149. Р. 548–557.
30. Wong M., Staszewsky L., Latini R. et al. Valsartan benefits left ventricular structure and function in heart failure: Val–HeFT echocardiographic study // J Am Coll Cardiol. 2002. Vol. 40. 970–975.
31. Lithell H., Hansson L., Skoog I. et al. For the SCOPE Study Group. The Study on Cognition and Prognosis in the Elderly (SCOPE): principal results of a randomized double–blind intervention trial // Hypertension. 2003. Vol. 21. Р. 875–876.
32. Papademetriou V., Farsang C., Emlfeldt D. et al. SCOPE Study Group. Stroke prevention with the angiotensin II type 1–receptor blocker candesartan in elderly patients with isolated systolic hypertension: the Study on Cognition and Prognosis in the Elderly (SCOPE) // J Am Coll Cardiol. 2004. Vol. 44. Р. 1175–1180.
33. Kuppers H. Mortality and Morbidity after Stroke – Eprosartan vs. Nitrendipine in Secondary Prevention (MOSES) – (Randomized comparison of eprosartan and nitrendipine in blood pressure control after cerebral ischemia) // Cardiovascular Risk management. 2003. Vol. 13. Р. 2–3.
34. Haller H., Ito S., Izzo J.L. et al. ROADMAP Trial Investigators. Olmesartan for the delay or prevention of microalbuminuria in type 2 diabetes // N Engl J Med. 2011. Vol. 364. Р. 907–917.
35. Viberti G. Microalbuminuria Reduction With Valsartan in Patients With Type 2 Diabetes Mellitus: A Blood Pressure – Independent Effect. Wheeldon and for the Microalbuminuria Reduction With VALsartan (MARVAL) Study Investigators // Circulation. 2002. Vol. 106. Р. 672–678.
36. The Shiga Microalbuminuria Reduction Trial (SMART) Group. Reduction of Microalbuminuria in Patients with Type 2 Diabetes // Diabetes Care. 2007. Vol. 30 (6). Р. 1581–1583.
37. Hollenberg et al. American Heart Association. 2006 (abstract).
38. Kjeldsen S.E., Julius S., Mancia G. et al. Effects of valsartan compared to amlodipine on preventing type 2 diabetes in high–risk hypertensive patients: the VALUE trial // J Hypertens. 2006. Vol. 24. 1405–1412.
39. Weycker D., Edelsberg J., Vincze G. et al. Risk of diabetes in a real–world setting among patients initiating antihypertensive therapy with valsartan or amlodipine // J Hum Hypertens. 2007. Vol. 21. Р. 374–380.
40. Top C., Cingozbay B.Y., Terekeci H. et al. The effects of valsartan on insulin sensitivity in patients with primary hypertension // J Int Med Res. 2002. Vol. 30. Р. 15–20.
41. Диагностика и лечение метаболического синдрома. Российские рекомендации // Кардиоваскулярная терапия и профилактика. 2007. Прил. 2. С. 3–26.
42. Fogari R., Corradi I., Poletti L. et al. Sexual activity in hypertensive males treated with valsartan or carvedilol. A cross–over study // J. Hypertens. 1999. Vol. 17 (Suppl. 3). Р. 65.
43. Подзолков В.И., Булатов В.А., Вигдорчик А.В. (от имени группы исследователей). Валсартан в повседневной клинической практике России: антигипертензивный эффект и влияние на сексуальную функцию у пациентов с артериальной гипертонией // РФК. 2010. Т. 6 (2). С. 166–172.












