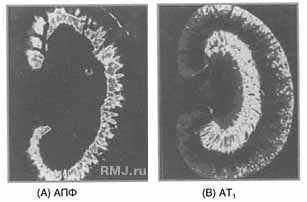
Рис. 1. Компьютерная радиограмма распределения АПФ (A) и AIIA (B) в почке крысы.
Ангиотензин II имеет много физиологических функций в почках (табл. 1), включая регуляцию и распределение почечного кровотока, селективную вазоконстрикцию эфферентных клубочковых артериол (что обеспечивает управление гломерулярным давлением и скоростью фильтрации), поддержку реабсорбции натрия и воды в проксимальных канальцах, торможение выброса ренина из почки, влияние на коэффициент гломерулярной фильтрации и функцию мезангия.

Негемодинамическое влияние AII на прогрессирование ХПН
Кроме прямого гемодинамического и гломерулярного эффекта, AII оказывает ряд косвенных влияний на прогрессирование ХПН, модулируя интерстициальный воспалительный и фиброзно–склеротический ответ клубочков и почечного интерстиция (рис. 2). Ангиотензин II стимулирует молекулы адгезии на эндотелиальных клетках, которые привлекают моноциты в интерстиций клубочков, а также активирует продукцию факторов роста и цитокинов клетками мезангия и макрофагами. Это, в свою очередь, стимулирует фибробласты к синтезу внеклеточного матрикса. Ангиотензин II вызывает также выброс эндотелина в почке, который, кроме гемодинамического эффекта, сходно с AII действует на фибробласты и макрофаги, активируя продукцию факторов роста и цитокинов. Вероятно, что РАС действует, как локальная воспалительная система, и таким образом включается в тканевой репарационный ответ на повреждение, который происходит при различных формах гломерулонефрита и гипертонии. Кроме того, ангиотензин II поддерживает оксидативный стресс, который, как предполагается, служит общим патологическим механизмом прогрессирования ХПН.

Рис. 2. Непрямые почечные эффекты AII, важные для патогенеза и прогрессирования ХПН
Давно известно, что ангиотензин II способен вызывать и усиливать протеинурию. Механизм этого, вероятно, связан с известным свойством ангиотензина II вызывать сокращение клубочков, при этом размер гломерулярных пор увеличивается. Ангиотензин II также влияет на белковый обмен в мезангии. Недавно стал более очевидным прямой нефротоксический эффект фильтрованных белков, особенно в связи с увеличением образования интерстициального матрикса – другим важным фактором прогрессирования ХПН.Ингибиторы АПФ радикально уменьшают протеинурию в экспериментальных моделях ХПН, а также при диабетической и недиабетической нефропатиях в клинике. Недавно было показано, что лозартан также уменьшает протеинурию при диабетической и недиабетической нефропатии, причем этот эффект опосредуется через АТ1–рецептор без участия брадикинина (рис. 3). Это уменьшение протеинурии путем блокады РАС более выражено, чем достигаемое другими гипотензивными средствами при таком же понижении АД.
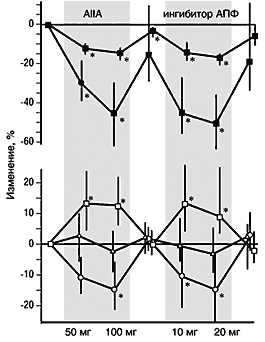
Рис. 3. Эффекты (медиана и 95% ДИ) антагониста AII (50 и 100 мг/сут) и ингибитора АПФ (10 и 20 мг/сут) при недиабетической нефропатии (n=11). Заштрихованные области - периоды активного лечения, не заштрихованные области - периоды плацебо. *P < 0,05 от исходного
Различия между AIIA и ингибиторами АПФБлокада АТ1–рецептора, который передает все известные почечные физиологические сигналы ангиотензина II, теоретически должна приводить к более специфичной и полной блокаде РАС. Поскольку E–3174, активный метаболит лозартана, является неконкурентным ингибитором, то увеличение плазменного уровня ангиотензина II вследствие реактивного выброса ренина при блокаде РАС, не приводит к разблокированию рецептора. Другая картина наблюдается в случае ингибиторов АПФ, которые являются конкурентными ингибиторами рецептора. Кроме того, антагонисты AT1–рецепторов блокируют действие ангиотензина II, образованного любыми не–АПФ–путями биосинтеза. Наконец, антагонисты AT1–рецепторов более специфичны, чем ингибиторы АПФ, потому что они не влияют на брадикинин и другие тахикинины. Благодаря этому неблагоприятные эффекты накопления тахикининов (таких, как кашель) не отмечаются при использовании лозартана.
Блокада АТ–рецептора, который передает все известные почечные физиологические сигналы ангиотензина II, теоретически должна приводить к более специфичной и полной блокаде РАС. Поскольку E–3174, активный метаболит лозартана, является неконкурентным ингибитором, то увеличение плазменного уровня ангиотензина II вследствие реактивного выброса ренина при блокаде РАС, не приводит к разблокированию рецептора. Другая картина наблюдается в случае ингибиторов АПФ, которые являются конкурентными ингибиторами рецептора. Кроме того, антагонисты AT–рецепторов блокируют действие ангиотензина II, образованного любыми не–АПФ–путями биосинтеза. Наконец, антагонисты AT–рецепторов более специфичны, чем ингибиторы АПФ, потому что они не влияют на брадикинин и другие тахикинины. Благодаря этому неблагоприятные эффекты накопления тахикининов (таких, как кашель) не отмечаются при использовании лозартана.Заключение
Множественные эффекты ангиотензина II в почках у взрослых опосредованы AT1–рецепторами. Ангиотензин II участвует в патогенезе и прогрессировании ХПН гемодинамическим и негемодинамическим путями. Через какой тип рецепторов (AT1 или AT2) AII влияет на воспалительные медиаторы, пока не установлено. Лозартан, подобно ингибиторам АПФ, благоприятно влияет на почечную гемодинамику, протеинурию и прогрессирование ХПН и почечного отказа(неудачи) в экспериментальных моделях, а также уменьшает протеинурию при недиабетической и диабетической нефропатии в клинической практике. Эти результаты свидетельствуют о том, что ренопротективный эффект ингибиторов АПФ опосредуется снижением ангиотензина II. Лозартан должен обеспечивать более специфичную и полную блокаду почечной РАС. Приводит ли это к лучшему клиническому результату, покажут результаты длительных сравнительных клинических испытаний, таких как Losartan Renal Protection Study и исследование RENAAL.
Таблица 1. Почечные эффекты ангиотензина II
1. Распределение почечного кровотока
2. Регулирование скорости клубочковой фильтрации:
3. Реабсорбция натрия проксимальными канальцами
4. Стимуляция почечного концентрирующего механизма
5. Потенцирование почечной симпатической активности
6. Модуляция функции мезангиальных клеток
7. Торможение выброса ренина из почки
8. Поддержка ростовых процессов через стимуляцию факторов роста и цитокинов
Список литературы Вы можете найти на сайте http://www.rmj.ru
Подготовил к.м.н. А.Н. Николаев
по материалам
C.I. Johnston. Progression of renal disease: involvment of AT1 receptor. // Receptors in cardiovascular disease, vol. 5: № 3.
1. Zatz R. Haemodynamically mediated glomerular injury: The end of a 15-year old controversy? Curr Opm Nepnrof Hypertens 1996;5(6):468-475.
2. Remuzzi G, Ruggenenti P, Benigni A. Understanding the nature of renal disease progression. Kidney nt 1997;51(1):2-15.
3. lohnston Cl, Fabris B, landeleit K. Intrarenal renin-angiotensin system in renal physiology and patho-physiology. Kidney Int 1993;44(suppl 42):S59-S63.
4. Lewis E), Hunsicker LG, Bain RP, Rohde RD, for the Collaborative Study Group. The effect of angiotensin-converting-enzyme inhibition on diabetic nephropa-thy. N Enal) Ued 1993,329(20): 1456-1462.
5. Zhuo J., Alien AM, Alcorn D, et al. The distribution of angiotensin II receptors. In: Laragh J.H, Brenner BM, eds. Hypertension: Pathophysiology, Diagnosis and Management. 2nd ed. New York: Raven Press Ltd, 1995:1739-1762.
6. Anderson S, Meyer TW, Rennke HG, Brenner BM. Control of glomerular hypertension limits glomerular injury in rats with reduced renal mass. I Clin Invest 1985;76(2):612-619.
7. Egido J. Vasoactive hormones and renal sclerosis. Kidney nt 1996;49(2):578-587.
8. lohnston CI. Tissue angiotensin converting enzyme in cardiac and vascular hypertrophy, repair and remodeling. Hypertension 1994;23(2):258-267.
9. Rajagopalan S, Kurz S, Munzel T, et al. Angiotensin Il-mediated hypertension in the rat increases vascular superoxide production via membrane NADH/NADPH oxidase activation. Contribution to the alterations of vasomotor tone. 1 Clin Invest 1996,97:1916-1923.
10. Morelli E, Loon N, Meye TW, et al. Effects of converting-enzyme inhibition on barrier function in diabetic glomerulopathy. Diabetes 1990; 39(1): 76-82,
11. Burton C, Harris KPG. The role of proteinuria in the progression of chronic renal failure. Am I Kidney Dis 1996:27(6);765-775.
12. Giatras I, Lau J, Levey AS. Effect of angiotensin-con-verting enzyme inhibitors on the progression of non-diabetic renal disease: A meta-analysis of randomized trials. Angiotensin-Converting-Enzyme Inhibition and Progressive Renal Disease Study Group. Ann Intern Mai 1997;127(5):337-345,
13. Gansevoort RT, de Zeeuw D, de long PE. Is the antiproteinuric effect of ACE inhibition mediated by interference in the renin-angiotensin system? Kidney nt 1994;45(3):861-867.












