Существуют различные клинические варианты ДПН. Дистальная симметричная полинейропатия составляет около 70% поражений периферической нервной системы при СД [5] и представляет собой комбинированное поражение периферических сенсорных, моторных и автономных нервных волокон. В первую очередь в патологический процесс вовлекаются наиболее длинные нервные волокна, в большинстве случаев это сенсорные нервные волокна малого диаметра [6], что проявляется снижением или потерей температурной и болевой чувствительности. Первые клинические признаки поражения нервных волокон появляются в области стоп – парестезии, чувство зябкости, жжения, острые, колющие боли. При развитии процесса симптомы возникают и в более проксимальных отделах. Дегенеративные изменения толстых сенсорных нервных волокон ведут к снижению или потере вибрационной и проприоцептивной чувствительности, ослаблению глубоких сухожильных рефлексов и замедлению скорости нервного проведения. Типичными жалобами являются онемение, чувство покалывания, иногда ощущение наличия инородного тела в области стоп. Кроме того, возможно развитие атаксии и слабости мышц верхних и нижних конечностей («ватные» ноги, невозможность удерживать предметы рукой). Поражение моторных нервных волокон выражено меньше и характерно в основном для дистальных отделов нижних конечностей, что проявляется атрофией мелких мышц стопы, перераспределением тонуса между сгибателями и разгибателями пальцев, атрофией межкостных мышц [7]. Помимо перечисленных симптомов для ДПН характерно наличие болевого синдрома. Частота болевой нейропатии по данным разных исследователей варьирует от 3 до 32%. По данным исследования M. Davies и соавт. [4], жалобы на болезненные ощущения предъявляли до 63,8% пациентов, при детальном обследовании истинную болевую форму имели 20% больных.
Итак, наиболее часто встречается хроническая дистальная симметричная сенсорная и сенсомоторная полинейропатия, и именно этот тип ДПН чаще всего сопровождается болевым синдромом.
Болевой синдром при ДПН
Боль является ведущим клиническим симптомом ДПН. В зависимости от механизма возникновения различают ноцицептивную и нейропатическую боль. Ноцицептивной называют боль, обусловленную воздействием какого–либо фактора (механическая травма, ожог, воспаление и т.д.) на периферические болевые рецепторы. Этот тип боли соответствует степени тканевого повреждения и длительности воздействия повреждающих факторов, полностью регрессирует после заживления. Боль, сохраняющаяся или появляющаяся после заживления, не имеет защитной функции и обычно развивается при поражении периферической или центральной нервной системы, называется нейропатической болью [8].
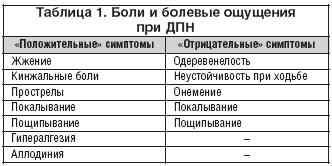
Нейропатическая боль сопровождается рядом специфических расстройств. Характерной для нейропатической боли является аллодиния – появление боли в ответ на стимул, который в нормальных условиях не вызывает боли. При нейропатической боли часто наблюдаются гиперестезия, гипералгезия и гиперпатия. При гипералгезии чувствительность к болевому стимулу оказывается значительно выше, чем ожидается в норме. При гиперпатии субъективный ответ как на болевой, так и неболевой стимулы является чрезмерным и часто сохраняется в течение долгого времени уже после прекращения раздражения. Пациента могут также беспокоить спонтанные боли, возникающие при очевидном отсутствии какого–либо внешнего воздействия. Они, как правило, носят жгучий, колющий характер. Чувство щекотания, безболезненного покалывания или другие подобные ощущения относятся к парестезиям; если эти ощущения причиняют боль, то их называют дизестезиями [8]. Обычно симптомы усиливаются к вечеру. Кроме того, пациенты с хронической сенсорно–моторной полинейропатией могут иметь так называемые «отрицательные» симптомы (табл. 1).
Развитие и течение острой болевой нейропатии отличается от хронической сенсомоторной полинейропатии (табл. 2). Острая болевая нейропатия начинается остро или подостро, а выраженная болевая симптоматика, как правило, ослабевает и купируется за короткий (до 1 года) период времени [9]. Острая болевая полинейропатия обычно развивается в период декомпенсации СД, может возникать после кетоацидоза, также ее развитие связывают со значительным снижением веса и нарушениями питания. Она также может развиваться после быстрого улучшения гликемического контроля (инсулиновая нейропатия), независимо от того, с помощью каких препаратов происходило снижение гликемии. При достижении стойкой компенсации углеводного обмена ДПН претерпевает обратное развитие в течение 6–9 мес. [10].
Боль может сопровождаться потерей веса, депрессией, нарушением сна, эректильной дисфункцией у мужчин. Основные жалобы включают ощущение жжения (особенно в стопах), гиперестезию, острую боль, описываемую как ощущения «прострелов». Все симптомы обычно усиливаются к вечеру, типично развитие аллодинии. При клиническом обследовании нарушения чувствительности не выражены, может обнаруживаться умеренное или незначительное снижение температурной чувствительности. Глубокие сухожильные рефлексы, вибрационная и тактильная чувствительность сохранены, признаков поражения моторного звена периферической нервной системы нет, иногда наблюдается снижение ахиллова рефлекса [7].
Патофизиология нейропатической боли
Механизм развития болевого синдрома при поражении периферических нервов у больных СД принципиально не отличается от такового при других нейропатиях. Нейропатическая боль возникает в результате нарушения взаимодействия ноцицептивных и антиноцицептивных систем вследствие их поражения или нарушения функций на различных уровнях нервной системы. Возможные механизмы боли включают в себя спонтанную эктопическую активность поврежденных аксонов с формированием патологической активности в участках демиелинизации, сенситизацию болевых рецепторов, патологические взаимодействия периферических сенсорных волокон в связи с их активной дегенерацией и атрофией аксонов. Центральная сенситизация (недостаточность антиноцицептивных нисходящих влияний на задний рог спинного мозга) группы нейронов спинного мозга является результатом нейрональной пластичности, активированной первичной афферентной стимуляцией [8]. Этот процесс считается решающим в формировании синдрома нейропатической боли, он приводит к развитию аллодинии и гиперпатии. На клеточном уровне в формировании нейропатической боли участвуют потенциалзависимые кальциевые N– и Р–каналы, расположенные в клетках поверхностной пластинки заднего рога спинного мозга, при активации которых происходит увеличение высвобождения нейротрансмиттеров.
В формировании боли при ДПН имеют большое значение также процессы, в основе которых лежит гипергликемия. Так, гипергликемическая гипоксия нарушает формирование потенциала действия, что играет определенную роль в генезе болевой симптоматики. Кроме того, гипергликемия снижает ноцицептивный порог и порог переносимости боли. Декомпенсация СД может сопровождаться транзиторными нарушениями проводимости по нервным волокнам (так называемая транзиторная, или возвратная, нейропатия). Как правило, это состояние временное, и при достижении стойкой компенсации углеводного обмена клиническая симптоматика постепенно купируется, однако развитие подобного осложнения является предпосылкой для возникновения в будущем других форм нейропатии [11]. Вследствие слишком быстрой нормализации гликемии может возникнуть ишемия нерва. Одной из гипотез развития острой нейропатической боли в этом случае является феномен «обкрадывания»: быстрые изменения содержания глюкозы крови ведут к изменению реологических свойств крови, нарушению кровотока и открытию артериовенозных шунтов, что вызывает ишемию эндоневрия [12].
Терапия болевого синдрома
Достижение стойкой компенсации СД является основным направлением в лечении и профилактике ДПН. В ходе исследования DCCT продемонстрировано, что частота развития нейропатии снижается на 64%, а выявления нарушений проводимости по нервным волокнам – на 44% на фоне интенсивной инсулинотерапии и обеспечения компенсации углеводного обмена в течение 5 лет [13]. Тем не менее, стабильная нормогликемия у больных с выраженной ДПН не способствует быстрой ликвидации ее проявлений. В связи с этим для повышения качества жизни пациентов требуется дополнительное симптоматическое лечение, особенно при наличии болевого синдрома. Важно определить показания для симптоматической терапии болевого синдрома. К ним относятся: выраженный болевой синдром (оценка боли по визуальной аналоговой шкале > 40 мм), нарушение сна из–за болей, снижение качества жизни и развитие депрессии. Нужно подчеркнуть, что лекарственная терапия на фоне декомпенсации углеводного обмена может быть неэффективной.
Фармакотерапия ДПН предусматривает два направления: уменьшение выраженности болевого синдрома (симптоматическая терапия) и восстановление пораженных нервов (патогенетическая терапия). В последнем случае используются α–липоевая кислота, бенфотиамин, факторы роста нервов, ингибиторы альдозоредуктазы, ингибиторы протеинкиназы С, сосудистая терапия [14]. Это направление терапии предопределяет прогноз, но не всегда сопровождается видимым клиническим улучшением. В то же время даже при незначительной нейропатии может иметь место выраженный болевой синдром, который часто является ведущим фактором в снижении качества жизни пациентов, приводя к депрессии, тревоге и социальной дезадаптации [15]. Поэтому одновременно с патогенетической терапией необходимо эффективное лечение нейропатического болевого синдрома.
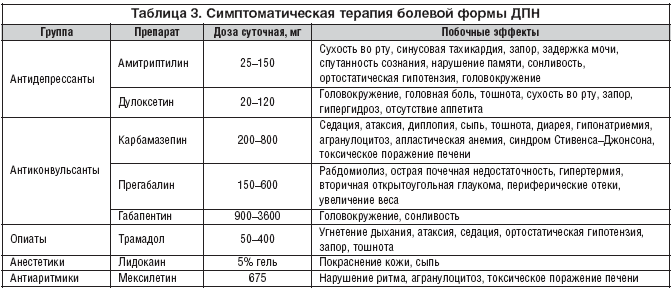
Основными группами препаратов для лечения нейропатической боли при ДПН являются: антидепрессанты, антиконвульсанты, опиоиды и местные анестетики (табл. 3).
К местным анестетикам относят пластыри и гели с 5% содержанием лидокаина, капсаицин, мексилетин. Трансдермальная терапевтическая система (ТТС) с лидокаином представляет собой накожную аппликацию в виде тканевой основы, покрытой гидрогелем, содержащим 700 мг 5% лидокаина. ТТС накладывается на 12 ч на максимально болезненные области, одновременно применяется не более 3–х пластырей. Преимуществами этого способа лечения считаются хорошая переносимость ТТС, отсутствие системного действия препарата и возможность комбинации с пероральными препаратами других групп. Капсаицин – алкалоид, выделенный из стручкового перца, выпускается в виде крема с содержанием капсаицина 0,075%. Препарат обладает подтвержденной эффективностью [16]. Механизм действия заключается в нарушении генерации болевого импульса вследствие истощения запасов субстанции Р в периферических сенсорных нейронах. Однако применение препарата сопряжено с некоторыми трудностями: необходимость нанесения 4 р./сут., риск раздражающего действия, усиление болевой симптоматики в первые дни применения. Антиаритмический препарат мексилетин является оральным аналогом лидокаина. Считается, что мексилетин блокирует натриевые каналы, стабилизируя мембрану нейронов и блокируя передачу болевых импульсов. Несмотря на доказанную эффективность, используется очень ограниченно из–за риска нарушения ритма, развития агранулоцитоза и потенциальной гепатотоксичности [17].
Обезболивание с помощью опиатов имеет определенные риски в виде развития физической зависимости, толерантности к лекарственным препаратам, а также психологических побочных эффектов, вследствие чего они не нашли широкого применения в лечении болевой формы ДПН. У части пациентов с невропатической болью применение опиатов может обеспечить оптимальное соотношение между анальгетической активностью и побочными эффектами терапии. В ряде случаев опиаты могут быть предпочтительнее, т.к. легче переносятся пожилыми пациентами. Однако в настоящее время опиаты не могут считаться препаратами выбора при лечении нейропатических болей. Из препаратов этой группы можно рекомендовать трамадол, который эффективен при многих хронических болевых синдромах.
Группа трициклических антидепрессантов (ТЦА) наиболее изучена и уже около 50 лет применяется для лечения нейропатической боли. ТЦА (амитриптилин) блокируют обратный захват норадреналина и серотонина в пресинаптических нейронах, что способствует активизации нисходящих антиболевых влияний и тормозит прохождение болевой афферентации. Появление болевой симптоматики часто сопровождается развитием у пациентов депрессий, и назначение антидепрессантов в этой ситуации способствует смягчению проявлений данного состояния. Кроме того, пациенты с нейропатической болью часто страдают расстройством сна, поэтому седативный эффект, свойственный некоторым ТЦА, может расцениваться как дополнительная польза. Тем не менее, широкое применение антидепрессантов ограничивается в связи с побочными эффектами, т.к. помимо блокирования обратного захвата норадреналина и серотонина, ТЦА в разной степени блокируют постсинаптические мускариновые, холинергические, α1–адренергические и гистаминовые рецепторы [18]. Вследствие этого ТЦА могут вызывать сухость во рту, синусовую тахикардию, запор, задержку мочи, спутанность сознания, нарушение памяти, сонливость, ортостатическую гипотензию и головокружение. ТЦА следует применять с осторожностью у пациентов с сердечной патологией, глаукомой, вегетативными нарушениями, и особенно у пожилых пациентов. Селективные ингибиторы обратного захвата серотонина имеют по сравнению с ТЦА более благоприятный профиль переносимости, но низкую эффективность. В дальнейшем были разработаны антидепрессанты, угнетающие обратный захват как серотонина, так и норадреналина (венлафаксин и дулоксетин), с хорошей переносимостью и достаточной эффективностью.
Эффективность антиконвульсантов первого поколения (карбамазепин, фенитоин, вальпроат) в лечении нейропатической (особенно острой и пароксизмальной) боли обусловлена блокированием натриевых каналов и ингибированием эктопической активности в пресинаптических сенсорных нейронах. Однако, в целом, применение противосудорожных препаратов первого поколения не рассматривается как терапия первой линии из–за обусловленных ими побочных эффектов. Наиболее крупные клинические исследования проведены по изучению анальгетической эффективности антиконвульсантов второго поколения: габапентина [19] и прегабалина [20]. Прегабалин воздействует на GABA–рецепторы, блокируя болевую импульсацию. Препарат характеризуется удовлетворительной переносимостью, однако он способен вызывать целый ряд редких, но серьезных побочных эффектов, таких как рабдомиолиз, острая почечная недостаточность, гипертермия, вторичная открытоугольная глаукома, периферические отеки, увеличение веса и ряд эффектов со стороны ЦНС. Таким образом, назначение прегабалина и титрация его дозы должны проводиться под наблюдением специалиста. Опыт использования других антиконвульсантов второго поколения – топирамата и ламотриджина – по количеству проведенных испытаний ограничен.
Габапентин является жирорастворимой аминокислотой, схожей по химическому строению с тормозным медиатором ГАМК. Механизм действия габапентина основан на связывании с α2–дельта–субъединицей потенциалзависимых кальциевых каналов периферических сенсорных нейронов. Это приводит к снижению входа кальция в пресинаптический нейрон, в результате чего уменьшается высвобождение главных медиаторов боли (глутамат, норадреналин и субстанция Р) перевозбужденными нейронами, что сопровождается редукцией болевого синдрома [21]. Препарат обладает хорошей переносимостью и высокой эффективностью, наблюдаемой уже на 1–й нед. лечения. Наиболее частыми побочными эффектами являются головокружение (21,1%) и сонливость (16,1%). Концентрация габапентина в плазме достигает пика через 2–3 ч после приема. Интервал дозирования не должен превышать 12 ч. Биодоступность составляет 60%. Прием пищи не влияет на фармакокинетику габапентина. Антациды снижают концентрацию габапентина в крови, поэтому его рекомендуется принимать не ранее чем через 2 ч после приема антацидов. Препарат выводится преимущественно почками и не метаболизируется в печени. При нарушении функции почек дозу габапентина подбирают с учетом клиренса креатинина.
Габапентин назначается в дозе 300 мг на ночь с последующей титрацией дозы до получения клинического эффекта: минимальная эффективная дозировка – 900 мг/сут., рекомендуемая – 1800 мг/сут., максимальная суточная доза – 3600 мг/сут. Период титрации дозы занимает до 14 дней. Оценка эффективности препарата должна проводиться не ранее чем через 1 нед. приема. Сочетание габапентина с лидокаином или антидепрессантами усиливает его эффект. Особенностью габапентина также является отсутствие взаимодействия с большинством неврологических препаратов и потенциальной гепатотоксичности. Однако следует воздержаться от его применения в сочетании с алкоголем, транквилизаторами, антигистаминными препаратами, барбитуратами, антиконвульсантами, снотворными, миорелаксантами, наркотиками.
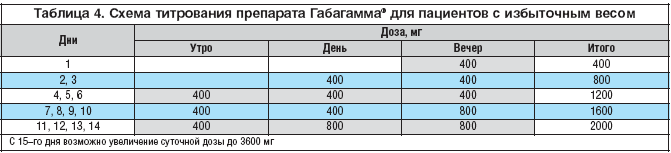
В настоящее время предпочтение в лечении большинства форм нейропатического болевого синдрома отдают габапентину. Хорошо зарекомендовал себя препарат Габагамма («Верваг Фарма», Германия). Преимущества препарата Габагамма включают в себя наличие разных доз – 300 и 400 мг, а также возможность их титрования с учетом массы тела больного (табл. 4 и 5). Так, в случае избыточной массы тела рекомендуется титровать по 400 мг, а в случае нормального веса – по 300 мг. Гибкая схема титрования также предотвращает развитие нежелательных побочных реакций в виде сонливости.
Таким образом, основой лечения и профилактики ДПН, как и других осложнений СД, является достижение и сохранение стойкой нормогликемии. Наличие болевого синдрома, резко снижающего качество жизни пациента, требует назначения эффективной симптоматической терапии. В настоящее время имеется широкий выбор лекарственных средств с доказанной клинической эффективностью. Индивидуальный подбор препарата каждому пациенту необходимо осуществлять с учетом выраженности болевой симптоматики, возможных побочных эффектов и сопутствующей патологии.


Литература
1. International guidelines on the out–patient management of diabetic peripheral neuropathy, 1996.
2. Harris M.I., Eastman R., Cowie C. Symptoms of sensory neuropathy in adults with NIDDM in the U.S. population // Diabetes Care. 1993. Vol. 16. P. 1446–1452.
3. Melton L.J. III, Dyck P.J. Epidemiology // Diabetic Neuropathy. 2nd ed. / P.J. Dyck, P.K. Thomas., eds. – Philadelphia: W.B. Saunders, 1999. P. 239–278.
4. Davies M., Brophy S., Williams R., Taylor A. The Prevalence, Severity, and Impact of Painful Diabetic Peripheral Neuropathy in Type 2 Diabetes // Diabetes Care. 2006. Vol. 29. P.1518–1522.
5. Melton L.J., Dyck P.J. Clinical features of the diabetic neuropathies/epidemiology / P.J. Dyck, P.K. Thomas, A.K. Asbury et al eds // Diabeticneuropathy. – Philadelphia: WB Saunders,1987. P. 27–35.
6. Anand P., Terenghi G., Warner G. et al. The role of endogenous nerve growth factor in human diabetic neuropathy // Nature Med. 1996. Vol. 2. P. 703–707.
7. Демидова И.Ю., Храмилин В.Н. Симптоматическая терапия болевого синдрома при диабетической полинейропатии.
8. Данилов А.Б. Нейропатическая боль. – М., 2003. – 60 с.
9. Eaton S., Tesfaye S. Clinical manifestations and measurement of neuropathy // Diabetes Rev. 1999. Vol. 7. P. 312–325.
10. Saudek C.D., Werns S., Reidenberg M.M. Phenytoin in the treatment of diabetic symmetrical polyneuropathy // Clin. Pharmacol. Ther. 1977. Vol. 22. P. 196–199.
11. Thomas P.K. Classification, differential diagnosis and staging of diabetic peripheral neuropathy // Diabetes. 1997. Vol. 46(suppl. 2). S54–57.
12. Oyibo S., Prasad Y.D., Jackson N.J. et al. The relationship between blood glucose excursions and painful diabetic peripheral neuropathy: a pilot study // Diabet Med. 2002. Vol. 19. P. 870–873.
13. The Diabetes Control and Complication Trial Research Group. The effect of intensive diabetes therapy on the development and progression of diabetic neuropathy // Ann. Intern. Med. 1995. Vol. 122. P. 561–568.
14. Vinik A.I. Diabetic neuropathy: pathogenesis and therapy // Amer. J. Med. 1999. Vol. 107 (suppl. 2). P. 17–26.
15. Данилов А.Б. Фармакотерапия болевого синдрома при диабетической полиневропатии // Consilium Medicum.
16. The Capsaicin Study Group: Treatment of painful diabetic neuropathy with topical capsaicin: a multicenter, double–blind, vehicle–controlled study // Arch. Intern. Med. 1991. Vol. 151. P. 2225–2229.
17. Wright J.M., Oki J.C., Graves L. 3rd: Mexiletine in the symptomatic treatment of diabetic peripheral neuropathy // Ann. Pharmacother. 1997. Vol. 31. P. 29–34.
18. Sindrup S.H., Otto M., Finnerup N.B., Jensen T.S. Antidepressants in the treatment of neuropathic pain // Basic Clin. Pharmacol. Toxicol. 2005. Vol. 96. P. 399–409.
19. Backonja M., Beydoun A., Edwards KR. et al. Gabapentin for the symptomatic treatment of painful neuropathy in patients with diabetes mellitus: a randomized controlled trial // JAMA. 1998. Vol. 280. P. 1831–1836.
20. Rosenstock J., Tuchman M., LaMoreaux L., Sharma U. Pregabalin for the treatment of painful diabetic peripheral neuropathy: a double–blind, placebo–controlled trial // Pain. 2004. Vol. 110. P. 628–638.
21. Tesfaye S., Stevens L.K., Stephenson J.M. et al. Prevalence of diabetic peripheral neuropathy and its relation to glycemic control and potential risks factors: the EURODIAB IDDM Complications Study // Diabetol. 1996. Vol. 39. P. 1377–1384.












