–Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –Э–Я–Т–Я
–Э–Я–Т–Я –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є –і–Њ–≤–Њ–ї—М–љ–Њ –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ—Г—О –≥—А—Г–њ–њ—Г –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –њ–Њ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ, –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –Є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –њ—А–Њ—Д–Є–ї—О –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є —А—П–і—Г –і—А—Г–≥–Є—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї. –Ю–і–љ–∞–Ї–Њ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —Ж–µ–ї—Л–є —А—П–і –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є, –≤—Б–µ –Э–Я–Т–Я –Њ–±–ї–∞–і–∞—О—В —Б—Е–Њ–ґ–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П, –Њ—В–Ї—А—Л—В—Л–Љ –±–Њ–ї–µ–µ 40 –ї–µ—В –љ–∞–Ј–∞–і [1]. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Э–Я–Т–Я –Є–љ–≥–Є–±–Є—А—Г—О—В —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л (–¶–Ю–У), —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ—А–Њ—Б—В–∞–љ–Њ–Є–і–Њ–≤. –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –¶–Ю–У –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –і–≤—Г–Љ—П –Є–Ј–Њ—Д–Њ—А–Љ–∞–Љ–Є вАУ –¶–Ю–У-1 –Є –¶–Ю–У-2 [3]. –¶–Ю–У-1 —П–≤–ї—П–µ—В—Б—П –Ї–Њ–љ—Б—В–Є—В—Г—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є, –њ–Њ—Б—В–Њ—П–љ–љ–Њ –њ—А–Є—Б—Г—В—Б—В–≤—Г–µ—В –≤ —В–Ї–∞–љ—П—Е –Є —А–µ–≥—Г–ї–Є—А—Г–µ—В —Б–Є–љ—В–µ–Ј —В–∞–Ї–Є—Е –њ—А–Њ—Б—В–∞–љ–Њ–Є–і–Њ–≤, –Ї–∞–Ї –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ—Л (–Я–У) (–Я–У–Х2, –Я–УF2ќ±, –Я–УD2, 15d-–Я–УJ2), –њ—А–Њ—Б—В–∞—Ж–Є–Ї–ї–Є–љ –Я–УI2 –Є —В—А–Њ–Љ–±–Њ–Ї—Б–∞–љ –Р2, –Ї–Њ—В–Њ—А—Л–µ —А–µ–≥—Г–ї–Є—А—Г—О—В –ї–Њ–Ї–∞–ї—М–љ—Л–є –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ [4]. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Н—Д—Д–µ–Ї—В—Л –њ—А–Њ—Б—В–∞–љ–Њ–Є–і–Њ–≤ —А–µ–∞–ї–Є–Ј—Г—О—В—Б—П –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –Є—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ —А–µ—Ж–µ–њ—В–Њ—А—Л, –њ—А–Є —Н—В–Њ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –Њ–і–Є–љ –Є —В–Њ—В –ґ–µ —А–µ—Ж–µ–њ—В–Њ—А, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л–є –≤ —А–∞–Ј–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е, –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–ї–Є—З–љ—Л–Љ —Н—Д—Д–µ–Ї—В–∞–Љ [4]. –Э–∞–њ—А–Є–Љ–µ—А, –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –Я–У–Х2 –љ–∞ —А–µ—Ж–µ–њ—В–Њ—А –Х–†3 —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –ґ–µ–ї—Г–і–Ї–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Г—Б–Є–ї–µ–љ–Є–µ–Љ –≤—Л—А–∞–±–Њ—В–Ї–Є —Б–ї–Є–Ј–Є –Є –±–Є–Ї–∞—А–±–Њ–љ–∞—В–Њ–≤, –≤ —В–Њ –ґ–µ –≤—А–µ–Љ—П –∞–Ї—В–Є–≤–∞—Ж–Є—П –і–∞–љ–љ–Њ–≥–Њ —А–µ—Ж–µ–њ—В–Њ—А–∞, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ–≥–Њ –љ–∞ –њ–∞—А–Є–µ—В–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е –ґ–µ–ї—Г–і–Ї–∞, –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –≤—Л—А–∞–±–Њ—В–Ї–Є —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –≥–∞—Б—В—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ [3]. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ —Б—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–∞—П —З–∞—Б—В—М –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є (–Э–Ы–†), —Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е –і–ї—П –Э–Я–Т–Я, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –Є–Љ–µ–љ–љ–Њ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ–Љ –¶–Ю–У-1.–Ф–Њ –љ–µ–і–∞–≤–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є —Б—З–Є—В–∞–ї–Є –¶–Ю–У-2 –Є–љ–і—Г—Ж–Є–±–µ–ї—М–љ—Л–Љ —Д–µ—А–Љ–µ–љ—В–Њ–Љ, –Ї–Њ—В–Њ—А—Л–є –≤ –љ–Њ—А–Љ–µ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В –Є –њ–Њ—П–≤–ї—П–µ—В—Б—П –ї–Є—И—М –≤ –Њ—В–≤–µ—В –љ–∞ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ, –љ–Њ —А–∞–±–Њ—В—Л –њ–Њ—Б–ї–µ–і–љ–Є—Е –ї–µ—В —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –≤ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –њ—А–Є—Б—Г—В—Б—В–≤—Г–µ—В –Є –Ї–Њ–љ—Б—В–Є—В—Г—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П –¶–Ю–У-2, –Ї–Њ—В–Њ—А–∞—П –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, —В–Є–Љ—Г—Б–∞, –њ–Њ—З–µ–Ї –Є –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ (–Ц–Ъ–Ґ) [5]. –Я–Њ—Н—В–Њ–Љ—Г –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ –Ї–Њ–љ—Б—В–Є—В—Г—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –¶–Ю–У-2, –љ–∞–±–ї—О–і–∞–µ–Љ–Њ–µ –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2 (–љ–∞–њ—А–Є–Љ–µ—А, –Ї–Њ–Ї—Б–Є–±–Њ–≤), –Љ–Њ–ґ–µ—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—В—М—Б—П —А–∞–Ј–≤–Є—В–Є–µ–Љ —А—П–і–∞ —Б–µ—А—М–µ–Ј–љ—Л—Е –Э–Ы–† —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л (–°–°–°) –Є –њ–Њ—З–µ–Ї [5].
–Я–Њ–Љ–Є–Љ–Њ —А—П–і–∞ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д—Г–љ–Ї—Ж–Є–є, –¶–Ю–У-2 –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –±–Њ–ї–Є –Є –ї–Є—Е–Њ—А–∞–і–Ї–Є [1]. –Ш–Љ–µ–љ–љ–Њ –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –¶–Ю–У-2 –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –∞–Ї—В–Є–≤–љ–Њ–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Я–У–Х2 –Є —А—П–і–∞ –і—А—Г–≥–Є—Е –њ—А–Њ—Б—В–∞–љ–Њ–Є–і–Њ–≤, —П–≤–ї—П—О—Й–Є—Е—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –Љ–µ–і–Є–∞—В–Њ—А–∞–Љ–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П. –Ш–Ј–±—Л—В–Њ—З–љ–Њ–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Я–У–Х2, –љ–∞–±–ї—О–і–∞–µ–Љ–Њ–µ –њ—А–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–Є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Ж–µ–ї—Л–Љ —А—П–і–Њ–Љ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є. –Э–∞–њ—А–Є–Љ–µ—А, —В–∞–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –Ї–∞–Ї –Њ—В–µ–Ї –Є –њ–Њ–Ї—А–∞—Б–љ–µ–љ–Є–µ, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –ї–Њ–Ї–∞–ї—М–љ–Њ–є –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–µ–є –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є —Б–Њ—Б—Г–і–Њ–≤ –њ—А–Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–Є –Я–У–Х2 —Б EP2 –Є EP4-—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є; –љ–∞—А—П–і—Г —Б —Н—В–Є–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –і–∞–љ–љ–Њ–≥–Њ –Я–У –љ–∞ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–µ –љ–µ–є—А–Њ–љ—Л –њ—А–Є–≤–Њ–і–Є—В –Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—О –≥–Є–њ–µ—А–∞–ї–≥–µ–Ј–Є–Є [4]. –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –Я–У–Х2 —Б–Є–љ—В–µ–Ј–Є—А—Г–µ—В—Б—П –Є–Ј –Я–У–Э2 –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –Љ–Є–Ї—А–Њ—Б–Њ–Љ–∞–ї—М–љ–Њ–є –Я–У–Х2-—Б–Є–љ—В–µ—В–∞–Ј—Л 1 (–ЉвАУ–Я–УE2–° 1), —Ж–Є—В–Њ–Ј–Њ–ї—М–љ–Њ–є –Я–У–Х2-—Б–Є–љ—В–µ—В–∞–Ј—Л (—Ж-–Я–УE2–°) –Є –Љ–Є–Ї—А–Њ—Б–Њ–Љ–∞–ї—М–љ–Њ–є –Я–У–Х2 —Б–Є–љ—В–µ—В–∞–Ј—Л 2 (–Љ-–Я–УE2–° 2) [4, 6]. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Ж-–Я–УE2–° —А–∞–±–Њ—В–∞–µ—В —Б–Њ–≥–ї–∞—Б–Њ–≤–∞–љ–љ–Њ —Б –¶–Ю–У-1 –Є –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –і–∞–љ–љ–Њ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ (–љ–Њ –љ–µ –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –¶–Ю–У-2) –њ—А–µ–≤—А–∞—Й–∞–µ—В –Я–У–Э2 –≤ –Я–У–Х2, —В. –µ. –і–∞–љ–љ–∞—П —Б–Є–љ—В–µ—В–∞–Ј–∞ —А–µ–≥—Г–ї–Є—А—Г–µ—В –≤—Л—А–∞–±–Њ—В–Ї—Г –Я–У–Х2 –≤ –љ–Њ—А–Љ–µ [4]. –Э–∞–њ—А–Њ—В–Є–≤, –Љ-–Я–УE2–° 1 —П–≤–ї—П–µ—В—Б—П –Є–љ–і—Г—Ж–Є–±–µ–ї—М–љ–Њ–є –Є —А–∞–±–Њ—В–∞–µ—В —Б–Њ–≥–ї–∞—Б–Њ–≤–∞–љ–љ–Њ —Б –¶–Ю–У-2 (–љ–Њ –љ–µ –¶–Ю–У-1) –Є –њ—А–µ–Њ–±—А–∞–Ј—Г–µ—В –Я–У–Э2 –≤ –Я–У–Х2 –њ—А–Є –љ–∞–ї–Є—З–Є–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Є–Љ–µ–љ–љ–Њ –Љ-–Я–УE2–° 1 —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –Ї–ї—О—З–µ–≤—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤, —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є—Е —Б–Є–љ—В–µ–Ј —В–∞–Ї–Њ–≥–Њ –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –Љ–µ–і–Є–∞—В–Њ—А–∞ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –Ї–∞–Ї –Я–У–Х2 [4].
–£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Љ-–Я–УE2–° 1 –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ (–љ–∞–њ—А–Є–Љ–µ—А, –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–∞-1b –Є —Д–∞–Ї—В–Њ—А–∞ –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є –∞–ї—М—Д–∞), –≤ —В–Њ –ґ–µ –≤—А–µ–Љ—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ—Б–ї–µ–і–љ–Є—Е –ї–µ—В —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–Є –≥—А—Г–њ–њ—Л –Њ–Ї—Б–Є–Ї–∞–Љ–Њ–≤ (–љ–∞–њ—А–Є–Љ–µ—А, –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ) —Б–њ–Њ—Б–Њ–±–љ—Л –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М –Љ-–Я–УE2–° 1 –Є –Ј–∞ —Б—З–µ—В —Н—В–Њ–≥–Њ —Г–Љ–µ–љ—М—И–∞—В—М –≤—Л—А–∞–±–Њ—В–Ї—Г –Я–У–Х2 –њ—А–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–Є. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –≥–Њ–≤–Њ—А—П—В –Њ –љ–∞–ї–Є—З–Є–Є –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ –і–≤—Г—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –і–µ–є—Б—В–≤–Є—П —Г –Њ–Ї—Б–Є–Ї–∞–Љ–Њ–≤: –њ–µ—А–≤—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ, —Е–∞—А–∞–Ї—В–µ—А–љ—Л–є –Є –і–ї—П –і—А—Г–≥–Є—Е –Э–Я–Т–Я, –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є –љ–∞ –¶–Ю–У, –∞ –≤—В–Њ—А–Њ–є вАУ —Б–≤—П–Ј–∞–љ —Б –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Љ-–Я–УE2–° 1, –њ—А–Є–≤–Њ–і—П—Й–Є–Љ –Ї –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—О –Є–Ј–±—Л—В–Њ—З–љ–Њ–≥–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Я–У–Х2 [6]. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ, –Є–Љ–µ–љ–љ–Њ –љ–∞–ї–Є—З–Є–µ –і–≤—Г—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –і–µ–є—Б—В–≤–Є—П —Г –Њ–Ї—Б–Є–Ї–∞–Љ–Њ–≤ –Њ–±—К—П—Б–љ—П–µ—В –Є—Е –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –њ—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ, –љ–Є–Ј–Ї—Г—О —З–∞—Б—В–Њ—В—Г –Э–Ы–† —Б–Њ —Б—В–Њ—А–Њ–љ—Л –°–°–° –Є –њ–Њ—З–µ–Ї –њ—А–Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є –≤—Л—Б–Њ–Ї–Њ–є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є [7].
–Ф–∞–ї–µ–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ–Љ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–Њ–≤ –Є –Ї—А—Г–њ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ –Ї–Њ—В–Њ—А—Л—Е –Є–Ј—Г—З–∞–ї–∞—Б—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Э–Я–Т–Я.
–Э–µ–≥–∞—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Э–Я–Т–Я –љ–∞ –Ц–Ъ–Ґ
–Э–Ы–† —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ —П–≤–ї—П—О—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ–Є –Є —Е–Њ—А–Њ—И–Њ –Є–Ј—Г—З–µ–љ–љ—Л–Љ–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є, —А–∞–Ј–≤–Є–≤–∞—О—Й–Є–Љ–Є—Б—П –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –Э–Я–Т–Я [8]. –Ю–њ–Є—Б–∞–љ–Њ 2 –Њ—Б–љ–Њ–≤–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –љ–µ–≥–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –Э–Я–Т–Я –љ–∞ —Б–ї–Є–Ј–Є—Б—В—Г—О –Њ–±–Њ–ї–Њ—З–Ї—Г –ґ–µ–ї—Г–і–Ї–∞: –≤–Њ-–њ–µ—А–≤—Л—Е, –Љ–µ—Б—В–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–µ —В–µ–Љ, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Э–Я–Т–Я —П–≤–ї—П—О—В—Б—П –Ї–Є—Б–ї–Њ—В–∞–Љ–Є –Є –њ—А–Є –њ–Њ–њ–∞–і–∞–љ–Є–Є –≤ –ґ–µ–ї—Г–і–Њ–Ї –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М –њ—А—П–Љ–Њ–µ –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–µ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ —Н–њ–Є—В–µ–ї–Є–є –ґ–µ–ї—Г–і–Ї–∞; –≤–Њ-–≤—В–Њ—А—Л—Е, —Б–Є—Б—В–µ–Љ–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П —Б–Є–љ—В–µ–Ј–∞ –Я–У —З–µ—А–µ–Ј —Г–≥–љ–µ—В–µ–љ–Є–µ –¶–Ю–У [9].–Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –Я–У –Є–≥—А–∞—О—В –Њ—З–µ–љ—М –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Ј–∞—Й–Є—В–µ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –ґ–µ–ї—Г–і–Ї–∞ –Њ—В –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –њ—А–Є —Н—В–Њ–Љ –љ–∞–Є–±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л–Љ–Є –Я–У —П–≤–ї—П—О—В—Б—П –Я–У–Х2 –Є –Я–УI2, –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Ї–Њ—В–Њ—А—Л—Е –≤ –љ–Њ—А–Љ–µ —А–µ–≥—Г–ї–Є—А—Г–µ—В—Б—П –¶–Ю–У-1 –Є –¶–Ю–У-2. –С—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Н—В–Є –Я–У —А–µ–≥—Г–ї–Є—А—Г—О—В –≤—Л—А–∞–±–Њ—В–Ї—Г —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤ –ґ–µ–ї—Г–і–Ї–µ, —Б–µ–Ї—А–µ—Ж–Є—О –±–Є–Ї–∞—А–±–Њ–љ–∞—В–Њ–≤ –Є —Б–ї–Є–Ј–Є, –Ј–∞—Й–Є—Й–∞—О—Й–Є—Е —Б–ї–Є–Ј–Є—Б—В—Г—О –ґ–µ–ї—Г–і–Ї–∞ –Њ—В –љ–µ–≥–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л (—В–∞–±–ї. 1).
–Я—А–Є —Н—В–Њ–Љ –љ–µ–≥–∞—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Э–Я–Т–Я (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е) –љ–∞ –ґ–µ–ї—Г–і–Њ–Ї —Б–≤—П–Ј–∞–љ–Њ —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –≤—Л—А–∞–±–Њ—В–Ї–Є –Я–У–Х2 –Ј–∞ —Б—З–µ—В –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –¶–Ю–У-1, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Г—Б–Є–ї–µ–љ–Є–µ–Љ –≤—Л—А–∞–±–Њ—В–Ї–Є —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –≤—Л—А–∞–±–Њ—В–Ї–Є –≤–µ—Й–µ—Б—В–≤, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є—Е –≥–∞—Б—В—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ (–±–Є–Ї–∞—А–±–Њ–љ–∞—В—Л –Є —Б–ї–Є–Ј—М) (—А–Є—Б. 1).
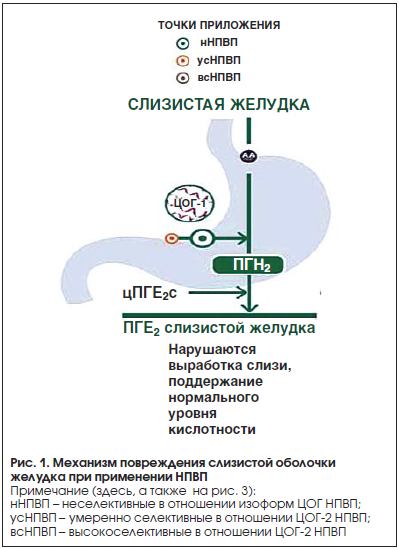
![–Ґ–∞–±–ї–Є—Ж–∞ 1. –Т–ї–Є—П–љ–Є–µ –Я–У –љ–∞ –ґ–µ–ї—Г–і–Њ–Ї [9] (—Б –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є) –Ґ–∞–±–ї–Є—Ж–∞ 1. –Т–ї–Є—П–љ–Є–µ –Я–У –љ–∞ –ґ–µ–ї—Г–і–Њ–Ї [9] (—Б –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є)](/upload/medialibrary/823/979-2.png)
–°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –¶–Ю–У-2 —Г—З–∞—Б—В–≤—Г–µ—В –≤ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –ґ–µ–ї—Г–і–Ї–∞, –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є–Є —П–Ј–≤–µ–љ–љ—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤ –≤ –ґ–µ–ї—Г–і–Ї–µ (–њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ —А–µ–≥—Г–ї–Є—А–Њ–≤–∞–љ–Є—П –≤—Л—А–∞–±–Њ—В–Ї–Є –Я–У–Х2, –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—О—Й–µ–≥–Њ —Б EP4-—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є), –Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б—Г–њ–µ—А—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2 –Љ–Њ–ґ–µ—В –Ј–∞–Љ–µ–і–ї—П—В—М –Ј–∞–ґ–Є–≤–ї–µ–љ–Є–µ —П–Ј–≤ –ґ–µ–ї—Г–і–Ї–∞, —З—В–Њ –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –Ј–∞–Ї–∞–љ—З–Є–≤–∞–µ—В—Б—П —В–∞–Ї–Є–Љ–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є, –Ї–∞–Ї –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ –Є–ї–Є –њ–µ—А—Д–Њ—А–∞—Ж–Є—П [9]. –Ф–∞–љ–љ—Л–µ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В, —З—В–Њ 1 –Є–Ј 600вАУ2400 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –Э–Я–Т–Я, –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А—Г–µ—В—Б—П –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А —Б –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ—Л–Љ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ–Љ –Є–ї–Є –њ–µ—А—Д–Њ—А–∞—Ж–Є–µ–є, –њ—А–Є —Н—В–Њ–Љ –Ї–∞–ґ–і—Л–є 10вАУ–є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–є –њ–∞—Ж–Є–µ–љ—В —Г–Љ–Є—А–∞–µ—В [10].
–Ф–∞–љ–љ—Л–µ –Ї—А—Г–њ–љ–Њ–Љ–∞—Б—И—В–∞–±–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –Є—Б–њ–∞–љ—Б–Ї–Є–Љ–Є —Г—З–µ–љ—Л–Љ–Є, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В–µ —А–∞–Ј–≤–Є—В–Є—П –Э–Ы–† —Б–Њ —Б—В–Њ—А–Њ–љ—Л –ґ–µ–ї—Г–і–Ї–∞ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –¶–Ю–У-2 –Э–Я–Т–Я [11]. –С—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–µ–њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Э–Я–Т–Я –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2 –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ–Њ–≤—Л—И–∞–ї–Њ —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А—М–µ–Ј–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –Ц–Ъ–Ґ (—Б–Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї (–Ю–†) 3,7; 95% –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ—Л–є –Є–љ—В–µ—А–≤–∞–ї (–Ф–Ш): 3,1вАУ4,3). –Э–∞—А—П–і—Г —Б —Н—В–Є–Љ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –¶–Ю–У-2 –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –≤—Л–Ј—Л–≤–∞–ї–Є —А–∞–Ј–≤–Є—В–Є–µ —В–∞–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (–Ю–† 2,6; 95% –Ф–Ш: 1,9вАУ3,6) [11]. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —Б–µ—А—М–µ–Ј–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤—Л—П–≤–ї–µ–љ –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –¶–Ю–У-2 вАУ —Н—В–Њ—А–Є–Ї–Њ–Ї—Б–Є–±–∞ (–Ю–† 12), –і–∞–ї–µ–µ —Б–ї–µ–і–Њ–≤–∞–ї–Є –љ–∞–њ—А–Њ–Ї—Б–µ–љ (–Ю–† 8,1) –Є –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ (–Ю–† 7,2), –љ–∞–њ—А–Њ—В–Є–≤, –љ–∞–Є–±–Њ–ї–µ–µ –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ–Є –Э–Я–Т–Я –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –Є–±—Г–њ—А–Њ—Д–µ–љ (–Ю–† 2), —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–± (–Ю–† 2,3) –Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ (–Ю–† 2,7) (—А–Є—Б. 2) [11]. –С–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї —Б–µ—А—М–µ–Ј–љ—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –Ц–Ъ–Ґ –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є —Н—В–Њ—А–Є–Ї–Њ–Ї—Б–Є–±–Њ–Љ, –≤–µ—А–Њ—П—В–љ–Њ, –Њ–±—К—П—Б–љ—П–µ—В—Б—П —В–µ–Љ, —З—В–Њ —Н—В–Њ—В –њ—А–µ–њ–∞—А–∞—В –љ–∞—А—Г—И–∞–µ—В –њ—А–Њ—Ж–µ—Б—Б –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—П —П–Ј–≤ –ґ–µ–ї—Г–і–Ї–∞ –Ј–∞ —Б—З–µ—В –љ–∞—А—Г—И–µ–љ–Є—П –≤—Л—А–∞–±–Њ—В–Ї–Є –Я–У–Х2 (—Б–≤—П–Ј–∞–љ–љ–Њ–≥–Њ —Б –¶–Ю–У-2), –Ї–Њ—В–Њ—А—Л–є, —Б–≤—П–Ј—Л–≤–∞—П—Б—М —Б –Х–†4, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –Ј–∞–ґ–Є–≤–ї–µ–љ–Є—О —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞.
![–†–Є—Б. 2. –°–Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї —Б–µ—А—М–µ–Ј–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –Ц–Ъ–Ґ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Э–Я–Т–Я –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–µ–њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Э–Я–Т–Я [11] –†–Є—Б. 2. –°–Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї —Б–µ—А—М–µ–Ј–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –Ц–Ъ–Ґ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Э–Я–Т–Я –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–µ–њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Э–Я–Т–Я [11]](/upload/medialibrary/154/979-3.png)
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Melero et al. –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Э–Я–Т–Я –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ, —З–µ–Љ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –¶–Ю–У-2, –≤—Л–Ј—Л–≤–∞—О—В —В—П–ґ–µ–ї—Л–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Ц–Ъ–Ґ [10]. –Ґ–∞–Ї, –Ю–† –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –±—Л–ї –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –∞—Ж–µ–Ї–ї–Њ—Д–µ–љ–∞–Ї–Њ–Љ (–њ—А–µ–њ–∞—А–∞—В —Б—А–∞–≤–љ–µ–љ–Є—П, –Ю–† 1) –Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–Њ–Љ (–Ю–† 1,3). –Э–∞–њ—А–Њ—В–Є–≤, –љ–∞–Є–±–Њ–ї—М—И–Є–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –≤—Л–Ј—Л–≤–∞–ї –Ї–µ—В–Њ—А–Њ–ї–∞–Ї (–Ю–† 14,9) [10].
–Я—А–µ–і—Б—В–∞–≤–ї—П—О—В –Є–љ—В–µ—А–µ—Б —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–µ—В–µ–≤–Њ–≥–Њ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞ Yang M. et al., –≤ –Ї–Њ—В–Њ—А–Њ–Љ –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ц–Ъ–Ґ —Г–Љ–µ—А–µ–љ–љ–Њ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2 (–љ–∞–±—Г–Љ–µ—В–Њ–љ, —Н—В–Њ–і–Њ–ї–∞–Ї –Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ) –Є –Ї–Њ–Ї—Б–Є–±–Њ–≤ (—Ж–µ–ї–µ–Ї–Њ–Ї—Б–Є–±, —Н—В–Њ—А–Є–Ї–Њ–Ї—Б–Є–±, –њ–∞—А–µ–Ї–Њ–Ї—Б–Є–± –Є –ї—Г–Љ–Є—А–∞–Ї–Њ–Ї—Б–Є–±) [12]. –Т –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л 36 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б –Њ–±—Й–Є–Љ —З–Є—Б–ї–Њ–Љ —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ 112 351, –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 36 –і–Њ 72 –ї–µ—В (–Љ–µ–і–Є–∞–љ–∞ 61,4 –≥–Њ–і–∞), –њ—А–Є —Н—В–Њ–Љ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤–∞—А—М–Є—А–Њ–≤–∞–ї–∞ –Њ—В 4 –і–Њ 156 –љ–µ–і. (–Љ–µ–і–Є–∞–љ–∞ 12 –љ–µ–і.). –С—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є —П–Ј–≤—Л –ґ–µ–ї—Г–і–Ї–∞ –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–Ї—Б–Є–±–Њ–≤ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 0,15% (95% –Ф–Ш: 0,05вАУ0,34), –∞ –≤ –≥—А—Г–њ–њ–µ —Г–Љ–µ—А–µ–љ–љ–Њ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2 вАУ 0,13% (95% –Ф–Ш: 0,04вАУ0,32), —А–∞–Ј–љ–Є—Ж–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–∞. –Э–∞—А—П–і—Г —Б —Н—В–Є–Љ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —П–Ј–≤—Л –ґ–µ–ї—Г–і–Ї–∞ –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–Ї—Б–Є–±–Њ–≤ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 0,18% (95% –Ф–Ш: 0,01вАУ0,74) –њ—А–Њ—В–Є–≤ 0,21% (95% –Ф–Ш: 0,04вАУ0,62) –≤ –≥—А—Г–њ–њ–µ —Г–Љ–µ—А–µ–љ–љ–Њ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤, —А–∞–Ј–љ–Є—Ж–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–∞. –Ґ–∞–Ї–ґ–µ –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –і–≤—Г–Љ—П –≥—А—Г–њ–њ–∞–Љ–Є –Э–Я–Т–Я –њ–Њ –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —П–Ј–≤ –ґ–µ–ї—Г–і–Ї–∞, –≤—Л—П–≤–ї–µ–љ–љ—Л—Е –Љ–µ—В–Њ–і–Њ–Љ –≥–∞—Б—В—А–Њ—Б–Ї–Њ–њ–Є–Є [12]. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Г—О —З–∞—Б—В–Њ—В—Г –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є (–Э–ѓ) –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е (—В–∞–±–ї. 2).
![–Ґ–∞–±–ї–Є—Ж–∞ 2. –Ф–∞–љ–љ—Л–µ —Б–µ—В–µ–≤–Њ–≥–Њ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є —Г–Љ–µ—А–µ–љ–љ–Њ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2 –Є –Ї–Њ–Ї—Б–Є–±–Њ–≤ [12] –Ґ–∞–±–ї–Є—Ж–∞ 2. –Ф–∞–љ–љ—Л–µ —Б–µ—В–µ–≤–Њ–≥–Њ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є —Г–Љ–µ—А–µ–љ–љ–Њ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2 –Є –Ї–Њ–Ї—Б–Є–±–Њ–≤ [12]](/upload/medialibrary/c43/979-4.png)
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —А–µ–Ј—Г–ї—М—В–∞—В—Л —Н—В–Њ–≥–Њ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Г—О –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ —Г–Љ–µ—А–µ–љ–љ–Њ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Э–Я–Т–Я –Є –Ї–Њ–Ї—Б–Є–±–Њ–≤.
–Я–Њ–Љ–Є–Љ–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –ґ–µ–ї—Г–і–Ї–∞ –Є –Ї–Є—И–µ—З–љ–Є–Ї–∞, –љ–∞ —Д–Њ–љ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Э–Я–Т–Я –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —А–∞–Ј–≤–Є—В–Є–µ –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є. –Я–Њ –і–∞–љ–љ—Л–Љ —А–∞–Ј–ї–Є—З–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —З–∞—Б—В–Њ—В–∞ –њ–Њ—А–∞–ґ–µ–љ–Є–є –њ–µ—З–µ–љ–Є, –≤—Л–Ј–≤–∞–љ–љ—Л—Е –Э–Я–Т–Я, —П–≤–ї—П–µ—В—Б—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –љ–µ–≤—Л—Б–Њ–Ї–Њ–є –Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ—В 1 –і–Њ 9 —Б–ї—Г—З–∞–µ–≤ –љ–∞ 100 —В—Л—Б. —З–µ–ї–Њ–≤–µ–Ї [13, 14]. –†–∞–Ј–ї–Є—З–љ—Л–µ —В–Є–њ—Л –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–µ—З–µ–љ–Є –Њ–њ–Є—Б–∞–љ—Л –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –і–ї—П –≤—Б–µ—Е –Э–Я–Т–Я, –њ—А–Є —Н—В–Њ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —А–µ–∞–Ї—Ж–Є–є –њ—А–Њ—В–µ–Ї–∞—О—В –≤ –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–є –Є–ї–Є –ї–µ–≥–Ї–Њ–є —Д–Њ—А–Љ–µ [15]. –У–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є, –≤—Л–Ј–≤–∞–љ–љ—Л–µ –Э–Я–Т–Я, –Љ–Њ–≥—Г—В –њ—А–Њ—П–≤–ї—П—В—М—Б—П –њ–Њ-—А–∞–Ј–љ–Њ–Љ—Г, –љ–∞–њ—А–Є–Љ–µ—А: –Є–±—Г–њ—А–Њ—Д–µ–љ –Љ–Њ–ґ–µ—В –≤—Л–Ј—Л–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ –Њ—Б—В—А–Њ–≥–Њ –≥–µ–њ–∞—В–Є—В–∞ –Є –і—Г–Ї—В–Њ–њ–µ–љ–Є–Є (–Є—Б—З–µ–Ј–∞—О—Й–Є–µ –ґ–µ–ї—З–љ—Л–µ –њ—А–Њ—В–Њ–Ї–Є); –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –љ–Є–Љ–µ—Б—Г–ї–Є–і–Њ–Љ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –Њ—Б—В—А–Њ–≥–Њ –≥–µ–њ–∞—В–Є—В–∞, —Е–Њ–ї–µ—Б—В–∞–Ј–∞; –Њ–Ї—Б–Є–Ї–∞–Љ—Л —Б–њ–Њ—Б–Њ–±–љ—Л –њ—А–Є–≤–Њ–і–Є—В—М –Ї –њ–Њ—П–≤–ї–µ–љ–Є—О –Њ—Б—В—А–Њ–≥–Њ –≥–µ–њ–∞—В–Є—В–∞, –≥–µ–њ–∞—В–Њ–љ–µ–Ї—А–Њ–Ј–∞, —Е–Њ–ї–µ—Б—В–∞–Ј–∞ –Є –і—Г–Ї—В–Њ–њ–µ–љ–Є–Є [16].
–Ф–ї—П –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Э–Я–Т–Я —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –њ—А—П–Љ–∞—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Љ–µ–ґ–і—Г –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є –≤–µ–ї–Є—З–Є–љ–Њ–є –і–Њ–Ј—Л –Є —А–Є—Б–Ї–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–µ—З–µ–љ–Є. –Ґ–∞–Ї, –≤ —А–∞–±–Њ—В–µ Donati M. et al. –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї—Б—П —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В—А–Њ–≥–Њ —Б–µ—А—М–µ–Ј–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–µ—З–µ–љ–Є –љ–∞ —Д–Њ–љ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е –Э–Я–Т–Я [17]. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –Љ–µ–љ–µ–µ 15 –і–љ–µ–є –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–µ—З–µ–љ–Є –≤—Л–Ј—Л–≤–∞–ї–Є –љ–Є–Љ–µ—Б—Г–ї–Є–і –Є –њ–∞—А–∞—Ж–µ—В–∞–Љ–Њ–ї (—Б–Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Њ—В–љ–Њ—И–µ–љ–Є–µ —И–∞–љ—Б–Њ–≤ (–Ю–®) 1,89 –Є 2,66 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ). –†–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є –≤ —Б–ї—Г—З–∞–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Э–Я–Т–Я (–±–Њ–ї–µ–µ 30 –і–љ–µ–є) –њ–Њ–≤—Л—И–∞–ї—Б—П —Г —А—П–і–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –±–Њ–ї–µ–µ —З–µ–Љ –≤ 8 —А–∞–Ј (—В–∞–±–ї. 3).
![–Ґ–∞–±–ї–Є—Ж–∞ 3. –†–Є—Б–Ї –Њ—Б—В—А–Њ–≥–Њ —Б–µ—А—М–µ–Ј–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–µ—З–µ–љ–Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Э–Я–Т–Я [17] –Ґ–∞–±–ї–Є—Ж–∞ 3. –†–Є—Б–Ї –Њ—Б—В—А–Њ–≥–Њ —Б–µ—А—М–µ–Ј–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–µ—З–µ–љ–Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Э–Я–Т–Я [17]](/upload/medialibrary/84a/979-5.png)
–Э–µ–≥–∞—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Э–Я–Т–Я –љ–∞ –°–°–°
–Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ (–Р–°–Ъ) –≤ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј–∞—Е –Њ–±–ї–∞–і–∞–µ—В –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ, —Г–Љ–µ–љ—М—И–∞—П —З–∞—Б—В–Њ—В—Г –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –°–°–° –Є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –Є –≤ —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –њ–Њ–≤—Б–µ–Љ–µ—Б—В–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞, –Є–љ—Б—Г–ї—М—В–∞ –Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–Є [18]. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Р–°–Ъ –Љ–љ–Њ–≥–Є–µ –Э–Я–Т–Я –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М –љ–µ–≥–∞—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –°–°–°, —З—В–Њ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П —Г—Е—Г–і—И–µ–љ–Є–µ–Љ —В–µ—З–µ–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–µ–є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –Є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є [8].–≠—В–Є –љ–µ–≥–∞—В–Є–≤–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –≤–ї–Є—П–љ–Є–µ–Љ –Э–Я–Т–Я –љ–∞ —Д—Г–љ–Ї—Ж–Є—О —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –Є —Н–љ–і–Њ—В–µ–ї–Є—П. –Т –љ–Њ—А–Љ–µ –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –∞–≥—А–µ–≥–∞—Ж–Є–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –Є–≥—А–∞–µ—В —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –Љ–µ–ґ–і—Г –њ—А–Њ—Б—В–∞—Ж–Є–Ї–ї–Є–љ–Њ–Љ (–Я–УI2) –Є —В—А–Њ–Љ–±–Њ–Ї—Б–∞–љ–Њ–Љ –Р2, –њ—А–Є —Н—В–Њ–Љ –Я–УI2 —П–≤–ї—П–µ—В—Б—П –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–Љ –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–Њ–Љ, –∞ —В—А–Њ–Љ–±–Њ–Ї—Б–∞–љ –Р2, –љ–∞–њ—А–Њ—В–Є–≤, —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –∞–≥—А–µ–≥–∞—Ж–Є—О —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤. –Я—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2 –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ—Б—В–∞—Ж–Є–Ї–ї–Є–љ–∞, –≤ —В–Њ –ґ–µ –≤—А–µ–Љ—П —В—А–Њ–Љ–±–Њ–Ї—Б–∞–љ –Р2 –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞—В—М—Б—П (–њ—А–Њ—Ж–µ—Б—Б –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ—В –¶–Ю–У-1), —З—В–Њ –≤ –Є—В–Њ–≥–µ –њ—А–Є–≤–Њ–і–Є—В –Ї –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є —Г—Б–Є–ї–µ–љ–љ–Њ–є –∞–≥—А–µ–≥–∞—Ж–Є–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ [8] (—А–Є—Б. 3).
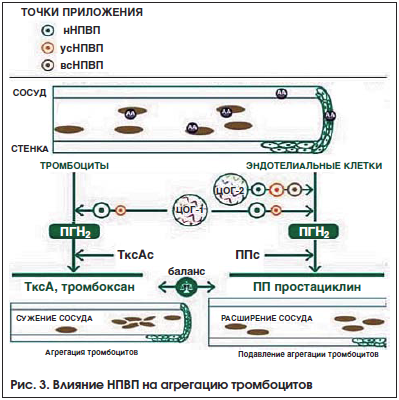
–°–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –і–∞–љ–љ–Њ–≥–Њ —Д–µ–љ–Њ–Љ–µ–љ–∞ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ –≤ —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–Њ–≤. –Ґ–∞–Ї, –≤ —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ –Њ–±–Ј–Њ—А–µ –Є –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–µ 42 –Њ–±—Б–µ—А–≤–∞—Ж–Є–Њ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —В–∞–Ї–Є–µ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –¶–Ю–У-2, –Ї–∞–Ї —Н—В–Њ–і–Њ–ї–∞–Ї –Є —Н—В–Њ—А–Є–Ї–Њ–Ї—Б–Є–±, –≤ –љ–∞–Є–±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –њ–Њ–≤—Л—И–∞–ї–Є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ (–Ю–† 1,55 –Є 1,97 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ) [19]. –Э–∞–њ—А–Њ—В–Є–≤, –љ–∞–њ—А–Њ–Ї—Б–µ–љ, —Ж–µ–ї–µ–Ї–Њ–Ї—Б–Є–±, –Є–±—Г–њ—А–Њ—Д–µ–љ –Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –њ–Њ–≤—Л—И–∞–ї–Є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –°–°–°.
–Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–ї—Г—З–µ–љ—Л –≤ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–µ 19 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ–Њ–Љ –≤ 2015 –≥. [7]. –Т —Б–≤–Њ–µ–є —А–∞–±–Њ—В–µ Asghar et al. —Г—Б—В–∞–љ–Њ–≤–Є–ї–Є, —З—В–Њ —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і—Ж–∞ (–Ї–Њ–і—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є I20-25, I46-52 —Б–Њ–≥–ї–∞—Б–љ–Њ –Ь–Ъ–С-10) –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї—Б—П –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –Є–±—Г–њ—А–Њ—Д–µ–љ–Њ–Љ (–Ю–† 1,03; 95% –Ф–Ш: 0,95вАУ1,11), –љ–∞–њ—А–Њ–Ї—Б–µ–љ–Њ–Љ (–Ю–† 1,10; 95% –Ф–Ш: 0,98вАУ1,23) –Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–Њ–Љ (–Ю–† 1,13; 95% –Ф–Ш: 0,98вАУ1,32) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ —В–µ—А–∞–њ–Є–Є –Э–Я–Т–Я. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–± (–Ю–† 1,46; 95% –Ф–Ш: 1,10вАУ1,93) –Є –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ (–Ю–† 1,47; 95% –Ф–Ш: 0,90вАУ2,4) —Г–≤–µ–ї–Є—З–Є–≤–∞–ї–Є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —В–∞–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є [7]. –Т —А–∞–Љ–Ї–∞—Е –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є–Ј—Г—З–∞–ї–Њ—Б—М –≤–ї–Є—П–љ–Є–µ –і–Њ–Ј–Є—А–Њ–≤–Ї–Є –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (–Ї–Ю–†), –Ї–Њ—В–Њ—А—Л–є —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї—Б—П –Ї–∞–Ї —Б—Г–Љ–Љ–∞ —А–Є—Б–Ї–Њ–≤ —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і—Ж–∞, —Б–Њ—Б—Г–і–Њ–≤ –Є –њ–Њ—З–µ–Ї. –Ю–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –Ї–Ю–† –љ–µ –≤–Њ–Ј—А–∞—Б—В–∞–ї –ї–Є—И—М –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј–Є—А–Њ–≤–Њ–Ї –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ (15 –Љ–≥/—Б—Г—В) –Є –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ–∞ (100вАУ200 –Љ–≥/—Б—Г—В) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–Є–Ј–Ї–Є–Љ–Є –і–Њ–Ј–∞–Љ–Є. –Э–∞–њ—А–Њ—В–Є–≤, –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј–Є—А–Њ–≤–Њ–Ї —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–±–∞ (–±–Њ–ї–µ–µ 25 –Љ–≥/—Б—Г—В) –Ї–Ю–† –≤–Њ–Ј—А–∞—Б—В–∞–ї –±–Њ–ї–µ–µ —З–µ–Љ –≤ 4 —А–∞–Ј–∞ (—Б 1,63 –і–Њ 6,63). –Т –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –і–Њ–Ј–Є—А–Њ–≤–Ї–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Њ —А–Њ—Б—В—Г –Ї–Ю–† –љ–∞ —Д–Њ–љ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–±—Г–њ—А–Њ—Д–µ–љ–∞ (1,03 [вЙ§1200 –Љ–≥/—Б—Г—В] –њ—А–Њ—В–Є–≤ 1,72 [1200вАУ2400 –Љ–≥/—Б—Г—В]) –Є –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ (1,17 [100 –Љ–≥/—Б—Г—В] –њ—А–Њ—В–Є–≤ 1,83 [150вАУ300 –Љ–≥/—Б—Г—В]). –†–µ–Ј—О–Љ–Є—А—Г—П —А–µ–Ј—Г–ї—М—В–∞—В—Л –і–∞–љ–љ–Њ–≥–Њ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞, –Љ–Њ–ґ–љ–Њ —Б–і–µ–ї–∞—В—М –≤—Л–≤–Њ–і, —З—В–Њ —Б—А–µ–і–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2 –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –±–µ–Ј–Њ–њ–∞—Б–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ [7].
–Э–∞—А—П–і—Г —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ –Э–Я–Т–Я —Б–њ–Њ—Б–Њ–±–љ—Л –њ—А–Є–≤–Њ–і–Є—В—М –Ї —А–∞–Ј–≤–Є—В–Є—О –Є–ї–Є —Г—Е—Г–і—И–∞—В—М —В–µ—З–µ–љ–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–•–°–Э). –Ґ–∞–Ї, –і–∞–љ–љ—Л–µ –Ї—А—Г–њ–љ–Њ–Љ–∞—Б—И—В–∞–±–љ–Њ–≥–Њ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2 –Є –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л ¬Ђ—В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е¬ї –Э–Я–Т–Я (—В–∞–Ї–Є—Е –Ї–∞–Ї –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї, –Є–±—Г–њ—А–Њ—Д–µ–љ –Є –љ–∞–њ—А–Њ–Ї—Б–µ–љ) –≤ 1,9вАУ2,5 —А–∞–Ј–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ –њ–Њ–≤—Л—И–∞–ї–Є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –њ–Њ –њ—А–Є—З–Є–љ–µ —Г—Е—Г–і—И–µ–љ–Є—П —В–µ—З–µ–љ–Є—П –•–°–Э [20].
–Ю–±—А–∞—Й–∞—О—В –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї—А—Г–њ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —В–Є–њ–∞ ¬Ђ—Б–ї—Г—З–∞–є вАУ –Ї–Њ–љ—В—А–Њ–ї—М¬ї, –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤ 2016 –≥. –≤ –С—А–Є—В–∞–љ—Б–Ї–Њ–Љ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–Љ –ґ—Г—А–љ–∞–ї–µ [21]. –С—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Э–Я–Т–Я –≤ —В–µ—З–µ–љ–Є–µ –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–Є—Е 14 –і–љ–µ–є –њ–Њ–≤—Л—И–∞–ї–Њ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –њ–Њ –њ—А–Є—З–Є–љ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –•–°–Э –љ–∞ 19%. –Э–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –љ–∞–±–ї—О–і–∞–ї—Б—П –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –Ї–µ—В–Њ—А–Њ–ї–∞–Ї–Њ–Љ (–Ю–† 1,83), —Н—В–Њ—А–Є–Ї–Њ–Ї—Б–Є–±–Њ–Љ (–Ю–† 1,51), –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ–Њ–Љ (–Ю–† 1,51), –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –љ–∞ —Д–Њ–љ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Н—В–Њ–і–Њ–ї–∞–Ї–∞, —Ж–µ–ї–µ–Ї–Њ–Ї—Б–Є–±–∞, –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ –Є –∞—Ж–µ–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ —А–Є—Б–Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –•–°–Э –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –≤–Њ–Ј—А–∞—Б—В–∞–ї [21].
–°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –љ–µ–≥–∞—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Э–Я–Т–Я –љ–∞ —В–µ—З–µ–љ–Є–µ –•–°–Э –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П (–Ј–∞ —Б—З–µ—В –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—Ж–Є–Є), –Ј–∞–і–µ—А–ґ–Ї–Њ–є –љ–∞—В—А–Є—П –Є –≤–Њ–і—Л (—З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –Њ–±—К–µ–Љ–∞ —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–µ–є –Ї—А–Њ–≤–Є –Є –њ–Њ–≤—Л—И–µ–љ–Є—О –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П) [8].
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —А—П–і–∞ –Э–Я–Т–Я, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –≤—Л—Б–Њ–Ї–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Є–љ—Б—Г–ї—М—В–∞. –Ґ–∞–Ї, —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є–є –Њ–±–Ј–Њ—А –Є –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј –Њ–±—Б–µ—А–≤–∞—Ж–Є–Њ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–є –≤ 2011 –≥., –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–Є—Б–Ї–∞ –Є–љ—Б—Г–ї—М—В–∞ –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–±–Њ–Љ (–Ю–† 1,64; 95% –Ф–Ш: 1,15вАУ2,33) –Є –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–Њ–Љ (–Ю–† 1,27; 95% –Ф–Ш: 1,08вАУ1,48) [22]. –Я—А–Є —Н—В–Њ–Љ –ї–µ—З–µ–љ–Є–µ –љ–∞–њ—А–Њ–Ї—Б–µ–љ–Њ–Љ, –Є–±—Г–њ—А–Њ—Д–µ–љ–Њ–Љ –Є —Ж–µ–ї–µ–Ї–Њ–Ї—Б–Є–±–Њ–Љ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–ї–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —А–Є—Б–Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Є–љ—Б—Г–ї—М—В–∞ [22].
–Т –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Haag et al. –њ—А–Є–љ—П–ї–Є —Г—З–∞—Б—В–Є–µ 7636 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 70,2 –≥–Њ–і–∞), —Г –Ї–Њ—В–Њ—А—Л—Е –љ–∞ –Љ–Њ–Љ–µ–љ—В –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–µ –±—Л–ї–Њ —Г–Ї–∞–Ј–∞–љ–Є–є –љ–∞ –Є—И–µ–Љ–Є—О –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ [23]. –Ч–∞ –±–Њ–ї–µ–µ —З–µ–Љ 10-–ї–µ—В–љ–Є–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П 807 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–µ—А–µ–љ–µ—Б–ї–Є –Є–љ—Б—Г–ї—М—В (460 вАУ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–є, 74 вАУ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є –Є 273 вАУ –љ–µ—Г—В–Њ—З–љ–µ–љ–љ—Л–є), –њ—А–Є —Н—В–Њ–Љ —Г –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Э–Я–Т–Я –Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –¶–Ю–У-2 —А–Є—Б–Ї –Є–љ—Б—Г–ї—М—В–∞ –±—Л–ї –≤—Л—И–µ (–Ю–† 1,72 –Є 2,75 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –¶–Ю–У-1 (–Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ, –њ–Є—А–Њ–Ї—Б–Є–Ї–∞–Љ, –Ї–µ—В–Њ–њ—А–Њ—Д–µ–љ, —Д–ї—Г–±–Є–њ—А–Њ—Д–µ–љ –Є –∞–њ–∞–Ј–Њ–љ) [23]. –°–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї –Є–љ—Б—Г–ї—М—В–∞ —Б—А–µ–і–Є –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Э–Я–Т–Я –±—Л–ї –≤—Л—П–≤–ї–µ–љ —Г –љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞ (–Ю–† 2,63; 95% –Ф–Ш: 1,47вАУ4,72), –∞ —Б—А–µ–і–Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2 –љ–∞–Є–±–Њ–ї–µ–µ –љ–µ–±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Є–љ—Б—Г–ї—М—В–∞ –±—Л–ї —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–± (–Ю–† 3,38; 95% –Ф–Ш: 1,48вАУ7,74) [23]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤ –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2 —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —З–∞—Й–µ, —З–µ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –і—А—Г–≥–Є—Е –Э–Я–Т–Я, –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–≤–Є—В–Є—О –Є–љ—Б—Г–ї—М—В–∞.
–Э–µ–≥–∞—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Э–Я–Т–Я –љ–∞ —Д—Г–љ–Ї—Ж–Є—О –њ–Њ—З–µ–Ї
–Э–µ—Д—А–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Њ–є –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –Э–Ы–†, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є—Е –љ–∞ —Д–Њ–љ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Э–Я–Т–Я, –њ—А–Є —Н—В–Њ–Љ –≤ –°–®–Р –µ–ґ–µ–≥–Њ–і–љ–Њ —Г 2,5 –Љ–ї–љ —З–µ–ї–Њ–≤–µ–Ї —А–µ–≥–Є—Б—В—А–Є—А—Г–µ—В—Б—П –љ–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л [24].–Ґ–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –Э–Я–Т–Я –љ–∞ –њ–Њ—З–Ї–Є –Љ–Њ–ґ–µ—В –њ—А–Њ—П–≤–ї—П—В—М—Б—П –≤ –≤–Є–і–µ –њ—А–µ—А–µ–љ–∞–ї—М–љ–Њ–є –∞–Ј–Њ—В–µ–Љ–Є–Є, –≥–Є–њ–Њ—А–µ–љ–Є–љ–Њ–≤–Њ–≥–Њ –≥–Є–њ–Њ–∞–ї—М–і–Њ—Б—В–µ—А–Њ–љ–Є–Ј–Љ–∞, –Ј–∞–і–µ—А–ґ–Ї–Є –љ–∞—В—А–Є—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є, –Њ—Б—В—А–Њ–≥–Њ –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ–Њ–≥–Њ –љ–µ—Д—А–Є—В–∞ –Є –љ–µ—Д—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ [18]. –Ю—Б–љ–Њ–≤–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї —Б–ї—Г–ґ–Є—В –≤–ї–Є—П–љ–Є–µ –Э–Я–Т–Я –љ–∞ —Б–Є–љ—В–µ–Ј —А—П–і–∞ –Я–У. –Ю–і–љ–Є–Љ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –Я–У, —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є—Е —Д—Г–љ–Ї—Ж–Є—О –њ–Њ—З–µ–Ї, —П–≤–ї—П–µ—В—Б—П –Я–У–Х2, –Ї–Њ—В–Њ—А—Л–є, –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—П —Б —А–µ—Ж–µ–њ—В–Њ—А–Њ–Љ –Х–†1, —Г–≥–љ–µ—В–∞–µ—В —А–µ–∞–±—Б–Њ—А–±—Ж–Є—О Na+ –Є –≤–Њ–і—Л –≤ —Б–Њ–±–Є—А–∞—В–µ–ї—М–љ–Њ–Љ –њ—А–Њ—В–Њ–Ї–µ, —В. –µ. –Њ–±–ї–∞–і–∞–µ—В –љ–∞—В—А–Є–є—Г—А–µ—В–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —А–µ—Ж–µ–њ—В–Њ—А –Х–†3 —Г—З–∞—Б—В–≤—Г–µ—В –≤ –Ј–∞–і–µ—А–ґ–Ї–µ –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –≤–Њ–і—Л –Є —Е–ї–Њ—А–Є–і–∞ –љ–∞—В—А–Є—П –≤ –њ–Њ—З–Ї–∞—Е, –∞ –Х–†4 —А–µ–≥—Г–ї–Є—А—Г–µ—В –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї—Г –≤ –њ–Њ—З–µ—З–љ—Л—Е –Ї–ї—Г–±–Њ—З–Ї–∞—Е [25]. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ—А–Њ—Б—В–∞—Ж–Є–Ї–ї–Є–љ —А–∞—Б—И–Є—А—П–µ—В –∞—А—В–µ—А–Є–Њ–ї—Л –њ–Њ—З–µ–Ї, –∞ —В—А–Њ–Љ–±–Њ–Ї—Б–∞–љ –Р2, –љ–∞–њ—А–Њ—В–Є–≤, –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —Б–Њ—Б—Г–і–Њ—Б—Г–ґ–Є–≤–∞—О—Й–Є–є —Н—Д—Д–µ–Ї—В –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ї–∞–њ–Є–ї–ї—П—А–Њ–≤ –Ї–ї—Г–±–Њ—З–Ї–∞, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О —Б–Ї–Њ—А–Њ—Б—В–Є –Ї–ї—Г–±–Њ—З–Ї–Њ–≤–Њ–є —Д–Є–ї—М—В—А–∞—Ж–Є–Є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –≤—Л—А–∞–±–Њ—В–Ї–Є –Я–У–Х2 –Є –њ—А–Њ—Б—В–∞—Ж–Є–Ї–ї–Є–љ–∞, –≤—Л–Ј–≤–∞–љ–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Э–Я–Т–Я, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –њ—А–Є—В–Њ–Ї–∞ –Ї—А–Њ–≤–Є –Ї –њ–Њ—З–Ї–∞–Љ, –њ—А–Є–≤–Њ–і–Є—В –Ї –Ј–∞–і–µ—А–ґ–Ї–µ –љ–∞—В—А–Є—П –Є –≤–Њ–і—Л.
–Т —Ж–µ–ї–Њ–Љ —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Ї–∞–Ї —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ, —В–∞–Ї –Є –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Э–Я–Т–Я —Б–њ–Њ—Б–Њ–±–љ—Л –≤—Л–Ј—Л–≤–∞—В—М –Њ—Б—В—А–Њ–µ –љ–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї [26вАУ28], –њ–Њ–Љ–Є–Љ–Њ —Н—В–Њ–≥–Њ, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Э–Я–Т–Я —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ–і–љ–Њ–є –Є–Ј –њ—А–Є—З–Є–љ —А–∞–Ј–≤–Є—В–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–•–Я–Э) [18]. –†–µ–Ј—Г–ї—М—В–∞—В—Л 2-—Е —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≥–Њ–≤–Њ—А—П—В –Њ —В–Њ–Љ, —З—В–Њ –Ю–† –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –•–Я–Э –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –Э–Я–Т–Я —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ—В 2 –і–Њ 8 [29, 30].
–Т –Ї—А—Г–њ–љ–Њ–Љ–∞—Б—И—В–∞–±–љ–Њ–Љ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –≤ –°–®–Р —Б —Г—З–∞—Б—В–Є–µ–Љ –±–Њ–ї–µ–µ 350 —В—Л—Б. –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є–Ј—Г—З–∞–ї–Њ—Б—М –≤–ї–Є—П–љ–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –Э–Я–Т–Я –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ –Њ—Б—В—А–Њ–≥–Њ –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї (–Њ–њ—А–µ–і–µ–ї—П–ї–Њ—Б—М –њ—А–Є—А–Њ—Б—В–Њ–Љ —Г—А–Њ–≤–љ—П –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 50%) [31]. –С—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Э–Я–Т–Я —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ –Њ—Б—В—А–Њ–≥–Њ –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї (—Б–Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–∞–љ–љ—Л–є –Ю–† 1,82; 95% –Ф–Ш: 1,68вАУ1,98) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–µ–њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л. –†–Є—Б–Ї –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–Њ—З–µ–Ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤–∞—А—М–Є—А–Њ–≤–∞–ї –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Э–Я–Т–Я, –њ—А–Є —Н—В–Њ–Љ —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –≤–Њ–Ј—А–∞—Б—В–∞–ї–∞ —Б —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –µ–≥–Њ —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –¶–Ю–У-2. –Э–∞–њ—А–Є–Љ–µ—А, —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–± (–Ю–† 0,95), —Ж–µ–ї–µ–Ї–Њ–Ї—Б–Є–± (–Ю–† 0,96) –Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ (–Ю–† 1,13) –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–ї–Є –љ–µ–≥–∞—В–Є–≤–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —Д—Г–љ–Ї—Ж–Є—О –њ–Њ—З–µ–Ї, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ (–Ю–† 1,94), –Ї–µ—В–Њ—А–Њ–ї–∞–Ї (–Ю–† 2,07), –Є–±—Г–њ—А–Њ—Д–µ–љ (–Ю–† 2,25) –Є –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –Р–°–Ъ (–Ю–† 3,64) –Ј–љ–∞—З–Є–Љ–Њ –њ–Њ–≤—Л—И–∞–ї–Є —А–Є—Б–Ї –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї [31]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤–ї–Є—П–љ–Є—П —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2 –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ –Њ—Б—В—А–Њ–≥–Њ –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї [31].
–Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї —Б–ї–µ–і—Г–µ—В –Є–Ј–±–µ–≥–∞—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Ї–∞–Ї –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Э–Я–Т–Я –≤ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј–∞—Е, —В–∞–Ї –Є —Б—Г–њ–µ—А—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2, –Ї–Њ—В–Њ—А—Л–µ —В–∞–Ї–ґ–µ –Љ–Њ–≥—Г—В –≤—Л–Ј—Л–≤–∞—В—М –љ–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї.












