Мы постарались изложить здесь основные положения, сформулированные в методических рекомендациях и руководствах российских, западноевропейских и североамериканских организаций, посвященных первичной профилактике сердечно-сосудистых заболеваний (ССЗ), в т. ч. инсульта.
Повышенный индекс массы тела (ИМТ) ≥25 кг/м2 связан с возрастанием риска инсульта в связи с увеличением частоты АГ и сахарного диабета (СД) (ESO, 2008). У пациентов, имеющих ожирение (ИМТ ≥30 кг/м2), также часто развивается атерогенная дислипидемия (ДЛП). На фоне увеличения веса в крови повышается концентрация триглицеридов (ТГ) и снижается уровень ХС липопротеидов высокой плотности (ЛПВП). Параллельно с ростом массы тела увеличивается высвобождение свободных жирных кислот (ЖК) из адипоцитов в портальный кровоток, что сопровождается повышением синтеза липопротеидов очень низкой плотности (ЛПОНП) в печени. Этот процесс поддерживается низкой активностью периферической липопротеидлипазы, не способной полноценно расщеплять липопротеидные частицы, богатые ТГ. При этом содержание ОХС может длительно находиться в пределах нормативных значений. Увеличение массы тела на каждые 10% сопровождается повышением уровня ОХС в плазме крови на 0,3 ммоль/л.
Особую актуальность эти нарушения приобретают у женщин, поскольку ССЗ остаются у них основной причиной смерти. ДЛП у женщин широко распространена, поскольку они на протяжении всей жизни испытывают регулярные гормональные изменения, которые влияют на метаболизм липопротеидов. С момента наступления менопаузы отмечается сдвиг липидного профиля в сторону повышения ОХС и развития атерогенной ДЛП. Хотя заместительная гормональная терапия некоторое время назад ассоциировалась с благоприятным состоянием липидного обмена, но последующие исследования показали, что она не только не уменьшает риск развития ССЗ, но может провоцировать другие болезни. Женщины в период менопаузы в отличие от мужчин часто имеют высокий базовый уровень ХС ЛПВП, однако следует осознавать, что это может маскировать риск, связанный с высоким уровнем ХС ЛПНП и ЛПОНП. Поэтому контроль за состоянием липидного обмена у женщин имеет не меньшее значение, чем у мужчин, а своевременная коррекция ДЛП им также необходима [11, 16].
Особенно заметные проатерогенные нарушения в системе липидного транспорта в виде гипертриглицеридемии и повышения концентрации апо-В отмечены при абдоминальном типе ожирения в большинстве популяций мира [8, 15]. На протяжении последних 50 лет среднестатистический взрослый человек среднего возраста имеет абдоминальное ожирение, обусловленное избыточным потреблением легкоусвояемых углеводов. Этот тип ожирения, как правило, связан с наличием инсулинорезистентности в сочетании с дефицитом секреции инсулина. Абдоминальное ожирение диагностируется методом измерения окружности талии, если у мужчины она превышает 102 см, а у женщины 88 см. По сравнению с подкожным абдоминальный жир метаболически более активен и представлен гипертрофированными инсулинорезистентными адипоцитами. В основе связи абдоминального ожирения с атерогенезом лежит не только атерогенная ДЛП, но и часто сопутствующие ожирению АГ, инсулинорезистентность и другие обменные нарушения, которые нередко обозначают как метаболический синдром.
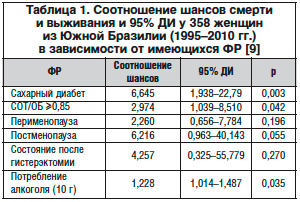
V. Colpani и соавт. использовали для оценки абдоминального ожирения у женщин соотношение окружности талии (СОТ) и бедер (ОБ), считая, что число более 0,85 свидетельствует о центральном отложении жира. Авторы обнаружили достоверную взаимосвязь с увеличением смертности от ССЗ наличия сахарного диабета (СД), абдоминального ожирения по соотношению окружности талии и окружности бедер (СОТ/ОБ) и увеличенного потребления алкоголя, в то время как взаимосвязь с физиологическим или хирургическим прекращением менструальной функции оказалась недостоверной (табл. 1).
Необходимо помнить о том, что ряд лекарственных средств, широко используемых для лечения АГ, способны вызывать появление или обострение уже имеющихся гиперлипидемических расстройств:
- Тиазидные диуретики (хлорталидон или гидрохлоротиазид) при длительном применении могут умеренно повысить уровни ТГ, ХС ЛПОНП и ХС ЛПНП. Они не влияют на уровень ХС ЛПВП. Однако у больных СД атерогенный эффект тиазидных диуретиков может быть более выраженным и включать в себя снижение уровня ХС ЛПВП.
- β-адреноблокаторы (БАБ) без внутренней симпатомиметической активности при длительном применении могут повысить уровень ТГ на 15–30% за счет усиленного образования ЛПОНП и снизить концентрацию ХС ЛПВП на 6–8%. БАБ более заметно влияют на уровень ТГ у пациентов с уже имеющейся гипертриглицеридемией. БАБ с внутренней симпатомиметической активностью не оказывают существенного влияния на уровни ТГ и ХС ЛПВП. Длительная терапия неселективными классическими БАБ (пропранолол), как и некоторыми селективными БАБ (атенолол), может повысить уровни атерогенных фракций липидов крови и снизить уровень ХС ЛПВП.
- Напротив, спиронолактон и индапамид не влияют на метаболизм липидов и углеводов, даже у больных СД. Антагонисты кальция не оказывают влияния на липидный профиль плазмы крови. Ингибиторы ангиотензинпревращающего фермента (иАПФ) нейтральны в отношении липидов плазмы или в незначительной степени могут снижать уровни ОХС и ТГ у больных СД.
- Блокаторы рецепторов ангиотензина-II (БРА) метаболически нейтральны по влиянию на липидный спектр крови [2].
В настоящее время нет доказательной базы клинических исследований, свидетельствующих о снижении риска инсульта при нормализации массы тела. Тем не менее, с учетом взаимосвязи ожирения с АГ, ДЛП, метаболическими расстройствами, необходимо достижение нормализации ИМТ.
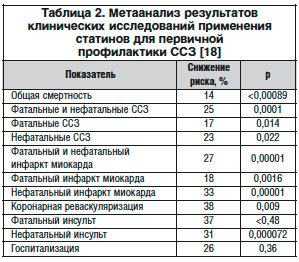
С целью коррекции уровня холестерина в крови помимо соблюдения гипохолестеринемической диеты рекомендуется прием препаратов, снижающих уровень ХС в крови. Существует значительное количество липидкорригирующих медикаментозных средств, к ним относятся ингибиторы ГМГ-КоА-редуктазы (статины), фибраты, никотиновая кислота, секвестранты желчных кислот, ω-3 полиненасыщенные жирные кислоты (ПНЖК), антиоксиданты. На сегодняшний день наиболее доказанной является эффективность статинов. Отметим, однако, что многочисленные клинические исследования выявили достоверно больший эффект статинов для профилактики инфаркта миокарда по сравнению с инсультом (табл. 2) [8, 18].
Статины являются структурными ингибиторами ГМГ-КоА-редуктазы – основного фермента, регулирующего биосинтез холестерина в гепатоцитах. В результате снижения внутриклеточного содержания ХС печеночная клетка увеличивает количество мембранных рецепторов к ЛПНП на своей поверхности. Рецепторы распознают, связывают и выводят из кровотока атерогенные частицы ЛПНП и таким образом снижают концентрацию ХС в крови.
Наряду с гиполипидемическим действием статины обладают плейотропными эффектами. В частности, они улучшают функцию эндотелия, снижают уровень С-реактивного протеина – маркера воспалительной реакции в сосудистой стенке, подавляют агрегацию тромбоцитов, ослабляют пролиферативную активность гладкомышечных клеток сосудистой стенки.
Статины различают по способу их получения. Так, ловастатин, симвастатин и правастатин являются природно-синтезированными соединениями, получаемыми из продуктов жизнедеятельности некоторых видов грибков, в то время как флувастатин, аторвастатин и розувастатин представляют собой синтезированные препараты. В России зарегистрированы оригинальные статины, а также большое количество дженерических препаратов.
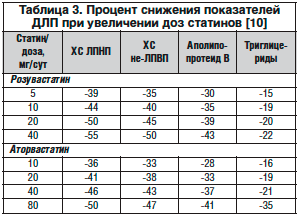
Статины наиболее эффективно снижают уровень ХС ЛПНП. В зависимости от дозы препарата снижают уровень данного липопротеина до 65%, при этом действие на уровень ХС ЛПНП является дозозависимым (табл. 3). Каждое удвоение дозы приводит к дополнительному снижению уровня ХС ЛПНП на 6% (правило 6 процентов). Статины в незначительной степени влияют на уровни ТГ и ХС ЛПВП. Как правило, они снижают уровень ТГ на 10–15% и повышают уровень ХС ЛПВП на 8–10% [10]. Пациенты обычно хорошо переносят лечение статинами, даже при длительном приеме.
Существуют физиологические особенности липидного обмена, связанные с полом. До менопаузы женщины имеют значительно меньший риск развития атеросклероза по сравнению с мужчинами, что во многом обусловлено защитными свойствами эстрогенов, поддерживающих концентрацию липидов в пределах нормальных значений. Однако у молодых женщин, страдающих СГХС, гиполипидемическая терапия необходима. В период постменопаузы терапия гиперлипопротеинемии у женщин не отличается от таковой у мужчин. В частности, исследование 4S показало, что у женщин профилактический эффект от применения статинов выражен в большей степени, чем у мужчин [1, 6].
Рекомендуется:
- Нормализация и контроль массы тела (ИМТ от 18,5 до 24,9 кг/м²) и окружности талии (менее 102 см – для мужчин и менее 88 см – для женщин).
- Достижение целевых показателей: уровень ОХС в сыворотке крови не выше 5,2 ммоль/л, ТГ – не выше 1,7 ммоль/л, ХС ЛПНП – не выше 3,36 ммоль/л, ХС ЛПВП в пределах 1,0–1,89 ммоль/л.
- Начинать коррекцию нарушений липидного обмена с немедикаментозных мер, уделив особое внимание диете, рациональной физической активности, прекращению курения.
- Назначение гиполипидемических препаратов показано лишь в случае безуспешности перечисленных мер, соблюдаемых по крайней мере в течение 3 мес.
- При превышении целевых показателей уровня ХС и ТГ, наличии (не менее двух) других дополнительных сердечно-сосудистых ФР инсульта показан прием статинов. Вопрос о целесообразности назначения решается в каждом конкретном случае индивидуально:
- Симвастатин назначать в начальной дозе 20 мг/сут, с последующим увеличением дозы до 40 мг/сут. Применение симвастатина в дозе 80 мг/сут возможно лишь у больных с выраженной ГХС с соблюдением мер предосторожности из-за опасности развития миопатии, желательно под наблюдением специалиста, имеющего опыт применения высоких доз статинов. Доза симвастатина 10 мг/сут не обладает достаточным гиполипидемическим эффектом, поэтому назначение данной дозировки нецелесообразно.
- Флувастатин в форме замедленного высвобождения в дозе 80 мг 1 р./сут. Форма замедленного высвобождения является единственной среди всех статинов и позволяет назначать препарат вне зависимости от времени суток, при этом принимаемая доза препарата высвобождается в течение 8 ч.
- Аторвастатин назначать в большинстве случаев в дозе 10 мг/сут, а у больных с высоким и очень высоким риском развития атеросклероза – 20–80 мг/сут. Пациенты, получающие аторвастатин в дозе 80 мг/сут, должны чаще (1 раз в 3 мес.) наблюдаться у специалистов с целью выявления возможных побочных реакций.
- Розувастатин к применению в дозах 5–40 мг/сут. Стартовая доза – 5–10 мг/сут.
- Не следует назначать статины женщинам репродуктивного периода, которые не пользуются адекватными методами контрацепции.
- Не назначать статины женщинам, планирующим рождение ребенка, и немедленно отменить в случае беременности.
- Пожилым больным, подверженным большему риску развития побочных явлений при приеме гиполипидемических средств, при наличии показаний назначать препараты следует с минимальной дозы, с постепенным ее увеличением, контролируя показатели печеночных ферментов не реже одного раза в месяц.
- Следует назначать статины больным с СД 2-го типа, представляющим собой группу высокого риска развития сосудистых осложнений, у которых нередко нет выраженной гиперхолестеринемии, однако у них частицы ЛПНП по сравнению с нормой более атерогенны, имеют меньший размер, большую плотность, легче подвергаются перекисному окислению. Выбор гиполипидемических препаратов зависит от конкретной ситуации.
- Статины назначать с осторожностью лицам с острыми заболеваниями печени, жировым гепатозом, неконтролируемым СД и клинически выраженным гипотиреозом.
- Особую осторожность соблюдать, если у больного на фоне лечения статинами развивается острая инфекция, требующая назначения антибиотиков, или если он получил тяжелую травму, или ему планируется проведение полостной операции, если, наконец, у него развились выраженные эндокринные или электролитные нарушения.
- При назначении статинов необходимо сделать исходно анализ крови на липидный профиль, АСТ, АЛТ, КФК. Через 4–6 нед. лечения следует оценить переносимость и безопасность терапии (жалобы пациента, повторный анализ крови на липиды, АСТ, АЛТ, КФК).
- При повышении активности трансаминаз печени более трех ВПН нужно повторить анализ крови.
- Необходимо исключить другие причины гиперферментемии: прием алкоголя накануне, холелитиаз, обострение хронического гепатита или другие первичные и вторичные заболевания печени. Причиной повышения активности КФК могут служить повреждения скелетной мускулатуры: интенсивная физическая нагрузка накануне, внутримышечные инъекции, полимиозит, мышечные дистрофии, травмы, операции, поражения миокарда (ОИМ, миокардит), гипотиреоз, застойная сердечная недостаточность.
- При титровании дозы в первую очередь ориентироваться на переносимость и безопасность лечения, во вторую – на достижение целевых уровней липидов.
Несмотря на то, что СД является независимым фактором риска развития инсульта, нормализация только уровня глюкозы крови не ассоциируется со значительным снижением его риска. В одном из последних метаанализов, проведенных в США, посвященных оценке влияния интенсивного контроля глюкозы на основные сердечно-сосудистые события (ОИМ, инсульт) у пациентов с СД 2–го типа с 1990 по 2009 г., было получено, что интенсивный контроль не влияет на заболеваемость и смертность при инсульте, при этом риск несмертельного ОИМ был статистически значимо снижен до 14%. Тем не менее, гликемический контроль необходим для предотвращения прогрессирования микрососудистых осложнений (нефропатия, ретинопатия, периферическая нейропатия), что также взаимосвязано с прогрессированием макрососудистых осложнений. Национальные Американские ассоциации AHA/ASA рекомендуют строгий контроль уровня сахара в крови у пациентов с СД 1-го и 2-го типа. Строгий контроль АД и прием статинов у пациентов с СД 2-го типа также значительно снижают риск инсульта [4].
Рекомендуется:
- Строгий контроль уровня глюкозы в крови (при этом не следует ограничиваться лишь одним показателем гликемии натощак, необходимо определять постпрандиальный показатель и уровень гликированного гемоглобина, рис. 1).
- Соблюдение диеты.
- Использование пероральных сахароснижающих препаратов или инсулина.
В профилактике церебрального инсульта большое значение имеет рациональное питание. Целесообразно употреблять в достаточном количестве фрукты и овощи, растительные масла, ограничить потребление продуктов животного происхождения, богатых холестерином. Основные направления диеты – снижение уровня ХС и других атерогенных липидов в крови при сохранении физиологической полноценности пищевого рациона, повышение уровня калия, снижение потребления соли. Другой важный принцип – увеличение потребления продуктов растительного происхождения, способных связывать и выводить ХС из организма.
Соблюдение антиатеросклеротической диеты также способствует поддержанию нормального уровня глюкозы в крови и уменьшению массы тела. В суточном рационе должно содержаться менее 300 мг ХС (лучше – менее 200 мг) и более 25 г растительной клетчатки. Среди углеводов должны преобладать сложные углеводы зерновых продуктов, овощей и фруктов, а количество сахара – не превышать 50 г в сутки. При нарушенной толерантности к глюкозе или СД 2-го типа потребление сахара сокращается до 3% от суточной калорийности.
Пища должна быть разнообразной, а количество потребляемых с пищей калорий – достаточным для поддержания идеального веса конкретного больного. Приводим рекомендации, изложенные в Национальном докладе «Все о холестерине» [5].
Рекомендуется:
Употреблять:
- Больше фруктов – не менее 400 г или 5 порций в день: 1 порция = 1 яблоко/1 банан/1 апельсин/1 груша/ 2 киви/2 сливы/ 1 столовая ложка сухофруктов/1 большой ломтик дыни или ананаса/1 стакан сока. Количество вареных или свежих овощей в пищевом рационе должно быть не менее 400 г (2 чашки).
- Пищевые волокна (не менее 30 г в сутки); они содержатся в большом количестве во фруктах (груши, яблоки, апельсины, персики), ягодах (малина, клубника, черника), овощах (цветная капуста, брокколи, зеленая фасоль) и бобовых (горох, чечевица, фасоль).
- Пектины (не менее 15 г в сутки), которые содержатся в свежих фруктах (яблоки, сливы, абрикосы, персики), ягодах (черная смородина) и овощах (морковь, столовая свекла).
- Ограниченное количество продуктов животного происхождения, богатых ХС и насыщенными жирами. В частности, это мясо жирных сортов, сало, сливочное масло, сметана, яичный желток, жирный сыр, колбаса, сосиски, все субпродукты, рыбная икра, креветки, кальмары. Из мясных продуктов выбирать тощее мясо, без прослоек жира или домашнюю птицу (без кожи). Употреблять не более 2–3 яиц в неделю (ограничивается употребление желтков, но не белков, которые можно есть без ограничения).
- Ограниченное количество животных жиров, заменяя их на растительные, поскольку последние богаты антиатерогенными ненасыщенными жирами. ПНЖК содержатся в виде ω-6-линолевой кислоты в растительном масле (подсолнечном, кукурузном, хлопковом) и в виде ω-3-α-линоленовой кислоты – в льняном и соевом масле. Минимальная суточная потребность человека в незаменимой линолевой кислоте составляет 2–6 г, что эквивалентно 10–15 г подсолнечного масла (2–3 чайные ложки).
- Оливковое масло, в котором содержится достаточное количество антиатерогенной мононенасыщенной олеиновой кислоты. Растительные масла не содержат ХС, но являются высококалорийными, поскольку это 100% жир. Потребление их в объеме, превышающем 10% от суточной калорийности, может вызвать снижение уровня ХС ЛПВП в крови (этот эффект нивелируется к концу первого года), повышение окисляемости ЛПНП и увеличение массы тела. Поэтому не рекомендуется употреблять более 1 чайной ложки оливкового масла в сутки.
- Меньшее количество гидрогенизированных растительных масел, широко распространенных в последнее десятилетие. Уровень трансизомеров (вредных веществ) в твердых маргаринах может достигать 60%. Трансизомеры ненасыщенных ЖК в обмене ЛП подобны насыщенным ЖК. Доказано, что их потребление (более 1%) увеличивает риск развития и прогрессирования ИБС за счет значительного повышения уровней ОХС и ХС ЛПНП и снижения концентрации ХС ЛПВП.
- Мягкий маргарин, заменяя им сливочное масло. Замена сливочного масла на мягкий маргарин снижает риск ИБС на 10%. Однако количество потребляемого мягкого маргарина следует ограничить, намазывая на хлеб не более 5 г.
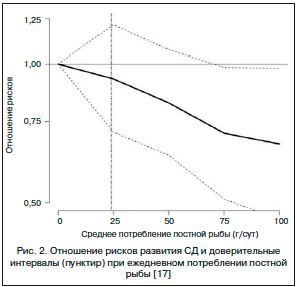
- Рыбу и морепродукты. Предпочтение следует отдавать рыбе северных морей, содержащей много ω-3 ПНЖК (скумбрия, сардины, тунец, лосось, макрель, сельдь, палтус и т. д.). Установлено, что ПНЖК существенно снижают уровень ТГ и, в меньшей степени, – ОХС. Среди других эффектов ПНЖК отмечено влияние на уровень АД, подавление тромбообразования и улучшение функции эндотелия. Установлено, что вероятность развития ИБС снижается по крайней мере на 25–30% при употреблении рыбы 2–4 раза в неделю. Рыбий жир богат ω-3 ПНЖК – эйкозапентаеновой и докозагексаеновой. Выявлено отчетливое профилактическое действие потребления рыбы на развитие СД и его сердечно-сосудистых осложнений (рис. 2) [17].
- Ограниченное количество натрия – до 1500 мг (65 ммоль) в сутки у пациентов в возрасте 50 лет и моложе; до 1300 мг (57 ммоль) в сутки – у пациентов от 51 до 70 лет; до 1200 мг (52 ммоль) в сутки – у пациентов старше 70 лет.
- Умеренное количество молочных продуктов (снятое молоко, сыр с низким содержанием жира и обезжиренный йогурт) (источники магния).