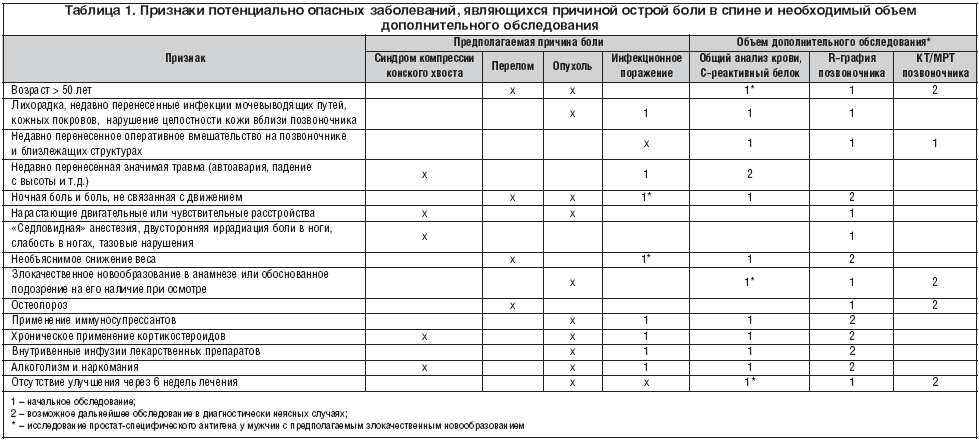
Для исключения потенциально опасной патологии при боли в спине необходимо пользоваться современными клиническими рекомендациями и диагностическими алгоритмами, основанными на выявлении клинических и параклинических маркеров таких состояний (табл.1) [33]. Терапевтические подходы к пациентам с острой болью в спине в настоящее время не являются предметом дискуссии и включают применение нестероидных противовоспалительных препаратов (НПВП), парацетамола, миорелаксантов, сохранение повседневной активности и исключение постельного режима [20;38]. Относительно назначения миорелаксантов можно отметить, что их применение при острой боли в спине, по данным клинических рекомендаций, имеет высокую степень доказательности (А), однако при этом, как правило, указывается целесообразность применения при «хорошей переносимости» [27]. Миорелаксантом, отличающимся редкой частотой нежелательных явлений, является толперизон (Мидокалм). Имеется ряд открытых исследований, показавших эффективность толперизона для лечения пациентов с болью в спине [8;9]. Отмечена эффективность Мидокалма у пациентов с острой болью в спине, которые лечились амбулаторно в поликлинике г. Москвы [3]. В течение четырех месяцев в исследование было включено 60 пациентов (43 женщины и 17 мужчин) в возрасте от 18 до 60 лет (средний возраст 41,8 года) с острой поясничной болью. Все пациенты принимали НПВП, кроме того, 30 пациентов дополнительно принимали Мидокалм по 150 мг 3 раза в сутки (группа лечения Мидокалмом), остальные 30 пациентов составили группу сравнения. Средняя длительность пребывания на больничном листе в группе пациентов, получавших Мидокалм, была достоверно ниже (10,3±1,0 дней), чем в группе сравнения, в которой она достигла 17,7±3,3 дней (р<0,05).
Пациентам, у которых не отмечено достаточного эффекта от медикаментозной терапии, рекомендуется присоединение нелекарственных методов лечения: тепловых физиопроцедур, мануальной терапии, массажа, лечебной физкультуры, проведение дополнительной образовательной программы о причинах развития боли в спине и методах ее лечения, а также включение в терапевтические мультидисциплинарные программы [27].
В отличие от пациентов с острой болью в спине больные с хронической болью, длящейся более 3 мес (при этом риск хронизации значительно возрастает при сохранении болевого синдрома свыше 1,5 мес) имеют неблагоприятный прогноз на полное выздоровление, что отчасти обусловлено недостаточной изученностью механизмов формирования хронической боли в спине (в частности, состояния скелетно–мышечной системы при этом заболевании). Определенные трудности вызывает терминология, применяемая для описания состояния мышц в случаях, когда они являются источниками боли. В руководстве для специалистов по боли, изданном Международной ассоциацией по изучению боли, отмечается, что термин «миофасциальная боль» может применяться как в широком значении, включающем все виды мышечной боли, так и в узком, когда облигатно выявление триггерных зон (ТЗ) в мышцах [23]. При этом минимально необходимым для диагностики ТЗ является локальная болезненность в пределах пальпируемого тяжа в мышце и воспроизводимость спонтанной боли при его пальпации. В отечественной литературе традиционно сохраняется выделение мышечно–тонического и миофасциального болевого синдромов (МФБС), истоки которого восходят к работам Я.Ю. Попелянского [13]. Основной проблемой в идентификации мышцы в качестве источника боли в спине является невозможность ни по локализации, ни по характеру боли точно определить, является ли мышца непосредственным источником локальной боли или она «включается» рефлекторно вместе с развитием отраженной боли. Локальная болезненность мышц при пальпации может являться проявлением как периферической (при локальной боли), так и центральной сенситизации. Примерами первого состояния может являться локальная боль при пальпации ТЗ при МФБС, второго – боль, возникающая при пальпации «чувствительных» зон при фибромиалгии [15,16]. МФБС – хронический болевой синдром, при котором в различных частях тела возникает локальная или сегментарная боль. Патогномоничным признаком МФБС являются ТЗ. ТЗ – участок локального продольного уплотнения, расположенный по направлению мышечных волокон, при раздражении которого (пальпаторном, уколом, перкуссией) вызывается местная болезненность и иррадиации боли. Размер ТЗ составляет от 2 до 5 мм. Хотя при МФБС, как правило, неврологической симптоматики, свидетельствующей о поражении нервной системы, не выявляется, пациенты могут жаловаться на ощущение «онемения», «ползание мурашек», покалывание в зоне иррадиации боли. Для каждой ТЗ характерна своя строго определенная область отраженной боли и парестезий. Детальное описание ТЗ в различных группах мышц дано в работах J.G. Travell и D.G. Simons (1989). Диагноз МФБС ставится на основе клинического обследования.
Проблема диагностики МФБС состоит и в том, что относительно большое количество мышц потенциально может принимать участие в развитии МФБС, и, соответственно, врач должен владеть методикой мануального исследования различных мышц. Затруднения связаны с различной конституцией пациентов, толщиной подкожной жировой клетчатки, глубиной залегания мышц. Особенно труднодоступны пальпации мышцы ног и ягодичной области (например, глубоко залегающая грушевидная мышца). Воспроизводимость диагноза МФБС при сравнении результатов обследования пациентов двумя независимыми обученными для диагностики МФБС специалистами остается низкой. Это отчасти объясняется тем, что области мышечного уплотнения с участками локальной болезненности и даже типичными паттернами отраженной боли и локальным сокращением мышцы нередко выявляются и в здоровой популяции. Показано, что в наибольшей степени пациентов с МФБС от здоровых отличает ограничение движений в пораженной мышце, уменьшение в ней силы (при активном сопротивлении) из–за возникающей при движении боли, и снижение болевого порога, выявляемого при альгометрии [42].
Кроме скелетно–мышечных нарушений у пациентов с МФБС нередко отмечаются расстройства сна и сопутствующие эмоциональные нарушения (тревожность и депрессия). Несмотря на продолжающуюся дискуссию о МФБС, как самостоятельной нозологической единице, с прямо противоположными точками зрения [24, 43], большинство (88%) исследователей и специалистов в области болевых синдромов диагноз МФБС считают правомочным [42].
Точная причина развития МФБС остается неизвестной. Существует несколько теорий патогенеза миофасциальной боли. Так, согласно теории ишемического спазма, исходным стимулом часто служит физическая травма мышцы, либо ее хроническое напряжение (мышечно–тонический синдром), что приводит к высвобождению внутриклеточного кальция и удлиненному ненормальному мышечному сокращению – спазму части мышцы. Этот спазм может вызывать боль и повреждение за счет высвобождения простагландинов и других медиаторов воспаления, которые, в свою очередь, возможно, дополнительно усиливают мышечный спазм. Такое продолженное сокращение может приводить к ишемии как на клеточном уровне за счет усиления анаэробного гликолиза и избыточного образования молочной кислоты, так и к снижению локального кровотока. Эта «модель энергетического кризиса» (D. Simons) частично объясняет напряжение, имеющееся в плотных мышечных тяжах и сохраняющееся в покое. Однако маловероятно, что возникающая при МФБС хроническая боль носит ишемический характер, поскольку она не имеет характерных признаков острой ишемической боли. Также остается неясным, почему мышечное повреждение при МФБС должно приводить к образованию ТЗ, в то время как другие его причины не вызывают формирование ТЗ. Продолжается дискуссия о том, являются ли ТЗ зонами патологического мышечного сокращения или же участками контрактуры, не генерирующими биоэлектрическую активность. Тем не менее, несмотря на эти вопросы, распространено убеждение, что МФБС каким–то образом связан с локальным мышечным спазмом.
Клинические характеристики мышечно–тонических синдромов описаны в работах Я.Ю. Попелянского (1989, 1997), В.П. Веселовского (1977), Г.А. Иваничева (2005, 2007), Ф.А. Хабирова (2006), А.А. Лиева (1995), В.В. Алексеева (2009) и др. авторов. Больные с мышечно–тоническими синдромами жалуются на боли в позвоночнике или в мышцах плечевого и тазового пояса, которые уменьшаются после отдыха, растирания, разминания и растяжения мышцы. Боль нередко носит «стягивающий» характер. Визуально можно определить изменение контура, «выбухание» мышцы, которая при пальпации может иметь повышенную плотность. Произвольные движения с вовлечением спазмированной мышцы совершаются в неполном объеме. Компрессия сосудисто–нервных структур при мышечно–тонических синдромах может вызывать иррадиацию боли в конечность, двигательные, чувствительные и вегетативные нарушения, локализующиеся в соответствующих зонах иннервации и васкуляризации. Хроническое течение мышечно–тонических синдромов чаще всего отмечается в тех мышцах, которые испытывают позные перегрузки, например, при асимметрии конечностей, таза, выраженном сколиозе, патологии внутренних органов. Боль в этих случаях, как правило, имеет слабую или умеренную интенсивность. Пациенты предъявляют жалобы на ощущение «дискомфорта», «тяжести» после физической нагрузки, которые уменьшаются после разминания мышцы, ее согревания. Болезненность в спазмированной мышце возникает при ее активном сокращении и обычно отсутствует при растяжении. Считается, что не все мышцы одинаково подвергаются формированию мышечно–тонического синдрома. Например, среди мышц тазового пояса и спины наиболее подвержены формированию хронического напряжения трехглавая мышца голени, прямая мышца бедра, напрягатель широкой фасции, грушевидная мышца, квадратная мышца поясницы и все разгибатели позвоночника [12].
Точные механизмы формирования мышечно–тонических синдромов неизвестны. Мышечно–тонической синдром может выполнять саногенетическую функцию, ограничивая пораженную область от дальнейшего повреждения. Считается, что повышение активности паравертебральных мышц в ответ на боль направлено на повышение стабильности позвоночника и таза. В.П. Веселовским (1977) развита теория «миоадаптивных» синдромов, сопровождающих как компрессионные, так и рефлекторные болевые синдромы. Определенная роль отводится повышению возбудимости сегментарных спинальных структур в ответ на афферентную импульсацию от раздражения рецепторов синувертебрального нерва в области пораженного диска. К другим рефлекторным механизмам, приводящим к формированию мышечно–тонического синдрома, относятся так называемые «висцеромоторные» реакции в виде спазма мышцы в ответ на афферентацию из пораженного внутреннего органа («висцеро–соматический рефлекс») [12,19].
При нормальной работе мышц сокращение чередуется с их расслаблением. При этом на восстановление мышцы после сокращения тратится энергия основного обмена [12]. В спазмированной мышце выявлено нарушение микроциркуляции и окислительного метаболизма [7,29].
В целом можно отметить, что до настоящего времени доминирующей теорией изменения состояния паравертебральных мышц у пациентов с болью в спине оставалась концепция «порочного круга» «боль – мышечный спазм – боль» [40]. Рядом исследователей ей противопоставлялась теория «адаптации к боли» [36]. У обеих теорий были как хорошо доказанные и подтверждающие их факты, так и относительно слабые стороны. Так, было показано, что экспериментальная мышечная боль повышает рефлекс на растяжение [47,48]. В рамках концепции «порочного круга» «боль – мышечный спазм – боль» предполагается повышение чувствительности мышечных веретен через g–мотонейроны в ответ на импульсацию по ноцицептивным мышечным афферентам [32]. При этом обсуждается стереотипное повышение мышечной активности, независимо от вида нагрузки [40], однако данный факт не нашел ни клинического, ни экспериментального подтверждения. Для подтверждения теории «адаптации к боли» привлекаются результаты экспериментальных работ, показывающие, что активность болезненных мышц при произвольном движении снижается (амплитудные, скоростные характеристики, сила), а увеличивается активация только мышц–антагонистов [36]. Также отмечено снижение активации мотонейронов при сокращении болезненной мышцы со стандартным усилием [44]. При исследовании мышцы, выпрямляющей позвоночник, при ходьбе и наклоне вперед у пациентов с хронической болью в спине показано, что ее активация увеличивается, когда мышца должна быть расслабленной, и, наоборот, снижается при нормальной нагрузке [14,21]. Описана гипотрофия многораздельных мышц у пациентов с хронической болью в спине по данным магнитно–резонансной томографии [37]. Тем не менее, если согласно теории «адаптации к боли» происходит только ингибирование активности болезненных мышц, в экспериментах на животных показано, что при активации ноцицептивных мышечных афферентов прямая регистрация активности мотонейронов показывает как возбуждающие, так и ингибиторные постсинаптические потенциалы [34]. У людей при транскраниальной магнитной стимуляции (ТКМС) после вызывания экспериментальной локальной мышечной боли амплитуды вызванных моторных потенциалов могут снижаться [30,35], увеличиваться [26, 28] или оставаться неизменными [41]. Недавние исследования показали, что возбудимость мышц при стимуляции моторной коры зависит от самой мышцы. При экспериментальной боли в спине амплитуда вызванного моторного потенциала при ТКМС снижается в поперечной мышце живота, но увеличивается в мышце, выпрямляющей позвоночник [31]. В противоположность этому при хронической боли в спине порог вызывания вызванного моторного потенциала в мышце, выпрямляющей позвоночник, повышается [45]. В целом можно отметить, что изучение состояния корково–мышечного пути не подтверждает в полной мере ни теорию «боль – мышечной спазм – боль», ни теорию «адаптации к боли», опровергая однонаправленость процесса, как активации, так и ингибирования мышечной активности при экспериментальной боли и в различных клинических ситуациях.
Теории «адаптации к боли» противоречит и то, что исследование активности различных двигательных единиц в пределах одной мышцы в норме и в условиях экспериментальной болевой стимуляции показало, что активация некоторых двигательных единиц при боли снижается, отдельные двигательные единицы становятся полностью инактивированными, но при этом в этой же мышце активируются «спящие» до этого двигательные единицы. P. Hodges, K. Tucker (2011), предложили свою, модифицированную с позиции современных данных об активации мышц в экспериментальных и клинических ситуациях теорию «моторной адаптации к боли» [31], состоящую из нескольких позиций: 1) активация различается как между отдельными мышечными группами, так и в пределах одной мышцы; 2) это, в свою очередь, приводит к изменению двигательного паттерна – перераспределению нагрузки на мышцы при движении и ограничению движений; 3) цель подобного изменения активации – защита пораженного позвоночного двигательного сегмента от дальнейшего повреждения или уменьшение боли; 4) указанные изменения объясняются многоуровневыми изменениями в состоянии двигательной системы, которые могут быть комплементарными или антагонистическими друг другу; 5) кратковременные благоприятные последствия указанных изменений могут сменяться негативными долговременными – повышением нагрузки на другие двигательные сегменты, ограничением движений и изменением их паттерна.
Исходя из представлений о различной степени мышечной активации при хронической боли в спине, ее лечение должно носить дифференцированный характер. В тех случаях, когда мышечно–тонические нарушения становятся основным или самостоятельным источником боли, применяют как местные, так и общие воздействия. Проводятся растяжение, массаж заинтересованной мышцы, воздействие согревающими физиопроцедурами, приемы мануальной терапии, направленные на мобилизация пораженного ПДС [4,18]. Целесообразна коррекция двигательного стереотипа, избегание провоцирующих нагрузок и поз. При отсутствии саногенетической роли мышечно–тонического синдрома возможно назначение миорелаксантов, обладающих анальгетическими свойствами – например, толперизона (Мидокалм) 300–450 мг/сут. В проспективном двойном слепом плацебо–контролируемом исследовании эффективности и безопасности толперизона (Мидокалма) у 113 пациентов с болевым мышечно–тоническим синдромом показано, что его назначение уже к 10–му дню наблюдения приводило к достоверному, по сравнению с плацебо, увеличению показателя общего клинического улучшения. При тензоальгометрии в проекции ТЗ на фоне применения толперизона отмечалось достоверное повышение прессорного болевого порога [39]. Однако в отличие от острой боли в спине, где преобладают механизмы активации паравертебральной мускулатуры, в случаях хронической боли в спине, когда нередко отмечаются не мышечно–тонические синдромы, а детренированность мышц, связанная в том числе и с психологическими особенностями пациентов – страхом движения, катастрофизацией боли, ограничительным болевым поведением, на первый план выходит необходимость активного включения пациентов в программы реабилитации: выполнение комплекса упражнений, проведение когнитивно–поведенческой психотерапии, направленной на коррекцию дисфункционального мышления, связанного с болью, и его поведенческих последствий [10]. Рациональная психотерапия позволяет скорректировать неправильные представления пациента о боли в спине, уменьшить уровень связанных с ней страха и катастрофизации, однако ее оказывается недостаточно для повышения уровня повседневной активности. Для снижения степени инвалидизации у пациентов с болью в спине показано применение физической нагрузки, вызывающей типичные болевые ощущения, методом так называемой «градуированной» экспозиции. Этот вид поведенческой психотерапии направлен на то, чтобы пациент с поведением в виде избегания, связанного со специфическими факторами (например, страхом движения – кинезиофобией), создал в своем воображении иерархию вызывающих страх и тревогу образов от менее до более пугающих, оставаясь на каждой «ступеньке» воздействия, пока страх и тревога не исчезнут. Эта процедура проводится под наблюдением врача с должным уровнем положительной поддержки. Когда пациент достигает понимания, что физическая активность не опасна, он увеличивает уровень повседневной активности, интенсивность боли в этом случае также снижается [25].
Литература
1. Алексеев В. В. Диагностика и лечение острых поясничных болей //Consilium Medicum – 2009 – том 11 – №2. – С.42–46.
2. Веселовский В.П. Формы люмбоишиальгии (клинико–экспериментальное, электрофизиологическое, биохимическое и биофизическое обоснование) – Казань, 1977. – дисс. соиск. д.м.н. – 427 С.
3. Гурак С.В., Парфенов В.А., Борисов К.Н. Мидокалм в комплексной терапии острой поясничной боли // Боль. – 2006. – № 3. – С. 27–30.
4. Есин Р.Г., Есин О.Р., Ахмадеева Г. с соавт. Боль в спине – 2010 – Казань, Казанский полиграфкомбинат – 272 С.
5. Иваничев Г.А. Мануальная медицина. – М. «Медпресс», 2005. – 486 С.
6. Иваничев Г.А. Миофасциальная боль – Казань, 2007 – 392 С.
7. Лиев А.А. Варианты и формы вертеброгенных миофасциальных люмбоишиалгических синдромов // Автореф. дисс. … докт. мед. наук – Казань, 1995 – 48 С.
8. Парфенов В.А. Боли в спине и их лечение Мидокалмом // РМЖ – 2009 – N.4 – 267–272
9. Парфенов В.А. Мидокалм в лечении болезненного мышечного спазма при болях в спине//Неврологический журнал.–2004.–№6.– с. 39–42
10. Подчуфаpова Е.В., Яхно Н.Н.. Боль в спине // Москва.–«ГОЭТАР–Медиа».– 2010. – 368 С.
11. Попелянский Я.Ю. Болезни периферической нервной системы – М., Медицина, 1989 – 469 С.
12. Попелянский Я.Ю. Ортопедическая неврология. – Т.1,2. – Казань, 1997.
13. Попелянский Я.Ю. Вертеброгенные заболевания нервной системы. Том 1– 1974. – Издательство казанского университета, Казань – 285С
14. Разумов Д.В., Подчуфарова Е.В Роль болевого поведения в формировании инвалидизации у пациентов с хронической болью в спине //Российский медицинский журнал 2010 N.3 – C.11–18
15. Табеева Г.Р. Фибромиалгия // Consilium medicum. – 2000. –№12 – C.506–508.
16. Табеева Г.Р., Азимова Ю.Э. Фибромиалгия: современное понимание патогенеза и новые подходы к лечению // Боль – 2007 – N.4 – P.9–14
17. Тревел Д.Г., Симонс Д.Г. Миофасциальные боли /пер. с англ. Москва, «Медицина»,1989, Т. 1–2.
18. Хабиров Ф.А. Руководство по клинической неврологии позвоночника. – Казань, «Медицина», 2006 – 518 С.
19. Хабиров Ф.А., Девликамова Ф.И., Лечение вертеброгенной боли // Лечение нервных заболеваний – 2002 – Том 3 – N1 – С.3–9
20. Эрдес Ш.Ф. и соавт. Неспецифическая боль в нижней части спины. Клинические рекомендации для участковых терапевтов и врачей общей практики, Москва – 2008 «КомплектСервис» – 70 С.
21. Arendt–Nielsen L, Graven–Nielsen T, Svarrer H The influence of low back pain on muscle activity and coordination during gait: a clinical and experimental study. // Pain – 1996 – Vol.64 –P. 231–40
22. Breivik Н., Collett B., Ventafridda V. et al. Survey of chronic pain in Europe: Prevalence, impact on daily life, and treatment //European Journal of Pain – 2006 – Vol.10. – P. 287–333
23. Charlton JE, ed. Core Curriculum for Professional Education in Pain, 3rd edition. Seattle, WA: IASP Press; 2005
24. Cohen M., Quintner J The horse is dead: let myofascial pain syndrome rest in peace // Pain Med – 2008 – Vol. 9(4) – 464–465
25. de Jong J.R., Vlaeyen J.W., Onghena P. et al. Fear of movement/(re)injury in chronic low back pain: education or exposure in vivo as mediator to fear reduction? – Clin J Pain – 2005; Vol. 21(1) – P.9–17
26. Del Santo F, Gelli F, Spidalieri R, Rossi A. Corticospinal drive during painful voluntary contractions at constant force output // Brain Res – 2007 –Vol.1128 – P.91–98.
27. Duffy R.L. Low Back Pain: An Approach to Diagnosis and Management// Prim Care Clin Office Pract 37 – 2010– P. 729–741
28. Fadiga L, Craighero L, Dri G, Facchin P. et al. Corticospinal excitability during painful self–stimulation in humans: a transcranial magnetic stimulation study // Neurosci Lett – 2004 –Vol.361 – P.250–253
29. Falla D. Neuromuscular control of the cervical spine in neck pain disorders // Fundamentals of musculosceletal pain ed. by Graven–Nielsen T., Arendt–Nielsen L., Mense S. – 2008. – IASP Press – Seattle – P.417–430.
30. Farina D, Arendt–Nielsen L, Merletti R, et al. Effect of experimental muscle pain on motor unit firing rate and conduction velocity // J Neurophysiol – 2004 – Vol.91 –P.1250–9.
31. Hodges P.W., Tucker K. Moving differently in pain: A new theory to explain the adaptation to pain // Pain – 2011– Vol.152 – S90–S98
32. Johansson H, Sojka P. Pathophysiological mechanisms involved in genesis and spread of muscular tension in occupational muscle pain and in chronic musculoskeletal pain syndromes: a hypothesis.// Med Hypotheses 1991 – Vol.35 –P.196–203
33. Kinkade S. Evaluation and Treatment of Acute Low Back Pain // American Family Physician. – 2007. – Vol.75. – N.8. – P. 1181–1188
34. Kniffki KD, Schomburg ED, Steffens H. Synaptic effects from chemicallyactivated fine muscle afferents upon alpha–motoneurones in decerebrate and spinal cats // Brain Res – 1981 – Vol.206–P.361–70.
35. Le Pera D., Graven–Nielsen T., Valeriani M. et al. Inhibition motor system excitability at cortical and spinal level by tonic muscle pain // Clin Neurophysiol. – 2001. – Vol.112. – P.1633–1641.
36. Lund JP, Donga R, Widmer CG, Stohler CS. The pain–adaptation model: adiscussion of the relationship between chronic musculoskeletal pain and motor activity // Can J Physiol Pharmacol – 1991; – Vol.69 – P.683–94
37. Mooney V, Gulick J, Perlman M, et al: Relationships between myoelectric activity, strength, and MRI of extensor muscles in back pain patients and normal subjects // Journal of Spinal Disorders – 1997 – Vol.10 – P.348–356.
38. NICE – National Institute for Health and Clinical Excellence http://www.nice.org.uk/nicemedia/live/11887/44345/44345.pdf
39. Pratzel HG, Alken R.G, and Ramm S. Efficacy and tolerance of repeated oral doses of tolperisone hydrochloride in the treatment of painful reflex muscle spasm: results of a prospective placebo–controlled double–blind trial// Pain 1996: 67: 417–425
40. Roland M. A critical review of the evidence for a pain–spasm–pain cycle in spinal disorders. // Clin Biomech – 1986 – Vol.1 – P.102–9
41. Romaniello A, Cruccu G, McMillan AS. et al. Effect of experimental pain from trigeminal muscle and skin on motor cortex excitability in humans // Brain Res – 2000 – Vol.882 – P.120–7.
42. Russell I.J. Myofascial pain syndrome and fibromyalgia syndrome in Raj’s Practical Management of Pain, 4th ed. ed. H. Benzon: – 2008– Mosby Elsivier – Philadelphia – 1319 P.
43. Simons D.G. The Dead Horse, Like the Phoenix, Is Arising– // Pain Med –2008 – Vol.9(4) – P/469–470
44. Sohn MK, Graven–Nielsen T, Arendt–Nielsen L. et al. Inhibition of motor unit firing during experimental muscle pain in humans // Muscle Nerve – 2000 – Vol.23 – P.1219–26
45. Strutton PH, Theodorou S, Catley M, et al. Corticospinal excitability in patients with chronic low back pain // J Spinal Disord Tech – 2005 – Vol.18 – P.420–4.
46. van Tulder M, Becker А., Bekkering T. et al. European guidelines for the management of acute nonspecific low back pain in primary care // Eur. Spine J. – 2006. – Vol.15. – suppl. 2. – S.169–191.
47. Wang K, Arendt–Nielsen L, Svensson P. Excitatory actions of experimental muscle pain on early and late components of human jaw stretch reflexes. // Arch Oral Biol – 2001 – Vol.46 – P.433–42;
48. Wang K, Arima T, Arendt–Nielsen L et al. EMG–force relationships are influenced by experimental jaw–muscle pain // J Oral Rehabil – 2000 –Vol.27 – P.394–402












