Исследования показали, что в дебюте СД 2-го типа около 50% больных уже имеют макро- и микрососудистые осложнения. Возможно, это результат того, что метаболические нарушения возникают гораздо раньше первых клинических проявлений СД и к моменту постановки диагноза приводят к необратимым сосудистым изменениям.
Диабетическая полинейропатия (ДП) является самым частым осложнением СД. В среднем частота нейропатии среди пациентов с СД составляет 25%, при углубленном неврологическом исследовании она возрастает до 50%, а при применении электрофизиологических методов исследования, исследовании вегетативных функций и количественной оценки чувствительности – до 90%. Нейропатия – обычно позднее осложнение у пациентов с СД 1-го типа, однако у пациентов с СД 2-го типа нейропатия может быть диагностирована первой [3]. Учитывая длительный латентный период СД 2-го типа, частой клинической ситуацией может быть выявление признаков полинейропатии, предшествующих появлению признаков самого СД. У многих пациентов неврологические нарушения являются первыми симптомами заболевания, даже на этапе начальных нарушений углеводного обмена (нарушенной толерантности к глюкозе и гликемии натощак), и позволяют в последующем, при своевременном проведении лечебно-профилактических мероприятий, предотвратить развитие СД. С увеличением длительности и тяжести диабета частота диабетической нейропатии неуклонно возрастает. Приблизительно у 50% пациентов с длительностью СД 1-го типа более 25 лет разовьется полинейропатия [4].
ДП может быть острой и хронической, симметричной и асимметричной, асимптомной или болевой. Хроническая дистальная симметричная сенсорная и сенсомоторная полинейропатии – это самые частые варианты ДП. Этот тип нейропатии, как правило, отражает длительность и тяжесть гипергликемии и зависит от продолжительности диабета и эффективности проводимой гипогликемической терапии, но иногда бывает и первым проявлением скрыто протекающего СД. Также этот вариант полинейропатии часто сочетается с другими микрососудистыми осложнениями СД – нефропатией и ретинопатией. Гипергликемия, обусловленная СД, вызывает серьезные метаболические нарушения, такие как избыточное гликирование белков и оксидативный стресс, существенно нарушающие структуру и функции нейронов [5]. Оксидативный стресс способствует повреждению эндотелиальных клеток, лежащих в основе мембраны эндоневральных сосудов, что приводит к микроваскулярной дисфункции. Развивающиеся в итоге гипоксия и ишемия еще в большей степени активируют процессы поражения нервов. Существенным механизмом формирования ДП является дефицит нейротрофических факторов, снижающий способности пораженного нерва к регенерации. Также в патогенезе определенную роль играют активация протеинкиназы С и блокирование выделения оксида азота, регулирующего тонус сосудов, что способствует развитию эндотелиальной дисфункции и прогрессированию микроангиопатии. Появление боли при ДП обусловлено поражением тонких сенсорных волокон, ответственных за болевую чувствительность [6].
Полинейропатия обычно начинается постепенно, иногда ассиметрично, и медленно прогрессирует, со временем всегда становясь симметричной. Прогрессирующее течение может иногда прерываться периодами стабилизации или ремиссии различной продолжительности, обычно на фоне улучшения. В клинической картине доминируют нарушения чувствительности в виде ощущений боли, онемения, парестезий в нижних конечностях. Парастезии проявляются как ощущения холода, покалывания, жжения, которые возникают спонтанно или при прикосновении. У 50% пациентов с полинейропатией боль является единственным ее проявлением [7]. Боль может быть жгучей, режущей, рвущей, пронизывающей, реже – тупой. Часто она отмечается в покое и усиливается в ночное время, нарушая сон, прикосновения к коже становятся крайне болезненными. В типичных случаях больной не может выносить даже прикосновения шерстяного одеяла, а затем иногда и обычного постельного белья.
Боль при ДП имеет сложный генез. Ее появление связывают с генерацией тонких немиелинизированных волокон или гипергликемией. Известно, что гипергликемия может снижать болевой порог и уменьшать эффект анальгетиков, поэтому нормализация содержания глюкозы в крови может привести к существенному уменьшению боли. У большинства больных боль имеет тенденцию к спонтанному уменьшению в течение нескольких месяцев, но иногда она неуклонно нарастает. Регресс боли может свидетельствовать не только о восстановлении функций, но и о дальнейшем прогрессировании патологического процесса.
Болевой синдром при ДП чаще всего развивается у больных с дистальной симметричной сенсомоторной полинейропатией. Типичными жалобами являются покалывание и онемение в стопах и голенях, усиливающиеся в ночное время. В то же время у больных могут возникать резкие, стреляющие, пульсирующие и жгучие боли. У части пациентов отмечаются аллодиния и гиперестезия. Все вышеописанные расстройства относят к позитивным сенсорным симптомам нейропатической боли. Негативными симптомами являются болевая и температурная гиперестезия, которые в начальных стадиях заболевания представлены умеренно в дистальных отделах, но по мере прогрессирования распространяются проксимально, в этот процесс постепенно могут вовлекаться и верхние конечности. Сухожильные рефлексы, как правило, снижены, а мышечная слабость ограничивается мышцами стопы [8].
Лечение
Поскольку отсутствие компенсации СД, т.е. хроническая гипергликемия, является основным патогенетическим фактором, запускающим процессы повреждения нервных волокон, то основным условием стабилизации и регресса проявлений диабетической нейропатии, а также ее профилактики будет нормализация углеводного обмена. Таким образом, основой лечения ДП являются оптимальный контроль уровня сахара в крови и коррекция всех метаболических нарушений. Другими факторами риска, которые могут быть связаны с диабетической нейропатией, являются гиперлипидемия, гипертония, курение, потребление алкоголя и избыточный вес. Хотя не было исследований, которые показывали бы сокращение риска развития нейропатии, влияние на эти обратимые факторы способно предотвратить другие долгосрочные осложнения СД, такие как сердечно-сосудистые заболевания (ССЗ).
Первый шаг в терапии болевой формы ДП – контроль за гликемией и исправление других метаболических расстройств. В исследовании Diabetes Control and Complications Trial (DCCT) улучшенный гликемический контроль у пациентов с СД 1-го типа, достигнутый в результате интенсивной инсулинотерапии, привел не только к снижению уровня нейропатии, но и замедлил ее прогрессию на 57% [9]. Следует отметить, что было достигнуто замедление прогрессирования, а не обратное развитие нейропатии. Сходные выводы были сделаны в исследовании UKPDS (Тне UK Prospective Diabetes Study), включавшем более 5 тыс. больных с СД 2-го типа. Было показано, что интенсивная терапия к концу 15 года наблюдения привела к снижению частоты полинейропатии на 40% по сравнению с группой, где концентрация глюкозы поддерживалась на более высоком уровне [10].
Патогенетически ориентированное лечение может замедлять, останавливать или даже менять направление развития нейропатии. Показана четкая корреляция между уровнем гипергликемии и развитием и прогрессией нейропатий, включая болевые формы [11]. После улучшения контроля гликемии могут отмечаться замедление прогрессирования, стабилизация и частичный регресс симптомов при уже развившейся полинейропатии. В среднем проявления полинейропатии начинают уменьшаться через 6 мес. после достижения оптимального контроля над гипергликемией. При этом уменьшаются не только субъективные сенсорные симптомы, но и проявления вегетативной дисфункции, увеличивается скорость проведения импульсов по нервам. Однако даже у пациентов с долгосрочным превосходным гликемическим контролем при уровне гликозилированного гемоглобина (HbA1C) менее 8% пожизненный уровень болевой формы ДП остается более 20% [12].
Несомненным является факт, что стабилизация уровня глюкозы в крови позволяет уменьшать выраженность болевого синдрома, тогда как резкие колебания уровня гликемии способствуют усилению боли. Поэтому в терапии следует избегать эпизодов гипогликемии, которая может усугублять повреждение периферических нервных волокон.
Фармакотерапия
Фармакотерапия ДП направлена на восстановление пораженных нервов, профилактику новых нарушений (патогенетическая терапия) и уменьшение выраженности болевого синдрома (симптоматическая терапия). В первом случае используются a-липоевая кислота, бенфотиамин, факторы роста нервов, ингибиторы альдозоредуктазы, ингибиторы протеинкиназы С, ацетил-L-карнитин, сосудистая терапия [13]. Это направление терапии является важным и во многом определяет прогноз, в т.ч. и в отношении болевого синдрома. Однако это лечение проводится длительными курсами и не всегда сопровождается очевидным клиническим улучшением. В то же время даже при нетяжелой полинейропатии могут иметь место выраженные боли, которые очень часто являются ведущим фактором снижения качества жизни пациентов, приводя к нарушениям сна, депрессии, тревоге и социальной дезадаптации. Эти боли являются единственными жалобами пациента. Именно поэтому важно проводить своевременную симптоматическую терапию, направленную на устранение болевого синдрома, параллельно с патогенетической терапией.
При хронической боли любого происхождения следует воздействовать прежде всего на этиологические и патогенетические процессы, а также на всевозможные факторы, способствующие развитию и усилению боли. Лечение должно включать комплекс медикаментозных средств, физических и психотерапевтических методов. Следует помнить, что нейропатическая боль, в отличие от ноцицептивной, плохо поддается лечению обычными анальгетиками и нестероидными противовоспалительными препаратами, поэтому эти препараты для лечения болей при ДП не рекомендуются. Более того, их длительный прием для больных СД, нефропатией и ССЗ может быть опасен [6].
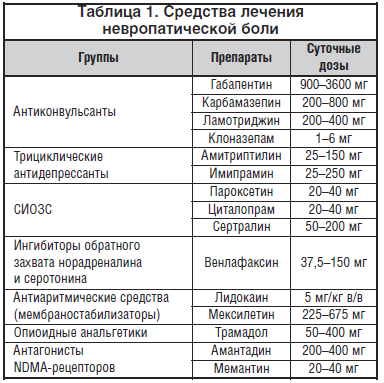
Основными группами препаратов для лечения болевой формы ДП являются антидепрессанты, антиконвульсанты, опиоидные анальгетики и местные анестетики. Основные препараты для лечения нейропатической боли представлены в таблице 1. Выбор препарата для лечения нейропатической боли проводится с учетом особенностей его терапевтического эффекта и побочного действия, имеющихся у больных сопутствующих заболеваний, а также индивидуальной переносимости.
Применение антидепрессантов
при нейропатической боли
Антидепрессанты дают положительный эффект в терапии хронической боли любого происхождения, но особенно важное место занимают в лечении нейропатической боли. Противоболевой эффект антидепрессантов не связан непосредственно с их антидепрессивным действием. Об этом свидетельствуют следующие факты: противоболевой эффект часто проявляется в значительно более низких дозах и обычно развивается быстрее, чем антидепрессивный; проявляется как у пациентов с депрессией, так и у пациентов, не страдающих аффективными расстройствами.
Терапевтическая эффективность антидепрессантов, назначаемых для облегчения нейропатической боли, была продемонстрирована при метаанализе нескольких плацебо-контролируемых исследований. Предполагают, что он связан с усилением активности норадренергических и, в меньшей степени, серотонинергических систем, оказывающих тормозящее влияние на проведение болевых импульсов по ноцицептивным путям в ЦНС. Ингибиторы обратного захвата моноаминов повышают концентрацию медиаторов в синапсах антиноцицептивной системы, активируют ее и подавляют проведение боли. Из них наименее селективны трициклические антидепрессанты [8], которые блокируют обратный захват норадреналина и серотонина в пресинаптических нейронах, что способствует активизации нисходящих антиболевых влияний и тормозит прохождение болевой афферентации. Трициклические антидепрессанты амитриптилин и имипрамин обладают наибольшей анальгетической способностью уже в первые дни лечения (амитриптилин в дозе 50–75, 150 мг и выше), в то время как антидепрессивный эффект возникает спустя лишь несколько недель или месяцев [14]. Лечение рекомендуется начинать с низкой дозы (10 мг/сут), постепенно ее титруя. Однако, помимо блокирования обратного захвата норадреналина и серотонина, трициклические антидепрессанты в разной степени блокируют постсинаптические мускариновые, холинергические, α1-адренергические и гистаминовые рецепторы. Это сопровождается рядом нежелательных эффектов, таких как сухость во рту, синусовая тахикардия, запор, задержка мочи, спутанность сознания, нарушение памяти, седативный эффект, сонливость, головокружение, ортостатическая гипотензия. Также трициклические антидепрессанты могут вызывать нарушение равновесия и когнитивные расстройства у пациентов преклонного возраста, а т.к. метаболизируются эти препараты при участии ферментов системы цитохрома Р-450, то они могут вступать во взаимодействие с другими лекарствами, которые также метаболизируются этими ферментами. Таким образом, несмотря на эффективность относительно низких доз трициклических антидепрессантов, спектр их побочных действий весьма широк (сухость во рту, тошнота, рвота, повышение внутриглазного давления, запор, задержка мочеиспускания; обусловленные адренергическим действием препаратов тахикардия, аритмии, ортостатическая гипотензия, а также выраженные седативный эффект и головокружение), что ограничивает их применение, особенно у лиц пожилого возраста.
Ингибиторы обратного захвата серотонина
Селективные ингибиторы обратного захвата серотонина (СИОЗС) имеют по сравнению с трициклическими антидепрессантами более безопасный и благоприятный профиль переносимости, однако блокируют обратный захват только серотонина, но не норадреналина. СИОЗС показаны главным образом в тех случаях, когда хроническая боль связана с депрессией, а больной плохо переносит трициклические антидепрессанты. Хотя СИОЗС вызывают меньше побочных действий, но оказывают менее отчетливый противоболевой эффект, что, возможно, объясняется отсутствием прямого влияния на норадренергическую передачу. Исследования, проведенные с представителем этой группы – флуоксетином у пациентов с нейропатической болью при ДП, демонстрировали лишь его ограниченную эффективность, и поэтому для лечения боли у пациентов с ДП он практически не используется [15].
Тем не менее показано, что другой представитель группы СИОЗС – пароксетин может обладать и самостоятельным противоболевым действием при нескольких вариантах нейропатической боли, в т.ч. и при ДП, что было подтверждено в клинических исследованиях [16]. Стартовая доза пароксетина для купирования болевого синдрома при ДП составляет 20 мг/сут, затем, при необходимости, происходит ее титрование (в зависимости от выраженности симптоматики и переносимости препарата) до 40 мг/сут, разделенных на 2 приема. Средняя терапевтическая суточная доза пароксетина для коррекции болевого синдрома составляет 20–40 мг. О поливалентности клинического действия пароксетина, а также о его хорошей переносимости свидетельствуют результаты многочисленных исследований [17].
Отмечается также, что наряду с высокой клинической активностью препарат обладает хорошей быстротой действия. Кроме того, по данным ряда исследований, пароксетин способствует снижению агрегации тромбоцитов, препятствующему тромбообразованию и оказывающему протективное воздействие на эндотелий сосудов, что является важным аспектом терапии у пациентов с СД, имеющих высокий риск развития ССЗ [18].
Ингибиторы обратного захвата серотонина
и норадреналина
В течение длительного времени трициклические антидепрессанты, включая амитриптилин, имипрамин, нортриптилин и дезипрамин, применялись в качестве препаратов первой линии терапии у больных с болевой формой ДП, однако они часто являются причиной развития тяжелых побочных эффектов, плохо переносятся многими пациентами. Большинство представителей СИОЗС, несмотря на лучшую переносимость, не приводят к более выраженному по сравнению с трициклическими антидепрессантами уменьшению болей и не используются, за редким исключением (например, пароксетин в лечении болевой формы ДП). Разработка нового класса антидепрессантов, угнетающих обратный захват как серотонина, так и норадреналина, привела к прорыву в терапии болевой формы ДП.
К этой группе препаратов относятся венлафаксин (Велафакс) и дулоксетин. Их эффективность основана на активации нисходящих серотонинергических и норадренергических проводящих путей, подавляющих боль в ЦНС [19]. В сравнительном исследовании при лечении в течение 4 нед. имипрамином – одним из самых эффективных представителей группы трициклических антидепрессантов и венлафаксином была показана одинаковая эффективность этих препаратов в уменьшении выраженности болей [20].
Венлафаксин (Велафакс) и его активные метаболиты являются сильными ингибиторами обратного захвата серотонина и норадреналина и слабыми ингибиторами обратного захвата дофамина. Венлафаксин (Велафакс) также обладает центральным эффектом за счет уменьшения восприятия боли. Схема титрования венлафаксина следующая: на 1-й нед. терапии препарат используется в дозе 37,5 мг/сут, со 2-й нед. – 75 мг/сут, на 3-й – 150 мг, при необходимости – дальнейшая титрация на 4–й нед. 225 мг/сут, разделенных на 3 приема. Быстрота эффекта обезболивающего действия венлафаксина (Велафакс) отмечается к началу 4-й нед. приема препарата.
Число больных, которых необходимо пролечить венлафаксином для получения достоверного эффективного результата – снижения выраженности болевого синдрома на 50% за 4 нед. терапии, рассчитано по результатам многих клинических исследований и составляет 5 пациентов (95% ДИ 3,4–14), что является демонстрацией его высокой эффективности. Для объективности оценки этих данных приведем пример этого же показателя для других препаратов, часто рекомендуемых и использующихся в настоящее время в терапии болевой формы ДП: прегабалин – 4,5, но длительность терапии – более 6 нед. и при использовании максимальных дозировок, габапентин – 4, но в дозе 3600 мг/сут и длительность терапии – более 4 нед. [21].
Непрямой метаанализ эффективности второго представителя этого класса антидепрессантов – дулоксетина в сравнении с габапентином и прегабалином также показал, что он сопоставим по эффективности и безопасности с этими препаратами, рекомендуемыми в последнее время как самые эффективные при болевых проявлениях полинейропатии [22].
К настоящему времени накоплен достаточный опыт эффективного клинического применения венлафаксина (Велафакс) у пациентов с болевой формой диабетического поражения нервной системы, во всех клинических исследованиях он обеспечивал достоверное уменьшение боли по сравнению с плацебо. Наиболее частыми побочными эффектами были тошнота, сухость во рту и сонливость. Помимо снижения выраженности боли в течение дня прием препарата также приводит к уменьшению ночных болей и улучшению качества жизни. Эффективность венлафаксина (Велафакс) в наибольшей степени связана с прямыми эффектами этого препарата и не зависит от возраста, пола, типа СД и длительности диабетической нейропатии [23–26]. В мае 2010 г. появилась новая, пролонгированная форма Велафакса – Велафакс МВ капсулы, которая показывает лучшую переносимость по сравнению с другими формами.
Применение антиконвульсантов
при нейропатической боли
Антиконвульсанты наиболее эффективны при острой и пароксизмальной боли. Особый интерес представляют данные о том, что антиконвульсанты, уменьшая импульсную активность мембран аксонов, не только снижают выраженность сенсорной симптоматики, но и улучшают функцию нервной системы и уменьшают выраженность апоптоза [27], что позволяет предположить патогенетический механизм их действия при ДП. По данным контролируемых исследований, антиконвульсанты уменьшают интенсивность болевых ощущений не менее чем на половину примерно у 50% пациентов с нейропатической болью. Из антиконвульсантов в клинической практике чаще всего применяют карбамазепин, особенно при наличии тригеминальной и постгерпетической невралгии, а также для терапии болевого синдрома на фоне диабетической нейропатии [28]. Частота купирования болевого синдрома при тригеминальной невралгии на фоне приема карбамазепина колеблется, по данным разных авторов, в пределах 58–90%, а при диабетической нейропатии достигает 63%, что наравне с экономической доступностью определяет широкое использование препарата при этих заболеваниях [29]. Механизм его действия, возможно, связан с блокадой натриевых каналов.
Карбамазепин первоначально назначают в дозе 100 мг 2 р./сут, а затем ее повышают до 200 мг 3–4 р./сут. Максимальная доза составляет 1200 мг/сут. Побочные эффекты (головокружение, атаксия, нарушение зрения, тошнота, сонливость, головная боль) менее вероятны при медленном увеличении дозы. Предпочтительнее использовать препараты карбамазепина с замедленным высвобождением (например, карбамазепин ретард), которые достаточно принимать 2 р./сут. Они обеспечивают более стабильную концентрацию препарата в течение суток, что снижает вероятность побочного эффекта.
Таким образом, для успешной терапии нейропатической боли, являющейся проявлением дистальной ДП, необходимы максимально ранняя диагностика этого осложнения у пациента с СД, учитывая период длительного латентного течения данной патологии, и своевременное начало лечения. Безусловно, ранняя комбинированная терапия является наиболее перспективной в лечении болевой формы ДП, и оптимальным будет сочетание препаратов из разных групп, что может позволить достичь максимального снижения боли с минимальным риском побочных реакций. В этом плане наиболее приемлемой может быть комбинация из следующих препаратов: антиконвульсанта карбамазепина и антидепрессанта (венлафаксин, пароксетин).
Литература
1. Wild S., Roglic G. et al. Global Prevalence of Diabetes. Estimates for the year 2000 and projections for 2030 // Diabetes Care. 2004. Vol. 27. Р. 1047–1053.
2. Дедов И.И., Ремизов О.В., Петеркова В.А. Сахарный диабет второго типа у детей и подростков // Сахарный диабет. 2001. № 4. С. 26–31.
3. Partanen J., Niskanen L., Lehtinen J. et al. Natural history of peripheral neuropathy in patients with non-insulin-dependent diabetes mellitus // N Engl J Med. 1995. Vol. 333. Р. 89–94.
4. Young M.J., Boulton A.J., MacLeod A.F., Williams D.R., Sonksen P.H. A multicentre study of the prevalence of diabetic peripheral neuropathy in the United Kingdom hospital clinic population // Diabetologia. 1993. Vol. 36. Р. 150–154.
5. Veves A., Backonja M., Malik R. A. Painful diabetic neuropathy: epidemiology, natural history, early diagnosis, and treatment options // Pain Med. 2008. Vol. 9 (6). Р. 660–674.
6. Данилов А.Б., Давыдов О.С. Нейропатическая боль. М.: Боргес, 2007.
7. Boulton A.J.M., Vinik A.I., Arezzo J.C. et al. Diabetic neuropathies: a statement by the American Diabetes Association // Diabetes Care. 2008. Vol. 28. Р. 5956–5962.
8. Левин О.С. Полинейропатии. М.: Медицинское информационное агентство, 2005.
9. Writing Team for the DCCT/EDIC Research Group: Effect of intensive therapy on the microvascular complications of type 1 diabetes mellitus // JAMA. 2002. Vol. 287. Р. 2563–2569.
10. UKPDS 33 // Lancet. 1998. Vol. 352. Р. 837–853.
11. Adler A.I., Boyko E.J., Ahroni J.H., Stensel V. et al. Risk factors for diabetic peripheral sensory neuropathy: results of the Seattle Prospective Diabetic Foot Study // Diabetes Care. 1997. Vol. 20. Р. 1162–1167.
12. Martin C.L., Albers J., Herman W.H., Cleary P. Neuropathy among the diabetes control and complications trial cohort 8 years after trial completion // Diabetes Care. 2006. Vol. 29. Р. 340–344.
13. Строков И.А., Баринов А.Н. Клиника, патогенез и лечение болевого синдрома при диабетической полиневропатии // Неврол. журн. 2001. № 6. С. 47–55.
14. Max M.B., Lynch S.A., Muir J. et al. Effects of desipramine, amitriptyline, and fluoxetine on pain in diabetic neuropathy // N Engl J Med. 1992. Vol. 326. Р. 1250–1256.
15. Ziegler D. Painful diabetic neuropathy: treatment and future aspects // Diabetes Metab Res Rev. 2008, May-Jun. Vol. 24 (Suppl 1). Р. 52–57.
16. Sindrup S. H., Gram L. F., Brosen K. et al. The selective serotonin reuptake inhibitor paroxetine is effective in the treatment of diabetic neuropathy symptoms // Pain. 1990. Vol. 42. Р. 135–144.
17. Дорожек И.Ю., Воронова Е.И. Плизил (пароксетин) при терапии непсихотических тревожных депрессий // Псих. расстройства в общей медицине. 2009. № 2. С. 34–37.
18. Медведев В.Э., Копылов Ф.Ю., Макух Е.А. Терапия депрессий при гипертонической болезни (на модели препарата Плизил) // Псих. расстройства в общей медицине. 2008. № 4. С. 51–55.
19. Данилов А.Б., Раймкулова О.К. Лечение болевых синдромов антидепрессантом венлафаксином // Журнал неврологии и психиатрии. 2009. № 1. С. 76–79.
20. Sindrup S.H., Bach F.W., Madsen C. et al. Venlafaxine versus imipramine in painful polyneuropathy: a randomized, controlled trial // Neurology. 2003. Vol. 60. Р. 1284–1289.
21. Finnerup N.B., Otto M., McQuay H.J. et al. Algorithm for neuropathic pain treatment: an evidence based proposal // Pain. 2005. Vol. 118. Р. 289–305.
22. Edwards K.R., Glantz M.J., Button J. et al. Efficacy and safety of topiramate in the treatment of painful diabetic neuropathy: a double-blind, placebo-controlled study // Neurology. 2000. Vol. 5 (Suppl 3). A81.
23. Davis J.L., Smith R.L. Painful peripheral diabetic neuropathy treated with venlafaxine HCl extended release capsules // Diabetes Care. 1999. Vol. 22. Р. 1909–1910.
24. Rowbotham M.C., Goli V., Kunz N.R., Lei D. Venlafaxine extended release in the treatment of painful diabetic neuropathy: a double-blind, placebo-controlled study // Pain. 2004. Vol. 110 (3). Р. 697–706.
25. Kadiroglu A.K., Sit D., Kayabasi H. et al. The effect of venlafaxine HCl on painful peripheral diabetic neuropathy in patients with type 2 diabetes mellitus // J Diabetes Complications. 2008. Vol. 22 (4). Р. 241–245.
26. Lithner F. Venlafaxine in treatment of severe painful peripheral diabetic neuropathy // Diabetes Care. 2000. Vol. 23. Р. 1710–1711.
27. Vinik A., Pittenger G., Anderson A. et al. Topiramate improves C-fiber neuropathy and features of the dysmetabolic syndrome in type 2 diabetes. Program and abstracts of the 63rd Scientific Sessions of the American Diabetes Association. 2003, June 13-17, New Orleans, Louisiana. Abstract A130.
28. Papp J., Simpson D.M. Safety profile of treatment in diabetic peripheral neuropathic pain // Pain Med. 2007, Sep. Vol. 8. Suppl 2. Р. 43–49.
29. Sindrup S.H., Jensen T.S. Efficacy of pharmacological treatments of neuropathic pain: an update and effect related to mechanism of drug action // Pain. 1999. Vol. 83. Р. 163–168.












