Перед современным практикующим врачом стоит сложная задача выбора приоритетов в лечении больных, которые зачастую принимают ежедневно целый ряд лекарственных средств для минимизации риска прогрессирования заболеваний сердечно–сосудистой системы. В то же время представляется принципиальным рассматривать категорию больных с цереброваскулярной патологией в рамках генерализованного мультифокального повреждения всей сердечно–сосудистой системы. Так, хорошо известно, что атеросклероз крайне редко изолированно поражает отдельные сосудистые бассейны. В подавляющем большинстве случаев в патологический процесс вовлекаются одновременно коронарные артерии, аорта и артерии нижних конечностей и брахиоцефальные сосуды. К основным механизмам, возникающим при хронической ишемии головного мозга, относятся снижение локального мозгового кровотока, вторичные нарушения ауторегуляции и снижение поступления кислорода и субстратов в вещество мозга [1,5,13].
Специфической функцией нервной клетки является нейрональная передача, осуществляемая нейротрансмиттерами, синтезируемыми самой клеткой, то есть ухудшение локального мозгового кровотока приводит к нарушению синтеза энергии нейронами, расстройству специфических клеточных функций, а также нарушению морфологической целостности клеток. Таким образом, формируется ишемическо–гипоксический каскад, темпы развития которого прямо пропорциональны степени снижения мозгового кровотока. В свою очередь гипоксия и ишемия нервных клеток провоцируют нарушение циклов анаэробного и аэробного гликолиза, снижение синтеза АТФ, глутаматную эксайтоксичность [2,10,11]. Целью назначения современных антиоксидантов является активация синтеза энергии, ингибирование оксидантного стресса и повышение резистентности нервных клеток к гипоксии и ишемии.
Одним из таких лекарственных средств является отечественный препарат Мексиприм. Он относится к группе гетероароматических антиоксидантов, действующим веществом его является этилметилгидроксипиридина сукцинат. Препарат имеет широкий спектр фармакологической активности с преимущественным антиоксидантным и мембранопротекторным действием [7,8]. Мексиприм ингибирует перекисное окисление липидов, повышает активность супероксиддисмутазы, уменьшает вязкость мембраны, увеличивает ее текучесть. Также он модулирует активность мембраносвязанных ферментов (кальций–независимой фосфодиэстеразы, аденилатциклазы, ацетилхолинэстеразы), рецепторных комплексов (бензодиазепинового, γ–аминомасляного – ГАМК, ацетилхолинового), что усиливает их способность связывания с лигандами, способствует сохранению структурно–функциональной организации биомембран, транспорта нейромедиаторов и улучшению синаптической передачи. Мексиприм также повышает содержание дофамина в головном мозге [3,12]. В нашем исследовании изучалось действие данного современного антиоксиданта у больных с хроническими формами недостаточности кровоснабжения головного мозга.
Материалы и методы
В период с августа по октябрь 2011 г. были обследованы 46 пациентов. Всем им на основании клинико–неврологического обследования, данных нейровизуализации (КТ, МРТ головного мозга), методов нейропсихологического тестирования было подтверждено наличие хронической недостаточности мозгового кровообращения 1–2 ст. на фоне артериальной гипертензии и атеросклероза церебральных сосудов. С целью исключения бессимптомного стеноза магистральных сосудов головы, а также для определения степени атеросклеротического поражения сонных и позвоночных артерий всем больным была выполнена УЗДГ экстракраниальных сосудов. В клинической картине имели место умеренные и легкие когнитивные нарушения, полисистемные вегетативные нарушения, атаксические и пирамидные проявления в виде рассеянной мелкоочаговой неврологической симптоматики.
Основную группу составили 25 человек, которые на фоне базовой терапии (антигипертензивные препараты, статины, антиагреганты в среднетерапевтических дозировках) получали дополнительно в течение 10 дней 200 мг/сут. Мексиприма внутривенно, а затем в течение шести недель принимали Мексиприм 125 мг 3 раза в сутки per os. Контрольную группу (21 чел.) составили пациенты, которые получали лишь базовую терапию без Мексиприма. Все больные дважды прошли нейропсихологическое тестирование (тест MMSE и тесты Шульте и Спилбергера), а также до терапии и спустя два месяца после нее – биохимическое исследование в виде развернутой липидограммы, коагулограммы с определением маркеров тромбообразования. Частота и тяжесть нежелательных побочных явлений, колебания артериального давления и частоты сердечных сокращений оценивались по дневникам пациентов. Статистическая обработка результатов проводилась с помощью пакета прикладных программ Statistica 6 фирмы «Stat Soft».
Результаты и обсуждение
Основные половозрастные характеристики в исследуемых группах были представлены следующим образом. В первой группе средний возраст составлял 59,2±2,45 года, преобладали женщины в соотношении 1,8:1. Во второй группе средний возраст составил 57,6±2,3 года, также в большей степени доминировали женщины в соотношении 1,9:1.
Степени когнитивных нарушений, уровней личностной и реактивной тревожности, концентрации и устойчивости внимания в обеих группах пациентов при проведении психометрического тестирования до лечения также были сопоставимы (табл. 1). Клинически когнитивные изменения в исследуемых группах больных проявлялись жалобами на трудности усвоения новой информации, сложности в использовании новой бытовой техники, мобильных устройств, нарушение памяти на текущие события, повышенную забывчивость на работе, в быту, трудности сосредоточения.
На фоне приема Мексиприма в основной группе достоверно улучшилось выполнение теста Шульте на устойчивость внимания и динамику работоспособности. В тоже время в контрольной группе на фоне проводимого лечения результаты изменились незначительно, сохранялись истощаемость внимания, снижение концентрации внимания. Так, при подсчете цифр в каждой из пяти предлагаемых таблиц в контрольной группе отмечались и после лечения значительные колебания времени, необходимого для выполнения теста, с четкой тенденцией к его увеличению к концу заполнения таблиц.
Такая же динамика отмечалась при выполнении теста MMSE, где в основной группе после лечения показатели шкалы приблизились к норме, а в контрольной группе изменились незначительно. Положительное влияние Мексиприма на когнитивные нарушения, не достигающие степени деменции, можно объяснить его как антиоксидантным, мембранопротективным действием, так и нейромедиаторной активностью в отношении дофамина.
Отчетливый противотревожный эффект Мексиприма был получен в основной группе пациентов после проведенного лечения. Так, личностная тревожность по тесту Спилбергера до лечения составляла 48,1±3,8 балла, а к концу терапии – 27,4±2,3 балла (p<0,001). Реактивная тревожность в основной группе изменилась в результате лечения также статистически значимо: с 41,2±3,6 до 24,4±3,1 балла (p<0,05). В то же время в контрольной группе личностная тревожность уменьшилась незначительно, а реактивная тревожность даже возросла.
Причинно–следственные связи между хронической цереброваскулярной недостаточностью и эмоционально–аффективными расстройствами могут быть объяснены с учетом современных клинико–экспериментальных исследований [3,11]. У больных с хронической ишемией головного мозга часто развиваются патологическая тревога, астенический и вегетативный симптомокомплексы. При этом в развитии тревожных расстройств одно из ведущих мест занимает нарушение ингибирующего влияния в ЦНС
γ–аминомасляной кислоты (ГАМК). На фоне гемодинамических нарушений в головном мозге происходит снижение чувствительности ГАМК–бензодиазепинового комплекса, а также угнетение физиологических противотревожных механизмов. Нарушение ГАМК–зависимых процессов в ЦНС опосредует дисфункцию серотонин–, катехоламин– и пептидергических систем, приобретающих при последующем развитии и прогрессировании тревожных расстройств роль самостоятельных патогенетических механизмов [12]. Следовательно, с одной стороны, гипоксические и ишемические процессы в головном мозге способствуют развитию психоэмоциональных нарушений, а с другой стороны, длительно текущий хронический дистресс вызывает прогрессирование проявлений энцефалопатии.
Наличие в составе Мексиприма янтарной кислоты способствует через цепь нейрохимических реакций повышению в головном мозге уровня ГАМК. Таким образом, использование данного современного антиоксиданта позволяет значительно уменьшать тревогу, страхи, степень диссомнических нарушений у больных с хронической цереброваскулярной недостаточностью. При этом очевидным преимуществом Мексиприма является отсутствие у него активирующего действия, повышения судорожной готовности, нарушений сна.
Так, в проведенном исследовании для купирования тревожных расстройств дополнительного назначения анксиолитиков у больных в основной группе не потребовалось. В контрольной группе для коррекции патологической тревоги у 16 пациентов использовались атипичные бензодиазепины (клоназепам 0,5 мг/сут. или альпрозолам 1,5 мг/сут.).
В ходе проведенного исследования изменились также основные показатели липидного обмена и свертывающей системы крови на фоне приема Мексиприма. Многофакторный механизм развития сосудистой мозговой недостаточности, общепринятый в настоящее время, включает корригируемые и некорригируемые факторы (возраст, наследственная отягощенность, ранее перенесенные сосудистые катастрофы) риска развития ишемических цереброваскулярных заболеваний. Артериальную гипертензию, сахарный диабет, атеросклеротический стеноз сонных и позвоночных артерий, курение, гиперхолестеринемию, гипертриглицеридемию относят к первой группе факторов. Нарушение липидного обмена значительно повышает риск развития основных сердечно–сосудистых заболеваний [4,8,13].
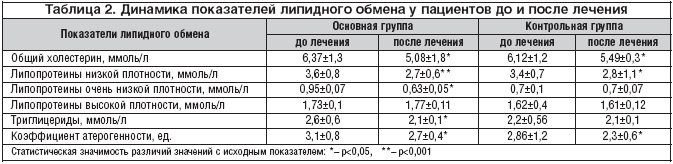
В проведенном исследовании в основной и контрольной группах до лечения отмечались умеренные нарушения липидного обмена в виде гиперхолестеринемии, гипертриглицеридемии, умеренного повышения липопротеинов низкой и очень низкой плотности. На фоне проведенного лечения в основной и контрольной группах отмечается положительная динамика (табл. 2). Так, уровень общего холестерина в основной группе снизился с 6,37±1,3 до 5,08±1,8 ммоль/л (p<0,05), а в контрольной группе – с 6,12±1,2 до 5,49±0,3 ммоль/л (p<0,05). Уровень липопротеинов низкой плотности снизился в основной группе с 3,6±0,8 до 2,7±0,6 ммоль/л (p<0,001). В контрольной группе уровень понижения данного показателя был менее значителен: с 3,4±0,7 до 2,8±1,1 ммоль/л (p<0,05). Разные темпы снижения основных показателей липидного обмена наблюдались в основной и контрольной группах при исследовании уровня триглицеридов и коэффициента атерогенности. Полученные данные показывают очевидную эффективность Мексиприма в коррекции нарушений липидного обмена.
Нарушение в системе гемостаза в виде гиперкоагуляции и тромбообразования может приводить к развитию и прогрессированию цереброваскулярной патологии. В результате патологических изменений происходит нарушение ауторегуляции мозгового кровообращения, возникает его большая зависимость от состояния системной гемодинамики [3,4]. Полученные в ходе исследования показатели гемостаза и реологических свойств крови представлены в таблице 3. В соответствии с наличием многочисленных факторов риска развития сердечно–сосудистых заболеваний, а также лабораторными показателями свертывающей системы крови больные в нашем исследовании принимали в комплексной терапии антиагреганты. Основные маркеры тромбинемии в виде D–димера и растворимых фибрин–мономерных комплексов (РФМК) в обеих группах сравнения были повышены и объективно указывали на высокую вероятность сердечно–сосудистых осложнений. Известно, что повышенное содержание в плазме D–димера является одним из главных показателей активации системы гемостаза, поскольку он отражает как образование фибрина в сосудах, так и реактивное повышение фибринолиза.
На фоне проведенной терапии отмечалась отчетливая тенденция снижения основных маркеров тромбообразования, более выраженная в основной группе. Так, уровень D–димера в основной группе снизился с 728,0±8,1 до 435,3±6,1 нг/мл (p<0,001), в контрольной группе – с 695,3±7,2 до 550,2±6,7 нг/мл (p<0,05). Уровень РФМК снизился в основной группе с 9,3±0,3 до 3,6±0,3 мг/100 м (p<0,001). Аналогичный показатель в контрольной группе на фоне проводимой терапии также понижался, но менее значимо: с 8,5±1,2 до 5,3±1,4 мг/100 м (p<0,05). Также на фоне проводимой терапии в основной группе пациентов отмечалось значимое снижение уровня фибриногена с 4,98±0,2 до 3,2±0,5 г/л (p<0,05), что не наблюдалось в контрольной группе. Наряду с этим в обеих группах также можно отметить снижение фибринолитической активности плазмы, что также указывает на снижение тромбогенного потенциала у исследуемых пациентов. Следовательно, можно отметить, что Мексиприм потенцирует действие антиагрегантов, способствует значимому улучшению реологических свойств крови и системы гемостаза.
За время лечения препаратом Мексиприм ни у одного пациента на фоне приема препарата в комбинации с другими лекарственными средствами не было отмечено нежелательных побочных эффектов. Также не было зарегистрировано изменений в показателях артериального давления и частоты сердечных сокращений. По окончанию терапии 92% пациентов в основной группе отметили значимое улучшение в своем состоянии. Один больной оценил результаты лечения как удовлетворительные и один – без существенной динамики. В группе контроля 24% пациентов отметили улучшение, 28,5% оценивали свое состояние по окончанию терапии как удовлетворительное, а 47% – без существенной динамики.
Таким образом, применение в комплексной терапии больных с хронической цереброваскулярной недостаточностью современных антиоксидантов позволяет достичь заметного улучшения в когнитивной и психоэмоциональной сферах. Прежде всего это относится к повышению продуктивности мнестической деятельности, концентрации и устойчивости внимания, а в целом – к повышению темпов психической деятельности и работоспособности. Мексиприм обладает выраженным антистрессорным действием, достоверно уменьшает проявления генерализованной и соматической тревоги, способствует нормализации сна. Кроме того, он потенцирует действие антиагрегантов, статинов, обладает самостоятельным антиатерогенным действием. Применение Мексиприма способствует нормализации реологических свойств крови, показателей гемостаза, уменьшению риска тромбообразования. С учетом высокого профиля безопасности, многообразных механизмов действия на сердечно–сосудистую и вегетативную нервную систему Мексиприм может с успехом применяться в терапии больных с хронической ишемией мозга.


Литература
1. Афанасьев В.В., Баранцевич Е.Р., Румянцева С.А. и др. Фармакотерапия синдромов ишемии. – СПб., М.: ООО «Юралекс», 2011. – 76 с.
2. Бобырев В.Н., Весельский И.Ш., Бобырева Л.Е. Антиоксиданты в профилактике и терапии церебрального атеросклероза // Журнал неврологии и психиатрии. – 1989. – № 9. – С. 60–63.
3. Боголепова А.Н., Семушкина Е.Г. Роль сердечно–сосудистой патологии в формировании и прогрессировании когнитивных нарушений // Неврологический журнал. – 2011.– № 4. – С. 27 – 30.
4. Воробьев А.И., Буевич Е.И. Проблемы физиологии и патологии системы гемостаза. – Барнаул, 2000. – 346 с.
5. Гусев Е.И.., Скворцова В.И. Ишемия головного мозга. – М: Медицина, 2001.– 328 с.
6. Захаров В.В., Яхно Н.Н. Синдром умеренных когнитивных расстройств в пожилом возрасте: диагностика и лечение // Русский медицинский журнал. – 2004. – № 10. – С. 573–576.
7. Костенко Е.В., Петрова Л.В., Зайцев К.А и др. Опыт применения антиоксидантной терапии (мексиприм) при лечении больных в раннем восстановительном периоде ишемического инсульта полушарной локализации // РМЖ.– 2010. – № 18:22.– С. 1–5.
8. Кукес В., Шиллер Л., Хаджиева Б., Беляева С. Применение препарата Мексиприм в терапии цереброваскулярной болезни // Врач. – 2008. – №3. – С. 55 – 61.
9. Левин О.С. Ранняя диагностика деменции // Пожилой пациент.– 2009. – №1. – С. 20–30.
10. Левин О.С. Алгоритмы диагностики и лечения деменции. – М., 2005. – 38 с.
11. Путилина М.В., Гришин Д.В. Мексиприм в комплексной терапии пациентов с шейной дорсопатией и синдромом позвоночной артерии // Журнал неврологии и психиатрии. – 2011. – №11.
12. Путилина М.В. Современные представления о терапии тревожно–депрессивных расстройств при хронической ишемии головного мозга // РМЖ. – 2011. – № 19:2.– С. 1–6.
13. Федин А.И. Оксидантный стресс и применение антиоксидантов в неврологии // Атмосфера. Нервные болезни. – 2002.– № 2. – С. 2–12.
14. Van der Flier W.M., Scheltens P. Epidemiology and risk factors of dementia // J. Neurol. Neurosurg Psychiatry. – 2005. – Vol. 76 (Suppl. 2). – P. 7.
15. Waldemar G., Dubois B., Emre M. et al. Alzheimer's disease and other disorders associated with dementia // European Handbook of Neurological Management / R. Hudges et al. (eds). – Blackwell Publishing Ltd, 2006. – P.266–298.












