–Ю–і–љ–∞–Ї–Њ –Є—Б—В–Є–љ–љ–∞—П –Є—Б—В–Њ—А–Є—П –Є–Ј—Г—З–µ–љ–Є—П –Љ–µ–і–ї–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є –Ї–∞–Ї –љ–∞—Г—З–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ—Л –љ–∞—З–∞–ї–∞—Б—М –ї–Є—И—М —Б —Б–µ—А–µ–і–Є–љ—Л –•–• –≤., —В.–µ. —Б —В–Њ–≥–Њ –Љ–Њ–Љ–µ–љ—В–∞, –Ї–Њ–≥–і–∞ –С—М—С—А–љ –°–Є–≥—Г—А–і—Б–Њ–љ – –њ—А–Њ—Д–µ—Б—Б–Њ—А –†–µ–є–Ї—М—П–≤–Є–Ї—Б–Ї–Њ–≥–Њ –Є–љ—Б—В–Є—В—Г—В–∞ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є (–Ш—Б–ї–∞–љ–і–Є—П) – –њ—А–Њ—З–Є—В–∞–ї —Б–≤–Њ–Є –Ј–љ–∞–Љ–µ–љ–Є—В—Л–µ –ї–µ–Ї—Ж–Є–Є –≤ –Ы–Њ–љ–і–Њ–љ—Б–Ї–Њ–Љ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–µ.
–Ч–∞–і–Њ–ї–≥–Њ –і–Њ —Н—В–Њ–≥–Њ –С. –°–Є–≥—Г—А–і—Б–Њ–љ –±—Л–ї –њ—А–Є–≥–ї–∞—И–µ–љ –Є—Б–ї–∞–љ–і—Б–Ї–Є–Љ–Є —Д–µ—А–Љ–µ—А–∞–Љ–Є –і–ї—П –≤—Л—П—Б–љ–µ–љ–Є—П –њ—А–Є—З–Є–љ –Љ–∞—Б—Б–Њ–≤—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Њ–≤–µ—Ж –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–µ—А–Љ–∞—Е –Њ—Б—В—А–Њ–≤–∞. –Ю–љ —Б—В–Њ–ї–Ї–љ—Г–ї—Б—П —Б –≤–µ—Б—М–Љ–∞ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є —Н—В–Є—Е –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ —А–∞–Ј–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї–Є –њ—А–Є–Ј–љ–∞–Ї–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П —Г –ґ–Є–≤–Њ—В–љ—Л—Е –Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (–¶–Э–°), –Є –љ–∞—А—Г—И–µ–љ–Є—П —Б–Њ —Б—В–Њ—А–Њ–љ—Л –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤. –Ю–і–љ–∞–Ї–Њ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —А–∞–Ј–ї–Є—З–Є—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є, –С. –°–Є–≥—Г—А–і—Б–Њ–љ –Њ–±–љ–∞—А—Г–ґ–Є–ї –Љ–µ–ґ–і—Г —Н—В–Є–Љ–Є –±–Њ–ї–µ–Ј–љ—П–Љ–Є –Є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ —З–µ—А—В—Л —Б—Е–Њ–і—Б—В–≤–∞: –љ–µ–Њ–±—Л—З–љ–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ—Л–є –Є–љ–Ї—Г–±–∞—Ж–Є–Њ–љ–љ—Л–є –њ–µ—А–Є–Њ–і (–≥–Њ–і—Л), –Љ–µ–і–ї–µ–љ–љ–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–є —Е–∞—А–∞–Ї—В–µ—А —В–µ—З–µ–љ–Є—П –њ—А–Њ—Ж–µ—Б—Б–∞, –љ–µ–Њ–±—Л—З–љ–Њ—Б—В—М –њ–Њ—А–∞–ґ–µ–љ–Є—П –Њ—А–≥–∞–љ–Њ–≤ –Є —В–Ї–∞–љ–µ–є –Є –љ–µ–Є–Ј–±–µ–ґ–љ—Л–є –ї–µ—В–∞–ї—М–љ—Л–є –Є—Б—Е–Њ–і. –Ш–Љ–µ–љ–љ–Њ —Н—В–Є —З–µ—В—Л—А–µ –њ—А–Є–Ј–љ–∞–Ї–∞ –Є –ї–µ–≥–ї–Є –≤ –Њ—Б–љ–Њ–≤—Г –љ–∞–Є–Љ–µ–љ–Њ–≤–∞–љ–Є—П —В–∞–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є «–Љ–µ–і–ї–µ–љ–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є» [2–4].
–Т 2014 –≥. —Н—В–Њ–Љ—Г –≤—Л–і–∞—О—Й–µ–Љ—Г—Б—П —Б–Њ–±—Л—В–Є—О –Є—Б–њ–Њ–ї–љ—П–µ—В—Б—П 60 –ї–µ—В, –∞ —В–Њ–≥–і–∞ – –≤ —Б–µ—А–µ–і–Є–љ–µ –•–• —Б—В–Њ–ї–µ—В–Є—П – –±—Л–ї –њ–µ—А–Є–Њ–і –±—Г—А–љ–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –≤–Є—А—Г—Б–Њ–ї–Њ–≥–Є–Є, —Б–≤—П–Ј–∞–љ–љ—Л–є —Б –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–Є–Љ—Б—П –Њ—В–Ї—А—Л—В–Є–µ–Љ –Є –Є–Ј—Г—З–µ–љ–Є–µ–Љ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –≤–Є—А—Г—Б–љ—Л—Е –∞–≥–µ–љ—В–Њ–≤ – –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Њ—Б—В—А—Л—Е –ї–Є—Е–Њ—А–∞–і–Њ—З–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Ш –Є–Љ–µ–љ–љ–Њ —В–Њ–≥–і–∞, —Б –љ–∞—З–∞–ї–∞ –≤—В–Њ—А–Њ–є –њ–Њ–ї–Њ–≤–Є–љ—Л –•–• –≤., –љ–∞—З–Є–љ–∞–µ—В –≤—Б–µ –±–Њ–ї–µ–µ —Г–Ї—А–µ–њ–ї—П—В—М—Б—П –Љ–љ–µ–љ–Є–µ –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Є —И–Є—А–Њ–Ї–Њ–≥–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—П —Б–Ї—А—Л—В—Л—Е —Д–Њ—А–Љ –≤–Є—А—Г—Б–љ–Њ–≥–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –Ю—В—Б—О–і–∞ –њ–Њ–љ—П—В–љ–Њ, –њ–Њ—З–µ–Љ—Г –≤ –њ—А–µ–і–њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е—Б—П —Н–љ–µ—А–≥–Є—З–љ—Л—Е –њ–Њ–Є—Б–Ї–∞—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Љ–µ–і–ї–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є –≥–Њ—Б–њ–Њ–і—Б—В–≤–Њ–≤–∞–ї–Њ –Љ–љ–µ–љ–Є–µ –Њ–± –Є—Е –≤–Є—А—Г—Б–љ–Њ–є –њ—А–Є—А–Њ–і–µ [5].
–Ш –≤—Б–Ї–Њ—А–µ —В–∞–Ї–Њ–µ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ, –Ї–∞–Ї –Ї–∞–Ј–∞–ї–Њ—Б—М, –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ —Б—В–∞–ї–Њ –Њ–њ—А–∞–≤–і—Л–≤–∞—В—М—Б—П. –Т 1960 –≥. –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –С. –°–Є–≥—Г—А–і—Б–Њ–љ–∞ –±—Л–ї –≤—Л–і–µ–ї–µ–љ –≤–Є—А—Г—Б –≤–Є—Б–љ—Л – –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—М —В–Є–њ–Є—З–љ–Њ–є –Љ–µ–і–ї–µ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –Њ–≤–µ—Ж, –Њ–њ–Є—Б–∞–љ–љ–Њ–є –µ—Й–µ –°–Є–≥—Г—А–і—Б–Њ–љ–Њ–Љ –≤ –µ–≥–Њ –њ–µ—А–≤—Л—Е –ї–µ–Ї—Ж–Є—П—Е. –Я–Њ —Б–≤–Њ–Є–Љ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ —Б–≤–Њ–є—Б—В–≤–∞–Љ –≤–Є—А—Г—Б –≤–Є—Б–љ—Л –Њ–Ї–∞–Ј–∞–ї—Б—П –±–ї–Є–Ј–Њ–Ї —Е–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ—Л–Љ –Њ–љ–Ї–Њ—А–љ–∞–≤–Є—А—Г—Б–∞–Љ [6]. –≠—В–Њ –Њ—В–Ї—А—Л—В–Є–µ –µ—Й–µ –±–Њ–ї–µ–µ —Г–Ї—А–µ–њ–Є–ї–Њ –Љ–љ–µ–љ–Є–µ –Њ –≤–Є—А—Г—Б–љ–Њ–є –њ—А–Є—А–Њ–і–µ –Љ–µ–і–ї–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є. –Ш, –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –≤—Б–Ї–Њ—А–µ –±—Л–ї –њ–Њ–ї—Г—З–µ–љ –Њ—З–µ–љ—М –≤–∞–ґ–љ—Л–є –∞—А–≥—Г–Љ–µ–љ—В –≤ –њ–Њ–ї—М–Ј—Г —В–∞–Ї–Њ–≥–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П – —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –≤–Є—А—Г—Б–љ–∞—П –њ—А–Є—А–Њ–і–∞ –Є–Ј–≤–µ—Б—В–љ–Њ–є –µ—Й–µ —Б 1933 –≥. –Љ–µ–і–ї–µ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –і–µ—В–µ–є –Є –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤ – –њ–Њ–і–Њ—Б—В—А–Њ–≥–Њ —Б–Ї–ї–µ—А–Њ–Ј–Є—А—Г—О—Й–µ–≥–Њ –њ–∞–љ—Н–љ—Ж–µ—Д–∞–ї–Є—В–∞ (–Я–°–Я–≠) – —Б–Љ–µ—А—В–µ–ї—М–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤—Л–Ј—Л–≤–∞–µ–Љ–Њ–≥–Њ, –Ї–∞–Ї –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, –≤–Є—А—Г—Б–Њ–Љ –Ї–Њ—А–Є [7].
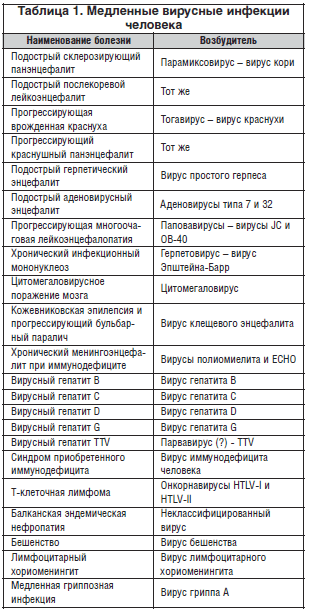
–Ф–∞–ї—М–љ–µ–є—И–µ–µ —А–∞–Ј–≤–Є—В–Є–µ –њ—А–Њ–±–ї–µ–Љ—Л –Љ–µ–і–ї–µ–љ–љ—Л—Е –≤–Є—А—Г—Б–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є –Њ—В–ї–Є—З–∞–ї–Њ—Б—М –љ–µ–Њ–±—Л—З–∞–є–љ—Л–Љ –і–Є–љ–∞–Љ–Є–Ј–Љ–Њ–Љ: —А–Њ–і–Є–≤—И–Є—Б—М –≤ —А–∞–Љ–Ї–∞—Е –≤–µ—В–µ—А–Є–љ–∞—А–Є–Є, —Н—В–∞ –њ—А–Њ–±–ї–µ–Љ–∞ —Г–≤–µ—А–µ–љ–љ–Њ –≤–Њ—И–ї–∞ –≤ –Љ–µ–і–Є—Ж–Є–љ—Г, –Ї–Њ–≥–і–∞ –Љ–µ–і–ї–µ–љ–љ—Л–µ –≤–Є—А—Г—Б–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є –±—Л–ї–Є –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ–Њ –Њ–њ–Є—Б–∞–љ—Л —Г —З–µ–ї–Њ–≤–µ–Ї–∞ (—В–∞–±–ї. 1).
–≠—В–Є –±–µ–Ј—Г—Б–ї–Њ–≤–љ—Л–µ —Г—Б–њ–µ—Е–Є –њ–Њ—Б–ї—Г–ґ–Є–ї–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ —Б—В–Є–Љ—Г–ї–Њ–Љ –≤ –њ–Њ–Є—Б–Ї–∞—Е –љ–Њ–≤—Л—Е –Љ–µ–і–ї–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –∞ —Б –і—А—Г–≥–Њ–є, – –≤ –≤—Л—П—Б–љ–µ–љ–Є–Є —Н—В–Є–Њ–ї–Њ–≥–Є–Є —В–µ—Е –Є–Ј –љ–Є—Е, –њ—А–Є—З–Є–љ—Л –Ї–Њ—В–Њ—А—Л—Е –Њ—Б—В–∞–≤–∞–ї–Є—Б—М –µ—Й–µ –љ–µ–Є–Ј–≤–µ—Б—В–љ—Л–Љ–Є.
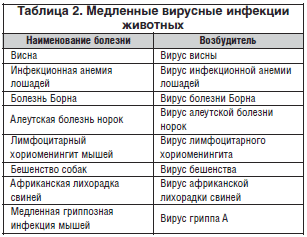
–Т—Б–µ —Н—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Њ –Њ—В–Ї—А—Л—В–Є—О –љ–Њ–≤—Л—Е –Љ–µ–і–ї–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є –Є –≤—Л—П—Б–љ–µ–љ–Є—О —Г –≤—Б–µ –љ–Њ–≤—Л—Е –≤–Є—А—Г—Б–Њ–≤ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Ї –Є—Е —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О. –Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј –њ—А–Є–≤–µ–і–µ–љ–љ—Л—Е –љ–Є–ґ–µ –і–∞–љ–љ—Л—Е, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –њ–Њ–њ–Њ–ї–љ—П–ї—Б—П —Б–њ–Є—Б–Њ–Ї –Љ–µ–і–ї–µ–љ–љ—Л—Е –≤–Є—А—Г—Б–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є –Є –ґ–Є–≤–Њ—В–љ—Л—Е (—В–∞–±–ї. 2).
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –≤ –Њ—Б–љ–Њ–≤–µ —А–∞–Ј–≤–Є—В–Є—П –Љ–µ–і–ї–µ–љ–љ–Њ–є —Д–Њ—А–Љ—Л –≤–Є—А—Г—Б–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –ї–µ–ґ–Є—В –Њ–і–Є–љ –Є —В–Њ—В –ґ–µ –њ—А–Њ—Ж–µ—Б—Б, –∞ –Є–Љ–µ–љ–љ–Њ –њ—А–Њ—Ж–µ—Б—Б –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б–Њ—Е—А–∞–љ–µ–љ–Є—П –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ – –њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є–Є (–Њ—В –ї–∞—В. persistentia – —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ –њ—А–µ–і—Л–і—Г—Й–µ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П, —Г–њ–Њ—А—Б—В–≤–Њ, –њ–Њ—Б—В–Њ—П–љ—Б—В–≤–Њ), –њ–∞—В–Њ–≥–µ–љ–µ–Ј –Ї–∞–ґ–і–Њ–≥–Њ –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Љ–Њ–≥ –Њ–Ї–∞–Ј–∞—В—М—Б—П –≤ –Ї–Њ—А–љ–µ –Њ—В–ї–Є—З–љ—Л–Љ. –Ґ–∞–Ї, –љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Є –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –Ї—А–∞—Б–љ—Г—Е–µ —А–∞–Ј–≤–Є—В–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ–Љ –≤–Є—А—Г—Б–∞ –≤ –њ—А–Њ—Ж–µ—Б—Б—Л –Ј–∞–Ї–ї–∞–і–Ї–Є –Є —А–∞–Ј–≤–Є—В–Є—П –Њ—А–≥–∞–љ–Њ–≤ –Є —В–Ї–∞–љ–µ–є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —Н–Љ–±—А–Є–Њ–љ–∞. –Ш —З–µ–Љ —А–∞–љ—М—И–µ —Н—В–Њ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В, —В.–µ. —З–µ–Љ —А–∞–љ—М—И–µ –±–µ—А–µ–Љ–µ–љ–љ–∞—П –Ј–∞—А–∞–ґ–∞–µ—В—Б—П –≤–Є—А—Г—Б–Њ–Љ –Ї—А–∞—Б–љ—Г—Е–Є, —В–µ–Љ –±–Њ–ї—М—И–µ–µ —З–Є—Б–ї–Њ –∞–љ–Њ–Љ–∞–ї–Є–є —А–µ–≥–Є—Б—В—А–Є—А—Г–µ—В—Б—П –њ—А–Є —А–Њ–ґ–і–µ–љ–Є–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б–∞–Љ –≤–Є—А—Г—Б –Ї—А–∞—Б–љ—Г—Е–Є –Ј–∞–Љ–µ—В–љ–Њ —Б–љ–Є–ґ–∞–µ—В —Б–Ї–Њ—А–Њ—Б—В—М –Ї–ї–µ—В–Њ—З–љ–Њ–є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –Є –ґ–Є–Ј–љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ј–∞—А–∞–ґ–µ–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї [8].
–Я—А–Є —А–∞–Ј–≤–Є—В–Є–Є –Я–°–Я–≠, –≤—Л–Ј—Л–≤–∞–µ–Љ–Њ–≥–Њ –≤–Є—А—Г—Б–Њ–Љ –Ї–Њ—А–Є, –љ–∞–њ—А–Њ—В–Є–≤, –≤—Л—П–≤–ї–µ–љ–љ—Л–µ –≤ –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Є —Б–њ–Є–љ–љ–Њ–Љ–Њ–Ј–≥–Њ–≤–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –њ—А–Њ—В–Є–≤–Њ–Ї–Њ—А–µ–≤—Л–µ –∞–љ—В–Є—В–µ–ї–∞ –њ—А—П–Љ–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–Є –Њ–± –Є–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞—Е –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ю–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ —А–∞–љ–љ–µ–µ (–і–Њ 2-–ї–µ—В–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞) –њ–µ—А–µ–љ–µ—Б–µ–љ–Є–µ –Ї–Њ—А–Є —А–µ–±–µ–љ–Ї–Њ–Љ –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Я–°–Я–≠, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ–Љ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –і–µ—Д–µ–Ї—В–љ—Л—Е —Д–Њ—А–Љ –≤–Є—А—Г—Б–∞, –њ—А–Є–≤–Њ–і—П—Й–Є—Е –Ї —Б–ї–∞–±–Њ–≤—Л—А–∞–ґ–µ–љ–љ–Њ–є, –љ–Њ –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –∞–љ—В–Є–≥–µ–љ–љ–Њ–є —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –Є–Љ–Љ—Г–љ–Њ–Ї–Њ–Љ–њ–µ—В–µ–љ—В–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –≤—Л–Ј—Л–≤–∞—П –≥–Є–њ–µ—А–њ—А–Њ–і—Г–Ї—Ж–Є—О –∞–љ—В–Є—В–µ–ї, –Ї–Њ—В–Њ—А—Л–µ –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М –љ–µ–є—В—А–∞–ї–Є–Ј—Г—О—В –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–µ –≤–Є—А—Г—Б-—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ –±–µ–ї–Ї–Є, –љ–Њ —Б–Њ—Е—А–∞–љ—П—О—В –љ–µ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –Ї–ї–µ—В–Ї–Є –і–ї—П —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –Є–ї–Є –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –ї–Є–Ј–Є—Б–∞ –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–Њ–Љ [7].
–Э–∞–Ї–Њ–љ–µ—Ж, –µ—Й–µ –Њ–і–Є–љ –њ—А–Є–Љ–µ—А —Б–≤–Њ–µ–Њ–±—А–∞–Ј–Є—П –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Љ—Л –љ–∞–±–ї—О–і–∞–µ–Љ –њ—А–Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–є –Љ–µ–і–ї–µ–љ–љ–Њ–є –≥—А–Є–њ–њ–Њ–Ј–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є, –Ї–Њ–≥–і–∞ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–≥–Њ –Ј–∞—А–∞–ґ–µ–љ–Є—П –њ–ї–Њ–і–∞ –≤–Є—А—Г—Б–Њ–Љ –≥—А–Є–њ–њ–∞ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤–Њ –≤—Б–µ—Е –Њ—А–≥–∞–љ–∞—Е –Є —В–Ї–∞–љ—П—Е –њ–Њ—В–Њ–Љ—Б—В–≤–∞, –≤–Љ–µ—Б—В–Њ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є, —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –њ–µ—А–≤–Є—З–љ–Њ-–і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –≤–њ–ї–Њ—В—М –і–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ–Њ–є —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ [9].
–Т—Б–µ –њ—А–Є–Љ–µ—А—Л, –њ—А–Є–≤–µ–і–µ–љ–љ—Л–µ –≤—Л—И–µ, –Ї—А–∞—Б–љ–Њ—А–µ—З–Є–≤–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В, —З—В–Њ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —Б —Б–∞–Љ–Њ–≥–Њ –љ–∞—З–∞–ї–∞ –≤—Б—П –њ—А–Њ–±–ї–µ–Љ–∞ –Љ–µ–і–ї–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–µ–і—Б—В–∞–≤–ї—П–ї–∞—Б—М –Ї–∞–Ї –≤–Є—А—Г—Б–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П, —З–µ–Љ—Г –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ –Є–Љ–µ–ї–Є—Б—М –≤–µ—Б–Ї–Є–µ –Њ—Б–љ–Њ–≤–∞–љ–Є—П.
–Э–Њ, —В–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –љ–∞ —Д–Њ–љ–µ –њ–Њ–і–Њ–±–љ–Њ–≥–Њ —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ, –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–Є—П, –Ї–Њ—В–Њ—А—Л–Љ, –Ї–∞–Ї –Љ—Л —В–Њ–ї—М–Ї–Њ —З—В–Њ –≤–Є–і–µ–ї–Є, –Њ—В–ї–Є—З–∞—О—В—Б—П –Љ–µ–і–ї–µ–љ–љ—Л–µ –≤–Є—А—Г—Б–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є, –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –љ–∞—З–Є–љ–∞—О—В –њ–Њ—П–≤–ї—П—В—М—Б—П —Б–Њ–Њ–±—Й–µ–љ–Є—П, –Њ–њ–Є—Б—Л–≤–∞—О—Й–Є–µ –Њ—Б–Њ–±—Г—О –≥—А—Г–њ–њ—Г –Љ–µ–і–ї–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –ґ–Є–≤–Њ—В–љ—Л—Е, –њ–∞—В–Њ–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Њ—В–ї–Є—З–∞—О—В—Б—П –≤–µ—Б—М–Љ–∞ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ —Б–≤–Њ–µ–Њ–±—А–∞–Ј–Є–µ–Љ. –Я—А–Є —В–∞–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Њ—В—Б—Г—В—Б—В–≤—Г—О—В –њ—А–Є–Ј–љ–∞–Ї–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є –љ–∞—А—П–і—Г —Б —Н—В–Є–Љ –≤ –¶–Э–° —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Љ–µ–і–ї–µ–љ–љ–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–∞—П –Ї–∞—А—В–Є–љ–∞ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –њ–µ—А–≤–Є—З–љ–Њ-–і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –≥–Њ–ї–Њ–≤–љ–Њ–Љ, –∞ –Є–љ–Њ–≥–і–∞ –Є –≤ —Б–њ–Є–љ–љ–Њ–Љ –Љ–Њ–Ј–≥–µ.
–Ш–Ј–Љ–µ–љ–µ–љ–Є—П –≤—Л—А–∞–ґ–∞—О—В—Б—П –≤ –Ї–∞—А—В–Є–љ–µ –≥–Є–±–µ–ї–Є –љ–µ–є—А–Њ–љ–Њ–≤, –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–Є –∞–Љ–Є–ї–Њ–Є–і–љ—Л—Е –±–ї—П—И–µ–Ї –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–Љ –≥–ї–Є–Њ–Ј–µ. –Т –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ –≤—Б–µ —Н—В–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ—А–Є–≤–Њ–і—П—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–≥–Њ –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П (st–∞tus spongiosus) –Љ–Њ–Ј–≥–Њ–≤–Њ–є —В–Ї–∞–љ–Є (—А–Є—Б. 1), —З—В–Њ –Є –њ–Њ—Б–ї—Г–ґ–Є–ї–Њ –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П –Њ–±–Њ–Ј–љ–∞—З–µ–љ–Є—П —Н—В–Њ–є –≥—А—Г–њ–њ—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Ї–∞–Ї «—В—А–∞–љ—Б–Љ–Є—Б—Б–Є–≤–љ—Л–µ –≥—Г–±–Ї–Њo–±—А–∞–Ј–љ—Л–µ —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–Є» (–Ґ–У–≠). –Ш–Љ–µ–љ–љ–Њ —В—А–∞–љ—Б–Љ–Є—Б—Б–Є–≤–љ–Њ—Б—В—М –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —В–Њ–ї—М–Ї–Њ –Љ–Њ–Ј–≥–Њ–≤–Њ–є —В–Ї–∞–љ–Є –Є —Б–ї—Г–ґ–Є—В –њ–∞—В–Њ–≥–љ–Њ–Љ–Њ–љ–Є—З–љ—Л–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–Љ —Н—В–Є—Е –±–Њ–ї–µ–Ј–љ–µ–є. –°–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –Є–Ј—Г—З–µ–љ–Є–µ –Ґ–У–≠ —И–ї–Њ –Њ—З–µ–љ—М –Љ–µ–і–ї–µ–љ–љ–Њ. –≠—В–Њ –±—Л–ї–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –Љ–љ–Њ–≥–Њ–ї–µ—В–љ–Є–Љ –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ —Б–≤–µ–і–µ–љ–Є–є –Њ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П—Е –і–∞–љ–љ—Л—Е –љ–µ–Њ–±—Л—З–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є.
–£–ґ–µ –≤ —В–µ—Е –њ–µ—А–≤—Л—Е –Њ—Б–љ–Њ–≤–Њ–њ–Њ–ї–∞–≥–∞—О—Й–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –С. –°–Є–≥—Г—А–і—Б–Њ–љ, —Б—А–µ–і–Є –њ—А–Њ—З–Є—Е, –њ–Њ–і—А–Њ–±–љ–Њ –Њ–њ–Є—Б–∞–ї –Є –і–∞–≤–љ–Њ –Є–Ј–≤–µ—Б—В–љ—Г—О –Љ–µ–і–ї–µ–љ–љ—Г—О –Є–љ—Д–µ–Ї—Ж–Є—О –Њ–≤–µ—Ж – —Б–Ї—А–µ–њ–Є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й—Г—О—Б—П –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є —А–µ–Ј–Ї–Њ–≥–Њ —А–∞–Ј–і—А–∞–ґ–µ–љ–Є—П –Ї–Њ–ґ–Є, –≤–Њ–Ј–±—Г–і–Є–Љ–Њ—Б—В—М—О –Є –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Ї–Њ–Њ—А–і–Є–љ–∞—Ж–Є–Є –і–≤–Є–ґ–µ–љ–Є–є. –Т–љ–∞—З–∞–ї–µ –њ–Њ—П–≤–ї—П–µ—В—Б—П —Б–њ–Њ—В—Л–Ї–∞—О—Й–∞—П—Б—П –њ–Њ—Е–Њ–і–Ї–∞ (–∞—В–∞–Ї—Б–Є—П), –∞ –Ј–∞—В–µ–Љ –љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ —Б—В–Њ—П—В—М. –Т—Б–µ —Н—В–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П —Б–Њ–Ј–і–∞—О—В –≤–µ—Б—М–Љ–∞ —В–Є–њ–Є—З–љ—Г—О –Ї–∞—А—В–Є–љ—Г, –Њ–±–ї–µ–≥—З–∞—О—Й—Г—О –њ–Њ—Б—В–∞–љ–Њ–≤–Ї—Г –і–Є–∞–≥–љ–Њ–Ј–∞. –Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Љ–µ–і–ї–µ–љ–љ–Њ. –Я—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П –Њ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Љ–µ—Б—П—Ж–µ–≤ –і–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –ї–µ—В –Є –≤—Б–µ–≥–і–∞ –љ–∞ —Д–Њ–љ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–≥–Њ –Є—Б—В–Њ—Й–µ–љ–Є—П –Ј–∞–Ї–∞–љ—З–Є–≤–∞–µ—В—Б—П –≥–Є–±–µ–ї—М—О –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —И–Є—А–Њ–Ї–Њ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ, –њ—А–Є—А–Њ–і–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –і–Њ–ї–≥–Њ–µ –≤—А–µ–Љ—П –Њ—Б—В–∞–≤–∞–ї–∞—Б—М –љ–µ–Є–Ј–≤–µ—Б—В–љ–Њ–є –Є —Б–Ї—А–µ–њ–Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–ї–∞—Б—М –Ї–∞–Ї —З–Є—Б—В–Њ —Б–µ–ї—М—Б–Ї–Њ—Е–Њ–Ј—П–є—Б—В–≤–µ–љ–љ–∞—П –њ—А–Њ–±–ї–µ–Љ–∞. –Т 1899 –≥. —Б–Ї—А–µ–њ–Є —Г–і–∞–ї–Њ—Б—М –њ–µ—А–µ–і–∞—В—М –Ј–і–Њ—А–Њ–≤–Њ–є –Њ–≤—Ж–µ –њ—Г—В–µ–Љ –Ј–∞—А–∞–ґ–µ–љ–Є—П –µ–µ –Љ–Њ–Ј–≥–Њ–≤–Њ–є —В–Ї–∞–љ—М—О, –≤–Ј—П—В–Њ–є –Њ—В –±–Њ–ї—М–љ–Њ–≥–Њ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ. –Ю–і–љ–∞–Ї–Њ –ї–Є—И—М –≤ 1936 –≥. –њ–Њ—П–≤–Є–ї–Є—Б—М –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞, —З—В–Њ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—М —Б–Ї—А–µ–њ–Є –њ—А–Њ—Е–Њ–і–Є—В —З–µ—А–µ–Ј –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ —Д–Є–ї—М—В—А—Л [10]. –Ф–ї—П —Б–Ї—А–µ–њ–Є —Г –Њ–≤–µ—Ж —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є –≤ –¶–Э–°. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ, –≤ –Љ–Њ–Ј–≥–Њ–≤–Њ–є —В–Ї–∞–љ–Є —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –≤–∞–Ї—Г–Њ–ї–Є–Ј–∞—Ж–Є—П –Є –њ–Њ—В–µ—А—П –љ–µ–є—А–Њ–љ–Њ–≤, –∞ —В–∞–Ї–ґ–µ –≤–∞–Ї—Г–Њ–ї–Є–Ј–∞—Ж–Є—П, –≥–Є–њ–µ—А—В—А–Њ—Д–Є—П –Є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—П –∞—Б—В—А–Њ–≥–ї–Є–Є. –°–µ—А–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ –њ—А–Є–Њ–±—А–µ—В–∞–µ—В –≤–Є–і –≥—Г–±–Ї–Є –Є –љ–∞ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ —Б—А–µ–Ј–µ –љ–∞–њ–Њ–Љ–Є–љ–∞–µ—В –Ї—А—Г–ґ–µ–≤–љ—Г—О —В–Ї–∞–љ—М (—А–Є—Б. 1).
–Ь–µ–і–ї–µ–љ–љ–Њ–µ –Є–Ј—Г—З–µ–љ–Є–µ —Б–Ї—А–µ–њ–Є –≤–Њ –Љ–љ–Њ–≥–Њ–Љ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –≤—Л–љ—Г–ґ–і–µ–љ–љ–Њ—Б—В—М—О –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–Њ–≤ –љ–∞ –Њ–≤—Ж–∞—Е, –Є —Г—Б–њ–µ—И–љ–∞—П –њ–µ—А–µ–і–∞—З–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Љ—Л—И–∞–Љ –Є –і—А—Г–≥–Є–Љ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ –ґ–Є–≤–Њ—В–љ—Л–Љ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –њ–µ—А–µ–ї–Њ–Љ–љ—Л–Љ –Љ–Њ–Љ–µ–љ—В–Њ–Љ –≤ –Є—Б—В–Њ—А–Є–Є –Є–Ј—Г—З–µ–љ–Є—П —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –Є –≤—Б–µ–є –њ—А–Њ–±–ї–µ–Љ—Л –≤ —Ж–µ–ї–Њ–Љ.
–Т—Б–Ї–Њ—А–µ –њ–Њ–і–Њ–±–љ–∞—П –Ї–∞—А—В–Є–љ–∞ –њ–∞—В–Њ–≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –±—Л–ї–∞ –Њ–њ–Є—Б–∞–љ–∞ –њ—А–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є –ї—О–і–µ–є, –Ї–Њ–≥–і–∞ –≤ 1957 –≥. –Ъ. –У–∞–є–і—Г—И–µ–Ї –Є –Т. –Ч–Є–≥–∞—Б [11] –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–≤–Њ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –љ–∞ –Њ—Б—В—А–Њ–≤–µ –Э–Њ–≤–∞—П –У–≤–Є–љ–µ—П, –≥–і–µ —Б—А–µ–і–Є –њ–∞–њ—Г–∞—Б–Њ–≤-–Ї–∞–љ–љ–Є–±–∞–ї–Њ–≤ —И–Є—А–Њ–Ї–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–Є–ї–Њ—Б—М —Б–Љ–µ—А—В–µ–ї—М–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ – –Ї—Г—А—Г (–≤ –њ–µ—А–µ–≤–Њ–і–µ —Б –њ–∞–њ—Г–∞—Б—Б–Ї–Њ–≥–Њ «–і—А–Њ–ґ–∞–љ–Є–µ –Њ—В —Б—В—А–∞—Е–∞ –Є–ї–Є –Њ—В —Е–Њ–ї–Њ–і–∞»). –≠–њ–Є–і–µ–Љ–Є—П –Ї—Г—А—Г —А–∞–Ј–≤–Є–ї–∞—Б—М –≤ 50-—Е –≥–Њ–і–∞—Е –•–• –≤. —Б—А–µ–і–Є –њ–ї–µ–Љ–µ–љ–Є –љ–∞—А–Њ–і–љ–Њ—Б—В–Є —Д–Њ—А–µ, –њ—А–Њ–ґ–Є–≤–∞–≤—И–µ–Љ –≤ –≥–ї—Г—Е–Є—Е –≥–Њ—А–љ—Л—Е —А–∞–є–Њ–љ–∞—Е –Я–∞–њ—Г–∞ – –Э–Њ–≤–Њ–є –У–≤–Є–љ–µ–Є. –Ч–∞ –≥–Њ–і —Г–Љ–Є—А–∞–ї–Њ –Њ–Ї–Њ–ї–Њ 200 —З–µ–ї–Њ–≤–µ–Ї. –Ч–∞–±–Њ–ї–µ–≤–∞–ї–Є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –і–µ—В–Є –Є –ґ–µ–љ—Й–Є–љ—Л –Є —В–Њ–ї—М–Ї–Њ 2% –≤–Ј—А–Њ—Б–ї—Л—Е –Љ—Г–ґ—З–Є–љ. –Т —Н—В–Њ–Љ –њ–ї–µ–Љ–µ–љ–Є, –љ–∞—Б—З–Є—В—Л–≤–∞–≤—И–µ–Љ –±–Њ–ї–µ–µ 35 —В—Л—Б. —З–µ–ї–Њ–≤–µ–Ї, —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–ї–∞ —В—А–∞–і–Є—Ж–Є—П —А–Є—В—Г–∞–ї—М–љ–Њ–≥–Њ –Ї–∞–љ–љ–Є–±–∞–ї–Є–Ј–Љ–∞. –Я—А–Є—З–µ–Љ –ґ–µ–љ—Й–Є–љ—Л –Є –і–µ—В–Є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –њ–Њ–µ–і–∞–ї–Є –Љ–Њ–Ј–≥ –Є –Љ—Л—И—Ж—Л –≤—А–∞–≥–Њ–≤ –Є–ї–Є —А–Њ–і—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤, —Б —З–µ–Љ –Є —Б–≤—П–Ј–∞–љ–∞ —А–∞–Ј–љ–∞—П –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –њ–Њ –њ–Њ–ї—Г –Є –≤–Њ–Ј—А–∞—Б—В—Г [12].
–Т 1957 –≥. –Ї–∞–љ–љ–Є–±–∞–ї–Є–Ј–Љ —Б—А–µ–і–Є –љ–∞—А–Њ–і–љ–Њ—Б—В–Є —Д–Њ—А–µ –±—Л–ї –Ј–∞–њ—А–µ—Й–µ–љ, –Є –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Ї—Г—А—Г –њ–Њ—И–ї–∞ –љ–∞ —Г–±—Л–ї—М. –Т –љ–∞—З–∞–ї–µ 1970-—Е –≥–≥. –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є–љ–Ї—Г–±–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 5–10 –ї–µ—В, –Њ–і–љ–∞–Ї–Њ –њ–Њ–Ј–і–љ–µ–µ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є —Б—А–µ–і–Є –ї–Є–љ–≥–≤–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –≥—А—Г–њ–њ—Л —Д–Њ—А–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–є –Є–љ–Ї—Г–±–∞—Ж–Є–Њ–љ–љ—Л–є –њ–µ—А–Є–Њ–і –њ—А–Є –Ї—Г—А—Г –Љ–Њ–ґ–µ—В –њ—А–Њ–і–Њ–ї–ґ–∞—В—М—Б—П 25–30 –ї–µ—В, –µ—Б–ї–Є –Ј–∞—А–∞–ґ–µ–љ–Є–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ —О–љ–Њ—Б—В–Є –Є–ї–Є –≤ —А–∞–љ–љ–µ–Љ –і–µ—В—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ. –Ъ–∞–Ї —Н—В–Њ –љ–Є –њ–∞—А–∞–і–Њ–Ї—Б–∞–ї—М–љ–Њ, –љ–Њ –љ–µ–і–∞–≤–љ–Њ –њ–Њ—Б—В—Г–њ–Є–ї–Њ —Б–Њ–Њ–±—Й–µ–љ–Є–µ –Њ —Б–ї—Г—З–∞–µ –Ї—Г—А—Г, –Ї–Њ–≥–і–∞ –Є–љ–Ї—Г–±–∞—Ж–Є–Њ–љ–љ—Л–є –њ–µ—А–Є–Њ–і —Б–Њ—Б—В–∞–≤–Є–ї 50 –ї–µ—В (–Ш.–Р. –Ч–∞–≤–∞–ї–Є—И–Є–љ, –ї–Є—З–љ–Њ–µ —Б–Њ–Њ–±—Й–µ–љ–Є–µ).
–Т—Б–µ –њ–∞—В–Њ–≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ—А–Є –Ї—Г—А—Г –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—О—В—Б—П —В–Њ–ї—М–Ї–Њ –¶–Э–° –Є –љ–∞ —Д–Њ–љ–µ –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є –Є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –∞—Б—В—А–Њ–≥–ї–Є–Є –≤—Л—А–∞–ґ–∞—О—В—Б—П –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є —В–Є–њ–Є—З–љ–Њ–є –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ–Њ–є —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–Є. –Т –Ї–Њ—А–µ, –њ–Њ–і–Ї–Њ—А–Ї–µ, –њ–Њ–і–±—Г–≥–Њ—А–љ–Њ–є –Њ–±–ї–∞—Б—В–Є –Є –Љ–Њ–Ј–ґ–µ—З–Ї–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –≤–∞–Ї—Г–Њ–ї–Є–Ј–∞—Ж–Є—П –і–µ–љ–і—А–Є—В–Њ–≤, –∞–Ї—Б–Њ–љ–Њ–≤ –Є —В–µ–ї–∞ –љ–µ–є—А–Њ–љ–Њ–≤, –∞ —В–∞–Ї–ґ–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –∞–Љ–Є–ї–Њ–Є–і–љ—Л—Е –±–ї—П—И–µ–Ї. –Я—А–Њ—Ж–µ—Б—Б —Б—В–∞–љ–Њ–≤–Є—В—Б—П —Б—В–Њ–ї—М –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ, —З—В–Њ —Б–µ—А–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ –±–Њ–ї—М—И–Є—Е –њ–Њ–ї—Г—И–∞—А–Є–є, –Ї–∞–Ї –Є –њ—А–Є —Б–Ї—А–µ–њ–Є, –њ—А–Є–Њ–±—А–µ—В–∞–µ—В –≤–Є–і –≥—Г–±–Ї–Є [13]. –Т —Е–Њ–і–µ –Љ–љ–Њ–≥–Њ–ї–µ—В–љ–Є—Е –Є –љ–∞—Б—В–Њ–є—З–Є–≤—Л—Е –њ–Њ–Є—Б–Ї–Њ–≤ –Ъ. –У–∞–є–і—Г—И–µ–Ї—Г —Г–і–∞–µ—В—Б—П –њ–µ—А–µ–і–∞—В—М –Ї—Г—А—Г —И–Є–Љ–њ–∞–љ–Ј–µ, –∞ –≤–њ–Њ—Б–ї–µ–і—Б—В–≤–Є–Є –Є –љ–Є–Ј—И–Є–Љ –Њ–±–µ–Ј—М—П–љ–∞–Љ, —З–µ–Љ –Њ–љ –Є –і–Њ–Ї–∞–Ј–∞–ї –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Г—О –њ—А–Є—А–Њ–і—Г –Ї—Г—А—Г.
–Т—Б–Ї–Њ—А–µ –±–ї–∞–≥–Њ–і–∞—А—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ –Т. –•—Н–і–ї–Њ—Г [14] –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –±–Њ–ї—М—И–Њ–µ —Б—Е–Њ–і—Б—В–≤–Њ –Љ–µ–ґ–і—Г –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є, —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –Є –њ–∞—В–Њ–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ–Њ–є –Ї—Г—А—Г —Г —З–µ–ї–Њ–≤–µ–Ї–∞ –Є —Б–Ї—А–µ–њ–Є —Г –Њ–≤–µ—Ж. –Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Н—В–Њ–≥–Њ —Б—В–∞–ї–Њ –Њ—З–µ–≤–Є–і–љ—Л–Љ, —З—В–Њ –Љ–µ–і–ї–µ–љ–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–µ—Б—П —В–Њ–ї—М–Ї–Њ –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є –≤ –¶–Э–°, –Љ–Њ–≥—Г—В –њ–Њ—А–∞–ґ–∞—В—М –љ–µ —В–Њ–ї—М–Ї–Њ –ґ–Є–≤–Њ—В–љ—Л—Е, –љ–Њ –Є –ї—О–і–µ–є. –≠—В–Є –љ–∞—Е–Њ–і–Ї–Є –Ј–∞–Љ–µ—В–љ–Њ —Г–≤–µ–ї–Є—З–Є–ї–Є –Є–љ—В–µ—А–µ—Б –Ї –њ–Њ–і–Њ–±–љ–Њ–≥–Њ —А–Њ–і–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ, –Є —Б —В–µ—Е –њ–Њ—А –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ –љ–∞—З–∞–ї–Є –љ–∞–Ї–∞–њ–ї–Є–≤–∞—В—М—Б—П —Б–Њ–Њ–±—Й–µ–љ–Є—П, –Њ–њ–Є—Б—Л–≤–∞—О—Й–Є–µ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –ґ–Є–≤–Њ—В–љ—Л—Е, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –њ–µ—А–µ–і–∞–≤–∞–ї–∞—Б—М –Њ–і–љ–∞ –Є —В–∞–Ї–ґ–µ –Ї–∞—А—В–Є–љ–∞ –њ–∞—В–Њ–≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є, –≤—Л—А–∞–ґ–∞—О—Й–∞—П—Б—П –≤ –≥–Є–±–µ–ї–Є –љ–µ–є—А–Њ–љ–Њ–≤, –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–Є –∞–Љ–Є–ї–Њ–Є–і–љ—Л—Е –±–ї—П—И–µ–Ї, —А–∞–Ј–≤–Є—В–Є–Є –≥–ї–Є–Њ–Ј–∞ –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П (status spongiosus) –Љ–Њ–Ј–≥–Њ–≤–Њ–є —В–Ї–∞–љ–Є.
–Я–Њ–Љ–Є–Љ–Њ —Г—Б–њ–µ—Е–Њ–≤ –њ—А–Є –Є–Ј—Г—З–µ–љ–Є–Є –Ї—Г—А—Г –Ї–Њ–ї–ї–µ–Ї—В–Є–≤—Г –њ–Њ–і —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ–Љ –Ъ. –У–∞–є–і—Г—И–µ–Ї–∞ –≤ 1968 –≥. —Г–і–∞–µ—В—Б—П –≤—Л—П—Б–љ–Є—В—М –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Г—О –њ—А–Є—А–Њ–і—Г –µ—Й–µ –Њ–і–љ–Њ–є –Љ–µ–і–ї–µ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є —Б –љ–µ—Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–µ–є, –Є–Ј–≤–µ—Б—В–љ–Њ–є –µ—Й–µ —Б 20–—Е –≥–Њ–і–Њ–≤ –њ—А–Њ—И–ї–Њ–≥–Њ –≤–µ–Ї–∞, – –±–Њ–ї–µ–Ј–љ–Є –Ъ—А–µ–є—В—Ж—Д–µ–ї—М–і–∞-–ѓ–Ї–Њ–±–∞ (–С–Ъ–ѓ), –њ–Њ–ї—Г—З–Є–≤ —А–∞–Ј–≤–Є—В–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Г —И–Є–Љ–њ–∞–љ–Ј–µ –њ–Њ—Б–ї–µ –≤–≤–µ–і–µ–љ–Є—П –ґ–Є–≤–Њ—В–љ—Л–Љ –Љ–Њ–Ј–≥–Њ–≤—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ –Њ—В –њ–Њ–≥–Є–±—И–Є—Е –ї—О–і–µ–є [15].
–С–Ъ–ѓ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–∞ –њ–Њ –≤—Б–µ–Љ—Г –Љ–Є—А—Г –Є –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Б —З–∞—Б—В–Њ—В–Њ–є 1–2 —Б–ї—Г—З–∞—П –љ–∞ 1 –Љ–ї–љ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –≤ –≥–Њ–і. –Ю–і–љ–∞–Ї–Њ –≤ –І–Є–ї–Є, –Ш–Ј—А–∞–Є–ї–µ –Є –°–ї–Њ–≤–∞–Ї–Є–Є —Б—Г—Й–µ—Б—В–≤—Г—О—В –Ї–ї–∞—Б—В–µ—А—Л, –≥–і–µ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—И–µ [16]. –Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є—О –њ–Њ–і–≤–µ—А–ґ–µ–љ—Л –Є –Љ—Г–ґ—З–Є–љ—Л, –Є –ґ–µ–љ—Й–Є–љ—Л –≤ –≤–Њ–Ј—А–∞—Б—В–µ 55–75 –ї–µ—В. –Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ–µ —Е–∞—А–∞–Ї—В–µ—А–љ—Л –±—Л—Б—В—А–Њ–њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ —Б–ї–∞–±–Њ—Г–Љ–Є–µ, –Љ–Є–Њ–Ї–ї–Њ–љ—Г—Б –Є –Ј–∞–Љ–µ—В–љ–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–µ –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П, —З—В–Њ, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Љ–µ—Б—П—Ж–µ–≤ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–Љ–µ—А—В–µ–ї—М–љ–Њ–Љ—Г –Є—Б—Е–Њ–і—Г.
–Т –Њ—В–ї–Є—З–Є–µ –Њ—В –≤—Б–µ—Е –Є–Ј–≤–µ—Б—В–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –і–ї—П –С–Ъ–ѓ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ, —З—В–Њ –Є–Ј 100% –Ј–∞–±–Њ–ї–µ–≤—И–Є—Е —Г 85% –С–Ъ–ѓ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –Ї–∞–Ї —Б–њ–Њ—А–∞–і–Є—З–µ—Б–Ї–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –ї—О–і–µ–є —Б—В–∞—А—И–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –≤ 10–15% —Б–ї—Г—З–∞–µ–≤ – –Ї–∞–Ї –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –Є –Љ–µ–љ–µ–µ —З–µ–Љ –≤ 1–5% —Б–ї—Г—З–∞–µ–≤ –і–∞–љ–љ–∞—П –±–Њ–ї–µ–Ј–љ—М —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–∞—П, —В.–µ. –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –≤–љ–µ—И–љ–µ–≥–Њ –Ј–∞—А–∞–ґ–µ–љ–Є—П [17]. –≠—В–Њ—В –њ–Њ—Б–ї–µ–і–љ–Є–є –≤–∞—А–Є–∞–љ—В –њ–Њ–і—А–∞–Ј—Г–Љ–µ–≤–∞–µ—В —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ —П—В—А–Њ–≥–µ–љ–љ—Л–µ —Б–ї—Г—З–∞–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–Љ–Є –Љ–∞–љ–Є–њ—Г–ї—П—Ж–Є—П–Љ–Є –Є–ї–Є –њ–µ—А–µ—Б–∞–і–Ї–∞–Љ–Є —В–Ї–∞–љ–µ–≤—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ –Њ—В —З–µ–ї–Њ–≤–µ–Ї–∞ –Ї —З–µ–ї–Њ–≤–µ–Ї—Г (—В–∞–±–ї. 3). –Т–њ–µ—А–≤—Л–µ –њ–Њ–і–Њ–±–љ—Л–є —Б–ї—Г—З–∞–є –±—Л–ї –Њ–њ–Є—Б–∞–љ –≤ 1974 –≥. —Г –њ–∞—Ж–Є–µ–љ—В–∞, –Ї–Њ—В–Њ—А–Њ–Љ—Г –њ–µ—А–µ—Б–∞–і–Є–ї–Є —А–Њ–≥–Њ–≤–Є—Ж—Г –Њ—В —В—А—Г–њ–∞ [18].
–Э–∞—А—П–і—Г —Б –Њ—В–Ї—А—Л—В–Є–µ–Љ –љ–Њ–≤—Л—Е —В—А–∞–љ—Б–Љ–Є—Б—Б–Є–≤–љ—Л—Е –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ—Л—Е —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–є —З–µ–ї–Њ–≤–µ–Ї–∞ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї—Б—П —Б–њ–Є—Б–Њ–Ї –њ–Њ–і–Њ–±–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є —Г –ґ–Є–≤–Њ—В–љ—Л—Е. –Ъ—А–Њ–Љ–µ –і–∞–≤–љ–Њ –Є–Ј–≤–µ—Б—В–љ–Њ–є —Б–Ї—А–µ–њ–Є, –≤ 1947 –≥. –љ–∞ –љ–Њ—А–Ї–Њ–≤–Њ–і—З–µ—Б–Ї–Є—Е —Д–µ—А–Љ–∞—Е —И—В–∞—В–Њ–≤ –Т–Є—Б–Ї–Њ–љ—Б–Є–љ –Є –Ь–Є–љ–љ–µ—Б–Њ—В–∞ (–°–®–Р) –±—Л–ї–∞ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–∞ —В—А–∞–љ—Б–Љ–Є—Б—Б–Є–≤–љ–∞—П —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є—П –љ–Њ—А–Њ–Ї (–Ґ–≠–Э), –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–∞—П –њ—А–Є—А–Њ–і–∞ –Ї–Њ—В–Њ—А–Њ–є –њ–Њ–і—В–≤–µ—А–ґ–і–∞–ї–∞—Б—М —Г—Б–њ–µ—И–љ–Њ–є –њ–µ—А–µ–і–∞—З–µ–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б –њ–Њ–Љ–Њ—Й—М—О —Д–Є–ї—М—В—А–∞—В–Њ–≤, –Ј–∞—А–∞–ґ–µ–љ–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤ –Њ—В –±–Њ–ї—М–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –Ј–і–Њ—А–Њ–≤—Л–Љ. –Ш–љ–Ї—Г–±–∞—Ж–Є–Њ–љ–љ—Л–є –њ–µ—А–Є–Њ–і –њ—А–Є –Ґ–≠–Э – –і–Њ 1 –≥–Њ–і–∞. –Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –њ–Њ—Б–ї–µ –њ–µ—А–≤—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –і–ї–Є—В—Б—П –Њ—В 2 –і–Њ 6 –љ–µ–і. –Є –≤—Б–µ–≥–і–∞ –Ј–∞–Ї–∞–љ—З–Є–≤–∞–µ—В—Б—П —Б–Љ–µ—А—В—М—О. –Я—А–Є –≤—Б–Ї—А—Л—В–Є–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В —В–Њ–ї—М–Ї–Њ –≤ –¶–Э–°: —И–Є—А–Њ–Ї–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–µ –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б–µ—А–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –≤ –Ї–Њ—А–µ –Є –њ–Њ–і–Ї–Њ—А–Ї–µ, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–µ–µ—Б—П —П—А–Ї–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –∞—Б—В—А–Њ—Ж–Є—В–Њ–Ј–Њ–Љ –љ–µ–є—А–Њ–≥–ї–Є–Є [19].
–Ъ —Н—В–Њ–Љ—Г —Б–њ–Є—Б–Ї—Г —Б–ї–µ–і—Г–µ—В –і–Њ–±–∞–≤–Є—В—М –Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–љ—Г—О –≤ 1978 –≥. –≤ —И—В–∞—В–µ –Ъ–Њ–ї–Њ—А–∞–і–Њ (–°–®–Р) —Е—А–Њ–љ–Є—З–µ—Б–Ї—Г—О –Є–Ј–љ—Г—А—П—О—Й—Г—О –±–Њ–ї–µ–Ј–љ—М (–•–Ш–С) –Њ–ї–µ–љ–µ–є –Є –ї–Њ—Б–µ–є. –Я–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ —Н—В–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–µ–µ—Б—П –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ–Њ–є —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–µ–є —Б –∞—Б—В—А–Њ—Ж–Є—В–Њ–Ј–Њ–Љ –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –∞–Љ–Є–ї–Њ–Є–і–љ—Л—Е –±–ї—П—И–µ–Ї –≤ –≥–Њ–ї–Њ–≤–љ–Њ–Љ –Љ–Њ–Ј–≥–µ –Є –њ—А–Њ—П–≤–ї—П—О—Й–µ–µ—Б—П –њ–Њ—В–µ—А–µ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞, –Њ–±—Й–Є–Љ –Є–Ј–љ—Г—А–µ–љ–Є–µ–Љ, –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–Љ–Є –њ–Њ–≤–µ–і–µ–љ—З–µ—Б–Ї–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є, —А–∞–Ј—А—Г—И–µ–љ–Є–µ–Љ –Ј—Г–±–Њ–≤, –≥–Є–њ–µ—А—Б–∞–ї–Є–≤–∞—Ж–Є–µ–є –Є —Д–∞—В–∞–ї—М–љ—Л–Љ –Є—Б—Е–Њ–і–Њ–Љ, —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–ї–Њ—Б—М –Ї–∞–Ї —А–µ–Ј—Г–ї—М—В–∞—В —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –ґ–Є–≤–Њ—В–љ—Л—Е –≤ –љ–µ–≤–Њ–ї–µ. –Ю–і–љ–∞–Ї–Њ –њ–Њ–Ј–і–љ–µ–µ –•–Ш–С –±—Л–ї–∞ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –≤ –°–®–Р –Є –Ъ–∞–љ–∞–і–µ —Б—А–µ–і–Є –Њ–ї–µ–љ–µ–є –Є –ї–Њ—Б–µ–є –Ј–Њ–Њ–њ–∞—А–Ї–Њ–≤, –∞ —В–∞–Ї–ґ–µ —Б—А–µ–і–Є —Б—В–∞–і, –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –≤ –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е [20].
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —Г–±–µ–і–Є—В–µ–ї—М–љ—Л–µ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –њ—А–Є—А–Њ–і—Л –Ґ–У–≠, –Є —Г —З–µ–ї–Њ–≤–µ–Ї–∞, –Є —Г –ґ–Є–≤–Њ—В–љ—Л—Е –љ–µ —Г–і–∞–≤–∞–ї–Њ—Б—М –≤—Л—П–≤–Є—В—М –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –љ–Є –≤ –Њ–і–љ–Њ–Љ —Б–ї—Г—З–∞–µ —Н—В–Є—Е –±–Њ–ї–µ–Ј–љ–µ–є. –Ь–µ–ґ–і—Г —В–µ–Љ, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ —Н—В–Њ–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є –њ—А–Є–Њ–±—А–µ—В–∞–ї–Є –≤—Б–µ –±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Є–є —А–∞–Ј–Љ–∞—Е, —З—В–Њ –≤–Њ –Љ–љ–Њ–≥–Њ–Љ –±—Л–ї–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –њ–µ—А–µ–і–∞—З–Є —А—П–і–∞ –Ґ–У–≠ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ –ґ–Є–≤–Њ—В–љ—Л–Љ, –Є –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –Љ—Л—И–∞–Љ –Є —Е–Њ–Љ—П–Ї–∞–Љ. –Я–Њ–љ—П—В–љ–Њ, —З—В–Њ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –≤–Є—А—Г—Б–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ–Њ–і—Е–Њ–і—Л, –Є—Б—Е–Њ–і—П –љ–µ —В–Њ–ї—М–Ї–Њ –Є–Ј –љ–∞–Ї–Њ–њ–ї–µ–љ–љ–Њ–≥–Њ –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Њ–± —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Љ–µ–і–ї–µ–љ–љ—Л—Е –≤–Є—А—Г—Б–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –ґ–Є–≤–Њ—В–љ—Л—Е, –љ–Њ –≤ –±–Њ–ї—М—И–Њ–є —Б—В–µ–њ–µ–љ–Є –µ—Й–µ –Є –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Г–ґ–µ –Є–Ј–≤–µ—Б—В–љ—Л—Е, —Е–Њ—В—П –Є –Ї–Њ—Б–≤–µ–љ–љ—Л—Е, —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ–Њ–≥–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –∞–≥–µ–љ—В–∞. –Ґ–∞–Ї, –±—Л–ї–Њ —В–≤–µ—А–і–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–є –∞–≥–µ–љ—В –≤—Б–µ—Е –Ґ–У–≠ –њ—А–Њ—Е–Њ–і–Є—В —З–µ—А–µ–Ј –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ —Д–Є–ї—М—В—А—Л; –љ–µ —А–∞–Ј–Љ–љ–Њ–ґ–∞–µ—В—Б—П –љ–∞ –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ—Л—Е –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е —Б—А–µ–і–∞—Е; –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–Њ–і–Є—В —Д–µ–љ–Њ–Љ–µ–љ —В–Є—В—А–Њ–≤–∞–љ–Є—П; –љ–∞–Ї–∞–њ–ї–Є–≤–∞–µ—В—Б—П –і–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є 105–1011 –Ш–Ф50 –≤ 1 –≥ –Љ–Њ–Ј–≥–Њ–≤–Њ–є —В–Ї–∞–љ–Є; —Б–њ–Њ—Б–Њ–±–µ–љ –∞–і–∞–њ—В–Є—А–Њ–≤–∞—В—М—Б—П –Ї –љ–Њ–≤–Њ–Љ—Г —Е–Њ–Ј—П–Є–љ—Г; —Б–њ–Њ—Б–Њ–±–µ–љ –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ —А–µ–њ—А–Њ–і—Г—Ж–Є—А–Њ–≤–∞—В—М—Б—П –≤ —Б–µ–ї–µ–Ј–µ–љ–Ї–µ –Є –і—А—Г–≥–Є—Е –Њ—А–≥–∞–љ–∞—Е —А–µ—В–Є–Ї—Г–ї–Њ—Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л; –Њ–±–ї–∞–і–∞–µ—В –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ –Ї–Њ–љ—В—А–Њ–ї–µ–Љ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Е–Њ–Ј—П–µ–≤; –Є–Љ–µ–µ—В —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є –Ї—А—Г–≥ —Е–Њ–Ј—П–µ–≤; –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ —Б–µ–ї–µ–Ї—Ж–Є—П —И—В–∞–Љ–Љ–Њ–≤ –Є–Ј –і–Є–Ї–Њ–≥–Њ —В–Є–њ–∞; –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–Є–µ —Д–µ–љ–Њ–Љ–µ–љ–∞ –Є–љ—В–µ—А—Д–µ—А–µ–љ—Ж–Є–Є; –Њ–±–ї–∞–і–∞–µ—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –Ї –њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є–Є –≤ –Ї–ї–µ—В–Њ—З–љ—Л—Е –Ї—Г–ї—М—В—Г—А–∞—Е, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –Є–Ј –Њ—А–≥–∞–љ–Њ–≤ –Є —В–Ї–∞–љ–µ–є –Ј–∞—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ [21].
–Т—Б–µ —Н—В–Є —З–µ—А—В—Л, –Ї–∞–Ј–∞–ї–Њ—Б—М, —П–≤–љ–Њ —Г–Ї–∞–Ј—Л–≤–∞–ї–Є –љ–∞ —Б–≤–Њ–є—Б—В–≤–∞, —Е–∞—А–∞–Ї—В–µ—А–љ—Л–µ –і–ї—П —И–Є—А–Њ–Ї–Њ –Є–Ј–≤–µ—Б—В–љ—Л—Е –≤–Є—А—Г—Б–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ, –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –∞–≥–µ–љ—В–Њ–≤ –Ґ–У–≠ –Њ–Ї–∞–Ј—Л–≤–∞–ї–Є—Б—М –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –љ–µ–Њ–±—Л—З–љ—Л–Љ–Є. –Т–Њ–Ј–±—Г–і–Є—В–µ–ї–Є –Ґ–У–≠ –Њ—В–ї–Є—З–∞–ї–Є—Б—М —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М—О –Ї –і–µ–є—Б—В–≤–Є—П–Љ –Ф–Э–Ъ-–∞–Ј—Л –Є –†–Э–Ъ-–∞–Ј—Л, —Г–ї—М—В—А–∞—Д–Є–Њ–ї–µ—В–∞, –њ—А–Њ–љ–Є–Ї–∞—О—Й–µ–є —А–∞–і–Є–∞—Ж–Є–Є, —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–∞, –≥–ї—О—В–∞—А–∞–ї—М–і–µ–≥–Є–і–∞, –±–µ—В–∞-–њ—А–Њ–њ–Є–Њ–ї–∞–Ї—В–Њ–љ–∞, —Д–Њ—А–Љ–∞–ї—М–і–µ–≥–Є–і–∞, –њ—Б–Њ—А–∞–ї–µ–љ–Њ–≤, —В–Њ–ї—Г–Њ–ї–∞, –Ї—Б–Є–ї–Њ–ї–∞, —Н—В–∞–љ–Њ–ї–∞, –љ–∞–≥—А–µ–≤–∞–љ–Є—П –і–Њ 80–Њ–° –Є –і–∞–ґ–µ –љ–µ –њ–Њ–ї–љ–Њ—Б—В—М—О –Є–љ–∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–ї–Є—Б—М –њ–Њ—Б–ї–µ –Ї–Є–њ—П—З–µ–љ–Є—П [22].
–Т —Б–≤—П–Ј–Є —Б –і–∞–љ–љ—Л–Љ–Є –њ–Њ—Б–ї–µ–і–љ–Є–Љ–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –і–ї—П –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Ґ–У–≠ –њ—А–µ–і–ї–∞–≥–∞–ї–Є—Б—М —А–∞–Ј–ї–Є—З–љ—Л–µ –љ–∞–Є–Љ–µ–љ–Њ–≤–∞–љ–Є—П, –Њ–і–љ–∞–Ї–Њ –≤—Б—П —Н—В–∞ –љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ—Б—В—М –≤ –Ї–Њ–љ—Ж–µ –Ї–Њ–љ—Ж–Њ–≤ –±—Л–ї–∞ —Г—Б—В—А–∞–љ–µ–љ–∞ –±–ї–∞–≥–Њ–і–∞—А—П —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є–Љ –±–Є–Њ—Е–Є–Љ–Є–Ї–Њ–Љ –°. –Я—А—Г–Ј–Є–љ–µ—А–Њ–Љ. –Ш–Љ –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –±—Л–ї –њ–Њ–ї—Г—З–µ–љ –Є—Б—Е–Њ–і–љ—Л–є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї –≤ –≤–Є–і–µ –≥–Њ–Љ–Њ–≥–µ–љ–∞—В–∞ –Љ–Њ–Ј–≥–∞ –Ј–∞—А–∞–ґ–µ–љ–љ—Л—Е —Б–Ї—А–µ–њ–Є —Е–Њ–Љ—П–Ї–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е –Љ–Њ–Ј–≥–Њ–≤–∞—П —В–Ї–∞–љ—М —Б–Њ–і–µ—А–ґ–∞–ї–∞ –≤ 100 —А–∞–Ј –±–Њ–ї—М—И–µ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –∞–≥–µ–љ—В–∞, —З–µ–Љ –Љ–Њ–Ј–≥–Њ–≤–∞—П —В–Ї–∞–љ—М –Љ—Л—И–µ–є.
–Ш—Б–њ–Њ–ї—М–Ј—Г—П —Н–Ї—Б—В—А–∞–Ї—Ж–Є—О –і–µ—В–µ—А–≥–µ–љ—В–∞–Љ–Є, –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–µ —Ж–µ–љ—В—А–Є—Д—Г–≥–Є—А–Њ–≤–∞–љ–Є–µ, –Њ–±—А–∞–±–Њ—В–Ї—Г –љ—Г–Ї–ї–µ–∞–Ј–∞–Љ–Є, –њ—А–Њ—В–µ–∞–Ј–∞–Љ–Є –Є –∞–љ–∞–ї–Є–Ј –≤ –≥–µ–ї–Є–µ–≤–Њ–Љ —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј–µ, —Г–і–∞–ї–Њ—Б—М –њ—А–Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ—Б—В–Є –Њ—З–Є—Б—В–Є—В—М –Є—Б—Е–Њ–і–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї –≤ 100 —А–∞–Ј. –Я–Њ—Б–ї–µ–і—Г—О—Й–µ–µ —Д—А–∞–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ –≤ –≥—А–∞–і–Є–µ–љ—В–µ –њ–ї–Њ—В–љ–Њ—Б—В–Є —Б–∞—Е–∞—А–Њ–Ј—Л –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ, —В–∞–Ї–ґ–µ –њ—А–Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ—Б—В–Є –≤ –Ї–Њ–љ–µ—З–љ–Њ–є –Њ—З–Є—Б—В–Ї–µ –≤ 100–1000 —А–∞–Ј, –Њ–њ—А–µ–і–µ–ї–Є—В—М —З–Є—Б—В–Њ –±–µ–ї–Ї–Њ–≤—Г—О –±–µ–Ј–љ—Г–Ї–ї–µ–Є–љ–Њ–≤—Г—О –њ—А–Є—А–Њ–і—Г –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П —Б–Ї—А–µ–њ–Є –≤ –≤–Є–і–µ –Љ–Њ–ї–µ–Ї—Г–ї –Њ–і–љ–Њ–≥–Њ –≤–Є–і–∞ —Б –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б–Њ–є 27–30 –Ї–Ф–∞ [23].
–°. –Я—А—Г–Ј–Є–љ–µ—А –Њ–±–Њ–Ј–љ–∞—З–Є–ї –Њ–±–љ–∞—А—Г–ґ–µ–љ–љ—Л–є –Є–Љ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–є –±–µ–ї–Њ–Ї –Ї–∞–Ї «–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–є –њ—А–Є–Њ–љ–љ—Л–є –±–µ–ї–Њ–Ї», –∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –µ–і–Є–љ–Є—Ж—Л, –њ–Њ –∞–љ–∞–ї–Њ–≥–Є–Є —Б —В–µ—А–Љ–Є–љ–Њ–Љ «–≤–Є—А–Є–Њ–љ», –њ—А–µ–і–ї–Њ–ґ–Є–ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —В–µ—А–Љ–Є–љ «–њ—А–Є–Њ–љ», –Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є—П –Ї–Њ—В–Њ—А–Њ–≥–Њ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –∞–љ–∞–≥—А–∞–Љ–Љ—Г –∞–љ–≥–ї–Є–є—Б–Ї–Є—Е —Б–ї–Њ–≤ – –±–µ–ї–Ї–Њ–≤–∞—П –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–∞—П (—З–∞—Б—В–Є—Ж–∞) – proteinaceous infectious (particle). –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Є–Њ–љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Г—О –µ–і–Є–љ–Є—Ж—Г (–њ–Њ –∞–љ–∞–ї–Њ–≥–Є–Є —Б –≤–Є—А–Є–Њ–љ–Њ–Љ –і–ї—П –≤–Є—А—Г—Б–Њ–≤), —Б–Њ—Б—В–Њ—П—Й—Г—О –Є–Ј –Љ–Њ–ї–µ–Ї—Г–ї –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ [24].
–Т—Л—П—Б–љ–Є–ї–Њ—Б—М, —З—В–Њ —Г –Љ–ї–µ–Ї–Њ–њ–Є—В–∞—О—Й–Є—Е –њ—А–Є–Њ–љ–љ—Л–є –±–µ–ї–Њ–Ї –Љ–Њ–ґ–µ—В —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞—В—М –≤ –і–≤—Г—Е –Є–Ј–Њ—Д–Њ—А–Љ–∞—Е, —В.–µ. –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –љ–µ–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–є –њ—А–Є–Њ–љ–љ—Л–є –±–µ–ї–Њ–Ї —В–Њ–≥–Њ –ґ–µ —Б–∞–Љ–Њ–≥–Њ –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –Є —В–Њ–є –ґ–µ —Б–∞–Љ–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б—Л, —В.–µ. —В–∞–Ї–ґ–µ —Б–Њ—Б—В–Њ—П—Й–Є–є –Є–Ј 253 –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В, –љ–Њ –љ–µ –Њ–±–ї–∞–і–∞—О—Й–Є–є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ—Б—В—М—О –Є –Њ—В–ї–Є—З–∞—О—Й–Є–є—Б—П –Њ—В –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –ї–Є—И—М –њ–Њ —Б–≤–Њ–µ–є —В—А–µ—В–Є—З–љ–Њ–є –Є –і–∞–ґ–µ —З–µ—В–≤–µ—А—В–Є—З–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ. –Х–≥–Њ –љ–∞–Є–≤—Л—Б—И–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –≤ –љ–µ–є—А–Њ–љ–∞—Е –Є –≤ –≥–ї–Є–Є. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ –µ–≥–Њ –љ–µ–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–∞—П –Є–Ј–Њ—Д–Њ—А–Љ–∞ (–њ—А–Є–љ–Є–Љ–∞—П –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ –µ–≥–Њ –Ї–ї–µ—В–Њ—З–љ–Њ–µ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є–µ) –±—Л–ї–∞ –љ–∞–Є–Љ–µ–љ–Њ–≤–∞–љ–∞ –Ї–∞–Ї «–љ–Њ—А–Љ–∞–ї—М–љ—Л–є» –Є–ї–Є «–Ї–ї–µ—В–Њ—З–љ—Л–є –њ—А–Є–Њ–љ–љ—Л–є –±–µ–ї–Њ–Ї», –Ї–Њ—В–Њ—А—Л–є –њ–Њ–ї—Г—З–Є–ї –Њ–±–Њ–Ј–љ–∞—З–µ–љ–Є–µ —Б–Є–Љ–≤–Њ–ї–Њ–Љ PrPC (–Њ—В –∞–љ–≥–ї–Є–є—Б–Ї–Њ–≥–Њ Prion Protein Cell).
–У–µ–љ Prnp, –Ї–Њ–і–Є—А—Г—О—Й–Є–є —Б–Є–љ—В–µ–Ј –±–µ–ї–Ї–∞ PrPC, –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –Ї–Њ—А–Њ—В–Ї–Њ–Љ –њ–ї–µ—З–µ —Е—А–Њ–Љ–Њ—Б–Њ–Љ—Л 20 —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –≤ —Е—А–Њ–Љ–Њ—Б–Њ–Љ–µ 2 – —Г –Љ—Л—И–Є. –У–µ–љ —П–≤–ї—П–µ—В—Б—П –≤—Л—Б–Њ–Ї–Њ–Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ—Л–Љ, –Є –љ–∞–Є–≤—Л—Б—И–Є–µ —Г—А–Њ–≤–љ–Є –µ–≥–Њ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –Њ—В–Љ–µ—З–µ–љ—Л –≤ –љ–µ–є—А–Њ–љ–∞—Е, –≥–і–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Є–†–Э–Ъ –і–ї—П PrPC –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –≤ 50 —А–∞–Ј –≤—Л—И–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є –≤ –Ї–ї–µ—В–Ї–∞—Е –≥–ї–Є–Є [25–27]. –°–Є–љ—В–µ–Ј–Є—А—Г—П—Б—М –≤ —Н–љ–і–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ —А–µ—В–Є–Ї—Г–ї—Г–Љ–µ –Ї–ї–µ—В–Ї–Є, –±–µ–ї–Њ–Ї –њ–Њ–Ї–Є–і–∞–µ—В –µ–≥–Њ, –њ—А–Њ—Е–Њ–і–Є—В —З–µ—А–µ–Ј –∞–њ–њ–∞—А–∞—В –У–Њ–ї—М–і–ґ–Є –Є –љ–∞–Ї–∞–њ–ї–Є–≤–∞–µ—В—Б—П –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ–Ї [27].
–Р–љ–∞–ї–Є–Ј —Д—Г–љ–Ї—Ж–Є–Є –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ PrPC –≤—Л—П–≤–Є–ї –µ–≥–Њ –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –ґ–Є–Ј–љ–µ–і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Љ–ї–µ–Ї–Њ–њ–Є—В–∞—О—Й–Є—Е, —Г –Ї–Њ—В–Њ—А—Л—Е –і–Њ 80% –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В–µ–є –±–µ–ї–Ї–∞ –Њ–Ї–∞–Ј—Л–≤–∞—О—В—Б—П –Є–і–µ–љ—В–Є—З–љ—Л–Љ–Є, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –Ї—Г—А, —Г –Ї–Њ—В–Њ—А—Л—Е –Є–і–µ–љ—В–Є—З–љ—Л –≤—Б–µ–≥–Њ 30%. –С–µ–ї–Њ–Ї PrPC –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є —Б–Њ—Е—А–∞–љ–љ–Њ—Б—В–Є –љ–µ–є—А–Њ–љ–Њ–≤ –Є –≥–ї–Є–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞, –њ—А–Є—З–∞—Б—В–µ–љ –Ї –њ—А–Њ—Ж–µ—Б—Б–∞–Љ —А–µ–≥—Г–ї—П—Ж–Є–Є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Ї–∞–ї—М—Ж–Є—П (–°–∞+) –≤ –љ–µ–є—А–Њ–љ–∞—Е, —Г—З–∞—Б—В–≤—Г–µ—В –≤ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П —Б–Є–љ–∞–њ—Б–Њ–≤, –≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ –Љ–µ–і–Є, –≤ —В—А–∞–љ—Б–і—Г–Ї—Ж–Є–Є —Б–Є–≥–љ–∞–ї–Њ–≤ –≤ –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є, –љ–Њ –≥–ї–∞–≤–љ–∞—П –µ–≥–Њ —Д—Г–љ–Ї—Ж–Є—П —Б–≤—П–Ј–∞–љ–∞ —Б –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ–Љ –≤ –Ї–ї–µ—В–Ї–∞—Е, —В–Ї–∞–љ—П—Е, –Њ—А–≥–∞–љ–∞—Е –Є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –≤ —Ж–µ–ї–Њ–Љ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л—Е —Ж–Є—А–Ї–∞–і–Є–∞–љ–љ—Л—Е —А–Є—В–Љ–Њ–≤ (–Њ—В –ї–∞—В. circa – –Њ–Ї–Њ–ї–Њ –Є dies – –і–µ–љ—М), —В.–µ. –Њ–Ї–Њ–ї–Њ—Б—Г—В–Њ—З–љ—Л—Е —А–Є—В–Љ–Њ–≤ –њ–Њ–Ї–Њ—П –Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є [28, 29].
–Я–Њ—Б–ї–µ–і–љ—П—П —Д—Г–љ–Ї—Ж–Є—П –±–µ–ї–Ї–∞ PrPC —Е–Њ—А–Њ—И–Њ –њ–Њ–і–Ї—А–µ–њ–ї—П–µ—В—Б—П —Д–∞–Ї—В–Њ–Љ –Њ—В–Ї—А—Л—В–Є—П –≤ 1986 –≥. –Ы—Г–≥–∞—А–µ–Ј–Є –Є —Б–Њ–∞–≤—В. –љ–Њ–≤–Њ–є –Љ–µ–і–ї–µ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є, –Њ–±–Њ–Ј–љ–∞—З–µ–љ–љ–Њ–є –Ї–∞–Ї «—Б–Љ–µ—А—В–µ–ї—М–љ–∞—П —Б–µ–Љ–µ–є–љ–∞—П –±–µ—Б—Б–Њ–љ–љ–Є—Ж–∞». –Р–≤—В–Њ—А—Л –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, c—В—А–∞–і–∞—О—Й–Є—Е —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —Б–Є–љ—В–µ–Ј–∞ –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ PrPC. –£ —В–∞–Ї–Є—Е –ї—О–і–µ–є —А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї–Њ—Б—М —А–µ–Ј–Ї–Њ–µ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Б–љ–∞, —Г –љ–Є—Е —А–∞–Ј–≤–Є–≤–∞–ї–Є—Б—М –≥–∞–ї–ї—О—Ж–Є–љ–∞—Ж–Є–Є, —Г—В—А–∞—З–Є–≤–∞–ї–Є—Б—М —Ж–Є—А–Ї–∞–і–Є–∞–љ–љ—Л–µ —А–Є—В–Љ—Л, –Є –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ —Б—З–µ—В–µ —В–∞–Ї–Є–µ –ї–Є—Ж–∞ –њ–Њ–≥–Є–±–∞–ї–Є –Њ—В –±–µ—Б—Б–Њ–љ–љ–Є—Ж—Л [30]. –Ю–њ–Є—Б–∞–љ—Л —Г–ґ–µ –Њ–Ї–Њ–ї–Њ 100 —Б–ї—Г—З–∞–µ–≤ —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б—А–µ–і–Є 40 —Б–µ–Љ–µ–є—Б—В–≤, –њ—А–Њ–ґ–Є–≤–∞—О—Й–Є—Е –≤ –Ш—В–∞–ї–Є–Є, –У–µ—А–Љ–∞–љ–Є–Є, –Р–≤—Б—В—А–Є–Є, –Ш—Б–њ–∞–љ–Є–Є, –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є, –§—А–∞–љ—Ж–Є–Є, –§–Є–љ–ї—П–љ–і–Є–Є, –°–®–Р, –Р–≤—Б—В—А–∞–ї–Є–Є, –ѓ–њ–Њ–љ–Є–Є, –Ъ–Є—В–∞–µ –Є –Ь–∞—А–Њ–Ї–Ї–Њ [31].
–Я—А–Є–Њ–љ–љ—Л–є –±–µ–ї–Њ–Ї –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –ї—О–і–µ–є –Є –ґ–Є–≤–Њ—В–љ—Л—Е, —Б—В—А–∞–і–∞—О—Й–Є—Е –Ґ–У–≠, –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –і—А—Г–≥–Њ–є —Д–Њ—А–Љ–µ, –Ї–Њ—В–Њ—А–∞—П –Њ–±–Њ–Ј–љ–∞—З–∞–µ—В—Б—П –∞–±–±—А–µ–≤–Є–∞—В—Г—А–Њ–є PrPSc (–Њ—В –∞–љ–≥–ї. Scrapie), —З—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б —В–µ–Љ, —З—В–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —Б–Ї—А–µ–њ–Є –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ –њ—А–Є—А–Њ–і–µ –Є —А–µ–Ј–µ—А–≤—Г–∞—А–Њ–Љ —В–∞–Ї–Њ–≥–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ —Б–ї—Г–ґ–∞—В –Њ–≤—Ж—Л –Є –Ї–Њ–Ј—Л, –Є –±–µ–ї–Њ–Ї —Н—В–Њ—В –±—Л–ї –≤—Л–і–µ–ї–µ–љ –Є–Ј –Љ–Њ–Ј–≥–Њ–≤–Њ–є —В–Ї–∞–љ–Є –Ј–∞—А–∞–ґ–µ–љ–љ—Л—Е —Б–Ї—А–µ–њ–Є –ґ–Є–≤–Њ—В–љ—Л—Е [26].
–£–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ PrPSc –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Ј–∞—А–∞–ґ–µ–љ–љ—Л—Е –ї—О–і–µ–є –Є–ї–Є –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В –њ—А–Њ—Ж–µ—Б—Б–∞ —А–∞–Ј–Љ–љ–Њ–ґ–µ–љ–Є—П –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –њ—А–Є –≤–Є—А—Г—Б–љ—Л—Е –Є–ї–Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є—П—Е –Є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –±–ї–∞–≥–Њ–і–∞—А—П –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ —В—А–µ—В–Є—З–љ–Њ–є –Є–ї–Є –і–∞–ґ–µ —З–µ—В–≤–µ—А—В–Є—З–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А –Љ–Њ–ї–µ–Ї—Г–ї –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ PrPC. –Ь–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ —Н—В–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ —Б–≤—П–Ј–∞–љ —Б –њ—А–µ–≤—А–∞—Й–µ–љ–Є–µ–Љ —З–∞—Б—В–Є α-—Б–њ–Є—А–∞–ї—М–љ—Л—Е –і–Њ–Љ–µ–љ–Њ–≤ –≤ β-—В—П–ґ–Є. –Ґ–∞–Ї–Њ–є –њ—А–Њ—Ж–µ—Б—Б –љ–Њ—Б–Є—В –љ–∞–Ј–≤–∞–љ–Є–µ –Ї–Њ–љ—Д–Њ—А–Љ–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, –њ–Њ–і—А–∞–Ј—Г–Љ–µ–≤–∞—О—Й–µ–≥–Њ –ї–Є—И—М –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л, –љ–Њ –љ–µ –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –±–µ–ї–Ї–Њ–≤–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—Л [28]. –Т —Н—В–Њ–є —Б–≤—П–Ј–Є, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В —А–∞–Ј–Љ–љ–Њ–ґ–µ–љ–Є—П –Є–Ј–≤–µ—Б—В–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, –Ј–∞—А–∞–ґ–µ–љ–љ–Њ–Љ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ –њ—А–Є–Њ–љ–љ—Л–Љ –±–µ–ї–Ї–Њ–Љ, –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –±–µ–ї–Ї–Њ–≤—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї –Ј–∞ —Б—З–µ—В –Ї–Њ–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Љ–Њ–ї–µ–Ї—Г–ї –±–µ–ї–Ї–∞ PrPC, –Є —В–∞–Ї–Њ–є –њ—А–Њ—Ж–µ—Б—Б –љ–Њ—Б–Є—В –ї–∞–≤–Є–љ–Њ–Њ–±—А–∞–Ј–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А [29] (—А–Є—Б. 2).
–Ю—В–Ї—А—Л—В–Є–µ –њ—А–Є–Њ–љ–Њ–≤ –°. –Я—А—Г–Ј–Є–љ–µ—А–Њ–Љ –≤ 1982 –≥. –±—Л–ї–Њ –љ–∞—Б—В–Њ–ї—М–Ї–Њ —И–Њ–Ї–Є—А—Г—О—Й–Є–Љ, –Є–±–Њ –љ–µ —Г–Ї–ї–∞–і—Л–≤–∞–ї–Њ—Б—М –≤ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ —А–∞–Љ–Ї–Є –Њ—Б–љ–Њ–≤ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –±–Є–Њ–ї–Њ–≥–Є–Є –Є –≥–µ–љ–µ—В–Є–Ї–Є, —З—В–Њ –Њ–љ–Њ —Б—А–∞–Ј—Г –і–∞–ґ–µ –љ–µ –±—Л–ї–Њ –њ–Њ –і–Њ—Б—В–Њ–Є–љ—Б—В–≤—Г –Њ—Ж–µ–љ–µ–љ–Њ. –Ш –ї–Є—И—М —Б–њ—Г—Б—В—П 15 –ї–µ—В –∞–≤—В–Њ—А—Г –±—Л–ї–∞ –њ—А–Є—Б—Г–ґ–і–µ–љ–∞ –Э–Њ–±–µ–ї–µ–≤—Б–Ї–∞—П –њ—А–µ–Љ–Є—П –њ–Њ –Љ–µ–і–Є—Ж–Є–љ–µ. –Т —Б–≤—П–Ј–Є —Б –Њ—В–Ї—А—Л—В–Є–µ–Љ –њ—А–Є–Њ–љ–Њ–≤ –≤—Л–Ј—Л–≤–∞–µ–Љ—Л–µ –Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–Њ–ї—Г—З–Є–ї–Є –љ–∞–Ј–≤–∞–љ–Є–µ «–њ—А–Є–Њ–љ–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є», —В–µ—А–Љ–Є–љ —Б—В–∞–ї —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –љ–∞—А—П–і—Г —Б –Є—Е –њ—А–µ–ґ–љ–Є–Љ –Њ–±–Њ–Ј–љ–∞—З–µ–љ–Є–µ–Љ – «—В—А–∞–љ—Б–Љ–Є—Б—Б–Є–≤–љ—Л–µ –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ—Л–µ —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–Є».
–Ю—Б–Њ–±—Л–є –Є–љ—В–µ—А–µ—Б –Ї –њ—А–Њ–±–ї–µ–Љ–µ –њ—А–Є–Њ–љ–Њ–≤ –Є –њ—А–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –±—Л–ї –≤—Л–Ј–≤–∞–љ —А–∞–Ј—А–∞–Ј–Є–≤—И–µ–є—Б—П —Б 1986 –≥. –≤ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є —Н–њ–Є–Ј–Њ–Њ—В–Є–µ–є –Ґ–У–≠ –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞ (–Ґ–У–≠–Ъ–†–°). –≠—В–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –±—Л–ї–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –Љ–∞—Б—Б–Њ–≤—Л–Љ –Ј–∞—А–∞–ґ–µ–љ–Є–µ–Љ –Љ–Њ–ї–Њ–і–љ—П–Ї–∞, –њ—А–Є –≤—Л–Ї–∞—А–Љ–ї–Є–≤–∞–љ–Є–Є –Ї–Њ—В–Њ—А–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Ј–∞—А–∞–ґ–µ–љ–љ—Г—О –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ –њ—А–Є–Њ–љ–љ—Л–Љ –±–µ–ї–Ї–Њ–Љ –Љ—П—Б–Њ–Ї–Њ—Б—В–љ—Г—О –Љ—Г–Ї—Г. –Э–∞–њ–Њ–Љ–љ–Є–Љ, —З—В–Њ —А–∞–љ–µ–µ –Љ—П—Б–Њ–Ї–Њ—Б—В–љ–∞—П –Љ—Г–Ї–∞ —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–∞—Б—М –≤–Њ –Љ–љ–Њ–≥–Є—Е —Б—В—А–∞–љ–∞—Е –њ—А–Є –≤—Л–Ї–∞—А–Љ–ї–Є–≤–∞–љ–Є–Є —В–µ–ї—П—В, –∞ —В–∞–Ї–ґ–µ –≤ –±—Л—В–Њ–≤—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е, –љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Є –≤—Л–Ї–∞—А–Љ–ї–Є–≤–∞–љ–Є–Є —Й–µ–љ–Ї–Њ–≤, —З—В–Њ –≤ –њ–Њ—Б–ї–µ–і–љ–µ–Љ —Б–ї—Г—З–∞–µ —Б—З–Є—В–∞–ї–Њ—Б—М –±–Њ–ї–µ–µ —Г–і–Њ–±–љ—Л–Љ –≤–Љ–µ—Б—В–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –∞–њ—В–µ—З–љ–Њ–≥–Њ –≥–ї—О–Ї–Њ–љ–∞—В–∞ –Ї–∞–ї—М—Ж–Є—П. –°—Л—А—М–µ–Љ –і–ї—П –Љ—П—Б–Њ–Ї–Њ—Б—В–љ–Њ–є –Љ—Г–Ї–Є —Б–ї—Г–ґ–∞—В —Б–Ї–µ–ї–µ—В—Л –Ї—А—Г–њ–љ–Њ–≥–Њ –Є –Љ–µ–ї–Ї–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞ –Є –і—А—Г–≥–Є–µ, –љ–µ –Є–і—Г—Й–Є–µ –≤ –њ–Є—Й—Г —З–µ–ї–Њ–≤–µ–Ї–∞, —З–∞—Б—В–Є —В—Г—И –Ї–Њ—А–Њ–≤ –Є –Њ–≤–µ—Ж. –Т —В–µ—Е–љ–Њ–ї–Њ–≥–Є—О –њ–Њ–ї—Г—З–µ–љ–Є—П —В–∞–Ї–Њ–є –Љ—Г–Ї–Є –њ–Њ—Б–ї–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —В—Й–∞—В–µ–ї—М–љ–Њ–≥–Њ –Є–Ј–Љ–µ–ї—М—З–µ–љ–Є—П –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —Б—Л—А—М—П –≤–Ї–ї—О—З–µ–љ–∞ —В–∞–Ї–ґ–µ –Њ–±—А–∞–±–Њ—В–Ї–∞ –∞–Ї—В–Є–≤–љ—Л–Љ–Є –ґ–Є—А–Њ—А–∞—Б—В–≤–Њ—А–Є—В–µ–ї—П–Љ–Є –Є, –љ–∞–Ї–Њ–љ–µ—Ж, —В–µ—А–Љ–Њ–Њ–±—А–∞–±–Њ—В–Ї–∞ –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ 130–Њ–°. –Ю–і–љ–∞–Ї–Њ –≤ –Ї–Њ–љ—Ж–µ 70-—Е –≥–≥. –•–• –≤. –≤ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є –њ—А–µ–і–њ—А–Є–љ–Є–Љ–∞—В–µ–ї–Є, —А–µ—И–Є–≤ –њ–Њ–≤—Л—Б–Є—В—М –њ–Є—В–∞—В–µ–ї—М–љ—Г—О —Ж–µ–љ–љ–Њ—Б—В—М –Љ—П—Б–Њ–Ї–Њ—Б—В–љ–Њ–є –Љ—Г–Ї–Є, —Б–љ–Є–Ј–Є–ї–Є –і–ї—П —Н—В–Њ–≥–Њ —А–µ–ґ–Є–Љ —В–µ—А–Љ–Њ–Њ–±—А–∞–±–Њ—В–Ї–Є –і–Њ 110–Њ–°, –∞ —В–∞–Ї–ґ–µ —Г–Љ–µ–љ—М—И–Є–ї–Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤–µ—Й–µ—Б—В–≤, —Н–Ї—Б—В—А–∞–≥–Є—А—Г—О—Й–Є—Е –ґ–Є—А. –Ш–Љ–µ–љ–љ–Њ —Н—В–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П —В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є –Є —Б—Л–≥—А–∞–ї–Є —А–Њ–Ї–Њ–≤—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є —Н–њ–Є–Ј–Њ–Њ—В–Є–Є –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞ [32].
–≠–њ–Є–Ј–Њ–Њ—В–Є—П —А–∞–Ј–≤–Є–≤–∞–ї–∞—Б—М —Б –љ–∞—А–∞—Б—В–∞—О—Й–µ–є —Б–Є–ї–Њ–є. –С–Њ–ї–µ–Ј–љ—М –Њ—Е–≤–∞—В–Є–ї–∞ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ –≥—А–∞—Д—Б—В–≤–∞, —З–Є—Б–ї–Њ –Ј–∞–±–Њ–ї–µ–≤—И–Є—Е –Ї–Њ—А–Њ–≤ –њ–Њ—Б—В–Њ—П–љ–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї–Њ—Б—М –Є –≤ 1992 –≥. –і–Њ—Б—В–Є–≥–ї–Њ –њ–Є–Ї–∞, –Ї–Њ–≥–і–∞ –Ї–∞–ґ–і—Г—О –љ–µ–і–µ–ї—О —А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–ї–Є –і–Њ 1000 —Б–ї—Г—З–∞–µ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є –±–Њ–ї–µ–Ј–љ—М –њ—А–Њ—П–≤–ї—П–ї–∞—Б—М –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ, –Ї–∞–Ї –≤—Л—А–∞–ґ–∞—О—В—Б—П –≤–µ—В–µ—А–Є–љ–∞—А—Л, –≤ «–њ–Њ—В–µ—А–µ –ґ–Є–≤–Њ—В–љ—Л–Љ –Ї–Њ–љ–і–Є—Ж–Є–Є» –Є —Б–љ–Є–ґ–µ–љ–Є–Є —Г–і–Њ–є–љ–Њ—Б—В–Є. –£ –Ї–Њ—А–Њ–≤ –Є –±—Л–Ї–Њ–≤ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –≤—А–µ–Љ—П –ґ–µ–≤–∞–љ–Є—П –њ–Є—Й–Є, –Њ–љ–Є —Б—В–∞–љ–Њ–≤—П—В—Б—П –Њ—Б–Њ–±–Њ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–Љ–Є –Ї –њ—А–Є–Ї–Њ—Б–љ–Њ–≤–µ–љ–Є—О –Є –Ј–≤—Г–Ї—Г, –Њ—В–Љ–µ—З–∞–µ—В—Б—П –љ–µ–љ–Њ—А–Љ–∞–ї—М–љ–∞—П –Њ—Б–∞–љ–Ї–∞ – –≥–Њ–ї–Њ–≤–∞ –љ–Є–Ј–Ї–Њ –Њ–њ—Г—Й–µ–љ–∞, –љ–∞—А—Г—И–∞—О—В—Б—П –і–≤–Є–ґ–µ–љ–Є—П, –ґ–Є–≤–Њ—В–љ–Њ–µ —Б–Ї–ї–Њ–љ–љ–Њ –Ї –њ–∞–і–µ–љ–Є—П–Љ. –° —Б–∞–Љ–Њ–≥–Њ –љ–∞—З–∞–ї–∞ –±—Л–ї–Є –њ–Њ–і–Љ–µ—З–µ–љ—Л –љ–∞—А—Г—И–µ–љ–Є—П –њ—Б–Є—Е–Є–Ї–Є: —Г –±–Њ–ї—М–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –њ–Њ—П–≤–ї—П–µ—В—Б—П —Б—В—А–∞—Е, –±–Њ—П–Ј–љ—М –і–≤–µ—А–љ—Л—Е –њ—А–Њ–µ–Љ–Њ–≤, –Є –љ–∞—А—П–і—Г —Б —Н—В–Є–Љ –њ–Њ—П–≤–ї—П—О—В—Б—П –њ—А–Є—Б—В—Г–њ—Л –±–µ—И–µ–љ—Б—В–≤–∞ («–±–Њ–ї–µ–Ј–љ—М –±–µ—И–µ–љ–Њ–є –Ї–Њ—А–Њ–≤—Л») [33].
–Ґ–∞–Ї –ґ–µ –Ї–∞–Ї —Г –Њ–≤–µ—Ж –Є –Ї–Њ–Ј –њ—А–Є —Б–Ї—А–µ–њ–Є, —Г –њ–Њ–≥–Є–±—И–Є—Е –Ї–Њ—А–Њ–≤ –њ—А–Є –≤—Б–Ї—А—Л—В–Є–Є –≤ –≥–Њ–ї–Њ–≤–љ–Њ–Љ –Є –Є–љ–Њ–≥–і–∞ –≤ —Б–њ–Є–љ–љ–Њ–Љ –Љ–Њ–Ј–≥–µ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –≥–Є–±–µ–ї—М –љ–µ–є—А–Њ–љ–Њ–≤, –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –≤–∞–Ї—Г–Њ–ї–µ–є, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –љ–∞ —Н—В–Њ–є –Њ—Б–љ–Њ–≤–µ –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Љ–Њ–Ј–≥–Њ–≤–Њ–є —В–Ї–∞–љ–Є –Є —А–∞–Ј–≤–Є—В–Є–µ –≥–ї–Є–Њ–Ј–∞. –Э–∞ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–Ј–∞—Е —В–Ї–∞–љ–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ PrPSc –≤ –Њ–±–ї–∞—Б—В–Є –≤–∞–Ї—Г–Њ–ї–Є–Ј–∞—Ж–Є–Є –Є –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –µ—Й–µ —Б–Њ—Е—А–∞–љ–Є–≤—И–Є—Е—Б—П –љ–µ–є—А–Њ–љ–Њ–≤.
–Ч–∞ 10 –ї–µ—В –≤ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є –њ–Њ–≥–Є–±–ї–Њ –Њ–Ї–Њ–ї–Њ 200 —В—Л—Б. –≥–Њ–ї–Њ–≤ –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞, —Е–Њ—В—П –њ—А–∞–≤–Є—В–µ–ї—М—Б—В–≤–Њ–Љ —Б—В—А–∞–љ—Л, –љ–∞—З–Є–љ–∞—П —Б 1988 –≥., –±—Л–ї–Є –њ—А–µ–і–њ—А–Є–љ—П—В—Л —Н–љ–µ—А–≥–Є—З–љ—Л–µ –Љ–µ—А—Л: —Б –Є—О–ї—П 1988 –≥. –≤–≤–µ–і–µ–љ –Ј–∞–њ—А–µ—В –љ–∞ –Ї–Њ—А–Љ–ї–µ–љ–Є–µ –ґ–≤–∞—З–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –±–µ–ї–Ї–Њ–≤–Њ—Б–Њ–і–µ—А–ґ–∞—Й–Є–Љ–Є –Ї–Њ—А–Љ–∞–Љ–Є, –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л–Љ–Є –Є–Ј –Њ—А–≥–∞–љ–Њ–≤ –Є —В–Ї–∞–љ–µ–є –ґ–≤–∞—З–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е; —Б –∞–≤–≥—Г—Б—В–∞ —В–Њ–≥–Њ –ґ–µ –≥–Њ–і–∞ –≤—Б–µ –ґ–Є–≤–Њ—В–љ—Л–µ —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ—Г—О —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є—О –Ї–Њ—А–Њ–≤ –њ–Њ–і–ї–µ–ґ–∞–ї–Є —Г–±–Њ—О, –∞ –Ј–∞—В–µ–Љ –Є —Г–љ–Є—З—В–Њ–ґ–µ–љ–Є—О –≤ —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Є—Е –њ–µ—З–∞—Е [32, 33].
–Э–∞—З–Є–љ–∞—П —Б 1993 –≥. —Н–њ–Є–Ј–Њ–Њ—В–Є—П –њ–Њ—И–ї–∞ –љ–∞ —Г–±—Л–ї—М, –Њ–і–љ–∞–Ї–Њ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —З–Є—Б–ї–Њ –Є–Ј–≤–µ—Б—В–љ—Л—Е —А–∞–љ–µ–µ —В—А–∞–љ—Б–Љ–Є—Б—Б–Є–≤–љ—Л—Е –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ—Л—Е —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–є —Г–і–≤–Њ–Є–ї–Њ—Б—М: –Ї –Є–Ј–≤–µ—Б—В–љ—Л–Љ —А–∞–љ–µ–µ —Б–Ї—А–µ–њ–Є, —В—А–∞–љ—Б–Љ–Є—Б—Б–Є–≤–љ–Њ–є —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–Є –љ–Њ—А–Њ–Ї –Є –•–Ш–С –Њ–ї–µ–љ–µ–є –Є –ї–Њ—Б–µ–є –њ—А–Є–±–∞–≤–Є–ї–Є—Б—М —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ –Ґ–У–≠–Ъ–†–°, —В—А–∞–љ—Б–Љ–Є—Б—Б–Є–≤–љ–∞—П –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ–∞—П —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є—П –Ї–Њ—И–µ–Ї –Є —В—А–∞–љ—Б–Љ–Є—Б—Б–Є–≤–љ–∞—П –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ–∞—П —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є—П —Н–Ї–Ј–Њ—В–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–њ—Л—В–љ—Л—Е.
–Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —Б–љ–∞—З–∞–ї–∞ –±—А–Њ–і—П—З–Є—Е, –∞ –Ј–∞—В–µ–Љ –Є –і–Њ–Љ–∞—И–љ–Є—Е –Ї–Њ—И–µ–Ї –±—Л–ї–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ–Љ –Є–Љ–Є –≤ –њ–Є—Й—Г –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –Љ—П—Б–∞ –Є –≤–љ—Г—В—А–µ–љ–љ–Њ—Б—В–µ–є –±–Њ–ї—М–љ—Л—Е –Є –њ–Њ–≥–Є–±—И–Є—Е –Ї–Њ—А–Њ–≤ –Є –±—Л–Ї–Њ–≤. –°–ї—Г—З–∞–Є –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ–Њ–є —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–Є –≤–Њ–Ј–љ–Є–Ї–ї–Є –Є —Г –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –≤ –Ы–Њ–љ–і–Њ–љ—Б–Ї–Њ–Љ –Ј–Њ–Њ–њ–∞—А–Ї–µ –њ—Г–Љ—Л, –і–≤—Г—Е –≥–µ–њ–∞—А–і–Њ–≤, –Њ—Ж–µ–ї–Њ—В–∞ –Є —В–Є–≥—А–∞. –Я—А–Є—З–Є–љ–∞ –њ—А–Њ—Б—В–∞ – –≤—Б–µ—Е –Є—Е –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Ї–Њ—А–Љ–Є–ї–Є —А–∞—Б–Ї–Њ–ї–Њ—В—Л–Љ–Є –≥–Њ–ї–Њ–≤–∞–Љ–Є –Є –Љ—П—Б–Њ–Љ –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞ [33].
–У—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ–∞—П —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є—П —Н–Ї–Ј–Њ—В–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–њ—Л—В–љ—Л—Е –Њ–њ–Є—Б–∞–љ–∞ —Г 5 –≤–Є–і–Њ–≤ –і–Є–Ї–Є—Е –ґ–Є–≤–Њ—В–љ—Л—Е: —Б–µ—А–љ–Њ–±—Л–Ї–∞, –∞—А–∞–≤–Є–є—Б–Ї–Њ–≥–Њ –Њ—А–Є–Ї—Б–∞, –Ї–∞–љ–љ—Л, —Б–∞—Е–∞—А—Б–Ї–Њ–≥–Њ –Њ—А–Є–Ї—Б–∞ –Є –±–Њ–ї—М—И–Њ–≥–Њ –Ї—Г–і—Г. –°–µ–Љ–љ–∞–і—Ж–∞—В—М —Б–ї—Г—З–∞–µ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Б—А–µ–і–Є —Н—В–Є—Е –ґ–Є–≤–Њ—В–љ—Л—Е –≤ –Ј–Њ–Њ–њ–∞—А–Ї–∞—Е —В–∞–Ї–ґ–µ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Є –Є—Е –≤—Л–Ї–∞—А–Љ–ї–Є–≤–∞–љ–Є–Є –Љ—П—Б–Њ–Ї–Њ—Б—В–љ–Њ–є –Љ—Г–Ї–Є.
–Я—А–Є–Њ–љ–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞ –њ–Њ–Љ–Є–Љ–Њ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є –≤—Б–Ї–Њ—А–µ –±—Л–ї–Є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ—Л –≤o –§—А–∞–љ—Ж–Є–Є, –У–µ—А–Љ–∞–љ–Є–Є, –®–≤–µ–є—Ж–∞—А–Є–Є, –Ш—В–∞–ї–Є–Є, –Я–Њ—А—В—Г–≥–∞–ї–Є–Є, –Ш—А–ї–∞–љ–і–Є–Є, –Э–Є–і–µ—А–ї–∞–љ–і–∞—Е, –Ф–∞–љ–Є–Є, –°–®–Р, –Ю–Љ–∞–љ–µ, –Ъ–Є—В–∞–µ –Є –љ–∞ –§–Њ–ї–Ї–ї–µ–љ–і—Б–Ї–Є—Е –Њ—Б—В—А–Њ–≤–∞—Е. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, —Б –≥–Њ–і–∞–Љ–Є —Б–њ–Є—Б–Њ–Ї —Б—В—А–∞–љ, –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–≤—И–Є—Е —Г —Б–µ–±—П —Б–ї—Г—З–∞–Є –Ґ–У–≠–Ъ–†–°, –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї—Б—П –Є –Ї 2006 –≥. –і–Њ—Б—В–Є–≥ —Г–ґ–µ 40, —З—В–Њ –±—Л–ї–Њ —Б–≤—П–Ј–∞–љ–Њ –ї–Є–±–Њ —Б –Є–Љ–њ–Њ—А—В–Њ–Љ —Г–ґ–µ –Ј–∞—А–∞–ґ–µ–љ–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е, –ї–Є–±–Њ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –≤ —Н—В–Є—Е —Б—В—А–∞–љ–∞—Е –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–љ–Њ–є –Љ—П—Б–Њ–Ї–Њ—Б—В–љ–Њ–є –Љ—Г–Ї–Є [34].
–°—В–Њ–ї—М —И–Є—А–Њ–Ї–Њ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ —Н—В–Њ–є –њ—А–Є–Њ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞, –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ, –Њ–±–Њ—Б–љ–Њ–≤—Л–≤–∞–ї–Њ –±–µ—Б–њ–Њ–Ї–Њ–є—Б—В–≤–Њ –њ–Њ –њ–Њ–≤–Њ–і—Г –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ–µ—А–µ–і–∞—З–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ—В –ґ–Є–≤–Њ—В–љ—Л—Е —З–µ–ї–Њ–≤–µ–Ї—Г, —В–µ–Љ –±–Њ–ї–µ–µ, —З—В–Њ –±—Л–ї —Г–ґ–µ —В–≤–µ—А–і–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –њ—Г—В—М –њ–µ—А–µ–і–∞—З–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –∞–≥–µ–љ—В–∞ —Б –Ј–∞—А–∞–ґ–µ–љ–љ–Њ–є –њ–Є—Й–µ–є.
–Т –Љ–∞—А—В–µ 1996 –≥. —Н—В–Њ –±–µ—Б–њ–Њ–Ї–Њ–є—Б—В–≤–Њ –±—Л–ї–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ–Њ–і–Ї—А–µ–њ–ї–µ–љ–Њ —Б–Њ–Њ–±—Й–µ–љ–Є–µ–Љ, –њ–µ—А–µ–і–∞–љ–љ—Л–Љ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–µ–є –≤ –Т–Ю–Ч, –Њ 10 —Б–ї—Г—З–∞—П—Е —Б–Љ–µ—А—В–Є –Љ–Њ–ї–Њ–і—Л—Е –ї—О–і–µ–є –Њ—В —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–≥–Њ «–љ–Њ–≤–Њ–≥–Њ –≤–∞—А–Є–∞–љ—В–∞ –С–Ъ–ѓ» (–љ–≤–С–Ъ–ѓ) [34]. –І–µ—А–µ–Ј 1 –Љ–µ—Б. –Њ —В–∞–Ї–Њ–Љ –ґ–µ —Б–ї—Г—З–∞–µ —Б–Њ–Њ–±—Й–Є–ї–∞ –§—А–∞–љ—Ж–Є—П, –∞ —З–µ—А–µ–Ј –≥–Њ–і –љ–∞ —В–µ—А—А–Є—В–Њ—А–Є–Є –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –µ—Й–µ 5 —Б–ї—Г—З–∞–µ–≤ —Н—В–Њ–є –±–Њ–ї–µ–Ј–љ–Є. –Ъ 1998 –≥. –≤ –Љ–Є—А–µ —Б—В–∞–ї–Њ –Є–Ј–≤–µ—Б—В–љ–Њ –Њ 24 —Б–ї—Г—З–∞—П—Е, –∞ –Ї –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –Є—Е —З–Є—Б–ї–Њ –≤ –Х–≤—А–Њ–њ–µ —Г–ґ–µ –њ—А–µ–≤—Л—Б–Є–ї–Њ 200 [35].
–Т —Б–∞–Љ–Њ–Љ –љ–∞—З–∞–ї–µ –±—Л–ї–Њ –њ–Њ–і–Љ–µ—З–µ–љ–Њ, —З—В–Њ –љ–≤–С–Ъ–ѓ –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–є –С–Ъ–ѓ —А—П–і–Њ–Љ —Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤: –±–Њ–ї–µ–Ј–љ—М –њ–Њ—А–∞–ґ–∞–µ—В –Љ–Њ–ї–Њ–і—Л—Е –ї—О–і–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –≤ —Б—А–µ–і–љ–µ–Љ –і–Њ 30 –ї–µ—В. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ—Л –љ–≤–С–Ъ–ѓ –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –≤ –Є–Ј–Љ–µ–љ–µ–љ–Є–Є –ї–Є—З–љ–Њ—Б—В–Є: –±–Њ–ї—М–љ–Њ–є —В–µ—А—П–µ—В –Є–љ—В–µ—А–µ—Б –Ї —Б–≤–Њ–µ–Љ—Г —Е–Њ–±–±–Є, –љ–∞—З–Є–љ–∞–µ—В —Б—В–Њ—А–Њ–љ–Є—В—М—Б—П —Б–∞–Љ—Л—Е –±–ї–Є–Ј–Ї–Є—Е –ї—О–і–µ–є, –≤–њ–∞–і–∞–µ—В –≤ –і–µ–њ—А–µ—Б—Б–Є—О. –°—А–µ–і–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Њ—В–Љ–µ—З–∞—О—В —А–∞–Ј–≤–Є—В–Є–µ —В—А–µ–≤–Њ–ґ–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П, –±–µ—Б—Б–Њ–љ–Є—Ж—Г, —Е–Њ—А–µ—О, –Љ–Є–Њ–Ї–ї–Њ–љ—Г—Б –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й—Г—О –∞—В–∞–Ї—Б–Є—О. –С–Њ–ї—М–љ–Њ–є –љ–µ –Љ–Њ–ґ–µ—В —Б–∞–Љ —Б–µ–±—П –Њ–±—Б–ї—Г–ґ–Є–≤–∞—В—М, —В–µ—А—П–µ—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ –њ—А–Є–љ–Є–Љ–∞—В—М –њ–Є—Й—Г. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ—Л –њ—А–Є –љ–≤–С–Ъ–ѓ –њ–Њ–Ј–і–љ–Њ –љ–∞—Б—В—Г–њ–∞–µ—В —Б–ї–∞–±–Њ—Г–Љ–Є–µ, –Є –њ–∞—Ж–Є–µ–љ—В –Њ—Б–Њ–Ј–љ–∞–µ—В —Б–≤–Њ–µ —Г—Е—Г–і—И–∞—О—Й–µ–µ—Б—П –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ. –Я–∞—В–Њ–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ —Е–Њ—В—П –Є –±—Л–ї–∞ —Е–∞—А–∞–Ї—В–µ—А–љ–∞ –і–ї—П –Ґ–У–≠, –Њ–і–љ–∞–Ї–Њ –Њ–љ–∞ –Њ—В–ї–Є—З–∞–ї–∞—Б—М –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ–Љ –±–Њ–ї—М—И–Є—Е –∞–Љ–Є–ї–Њ–Є–і–љ—Л—Е –±–ї—П—И–µ–Ї –≤ –Љ–Њ–Ј–ґ–µ—З–Ї–µ –Є –Ї–Њ—А–µ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –Њ–Ї—А—Г–ґ–µ–љ–љ—Л—Е –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–Љ–Є –≤–∞–Ї—Г–Њ–ї—П–Љ–Є [36].
–£—З–Є—В—Л–≤–∞—П –і–Њ–Ї–∞–Ј–∞–љ–љ–Њ—Б—В—М –∞–ї–Є–Љ–µ–љ—В–∞—А–љ–Њ–≥–Њ –њ—Г—В–Є –Ј–∞—А–∞–ґ–µ–љ–Є—П –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –і–ї—П –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ –њ—А–µ–Њ–і–Њ–ї–µ–≤–∞—В—М –Љ–µ–ґ–≤–Є–і–Њ–≤—Л–µ –±–∞—А—М–µ—А—Л, —Б –і—А—Г–≥–Њ–є, –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ, –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ, –њ–∞–і–∞–ї–Њ –љ–∞ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –љ–≤–С–Ъ–ѓ –≤ —Б–≤—П–Ј–Є —Б —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ–Љ –≤ –њ–Є—Й—Г –Ј–∞—А–∞–ґ–µ–љ–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ –њ–Є—В–∞–љ–Є—П. –Ф–ї—П –≤—Л—П—Б–љ–µ–љ–Є—П –њ—А–Є—З–Є–љ –љ–∞ –Љ—Л—И–∞—Е –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —В—А–µ—Е —И—В–∞–Љ–Љ–Њ–≤ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ PrPSc, –≤—Л–і–µ–ї–µ–љ–љ–Њ–≥–Њ: 1) –Є–Ј –Љ–Њ–Ј–≥–Њ–≤–Њ–є —В–Ї–∞–љ–Є –Ї–Њ—А–Њ–≤—Л, –њ–Њ–≥–Є–±—И–µ–є –Њ—В –Ґ–У–≠, 2) –Є–Ј –Љ–Њ–Ј–≥–Њ–≤–Њ–є —В–Ї–∞–љ–Є –Њ–≤—Ж—Л, –њ–Њ–≥–Є–±—И–µ–є –Њ—В —Б–Ї—А–µ–њ–Є –Є 3) –Є–Ј –Љ–Њ–Ј–≥–Њ–≤–Њ–є —В–Ї–∞–љ–Є –Љ–Њ–ї–Њ–і–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞, –њ–Њ–≥–Є–±—И–µ–≥–Њ –Њ—В –љ–≤–С–Ъ–ѓ.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ —В—А–µ–Љ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ –Љ–∞—А–Ї–µ—А–∞–Љ – –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є–љ–Ї—Г–±–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞, —Б–Ї–Њ—А–Њ—Б—В—М –≥–Є–±–µ–ї–Є –Ј–∞—А–∞–ґ–µ–љ–љ—Л—Е –Љ—Л—И–µ–є –Є –њ—А–Њ—Д–Є–ї—М –њ–Њ—А–∞–ґ–µ–љ–Є—П –¶–Э–° – –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є —Б—Е–Њ–і—Б—В–≤–Њ –њ—А–Є–Њ–љ–Њ–≤, –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –Њ—В –љ–≤–С–Ъ–ѓ, —Б –њ—А–Є–Њ–љ–∞–Љ–Є, –≤—Л–і–µ–ї–µ–љ–љ—Л–Љ–Є –Є–Љ–µ–љ–љ–Њ —В–Њ–ї—М–Ї–Њ –Њ—В –Ї–Њ—А–Њ–≤—Л, –њ–Њ–≥–Є–±—И–µ–є –Њ—В –Ґ–У–≠ [37].
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л–µ –љ–∞ —В—А–∞–љ—Б–≥–µ–љ–љ—Л—Е –Љ—Л—И–∞—Е, –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Б—В–µ–њ–µ–љ—М —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –Ї –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–Љ—Г –њ—А–Є–Њ–љ–љ–Њ–Љ—Г –±–µ–ї–Ї—Г PrPSc –і–Њ–љ–Њ—А–Њ–≤ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Б—В—А—Г–Ї—В—Г—А–љ–Њ–є –±–ї–Є–Ј–Њ—Б—В—М—О –Ї –љ–µ–Љ—Г –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ PrPC —А–µ—Ж–Є–њ–Є–µ–љ—В–∞. –Ю–і–љ–∞–Ї–Њ —В–∞–Ї–∞—П –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ—Б—В—М –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –љ–µ –∞–±—Б–Њ–ї—О—В–љ–Њ–є, –∞ —П–≤–ї—П–µ—В—Б—П –ї–Є—И—М —В–µ–љ–і–µ–љ—Ж–Є–µ–є, —В. –Ї. –≤—Б–µ –њ—А–Є–≤–µ–і–µ–љ–љ—Л–µ –≤—Л—И–µ –њ—А–Є–Љ–µ—А—Л –Є –≥–ї–∞–≤–љ—Л–є –Є–Ј –љ–Є—Е – —Н–њ–Є–Ј–Њ–Њ—В–Є—П –Ґ–У–≠–Ъ–†–° —Б –µ–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П–Љ–Є –і–ї—П –і—А—Г–≥–Є—Е –≤–Є–і–Њ–≤ –ґ–Є–≤–Њ—В–љ—Л—Е – –њ—А—П–Љ–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –і–Њ–Ј—Л –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Є —З–∞—Б—В–Њ—В—Л –µ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Г—Б–њ–µ—И–љ–Њ–Љ—Г –њ—А–µ–Њ–і–Њ–ї–µ–љ–Є—О –±–∞—А—М–µ—А–Њ–≤ –љ–µ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Ї –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–Љ—Г –њ—А–Є–Њ–љ–љ–Њ–Љ—Г –±–µ–ї–Ї—Г. –Ъ—А–Њ–Љ–µ —Н—В–Њ–≥–Њ, —Б–ї–µ–і—Г–µ—В –Њ—Б–Њ–±–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –≤ –Є–Ј—Г—З–µ–љ–Є–Є –њ—А–Є—А–Њ–і—Л —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є –љ–µ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї –њ—А–Є–Њ–љ–љ—Л–Љ –±–Њ–ї–µ–Ј–љ—П–Љ –±–Њ–ї—М—И—Г—О —А–Њ–ї—М –Є–≥—А–∞–µ—В –≥–µ–љ–Њ—В–Є–њ –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –Є–ї–Є —З–µ–ї–Њ–≤–µ–Ї–∞. –Ш —Н—В–Њ—В –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–є –Ї–Њ–љ—В—А–Њ–ї—М –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –≤–Є–і–Њ–Љ –Љ—Г—В–∞—Ж–Є–є, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–Є—Е –≤ –≥–µ–љ–µ Prnp, –Ї–Њ–і–Є—А—Г—О—Й–µ–Љ —Б–Є–љ—В–µ–Ј –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ PrPC [35].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Ї–∞—А—В–Є—А–Њ–≤–∞–љ—Л –±–Њ–ї–µ–µ 40 —Е–Њ—А–Њ—И–Њ –Є–Ј—Г—З–µ–љ–љ—Л—Е –Љ—Г—В–∞—Ж–Є–є –≤ –≥–µ–љ–µ Prnp. –Ґ–∞–Ї, –њ—А–Є —Б–ї—Г—З–∞—П—Е —Б–њ–Њ—А–∞–і–Є—З–µ—Б–Ї–Њ–є –С–Ъ–ѓ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ –Љ—Г—В–∞—Ж–Є—П –≤ –Ї–Њ–і–Њ–љ–µ 178, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Ј–∞–Љ–µ–љ–∞ –∞—Б–њ–∞—А–∞–≥–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –љ–∞ –∞—Б–њ–∞—А–∞–≥–Є–љ. –Э–Њ –µ—Б–ї–Є –њ—А–Є —Н—В–Њ–Љ 129-–є –Ї–Њ–і–Њ–љ –Ї–Њ–і–Є—А—Г–µ—В –≤–∞–ї–Є–љ, —В–Њ –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –С–Ъ–ѓ, –∞ –µ—Б–ї–Є –ґ–µ –≤ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є 129 –љ–∞—Е–Њ–і–Є—В—Б—П –Љ–µ—В–Є–Њ–љ–Є–љ, —В–Њ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —Б–µ–Љ–µ–є–љ–∞—П —Б–Љ–µ—А—В–µ–ї—М–љ–∞—П –±–µ—Б—Б–Њ–љ–Є—Ж–∞. –Я—А–Є –Љ—Г—В–∞—Ж–Є–Є –Я—А–Њ102–Ы–µ–є –≤–Њ–Ј–љ–Є–Ї–∞–µ—В —Б–Є–љ–і—А–Њ–Љ –У–µ—А—Б—В–Љ–∞–љ–љ–∞––®—В—А–µ—Г—Б—Б–ї–µ—А–∞––®–µ–є–љ–Ї–µ—А–∞ [38].
–Я–µ—А–≤—Л–µ –њ–Њ–њ—Л—В–Ї–Є –Є–Љ–Љ—Г–љ–Њ–і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є–Є –Є–ї–Є –Є–Љ–Љ—Г–љ–Њ–њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ—А–Є–Њ–љ–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є —Б—В–Њ–ї–Ї–љ—Г–ї–Є—Б—М —Б —Д–∞–Ї—В–Њ–Љ –њ–Њ–ї–љ–Њ–≥–Њ –Њ—В—Б—Г—В—Б—В–≤–Є—П —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –∞–љ—В–Є—В–µ–ї –≤ –Ј–∞—А–∞–ґ–µ–љ–љ–Њ–Љ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ [10, 24]. –Я–Њ–і–Њ–±–љ—Л–є —А–µ–Ј—Г–ї—М—В–∞—В —Б—В–∞–љ–Њ–≤–Є—В—Б—П –њ–Њ–љ—П—В–љ—Л–Љ, —Г—З–Є—В—Л–≤–∞—П —Б—В—А—Г–Ї—В—Г—А–љ—Г—О –±–ї–Є–Ј–Њ—Б—В—М –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ PrPSc –Є –µ–≥–Њ –Ї–ї–µ—В–Њ—З–љ–Њ–є –Є–Ј–Њ—Д–Њ—А–Љ—Л PrP–°, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –Њ—А–≥–∞–љ–Є–Ј–Љ «—А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В» –±–µ–ї–Њ–Ї PrPSc –Ї–∞–Ї «—Б–≤–Њ–є». –Я–Њ—Н—В–Њ–Љ—Г –љ–µ—Г–і–Є–≤–Є—В–µ–ї—М–љ–Њ, —З—В–Њ –Є—Б–њ—Л—В–∞–љ–Є—П –±–Њ–ї—М—И–Њ–≥–Њ —З–Є—Б–ї–∞ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ —Б —Ж–µ–ї—М—О –њ–Њ–≤–ї–Є—П—В—М –љ–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Љ—Л—И–µ–є –Њ–Ї–Њ–љ—З–Є–ї–Є—Б—М –љ–µ—Г–і–∞—З–µ–є, –Є —В–Њ–ї—М–Ї–Њ –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ, –∞—А–∞—Е–Є—Б–Њ–≤–Њ–µ –Љ–∞—Б–ї–Њ –Є –њ–Њ–ї–Є–∞–љ–Є–Њ–љ—Л –Ј–∞–Љ–µ—В–љ–Њ —Б–љ–Є–ґ–∞–ї–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Љ—Л—И–µ–є –Ї –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—О —Б–Ї—А–µ–њ–Є [34]. –Я—А–Є–Њ–љ–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 4.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –њ—А–Є–Њ–љ–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є –Њ—Б–љ–Њ–≤—Л–≤–∞–µ—В—Б—П –љ–∞ —Г–ґ–µ –Њ–њ–Є—Б–∞–љ–љ–Њ–є –≤—Л—И–µ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–µ. –Ы–∞–±–Њ—А–∞—В–Њ—А–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ —Н—В–Є—Е —Б—В—А–∞–і–∞–љ–Є–є –≤–Ї–ї—О—З–∞–µ—В –≤ —Б–µ–±—П –њ—А—П–Љ—Л–µ –Є –љ–µ–њ—А—П–Љ—Л–µ –Љ–µ—В–Њ–і—Л [30]. –Ъ –њ–µ—А–≤—Л–Љ –Є–Ј –љ–Є—Е –Њ—В–љ–Њ—Б—П—В—Б—П: —Н–ї–µ–Ї—В—А–Њ–љ–љ–Њ-–Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Б–Ї—А–µ–њ–Є-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Д–Є–±—А–Є–ї–ї, –Њ–њ—А–µ–і–µ–ї—П–µ–Љ—Л—Е –≤ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–∞—Е –Є–ї–Є –Њ—В–њ–µ—З–∞—В–Ї–∞—Е; –Є–Љ–Љ—Г–љ–Њ–±–ї–Њ—В—В–Є–љ–≥ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї; –Љ–µ—В–Њ–і –њ–µ–њ—В–Є–і–љ—Л—Е –Ј–Њ–љ–і–Њ–≤, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л–є –љ–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Љ–µ—З–µ–љ—Л—Е —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є—Е –њ–µ–њ—В–Є–і–Њ–≤, –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В–љ–∞—П –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В—М –Ї–Њ—В–Њ—А—Л—Е –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Љ —Б–≤—П–Ј—Л–≤–∞—В—М—Б—П —Б–Њ —Б—В—А—Г–Ї—В—Г—А–Њ–є –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞.
–Т–∞–ґ–љ—Л–Љ —И–∞–≥–Њ–Љ, –Є–Љ–µ—О—Й–Є–Љ –Ї–∞–Ї —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Њ–µ, —В–∞–Ї –Є –Љ–µ—В–Њ–і–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, –±—Л–ї–Њ –њ–Њ–ї—Г—З–µ–љ–Є–µ –∞–љ—В–Є—В–µ–ї –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–љ—В–Є–≥–µ–љ–∞ –≤—Л—Б–Њ–Ї–Њ–Њ—З–Є—Й–µ–љ–љ—Л—Е –њ—А–Є–Њ–љ–Њ–≤ —Б–Ї—А–µ–њ–Є. –Т —Б—Л–≤–Њ—А–Њ—В–Ї–∞—Е –Ї—А–Њ–ї–Є–Ї–Њ–≤, –Ї–Њ—В–Њ—А—Л–Љ –≤–≤–Њ–і–Є–ї–Є PrPSc, –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –∞–љ—В–Є—В–µ–ї–∞ –љ–µ —В–Њ–ї—М–Ї–Њ –Ї –љ–µ–Љ—Г, –љ–Њ –Є –Ї –і—А—Г–≥–Є–Љ –±–µ–ї–Ї–∞–Љ, –Њ—В–ї–Є—З–∞—О—Й–Є–Љ—Б—П –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б–Њ–є. –Ю—З–µ–≤–Є–і–љ–Њ, —Н—В–Є –±–µ–ї–Ї–Є –ї–Є–±–Њ –Њ–±–ї–∞–і–∞—О—В –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є –∞–љ—В–Є–≥–µ–љ–љ–Њ–є –і–µ—В–µ—А–Љ–Є–љ–∞–љ—В–Њ–є (–Њ–±–ї–∞—Б—В—М—О –∞–љ—В–Є–≥–µ–љ–∞, –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞—А–љ–Њ–є –∞–љ—В–Є—В–µ–ї—Г) —Б PrPSc, –ї–Є–±–Њ –Њ–љ–Є –њ—А–Њ–і—Г–Ї—В –µ–≥–Њ —А–∞—Б—Й–µ–њ–ї–µ–љ–Є—П [51, 52].
–Э–µ–њ—А—П–Љ—Л–µ –Љ–µ—В–Њ–і—Л –≤–Ї–ї—О—З–∞—О—В –Њ–±—Л—З–љ—Г—О –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О —В–µ—Е–љ–Є–Ї—Г, –±–ї–∞–≥–Њ–і–∞—А—П –Ї–Њ—В–Њ—А–Њ–є –≤ –Њ–±—А–∞–Ј—Ж–∞—Е –±–Є–Њ–њ—Б–Є–є–љ–Њ–≥–Њ –Є–ї–Є –∞—Г—В–Њ–њ—Б–Є–є–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Њ–њ—А–µ–і–µ–ї—П—О—В –≥–ї–Є–Њ–Ј, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Љ–Њ–Ј–≥–Њ–≤–Њ–є —В–Ї–∞–љ–Є –Є –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –≤ –љ–µ–є –∞–Љ–Є–ї–Њ–Є–і–љ—Л—Е –±–ї—П—И–µ–Ї; –≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–є –Љ–µ—В–Њ–і –Њ—Б–љ–Њ–≤—Л–≤–∞–µ—В—Б—П –љ–∞ –≤—Л—П–≤–ї–µ–љ–Є–Є —Б –њ–Њ–Љ–Њ—Й—М—О –Ї—А–∞—Б–Є—В–µ–ї–µ–є (–Ї–Њ–љ–≥–Њ –Ї—А–∞—Б–љ—Л–є, —В–µ–Њ—Д–ї–∞–≤–Є–љ –Ґ) —Б–Ї–Њ–њ–ї–µ–љ–Є–є –∞–Љ–Є–ї–Њ–Є–і–∞; –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Љ–µ—В–Њ–і –≤–Ї–ї—О—З–∞–µ—В –Ј–∞—А–∞–ґ–µ–љ–Є–µ –Є—Б–њ—Л—В—Г–µ–Љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е (–±–Є–Њ–њ—А–Њ–±–∞), —З—В–Њ, –Њ–і–љ–∞–Ї–Њ, —Б–≤—П–Ј–∞–љ–Њ —Б –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –љ–∞–±–ї—О–і–µ–љ–Є—П, –Є–ї–Є –Ј–∞—А–∞–ґ–µ–љ–Є–µ –Ї–ї–µ—В–Њ—З–љ—Л—Е –Ї—Г–ї—М—В—Г—А. –Э–µ–і–∞–≤–љ–Њ –і–ї—П –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –≤–∞—А–Є–∞–љ—В–∞ –±—Л–ї–∞ –њ—А–µ–і–ї–Њ–ґ–µ–љ–∞ –Ї—Г–ї—М—В—Г—А–∞ –Ї–ї–µ—В–Њ–Ї N2a, –Ј–∞—А–∞–ґ–µ–љ–Є–µ –Ї–Њ—В–Њ—А–Њ–є –Є—Б–њ—Л—В—Г–µ–Љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤ 10 —А–∞–Ј –±—Л—Б—В—А–µ–µ, —З–µ–Љ —Б –њ–Њ–Љ–Њ—Й—М—О –±–Є–Њ–њ—А–Њ–±—Л, –њ–Њ–ї—Г—З–Є—В—М —А–µ–Ј—Г–ї—М—В–∞—В –њ—А–Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є —В–Њ–≥–Њ –ґ–µ —Г—А–Њ–≤–љ—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є [38, 39].
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –њ—А–Є–Њ–љ–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є, –њ–Њ–Љ–Є–Љ–Њ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –≤—Л—И–µ –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є, –Њ—Б–љ–Њ–≤—Л–≤–∞–µ—В—Б—П —В–∞–Ї–ґ–µ –љ–∞ –љ–µ–і–Њ–њ—Г—Й–µ–љ–Є–Є –≤ –њ–Є—Й—Г –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –Љ—П—Б–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ –Є–ї–Є –і—А—Г–≥–Є—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ —Г–±–Њ—П. –Ш–Љ–µ–љ–љ–Њ –≤ —Н—В–Њ–є —Б–≤—П–Ј–Є –µ—Й–µ –≤ 2000 –≥. –≥–ї–∞–≤–љ—Л–Љ –≥–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ—Л–Љ —Б–∞–љ–Є—В–∞—А–љ—Л–Љ –≤—А–∞—З–Њ–Љ –†–§ –±—Л–ї–Њ –≤—Л–њ—Г—Й–µ–љ–Њ –Я–Њ—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ вДЦ 15 «–Ю –Љ–µ—А–∞—Е –њ–Њ –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—О —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—П –±–Њ–ї–µ–Ј–љ–Є –Ъ—А–µ–є—В—Ж—Д–µ–ї—М–і–∞-–ѓ–Ї–Њ–±–∞ –љ–∞ —В–µ—А—А–Є—В–Њ—А–Є–Є –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є». –Я—А–µ–і–њ–Є—Б—Л–≤–∞–ї–Њ—Б—М, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, «–љ–µ –і–Њ–њ—Г—Б–Ї–∞—В—М –Ј–∞–Ї—Г–њ–Њ–Ї –Љ—П—Б–∞, –Љ—П—Б–љ—Л—Е –Є –і—А—Г–≥–Є—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ —Г–±–Њ—П –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞, –∞ —В–∞–Ї–ґ–µ –њ–Њ–ї—Г—З–µ–љ–Є—П –Є—Е –њ–Њ –≥—Г–Љ–∞–љ–Є—В–∞—А–љ–Њ–є –њ–Њ–Љ–Њ—Й–Є –±–µ–Ј –њ—А–µ–і–Њ—Б—В–∞–≤–ї–µ–љ–Є—П –і–Њ–Ї—Г–Љ–µ–љ—В–Њ–≤, –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—Й–Є—Е –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤ —Б—В—А–∞–љ–µ-—Н–Ї—Б–њ–Њ—А—В–µ—А–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≥—Г–±–Ї–Њ–Њ–±—А–∞–Ј–љ–Њ–є —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–µ–є –Ї–Њ—А–Њ–≤». –Я—А–µ–і–ї–∞–≥–∞–ї–Њ—Б—М —В–∞–Ї–ґ–µ —Г—Б–Є–ї–Є—В—М –Ї–Њ–љ—В—А–Њ–ї—М –љ–∞ –Љ–µ—Б—В–∞—Е –Ј–∞ –њ—А–Њ–і–∞–ґ–µ–є –Љ—П—Б–∞ –Є –Љ—П—Б–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ [34].
–Т–Љ–µ—Б—В–µ —Б —В–µ–Љ, –Њ—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є—П—Е –њ—А–Є–Ї–Њ–≤—Л–≤–∞–µ—В –Ї —Б–µ–±–µ –њ—А–Њ–±–ї–µ–Љ–∞ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е –Є–Ј–і–µ–ї–Є–є –Є –Ї–Њ—Б–Љ–µ—В–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤, –њ–Њ–ї—Г—З–∞–µ–Љ—Л—Е –Є–Ј –Њ—А–≥–∞–љ–Њ–≤ –Є —В–Ї–∞–љ–µ–є –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞. –Т –њ–µ—А–≤—Л–µ –≥–Њ–і—Л —А–∞–Ј–≤–Є—В–Є—П —Н–њ–Є–Ј–Њ–Њ—В–Є–Є –Ґ–У–≠–Ъ–†–° –±—Л–ї–Њ —В–≤–µ—А–і–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ –Њ—А–≥–∞–љ—Л –Є —В–Ї–∞–љ–Є –Ј–∞—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–∞—В –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–є –њ—А–Є–Њ–љ–љ—Л–є –±–µ–ї–Њ–Ї, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Ї–Њ—В–Њ—А–Њ–≥–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–µ–ї–Є–Ї–∞ –≤ –≥–Њ–ї–Њ–≤–љ–Њ–Љ –Є —Б–њ–Є–љ–љ–Њ–Љ –Љ–Њ–Ј–≥–µ, –Ї–Њ—Б—В–љ–Њ–Љ –Љ–Њ–Ј–≥–µ, –≥–ї–∞–Ј–љ—Л—Е —П–±–ї–Њ–Ї–∞—Е, –Ї—А–Њ–≤–Є, —Б–µ–ї–µ–Ј–µ–љ–Ї–µ, –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–∞—Е, –Љ—Л—И—Ж–∞—Е, –Ї–Є—И–µ—З–љ–Є–Ї–µ, —В–Є–Љ—Г—Б–µ, –њ–µ—З–µ–љ–Є, –ї–µ–≥–Ї–Є—Е, –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–∞—Е. –Т—Б–Ї–Њ—А–µ –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ —Н–њ–Є–Ј–Њ–Њ—В–Є–Є –Ґ–У–≠–Ъ–†–° –≤ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є –°–Њ–≤–µ—В –Х–≤—А–Њ–њ—Л –Ј–∞–њ—А–µ—В–Є–ї –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–Њ –Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —Б–Њ—В–µ–љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤, –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–Њ –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б—Л—А—М—П –Є–Ј –Њ—А–≥–∞–љ–Њ–≤ –Є —В–Ї–∞–љ–µ–є –Ї–Њ—А–Њ–≤.
–Ъ–∞—Б–∞—П—Б—М –њ—А–Њ–±–ї–µ–Љ—Л –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є, –Љ—Л –≤—Л—Б–Ї–∞–Ј—Л–≤–∞–µ–Љ –Њ–Ј–∞–±–Њ—З–µ–љ–љ–Њ—Б—В—М –≤ —Б–≤—П–Ј–Є —Б —В–µ–Љ, —З—В–Њ —Г –љ–∞—Б –≤ —Б—В—А–∞–љ–µ —Б—Л—А—М–µ –і–ї—П —Г–њ–Њ–Љ—П–љ—Г—В—Л—Е –≤—Л—И–µ —В–Њ–≤–∞—А–Њ–≤ –њ—А–Є–Њ–±—А–µ—В–∞–µ—В—Б—П –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –Є–Ј-–Ј–∞ —А—Г–±–µ–ґ–∞, –∞ –≤–µ–і—М —Н—В–Њ —В–Њ–≤–∞—А—Л –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ–Њ–≥–Њ, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П. –Т –љ–∞—И–µ–є —Б—В—А–∞–љ–µ –Ј–∞–Ї–Њ–љ–Њ–і–∞—В–µ–ї—М–љ—Л–µ –Љ–µ—А—Л –Ї–Њ—Б–љ—Г–ї–Є—Б—М –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ї–Є—И—М —З–∞—Б—В–Є—З–љ–Њ. –Ґ–∞–Ї, –±—Л–ї–Є –Ј–∞–њ—А–µ—Й–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В—Л, –њ—А–Њ–Є–Ј–≤–Њ–і–Є–Љ—Л–µ –Є–Ј –≥–Є–њ–Њ—Д–Є–Ј–∞ —З–µ–ї–Њ–≤–µ–Ї–∞, –∞ —В–∞–Ї–ґ–µ –Є–Ј —А–∞–Ј–љ—Л—Е —З–∞—Б—В–µ–є –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞ – –Ї–Њ—А—В–Є–Ї–Њ—В—А–Њ–њ–Є–љ, —Ж–Є–љ–Ї-–Ї–Њ—А—В–Є–Ї–Њ—В—А–Њ–њ–Є–љ–∞ —Б—Г—Б–њ–µ–љ–Ј–Є—П, –∞–і–Є—Г—А–µ–Ї—А–Є–љ, –≥–Њ–Є—Д–Њ—В–Њ—Ж–Є–љ, –ї–∞–Ї—В–Є–љ –і–ї—П –Є–љ—К–µ–Ї—Ж–Є–є, –њ–Є—В—Г–Є—В—А–Є–љ –і–ї—П –Є–љ—К–µ–Ї—Ж–Є–є, –∞ —В–∞–Ї–ґ–µ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л–µ –і–Њ–±–∞–≤–Ї–Є –Ї –њ–Є—Й–µ [40].
–Ю–і–љ–∞–Ї–Њ —А—П–і –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Є–Ј–≥–Њ—В–∞–≤–ї–Є–≤–∞—О—Й–Є—Е—Б—П –љ–∞ –Њ—Б–љ–Њ–≤–µ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ —Б—Л—А—М—П, –њ—А–Њ–і–Њ–ї–ґ–∞—О—В –≤—Л–Ј—Л–≤–∞—В—М –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ –Њ–њ–∞—Б–µ–љ–Є—П. –Э–µ—Б–ї—Г—З–∞–є–љ–Њ, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, –Њ–і–љ–∞ –Є–Ј –њ—Г–±–ї–Є–Ї–∞—Ж–Є–є –Є–Ј –Ы–∞–±–Њ—А–∞—В–Њ—А–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥—Б–Ї–Њ–≥–Њ –≥–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ —В–∞–Ї –Є –Њ–Ј–∞–≥–ї–∞–≤–ї–µ–љ–∞ «–Ю—Б—В–Њ—А–Њ–ґ–љ–Њ: –∞–Ї—В–Њ–≤–µ–≥–Є–љ, —Б–Њ–ї–Ї–Њ—Б–µ—А–Є–ї, –Ї–Њ—А—В–µ–Ї—Б–Є–љ, —Ж–µ—А–µ–±—А–Њ–ї–Є–Ј–∞—В!». –Ф–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –њ—А–Є –±–ї–Є–ґ–∞–є—И–µ–Љ —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–Є–Є –≤—Л—П—Б–љ—П–µ—В—Б—П, —З—В–Њ, –љ–∞–њ—А–Є–Љ–µ—А, –∞–Ї—В–Њ–≤–µ–≥–Є–љ –Є —Б–Њ–ї–Ї–Њ—Б–µ—А–Є–ї –Є–Ј–≥–Њ—В–∞–≤–ї–Є–≤–∞—О—В—Б—П –Є–Ј –Ї—А–Њ–≤–Є —В–µ–ї—П—В, –∞ –Ї–Њ—А—В–µ–Ї—Б–Є–љ –Є —Ж–µ—А–µ–±—А–Њ–ї–Є–Ј–∞—В – –Є–Ј –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ —Г–±–Њ–є–љ–Њ–≥–Њ –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞ [40].
–Ф–ї—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–є –Є–ї–ї—О—Б—В—А–∞—Ж–Є–Є –Љ–Њ–ґ–љ–Њ –њ—А–Є–≤–µ—Б—В–Є –і–∞–љ–љ—Л–µ, –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–µ —В–Њ–є –ґ–µ –Ы–∞–±–Њ—А–∞—В–Њ—А–Є–µ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ —Д–∞–Ї—Г–ї—М—В–µ—В–∞ –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥—Б–Ї–Њ–≥–Њ –≥–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞, –≤ –Ї–Њ—В–Њ—А—Л—Е —Б–Њ–Њ–±—Й–∞–µ—В—Б—П –Њ–± —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –љ–∞ –Њ–і–љ—Г —В—А–µ—В—М —Б—Г–Љ–Љ–∞—А–љ–Њ–є —З–∞—Б—В–Њ—В—Л –≤—Б–µ—Е –і–µ–Љ–µ–љ—Ж–Є–є –≤ 16 —Б—В—А–∞–љ–∞—Е, –њ—А–Є–Љ–µ–љ—П–≤—И–Є—Е –њ—А–µ–њ–∞—А–∞—В –∞–Ї—В–Њ–≤–µ–≥–Є–љ–∞, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—П —Б 25 —Б—В—А–∞–љ–∞–Љ–Є, –≥–і–µ —Г–Ї–∞–Ј–∞–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –љ–µ –њ—А–Є–Љ–µ–љ—П–ї—Б—П –љ–Є–Ї–Њ–≥–і–∞. –Я–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ, —З—В–Њ –њ–Њ—Б–ї–µ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–Є—П —Г–Ї–∞–Ј–∞–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –≤ –љ–∞—З–∞–ї–µ 2011 –≥. –њ—А–µ–њ–∞—А–∞—В –∞–Ї—В–Њ–≤–µ–≥–Є–љ –Є –ї—О–±—Л–µ –і—А—Г–≥–Є–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, –Є–Ј–≥–Њ—В–∞–≤–ї–Є–≤–∞–µ–Љ—Л–µ –Є–Ј —В–Ї–∞–љ–µ–є –Ї—А—Г–њ–љ–Њ–≥–Њ —А–Њ–≥–∞—В–Њ–≥–Њ —Б–Ї–Њ—В–∞, –≤ —В–Њ–Љ –ґ–µ –≥–Њ–і—Г –±—Л–ї–Є –љ–µ–Љ–µ–і–ї–µ–љ–љ–Њ –Ј–∞–њ—А–µ—Й–µ–љ—Л –≤ –Ъ–∞–љ–∞–і–µ –Є –°–®–Р.
–°–µ–≥–Њ–і–љ—П –љ–∞–і–Њ –њ—А–Є–Ј–љ–∞—В—М, —З—В–Њ –њ—А–Њ–±–ї–µ–Љ–∞ –ї–µ—З–µ–љ–Є—П –њ—А–Є–Њ–љ–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є –Њ—Б—В–∞–µ—В—Б—П –љ–µ—А–µ—И–µ–љ–љ–Њ–є, –Є –≤—Б–µ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –њ–Њ–њ—Л—В–Ї–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, –∞—Ж–Є–Ї–ї–Њ–≤–Є—А–∞, —Б—В–µ—А–Њ–Є–і–Њ–≤ –Є–ї–Є —В–Є–∞–Љ–Є–љ–∞ –њ—А–Є –С–Ъ–ѓ –љ–µ–Є–Ј–Љ–µ–љ–љ–Њ –Ј–∞–Ї–∞–љ—З–Є–≤–∞–ї–Є—Б—М –љ–∞—Г–і–∞—З–µ–є [34, 41]. –Я–Њ—Н—В–Њ–Љ—Г –њ–Њ–Ї–∞ –Љ–Њ–ґ–љ–Њ –≥–Њ–≤–Њ—А–Є—В—М –ї–Є—И—М –Њ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–∞—Е, –і–∞—О—Й–Є—Е –Њ—Б–љ–Њ–≤–∞–љ–Є–µ –і–ї—П –і–∞–ї—М–љ–µ–є—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Ъ —В–∞–Ї–Є–Љ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П–Љ —Г–ґ–µ —Б–µ–≥–Њ–і–љ—П –Њ—В–љ–Њ—Б—П—В—Б—П: –≥—А—Г–њ–њ–∞ —Б—Г–ї—М—Д–∞—В–Є—А–Њ–≤–∞–љ–љ—Л—Е –≥–ї—О–Ї–Њ–Ј–Њ–∞–Љ–Є–љ–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤, –≤–Ї–ї—О—З–∞—О—Й–∞—П –њ–µ–љ—В–Њ–Ј–∞–љ –њ–Њ–ї–Є—Б—Г–ї—М—Д–∞—В, –Ї–∞—А—А–∞–≥–Є–љ–∞–љ, –і–µ–Ї—Б—В—А–∞–љ—Б—Г–ї—М—Д–∞—В 500; –њ–Њ–ї–Є–µ–љ–Њ–≤—Л–є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї –∞–Љ—Д–Њ—В–µ—А–Є—Ж–Є–љ –Т –Є –µ–≥–Њ –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л–µ, –∞–љ—В–Є–±–Є–Њ—В–Є–Ї –∞–љ—В—А–∞—Ж–Є–Ї–ї–Є–љ, –њ–Њ—А—Д–Є—А–Є–љ—Л –Є —Д—В–∞–ї–Њ—Ж–Є–∞–љ–Є–љ—Л, –њ–Њ–ї–Є–∞–Љ–Є–љ—Л –Є –љ–µ–Ї–Њ—В–Њ—А—Л–µ –і—А—Г–≥–Є–µ. –Я–Њ –Љ–љ–µ–љ–Є—О —Н–Ї—Б–њ–µ—А—В–Њ–≤ –Т—Б–µ–Љ–Є—А–љ–Њ–є –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П, –љ–∞–Є–±–Њ–ї–µ–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ–Є —Б–ї–µ–і—Г–µ—В –њ—А–Є–Ј–љ–∞—В—М –њ–Њ–і—Е–Њ–і—Л, –Њ—Б–љ–Њ–≤—Л–≤–∞—О—Й–Є–µ—Б—П –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —В—А–µ—Е–Љ–µ—А–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л –њ—А–Є–Њ–љ–Њ–≤. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Љ–Њ–ї–µ–Ї—Г–ї–∞ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ PrPC —Б–Њ—Б—В–Њ–Є—В –Є–Ј —З–µ—В—Л—А–µ—Е α-—Б–њ–Є—А–∞–ї—М–љ—Л—Е –і–Њ–Љ–µ–љ–Њ–≤, —Б—В–∞–±–Є–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Љ–µ–ґ–і–Њ–Љ–µ–љ–љ—Л–Љ–Є —Н–ї–µ–Ї—В—А–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П–Љ–Є –Є S-S1-—Б–≤—П–Ј—М—О, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≤ –Љ–Њ–ї–µ–Ї—Г–ї–µ –µ–≥–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –Є–Ј–Њ—Д–Њ—А–Љ—Л PrPSc –і–≤–∞ –і–Њ–Љ–µ–љ–∞ (–Э3 –Є –Э4) —Б–Њ—Е—А–∞–љ—П—О—В —Б–≤–Њ—О –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ—Г—О —Б–њ–Є—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Г—О —Д–Њ—А–Љ—Г, –∞ –і–≤–∞ –і—А—Г–≥–Є—Е (–Э1 –Є –Э2) –њ—А–µ–≤—А–∞—Й–∞—О—В—Б—П –≤ —З–µ—В—Л—А–µ β-—В—П–ґ–∞, —Б–≤—П–Ј–∞–љ–љ—Л—Е –і—А—Г–≥ —Б –і—А—Г–≥–Њ–Љ –Є —Б –і–Њ–Љ–µ–љ–∞–Љ–Є –Э3 –Є –Э4 [35, 42]. –Я–Њ–і–Њ–±–љ–Њ–µ –њ—А–µ–≤—А–∞—Й–µ–љ–Є–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ —Б–∞–Љ–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—Л –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –±–µ–ї–Ї–∞, –∞ —В–∞–Ї–ґ–µ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ–Њ—А–Њ–є –і–∞–ґ–µ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л—Е –Љ—Г—В–∞—Ж–Є–Њ–љ–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ PrP-–≥–µ–љ–µ –Є–ї–Є, –Љ–Њ–ґ–µ—В –±—Л—В—М, –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –Ї–∞–Ї–Є—Е-–љ–Є–±—Г–і—М —А–µ–∞–Ї—Ж–Є–Њ–љ–љ–Њ –∞–Ї—В–Є–≤–љ—Л—Е (–љ–∞–њ—А–Є–Љ–µ—А, —Д–Њ—Б—Д–Њ—А–Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є—Е) —Б–Њ–µ–і–Є–љ–µ–љ–Є–є [43] (—А–Є—Б. 3).
–Т—Б–µ –≤–Њ–Ј—А–∞—Б—В–∞—О—Й–Є–є –Љ–Є—А–Њ–≤–Њ–є –Є–љ—В–µ—А–µ—Б –Ї –њ—А–Њ–±–ї–µ–Љ–µ –њ—А–Є–Њ–љ–Њ–≤ –Є –њ—А–Є–Њ–љ–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є —Б–≤—П–Ј–∞–љ –љ–µ —В–Њ–ї—М–Ї–Њ —Б –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–Є–Љ—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —З–Є—Б–ї–∞ —Б–ї—Г—З–∞–µ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –љ–≤–С–Ъ–ѓ –ї—О–і–µ–є –Є –Ґ–У–≠–Ъ–†–°, –љ–Њ –Є —Б –∞–±—Б–Њ–ї—О—В–љ–Њ –љ–Њ–≤—Л–Љ–Є –Ї–∞—З–µ—Б—В–≤–∞–Љ–Є —Б–∞–Љ–Њ–≥–Њ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П —Н—В–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –љ–∞–Ї–∞–њ–ї–Є–≤–∞–µ—В—Б—П –≤—Б–µ –±–Њ–ї—М—И–µ –і–∞–љ–љ—Л—Е –Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –±–µ–ї–Ї–Њ–≤ –Ї –Є–Ј–Љ–µ–љ–µ–љ–Є—О —Б–≤–Њ–µ–є —В—А–µ—В–Є—З–љ–Њ–є –Є –≤—В–Њ—А–Є—З–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л –і–∞–ґ–µ –±–µ–Ј –Љ—Г—В–∞—Ж–Є–Њ–љ–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ–± —Н—Б—Б–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —В–∞–Ї–Є—Е –±–µ–ї–Ї–Њ–≤ –Ї –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Ї–Њ–љ—Д–Њ—А–Љ–∞—Ж–Є–Є [27]. –Ф–Њ–±–∞–≤–Є–Љ, —З—В–Њ –њ–Њ—П–≤–ї–µ–љ–Є–µ –і—А—Г–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л—Е –љ–∞ –љ–∞—А—Г—И–µ–љ–Є—П—Е —В—А–µ—В–Є—З–љ–Њ–є –Є–ї–Є –≤—В–Њ—А–Є—З–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л –±–µ–ї–Ї–Њ–≤, –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –њ–Њ–і—А–∞–Ј–і–µ–ї–Є—В—М –Є—Е –љ–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –Є –љ–µ–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –∞–Љ–Є–ї–Њ–Є–і–Њ–Ј—Л –Є –≤–≤–µ—Б—В–Є –љ–Њ–≤–Њ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ – «–Ї–Њ–љ—Д–Њ—А–Љ–∞—Ж–Є–Њ–љ–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є» [43]. –Х—Б—В—М –Њ—Б–љ–Њ–≤–∞–љ–Є—П –њ–Њ–ї–∞–≥–∞—В—М, —З—В–Њ —В–∞–Ї–Є–µ –Ї–Њ–љ—Д–Њ—А–Љ–∞—Ж–Є–Њ–љ–љ—Л–µ –±–µ–ї–Ї–Є –Љ–Њ–≥—Г—В –≤—Л–њ–Њ–ї–љ—П—В—М —А–Њ–ї—М –≥–ї–∞–≤–љ—Л—Е —А–µ–≥—Г–ї—П—В–Њ—А–Њ–≤ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ. –Ю–і–љ–∞–Ї–Њ –≤—Л—Б–Ї–∞–Ј—Л–≤–∞–µ–Љ—Л–µ –Є–љ–Њ–≥–і–∞ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є—П –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Є–Њ–љ—Л –Љ–Њ–≥—Г—В –∞–Ї—В–Є–≤–љ–Њ —Г—З–∞—Б—В–≤–Њ–≤–∞—В—М –≤ –њ—А–Њ—Ж–µ—Б—Б–µ —Б—В–∞—А–µ–љ–Є—П, —П–≤–ї—П—О—В—Б—П –Њ—И–Є–±–Њ—З–љ—Л–Љ–Є, —В.–Ї. –Є–Ј–≤–µ—Б—В–љ—Л–µ —Б–µ–≥–Њ–і–љ—П –±–µ–ї–Ї–Є, –≤—Л–Ј—Л–≤–∞—О—Й–Є–µ –Ї–∞—А–і–Є–љ–∞–ї—М–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л —Б—В–∞—А–µ–љ–Є—П, – –≥–Є–±–µ–ї—М –љ–µ–є—А–Њ–љ–Њ–≤ –Є –≥–ї–Є–Њ–Ј [44], –∞ —В–∞–Ї–ґ–µ —Г—З–∞—Б—В–≤—Г—О—Й–Є–µ –≤ —Г–≥–љ–µ—В–µ–љ–Є–Є –љ–µ–є—А–Њ–≥–µ–љ–µ–Ј–∞ [45], – –Є–Љ–µ—О—В –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Г—О –Љ–∞—Б—Б—Г –њ–Њ—А—П–і–Ї–∞ 10 –Ї–Ф–∞, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –Љ–∞—Б—Б–∞ –њ—А–Є–Њ–љ–Њ–≤ –±–Њ–ї—М—И–µ.
–Ф–ї—П —В–Њ–≥–Њ —З—В–Њ–±—Л –њ—А–µ–і—Б—В–∞–≤–ї—П—В—М —Б–µ–±–µ –Љ–µ—Б—В–Њ –Љ–µ–і–ї–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є –≤ –Њ–±—Й–µ–Љ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–Љ –∞–љ—Б–∞–Љ–±–ї–µ, –љ–µ —Б–ї–µ–і—Г–µ—В –Ј–∞–±—Л–≤–∞—В—М, —З—В–Њ –Љ–µ–і–ї–µ–љ–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —З–∞—Б—В–љ—Л–є —Б–ї—Г—З–∞–є –њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П, –Ї–Њ—В–Њ—А–∞—П (–њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є—П), –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –Љ–Њ–ґ–µ—В –≤—Л—А–∞–ґ–∞—В—М—Б—П –Ї–∞–Ї –ї–∞—В–µ–љ—В–љ–∞—П –Є–ї–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П —Д–Њ—А–Љ–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ (—В–∞–±–ї. 5).
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –Ї–∞–ґ—Г—Й—Г—О—Б—П –њ–Њ–і—А–Њ–±–љ—Г—О —А—Г–±—А–Є–Ї–∞—Ж–Є—О —Д–Њ—А–Љ, –љ–∞–њ—А–Є–Љ–µ—А –≤–Є—А—Г—Б–љ–Њ–є –њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є–Є, –≤ –Є–љ—В–µ—А–µ—Б–∞—Е –Њ–±—К–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ –њ—А–µ–і–ї–∞–≥–∞–µ–Љ–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –љ–µ –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є –њ—А–µ–і—Г—Б–Љ–Њ—В—А–µ—В—М –Є –≤–Ї–ї—О—З–Є—В—М –≤ —Б–µ–±—П –≤—Б–µ —В–µ –љ–µ –≤—Б–µ–≥–і–∞ —П—Б–љ—Л–µ, –љ–Њ, —В–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–µ –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ—Л–µ –Є –њ–µ—А–µ—Е–Њ–і–љ—Л–µ —Д–Њ—А–Љ—Л –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –≤–Є—А—Г—Б–∞ —Б —Е–Њ–Ј—П–Є–љ–Њ–Љ, –Ї–Њ—В–Њ—А—Л–µ –њ—А–µ–і–ї–∞–≥–∞–µ—В –њ—А–Є—А–Њ–і–∞. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ, –±—Л–ї–Њ –±—Л –љ–µ–≤–µ—А–љ—Л–Љ —Б—З–Є—В–∞—В—М, —З—В–Њ –≤—Л–і–µ–ї–µ–љ–љ—Л–µ –≤ —В–∞–±–ї–Є—Ж–µ —Д–Њ—А–Љ—Л –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –љ–Њ—Б—П—В –Њ–±–Њ—Б–Њ–±–ї–µ–љ–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А. –Э–∞–њ—А–Њ—В–Є–≤, –Ї–∞–Ї —Д–Њ—А–Љ—Л —Б –љ–µ–њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ—Л–Љ –њ—А–µ–±—Л–≤–∞–љ–Є–µ–Љ –≤–Є—А—Г—Б–∞ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, —В–∞–Ї –Є —Д–Њ—А–Љ—Л, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–µ—Б—П –њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є–µ–є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П, –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М—Б—П —В–µ—Б–љ–Њ —Б–≤—П–Ј–∞–љ–љ—Л–Љ–Є –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є, –Ї–Њ–≥–і–∞ –Њ–і–љ–∞ —Д–Њ—А–Љ–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –њ–µ—А–µ—Е–Њ–і–Є—В –≤ –і—А—Г–≥—Г—О.
–•—А–µ—Б—В–Њ–Љ–∞—В–Є–є–љ—Л–Љ –њ—А–Є–Љ–µ—А–Њ–Љ –∞–Ї—В–Є–≤–∞—Ж–Є–Є —А–µ–њ—А–Њ–і—Г–Ї—Ж–Є–Є —Б–Ї—А—Л—В–Њ –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–µ–≥–Њ –≤–Є—А—Г—Б–∞ –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М –≤–Є—А—Г—Б –≥–µ—А–њ–µ—Б–∞, –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ —Б–∞–Љ—Л—Е —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–µ–∞–ї–Є–Ј—Г—О—Й–Є–є –њ–µ—А–µ—Е–Њ–і –ї–∞—В–µ–љ—В–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –≤ –Њ—Б—В—А—Г—О. –Ф—А—Г–≥–Є–Љ –њ—А–Є–Љ–µ—А–Њ–Љ –њ–µ—А–µ—Е–Њ–і–∞ –ї–∞—В–µ–љ—В–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –≤ —Е—А–Њ–љ–Є—З–µ—Б–Ї—Г—О —П–≤–ї—П–µ—В—Б—П –∞–і–µ–љ–Њ–≤–Є—А—Г—Б–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П, –Є–Љ–µ—О—Й–∞—П —И–Є—А–Њ–Ї–Њ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ. –Э–∞–Ї–Њ–љ–µ—Ж, –њ—А–Є–Љ–µ—А –њ–µ—А–µ—Е–Њ–і–∞ –ї–∞—В–µ–љ—В–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –≤ –µ–µ –Љ–µ–і–ї–µ–љ–љ—Г—О —Д–Њ—А–Љ—Г –Љ—Л –≤—Б—В—А–µ—З–∞–µ–Љ –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–є –њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є–Є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–є –њ–∞–њ–Њ–≤–∞–≤–Є—А—Г—Б–Њ–≤ (–≤–Є—А—Г—Б—Л JC –Є –Ю–Т-40), –∞–Ї—В–Є–≤–∞—Ж–Є—П —А–µ–њ—А–Њ–і—Г–Ї—Ж–Є–Є –Ї–Њ—В–Њ—А—Л—Е (–љ–∞–њ—А–Є–Љ–µ—А, –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–Њ–і–µ–њ—А–µ—Б—Б–Є–Є, –≤—Л–Ј–≤–∞–љ–љ–Њ–є –ї–Є–±–Њ —В—П–ґ–µ–ї—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ, –ї–Є–±–Њ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є) –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї —А–∞–Ј–≤–Є—В–Є—О —В–∞–Ї–Њ–є –Љ–µ–і–ї–µ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є, –Ї–∞–Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–∞—П –Љ–љ–Њ–≥–Њ–Њ—З–∞–≥–Њ–≤–∞—П –ї–µ–є–Ї–Њ—Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є—П.
–І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –Љ–µ–і–ї–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є, –≤—Л–Ј—Л–≤–∞–µ–Љ—Л—Е –њ—А–Є–Њ–љ–∞–Љ–Є, —В–Њ –Ј–і–µ—Б—М –Љ—Л —Б—В–∞–ї–Ї–Є–≤–∞–µ–Љ—Б—П —Б –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ–є, –љ–Њ —Б—Е–Њ–і–љ–Њ–є –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ—Б—В—М—О, –∞ –Є–Љ–µ–љ–љ–Њ – –њ—А–Є–Њ–љ—Л –љ–µ –≤—Л–Ј—Л–≤–∞—О—В –Њ—Б—В—А–Њ–≥–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, –љ–Њ, –≤–Љ–µ—Б—В–µ —Б —В–µ–Љ, —Б–њ–Њ—Б–Њ–±–љ—Л —Д–Њ—А–Љ–Є—А–Њ–≤–∞—В—М –ї–∞—В–µ–љ—В–љ—Г—О –Є–љ—Д–µ–Ї—Ж–Є—О, —В–∞–Ї–ґ–µ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й—Г—О—Б—П —Б–Ї—А—Л—В–Њ–є –њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є–µ–є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П, –≤ –Ї–∞—З–µ—Б—В–≤–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤—Л—Б—В—Г–њ–∞–µ—В –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–є –њ—А–Є–Њ–љ–љ—Л–є –±–µ–ї–Њ–Ї PrPSc. –Т–њ–µ—А–≤—Л–µ –Њ–± —Н—В–Њ–Љ —Б–Њ–Њ–±—Й–Є–ї –†.–Р. –Ъ–∞—А–њ [46]. –Я–Њ–Ј–і–љ–µ–µ –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П —Б–Ї—А–µ–њ–Є –±—Л–ї–∞ –Њ–њ–Є—Б–∞–љ–∞ –±–Њ–ї–≥–∞—А—Б–Ї–Є–Љ–Є –Є –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П–Љ–Є [47, 48].
–Т–Љ–µ—Б—В–µ —Б —В–µ–Љ, –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б, –≤—Л–Ј—Л–≤–∞–µ–Љ—Л–є –њ—А–Є–Њ–љ–∞–Љ–Є, –Љ–Њ–ґ–µ—В –Є–Љ–µ—В—М –љ–µ —Б—В—А–Њ–≥–Њ –Њ—З–µ—А—З–µ–љ–љ—Г—О, –љ–Њ –Є–Љ–µ–љ–љ–Њ –њ—А–Њ–Љ–µ–ґ—Г—В–Њ—З–љ—Г—О —Д–Њ—А–Љ—Г. –Я—А–Є–Љ–µ—А—Л –њ–Њ–і–Њ–±–љ–Њ–≥–Њ —А–Њ–і–∞ –±—Л–ї–Є –њ—А–Є–≤–µ–і–µ–љ—Л –љ–µ–і–∞–≤–љ–Њ –≤ –Њ–њ–Є—Б–∞–љ–Є–Є 11 —Б–ї—Г—З–∞–µ–≤ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–є «–≤–∞—А–Є–∞–±–µ–ї—М–љ–Њ–є –њ—А–Њ—В–µ–∞–Ј–∞-—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ–є –њ—А–Є–Њ–љ–Њ–њ–∞—В–Є–Є» – –∞—В–Є–њ–Є—З–љ–Њ–≥–Њ –њ—А–Є–Њ–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤—Л–Ј—Л–≤–∞–µ–Љ–Њ–≥–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ –њ—А–Є–Њ–љ–љ—Л–Љ –±–µ–ї–Ї–Њ–Љ, –љ–µ —Г—Б—В–Њ–є—З–Є–≤—Л–Љ –Ї –і–µ–є—Б—В–≤–Є—О –њ—А–Њ—В–µ–∞–Ј—Л –Ъ [49]. –Ъ–∞–Ї –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, –≤—Б–µ –Њ–њ–Є—Б–∞–љ–љ—Л–µ —Б–ї—Г—З–∞–Є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–ї–Є—Б—М –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ–Њ—Б—В—М—О –њ–Њ 129 –≤–∞–ї–Є–љ–Њ–≤–Њ–Љ—Г –Ї–Њ–і–Њ–љ—Г [50].
–Ъ—А–Њ–Љ–µ –њ—А–Є–≤–µ–і–µ–љ–љ—Л—Е –≤ —В–∞–±–ї–Є—Ж–∞—Е 1, 2, 4 –Є 6 –Љ–µ–і–ї–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –ґ–Є–≤–Њ—В–љ—Л—Е, –≤—Л–Ј—Л–≤–∞–µ–Љ—Л—Е –≤–Є—А—Г—Б–∞–Љ–Є –Є –њ—А–Є–Њ–љ–∞–Љ–Є, —Б—Г—Й–µ—Б—В–≤—Г–µ—В –≥—А—Г–њ–њ–∞ –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д–Њ—А–Љ, –Ї–∞–ґ–і–∞—П –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ—Г —Б–Є–Љ–њ—В–Њ–Љ–Њ–Ї–Њ–Љ–њ–ї–µ–Ї—Б—Г, —Е–∞—А–∞–Ї—В–µ—А—Г —В–µ—З–µ–љ–Є—П –Є –Є—Б—Е–Њ–і—Г —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –њ—А–Є–Ј–љ–∞–Ї–∞–Љ –Љ–µ–і–ї–µ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є. –Ю–і–љ–∞–Ї–Њ –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ—В —В–Њ—З–љ—Л—Е –і–∞–љ–љ—Л—Е –Њ–± –Є—Е —Н—В–Є–Њ–ї–Њ–≥–Є–Є. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –≤—Б–µ –љ–Є–ґ–µ–њ—А–Є–≤–µ–і–µ–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ—В–љ–Њ—Б—П—В –Ї –Ї–∞—В–µ–≥–Њ—А–Є–Є —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л—Е –Љ–µ–і–ї–µ–љ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є —Б –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–µ–є [1].



–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Ґ–Є–Љ–∞–Ї–Њ–≤ –Т.–Ф., –Ч—Г–µ–≤ –Т.–Р. –Ь–µ–і–ї–µ–љ–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є. –Ь.: –Ь–µ–і–Є—Ж–Є–љ–∞, 1977. –°. 7–17.
2. Sigurdsson B.// Brit. Vet. J. 1954. Vol. 110. P. 255–270.
3. Idem ibid. P. 307–322.
4. Idem ibid. P. 341–354.
5. Gajdusek D.C., Gibbs C.J. Slow, latent, and temperate virus infections; eds. D.C. Gajdusek, C.J. Gibbs, M. Alpers. Monograph. вДЦ 2. Washington, 1965. P. IX–X.
6. Sigurdsson B., Thormar H., Polson P.A. // Arch. ges. Vidusforsch. 1960. Vol. 10. P. 368–381.
7. Horta-Barbosa L., Fucillo D., Sever J. et al. // Nature. 1969. Vol. 221. P. 974.
8. Weller T.H., Neva F.A. // Proc. Soc. Exp. Biol. Med. 1962. Vol. 3. P. 215–225.
9. –Ч—Г–µ–≤ –Т.–Р. –Ь–µ–і–ї–µ–љ–љ—Л–µ –≤–Є—А—Г—Б–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –ґ–Є–≤–Њ—В–љ—Л—Е. –Ь.: –Ь–µ–і–Є—Ж–Є–љ–∞, 1988. C. 115–136.
10. –°uille J., Chelle P.L. C.R. // Acad. Sci. 1936. Vol. 203. P. 1552–1554.
11. Gajdusek D.C., Zigas V. // New Engl. J. Med. 1957. Vol. 257. P. 974–978.
12. Alpers M.P. // Am.J. trop. Med. Hyg. 1970. Vol. 19. P. 133–137.
13. Lampert P.W., Gajdusek D.C., Gibbs C.J. // Am. J. Pathol. 1972. Vol. 68. P. 626–646.
14. Hadlow W.J. // Lancet. 1959. Vol. 2. P. 289–290.
15. Gibbs C.J., Gajdusek D.C., Asher D.T. et al. // Science. 1968. Vol. 161. P. 388–389.
16. Alperovich A. // Eur. J. Neurol. 1996. Vol. 3. P. 500–506.
17. Brown P., Gibbs C.J., Rodgers-Johnson P. et al. // Ann. Neurol. 1994. Vol. 35. P. 513–529.
18. Duffy P., Wolf J., Collins G. et al. // New Engl. J. Med. 1974. Vol. 290. P. 692–693.
19. Bradley R. Prion Diseases; td. J. Collinge and M.S. Palmer. Oxford Univ. Press. 1997. P. 89–129.
20. Williams E.S., Young S. J. // Wildi Dis. 1980. Vol. 16. P. 89–98.
21. Gajdusek D.C. Virology; ed. B.N. Fiedds. New York,1985. P. 1519–1557.
22. Gajdusek D.C. Subviral Parthogenesis of Plants and Animals: Viroid and Prions. New York, 1985. P. 483–544.
23. Prusiner S.B., McKinley M.P., Groth D.F. et al. // Proc. Natl. Acad. Sci. 1981. Vol. 78. P. 6675–6679.
24. Prusiner S.B. // Science. 1982. Vol. 216. P. 136–144.
25. Bolton D.C., McKinley M.P., Prusiner S.B. // Scvience. 1982. Vol. 218. P. 1309–1311.
26. McKinley M.P., Bolton D.C., Prusiner S.B. // Cell. 1983. Vol. 35. P. 57–62.
27. Imran M., Mahmood S.V. // Virol. Journal. 2011. Vol. 8. P. 559.
28. Tobler J., Gaus T., Deboer P. et al. // Nature. 1996. Vol. 380. P. 639–642.
29. Harris D.A., Falls D.L., Johnson F.A. et al. // Proc. Natl. Acad. Sci. 1991. Vol. 88. P. 7664–7668.
30. Lugaresi E., Medori P., Baruzzi A. et al. // New Engl. J. Med. 1986. Vol. 315. P. 997–1003.
31. Boldin E., Capellari C., Provini F. et al. // J. Neurol. 2009. Vol. 256. P. 778–779.
32. –Ч—Г–µ–≤ –Т.–Р., –Ч–∞–≤–∞–ї–Є—И–Є–љ –Ш.–Р., –†–Њ–є—Е–µ–ї—М –Т.–Ь. –Я—А–Є–Њ–љ–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –ґ–Є–≤–Њ—В–љ—Л—Е. –Ь.: –Ь–µ–і–Є—Ж–Є–љ–∞, 1999. C. 136–142.
33. Bradley R. Prion Diseases; eds. J. Collinge, M.S. Palmer. Oxford, 1997. P. 89–129.
34. –Я–Њ–Ї—А–Њ–≤—Б–Ї–Є–є –Т.–Ш., –Ъ–Є—Б–µ–ї–µ–≤, –І–µ—А–Ї–∞—Б—Б–Ї–Є–є –С.–Ы. –Я—А–Є–Њ–љ—Л –Є –њ—А–Є–Њ–љ–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є. –Ь.: –Ш–Ј–і-–≤–Њ –†–Р–Ь–Э, 2004. C. 45–55.
35. Colby D.W., Prusiner S.B. Prions. // Cold Spering Harb. Perspect. Biol. 20011. Vol. 3. P. 1–22.
36. Chazot G., Brousolle E., Lapras C.I. et al. // Lancet. 1996. Vol. 347. P. 1181.
37. Collinge J., Palmer M. Prion Diseases; eds. J. Collinge, M. Palmer. Oxford, 1997. P. 18–55.
38. Parchi P., Saverioni D. // Folia Neuropathol. 2012. Vol. 50(1). P. 20–45.
39. –У—А–Є–≥–Њ—А—М–µ–≤ –Т.–С., –Я–Њ–Ї–Є–і—Л—И–µ–≤ –Р.–Э., –Ъ–∞–ї—М–Ї–Њ–≤ –°.–Ы. –Є –і—А. // –Т–Њ–њ—А. –≤–Є—А—Г—Б–Њ–ї. 2009. T. 5. P. 4–9.
40. –Ґ—А—Г–±–∞—З–µ–≤–∞ –Х.–°. –Ь–∞—В–µ—А–Є–∞–ї—Л 2-–є –Ь–µ–ґ—А–µ–≥–Є–Њ–љ–∞–ї—М–љ–Њ–є –љ–∞—Г—З–љ–Њ-–њ—А–∞–Ї—В–Є—З. –Ї–Њ–љ—Д. «–Ґ–Њ–ї—М—П—В—В–Є–љ—Б–Ї–∞—П –Њ—Б–µ–љ—М». –Ґ–Њ–ї—М—П—В—В–Є, 2009. C. 296–299.
41. Brown H. // Antiviral. Chem. Chemother. 1990. Vol. 1. P. 75–83.
42. Gambetti P., Cali I., Notari S. et al. // Acta Neuropathol. 2011. Vol. 121 (1). P. 79–90.
43. Safar J.G. // Prion. 2012. Vol. 6(2). P. 108–115.
44. –Ч—Г–µ–≤ –Т.–Р., –Ш–≥–љ–∞—В–Њ–≤–∞ –Э.–У., –Р–≤—В–∞–љ–і–Є–ї–Њ–≤ –У.–У. // –£—Б–њ–µ—Е–Є –≥–µ—А–Њ–љ—В–Њ–ї. 2005. T. 17. C. 108–116.
45. Villeda S., Luo J., Mosher K. et al.// Natura. 2011. Vol. 477. P. 90–96.
46. Carp R.A. Int. Virol. 2nd int. // Congr. Virol. Budapesht. 1971. Karger. Basel. 1972. P. 210.
47. Haralambiev H., Ivanov I., Vesselinova A. // Zbl. Vet. 1973. Vol. 201. P. 201–209.
48. –†–Њ–є—Е–µ–ї—М –Т.–Ь., –§–Њ–Ї–Є–љ–∞ –У. –Ш., –Ъ–Њ–љ–і–∞–Ї–Њ–≤–∞ –Ы.–Ш. // –Т–Њ–њ—А. –≤–Є—А—Г—Б–Њ–ї. 1997. вДЦ 5. C. 203–205.
49. Gambetti P., Dong Z., Yuan J. et al. // Annal. Neurol. 2008. Vol. 63. P. 697–708.
50. Zou W.Q., Puoti G., Xiao X. et al. // Annal. Neurol. 2010. Vol. 68. P. 162–172.
51. Bendheim P.E., Barry R.A., DeArmond S.J. et al. Antibodies to a scrapie prion protein // Nature. 1984. Vol. 310(5976). P. 418–421.
52. –†–Њ–є—Е–µ–ї—М –Т.–Ь. –Ь–µ–і–ї–µ–љ–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –ґ–Є–≤–Њ—В–љ—Л—Е, –≤—Л–Ј–≤–∞–љ–љ—Л–µ –њ—А–Є–Њ–љ–∞–Љ–Є // –Я—А–Є—А–Њ–і–∞. 2002. вДЦ 2.












