–ü—Ä–ĺ–Ī–Ľ–Ķ–ľ–į –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ–ĺ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł –ĺ—Ā—ā–į–Ķ—ā—Ā—Ź –ĺ–ī–Ĺ–ĺ–Ļ –ł–∑ –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ —Ā–Ľ–ĺ–∂–Ĺ—č—Ö –∑–į–ī–į—á –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ĺ–Ķ–≤—Ä–ĺ–Ľ–ĺ–≥–ł–ł. –≠—ā–ĺ –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–ĺ —ą–ł—Ä–ĺ–ļ–ĺ–Ļ —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć—é –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź, –≤—č—Ā–ĺ–ļ–ĺ–Ļ —á–į—Ā—ā–ĺ—ā–ĺ–Ļ –ł–Ĺ–≤–į–Ľ–ł–ī–ł–∑–į—Ü–ł–ł –ł —Ā–ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –ī–Ķ–∑–į–ī–į–Ņ—ā–į—Ü–ł–Ķ–Ļ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–Ķ–Ļ. –ó–į–Ī–ĺ–Ľ–Ķ–≤–į–Ķ–ľ–ĺ—Ā—ā—Ć —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–Ķ–Ļ —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ—ā –≤ —Ā—Ä–Ķ–ī–Ĺ–Ķ–ľ 30–50 —á–Ķ–Ľ–ĺ–≤–Ķ–ļ –Ĺ–į 100 —ā—č—Ā. –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź, –≤ –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–Ķ —Ā–Ľ—É—á–į–Ķ–≤ –Ņ—Ä–ł—Ö–ĺ–ī–ł—ā—Ā—Ź –Ĺ–į –≤–ĺ–∑—Ä–į—Ā—ā –ĺ—ā 20 –ī–ĺ 30 –Ľ–Ķ—ā –ł –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ –ł–Ĺ–≤–į–Ľ–ł–ī–ł–∑–į—Ü–ł–ł –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ —ā—Ä—É–ī–ĺ—Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ–Ļ —á–į—Ā—ā–ł –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź [–ď—Ä–ĺ–ľ–ĺ–≤ –°. –ź., 2004].
–í –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–Ķ –≤—Ä–Ķ–ľ—Ź –Ĺ–į–ļ–ĺ–Ņ–Ľ–Ķ–Ĺ –Ī–ĺ–Ľ—Ć—ą–ĺ–Ļ –ĺ–Ņ—č—ā –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ–ĺ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł. –ö–ĺ—Ä—Ä–Ķ–ļ—ā–Ĺ–ĺ–Ķ –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ķ —Ā–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č—Ö –į–Ĺ—ā–ł—ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ (–ź–≠–ü) –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –ī–ĺ—Ā—ā–ł—á—Ć –≤—č—Ā–ĺ–ļ–ł—Ö —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–ĺ–≤. –ě–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ—č –Ī–į–∑–ĺ–≤—č–Ķ, –į —ā–į–ļ–∂–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č –Ņ–Ķ—Ä–≤–ĺ–≥–ĺ –ł –≤—ā–ĺ—Ä–ĺ–≥–ĺ —Ä—Ź–ī–į –≤—č–Ī–ĺ—Ä–į —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā —Ä–į–∑–Ľ–ł—á–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł. –†–į–∑—Ä–į–Ī–ĺ—ā–į–Ĺ—č –Ņ–ĺ–ī—Ö–ĺ–ī—č –į–ī–Ķ–ļ–≤–į—ā–Ĺ–ĺ–≥–ĺ –ī–ĺ–∑–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –ź–≠–ü –ł —Ā—ā—Ä–į—ā–Ķ–≥–ł—Ź –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł—Ź —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ľ–ĺ–Ĺ–ł—ā–ĺ—Ä–ł–Ĺ–≥–į. –Ę–Ķ–ľ –Ĺ–Ķ –ľ–Ķ–Ĺ–Ķ–Ķ, –Ĺ–Ķ—Ā–ľ–ĺ—ā—Ä—Ź –Ĺ–į –ł–Ĺ—ā–Ķ–Ĺ—Ā–ł–≤–Ĺ–ĺ–Ķ —Ä–į–∑–≤–ł—ā–ł–Ķ –Ĺ–Ķ–Ļ—Ä–ĺ—Ą–į—Ä–ľ–į–ļ–ĺ–Ľ–ĺ–≥–ł–ł, —Ā–ł–Ĺ—ā–Ķ–∑ –Ĺ–ĺ–≤—č—Ö –≤—č—Ā–ĺ–ļ–ĺ—ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ—č—Ö –į–Ĺ—ā–ł—ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –ł –Ĺ–į–ļ–ĺ–Ņ–Ľ–Ķ–Ĺ–Ĺ—č–Ļ –ĺ–Ņ—č—ā –ł—Ö –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź, —Ā–ĺ—Ö—Ä–į–Ĺ—Ź–Ķ—ā—Ā—Ź –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ –≤—č—Ā–ĺ–ļ–ł–Ļ –Ņ—Ä–ĺ—Ü–Ķ–Ĺ—ā —Ą–į—Ä–ľ–į–ļ–ĺ—Ä–Ķ–∑–ł—Ā—ā–Ķ–Ĺ—ā–Ĺ—č—Ö —Ą–ĺ—Ä–ľ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź, —ā—Ä–Ķ–Ī—É—é—Č–ł—Ö –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź —ā–Ķ—Ä–į–Ņ–ł–ł –ī–≤—É–ľ—Ź, –į –≤ –ĺ—ā–ī–Ķ–Ľ—Ć–Ĺ—č—Ö —Ā–Ľ—É—á–į—Ź—Ö –ł —ā—Ä–Ķ–ľ—Ź –į–Ĺ—ā–ł—ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł–ľ–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł.
–Ě–Ķ—Ā–ĺ–ľ–Ĺ–Ķ–Ĺ–Ĺ–ĺ, —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–ĺ–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –ī–≤—É—Ö –ź–≠–ü, –Ņ–ĺ–ľ–ł–ľ–ĺ –ĺ–∂–ł–ī–į–Ķ–ľ–ĺ–≥–ĺ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —ć—Ą—Ą–Ķ–ļ—ā–į, –Ĺ–Ķ—Ā–Ķ—ā –∑–į —Ā–ĺ–Ī–ĺ–Ļ –Ī–ĺ–Ľ–Ķ–Ķ –≤—č—Ā–ĺ–ļ–ł–Ļ —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤. –Ě–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ —É—á–ł—ā—č–≤–į—ā—Ć, —á—ā–ĺ –≤—č–Ī—Ä–į–Ĺ–Ĺ–į—Ź –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł—Ź –Ī—É–ī–Ķ—ā –ĺ—Ā—É—Č–Ķ—Ā—ā–≤–Ľ—Ź—ā—Ć—Ā—Ź –Ĺ–į –Ņ—Ä–ĺ—ā—Ź–∂–Ķ–Ĺ–ł–ł –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ł—Ö –Ľ–Ķ—ā –ł –ī–ĺ–Ľ–∂–Ĺ–į –Ī—č—ā—Ć —ā—Č–į—ā–Ķ–Ľ—Ć–Ĺ–ĺ –≤–∑–≤–Ķ—ą–Ķ–Ĺ–į —Ā –Ņ–ĺ–∑–ł—Ü–ł–ł –≤–ĺ–∑–Ĺ–ł–ļ–Ĺ–ĺ–≤–Ķ–Ĺ–ł—Ź –Ĺ–Ķ–∂–Ķ–Ľ–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö —Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ. –ü–ĺ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–į–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź Pellock J. M. —Ā —Ā–ĺ–į–≤—ā. (1991), —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź –Ņ–Ķ—á–Ķ–Ĺ–ĺ—á–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł —É–≤–Ķ–Ľ–ł—á–ł–≤–į–Ķ—ā—Ā—Ź –≤ 5 —Ā –Ņ–ĺ–Ľ–ĺ–≤–ł–Ĺ–ĺ–Ļ —Ä–į–∑ —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö, –Ņ–ĺ–Ľ—É—á–į—é—Č–ł—Ö –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł—é, –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —á–į—Č–Ķ –≤—Ā—ā—Ä–Ķ—á–į—é—ā—Ā—Ź –≤ –Ľ–ł—ā–Ķ—Ä–į—ā—É—Ä–Ķ –ĺ–Ņ–ł—Ā–į–Ĺ–ł—Ź —ā—Ź–∂–Ķ–Ľ—č—Ö –≥–Ķ–ľ–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –ĺ—Ā–Ľ–ĺ–∂–Ĺ–Ķ–Ĺ–ł–Ļ, –≤ —á–į—Ā—ā–Ĺ–ĺ—Ā—ā–ł, —ā—Ä–ĺ–ľ–Ī–ĺ—Ü–ł—ā–ĺ–Ņ–Ķ–Ĺ–ł–ł –Ņ—Ä–ł —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–ĺ–ľ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –ł –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–į [Finsterer J., Pelzl G., Hess B., 2001].
–ü–ĺ–ľ–ł–ľ–ĺ —Ą–į—Ä–ľ–į–ļ–ĺ–ī–ł–Ĺ–į–ľ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł—Ź –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤, –ĺ—Ā—É—Č–Ķ—Ā—ā–≤–Ľ—Ź–Ķ–ľ–ĺ–≥–ĺ –Ĺ–į —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–Ĺ–ĺ–ľ —É—Ä–ĺ–≤–Ĺ–Ķ –ł –ļ–ĺ—Ā–≤–Ķ–Ĺ–Ĺ–ĺ –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ķ–ľ–ĺ–≥–ĺ –Ĺ–į–ľ–ł –Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ–į—Ä—ā–ł–Ĺ—č —ā–Ķ—á–Ķ–Ĺ–ł—Ź –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź (–ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź —Ö–į—Ä–į–ļ—ā–Ķ—Ä–į –ł —á–į—Ā—ā–ĺ—ā—č —ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤, –Ņ–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤) –ł –ī–į–Ĺ–Ĺ—č—Ö –Ĺ–Ķ–Ļ—Ä–ĺ—Ą–ł–∑–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –ľ–Ķ—ā–ĺ–ī–ĺ–≤ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź (—ć–Ľ–Ķ–ļ—ā—Ä–ĺ—ć–Ĺ—Ü–Ķ—Ą–į–Ľ–ĺ–≥—Ä–į—Ą–ł–ł), –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ —É—á–ł—ā—č–≤–į—ā—Ć –ł –Ĺ–į–Ľ–ł—á–ł–Ķ —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł—Ź. –ü–ĺ—Ā–Ľ–Ķ–ī–Ĺ–Ķ–Ķ –ľ–ĺ–∂–Ķ—ā –ĺ—Ā—É—Č–Ķ—Ā—ā–≤–Ľ—Ź—ā—Ć—Ā—Ź –Ĺ–į –≤—Ā–Ķ—Ö —ć—ā–į–Ņ–į—Ö —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į: –į–Ī—Ā–ĺ—Ä–Ī—Ü–ł–ł, —Ä–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź, –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ–į –ł —ć–Ľ–ł–ľ–ł–Ĺ–į—Ü–ł–ł –ļ—Ā–Ķ–Ĺ–ĺ–Ī–ł–ĺ—ā–ł–ļ–ĺ–≤ –ł–∑ –ĺ—Ä–≥–į–Ĺ–ł–∑–ľ–į. –ě—Ā–Ĺ–ĺ–≤–Ĺ—č–ľ–ł –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ–į–ľ–ł –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł—Ź –ļ—Ā–Ķ–Ĺ–ĺ–Ī–ł–ĺ—ā–ł–ļ–ĺ–≤ —Ź–≤–Ľ—Ź—é—ā—Ā—Ź: –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź —Ā–ļ–ĺ—Ä–ĺ—Ā—ā–ł –į–Ī—Ā–ĺ—Ä–Ī—Ü–ł–ł –ł –Ī–ł–ĺ–ī–ĺ—Ā—ā—É–Ņ–Ĺ–ĺ—Ā—ā–ł, –ļ–ĺ–Ĺ–ļ—É—Ä–Ķ–Ĺ—ā–Ĺ–ĺ–Ķ —Ā–≤—Ź–∑—č–≤–į–Ĺ–ł–Ķ —Ā –Ī–Ķ–Ľ–ļ–į–ľ–ł –Ņ–Ľ–į–∑–ľ—č –ļ—Ä–ĺ–≤–ł, —É—Ā–ļ–ĺ—Ä–Ķ–Ĺ–ł–Ķ –ł–Ľ–ł —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ —Ā–ļ–ĺ—Ä–ĺ—Ā—ā–ł –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ–į, –ĺ–Ņ–ĺ—Ā—Ä–Ķ–ī–ĺ–≤–į–Ĺ–Ĺ–ĺ–Ķ —á–Ķ—Ä–Ķ–∑ —Ā–ł—Ā—ā–Ķ–ľ—É —Ü–ł—ā–ĺ—Ö—Ä–ĺ–ľ–į –†450 –ł –ī—Ä. –°–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ–ľ –ī–į–Ĺ–Ĺ—č—Ö –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł–Ļ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ķ –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł–ł –ļ—Ā–Ķ–Ĺ–ĺ–Ī–ł–ĺ—ā–ł–ļ–į –≤ —Ā—č–≤–ĺ—Ä–ĺ—ā–ļ–Ķ –ļ—Ä–ĺ–≤–ł –ł –ĺ—Ä–≥–į–Ĺ–Ķ––ľ–ł—ą–Ķ–Ĺ–ł, —á—ā–ĺ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł –ľ–ĺ–∂–Ķ—ā –Ī—č—ā—Ć –∑–Ĺ–į—á–ł–ľ—č–ľ –ł –Ņ—Ä–ł–≤–ĺ–ī–ł—ā—Ć –ļ–į–ļ –ļ —Ä–į–∑–≤–ł—ā–ł—é –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤, —ā–į–ļ –ł –ļ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—é —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –Ņ—Ä–ĺ–≤–ĺ–ī–ł–ľ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł. –Ě–į–Ľ–ł—á–ł–Ķ —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł—Ź –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ķ—ā –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ—Ā—ā—Ć –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł—Ź —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ľ–ĺ–Ĺ–ł—ā–ĺ—Ä–ł–Ĺ–≥–į –ł –ļ–ĺ—Ä—Ä–Ķ–ļ—Ü–ł–ł –ī–ĺ–∑—č –ź–≠–ü.
–Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –Ņ–Ķ—Ä–Ķ–ī –Ĺ–į–ľ–ł —Ā—ā–ĺ–ł—ā –∑–į–ī–į—á–į –Ņ–ĺ–ł—Ā–ļ–į —Ā—Ö–Ķ–ľ —Ä–į—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł–ł, –ĺ—ā–≤–Ķ—á–į—é—Č–ł—Ö –ī–≤—É–ľ –≥–Ľ–į–≤–Ĺ—č–ľ —É—Ā–Ľ–ĺ–≤–ł—Ź–ľ: –≤–ĺ––Ņ–Ķ—Ä–≤—č—Ö, –Ņ–ĺ–Ľ–ĺ–∂–ł—ā–Ķ–Ľ—Ć–Ĺ—č–ľ —Ą–į—Ä–ľ–į–ļ–ĺ–ī–ł–Ĺ–į–ľ–ł—á–Ķ—Ā–ļ–ł–ľ –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ–ľ, —ā–ĺ –Ķ—Ā—ā—Ć –Ņ–ĺ—ā–Ķ–Ĺ—Ü–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ–ľ –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź –ī—Ä—É–≥ –ī—Ä—É–≥–į (—Ā–ł–Ĺ–Ķ—Ä–≥–ł–∑–ľ) –Ņ—Ä–ł –Ĺ–ł–∑–ļ–ĺ–ľ —Ä–ł—Ā–ļ–Ķ —Ä–į–∑–≤–ł—ā–ł—Ź –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤; –≤–ĺ––≤—ā–ĺ—Ä—č—Ö, –ľ–ł–Ĺ–ł–ľ–į–Ľ—Ć–Ĺ—č–ľ –ł–Ľ–ł —Ö–ĺ—Ä–ĺ—ą–ĺ –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–ł—Ä—É–Ķ–ľ—č–ľ —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł–ľ –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ–ľ –Ĺ–į —ć—ā–į–Ņ–į—Ö –į–Ī—Ā–ĺ—Ä–Ī—Ü–ł–ł, —Ä–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź, —ć–Ľ–ł–ľ–ł–Ĺ–į—Ü–ł–ł –ļ—Ā–Ķ–ĺ–Ĺ–ĺ–Ī–ł–ĺ—ā–ł–ļ–ĺ–≤ –ł–∑ –ĺ—Ä–≥–į–Ĺ–ł–∑–ľ–į.
–ú–į—ā–Ķ—Ä–ł–į–Ľ—č –ł –ľ–Ķ—ā–ĺ–ī—č
–í —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–ł–ł —Ā –Ņ–ĺ—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ—č–ľ–ł —Ü–Ķ–Ľ—Ź–ľ–ł –ł –∑–į–ī–į—á–į–ľ–ł –≤ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –≤–ĺ—ą–Ľ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č —Ā –Ľ–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ—č–ľ–ł –ł –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł, –ľ–ĺ–Ĺ–ĺ—ā–Ķ—Ä–į–Ņ–ł—Ź —É –ļ–ĺ—ā–ĺ—Ä—č—Ö –Ī–į–∑–ĺ–≤—č–ľ–ł –į–Ĺ—ā–ł—ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł–ľ–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł (–Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č (–í–ö), –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–ĺ–ľ (–ö)) —Ā –į–ī–Ķ–ļ–≤–į—ā–Ĺ–ĺ –Ņ–ĺ–ī–ĺ–Ī—Ä–į–Ĺ–Ĺ—č–ľ–ł —Ā—É—ā–ĺ—á–Ĺ—č–ľ–ł –ī–ĺ–∑–į–ľ–ł –Ĺ–Ķ –Ņ–ĺ–∑–≤–ĺ–Ľ–ł–Ľ–į –ī–ĺ—Ā—ā–ł—á—Ć —É—Ä–Ķ–∂–Ķ–Ĺ–ł—Ź –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤ –Ī–ĺ–Ľ–Ķ–Ķ —á–Ķ–ľ –Ĺ–į 50% –Ņ—Ä–ł –Ĺ–į–Ľ–ł—á–ł–ł –ł—Ö –ł—Ā—Ö–ĺ–ī–Ĺ–ĺ –≤—č—Ā–ĺ–ļ–ĺ–Ļ —á–į—Ā—ā–ĺ—ā—č (1 —Ä–į–∑ –≤ –ľ–Ķ—Ā—Ź—Ü –ł –≤—č—ą–Ķ).
–ü–ĺ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–į–ľ –ļ–Ľ–ł–Ĺ–ł–ļ–ĺ––ł–Ĺ—Ā—ā—Ä—É–ľ–Ķ–Ĺ—ā–į–Ľ—Ć–Ĺ—č—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ –≤ –≥—Ä—É–Ņ–Ņ–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –Ľ–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –≤ –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ –≤—č—Ā–ĺ–ļ–ĺ–ľ –Ņ—Ä–ĺ—Ü–Ķ–Ĺ—ā–Ķ —Ā–Ľ—É—á–į–Ķ–≤ –Ī—č–Ľ–į —É—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–į –Ľ–ĺ–Ī–Ĺ–į—Ź (n=17; 31,5%) —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł—Ź, —á—ā–ĺ –ļ–ĺ—Ā–≤–Ķ–Ĺ–Ĺ–ĺ –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–į–Ķ—ā —ā—Ź–∂–Ķ–Ľ—č–Ļ —Ö–į—Ä–į–ļ—ā–Ķ—Ä –Ķ–Ķ —ā–Ķ—á–Ķ–Ĺ–ł—Ź. –í–ł—Ā–ĺ—á–Ĺ–į—Ź, —ā–Ķ–ľ–Ķ–Ĺ–Ĺ–į—Ź –ł –∑–į—ā—č–Ľ–ĺ—á–Ĺ–į—Ź —Ą–ĺ—Ä–ľ—č –Ī—č–Ľ–ł –≤—č—Ź–≤–Ľ–Ķ–Ĺ—č –≤ 29 (53,7%), 5 (9,3%) –ł 3 (5,6%) —Ā–Ľ—É—á–į—Ź—Ö —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ. –í –≥—Ä—É–Ņ–Ņ–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł –Ņ—Ä–Ķ–≤–į–Ľ–ł—Ä–ĺ–≤–į–Ľ–į —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł—Ź —Ā –ł–∑–ĺ–Ľ–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł —ā–ĺ–Ĺ–ł–ļ–ĺ––ļ–Ľ–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ–ł –Ņ—Ä–ł–Ņ–į–ī–ļ–į–ľ–ł (–ď–Ę–ö–ü) (n=9; 56,3%), –≤ —ā–ĺ –≤—Ä–Ķ–ľ—Ź –ļ–į–ļ —é–Ĺ–ĺ—ą–Ķ—Ā–ļ–į—Ź –ľ–ł–ĺ–ļ–Ľ–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–į—Ź –ł —é–Ĺ–ĺ—ą–Ķ—Ā–ļ–į—Ź –į–Ī—Ā–į–Ĺ—Ā–Ĺ–į—Ź —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł –Ī—č–Ľ–ł —É—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ—č –≤ 6 (37,5%) –ł 2 (12,5%) —Ā–Ľ—É—á–į—Ź—Ö —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ.
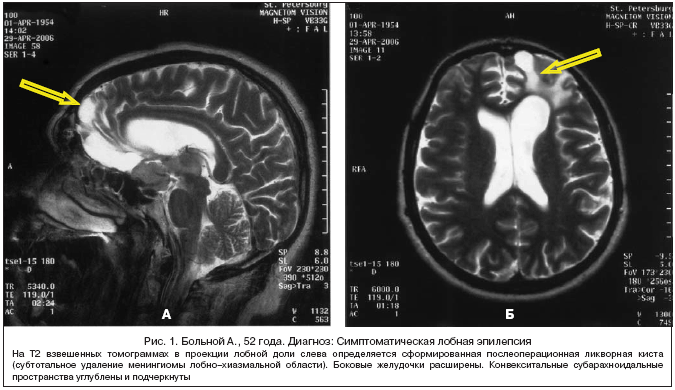
–Ē–Ľ—Ź –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –ĺ–Ī–Ķ–ł—Ö –≥—Ä—É–Ņ–Ņ –Ī—č–Ľ–ĺ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ–ĺ –Ĺ–į–Ľ–ł—á–ł–Ķ —Ä—Ź–ī–į –ĺ–Ī—Č–ł—Ö –Ņ—Ä–ł–∑–Ĺ–į–ļ–ĺ–≤, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –≤—č—Ā—ā—É–Ņ–į–Ľ–ł —Ą–į–ļ—ā–ĺ—Ä–į–ľ–ł —ā—Ä—É–ī–Ĺ–ĺ–ļ—É—Ä–į–Ī–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź: –≤—č—Ā–ĺ–ļ–į—Ź –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź (9,2±4,4 –ł 6,1±4,5 –Ľ–Ķ—ā –≤ –Ņ–Ķ—Ä–≤–ĺ–Ļ –ł –≤—ā–ĺ—Ä–ĺ–Ļ –≥—Ä—É–Ņ–Ņ–į—Ö —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ), –≤—č—Ā–ĺ–ļ–į—Ź —á–į—Ā—ā–ĺ—ā–į –ł –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–ł–∑–ľ —ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤, –≥—Ä—É–Ī–ĺ–Ķ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ –Ī–ł–ĺ—ć–Ľ–Ķ–ļ—ā—Ä–ł—á–Ķ—Ā–ļ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į (–Ď–ź–ď–ú) –ł —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –∑–Ķ—Ä–ļ–į–Ľ—Ć–Ĺ—č—Ö –ĺ—á–į–≥–ĺ–≤ –Ņ–ĺ –ī–į–Ĺ–Ĺ—č–ľ —ć–Ľ–Ķ–ļ—ā—Ä–ĺ—ć–Ĺ—Ü–Ķ—Ą–į–Ľ–ĺ–≥—Ä–į—Ą–ł–ł, —Ā—ā—Ä—É–ļ—ā—É—Ä–Ĺ—č–Ķ –Ņ–ĺ—Ä–į–∂–Ķ–Ĺ–ł—Ź –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ–≥–ĺ –ľ–ĺ–∑–≥–į –Ņ–ĺ –ī–į–Ĺ–Ĺ—č–ľ–ł –ú–†–Ę —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –Ľ–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł (–õ–ě–§–≠) (—Ä–ł—Ā. 1).
–ü–ĺ–ī–į–≤–Ľ—Ź—é—Č–Ķ–ľ—É –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤—É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ī–ĺ –≤–ļ–Ľ—é—á–Ķ–Ĺ–ł—Ź –≤ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ĺ—Ā—Ć –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ –Ĺ–Ķ–ļ–ĺ—Ä—Ä–Ķ–ļ—ā–Ĺ–ĺ–Ķ –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ: –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –ź–≠–ü –≤ –Ĺ–Ķ–į–ī–Ķ–ļ–≤–į—ā–Ĺ–ĺ –Ĺ–ł–∑–ļ–ł—Ö –ī–ĺ–∑–į—Ö (n=38; 54,3%), –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł—Ź –ź–≠–ü –Ī–Ķ–∑ —É—á–Ķ—ā–į —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł—Ź –ź–≠–ü, –Ĺ–Ķ –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–ł–≤–į—é—Č–į—Ź –ł—Ö –į–ī–Ķ–ļ–≤–į—ā–Ĺ–ĺ–≥–ĺ —É—Ä–ĺ–≤–Ĺ—Ź –≤ –ļ—Ä–ĺ–≤–ł (n=19; 27,1%), –Ĺ–Ķ–ļ–ĺ—Ä—Ä–Ķ–ļ—ā–Ĺ—č–Ļ –≤—č–Ī–ĺ—Ä –≥—Ä—É–Ņ–Ņ—č –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į (n=8; 11,4%). –Ē–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ —á–į—Ā—ā–ĺ –Ī–ĺ–Ľ—Ć–Ĺ—č–ľ–ł —Ā–į–ľ–ĺ—Ā—ā–ĺ—Ź—ā–Ķ–Ľ—Ć–Ĺ–ĺ –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–į—Ā—Ć –ĺ—ā–ľ–Ķ–Ĺ–į –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź, –ĺ—Ā—É—Č–Ķ—Ā—ā–≤–Ľ—Ź–Ľ—Ā—Ź –Ĺ–Ķ—Ä–Ķ–≥—É–Ľ—Ź—Ä–Ĺ—č–Ļ –Ņ—Ä–ł–Ķ–ľ –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤, –Ĺ–Ķ—Ā–ľ–ĺ—ā—Ä—Ź –Ĺ–į —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł–ł –≤—Ä–į—á–Ķ–Ļ–—Ā–Ņ–Ķ—Ü–ł–į–Ľ–ł—Ā—ā–ĺ–≤, –Ņ–ĺ–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –ī–ĺ–∑—č, —á—ā–ĺ –Ī—č–Ľ–ĺ —Ā–≤—Ź–∑–į–Ĺ–ĺ –ļ–į–ļ —Ā–ĺ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ–ľ –ļ—Ä–ł—ā–ł–ļ–ł –ļ —Ā–≤–ĺ–Ķ–ľ—É —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł—é, —Ą–ĺ—Ä–ľ–ł—Ä—É—é—Č–ł–ľ–ł—Ā—Ź –ļ–ĺ–≥–Ĺ–ł—ā–ł–≤–Ĺ—č–ľ–ł —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤–į–ľ–ł, —ā–į–ļ –ł –≤ –ĺ—ā–ī–Ķ–Ľ—Ć–Ĺ—č—Ö —Ā–Ľ—É—á–į—Ź—Ö —Ā –ľ–į—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ—č–ľ –Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–ł–Ķ–ľ. –Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–į—Ź –Ĺ–Ķ–į–ī–Ķ–ļ–≤–į—ā–Ĺ–į—Ź —ā–Ķ—Ä–į–Ņ–ł—Ź —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –ĺ–ī–Ĺ–ł–ľ –ł–∑ –≥–Ľ–į–≤–Ĺ—č—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –Ņ—Ä—Ź–ľ–ĺ–Ļ –ł –Ņ–Ķ—Ä–Ķ–ļ—Ä–Ķ—Ā—ā–Ĺ–ĺ–Ļ —ā–ĺ–Ľ–Ķ—Ä–į–Ĺ—ā–Ĺ–ĺ—Ā—ā–ł –ľ–Ķ–ľ–Ī—Ä–į–Ĺ–Ĺ—č—Ö —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–ĺ–≤ –Ĺ–Ķ–Ļ—Ä–ĺ–Ĺ–ĺ–≤ –ļ –į–Ĺ—ā–ł—ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł–ľ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ [–ó–Ķ–Ĺ–ļ–ĺ–≤ –õ.–†., 2003].
–° —Ü–Ķ–Ľ—Ć—é –ł–∑—É—á–Ķ–Ĺ–ł—Ź —Ą–į—Ä–ľ–į–ļ–ĺ–ī–ł–Ĺ–į–ľ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł—Ź –Ĺ–į–ľ–ł –Ņ—Ä–ĺ–į–Ĺ–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ–į —á–į—Ā—ā–ĺ—ā–į –ł —Ö–į—Ä–į–ļ—ā–Ķ—Ä —ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤, —Ö–į—Ä–į–ļ—ā–Ķ—Ä –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤, –ī–ł–Ĺ–į–ľ–ł–ļ–į —ć–Ľ–Ķ–ļ—ā—Ä–ĺ—ć–Ĺ—Ü–Ķ—Ą–į–Ľ–ĺ–≥—Ä–į—Ą–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā —ā—Ä—É–ī–Ĺ–ĺ–ļ—É—Ä–į–Ī–Ķ–Ľ—Ć–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł, –Ņ–ĺ–Ľ—É—á–į—é—Č–ł—Ö —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö —Ā—Ö–Ķ–ľ—č –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł–ł –į–Ĺ—ā–ł—ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł–ľ–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł.
–° —Ü–Ķ–Ľ—Ć—é –ł–∑—É—á–Ķ–Ĺ–ł—Ź —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł—Ź —É –≤—Ā–Ķ—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ī—č–Ľ–ĺ –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ —É—Ä–ĺ–≤–Ĺ—Ź –Ī–į–∑–ĺ–≤—č—Ö –į–Ĺ—ā–ł—ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –ī–ĺ –ł –Ņ–ĺ—Ā–Ľ–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł–ł, –į –≤ —Ä—Ź–ī–Ķ —Ā–Ľ—É—á–į–Ķ–≤ – —Ä–į—Ā—á–Ķ—ā –Ņ–į—Ä–į–ľ–Ķ—ā—Ä–ĺ–≤ –į–Ī—Ā–ĺ—Ä–Ī—Ü–ł–ł, —Ä–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź, –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ–į –ł —ć–Ľ–ł–ľ–ł–Ĺ–į—Ü–ł–ł (–ź–†–ú–≠).
–†–Ķ–∑—É–Ľ—Ć—ā–į—ā—č
—Ā–ĺ–Ī—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ
–í–ĺ –≤—Ā–Ķ—Ö —Ā–Ľ—É—á–į—Ź—Ö –ī–ĺ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź –≤—ā–ĺ—Ä–ĺ–≥–ĺ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ĺ—Ā—Ć –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ –Ī–į–∑–ĺ–≤—č–ľ–ł –ź–≠–ü – –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –ł –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–ĺ–ľ. –ė—Ö —Ā—É—ā–ĺ—á–Ĺ–į—Ź –ī–ĺ–∑–į –ł–∑–Ĺ–į—á–į–Ľ—Ć–Ĺ–ĺ –ļ–ĺ—Ä—Ä–Ķ–ļ—ā–ł—Ä–ĺ–≤–į–Ľ–į—Ā—Ć –Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–ł —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–ĺ–≤ —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ľ–ĺ–Ĺ–ł—ā–ĺ—Ä–ł–Ĺ–≥–į (–Ę–õ–ú) –ł —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ľ–į –≤ —Ā—Ä–Ķ–ī–Ĺ–Ķ–ľ 1457,7±543,1 –ł 1183,3±364,1 –ľ–≥/–ī–Ĺ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ. –ö–ĺ–Ľ–Ķ–Ī–į–Ĺ–ł—Ź —É—Ä–ĺ–≤–Ĺ—Ź –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤ —Ā—č–≤–ĺ—Ä–ĺ—ā–ļ–Ķ –ļ—Ä–ĺ–≤–ł –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –ī–Ĺ—Ź –Ĺ–į—Ö–ĺ–ī–ł–Ľ–ł—Ā—Ć –≤ –Ņ—Ä–Ķ–ī–Ķ–Ľ–į—Ö —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ł–Ĺ—ā–Ķ—Ä–≤–į–Ľ–į, —Ä–į—Ā—Ā–ľ–į—ā—Ä–ł–≤–į–Ķ–ľ–ĺ–≥–ĺ –Ĺ–į–ľ–ł –≤ –ī–ł–į–Ņ–į–∑–ĺ–Ĺ–Ķ –ĺ—ā 6 –ī–ĺ 12 –ľ–ļ–≥/–ľ–Ľ –≤ —Ā–Ľ—É—á–į–Ķ –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–į –ł –ĺ—ā 50 –ī–ĺ 120 –ľ–ļ–≥/–ľ–Ľ – –≤–į–Ľ—Ć–Ņ—Ä–ĺ–į—ā–ĺ–≤ [Warner A., 1998].
–Ě–Ķ—Ā–ľ–ĺ—ā—Ä—Ź –Ĺ–į —ā–ĺ, —á—ā–ĺ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā—č —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ľ–Ķ–≤–Ķ—ā–ł—Ä–į—Ü–Ķ—ā–į–ľ–ĺ–ľ –ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č, –Ľ–Ķ–≤–Ķ—ā–ł—Ä–į—Ü–Ķ—ā–į–ľ–ĺ–ľ (–õ–í–Ę) –ł –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–ĺ–ľ –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ľ–ł—Ā—Ć –Ĺ–į –Ĺ–Ķ–Ī–ĺ–Ľ—Ć—ą–ĺ–Ļ –≥—Ä—É–Ņ–Ņ–Ķ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ (–≤ 9 –ł 5 —Ā–Ľ—É—á–į—Ź—Ö —Ā–ĺ–ĺ—ā–≤.), –Ī—č–Ľ –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ –≤—č—Ā–ĺ–ļ–ł–Ļ —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ł–Ļ —ć—Ą—Ą–Ķ–ļ—ā –≤–ĺ –≤—Ā–Ķ—Ö –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź—Ö. –≠—ā–ł —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź—é—ā —É—ā–≤–Ķ—Ä–∂–ī–į—ā—Ć –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ—É—é –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ—É—é —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –Ņ—Ä–Ķ–ī–Ľ–ĺ–∂–Ķ–Ĺ–Ĺ—č—Ö —Ā—Ö–Ķ–ľ –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł–ł. –ü—Ä–ł —ć—ā–ĺ–ľ —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —é–Ĺ–ĺ—ą–Ķ—Ā–ļ–ĺ–Ļ –ľ–ł–ĺ–ļ–Ľ–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–Ķ–Ļ —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–ĺ–Ķ –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ķ –õ–í–Ę –ł –í–ö –Ņ–ĺ–∑–≤–ĺ–Ľ–ł–Ľ–ĺ –ī–ĺ—Ā—ā–ł—á—Ć –ļ—É–Ņ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –ľ–ł–ĺ–ļ–Ľ–ĺ–Ĺ–ł–Ļ –≤–ĺ –≤—Ā–Ķ—Ö —Ā–Ľ—É—á–į—Ź—Ö (n=3). –£ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –Ņ–į—Ä—Ü–ł–į–Ľ—Ć–Ĺ—č–ľ–ł —ā–ł–Ņ–į–ľ–ł –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤ —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–ĺ–Ķ –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ķ –õ–í–Ę —Ā –ö, –õ–í–Ę —Ā –í–ö —ā–į–ļ–∂–Ķ –Ņ–ĺ–∑–≤–ĺ–Ľ–ł–Ľ–ĺ –ī–ĺ—Ā—ā–ł—á—Ć –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ –≤—č—Ā–ĺ–ļ–ł—Ö —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–ĺ–≤ –ł –Ņ—Ä–ł–≤–Ķ–Ľ–ĺ –ļ —É—Ä–Ķ–∂–Ķ–Ĺ–ł—é –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤ –Ī–ĺ–Ľ–Ķ–Ķ —á–Ķ–ľ –Ĺ–į 50% —É 7 –ł–∑ 9 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤. –°—Ä–Ķ–ī–ł –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤ –Ņ—Ä–Ķ–≤–į–Ľ–ł—Ä–ĺ–≤–į–Ľ–ł –ľ—Ź–≥–ļ–ł–Ķ –Ĺ–Ķ–Ļ—Ä–ĺ—ā–ĺ–ļ—Ā–ł—á–Ķ—Ā–ļ–ł–Ķ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź. –í —ā–ĺ –∂–Ķ –≤—Ä–Ķ–ľ—Ź —É –ĺ–ī–Ĺ–ĺ–≥–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –Ĺ–į–Ī–Ľ—é–ī–į–Ľ–į—Ā—Ć –į–≥–≥—Ä–į–≤–į—Ü–ł—Ź –Ņ—Ä–ĺ—Ā—ā—č—Ö –Ņ–į—Ä—Ü–ł–į–Ľ—Ć–Ĺ—č—Ö –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤ – –Ņ–ĺ–≤—ā–ĺ—Ä–Ĺ–ĺ–Ķ –≤–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ –ī–ł–į–∑–Ķ–Ņ–į–ľ–į –Ņ–ĺ–∑–≤–ĺ–Ľ–ł–Ľ–ĺ –Ņ—Ä–ĺ–ī–ĺ–Ľ–∂–ł—ā—Ć –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ –Ī–Ķ–∑ –ļ–ĺ—Ä—Ä–Ķ–ļ—Ü–ł–ł —Ā—Ö–Ķ–ľ—č –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł–ł.
–í –≥—Ä—É–Ņ–Ņ–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –Ľ–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ—č–ľ–ł –ł –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł –≤ 16 –ł 11 —Ā–Ľ—É—á–į—Ź—Ö —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –ļ –Ī–į–∑–ĺ–≤–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –Ī—č–Ľ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ (–õ). –ü–Ķ—Ä–Ķ—Ö–ĺ–ī –Ĺ–į –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł—é –Ņ—Ä–ł–≤–Ķ–Ľ –ļ –∑–Ĺ–į—á–ł–ľ–ĺ–ľ—É —É—Ä–Ķ–∂–Ķ–Ĺ–ł—é —ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤ –≤ –ĺ–Ī–Ķ–ł—Ö –≥—Ä—É–Ņ–Ņ–į—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤. –ü—Ä–ł —ć—ā–ĺ–ľ —É–ī–į–Ľ–ĺ—Ā—Ć –ī–ĺ—Ā—ā–ł—á—Ć —Ä–Ķ–ľ–ł—Ā—Ā–ł–ł –≤—Ā–Ķ—Ö —ā–ł–Ņ–ĺ–≤ —ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤ —É 2 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā —Ā–ł–ľ–Ņ—ā–ĺ–ľ–į—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ľ–ĺ–Ī–Ĺ–ĺ–Ļ –ł –≤–ł—Ā–ĺ—á–Ĺ–ĺ–Ļ —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–Ķ–Ļ, –į —ā–į–ļ–∂–Ķ —É 2 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –ł–ī–ł–ĺ–Ņ–į—ā–ł—á–Ķ—Ā–ļ–ł–ľ–ł –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł (—é–Ĺ–ĺ—ą–Ķ—Ā–ļ–į—Ź –ľ–ł–ĺ–ļ–Ľ–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–į—Ź, –ī–Ķ—ā—Ā–ļ–į—Ź –į–Ī—Ā–į–Ĺ—Ā–Ĺ–į—Ź —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł—Ź), —á—ā–ĺ —É–ļ–į–∑—č–≤–į–Ķ—ā –Ĺ–į —ą–ł—Ä–ĺ–ļ–ł–Ļ —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ł–Ļ —Ā–Ņ–Ķ–ļ—ā—Ä –≤—č–Ī—Ä–į–Ĺ–Ĺ–ĺ–Ļ —Ā—Ö–Ķ–ľ—č —ā–Ķ—Ä–į–Ņ–ł–ł [Ferrie C.D., Panayiotopoulos C.P., 1994, McCabe P.H., McNew C.D., Michel N.C., 2001]. –í 6 —Ā–Ľ—É—á–į—Ź—Ö —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –Ņ–į—Ä—Ü–ł–į–Ľ—Ć–Ĺ—č–ľ–ł –ł 6 – —Ā –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł —É–ī–į–Ľ–ĺ—Ā—Ć –ī–ĺ—Ā—ā–ł—á—Ć —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ —É—Ä–Ķ–∂–Ķ–Ĺ–ł—Ź –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤. –ü—Ä–ł —ć—ā–ĺ–ľ —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –Ľ–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł –≤ –Ņ–Ķ—Ä–≤—É—é –ĺ—á–Ķ—Ä–Ķ–ī—Ć —É–ī–į–≤–į–Ľ–ĺ—Ā—Ć –ī–ĺ—Ā—ā–ł—á—Ć –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –Ĺ–į–ī –≤—ā–ĺ—Ä–ł—á–Ĺ—č–ľ–ł –ď–Ę–ö–ü (–í–ď–Ę–ö–ü) –ł –Ņ—Ā–ł—Ö–ĺ–ľ–ĺ—ā–ĺ—Ä–Ĺ—č–ľ–ł –į–≤—ā–ĺ–ľ–į—ā–ł–∑–ľ–į–ľ–ł –Ņ—Ä–ł —Ā–ĺ—Ö—Ä–į–Ĺ—Ź—é—Č–ł—Ö—Ā—Ź –Ņ—Ä–ĺ—Ā—ā—č—Ö –Ņ–į—Ä—Ü–ł–į–Ľ—Ć–Ĺ—č—Ö –Ņ—Ä–ł–Ņ–į–ī–ļ–į—Ö, —á—ā–ĺ —Ā–≤–ł–ī–Ķ—ā–Ķ–Ľ—Ć—Ā—ā–≤—É–Ķ—ā –ĺ –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–ľ —Ā–ĺ—Ö—Ä–į–Ĺ–Ķ–Ĺ–ł–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ĺ–≥–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ĺ—á–į–≥–į [–ď—Ä–ĺ–ľ–ĺ–≤ –°. –ź., 2004]. –í—č–Ī—Ä–į–Ĺ–Ĺ–ĺ–Ķ —Ā–ĺ—á–Ķ—ā–į–Ĺ–ł–Ķ –≤ –≥—Ä—É–Ņ–Ņ–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł –Ņ–ĺ–ļ–į–∑–į–Ľ–ĺ –≤—č—Ā–ĺ–ļ—É—é —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –Ņ–ĺ –ĺ—ā–Ĺ–ĺ—ą–Ķ–Ĺ–ł—é –ļ–ĺ –≤—Ā–Ķ–ľ —ā–ł–Ņ–į–ľ —ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤: –į–Ī—Ā–į–Ĺ—Ā–į–ľ, –ľ–ł–ĺ–ļ–Ľ–ĺ–Ĺ–ł—Ź–ľ, –ď–Ę–ö–ü. –í —ā–ĺ –∂–Ķ –≤—Ä–Ķ–ľ—Ź –≤ –Ņ–ĺ–Ľ–ĺ–≤–ł–Ĺ–Ķ —Ā–Ľ—É—á–į–Ķ–≤ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —ć—Ą—Ą–Ķ–ļ—ā–į –ī–ĺ—Ā—ā–ł—á—Ć –Ĺ–Ķ —É–ī–į–Ľ–ĺ—Ā—Ć, —á—ā–ĺ, –Ņ–ĺ––≤–ł–ī–ł–ľ–ĺ–ľ—É, —Ā–≤—Ź–∑–į–Ĺ–ĺ —Ā –≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł–ľ–ł –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ź–ľ–ł –≤–ĺ–Ľ—Ć—ā–į–∂–∑–į–≤–ł—Ā–ł–ľ—č—Ö –ļ–į–Ĺ–į–Ľ–ĺ–≤ –ł –Ĺ–Ķ–Ļ—Ä–ĺ—ā—Ä–į–Ĺ—Ā–ľ–ł—ā—ā–Ķ—Ä–Ĺ—č—Ö —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–ĺ–≤, —Ą–ĺ—Ä–ľ–ł—Ä—É—é—Č–ł—Ö –į–Ī—Ā–ĺ–Ľ—é—ā–Ĺ—É—é —Ą–į—Ä–ľ–į–ļ–ĺ—Ä–Ķ–∑–ł—Ā—ā–Ķ–Ĺ—ā–Ĺ–ĺ—Ā—ā—Ć [Lucas P.T., Meadows L.S., Nicholls J., Ragsdale D.S., 2005, Ragozzino D., Palma E., Di Anelatonio S., et al., 2005]. –ü—Ä–ł –į–Ĺ–į–Ľ–ł–∑–Ķ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–į –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤ —ā–ł–Ņ–ł—á–Ĺ—č–ľ –Ī—č–Ľ–ĺ —Ä–į–∑–≤–ł—ā–ł–Ķ –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł—Ö —Ä–Ķ–į–ļ—Ü–ł–Ļ –≤ –≤–ł–ī–Ķ –ļ–ĺ–∂–Ĺ—č—Ö –≤—č—Ā—č–Ņ–į–Ĺ–ł–Ļ –Ņ–į–Ņ—É–Ľ–Ķ–∑–Ĺ–ĺ–≥–ĺ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–į –≤ 18,5% (n=5) —Ā–Ľ—É—á–į–Ķ–≤. –Ē–į–Ĺ–Ĺ—č–Ķ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź –≤–ĺ–∑–Ĺ–ł–ļ–į–Ľ–ł –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –Ņ–Ķ—Ä–≤–ĺ–≥–ĺ –ľ–Ķ—Ā—Ź—Ü–į —ā–Ķ—Ä–į–Ņ–ł–ł –ł —Ä–Ķ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ľ–ł –Ņ—Ä–ł —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–ł –ī–ĺ–∑—č –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–į. –í —ā–ĺ –∂–Ķ –≤—Ä–Ķ–ľ—Ź –≤ –ĺ–ī–Ĺ–ĺ–ľ —Ā–Ľ—É—á–į—Ź —Ä–į–∑–≤–ł–Ľ–į—Ā—Ć —ā—Ź–∂–Ķ–Ľ–į—Ź –ł–ľ–ľ—É–Ĺ–ĺ––į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–į—Ź —Ä–Ķ–į–ļ—Ü–ł—Ź –≤ –≤–ł–ī–Ķ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į –°—ā–ł–≤–Ķ–Ĺ—Ā–į––Ē–∂–ĺ–Ĺ—Ā–į, —á—ā–ĺ –Ņ–ĺ—ā—Ä–Ķ–Ī–ĺ–≤–į–Ľ–ĺ –Ņ–ĺ–Ľ–Ĺ–ĺ–Ļ –ĺ—ā–ľ–Ķ–Ĺ—č —ā–Ķ—Ä–į–Ņ–ł–ł –ł —É–ļ–į–∑—č–≤–į–Ľ–ĺ –Ĺ–į –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ –ł–ī–ł–ĺ—Ā–ł–Ĺ–ļ—Ä–į–∑–ł–ł –≤ —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–ł –ī–į–Ĺ–Ĺ–ĺ–≥–ĺ –Ĺ–Ķ–∂–Ķ–Ľ–į—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ —ć—Ą—Ą–Ķ–ļ—ā–į.
–í –≥—Ä—É–Ņ–Ņ–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –Ľ–ĺ–ļ–į–Ľ—Ć–Ĺ—č–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł—Ź–ľ–ł –ļ –Ī–į–∑–ĺ–≤–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł –í–ö –ī–ĺ–Ņ–ĺ–Ľ–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –Ĺ–į–∑–Ĺ–į—á–į–Ľ—Ā—Ź –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ –≤ 10 —Ā–Ľ—É—á–į—Ź—Ö, –į –ļ –Ī–į–∑–ĺ–≤–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–ĺ–ľ – –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ –ł —Ą–Ķ–Ĺ–ĺ–Ī–į—Ä–Ī–ł—ā–į–Ľ (–§–Ď) –≤ 11 –ł 8 —Ā–Ľ—É—á–į—Ź—Ö —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ. –ö–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–į—Ź —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –Ņ—Ä–ĺ–≤–ĺ–ī–ł–ľ–ĺ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –Ī—č–Ľ–į –Ņ—Ä–ł–Ī–Ľ–ł–∑–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —Ä–į–≤–Ĺ–ĺ–Ļ –ł –Ņ–ĺ–∑–≤–ĺ–Ľ–ł–Ľ–į –ī–ĺ—Ā—ā–ł—á—Ć –∑–Ĺ–į—á–ł–ľ–ĺ–≥–ĺ —É—Ä–Ķ–∂–Ķ–Ĺ–ł—Ź –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤ (–Ī–ĺ–Ľ–Ķ–Ķ —á–Ķ–ľ –Ĺ–į 50%) –≤ —Ā—Ä–Ķ–ī–Ĺ–Ķ–ľ –≤ 46–60% —Ā–Ľ—É—á–į–Ķ–≤.
–í–ľ–Ķ—Ā—ā–Ķ —Ā —ā–Ķ–ľ, –Ĺ–Ķ—Ā–ľ–ĺ—ā—Ä—Ź –Ĺ–į —ā–ĺ, —á—ā–ĺ —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö, –Ņ–ĺ–Ľ—É—á–į—é—Č–ł—Ö —Ä–į–∑–Ľ–ł—á–Ĺ—č–Ķ —Ā—Ö–Ķ–ľ—č –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł–ł, –Ī—č–Ľ–į –Ņ—Ä–ł–Ī–Ľ–ł–∑–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —Ä–į–≤–Ĺ–ĺ–Ļ, –Ņ–ĺ–Ī–ĺ—á–Ĺ—č–Ķ —ć—Ą—Ą–Ķ–ļ—ā—č –ĺ—ā—á–Ķ—ā–Ľ–ł–≤–ĺ –ĺ—ā–Ľ–ł—á–į–Ľ–ł—Ā—Ć –ļ–į–ļ –Ņ–ĺ —Ā—ā—Ä—É–ļ—ā—É—Ä–Ķ, —ā–į–ļ –ł –Ņ–ĺ —á–į—Ā—ā–ĺ—ā–Ķ –≤–ĺ–∑–Ĺ–ł–ļ–Ĺ–ĺ–≤–Ķ–Ĺ–ł—Ź. –Ě–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–į –ļ –Ī–į–∑–ĺ–≤–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č —Ź–≤–ł–Ľ–ĺ—Ā—Ć –Ņ—Ä–ł—á–ł–Ĺ–ĺ–Ļ —Ä–į–∑–≤–ł—ā–ł—Ź —ā—Ä–ĺ–ľ–Ī–ĺ—Ü–ł—ā–ĺ–Ņ–Ķ–Ĺ–ł–ł –ī–ĺ 110—Ö109, –Ľ–Ķ–Ļ–ļ–ĺ–Ņ–Ķ–Ĺ–ł–ł –ī–ĺ 4,0—Ö109 —É –ĺ–ī–Ĺ–ĺ–≥–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į, —á—ā–ĺ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł —Ā–ĺ–Ņ—Ä–ĺ–≤–ĺ–∂–ī–į–Ľ–ĺ—Ā—Ć –Ņ–Ķ—ā–Ķ—Ö–ł–į–Ľ—Ć–Ĺ—č–ľ–ł –ļ–ĺ–∂–Ĺ—č–ľ–ł –ļ—Ä–ĺ–≤–ĺ–ł–∑–Ľ–ł—Ź–Ĺ–ł—Ź–ľ–ł. –Ě–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ —ā–Ķ—Ä–į–Ņ–ł–ł –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–ĺ–ľ –ł —Ą–Ķ–Ĺ–ĺ–Ī–į—Ä–Ī–ł—ā–į–Ľ–ĺ–ľ, –į —ā–į–ļ–∂–Ķ –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–ĺ–ľ –ł –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–ĺ–ľ –Ņ—Ä–ł–≤–Ķ–Ľ–ĺ –ļ —Ä–į–∑–≤–ł—ā–ł—é –Ĺ–Ķ–Ļ—Ä–ĺ—ā–ĺ–ļ—Ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤ –≤ 62,5 –ł 27,3% —Ā–Ľ—É—á–į–Ķ–≤ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ. –Ē–Ľ—Ź –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ī—č–Ľ–ł —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ—č –∂–į–Ľ–ĺ–Ī—č –Ĺ–į –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–Ĺ—É—é —Ā–ĺ–Ĺ–Ľ–ł–≤–ĺ—Ā—ā—Ć, —É—ā–ĺ–ľ–Ľ—Ź–Ķ–ľ–ĺ—Ā—ā—Ć, —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –Ņ–į–ľ—Ź—ā–ł, –≥–ĺ–Ľ–ĺ–≤–ĺ–ļ—Ä—É–∂–Ķ–Ĺ–ł—Ź –Ĺ–Ķ—Ā–ł—Ā—ā–Ķ–ľ–Ĺ–ĺ–≥–ĺ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–į, –≤ –Ĺ–Ķ–≤—Ä–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–ľ —Ā—ā–į—ā—É—Ā–Ķ – –Ņ–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ķ –Ĺ–ł—Ā—ā–į–≥–ľ–į, –ł–Ĺ—ā–Ķ–Ĺ—Ü–ł–ł –Ņ—Ä–ł –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ł–ł –Ņ–į–Ľ—Ć—Ü–Ķ––Ĺ–ĺ—Ā–ĺ–≤–ĺ–Ļ –ł –Ņ–į–Ľ—Ć—Ü–Ķ––ľ–ĺ–Ľ–ĺ—ā–ĺ—á–ļ–ĺ–≤–ĺ–Ļ –Ņ—Ä–ĺ–Ī. –ě—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ –≤–į–∂–Ĺ–ĺ –Ņ–ĺ–ī—á–Ķ—Ä–ļ–Ĺ—É—ā—Ć, —á—ā–ĺ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –§–Ď –ł –ö –Ņ—Ä–ł–≤–ĺ–ī–ł–Ľ–ĺ –≤ 62,5% —Ā–Ľ—É—á–į–Ķ–≤ –ļ –ĺ–Ņ–ł—Ā–į–Ĺ–Ĺ—č–ľ –Ĺ–Ķ–∂–Ķ–Ľ–į—ā–Ķ–Ľ—Ć–Ĺ—č–ľ —ć—Ą—Ą–Ķ–ļ—ā–į–ľ. –†–į–∑–≤–ł—ā–ł–Ķ –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤ –Ņ–ĺ—Ā–Ľ—É–∂–ł–Ľ–ĺ –Ņ—Ä–ł—á–ł–Ĺ–ĺ–Ļ –ĺ—ā–ľ–Ķ–Ĺ—č –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–į –ł –Ī–į—Ä–Ī–ł—ā—É—Ä–į—ā–ĺ–≤ –≤ 9,1% –ł 12,5% —Ā–Ľ—É—á–į–Ķ–≤ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ.
–Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, —Ä–į—Ā—Ā–ľ–į—ā—Ä–ł–≤–į–Ķ–ľ—č–Ķ —Ā—Ö–Ķ–ľ—č –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł–ł –Ņ–ĺ–ļ–į–∑–į–Ľ–ł –Ņ—Ä–ł–Ī–Ľ–ł–∑–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –ĺ–ī–ł–Ĺ–į–ļ–ĺ–≤—É—é –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ—É—é —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ļ–į–ļ –≤ –≥—Ä—É–Ņ–Ņ–Ķ —Ā –Ľ–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ—č–ľ–ł, —ā–į–ļ –ł —Ā –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł —ā—Ä—É–ī–Ĺ–ĺ–ļ—É—Ä–į–Ī–Ķ–Ľ—Ć–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł, –ĺ–ī–Ĺ–į–ļ–ĺ –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ –ĺ—ā–Ľ–ł—á–į–Ľ–ł—Ā—Ć –Ņ–ĺ —Ö–į—Ä–į–ļ—ā–Ķ—Ä—É –ł —á–į—Ā—ā–ĺ—ā–Ķ —Ä–į–∑–≤–ł—ā–ł—Ź –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤. –Ę–Ķ–ľ –Ĺ–Ķ –ľ–Ķ–Ĺ–Ķ–Ķ –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ —ą–ł—Ä–ĺ–ļ–ł–Ļ —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ł–Ļ —Ā–Ņ–Ķ–ļ—ā—Ä –Ņ–ĺ–ļ–į–∑–į–Ľ–ĺ —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–ĺ–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –Ľ–Ķ–≤–Ķ—ā–ł—Ä–į—Ü–Ķ—ā–į–ľ–į –ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č, –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–į –ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č.
–§–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–į—Ź –ł–Ĺ—ā–Ķ—Ä—Ą–Ķ—Ä–Ķ–Ĺ—Ü–ł—Ź –į–Ĺ—ā–ł—ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö
—Ā —ā—Ä—É–ī–Ĺ–ĺ–ļ—É—Ä–į–Ī–Ķ–Ľ—Ć–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł
–° —Ü–Ķ–Ľ—Ć—é –ł–∑—É—á–Ķ–Ĺ–ł—Ź —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł—Ź –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ —É –≤—Ā–Ķ—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ī—č–Ľ–ĺ –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ —É—Ä–ĺ–≤–Ĺ—Ź –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–į –ł –≤–į–Ľ—Ć–Ņ—Ä–ĺ–į—ā–ĺ–≤ –ī–ĺ –ł –Ņ–ĺ—Ā–Ľ–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź –≤—ā–ĺ—Ä–ĺ–≥–ĺ –į–Ĺ—ā–ł—ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į, –į –≤ —Ä—Ź–ī–Ķ —Ā–Ľ—É—á–į–Ķ–≤ – —Ä–į—Ā—á–Ķ—ā –Ņ–į—Ä–į–ľ–Ķ—ā—Ä–ĺ–≤ –ź–†–ú–≠.
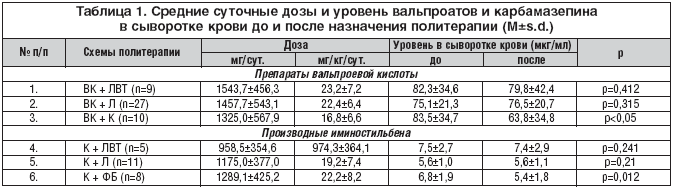
–°—Ä–Ķ–ī–Ĺ–ł–Ķ —Ā—É—ā–ĺ—á–Ĺ—č–Ķ –ī–ĺ–∑—č, –ł—Ā–Ņ–ĺ–Ľ—Ć–∑—É–Ķ–ľ—č–Ķ –≤ –Ĺ–į—ą–Ķ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł, –ł —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź —É—Ä–ĺ–≤–Ĺ—Ź –Ī–į–∑–ĺ–≤—č—Ö –ź–≠–ü –≤ —Ā—č–≤–ĺ—Ä–ĺ—ā–ļ–Ķ –ļ—Ä–ĺ–≤–ł –ī–ĺ –ł –Ņ–ĺ—Ā–Ľ–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö —Ā—Ö–Ķ–ľ –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł–ł –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ—č –≤ —ā–į–Ī–Ľ–ł—Ü–Ķ 1.
–Ě–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –Ľ–Ķ–≤–Ķ—ā–ł—Ä–į—Ü–Ķ—ā–į–ľ–į –ł –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–į –ļ –Ī–į–∑–ĺ–≤–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –ł –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–ĺ–ľ –Ĺ–Ķ –Ņ—Ä–ł–≤–Ķ–Ľ–ĺ –ļ –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ–ľ—É –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—é –Ĺ–ł –ĺ–ī–Ĺ–ĺ–≥–ĺ –ł–∑ —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ–į—Ä–į–ľ–Ķ—ā—Ä–ĺ–≤, –ĺ—ā—Ä–į–∂–į—é—Č–ł—Ö –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā—č –į–Ī—Ā–ĺ—Ä–Ī—Ü–ł–ł, —Ä–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –ł —ć–Ľ–ł–ľ–ł–Ĺ–į—Ü–ł–ł. –ü–Ľ–ĺ—Č–į–ī—Ć –Ņ–ĺ–ī —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ—Ä–ł–≤–ĺ–Ļ «–ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł—Ź – –≤—Ä–Ķ–ľ—Ź» —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–į 2301,0±965,6 –ł 2413,3±1030,4 –ľ–ļ–≥.—á.–ľ–Ľ–1, 223,1±96,5 –ł 181,2±80,9 –ľ–ļ–≥.—á.–ľ–Ľ–1 –≤ —Ā–Ľ—É—á–į–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –í–ö (p=0,17) –ł –ö (p=0,40) —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ. –ö–į–ļ —Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ – –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł—Ź –Ę–õ–ú –ł –ļ–ĺ—Ä—Ä–Ķ–ļ—Ü–ł–ł —Ā—É—ā–ĺ—á–Ĺ–ĺ–Ļ –ī–ĺ–∑—č –Ī–į–∑–ĺ–≤—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –Ĺ–Ķ –Ņ–ĺ—ā—Ä–Ķ–Ī–ĺ–≤–į–Ľ–ĺ—Ā—Ć –Ĺ–ł –≤ –ĺ–ī–Ĺ–ĺ–ľ —Ā–Ľ—É—á–į–Ķ.
–Ě–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–į –ļ –Ī–į–∑–ĺ–≤–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č —É 10 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ—Ä–ł–≤–Ķ–Ľ–ĺ –ļ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—é –ľ–ł–Ĺ–ł–ľ–į–Ľ—Ć–Ĺ–ĺ–Ļ —Ä–į–≤–Ĺ–ĺ–≤–Ķ—Ā–Ĺ–ĺ–Ļ –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł–ł –≤–į–Ľ—Ć–Ņ—Ä–ĺ–į—ā–ĺ–≤ –≤ —Ā—č–≤–ĺ—Ä–ĺ—ā–ļ–Ķ –ļ—Ä–ĺ–≤–ł –≤ —Ā—Ä–Ķ–ī–Ĺ–Ķ–ľ –Ĺ–į 27% –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā –Ķ–Ķ –ł—Ā—Ö–ĺ–ī–Ĺ—č–ľ —É—Ä–ĺ–≤–Ĺ–Ķ–ľ. –†–į—Ā—á–Ķ—ā –Ņ–į—Ä–į–ľ–Ķ—ā—Ä–ĺ–≤ –ź–†–ú–≠ –Ņ–ĺ–ļ–į–∑–į–Ľ –≤—č—Ā–ĺ–ļ–ĺ–∑–Ĺ–į—á–ł–ľ–ĺ–Ķ (p=0,003) —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –Ņ–Ľ–ĺ—Č–į–ī–ł –Ņ–ĺ–ī —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ—Ä–ł–≤–ĺ–Ļ «–° – t» –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ –∑–Ĺ–į—á–ł–ľ–ĺ–≥–ĺ (p=0,047) —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł—Ź –ļ–Ľ–ł—Ä–Ķ–Ĺ—Ā–į —Ā 4,8±1,2 –ľ–Ľ/—á/–ļ–≥ –ī–ĺ 6,2±1,9 –ľ–Ľ/—á/–ļ–≥ –ł —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź –Ņ–Ķ—Ä–ł–ĺ–ī–į –Ņ–ĺ–Ľ—É–≤—č–≤–Ķ–ī–Ķ–Ĺ–ł—Ź —Ā 15,2±4,9 —á –ī–ĺ 13,3±4,1 —á –≤–į–Ľ—Ć–Ņ—Ä–ĺ–į—ā–ĺ–≤. –ó–Ĺ–į—á–ł–ľ—č—Ö —Ä–į–∑–Ľ–ł—á–ł–Ļ –ľ–Ķ–∂–ī—É –Ņ–į—Ä–į–ľ–Ķ—ā—Ä–į–ľ–ł —Ä–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –ł –į–Ī—Ā–ĺ—Ä–Ī—Ü–ł–ł –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–ĺ –Ĺ–Ķ –Ī—č–Ľ–ĺ. –£–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ —Ā–ļ–ĺ—Ä–ĺ—Ā—ā–ł —ć–Ľ–ł–ľ–ł–Ĺ–į—Ü–ł–ł –≤–į–Ľ—Ć–Ņ—Ä–ĺ–į—ā–ĺ–≤ –Ņ–ĺ—ā—Ä–Ķ–Ī–ĺ–≤–į–Ľ–ĺ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł—Ź —Ā—É—ā–ĺ—á–Ĺ–ĺ–Ļ –ī–ĺ–∑—č –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č —Ā 22,4±6,4 –ī–ĺ 27,3±8,4 –ľ–≥/–ļ–≥/–ī–Ĺ.
–ě–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ —É—Ä–ĺ–≤–Ĺ—Ź –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–į –≤ —Ā—č–≤–ĺ—Ä–ĺ—ā–ļ–Ķ –ļ—Ä–ĺ–≤–ł –Ņ–ĺ—Ā–Ľ–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź —Ą–Ķ–Ĺ–ĺ–Ī–į—Ä–Ī–ł—ā–į–Ľ–į —É 8 –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –Ľ–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł –Ņ–ĺ–ļ–į–∑–į–Ľ–ĺ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –Ķ–≥–ĺ –Ī–į–∑–ĺ–≤–ĺ–≥–ĺ —É—Ä–ĺ–≤–Ĺ—Ź –≤ —Ā—Ä–Ķ–ī–Ĺ–Ķ–ľ –Ĺ–į 25% (—Ā 6,8±1,9 –ī–ĺ 5,4±1,8 –ľ–ļ–≥/–ľ–Ľ). –ė–∑—É—á–Ķ–Ĺ–ł–Ķ —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ą–ł–Ľ—Ź –Ņ–ĺ–ļ–į–∑–į–Ľ–ĺ –∑–Ĺ–į—á–ł–ľ–ĺ–Ķ (—Ä=0,011) —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –Ņ–Ķ—Ä–ł–ĺ–ī–į –Ņ–ĺ–Ľ—É–≤—č–≤–Ķ–ī–Ķ–Ĺ–ł—Ź —Ā 22,3±8,8 —á –ī–ĺ 18,8±10,2 —á –ł —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –ļ–Ľ–ł—Ä–Ķ–Ĺ—Ā–į —Ā 46,9±13,1 –ī–ĺ 65,3±30,9 –ľ–Ľ/—á/–ļ–≥ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į. –ö–į–ļ –ł –≤ –ī—Ä—É–≥–ł—Ö —Ā–Ľ—É—á–į—Ź—Ö, —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ —Ā–ł–Ľ—Ć–Ĺ–ĺ –≤–į—Ä—Ć–ł—Ä–ĺ–≤–į–Ľ–į –ľ–Ķ–∂–ī—É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į–ľ–ł, –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź—Ź —ā–Ķ–ľ —Ā–į–ľ—č–ľ –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ—É—é –ľ–Ķ–∂–ł–Ĺ–ī–ł–≤–ł–ī—É–į–Ľ—Ć–Ĺ—É—é —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ—É—é –≤–į—Ä–ł–į–Ī–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –ł –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ—Ā—ā—Ć –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł—Ź –Ņ—Ä–ĺ—Ü–Ķ–ī—É—Ä—č –Ę–õ–ú.
–Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –ł–∑—É—á–Ķ–Ĺ–ł–Ķ —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł—Ź –ź–≠–ü –Ņ–ĺ–∑–≤–ĺ–Ľ–ł–Ľ–ĺ –≤—č—Ź–≤–ł—ā—Ć –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –≤–Ľ–ł—Ź–Ĺ–ł—Ź –Ĺ–į –ļ–ł–Ĺ–Ķ—ā–ł–ļ—É –Ī–į–∑–ĺ–≤—č—Ö –ź–≠–ü –Ľ–Ķ–≤–Ķ—ā–ł—Ä–į—Ü–Ķ—ā–į–ľ–į –ł –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–į, –į —ā–į–ļ–∂–Ķ –∑–Ĺ–į—á–ł–ľ–ĺ–Ķ —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –ł—Ö –ļ–Ľ–ł—Ä–Ķ–Ĺ—Ā–į –Ņ—Ä–ł –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–ł –ł–Ĺ–ī—É–ļ—ā–ĺ—Ä–ĺ–≤ –ľ–ł–ļ—Ä–ĺ—Ā–ĺ–ľ–į–Ľ—Ć–Ĺ—č—Ö —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ –Ņ–Ķ—á–Ķ–Ĺ–ł (–≤ —ā–ĺ–ľ —á–ł—Ā–Ľ–Ķ –Ī–į—Ä–Ī–ł—ā—É—Ä–į—ā–ĺ–≤).
–ě–Ī—Ā—É–∂–ī–Ķ–Ĺ–ł–Ķ –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–Ĺ—č—Ö —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–ĺ–≤
–ė–∑—É—á–Ķ–Ĺ–ł–Ķ —Ą–į—Ä–ľ–į–ļ–ĺ–ī–ł–Ĺ–į–ľ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ł —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł—Ź –į–Ĺ—ā–ł—ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –Ņ–ĺ–∑–≤–ĺ–Ľ–ł–Ľ–ĺ –≤—č—Ź–≤–ł—ā—Ć —Ä—Ź–ī –∑–į–ļ–ĺ–Ĺ–ĺ–ľ–Ķ—Ä–Ĺ–ĺ—Ā—ā–Ķ–Ļ, –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź—é—Č–ł—Ö –ĺ–Ņ—ā–ł–ľ–ł–∑–ł—Ä–ĺ–≤–į—ā—Ć —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–ĺ–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö –≥—Ä—É–Ņ–Ņ –ź–≠–ü, –≤—č–ī–Ķ–Ľ–ł—ā—Ć —Ā—Ö–Ķ–ľ—č –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł–ł –Ņ–Ķ—Ä–≤–ĺ–≥–ĺ –ł –≤—ā–ĺ—Ä–ĺ–≥–ĺ —Ä—Ź–ī–į –≤—č–Ī–ĺ—Ä–ĺ–≤ –ī–Ľ—Ź –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—Ź –ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ–ĺ–Ļ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł —Ā –ľ–ł–Ĺ–ł–ľ–į–Ľ—Ć–Ĺ—č–ľ —Ä–ł—Ā–ļ–ĺ–ľ —Ä–į–∑–≤–ł—ā–ł—Ź –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤.
–Ě–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –ł –Ľ–Ķ–≤–Ķ—ā–ł—Ä–į—Ü–Ķ—ā–į–ľ–ĺ–ľ, –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –ł –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–ĺ–ľ –Ņ–ĺ–ļ–į–∑–į–Ľ–ĺ –≤—č—Ā–ĺ–ļ—É—é –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ—É—é —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ļ–į–ļ –≤ –≥—Ä—É–Ņ–Ņ–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā —Ā–ł–ľ–Ņ—ā–ĺ–ľ–į—ā–ł—á–Ķ—Ā–ļ–ł–ľ–ł –ł –ļ—Ä–ł–Ņ—ā–ĺ–≥–Ķ–Ĺ–Ĺ—č–ľ–ł –Ľ–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ—č–ľ–ł, —ā–į–ļ –ł —Ā –ł–ī–ł–ĺ–Ņ–į—ā–ł—á–Ķ—Ā–ļ–ł–ľ–ł –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł. –ü—Ä–ł —ć—ā–ĺ–ľ —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–į—Ź —ā–Ķ—Ä–į–Ņ–ł—Ź –õ–í–Ę —Ā –í–ö –Ņ–ĺ–ļ–į–∑–į–Ľ–į –Ī–ĺ–Ľ–Ķ–Ķ –≤—č—Ā–ĺ–ļ–ł–Ļ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ —ć—Ą—Ą–Ķ–ļ—ā —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł (–≤ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–ĺ–ľ –Į–Ĺ—Ü–į). –ü–ĺ–Ľ—É—á–Ķ–Ĺ–Ĺ—č–Ķ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–į—é—ā—Ā—Ź –Ľ–ł—ā–Ķ—Ä–į—ā—É—Ä–Ĺ—č–ľ–ł –ī–į–Ĺ–Ĺ—č–ľ–ł, –Ņ–ĺ –ļ–ĺ—ā–ĺ—Ä—č–ľ –õ–í–Ę —É—Ā–Ņ–Ķ—ą–Ĺ–ĺ –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ľ—Ā—Ź —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —é–Ĺ–ĺ—ą–Ķ—Ā–ļ–ĺ–Ļ –ľ–ł–ĺ–ļ–Ľ–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–Ķ–Ļ –Ņ—Ä–ł –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–ł –ļ–į–ļ –≤ —Ä–Ķ–∂–ł–ľ–Ķ –ľ–ĺ–Ĺ–ĺ—ā–Ķ—Ä–į–Ņ–ł–ł [Verrotti A., Cerminara C., Coppola G., et al., 2008; Sharpe D.V., Patel A.D., Abou–Khalil B., Fenichel G.M., 2008], —ā–į–ļ –ł —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–ĺ —Ā –ź–≠–ü –ł–∑ –ī—Ä—É–≥–ł—Ö –≥—Ä—É–Ņ–Ņ [Kumar S. P., Smith P. E., 2004]. –ü–ĺ –ī–į–Ĺ–Ĺ—č–ľ Labate A. —Ā —Ā–ĺ–į–≤—ā. (2006), –Ľ–Ķ–≤–Ķ—ā–ł—Ä–į—Ü–Ķ—ā–į–ľ –Ņ–ĺ–ļ–į–∑–į–Ľ —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –Ņ—Ä–ł –Ľ–Ķ—á–Ķ–Ĺ–ł–ł –ľ–ł–ĺ–ļ–Ľ–ĺ–Ĺ–ł–Ļ –≤ —Ā—ā—Ä—É–ļ—ā—É—Ä–Ķ –ī—Ä—É–≥–ł—Ö —Ą–ĺ—Ä–ľ —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–Ļ, –≤ —ā.—á., —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł–∑—É—é—Č–ł—Ö—Ā—Ź —ā—Ź–∂–Ķ–Ľ—č–ľ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ–ľ – —ā—Ź–∂–Ķ–Ľ–ĺ–Ļ –ľ–ł–ĺ–ļ–Ľ–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł –ľ–Ľ–į–ī–Ķ–Ĺ—á–Ķ—Ā—ā–≤–į (severe myoclonic epilepsy of infancy, SMEI), —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–Ķ –õ–Ķ–Ĺ–Ĺ–ĺ–ļ—Ā–į––ď–į—Ā—ā–ĺ (Lennox–Gastaut syndrome, LGS), —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł —Ā –ľ–ł–ĺ–ļ–Ľ–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł––į—Ā—ā–į—ā–ł—á–Ķ—Ā–ļ–ł–ľ–ł –Ņ—Ä–ł—Ā—ā—É–Ņ–į–ľ–ł (myoclonic–astatic epilepsy, MAE), —Ā –ľ–ł–ĺ–ļ–Ľ–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ–ł –į–Ī—Ā–į–Ĺ—Ā–į–ľ–ł (myoclonic absences, MA), –ľ–ł–ĺ–ļ–Ľ–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł –ľ–Ľ–į–ī–Ķ–Ĺ—á–Ķ—Ā—ā–≤–į (benign myoclonic epilepsy in infancy, BMEI).
–í—č—Ā–ĺ–ļ—É—é –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ—É—é —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć —Ä–į—Ā—Ā–ľ–į—ā—Ä–ł–≤–į–Ķ–ľ–į—Ź —Ā—Ö–Ķ–ľ–į –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł–ł –Ņ–ĺ–ļ–į–∑–į–Ľ–į —ā–į–ļ–∂–Ķ —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –Ņ–į—Ä—Ü–ł–į–Ľ—Ć–Ĺ—č–ľ–ł —ā–ł–Ņ–į–ľ–ł –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤. –ü—Ä–ł —ć—ā–ĺ–ľ —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –õ–í–Ę —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –Ľ–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł –Ī—č–Ľ–į –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–į –≤ —Ü–Ķ–Ľ–ĺ–ľ —Ä—Ź–ī–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ [Brodie M.J., Perucca E., Ryvlin P., et al. 2007; Glauser T.A., Ayala R., Elterman R.D., et al., 2006] –ł –Ĺ–Ķ –≤—č–∑—č–≤–į–Ķ—ā —Ā–ĺ–ľ–Ĺ–Ķ–Ĺ–ł—Ź. –ě–ī–Ĺ–į–ļ–ĺ –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ —É—á–ł—ā—č–≤–į—ā—Ć –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā—Ć —Ä–į–∑–≤–ł—ā–ł—Ź –Ĺ–Ķ–Ļ—Ä–ĺ—ā–ĺ–ļ—Ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ, –į —ā–į–ļ–∂–Ķ –Ņ–į—Ä–į–ī–ĺ–ļ—Ā–į–Ľ—Ć–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤ –≤ –≤–ł–ī–Ķ –į–≥–≥—Ä–į–≤–į—Ü–ł–ł –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤.
–í —ā–ĺ –∂–Ķ –≤—Ä–Ķ–ľ—Ź –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ —É—á–ł—ā—č–≤–į—ā—Ć, —á—ā–ĺ —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö, –≤–ĺ—ą–Ķ–ī—ą–ł—Ö –≤ —Ä–į—Ā—Ā–ľ–į—ā—Ä–ł–≤–į–Ķ–ľ—č–Ķ –Ĺ–į–ľ–ł –≥—Ä—É–Ņ–Ņ—č, —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź —Ā–Ķ—Ä–ł–Ļ–Ĺ—č—Ö –ł —Ā—ā–į—ā—É—Ā–ĺ–≤ —ć–Ņ–ł–Ľ–Ķ–Ņ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤ –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ –≤—č—Ā–ĺ–ļ. –ü—Ä–ł —ć—ā–ĺ–ľ, –Ī–Ķ–∑—É—Ā–Ľ–ĺ–≤–Ĺ–ĺ, –Ĺ–Ķ–∑–į–ľ–Ķ–Ĺ–ł–ľ—É—é —Ä–ĺ–Ľ—Ć –Ņ—Ä–ł –ĺ–ļ–į–∑–į–Ĺ–ł–ł –Ĺ–Ķ–ĺ—ā–Ľ–ĺ–∂–Ĺ—č—Ö –ľ–Ķ—Ä–ĺ–Ņ—Ä–ł—Ź—ā–ł–Ļ –Ī—É–ī–Ķ—ā –ł–≥—Ä–į—ā—Ć –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā—Ć –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł—Ź —Ą–ĺ—Ä–ľ –ź–≠–ü –ī–Ľ—Ź –≤–Ĺ—É—ā—Ä–ł–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –≤–≤–Ķ–ī–Ķ–Ĺ–ł—Ź. –ě–ī–Ĺ–į–ļ–ĺ —Ā–Ņ–Ķ–ļ—ā—Ä –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤, –ł–ľ–Ķ—é—Č–ł—Ö –≤–Ĺ—É—ā—Ä–ł–≤–Ķ–Ĺ–Ĺ—č–Ķ —Ą–ĺ—Ä–ľ—č, –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ —É–∑–ļ–ł–Ļ: –ļ –Ĺ–ł–ľ –ĺ—ā–Ĺ–ĺ—Ā—Ź—ā—Ā—Ź –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č, –ī–ł—Ą–Ķ–Ĺ–ł–Ĺ –ł –Ľ–Ķ–≤–Ķ—ā–ł—Ä–į—Ü–Ķ—ā–į–ľ. –ü—Ä–ł —ć—ā–ĺ–ľ –Ķ—Ā–Ľ–ł –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł–Ķ –≤–į–Ľ—Ć–Ņ—Ä–ĺ–į—ā–ĺ–≤ –Ņ—Ä–ł –ĺ–ļ–į–∑–į–Ĺ–ł–ł –Ĺ–Ķ–ĺ—ā–Ľ–ĺ–∂–Ĺ–ĺ–Ļ –Ņ–ĺ–ľ–ĺ—Č–ł –Ĺ–Ķ –≤—č–∑—č–≤–į–Ķ—ā —Ā–ĺ–ľ–Ĺ–Ķ–Ĺ–ł—Ź, —ā–ĺ –≤ –Ņ–ĺ—Ā–Ľ–Ķ–ī–Ĺ–ł–Ķ –≥–ĺ–ī—č –≤ –Ľ–ł—ā–Ķ—Ä–į—ā—É—Ä–Ķ –Ņ–ĺ—Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –≤—Ā–Ķ –Ī–ĺ–Ľ—Ć—ą–Ķ –Ņ—É–Ī–Ľ–ł–ļ–į—Ü–ł–Ļ —Ä–į—Ā–ļ—Ä—č–≤–į—é—Č–ł—Ö –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā—Ć –Ņ–ĺ—ā–Ķ–Ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –Ľ–Ķ–≤–Ķ—ā–ł—Ä–į—Ü–Ķ—ā–į–ľ–į –≤ –ī–į–Ĺ–Ĺ—č—Ö —Ā–ł—ā—É–į—Ü–ł—Ź—Ö [Abend N. S., Flarance N., Finkel R.S., et al., 2008; Trabacca A., Profice P., Costanza M.C., et al., 2007; Schulze–Bonhage A., Hefft S., Oehl B., 2007]. –ě–≥—Ä–į–Ĺ–ł—á–Ķ–Ĺ–ł–Ķ–ľ –ł—Ö –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł—Ź —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –≤ —Ā—ā—Ä–į–Ĺ–Ķ —Ä–į–∑—Ä–Ķ—ą–Ķ–Ĺ–Ĺ—č—Ö —Ą–ĺ—Ä–ľ –ú–ó –†–§.
–°–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–į—Ź —ā–Ķ—Ä–į–Ņ–ł—Ź –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –ł –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–ĺ–ľ —ā–į–ļ–∂–Ķ –Ņ–ĺ–ļ–į–∑–į–Ľ–į —ą–ł—Ä–ĺ–ļ–ł–Ļ «—ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ł–Ļ –ł–Ĺ—ā–Ķ—Ä–≤–į–Ľ» –ł –≤—č—Ā–ĺ–ļ—É—é –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ—É—é —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –Ņ–ĺ –ĺ—ā–Ĺ–ĺ—ą–Ķ–Ĺ–ł—é –ļ–ĺ –≤—Ā–Ķ–ľ —ā–ł–Ņ–į–ľ –Ņ—Ä–ł–Ņ–į–ī–ļ–ĺ–≤ – –Ņ–į—Ä—Ü–ł–į–Ľ—Ć–Ĺ—č–ľ (—Ā–Ľ–ĺ–∂–Ĺ—č–ľ –ł –í–ď–Ę–ü–ö) –ł –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ—č–ľ (–į–Ī—Ā–į–Ĺ—Ā–Ĺ—č–ľ, –ľ–ł–ĺ–ļ–Ľ–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ, –ď–Ę–ö–ü). –ü–ĺ—Ā–Ľ–Ķ–ī–Ĺ–Ķ–Ķ –Ņ–ĺ–∑–≤–ĺ–Ľ–ł–Ľ–ĺ –≤ —Ä—Ź–ī–Ķ —Ā–Ľ—É—á–į–Ķ–≤ —Ā–Ĺ–ł–∑–ł—ā—Ć —Ā—É—ā–ĺ—á–Ĺ—É—é –ī–ĺ–∑—É –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –ł —ā–Ķ–ľ —Ā–į–ľ—č–ľ —É–Ļ—ā–ł –ĺ—ā –ī–ĺ–∑–ĺ–∑–į–≤–ł—Ā–ł–ľ—č—Ö –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤. –í —ā–ĺ –∂–Ķ –≤—Ä–Ķ–ľ—Ź –ł—Ö —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–ĺ–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –≤ –ļ–į–∂–ī–ĺ–ľ ? —Ā–Ľ—É—á–į–Ķ –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ –ļ–ĺ–∂–Ĺ—č–ľ –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–ľ –≤—č—Ā—č–Ņ–į–Ĺ–ł—Ź–ľ, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –Ņ–ĺ–ļ–į–∑—č–≤–į–Ľ–ł —Ā–≤–ĺ—é –Ī–ł–≤–į–Ľ–Ķ–Ĺ—ā–Ĺ–ĺ—Ā—ā—Ć –Ņ–ĺ –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ—É —Ä–į–∑–≤–ł—ā–ł—Ź. –ü—Ä–ł —ć—ā–ĺ–ľ –≤ –ĺ–ī–Ĺ–ĺ–ľ —Ā–Ľ—É—á–į–Ķ –ī–į–Ĺ–Ĺ–į—Ź —ā–Ķ—Ä–į–Ņ–ł—Ź –Ņ—Ä–ł–≤–Ķ–Ľ–į –ļ —Ä–į–∑–≤–ł—ā–ł—é —ā—Ź–∂–Ķ–Ľ–ĺ–Ļ –ł–ľ–ľ—É–Ĺ–ĺ––į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ä–Ķ–į–ļ—Ü–ł–ł –Ņ–ĺ —ā–ł–Ņ—É –°—ā–ł–≤–Ķ–Ĺ—Ā–į––Ē–∂–ĺ–Ĺ—Ā–į. –†–į–∑–≤–ł—ā–ł–Ķ –ļ–ĺ–∂–Ĺ—č—Ö –≤—č—Ā—č–Ņ–į–Ĺ–ł–Ļ –≤ –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–Ķ —Ā–Ľ—É—á–į–Ķ–≤ —ā—Ä–Ķ–Ī—É–Ķ—ā –Ľ–ł–Ī–ĺ –Ņ–ĺ–Ľ–Ĺ–ĺ–Ļ –ĺ—ā–ľ–Ķ–Ĺ—č –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–į, –Ľ–ł–Ī–ĺ —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź –Ķ–≥–ĺ –ī–ĺ–∑—č.
–ė–∑—É—á–Ķ–Ĺ–ł–Ķ —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –į—Ā–Ņ–Ķ–ļ—ā–ĺ–≤ –Ņ–ĺ–∑–≤–ĺ–Ľ–ł–Ľ–ĺ –≤—č—Ź–≤–ł—ā—Ć –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –≤–Ľ–ł—Ź–Ĺ–ł—Ź –Ľ–Ķ–≤–Ķ—ā–ł—Ä–į—Ü–Ķ—ā–į–ľ–į –ł –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–į –Ĺ–į –ļ–ł–Ĺ–Ķ—ā–ł–ļ—É –í–ö –ł –ö –Ĺ–į –≤—Ā–Ķ—Ö —ć—ā–į–Ņ–į—Ö —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į, —á—ā–ĺ —Ö–ĺ—Ä–ĺ—ą–ĺ —Ā–ĺ–≥–Ľ–į—Ā—É–Ķ—ā—Ā—Ź —Ā —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–į–ľ–ł, –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ—č–ľ–ł –≤ —Ä–į–Ī–ĺ—ā–į—Ö Otoul C. (2007), Gidal B.E. (2005), Mataringa M.I. (2002). –ü–ĺ—ć—ā–ĺ–ľ—É –ľ—č –Ņ–ĺ–Ľ–į–≥–į–Ķ–ľ, —á—ā–ĺ –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź —É—Ä–ĺ–≤–Ĺ—Ź –Ī–į–∑–ĺ–≤—č—Ö –ź–≠–ü –≤ —Ā—č–≤–ĺ—Ä–ĺ—ā–ļ–Ķ –ļ—Ä–ĺ–≤–ł –Ņ–ĺ—Ā–Ľ–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź –Ľ–Ķ–≤–Ķ—ā–ł—Ä–į—Ü–Ķ—ā–į–ľ–į –ł –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–į –Ĺ–Ķ—Ü–Ķ–Ľ–Ķ—Ā–ĺ–ĺ–Ī—Ä–į–∑–Ĺ–ĺ. –ú–ł–Ĺ–ł–ľ–į–Ľ—Ć–Ĺ–ĺ–Ķ –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –Ľ–Ķ–≤–Ķ—ā–ł—Ä–į—Ü–Ķ—ā–į–ľ–į –Ĺ–į –ļ–ł–Ĺ–Ķ—ā–ł–ļ—É –ī—Ä—É–≥–ł—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–ĺ —Ä—Ź–ī–ĺ–ľ –Ņ—Ä–ł—á–ł–Ĺ: –≤—č—Ā–ĺ–ļ–ĺ–Ļ –Ī–ł–ĺ–ī–ĺ—Ā—ā—É–Ņ–Ĺ–ĺ—Ā—ā—Ć—é –ł –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ–ľ –≤–Ľ–ł—Ź–Ĺ–ł—Ź –Ņ–ł—Č–ł –Ĺ–į –Ķ–≥–ĺ –į–Ī—Ā–ĺ—Ä–Ī—Ü–ł—é; –Ĺ–ł–∑–ļ–ł–ľ —Ā–≤—Ź–∑—č–≤–į–Ĺ–ł–Ķ–ľ —Ā –Ī–Ķ–Ľ–ļ–į–ľ–ł –Ņ–Ľ–į–∑–ľ—č –ļ—Ä–ĺ–≤–ł, —á—ā–ĺ –ł—Ā–ļ–Ľ—é—á–į–Ķ—ā –ļ–ĺ–Ĺ–ļ—É—Ä–Ķ–Ĺ—Ü–ł—é –≤ —Ā–≤—Ź–∑–ł —Ā –Ī–Ķ–Ľ–ļ–į–ľ–ł —Ā –ī—Ä—É–≥–ł–ľ–ł –ļ—Ā–Ķ–Ĺ–ĺ–Ī–ł–ĺ—ā–ł–ļ–į–ľ–ł; –Ľ–ł–Ĺ–Ķ–Ļ–Ĺ—č–ľ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ĺ–ľ —Ą–į—Ä–ľ–į–ļ–ĺ–ļ–ł–Ĺ–Ķ—ā–ł–ļ–ł, —ā–ĺ –Ķ—Ā—ā—Ć –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–Ķ–ľ –Ķ–≥–ĺ —É—Ä–ĺ–≤–Ĺ—Ź –≤ —Ā—č–≤–ĺ—Ä–ĺ—ā–ļ–Ķ –ļ—Ä–ĺ–≤–ł –Ņ—Ä–ĺ–Ņ–ĺ—Ä—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł—é –ī–ĺ–∑—č [E. Perucca, S.I. Johannessen, 2003]. –Ě–į–Ľ–ł—á–ł–Ķ —É –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į –Ņ–ĺ—á–Ķ—á–Ĺ–ĺ–≥–ĺ –ļ–Ľ–ł—Ä–Ķ–Ĺ—Ā–į —Ä–į—Ā—ą–ł—Ä—Ź–Ķ—ā –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā–ł –Ķ–≥–ĺ –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –ĺ—Ā—ā—Ä—č–ľ–ł –ł —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź–ľ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł, –ĺ–ī–Ĺ–į–ļ–ĺ –ĺ–≥—Ä–į–Ĺ–ł—á–ł–≤–į–Ķ—ā —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –Ņ–ĺ—á–Ķ—á–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć—é.
–Ě–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ —É—á–ł—ā—č–≤–į—ā—Ć –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –≤–į–Ľ—Ć–Ņ—Ä–ĺ–į—ā–ĺ–≤ –Ĺ–į –Ņ–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–į –≤ –ĺ—Ä–≥–į–Ĺ–ł–∑–ľ–Ķ –≤ –≤–ł–ī–Ķ —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł—Ź –Ņ–Ķ—Ä–ł–ĺ–ī–į –Ķ–≥–ĺ –Ņ–ĺ–Ľ—É–≤—č–≤–Ķ–ī–Ķ–Ĺ–ł—Ź –≤ 1,5–2 —Ä–į–∑–į, —á—ā–ĺ —ā—Ä–Ķ–Ī—É–Ķ—ā —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź –ī–ĺ–∑—č –≤ –ī–≤–į —Ä–į–∑–į, —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź—Ź –≤ –Ĺ–į—ą–Ķ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł 75–150 –ľ–≥/—Ā—É—ā. –Ņ—Ä–ł –ľ–Ķ–ī–Ľ–Ķ–Ĺ–Ĺ–ĺ–ľ –Ķ–Ķ —ā–ł—ā—Ä–ĺ–≤–į–Ĺ–ł–ł. –í –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź—Ö Gidal B.E. (2003) –Ī—č–Ľ–ĺ –≤—č—Ā–ļ–į–∑–į–Ĺ–ĺ –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–ł–Ķ –ĺ –ī–ĺ–∑–ĺ–∑–į–≤–ł—Ā–ł–ľ–ĺ–ľ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ķ –ī–į–Ĺ–Ĺ–ĺ–≥–ĺ –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł—Ź –ł –Ņ–ĺ–ļ–į–∑–į–Ĺ–į –Ī–ĺ–Ľ—Ć—ą–į—Ź –Ķ–≥–ĺ –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ņ—Ä–ł –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–ł —Ā—É—ā–ĺ—á–Ĺ–ĺ–Ļ –ī–ĺ–∑—č –≤–į–Ľ—Ć–Ņ—Ä–ĺ–į—ā–ĺ–≤, —Ä–į—Ā—Ā–ľ–į—ā—Ä–ł–≤–į—Ź –Ņ—Ä–ł—á–ł–Ĺ–ĺ–Ļ –ł–Ĺ–≥–ł–Ī–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ –Ņ–Ķ—á–Ķ–Ĺ–ł – —Ą—Ä–į–ļ—Ü–ł–ł –°–£–†2–°9 —Ü–ł—ā–ĺ—Ö—Ä–ĺ–ľ–į –†450 [Tanaka E., 1999].
–Ē–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ –≤—č—Ā–ĺ–ļ—É—é —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ c –õ–ě–§–≠ –Ņ—Ä–ł —É–ī–ĺ–≤–Ľ–Ķ—ā–≤–ĺ—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –Ņ–Ķ—Ä–Ķ–Ĺ–ĺ—Ā–ł–ľ–ĺ—Ā—ā–ł –Ņ–ĺ–ļ–į–∑–į–Ľ–ĺ —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–ĺ–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –ł –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–į, —á—ā–ĺ –Ī—č–Ľ–ĺ –ĺ—ā—Ä–į–∂–Ķ–Ĺ–ĺ –≤ —Ä—Ź–ī–Ķ –ĺ—ā–Ķ—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö [–ď—Ä–ĺ–ľ–ĺ–≤ –°. –ź., 2004] –ł –∑–į—Ä—É–Ī–Ķ–∂–Ĺ—č—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ [Steinborn B., 2005]. –í —ā–ĺ –∂–Ķ –≤—Ä–Ķ–ľ—Ź –∑–Ĺ–į—á–ł–ľ–ĺ–Ķ —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –ļ–Ľ–ł—Ä–Ķ–Ĺ—Ā–į —Ā 4,8±1,2 –ī–ĺ 6,2±1,9 –ľ–Ľ/—á/–ļ–≥ –ł —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –Ņ–Ķ—Ä–ł–ĺ–ī–į –Ņ–ĺ–Ľ—É–≤—č–≤–Ķ–ī–Ķ–Ĺ–ł—Ź —Ā 15,2±4,9 —á –ī–ĺ 13,3±4,1 —á, –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–į—é—ā—Ā—Ź –ł –ī–į–Ĺ–Ĺ—č–ľ–ł –ī—Ä—É–≥–ł—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ [Bowdle T. A., Levy R.H., Cutler R.E., 1979]. –≠—ā–ĺ –ĺ–Ī—Ā—ā–ĺ—Ź—ā–Ķ–Ľ—Ć—Ā—ā–≤–ĺ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ķ—ā –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ—Ā—ā—Ć –ļ–ĺ—Ä—Ä–Ķ–ļ—Ü–ł–ł —Ā—É—ā–ĺ—á–Ĺ–ĺ–Ļ –ī–ĺ–∑—č –Ī–į–∑–ĺ–≤–ĺ–≥–ĺ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į –Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–ł —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–ĺ–≤ –Ę–õ–ú. –Ě–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ —ā–į–ļ–∂–Ķ —É—á–ł—ā—č–≤–į—ā—Ć –Ī–ĺ–Ľ–Ķ–Ķ –≤—č—Ā–ĺ–ļ–ł–Ļ —Ä–ł—Ā–ļ –≥–Ķ–ľ–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –ĺ—Ā–Ľ–ĺ–∂–Ĺ–Ķ–Ĺ–ł–Ļ –≤ –≤–ł–ī–Ķ –Ņ–ĺ–ī–į–≤–Ľ–Ķ–Ĺ–ł—Ź —ā—Ä–ĺ–ľ–Ī–ĺ—Ü–ł—ā–į—Ä–Ĺ–ĺ–≥–ĺ –ł –Ľ–Ķ–Ļ–ļ–ĺ—Ü–ł—ā–į—Ä–Ĺ–ĺ–≥–ĺ –ļ—Ä–ĺ–≤—Ź–Ĺ—č—Ö —Ä–ĺ—Ā—ā–ļ–ĺ–≤.
–Ě–Ķ—Ā–ľ–ĺ—ā—Ä—Ź –Ĺ–į –≤—č—Ā–ĺ–ļ–ł–Ļ –Ņ—Ä–ĺ—Ü–Ķ–Ĺ—ā –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—Ź —Ä–Ķ–ľ–ł—Ā—Ā–ł–ł —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –Ņ–ĺ–Ľ—É—á–į—é—Č–ł—Ö —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ—É—é —ā–Ķ—Ä–į–Ņ–ł—é –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–ĺ–ľ –ł —Ą–Ķ–Ĺ–ĺ–Ī–į—Ä–Ī–ł—ā–į–Ľ–ĺ–ľ, –į —ā–į–ļ–∂–Ķ –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–ĺ–ľ –ł –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–ĺ–ľ, –≤ –Ĺ–į—ą–Ķ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –Ĺ–į–Ī–Ľ—é–ī–į–Ľ–į—Ā—Ć –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ –≤—č—Ā–ĺ–ļ–į—Ź —á–į—Ā—ā–ĺ—ā–į –Ĺ–Ķ–Ļ—Ä–ĺ—ā–ĺ–ļ—Ā–ł—á–Ķ—Ā–ļ–ł—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤, –ī–ĺ—Ā—ā–ł–≥–į—é—Č–į—Ź 30 –ł 50% —Ā–Ľ—É—á–į–Ķ–≤ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ. –ü–ĺ—Ā–Ľ–Ķ–ī–Ĺ–Ķ–Ķ, –Ņ–ĺ –ī–į–Ĺ–Ĺ—č–ľ Spina E. —Ā —Ā–ĺ–į–≤—ā. (1996), —Ā–≤—Ź–∑–į–Ĺ–ĺ —Ā —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ–ľ —Ą—Ä–į–ļ—Ü–ł–ł –į–ļ—ā–ł–≤–Ĺ–ĺ–≥–ĺ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—ā–į –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–10, 11–—ć–Ņ–ĺ–ļ—Ā–ł–ī–į, –ĺ–Ī–Ľ–į–ī–į—é—Č–Ķ–≥–ĺ —Ā–ĺ–Ī—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ļ —Ą–į—Ä–ľ–į–ļ–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć—é. –Ē–į–Ĺ–Ĺ—č–Ķ –Ĺ–Ķ–∂–Ķ–Ľ–į—ā–Ķ–Ľ—Ć–Ĺ—č–Ķ —ć—Ą—Ą–Ķ–ļ—ā—č –Ī—č–Ľ–ł –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ—č–ľ–ł –≤ —Ā—ā–į—Ä—ą–Ķ–Ļ –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ–ĺ–Ļ –≥—Ä—É–Ņ–Ņ–Ķ, —á—ā–ĺ —É–ļ–į–∑—č–≤–į–Ķ—ā –Ĺ–į –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ—Ā—ā—Ć –ĺ—Ā—ā–ĺ—Ä–ĺ–∂–Ĺ–ĺ–≥–ĺ –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł—Ź —ć—ā–ł—Ö —Ā—Ö–Ķ–ľ —ā–Ķ—Ä–į–Ņ–ł–ł —É –Ņ–ĺ–∂–ł–Ľ—č—Ö –Ľ—é–ī–Ķ–Ļ.
–Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, —Ā–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ–ĺ–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –ł –Ľ–Ķ–≤–Ķ—ā–ł—Ä–į—Ü–Ķ—ā–į–ľ–į, –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤–į–Ľ—Ć–Ņ—Ä–ĺ–Ķ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –ł –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–į –Ņ–ĺ–ļ–į–∑—č–≤–į–Ķ—ā –≤—č—Ā–ĺ–ļ—É—é —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ļ–į–ļ –≤ –≥—Ä—É–Ņ–Ņ–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –Ľ–ĺ–ļ–į–Ľ—Ć–Ĺ–ĺ –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ—č–ľ–ł, —ā–į–ļ –ł —Ā –≥–Ķ–Ĺ–Ķ—Ä–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł. –°–ĺ–≤–ľ–Ķ—Ā—ā–Ĺ—É—é —ā–Ķ—Ä–į–Ņ–ł—é –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–ĺ–ľ –ł –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ–ĺ–ľ, –į —ā–į–ļ–∂–Ķ –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–ĺ–ľ –ł —Ą–Ķ–Ĺ–ĺ–Ī–į—Ä–Ī–ł—ā–į–Ľ–ĺ–ľ –ľ—č —Ä–į—Ā—Ā–ľ–į—ā—Ä–ł–≤–į–Ķ–ľ –ļ–į–ļ —Ā—Ö–Ķ–ľ—č –Ņ–ĺ–Ľ–ł—ā–Ķ—Ä–į–Ņ–ł–ł –≤—ā–ĺ—Ä–ĺ–≥–ĺ —Ä—Ź–ī–į –≤—č–Ī–ĺ—Ä–į –ł, –Ĺ–į –Ĺ–į—ą –≤–∑–≥–Ľ—Ź–ī, –ĺ–Ĺ–ł –ī–ĺ–Ľ–∂–Ĺ—č –Ĺ–į–∑–Ĺ–į—á–į—ā—Ć—Ā—Ź —Ā –ĺ—Ā–ĺ–Ī–ĺ–Ļ –ĺ—Ā—ā–ĺ—Ä–ĺ–∂–Ĺ–ĺ—Ā—ā—Ć—é —É –Ľ–ł—Ü —Ā—ā–į—Ä—ą–Ķ–Ļ –≤–ĺ–∑—Ä–į—Ā—ā–Ĺ–ĺ–Ļ –≥—Ä—É–Ņ–Ņ—č. –Ě–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –ł–Ĺ–ī—É–ļ—ā–ĺ—Ä–ĺ–≤ –ľ–ł–ļ—Ä–ĺ—Ā–ĺ–ľ–į–Ľ—Ć–Ĺ—č—Ö —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ –Ņ–Ķ—á–Ķ–Ĺ–ł, –≤ —á–į—Ā—ā–Ĺ–ĺ—Ā—ā–ł, –ļ–į—Ä–Ī–į–ľ–į–∑–Ķ–Ņ–ł–Ĺ–į –ł —Ą–Ķ–Ĺ–ĺ–Ī–į—Ä–Ī–ł—ā–į–Ľ–į, –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ķ—ā –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ—Ā—ā—Ć –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł—Ź —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ľ–ĺ–Ĺ–ł—ā–ĺ—Ä–ł–Ĺ–≥–į –Ī–į–∑–ĺ–≤—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ —Ā —Ü–Ķ–Ľ—Ć—é –ļ–ĺ—Ä—Ä–Ķ–ļ—Ü–ł–ł –ł—Ö –ī–ĺ–∑. –õ–Ķ–≤–Ķ—ā–ł—Ä–į—Ü–Ķ—ā–į–ľ –ł –Ľ–į–ľ–ĺ—ā—Ä–ł–ī–∂–ł–Ĺ –≤–Ľ–ł—Ź–Ĺ–ł—Ź –Ĺ–į –ļ–ł–Ĺ–Ķ—ā–ł–ļ—É –Ī–į–∑–ĺ–≤—č—Ö –ź–≠–ü –Ĺ–Ķ –ĺ–ļ–į–∑—č–≤–į–Ķ—ā.
–õ–ł—ā–Ķ—Ä–į—ā—É—Ä–į
1. –ď—Ä–ĺ–ľ–ĺ–≤ –°.–ź. –ö–ĺ–Ĺ—ā—Ä–ĺ–Ľ–ł—Ä—É–Ķ–ľ–į—Ź —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł—Ź / –°.–ź. –ď—Ä–ĺ–ľ–ĺ–≤. – –°–ü–Ī.: –ė–ė–¶ –Ď–į–Ľ—ā–ł–ļ–į, 2004. – 302 —Ā.
2. –ó–Ķ–Ĺ–ļ–ĺ–≤ –õ. –†. –§–į—Ä–ľ–į–ļ–ĺ—Ä–Ķ–∑–ł—Ā—ā–Ķ–Ĺ—ā–Ĺ—č–Ķ —ć–Ņ–ł–Ľ–Ķ–Ņ—Ā–ł–ł / –õ. –†. –ó–Ķ–Ĺ–ļ–ĺ–≤, –ź. –ď. –ü—Ä–ł—ā—Ć–ļ–ĺ. – –ú.: –ú–ē–Ē–Ņ—Ä–Ķ—Ā—Ā––ł–Ĺ—Ą–ĺ—Ä–ľ, 2003. – 207 —Ā.
3. Abend N. S. Intravenous levetiracetam terminates refractory focal status epilepticus / N. S. Abend, N. Florance, R. S. Finkel, et al. // Neurocrit. Care. – 2008 (abstract).
4. Bowdle T. A. Effect of carbamazepine on valproic acid kinetics in normal subjects / T. A. Bowdie, R. H. Levy, R. E. Cutler // Clin. Pharmacol. Ther. – 1979. – Vol. 26, N 5. – P. 629 – 634.
5. Brodie M. J. Comparison of levetiracetam and controlled–release carbamazepine in newly diagnosed epilepsy / M. J. Brodie, E. Perucca, P. Ryvlin, et al. // Neurology. – 2007. – Vol. 68, N. 6. – P. 402 – 408.
6. Ferrie C. Therapeutic interaction of lamotrigine and sodium valproate in intractable myoclonic epilepsy / C. D. Ferrie, C. P. Panayiotopoulos // Seizure. – 1994. – Vol. 3, N. 2. – P. 157 – 159.
7. Finsterer J. Severe, isolated thrombocytopenia under polytherapy with carbamazepine and valproate / J. Finsterer, G. Pelzl, B. Hess // Psychiatry Clin. Neurosci. – 2001. – Vol. 55. – P. 423 – 426.
8. Gidal B. E. Evaluation of valproic acid dose and concentration effects on lamotrigine pharmacokinetics: implications for conversion to lamotrigine monotherapy / B. E. Gidal, R. Sheth, J. Parnell // Epilepsy Res. – 2003. – Vol. 57, N. 2 – P. 85 – 93.
9. Gidal B. E. Effect of levetiracetam on the pharmacokinetics of adjunctive antiepileptic drugs: a polled analysis of data from randomized clinical trials / Gidal BE, Baltes E, Otoul C, Perucca E. // Epilepsy Res. – 2005. – Vol. 64, N. 1 – 2. – P 1 – 11.
10. Glauser T. A. Double–blind placebo–controlled trial of adjunctive levetiracetam in pediatric partial seizures / T. A. Glauser, R. Avala, R. D. Elterman, et al. // Nat. Clin. Pract. Neurol. – 2006. – Vol. 11, N. 2. – P. 596 – 597.
11. Kumar S. P. Levetiracetam as add–on therapy in generalised epilepsies / S. P. Kumar, P. E. Smith // Seizure. – 2004. – Vol. 13, N. 7. – P. 475 – 477.
12. Labate A. Levetiracetame in patients with generalized epilepsy and myoclonic seizures: an open label study / A. Labate, E. Colosimo, A. Gambardelaa // Seizure. – 2006. – Vol. 3, N. 3. – P. 214 – 218.
13. Lucas P. T. An epilepsy mutation in the B1 subunit of the voltage–gates sodium channel results in reduced channel sensitivity to phenytoin / P. T. Lucas, L. S. Meadows, J. Nicholls, D. S. Ragsdale // Epilepsy Res. – 2005. – Vol. 64, N. 3 – P. 77 – 84.
14. Mataringa M I. Does lamotrigine influence valproate concentrations? / M. I. Mataringa, T. W. May, B. Rambeck // Ther. Drug Monit. – 2002. – Vol. 24, N 5. – P. 631 – 636.
15. McCabe P. H. Effect of divalproex–lamotrigine combination therapy in frontal lobe seizures / P. H. McCabe, C. D. McNew, N. C. Michel // Arch. Neurol. – 2001. – Vol. 58, N. 8. – P. 1264 – 1268.
16. Otoul C. Lack of pharmacokinetic interaction of levetiracetam on carbamazepine, valproic acid, topiramate, and lamotrigine in children with epilepsy // Otoul C., De Smedt H., Stockis A. // Epilepsia. – 2007. – Vol. 48, ‚ĄĖ 11. – P. 2111–2115.
17. Pellock J. M. A rational guide to routine blood monitoring in patients receiving antiepileptic drugs / J. M. Pellock, L. J. Willmore // Neurology. – 1991. – Vol. 41, N. 7. – P. 961 – 964.
18. Perucca E. The ideal pharmacokinetic properties of an antiepileptic drugs: how close does levetiracetame come? / E. Perucca, S. I. Johannessen // Epileptic. Disord. – 2003. – Vol. 5, Suppl. 1. – S. 17 – 26.
19. Pisani F. The efficacy of valproate–lamotrigine comedication in refractory complex partial seizures: evidence for a pharmacodynamic interaction / F. Pisani, G. Oteri, M. F. Russo, et al. // Epilepsia. – 1999. – Vol. 40, N. 8. – P. 1141 – 1146.
20. Ragozzino D. Rundown of GABA type A receptors is a dysfunction associated with human drug–resistant mesial temporal lobe epilepsy / D. Ragozzino, E. Palma, S. Di Anelantonio, et al. // PNAS. – 2005. – Vol. 42. – P. 15219 – 15223.
21. Schulze–Bonhage A. Termination of complex partial status epilepticus by intravenous levetiracetam – a case report / A. Schulze–Bonhage, S. Hefft, B. Oehl // J. Neurol. Neurosurg. Psychiatry. – 2007. – Vol. 12 (abstract).
22. Sharpe D. V. Levetiracetam monotherapy in juvenile myoclonic epilepsy / D. V. Sharpe, A. D. Patel, B. Abou–Khalil, G. M. Fenichel // Seizures. – 2008. – Vol. 17, N. 1. – P. 64 – 68.
23. Spina E. Clinically significant pharmacokinetic drug interactions with carbamazepine / E. Spina, F. Pisani, E. Perucca // Clin. Pharmacokinet. – 1996. – Vol. 31, N. 3. – P. 198 – 214.
24. Steinborn B. Pharmacokinetics interactions of carbamazepine with some antiepileptic drugs during epilepsy treatment in children and adolescents/ B. Steinborn // Rocz. Ackad. Med. Bialymst. – 2005. – Vol. 50. – Suppl. 1. – P. 9 – 15.
25. Tanaka E. Clinically significant pharmacokinetic drug interactions between antiepileptic drugs / E. Tanaka // J. Clin. Pharm. Ther. – 1999. – Vol. 24. – P. 87 – 92.
26. Trabacca A. Levetiracetam in nonconvulsive status epilepticus in childhood: a case report / Trabacca A., Profice P., Costanza M. C., et al. // J. Child. Neurol. – 2007. – Vol. 22, N. 5. – P. 639 – 641.
27. Verrotti A. Levetiracetam in juvenile myoclonic epilepsy: long–term efficacy in newly diagnosed adolescents / A. Verrotti, C. Cerminara, G. Coppola G, et al.// Dev. Med. Child. Neurol. – 2008. – Vol. 50, N. 1. – P. 29 – 32.
28. Warner A. Standarts of laboratory practice: antiepileptic drugs monitoring / A. Warner, M. Privitera, D. Bates // Clinincal Chemistry. – 1998. – Vol. 44, N. 5. – P. 1085 – 1095.
29. Zhou B. Effects of levetiracetam as an add–on therapy on cognitive function and quality of life in patients with refractory partial seizures / Zhou B., Zhang Q., Tian L., et al. // Epilepsy Behav. – 2008. – Vol. 12, N. 2. – P. 305 – 310.












