В настоящее время наряду с ПИТРС первого ряда (интерфероны-бета и глатирамера ацетат) все шире используются препараты нового поколения, причем особое внимание уделяется средствам для перорального приема. Финголимод (Ф) принадлежит к новой фармакологической группе, является модулятором сфингозин-1-фосфат (S1P)-рецепторов. Действие Ф направлено на предотвращение выхода лимфоцитов из лимфоузлов, что ведет к уменьшению проникновения потенциально агрессивных клеток в ЦНС [2]. По данным исследования FREEDOMS, применение Ф привело к снижению числа обострений и риска нарастания инвалидизации, а также уменьшению объема и числа воспалительных очагов, накапливающих гадолиний, и новых Т2 очагов через 6, 12 и 24 мес. терапии [6–8].
Увеличение числа больных РС, получающих лечение Ф, делает актуальным вопрос о том, как изменяется состояние пациента после прекращения приема Ф. В настоящее время имеется лишь небольшое число наблюдений, пока не позволяющее ответить на вопрос о степени риска возобновления активности воспалительного процесса у таких больных. В Центре рассеянного склероза Московской области накоплены результаты наблюдения больных РС, прерывавших терапию Ф без медицинских показаний.
Материалы и методы
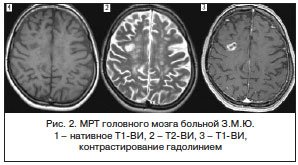
В Центре рассеянного склероза Московской области наблюдаются 30 пациентов (9 мужчин и 21 женщина) в возрасте от 20 до 44 лет (средний возраст 31,61±0,95 лет), получающих терапию Ф в течение 1–3 лет, при этом общий срок наблюдения составил 48,5 пациентолет.
Продолжительность заболевания до начала терапии Ф находилась в пределах 2–10 лет, общее число перенесенных обострений до начала лечения – от 2 до 16 (среднее число обострений до терапии – 7,2±0,6), среднее число обострений в год – 2,6±0,2. Предшествующая терапия: глатирамера ацетат (ГА) – 8; интерферон-бета-1а 30 мкг (ИНФ1а30) – 2, интерферон-бета-1б (ИНФ1б) – 11, у 4 проводилась неоднократная смена препаратов (ГА, ИНФ1б, интерферон-бета-1а 44 мкг /ИНФ1а44) в связи с неэффективностью, у 1 из них в анамнезе 2 курса митоксантрона, у 1 – годичный курс натализумаба (НАТ). У 5 пациентов, не получавших ранее терапию ПИТРС, диагностировано активное течение РС с частыми экзацербациями (3 и более обострений за предшествующие 2 года). Средний уровень EDSS до старта терапии Ф – 2,65±0,2 балла (от 1,5 до 6,0). У всех пациентов применялся стандартный режим дозирования – 1 капсула 0,5 мг внутрь 1 р./сут вне зависимости от времени приема пищи.
В октябре–декабре 2013 и феврале–марте 2014 г. у 27 пациентов без медицинских показаний произошли повторные перерывы в приеме препарата на срок от 3 нед. до 2,5 мес. У 1/3 пациентов перерыв в лечении Ф привел к развитию обострения.
Результаты
Демографические и клинические данные наблюдаемых пациентов приведены в таблице 1. В период лечения Ф у 30 пациентов было зарегистрировано одно обострение, проявившееся нарастанием уровня EDSS на 1 балл, у 2 – появление клинически «немых» очагов на МРТ, накапливающих гадолиний. Этим пациентам была проведена пульс-терапия метилпреднизолоном (МП) 5000 мг на курс.
На момент перерыва терапии Ф уровень инвалидизации в группе составил 2,55±0,2 балла EDSS, причем у 2 произошло нарастание оценки на 0,5 балла, у 7 – снижение на 0,5–3,5 балла (в среднем – 2,43±0,44 балла), у 21 – не изменилось.
У 27 пациентов произошел перерыв в приеме Ф без медицинских показаний на срок от 3 нед. до 2,5 мес., 3 пациента продолжали прием Ф без перерыва. В период прекращения терапии Ф у 12 пациентов было зарегистрировано обострение РС, проявившееся нарастанием оценки EDSS не менее чем на 1 балл или увеличением оценки по двум функциональным шкалам на 1 балл по каждой. У 7 из них проведена МРТ и выявлено появление от 2 до 15 очагов, накапливающих гадолиний. Оценка EDSS до перерыва терапии составляла 2,88±0,42, в период обострения – 3,79±0,37 балла (p>0,05).
У 3 пациентов клинических признаков обострения зарегистрировано не было, но в связи с ухудшением самочувствия им была выполнена МРТ головного мозга и выявлены «немые» активные очаги, накапливающие контраст. Пациентам, имевшим клинические и МРТ-признаки обострения, проведена пульс-терапия МП в дозе 5000 мг на курс с положительным эффектом.
При дальнейшем наблюдении за состоянием пациентов после возобновления терапии Ф в течение последующих 3 мес. у 6 из них зарегистрировано обострение, причем у 4 из них экзацербация РС была повторной, учитывая обострение в предшествующий период отмены Ф, а у 2 на МРТ обнаружены очаги, накапливающие гадолиний. Оценка по EDSS через 3 мес. после возобновления терапии Ф составила 3,17±0,42 балла, т. е. зарегистрировано нарастание уровня инвалидизации по сравнению с периодом до прекращения терапии Ф.
В качестве иллюстрации приводим следующий клинический случай.
Пациентка З.М.Ю., 24 года. Дебют заболевания – в 20 лет (04.2009 г.), проявившийся правосторонней гипестезией лица. Через 1 год и 2 мес. (06.2010) появилась дизартрия. По данным МРТ головного мозга – множественные очаги демиелинизации, после введения контраста определялось накопление контрастного вещества в виде диффузных очагов и «полуколец» очагами обеих лобных, височных и левой теменной долей, в базальных ядрах слева. Больной выставлен диагноз «рассеянный склероз, ремитирующее течение», проведен курс кортикостероидной терапии.
С августа 2010 г. получала терапию препаратом интерферона-бета-1б 9,6 млн МЕ п/к через день. На фоне терапии с 08.2010 по 06.2012 г. было зарегистрировано 4 обострения, причем 2 из них (10.2011 и 06.2012 г.) проявились генерализованными эпилептическими приступами.
С 07.2012 г. пациентка переведена на терапию Ф. За время терапии Ф обострений не отмечалось. Уровень EDSS снизился с 3,0 до 1,5 баллов. Переносимость препарата была удовлетворительной. Через 3 мес. от начала терапии отмечено транзиторное повышение показателей трансаминаз (АЛТ – 68 ЕД/л, ГГТ – 59 ЕД/л), но через месяц показатели нормализовались.
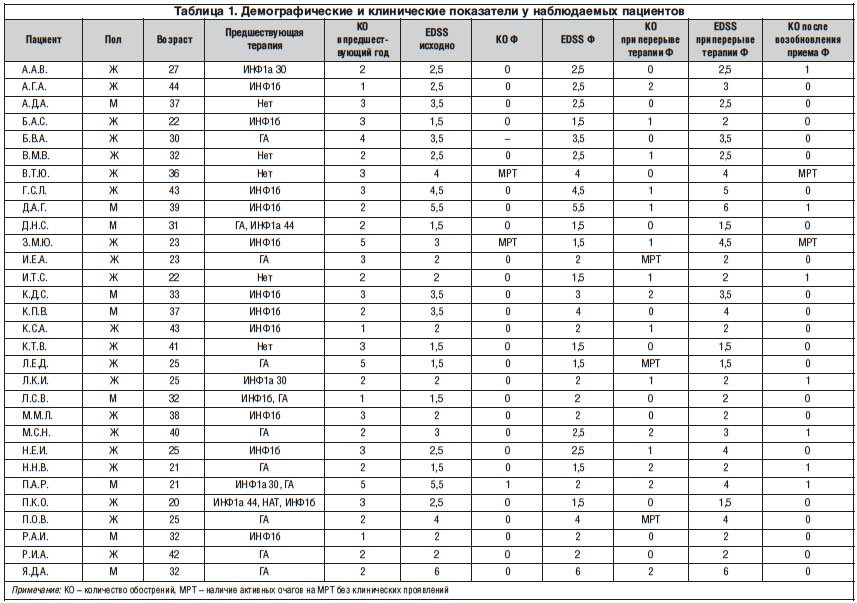
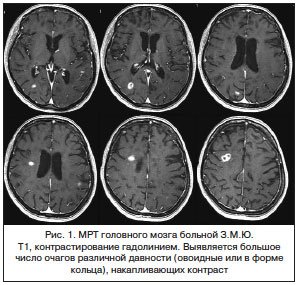
С 04.10.2013 г. – вынужденный перерыв в терапии. 07.11.2013 г. зарегистрировано обострение, проявившееся нарастанием пирамидной недостаточности (3 балла), координаторными нарушениями (2 балла), нарушением функции тазовых органов (1 балл), явлениями энцефалопатии – нарушение ориентации, галлюцинации, эмоциональная неустойчивость, когнитивными расстройствами (4 балла), EDSS – 4,5 баллов. При исследовании теста PASAT (MSFS) больная правильно ответила на 17 (28%) вопросов, изначальный уровень – 48 (80%) верных ответов. С 17.11.2013 по 22.11.2013 г. проведен курс кортикостероидной терапии МП в суммарной дозе 5000 мг, без эффекта. МРТ головного мозга от 04.12.2013 г. – многоочаговое демиелинизирующее поражение белого вещества головного мозга с супра- и инфратенториальной локализацией очагов, вовлечением в процесс мозолистого тела. Наиболее крупные очаги определяются в правой заднелобно-теменной области (17х12 мм), в правой теменно-затылочной области (10х10 мм), в правой затылочной области (8х4 мм), в перивентрикулярном веществе справа (7х5 мм), в перечисленных очагах определяется кольцевидный тип накопления контраста. Также визуализируются очаги патологического гомогенного контрастирования в субкортикальном белом веществе левых лобной, теменной и височных долей, правой височной доли. Общее количество активных очагов – 11 (рис. 1). На рисунке 2 показан крупный активный очаг, накапливающий контраст, который отчетливо выявляется на нативных Т1-взвешенных изображениях (ВИ), что указывает на раннее грубое повреждение белого вещества правой гемисферы, которое обычно выявляется лишь после многолетней эволюции очагов при РС.
Был проведен повторный курс пульс-терапии МП в суммарной дозе 5000 мг с минимальным положительным эффектом. С 12.12.2013 г. проведено 4 сеанса плазмафереза. На фоне терапии уменьшился парапарез, восстановились функции тазовых органов, уменьшились когнитивные нарушения, оценка по EDSS снизилась до 3,5 баллов. Больная при выписке полностью ориентирована в месте и времени, галлюцинаций нет, но сохраняются снижение внимания, памяти, эйфория, при исследовании теста PASAT (MSFS) – 16 (27%) правильных ответов.
Пациентка возобновила прием Ф в стандартной дозе. Рестарт терапии – без особенностей.
В данном случае у пациентки З.М.Ю. по тяжести обострения (нарастание оценки EDSS на 2,5 балла), наличию выраженного нарушения когнитивных функций, что ранее при предыдущих обострениях никогда не фиксировалось, а также выявлению множества очагов, накапливающих гадолиний, на МРТ головы можно говорить не просто о возобновлении течения РС, а о ребаунд-феномене.
Повторный перерыв в терапии 30 пациентов произошел спустя 3–6 мес. с момента возобновления терапии Ф. У 9 из 30 больных возникло обострение, зафиксированное клинически и подтвержденное данными МРТ. Развитие обострения возникало спустя 2–3 нед. после прекращения терапии. Оценка по EDSS до обострения составила 2,72±0,48, в период экзацербации – 3,88±0,42 балла. Этим пациентам проведена пульс-терапия МП в дозе 5000 мг на курс с положительным эффектом. Через 3 мес. после возобновления терапии оценка по EDSS составляла у данных больных 3,17±0,54. Таким образом, при повторной отмене Ф вновь зарегистрировано нарастание уровня инвалидизации по сравнению с периодом до прекращения терапии Ф. В этот период одна пациентка перенесла повторную экзацербацию.
Учитывая опыт первой временной отмены Ф, при повторном прекращении терапии всем пациентам давалась рекомендация проведения превентивного курса МП в дозе 5000 мг на курс, эту рекомендацию выполнили только 7 пациентов, причем несмотря на это, у 3 из них произошло обострение.
Обсуждение
По мере увеличения числа пациентов, получающих терапию ПИТРС, увеличивается число лиц, у которых происходит отмена препарата или смена лечения в связи с непереносимостью или отсутствием ответа на препарат. Проведенные исследования показали примерно одинаковую эффективность и переносимость двух наиболее распространенных групп ПИТРС – глатирамера ацетата и интерферонов-бета [9, 10]. Прекращение терапии этими ПИТРС приводило к возобновлению течения с активностью, соответствующей периоду до начала терапии.
Два новых ПИТРС – НАТ и Ф – превосходят предыдущую генерацию по эффективности. Учитывая необходимость переоценки целесообразности продолжения терапии НАТ после 2 лет терапии, вопрос о прекращении или переключении на другой препарат стоит достаточно остро, учитывая возрастающий риск развития прогрессирующей мультифокальной лейкоэнцефалопатии. По мнению P.W. O’Connor и соавт. [11], прекращение терапии НАТ приводит к возобновлению активности РС, примерно соответствующей таковой до начала лечения НАТ. С ними не согласны K.W. Rammohan и соавт. [12], считающие, что правильнее это расценивать как обострение течения РС. В настоящее время такое обострение при отмене терапии НАТ обозначают термином «воспалительный синдром восстановления иммунитета».
Причинами прекращения терапии Ф чаще всего являются побочные действия, частота возникновения которых существенно ниже, чем при использовании других ПИТРС, и вопросы экономической доступности препарата, в частности – взаимодействие со страховыми компаниями в США [13].
Имеется ряд описаний отдельных случаев отмены Ф. Так, A. Ghezzi с соавт. [14] описали 2 случая резкого ухудшения состояния, повторных обострений с появлением множественных очагов, накапливающих гадолиний, с выраженными когнитивными и очаговыми нарушениями у пациенток, у которых исходно ПИТРС первой линии (ГА и ИФН) были неэффективны. Авторы связали такое ухудшение течения РС у данных пациенток с массивным выходом аутоагрессивных лимфоцитов из лимфоузлов после отмены Ф. Среди наблюдавшихся нами пациентов у 4 была множественная неэффективность ПИТРС первого ряда, при этом лишь у 1 из них возникло обострение.
Сходное наблюдение привели J.B. Havla и соавт. [15]. У пациента с исходно невысокой активностью РС, недостаточной эффективностью Ф ими описана экзацербация через 2 нед. после отмены Ф по медицинским показаниям в связи с обнаружением меланомы, затем спустя 3 мес. – тяжелое обострение с появлением более 20 очагов, накапливающих гадолиний. Авторы провели параллель с ухудшением состояния пациентов после отмены НАТ с так называемым «воспалительным синдромом восстановления иммунитета». P.W. O'Connor и соавт. [16], проанализировавшие этот феномен, отмечают, что такое обострение течения чаще возникало у пациентов с исходно агрессивно протекающим РС. Другими предвестниками такого обострения РС были молодой возраст и относительно небольшая длительность терапии НАТ [17, 18].
B. Hakiki и соавт. [19], наблюдавшие 6 пациентов с отменой терапии Ф, отметили восстановление активности РС у 5 и резкое обострение через 3 мес. после отмены с появлением более 25 очагов, накапливающих гадолиний, у 1 пациента. Авторы отметили, что частота обострений после отмены Ф у пациентов была ниже, чем до начала терапии Ф, но, возможно, это связано с тем, что они были переведены на другой ПИТРС.
E. Piscolla и соавт. [20] сообщили о наблюдении за пациенткой с началом РС в детском возрасте, агрессивным течением и множественной неэффективностью ПИТРС первого ряда. Назначенная в течение полугода терапия Ф также была неэффективна, но ее отмена вызвала резкое обострение с появлением более 35 очагов, накапливающих гадолиний. Под нашим наблюдением находились двое с дебютом РС в детстве. У одной из них обострения не зарегистрировано при обеих отменах. У другого с изначально агрессивным течением РС (5 обострений в год), высокой эффективностью Ф возникли 2 обострения через 30 и 14 сут после отмены с нарастанием оценки по EDSS с 2 до 4 баллов и обратным регрессом до исходного уровня после курсов МП и возобновления терапии Ф.
Заключение
Таким образом, если в период лечения Ф у 30 пациентов было отмечено лишь одно клинически зарегистрированное обострение и 2 случая появления очагов, накапливающих гадолиний, на МРТ головного мозга, то в период временного прекращения приема Ф возникло 21 клиническое обострение, причем 4 пациента перенесли по 2 обострения в каждый из периодов прерывания терапии. Еще у 3 пациентов обнаружены клинически «немые» активные очаги, накапливающие гадолиний, на МРТ. Частота экзацербации, таким образом, составила 40%, а развития ребаунд-феномена – 3,3%. Приведенное наблюдение демонстрирует не только высокую эффективность терапии Ф, но и значительный риск экзацербации при внезапном прекращении терапии. К сожалению, предпринятые попытки снижения риска обострения превентивным назначением МП не дали существенного результата. В наших наблюдениях мы не производили переключения пациентов на другой ПИТРС (ИФН, ГА), поскольку ожидали быстрейшего возобновления терапии Ф, однако в случае постоянного прекращения терапии Ф, очевидно, следует немедленно назначить пациенту другой ПИТРС, не дожидаясь выхода на 14–72 сут отмены Ф активных лимфоцитов из депо. Полученный нами опыт терапии РС с использованием Ф позволяет подчеркнуть необходимость проведения длительной и непрерывной терапии этим препаратом.
Литература
1. Frohman E.M., Racke M.K., Raine C.S. Multiple sclerosis – the plaque and its pathogenesis // N. Engl. J. Med. 2006. Vol. 354 (9). P. 942–955.
2. Chun J., Hartung H.-P. Mechanism of Action of Oral Fingolimod (FTY720) in Multiple Sclerosis // Clin. Neuropharmacol. 2010. Vol. 33 (2). P. 91–101.
3. Peterson L.K., Fujinami R.S. Inflammation, demyelination, neurodegeneration and neuroprotection in the pathogenesis of multiple sclerosis // J. Neuroimmunol. 2007. Vol. 184. P. 37–44.
4. Compston A., Coles A. Multiple sclerosis // Lancet. 2002. Vol. 359 (9313). P. 1221–1231.
5. Frohman E.M., Filippi M., Stuve O. et al. Characterizing the mechanisms of progression in multiple sclerosis: evidence and new hypotheses for future directions // Arch. Neurol. 2005. Vol. 62 (9). P. 1345–1356.
6. Kappos L., Radue E.W., O'Connor P., Polman C. et al. FREEDOMS Study Group. A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis // N. Engl. J. Med. 2010. Vol. 362 (5). P. 387–401.
7. Devonshire V., Havrdova E., Radue E.W. et al. FREEDOMS study group. Relapse and disability outcomes in patients with multiple sclerosis treated with fingolimod: subgroup analyses of the double-blind, randomised, placebo-controlled FREEDOMS study // Lancet Neurol. 2012. Vol. 11 (5). P. 420–428.
8. Radue E.W., O'Connor P., Polman C.H. et al. FTY720 Research Evaluating Effects of Daily Oral Therapy in Multiple Sclerosis (FREEDOMS) Study Group. Impact of fingolimod therapy on magnetic resonance imaging outcomes in patients with multiple sclerosis // Arch. Neurol. 2012. Vol. 69 (10). P. 1259–1269.
9. Mikol D.D., Barkhof F., Chang P. et al. Comparison of subcutaneous interferon beta-1a with glatiramer acetate in patients with relapsing multiple sclerosis (the REbif vs Glatiramer Acetate in Relapsing MS Disease [REGARD] study): a multicentre, randomised, parallel, open-label trial // Lancet Neurol. 2008. Vol. 7. P. 903–914.
10. O’Connor P., Filippi M., Arnason B. et al. 250 microg or 500 microg interferon beta-1b versus 20 mg glatiramer acetate in relapsingremitting multiple sclerosis: a prospective, randomised, multicentre study // Lancet Neurol. 2009. Vol. 8. P. 889–897.
11. O’Connor P.W., Goodman A., Kappos L. et al. Disease activity return during natalizumab treatment interruption in patients with multiple sclerosis // Neurology. 2011. Vol. 76. P. 1858–1865.
12. Rammohan K.W., Ortega M.R., Delgado S.R., Tornes L. Disease activity return during natalizumab treatment interruption in patients with multiple sclerosis // Neurology. 2011. Vol. 77. P. 1930–1931.
13. Hanson K.A., Agashivala N., Wyrwich K.W. et al. Treatment selection and experience in multiple sclerosis: survey of neurologists // Patient Preference and Adherence. 2014. Vol. 8. P. 415–422.
14. Ghezzi A., Rocca M. A., Baroncini D. et al. Disease reactivation after fingolimod discontinuation in two multiple sclerosis patients // J. Neurol.
15. Havla J.B., Pellkofer H.L., Meinl I. et al. Rebound of Disease Activity After Withdrawal of Fingolimod (FTY720) Treatment // Arch. Neurol. 2012. Vol. 69 (2). P. 262–264.
16. O'Connor P.W., Goodman A., Kappos L. et al. Disease activity return during natalizumab treatment interruption in patients with multiple sclerosis // Neurology. 2011. Vol. 76 (22). P. 1858–1865.
17. Miravalle A., Jensen R., Kinkel R.P. Immune reconstitution inflammatory syndrome in patients with multiple sclerosis following cessation of natalizumab therapy // Arch. Neurol. 2011. Vol. 68. P. 186–191.
18. Vellinga M.M., Castelijns J.A., Barkhof F. et al. Postwithdrawal rebound increase in T2 lesional activity in natalizumab-treated MS patients // Neurology. 2008. Vol. 70 (13 Pt 2). P. 1150–1151.
19. Hakiki B., Portaccio E., Giannini M. et al. Withdrawal of fingolimod treatment for relapsing-remitting multiple sclerosis: report of six cases // Multiple Sclerosis. J. 0 (0). P. 1–4.
20. Piscolla E., Hakiki B., Pasto L. et al. Rebound after Fingolimod suspension in a pediatric-onset multiple sclerosis patient // J. Neurol.












