Мигрень неизлечима в силу своей наследственной природы, поэтому основной целью лечения мигрени является поддержание высокого качества жизни пациента.
Эффективное лечение мигрени начинается с установления диагноза и проведения дифференциальной диагностики заболевания. В этом смысле неоценимую помощь практическому врачу оказывает международная классификация головной боли (ГБ). Лечение специфическими антимигренозными средствами должно начинаться только после установления диагноза, в противном случае эти препараты не будут эффективны или даже способны нанести вред здоровью пациента. Например, остро возникшая вследствие транзиторной ишемической атаки (ТИА) или субарахноидального кровоизлияния ГБ может напоминать мигрень и даже регрессировать в результате назначения триптанов, однако их сосудосуживающее воздействие может привести к усугублению неврологической симптоматики и возникновению ишемического инсульта.
Пациент, страдающий периодическими головными болями значительной интенсивности, сопровождающимися тошнотой и рвотой (особенно при учащении и удлинении приступов) обычно испытывает серьезное беспокойство о своем здоровье, предполагая, что причиной является опухоль, сосудистая аневризма или какое–либо другое «смертельное» заболевание. Важнейшей задачей врача является проведение информационной беседы о том, что такое мигренозная ГБ, о ее течении, благоприятном прогнозе заболевания и отсутствии у пациента фатального органического заболевания. Подобная беседа направлена на снятие дистресса, нормализацию психического состояния больного и имеет важное значение для успеха будущего лечения. В то же время пациент должен быть проинформирован о том, что мигрень является неизлечимым заболеванием в силу своей наследственной природы. В связи с этим основной целью лечения является поддержание высокого качества жизни у пациента с мигренью путем обучения его быстро, эффективно и безопасно купировать мигренозную ГБ и ознакомление с целым рядом мероприятий, направленных на урежение частоты, интенсивности и длительности приступов.
Необходимым условием поставленной цели является сотрудничество врача и пациента, а также активное участие последнего в собственном лечении. Пациенту рекомендуется вести дневник ГБ, где в течение 2–3 мес. (на период обследования и лечения) необходимо регистрировать частоту, интенсивность, длительность ГБ, используемые лекарственные средства, день менструального цикла, а также желательно отмечать провоцирующие факторы и сопутствующие симптомы. В процессе лечения дневник может наглядно и достоверно демонстрировать его эффективность.
Пациенты с мигренью имеют повышенную чувствительность к самым разнообразным внешним и внутренним факторам: гормональным колебаниям, пищевым, факторам окружающей среды, сенсорным стимулам, стрессу [3]. В таблице 1 представлены провоцирующие факторы – триггеры мигрени.
Выявление у пациента специфичных для него провоцирующих факторов и избегание их во многом может способствовать снижению частоты приступов.
Анализ коморбидности является одним из важнейших моментов выработки терапевтической тактики [7]. С одной стороны, коморбидные нарушения могут наряду с основным заболеванием существенным образом влиять на качество жизни пациента, что обязательно должно быть учтено в комплексной терапии, с другой – могут определять показания или предпочтения, а также противопоказания при выборе тех или иных препаратов и путей их введения. Наличие у пациента кардиоваскулярных нарушений, особенно лабильной артериальной гипертензии, стенокардии или ишемической болезни сердца является противопоказанием для использования триптанов и препаратов эрготамина. При сочетании мигрени с эпилепсией и инсультом преимущество имеют вальпроаты. Наличие у пациента с мигренью таких коморбидных заболеваний, как синдром Рейно, депрессии, тревоги или паники, определяет предпочтительный выбор антидепрессантов. Коморбидные мигрени заболевания представлены в таблице 2.
В.В. Осиповой [2] был уточнен перечень коморбидных мигреней заболеваний с точки зрения их наибольшей встречаемости и влияния на течение мигрени и качество жизни больных. К наиболее значимым для качества жизни больных с мигренью следует отнести: депрессию, нарушения сна, дисфункцию перикраниальных мышц, гипервентиляционный синдром, панические атаки и головные боли напряжения.
Самыми последними, но, несомненно, наиболее важными этапами является выбор средства для лечения приступа и назначение при необходимости профилактической терапии.
Лечение приступа мигрени
(абортивная терапия)
Основная цель лечения приступа мигрени состоит не только в устранении ГБ и сопутствующих симптомов, но и в быстром восстановлении дееспособности пациента и повышении качества его жизни. Требования, предъявляемые к лекарственному средству для лечения мигрени, перечислены в таблице 3.
Для лечения приступов мигрени (абортивная терапия) используют как препараты с неспецифическим, так и специфическим механизмом действия. Препараты с неспецифическим механизмом действия способны уменьшать болевой синдром и сопутствующие симптомы не только при мигрени, но и при других болевых синдромах. Препараты со специфическим механизмом – производные эрготамина и триптаны эффективны только при мигренозной головной боли. Наряду с этим используются комбинированные препараты, содержащие как анальгетики неспецифического действия, кофеин, так и специфического действия (эрготамин), а также противорвотные вспомогательные средства.
Правильный выбор препарата для лечения приступа является сложной задачей и зависит от интенсивности и длительности самого приступа, сопровождающих симптомов, сопутствующих заболеваний, прошлого опыта применения препаратов, наконец, их стоимости. Существуют два методических подхода к выбору препарата – ступенчатый и стратифицированный [1]. При ступенчатом подходе лечение начинают с самых дешевых и наименее эффективных препаратов: первая ступень – обычные анальгетики (парацетамол или ацетилсалициловая кислота) и НПВП. Если пробное лечение не было эффективным или препараты перестали быть эффективными через какое–то время, то переходят ко второй ступени: лечению комбинированными препаратами (спазмалгон, пенталгин, каффетин, кафергот и др.). Третьей ступенью является специфическое противомигренозное лечение с использованием как селективных агонистов 5НТ1 рецепторов – триптанов, так и неселективных агонистов 5НТ1 рецепторов препаратов эрготамина. Следует отметить, что при частом и длительном использовании анальгетиков и особенно комбинированных препаратов происходит привыкание и формирование анальгетической зависимости, что приводит к хронификации болевого синдрома и трансформации мигрени в хроническую форму. Именно ступенчатый подход с необоснованно длительным и почти ежедневным использованием из–за малой эффективности анальгетиков и комбинированных препаратов может привести к абузусной ГБ. Второй опасностью ступенчатого подхода к лечению является тот факт, что пациентам с тяжелыми приступами, сопровождающимися тошнотой и рвотой, вообще не следует идти по пути постепенного подбора препаратов. Такое лечение будет заведомо не эффективным, больной и врач останутся неудовлетворенными результатами лечения, а поиск и постоянная замена препарата сделает лечение также и дорогостоящим. В связи с этим для подбора лечения предлагается стратифицированный подход. Согласно этому подходу первично проводится оценка тяжести приступа на основании анализа интенсивности боли и степени нарушения трудоспособности. У пациентов с более легкими приступами весьма вероятно, что препараты первой ступени окажутся эффективными. Пациентам с тяжелыми приступами лечение сразу следует начинать с препаратов более высокого уровня – например, триптанов. Это позволит избежать во многих случаях вызова скорой помощи, быстро восстановить трудоспособность и повысить уровень самоконтроля у пациента, уменьшить чувство страха и беспомощности перед очередной атакой. Пациенты с затяжными тяжелыми приступами, мигренозным статусом нуждаются в госпитализации и проведении лечения в условиях неврологического стационара или реанимации.
Действие селективных агонистов 5–НТ1b и 5НТ1d–рецепторов триптанов основано как на нейрогенном, так и сосудистом действии. Триптаны подавляют выход из периферических окончаний тройничного нерва вазоактивных веществ, вызывающих вазодилатацию, и стимуляцию болевых рецепторов нервных окончаний тройничного нерва, а также вызывают сокращение расширенных во время приступа сосудов, что препятствует экссудации и раздражению болевых рецепторов альгогенными веществами, проникающими из плазмы крови в периваскулярное пространство.
Первым селективным агонистом 5–НТ 1b/d рецепторов был суматриптан. Его клиническое использование началось с 1991 года. В последующем появились: золмитриптан, наратриптан, ризатриптан, элетриптан, алмотриптан, фроватриптан. В медицинской литературе этот класс препаратов получил название триптаны.
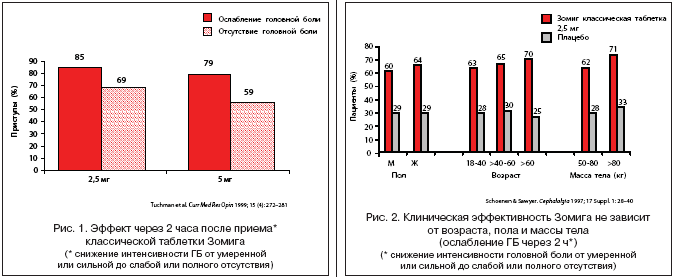
Золмитриптан (Зомиг) является одним из наиболее широко используемых триптанов второго поколения. Таблетки Зомига 2,5 мг и 5 мг являются высокоэффективным средством купирования мигренизных приступов. В исследовании Tuchman (1999 г.) [9] было показано, что интенсивность боли во время приступа мигрени уменьшается наполовину и более в 85% атак, а боль полностью проходит в 69% (рис. 1), что является хорошим показателем и демонстрирует более высокую эффективность по сравнению с триптаном первого поколения – суматриптаном. Выраженный эффект развивается через 2 часа после приема классической таблетки Зомига.
Помимо выраженного противоболевого действия Зомиг оказывает влияние на сопутствующие мигрени симптомы (тошноту, рвоту, фото– и фонофобию), уменьшая их. Клиническая эффективность Зомига не зависит от возраста, пола и массы тела пациента (рис. 2).
Клиническая эффективность различных триптанов при купировании мигренозных приступов, по данным многочисленных плацебо–контролируемых исследований, в целом колеблется от 70 до 85%. Важнейшим фактором, влияющим на эффективность лечения, считают время приема препарата. Рекомендуют наиболее ранний прием – в первые 2 часа от начала мигренозного приступа – на стадии периферической сенситизации. В последующем развивается центральная сенситизация нейронов ядра тройничного нерва. Периферическая сенситизация (ПС) – это увеличение возбудимости периферических ноцицепторов в ответ на воспаление. Центральная сенситизация (ЦС) – это повышение возбудимости нейронов в ЦНС при условии продолжения боли. ЦС развивается как следствие периферической сенситизации. На этой стадии периферические рецепторы уже обладают спонтанной активностью, даже в отсутствие периферической стимуляции. Для центральной сенситизации характерным является феномен аллодинии (возникновение ощущения боли в ответ на неболевой стимул). Триптаны имеют три основных механизма действия: 1) краниальная вазоконстрикция; 2) подавление активности периферических тригеминальных волокон; 3) подавление трансмиссии через вторые нейроны (ядро тройничного нерва) тригеминоваскулярного комплекса. Удельный вес и относительная значимость каждого из перечисленных механизмов действия триптанов до сих пор остается мало изученной. Значительное снижение эффективности триптанов на стадии развития центральной сенситизации может свидетельствовать об их преимущественном периферическом действии (краниальная вазоконстрикция и подавление активности периферических тригеминальных волокон). В литературе имеются исследования [8], которые указывают на независимость эффекта Зомига от времени приема препарата, что может косвенно указывать на его более выраженное центральное действие. Зомиг эффективен в любое время от начала приступа, а также при приступах, возникающих ночью (рис. 3).
Профилактическое лечение мигрени
Профилактическое лечение мигрени проводят ежедневно, в течение нескольких месяцев, чаще 3 месяца, затем делают перерыв и повторяют его через полгода. В случае резистентности профилактическое лечение проводят более длительно, стараясь подобрать для данного пациента наиболее эффективный курс. Наиболее частые ошибки – назначение профилактической терапии на 1–2–й неделе и при отсутствии явного эффекта ее последующая отмена.
Основной задачей профилактического лечения является уменьшение частоты, интенсивности и длительности приступов.
Показания к назначению профилактического лечения включают:
• два и более приступов в месяц;
• приступы, которые длятся 3 и более дней и вызывают выраженную дезадаптацию;
• противопоказания к абортивному лечению или неэффективность симптоматической терапии;
• гемиплегическая мигрень или другие редкие приступы ГБ, во время которых существует риск возникновения перманентной неврологической симптоматики.
К наиболее популярным средствам профилактического лечения мигрени относят: b–блокаторы, антидепрессанты, антиконвульсанты, блокаторы кальциевых каналов, антагонисты серотонина и другие средства (НПВП, ботулотоксин).
b–блокаторы используются в профилактическом лечении мигрени около 30 лет, по данным различных исследований, их эффективность составляет от 60 до 80%. Предполагают, что b–блокаторы модулируют активность центральных антиноцицептивных систем и предупреждают вазодилатацию. На периферии b–блокаторы способны блокировать агрегацию тромбоцитов, вызванную катехоламинами, и выделение из них серотонина [4]. Наиболее эффективны при мигрени адреноблокаторы, не обладающие частичной симпатомиметической активностью. Наличие кардиоселективного свойства не оказывает значимого влияния на лечение при мигрени. При наличии у пациента артериальной гипертензии b–блокаторы имеют преимущество перед другими антимигренозными профилактическими средствами. Их сочетание с антидепрессантами (амитриптилином) значительно повышает эффективность лечения, что позволяет уменьшить дозы обоих препаратов и снизить вероятность побочных эффектов. В клинической практике для профилактики мигрени наиболее часто используются как неселективные (пропранолол от 40 до 120 мг в сутки), так и селективные b–адреноблокаторы (атенолол от 50 до 200 мг в сутки).
В профилактической терапии мигрени используются антидепрессанты различных классов: ТЦА, СИОЗС, ингибиторы МАО, селективные норадренэргические и серотонинэргические антидепрессанты. Антимигренозное действие антидепрессантов не зависит от их психотропного действия. Антидепрессанты широко используются для лечения хронической боли как обусловленной, так и не обусловленной депрессией. Противоболевое действие антидепрессантов прежде всего связано с их серотонинэргическим действием, развивается раньше по времени, чем антидепрессантное, и обусловлено модуляцией активности серотонинэргических рецепторов в ЦНС. Клинические и экспериментальные исследования свидетельствуют о повышенной чувствительности серотониновых рецепторов 5НТ2 типа и сниженном уровне серотонина в межприступный период при мигрени. Антидепрессанты различных классов способны увеличивать содержание серотонина и модулировать чувствительность серотониновых рецепторов.
В настоящее время в лечении мигрени используются антиконвульсанты последнего поколения: вальпроат, топирамат и габапентин [5]. Используемые ранее с этой целью карбамазепин и существенно реже антелепсин не показали своих преимуществ перед другими антимигренозными средствами и плацебо. Механизм действия антиконвульсантов до конца не ясен. Обсуждается несколько механизмов действия каждого лекарственного средства. Вальпроат, топирамат и габапентин способны влиять на ноцицепцию путем модуляции ГАМК и/или глутаматэргической трансмиссии. Все три антиконвульсанта усиливают ГАМК–эргическое торможение. Вальпроат и габапентин влияют на метаболизм ГАМК, предотвращая ее превращение в сукцинат, а топирамат потенциирует ГАМК–эргическое торможение, обладая возбуждающим воздействием на ГАМК–рецепроры. Кроме того, топирамат способен прямо воздействовать на глутаматные рецепторы, уменьшая их активность. Вальпроат, габапентин и топирамат уменьшают активность натриевых ионных каналов (стабилизация нейрональных мембран). Все три антиконвульсанта модулируют активность кальциевых ионных каналов. Вальпроат блокирует Т–тип кальциевых ионных каналов; топирамат ингибирует высоковольтажные L– тип кальциевые ионные каналы, а габапентин связывается с a2DL–подтипом ионных каналов. Терапевтическое действие антиконвульсантов, таким образом, основано на их воздействии на ионные каналы и биохимической модуляции нейрональной возбудимости, а также прямом воздействии на ноцицептивные системы. Антиконвульсанты в настоящее время являются наиболее перспективными средствами профилактики мигрени и, по данным мультицентровых исследований, выходят в первый ряд профилактики мигрени.
Кальций в сочетании с кальцийсвязывающим протенином (таким как калмодулин или тропонин) регулирует множество функций в организме – сокращение мышц, выделение нейротрансмиттеров и гормонов, активность ферментов. Экстрацеллюлярная концентрация кальция высока, интрацеллюлярная, наоборот, низкая. Такая разница в концентрации (концентрационный градиент) поддерживается мембранной помпой. Существуют два типа кальциевых каналов – каналы, по которым кальций поступает в клетку, и каналы, по которым кальций выделяется из клеточных органелл в цитоплазму. Предполагают, что блокаторы кальциевых каналов предотвращают гипоксию нейронов, сокращение гладкой мускулатуры сосудов и ингибируют кальций–зависимые пептиды, участвующие в синтезе простагландинов, предотвращая нейрогенное воспаление. Кроме того, эти препараты могут блокировать выделение серотонина. В профилактической терапии мигрени используются верапамил от 80 до 240 мг/сут., нифедипин от 20 до 100 мг/сут., нимодипин 30–60 мг/сут., флунаризин 5–10 мг/сут. Побочные действия блокаторов кальциевых каналов отличаются при использовании различных препаратов; к наиболее частым относятся депрессия, запоры, ортостатическая гипотензия, брадикардия, отеки.
Антагонисты серотонина в настоящее время редко используются в клинической практике, так как наиболее эффективный препарат из этой группы – метисергид может вызывать при длительном (более 6 месяцев) применении ретроперитонеальный и ретроплевральный фиброз, а также выраженную седацию, тошноту, прибавку в весе, галлюцинации.
Метисергид является антагонистом 5–HT2 рецепторов и агонистом 5–НТ 1b/d рецепторов. Воздействие на 5–НТ2 рецепторы препятствует выходу свободного серотонина в кровь из тромбоцита и предотвращает вазоконстрикцию, предшествующую мигренозному приступу, взаимодействие с 5НТ 1b/d рецепторами изменяет активность тригемино–васкулярной системы. В 70–80–е годы прошлого века было проведено множество контролируемых сравнительных и несравнительных исследований, которые показали, что метисергид статистически достоверно по сравнению с плацебо уменьшает частоту ГБ. Другие антагонисты серотониновых рецепторов – ципрогептадин и пизотифен значительно менее эффективны для профилактики мигрени, хотя и вызывают меньше нежелательных побочных эффектов.
При лечении рефрактерной мигрени нередко используются комбинации лекарственных препаратов [7]. Некоторые комбинации являются предпочтительными, например, антидепрессанты и b–блокаторы, другие нужно использовать с осторожностью – b–блокаторы и блокаторы кальциевых каналов, а некоторые строго противопоказаны – ингибиторы МАО и СИОЗС. Клинические наблюдения показали также, что комбинация антидепрессантов (ТЦА или СИОЗС) и b–блокаторов действует синергично. Комбинация метисергида и блокаторов кальциевых каналов уменьшает его побочные эффекты. Вальпроат в комбинации с антидепрессантами с успехом применяется при рефрактерной мигрени в сочетании с депрессией или биполярными расстройствами.
Важно отметить, что абортивная терапия, как неспецифические анальгетики, так и специфические (триптаны), хорошо сочетаются с любыми средствами профилактической терапии. Совместное их использование позволяет поддерживать высокое качество жизни пациента с мигренью.



Литература
1. Амелин А.В., Игнатов Ю.Д., Скоромец А.А. Мигрень (патогенез, клиника, лечение). Санкт–Петербургское медицинское издательство. 2001. 199 с.
2. Осипова В.В. Мигрень: клинико–психофизиологический анализ, качество жизни, коморбидность, терапевтические подходы. Дисс. Д.м.н., Москва, 2003. 250 с.
3. Diamond S. Migraine Headache . In: Diamond and Dalessio’s The practicing physician’s approach to headache.– 6th ed. 1999, p. 46–71.
4. Diener H–C., Limmroth V. Prevention migraine: beta–blockers and amine agonists: efficacy. In: Preventive pharmacotherapy of headache disorders. Oxford University Press. 2004, p.59–67.
5. Mathew N.T., Hulihan J.F., Rothrock J.F. Anticonvulsants in migraine prophylaxis. Neurology v. 60, N7, 2003, 67–72.
6. Silberstien S.D., Lipton R.B., Goadsby P.J. Headache in clinical practice. ISIS Medical Media. Oxford 1998, 219.
7. Silberstein S.D., Saper J.R., Freitag F.G Migraine: diagnosis and treatment. In: Wolf’s Headache and Other Head Pain. 7th ed., Oxford University Press. 2001, p. 121–238.
8. Schoenen L. et al. Chephalalgia 1997; 17 Suppl.1:28–40.
9. Tuchman et al. Curr. Med. Res. Opin 1999; 15(4) 272–282.












