Большой интерес в понимании причин развития дорсопатий вызывает теория многофакторности развития, согласно которой для данного заболевания необходима генетическая предрасположенность, а для его проявлений – воздействие различных средовых механизмов. В настоящее время к наиболее изученным факторам риска возникновения дорсопатий и их неврологических проявлений относят: женский пол, средний возраст, травма позвоночника в анамнезе, наследственность, тяжелые и несбалансированные физические нагрузки, длительное нахождение в вынужденной и нефизиологической позе, монотонная работа, курение, ожирение, неудовлетворенность профессиональной деятельностью и т.д. Несмотря на все разнообразие факторов, практически во всех теориях развития дорсопатий фигурируют два основных аспекта: декомпенсация в трофических системах и перегрузки позвоночно-двигательных сегментов (ПДС). Локальные перегрузки ПДС возникают под воздействием как экзогенных (перегрузки в быту, на производстве), так и эндогенных (врожденные особенности функционирования мышечно-связочного аппарата) факторов. Все это является еще и предопределяющим условием для разрушающего воздействия на хрящевую ткань с вовлечением как межпозвонковых дисков, так и межпозвонковых суставов.
Хрящевая ткань представляет собой разновидность соединительной ткани и внешне напоминает гель. Толщина хряща составляет 1–7 мм и зависит от типа сустава и его функциональной нагрузки. Суставной хрящ представляет собой высокоспециализированную хрящевую ткань, покрытую надхрящницей, которая выполняет в организме две важнейшие функции – обеспечивает скольжение суставных поверхностей и равномерно распределяет нагрузку при воздействии механических факторов, снижая тем самым травмирующий эффект при движении.
В межпозвоночных дисках, подвижных сочленениях находится волокнистая, или фиброзная, хрящевая ткань. Ее межклеточное вещество содержит параллельно направленные коллагеновые пучки, постепенно разрыхляющиеся и переходящие в гиалиновый хрящ, они составляют до 97%. Кроме коллагеновых волокон ее межклеточное вещество, или внеклеточный матрикс, состоит из основного вещества, включающего до 70% воды, гиалуроновой кислоты и протеогликанов около 10–20%. Целостность этой матрицы соответственно определяет биомеханические свойства суставного хряща. Структура протеогликана обеспечивает высокую гидрофобность, что в сочетании с низкой вязкостью делает его идеальной молекулой для противодействия нагрузке на сустав.
Хрящ не имеет нервных окончаний, сосудов. Его питание осуществляется пассивно из синовиальной жидкости и сосудов подлежащей кости, которая носит название субхондральная кость. Поэтому по мере старения организма в хрящевой ткани уменьшаются концентрация протеогликанов и связанная с ними гидрофильность ткани. Ослабляются процессы размножения хондробластов и молодых хондроцитов.
Некоторые авторы считают, что дегенеративная болезнь диска и артроз фасеточных суставов являются главными компонентами формирования остеоартроза позвоночника. Принимая во внимание родство патогенетических механизмов дегенеративных процессов позвоночника и крупных суставов, в настоящее время в базисную терапию стали все чаще включать препараты, обладающие хондропротективной активностью. Хондропротекторы – это препараты, обладающие симптом-модифицирующим действием (уменьшают боль и способствуют улучшению функции суставов и позвоночника) и структурно-модифицирующим эффектом (задерживают или приостанавливают прогрессирование дегенеративно-дистрофического процесса). Данная группа препаратов включена в рекомендации российских и зарубежных руководств по лечению остеоартроза и иных дегенеративно-дистрофических заболеваний.
На основании международных критериев выделено несколько химических соединений, используемых для лечения остеоартроза.
Препараты со структурно-модифицирующими свойствами:
• глюкозамина сульфат;
• хондроитина сульфат;
• комбинированные препараты хондроитина сульфат + глюкозамин;
• неомыляемые вещества сои и авокадо;
• биоактивный концентрат из мелкой морской рыбы;
• препараты гиалуроновой кислоты;
• стронция ранелат;
• имбирь (cтандартизованный препарат экстракта Zingler officinale и Alpinia galanga);
• эстрогены.
Наиболее изученными в настоящее время являются хондроитина сульфат и глюкозамин.
Хондроитина сульфат – гетерогенная группа соединений, имеющих различную молекулярную массу и удельный вес. Эта способность иметь подобную, но переменную первичную структуру позволяет хондроитина сульфату специализировать биологические функции в пределах живого организма. В основном хондроитина сульфаты являются компонентом протеогликанов. Особенностью хондроитина является его способность сохранять воду в толще хряща в виде водных полостей, создающих хорошую амортизацию и поглощающих удары, что в итоге повышает прочность соединительной ткани. При рассмотрении дегенеративно-дистрофических процессов в позвоночнике отмечается важное действие хондроитина – его способность угнетать действие специфических ферментов, разрушающих соединительную ткань, в т.ч. лизосомальных ферментов, высвобождающихся в результате разрушения хондроцитов (эластаза, пептидаза, катепсин, интерлейкин-1 и др.), тем самым уменьшая выраженность неспецифического воспаления [1].
Одна из первичных физиологических ролей глюкозамина – стимуляция синтеза веществ, необходимых для надлежащей суставной функции. В экспериментальных исследованиях доказано, что глюкозамин стимулирует синтез протеогликанов, ингибирует их деградацию и стимулирует регенерацию хряща после экспериментально вызванного повреждения, стимулирует образование гиалуронана, синтез протеогликанов и коллагена II типа, поддерживает вязкость синовиальной жидкости, активизирует механизмы репарации хрящевой ткани.
Глюкозамин является аминомоносахаридом, в организме он вырабатывается самой хрящевой тканью. Глюкозамин служит необходимым строительным компонентом хондроитина, обладает специфическим влиянием на остеоартритический хрящ и стимулирует синтез хондроцитами полноценного экстрацеллюлярного матрикса, и прежде всего наиболее важных его составляющих – протеогликанов и гиалуроновой кислоты. Он снижает активность катаболических энзимов в хряще, включая матриксные металлопротеиназы, подавляет синтез оксида азота, стимулирует синтез хондроитин- серной кислоты [2].
Неоднократно показана эффективность экзогенного введения глюкозамина. При пероральном приеме глюкозамин хорошо всасывается (глюкозамина сульфат – до 80%, глюкозамина гидрохлорид – до 95%, за счет лучшей растворимости), после прохождения печени в кровь поступает около 20–25% препарата. Радиоизотопные исследования демонстрируют отчетливую тропность глюкозамина к суставным тканям. Около 30% введенного препарата длительно персистирует в соединительной ткани [1].
Кроме того, установлено хондропротективное действие глюкозамина в условиях терапевтической агрессии нестероидных и стероидных противовоспалительных препаратов на хондроциты и внеклеточный матрикс. В этих случаях он оказывал хондропротекторный и остеотропный эффект, способствовал нормализации содержания общих хондроитина сульфатов и активности щелочной фосфатазы.
В ряде классификаций глюкозамин относят к нестероидным противовоспалительным препаратам, т.к. он проявляет умеренное противовоспалительное действие на разных моделях воспаления. Оно не связано с подавлением синтеза простагландинов, а реализуется за счет антиоксидантной активности (путем блокирования образования супероксидных радикалов) и подавления активности лизосомальных ферментов [3].
Необходимо еще раз подчеркнуть тот факт, что, несмотря на то, что и глюкозамина и хондротина сульфат являются естественными метаболитами хрящевой ткани и присутствуют в составе здоровой хрящевой ткани, оба этих вещества оказывают сходные эффекты и при их экзогенном введении.
Основные механизмы хондроитина сульфата и глюкозамина представлены в таблице 1.
Единство механизмов влияний и однонаправленность действия глюкозамина и хондроитина сульфата дают основания говорить об их синергическом хондропротекторном действии. Оно основано на совместном стимулировании метаболизма хондроцитов и синовиоцитов, ингибировании активности ферментов, способствующих деградации матрикса хряща, улучшении микроциркуляции сосудистого русла периартикулярных тканей. Эти теоретические предпосылки нашли свое подтверждение в клинической практике.
Впервые применение хондропротекторов (хондроитина сульфата) при хронической боли в спине было предпринято в исследовании K.D. Christensen, L.R. Bucci в 1989 г., в котором была продемонстрирована их эффективность.
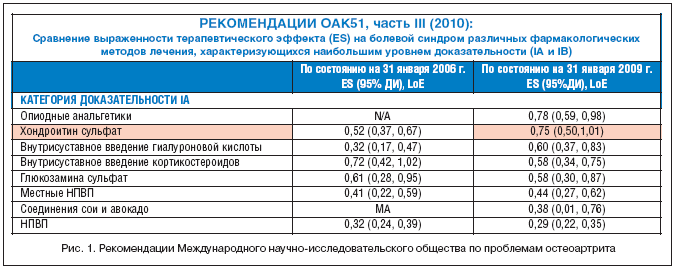
При анализе литературы за последние несколько лет выявлено, что в большинстве зарубежных клинических исследований используется хондроитина сульфат и в меньшей степени глюкозамин. Эффективность применения хондроитина сульфата подтверждена в таких исследованиях, как STOPP, GUIDE. Данные, приведенные в рекомендациях Международного научно-исследовательского общества по проблемам остеоартрита (OARSI) (рис. 1), показывают, что уровень доказательности повышается.
Однако в исследованиях GRADE (Grading of Recommendations Assessment, Development and Evaluation), результаты которых были опубликованы в 2008 г., при комбинированном применении хондроитина и глюкозамина показано, что при определении риска и пользы от применения комбинированного препарата степень рекомендаций определена была как сильная, а качество доказательств – умеренное.
Сочетание глюкозамина и хондроитина сульфата включено в рекомендации EULAR (Европейская антиревматическая лига) для лечения больных с остеоартрозом. По данным EULAR, комбинация этих препаратов обладает высокой степенью доказательности и может быть рекомендована для клинической практики [4].
В многочисленных российских исследованиях, проводимых в последнее время, также подтверждена высокая эффективность препаратов комбинированного типа (хондроитина сульфат + глюкозамина сульфат). Применение этих препаратов рекомендовано Формулярной системой для лечения остеоартроза [5].
Одним из препаратов, в состав которых входит данная комбинация, является Терафлекс. Он включает в себя глюкозамина гидрохлорид (500 мг) и натрия хондроитина сульфат (400 мг). Препарат назначается первые 3 нед. по 1 капсуле 3 раза/сут., а затем по 1 капсуле 2 раза/сут. Для достижения ожидаемого структурно-модифицирующего эффекта на хрящевую ткань необходимо длительное применение препарата. Как правило, длительность курса терапии должна составлять от 6 мес. и более. Желательно проведение повторных курсов лечения, поскольку патогенез дегенеративных изменений хрящевой ткани требует постоянной поддерживающей терапии.
Проведен ряд исследований по оценке терапевтической эффективности и переносимости этого препарата у больных остеоартрозом [6–8]. Во всех работах продемонстрирован высокий уровень эффективности препарата Терафлекс, который достигается в ходе курсового лечения и сохраняется в течение длительного времени. В то же время отмечается хорошая переносимость и сочетаемость данного препарата с другими методами комплексного лечения дорсалгий.
Предварительные данные собственных исследований по локальному применению инъекционных хондропротекторов для увеличения концентрации активного вещества в региональном кровотоке и, следовательно, в поврежденных тканях демонстрируют возможность дать им положительную оценку в качестве средств первичной и вторичной профилактики при заболеваниях позвоночника и суставов.
Еще имеется ряд работ по применению мазевых и гелевых форм ходроитина сульфата, а также в сочетанном использовании с диметилсульфоксидом, гиалуроновой кислотой и др.
Но необходимо отметить, что, несмотря на наметившийся прогресс в лечении заболеваний опорно-двигательного аппарата, по-прежнему не уделяется должного внимания немедикаментозным способам коррекции дорсопатий. Применение хондропротективных препаратов дает возможность замедлить прогрессирование дегенеративного процесса за счет их структурно-модифицирующего действия. Но поддержание здоровья и вопросы приверженности терапии обеспечиваются целым комплексом мероприятий, которые невозможно свести лишь к фармакотерапии. Расширение спектра воздействия за счет немедикаментозных методов позволит повысить качество жизни у пациентов с дорсопатиями, т.к. созданное мнение о неизбежности прогрессирования «остеохондроза позвоночника» формирует поведение, которое можно описать словами C.R. Chapman (1988): «ничегонеделание и поглощение лекарств становятся для больных привычкой». Это неизбежно ведет к выработке у пациентов стратегии на катастрофизацию, в последующем сменяющуюся бездеятельностью.
Лечение этой категории больных требует комплексного подхода, в первую очередь направленного на немедикаментозную коррекцию. Это способствует активному вовлечению пациентов в процесс лечения и повышению мотивационных установок на выздоровление.
В рекомендациях Европейского симпозиума, посвященного проблеме боли в спине (2006), важное место отведено советам по активизации больных в период острой боли (это положение имеет доказательную базу А). С точки зрения доказательной медицины это дает более быстрый регресс боли, создаются оптимальные условия для реституции поврежденных тканей (мышц, сухожилий, межостистых связок, диска и др.), происходит быстрейшее выздоровление и предупреждение инвалидности. Постельный режим отрицательно сказывается на результатах терапии. Двигательный рацион должен расширяться постепенно, в начальный период с ограничением физической активности (поднятие тяжестей, наклоны, длительное сидение и т.д.). Необходимо научить пациента правильно совершать движения. Раннее возвращение к привычному для больного уровню двигательной активности способствует более быстрому купированию боли и предупреждает ее хронизацию [9, 10].
При анализе современной литературы складывается впечатление, что в настоящее время не существует ни одного немедикаментозного способа лечения, обоснованного при болях в спине с позиций доказательной медицины. Зачастую считается, что объективных доказательств эффективности таких отраслей медицины, как акупунктура или мануальная терапия, просто не существует. Возможно, это связано с трудностями в проведении слепых и плацебо-контролируемых исследований для физических методов реабилитации. Однако несмотря на это в Кокрановский реестр контролируемых испытаний уже включено около 4 тыс. рандомизированных контролируемых исследований, посвященных оценке этих методов, и еще столько же работ предстоит проанализировать [11, 12].
Исследование, проведенное в Великобритании, где врачи общей практики могут передать своих пациентов с болью в спине врачам-остеопатам для проведения мануальной терапии, показало, что мануальная терапия улучшает физические и психологические результаты при незначительных дополнительных затратах.
В США, Великобритании, Германии, Франции уже внедряются новые подходы к ведению пациентов с дорсопатиями. При этом опыт ведущих клиник мира по лечению вертеброневрологической патологии демонстрирует, что затраты, связанные с применением немедикаментозных способов лечения, полностью окупаются, а пациенты после прохождения специальных лечебных программ быстрее возвращаются к работе.
Важную роль в решении проблемы вертеброневрологической патологии может сыграть внедрение среди населения образовательных программ, направленных на информирование о данной патологии и мерах по предупреждению ее развития и прогрессирования. Ряд зарубежных исследований показывают, что широкое внедрение таких программ позволяет как существенно повысить качество жизни пациентов с дорсопатиями, так и снизить прямые и непрямые расходы на их лечение.
Умеренные дозы любых видов физиотерапии способствуют нормализации гомеостаза, стимулируют защитные рефлексы, иммунную систему, процессы репарации. Однако нельзя забывать, что физиотерапия – мощное воздействие физических факторов на определенные зоны кожи и подкожных структур, которое, если не соблюдать принцип стадийности, может привести к ухудшению. Не рекомендуется прибегать к ФТЛ в стадии обострения, в первую неделю (когда целесообразно назначать блокады и ИРТ). В эту стадию физиотерапевтические методы чаще всего приводят к обострению. При уменьшении болевого синдрома наиболее адекватным из методов ФТЛ является назначение лазеротерапии, диадинамических и синусоидально-модулированных токов, ЧЭНС, электрофореза с анестетиками и фонофореза с глюкокортикостероидами.
Таким образом, лечение дорсопатий по-прежнему остается сложной клинической задачей. Наиболее перспективным на данный момент представляется сочетание патогенетически обусловленной терапии хондропротективными препаратами в течение длительного времени в сочетании с комплексными немедикаментозными методиками лечения. При этом для обеспечения приверженности терапии и поддержания должного уровня физической активности необходимо проведение образовательных программ для пациентов с дорсопатиями.

Литература
1. Алексеев В.В. Хондропротекторы в неврологии: основания к применению // Consilium Medicum. 2012. Т. 14, № 9.
2. Бадокин В.В. Существуют ли хондропротективные препараты? // РМЖ. 2010. № 30.
3. Du Souich P. Immunomodulatory and anti-inflammatory effects of chondroitin sulphate // Eur. Musculoskeletal Review. 2009. Vol. 4(2). P. 8–10.
4. Jordan K.M., Arden N.K., Doherty M. et al. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT) // Ann. Rheum. Dis. 2003. Vol. 62. P. 1145–1155. doi: 10.1136/ard.2003.011742.
5. Чучалин А.Г., Белоусов Ю.Б., Леонова М.В. Федеральное руководство по использованию лекарственных средств (формулярная система) выпуск 5. – М., 2004.
6. Беневоленская Л.И., Алексеева Л.И., Зайцева Е.М. Эффективность препарата Терафлекс у больных с остеоартрозом коленных и тазобедренных суставов // РМЖ. 2005. № 8. С. 525–527.
7. Лила А.М., Мазуров В.И. и др. Терафлекс в комплексной терапии остеоартроза коленных суставов и остеохондроза позвоночника (результаты клинического исследования) // РМЖ. 2005. № 24. С. 1618–1622.
8. Кригштейн О.С., Голубев Г.Ш. Оценка доказательств эффективности средств, претендующих называться «структурно-модифицирующими препаратами», 2004–2007 гг. // Клинич. фармакология и фармакоэкономика. 2008. № 1. С. 55–88.
9. Traynor L.M., Thiessen C.N., Traynor A.P. Pharmacotherapy of fibromyalgia // Am. J. Health Syst. Pharm. 2011. Vol. 68(14). P.1307–1319. doi: 10.2146/ajhp100322.
10. Radcliffe M. Pain management is still not being taken seriously // Nurs. Times. 2008. Vol. 1;104(47). P. 17.
11. Vickers A.J., Maschino A.C. The Acupuncture Trialists' Collaboration: individual patient data meta-analysis of chronic pain trials // Acupunct. Med. 2009. Vol. 27(3). P. 126–127. doi: 10.1136/aim.2009.001313.
12. Schnitzer T.J. Update on guidelines for the treatment of chronic musculoskeletal pain // Clin. Rheumatol. 2006( Suppl 1). S. 22–29.












