–Т –љ–∞—И–µ–є —Б—В—А–∞–љ–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Є –Є–љ–≤–∞–ї–Є–і–Є–Ј–∞—Ж–Є–Є –љ–∞—Б–µ–ї–µ–љ–Є—П —В—А—Г–і–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –Њ—Б—В—А—Л—Е —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (–¶–Ч–Т), –љ–µ—Г–Ї–ї–Њ–љ–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –µ–ґ–µ–≥–Њ–і–љ–∞—П –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Є–љ—Б—Г–ї—М—В–Њ–Љ – –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 20 –ї–µ—В –Њ–љ–∞ –≤—Л—А–Њ—Б–ї–∞ –≤ 1,67 —А–∞–Ј–∞ [4, 18]. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –њ–µ—А–≤–Є—З–љ–Њ–є –Є –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –і–∞–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –њ—А–Є–і–∞–µ—В—Б—П –Њ—Б–Њ–±–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ [3, 34]. –Я–Њ—Н—В–Њ–Љ—Г –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –Њ—Б–љ–Њ–≤–љ–Њ–є –Ј–∞–і–∞—З–µ–є –Ї–∞—А–і–Є–Њ–љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є —П–≤–ї—П–µ—В—Б—П —А–∞–Ј—А–∞–±–Њ—В–Ї–∞ –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –Є —Н—В–Є–Њ–њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л—Е –Љ–µ—В–Њ–і–Є–Ї –Є –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ—Б—В—А—Л—Е —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Є —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–С–Њ–ї—М—И—Г—О —А–Њ–ї—М –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –≤–Ј–≥–ї—П–і–∞ –љ–∞ –њ—А–Њ–±–ї–µ–Љ—Г –Є–љ—Б—Г–ї—М—В–∞ —Б—Л–≥—А–∞–ї–∞ –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П –≥–µ—В–µ—А–Њ–≥–µ–љ–љ–Њ—Б—В–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ [5, 9, 20, 31], –≤—Л–і–µ–ї–µ–љ–Є–µ –≤ –Ї–Њ—В–Њ—А–Њ–є –Ї–∞—А–і–Є–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–і—В–Є–њ–Њ–≤ —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –µ—Й–µ —А–∞–Ј –њ–Њ–і—З–µ—А–Ї–Є–≤–∞–µ—В –Њ–±—Й–љ–Њ—Б—В—М –Є –≤–Ј–∞–Є–Љ–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М —Н—В–Є—Е –і–≤—Г—Е –±–∞—Б—Б–µ–є–љ–Њ–≤ –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П. –°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ–Њ–є —В–µ–Њ—А–Є–Є, —А–µ—И–∞—О—Й–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≤ –Є–љ–Є—Ж–Є–∞—Ж–Є–Є –Њ—Б—В—А–Њ–є —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є –Ї–∞—В–∞—Б—В—А–Њ—Д—Л —З–∞—Й–µ –Є–Љ–µ–µ—В –Ї–∞—А–і–Є–∞–ї—М–љ–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П [5, 12, 22], –Њ–љ–∞ –≤–љ–Њ—Б–Є—В –≤–Ї–ї–∞–і –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–µ–і–њ–Њ—Б—Л–ї–Њ–Ї –і–ї—П —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В—А–Њ–≥–Њ –¶–Т–Ч, —П–≤–ї—П–µ—В—Б—П —З–∞—Б—В—Л–Љ –њ–Њ–≤–Њ–і–Њ–Љ –і–ї—П –µ–≥–Њ –≤–љ–µ–Ј–∞–њ–љ–Њ–≥–Њ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П [26].
–Р–љ–∞–ї–Є–Ј —А–µ–≥–Є—Б—В—А–Њ–≤ –Є–љ—Б—Г–ї—М—В–∞ –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 10 –ї–µ—В –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В, —З—В–Њ –Є–Љ–µ–љ–љ–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–µ—А–і—Ж–∞ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ —П–≤–ї—П—О—В—Б—П –њ—А–Є—З–Є–љ–∞–Љ–Є –Ї–∞—А–і–Є–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ –Є —З–∞—Й–µ – –Њ—Б–љ–Њ–≤–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ [11].
–Т—Б–µ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ –≤—Л—И–µ –≤–ї–Є—П–љ–Є—П –Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–∞ —Ж–µ–љ—В—А–∞–ї—М–љ—Г—О –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї—Г —П–≤–ї—П—О—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –∞—Б–њ–µ–Ї—В–Њ–≤ –Ї–∞—А–і–Є–Њ—Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. –°—Г—В—М –і–∞–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Њ–±—К—П—Б–љ—П–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ –≤–Ї–ї–∞–і–Њ–Љ –≤ –≥–µ–љ–µ–Ј –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–є –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –≤–љ—Г—В—А–Є—Б–µ—А–і–µ—З–љ–Њ–є –Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є [14].
–Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Є —Б–∞–Љ—Л–Љ–Є –∞–≥—А–µ—Б—Б–Є–≤–љ—Л–Љ–Є –≤ –њ–ї–∞–љ–µ –њ—А–Њ–≤–Њ–Ї–∞—Ж–Є–Є –Ю–Э–Ь–Ъ —П–≤–ї—П—О—В—Б—П —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ —А–Њ–і–∞ –љ–∞—А—Г—И–µ–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ–≥–Њ —А–Є—В–Љ–∞. –Р—А–Є—В–Љ–Є–Є –Љ–Њ–≥—Г—В –±—Л—В—М –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ—Л–Љ–Є –њ—А–Њ–≤–Њ—Ж–Є—А—Г—О—Й–Є–Љ–Є –∞–≥–µ–љ—В–∞–Љ–Є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–є –Є–љ—В—А–∞–Ї—А–∞–љ–Є–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є–є, –љ–∞–±–ї—О–і–∞—О—В—Б—П –≤ –Њ—Б—В—А–Њ–Љ –Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ–Њ–Љ –њ–µ—А–Є–Њ–і–∞—Е –Ю–Э–Ь–Ъ, –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Њ—В—П–≥–Њ—Й–∞—П –Є—Е [24, 33].
–Э–∞—А—П–і—Г —Б –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Б–µ—А–і–µ—З–љ–Њ–≥–Њ —А–Є—В–Љ–∞ –≤–µ—Б–Њ–Љ—Л–є –≤–Ї–ї–∞–і –≤ —А–∞–Ј–≤–Є—В–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤–љ–Њ—Б—П—В –Є –і—А—Г–≥–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Є –Њ—Б—В—А—Л–µ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –¶–µ—А–µ–±—А–∞–ї—М–љ–∞—П —Б–Њ—Б—Г–і–Є—Б—В–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –њ—А–Є –љ–∞–ї–Є—З–Є–Є –і–µ–Ј–∞–і–∞–њ—В–Є–≤–љ–Њ–≥–Њ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Ї–∞–Љ–µ—А —Б–µ—А–і—Ж–∞, –њ—А–Є –Є–Љ–µ—О—Й–µ–є—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–∞ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (II, III —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–ї–∞—Б—Б–∞) —Б –Њ—Б–ї–∞–±–ї–µ–љ–Є–µ–Љ –љ–∞—Б–Њ—Б–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є —Б–µ—А–і—Ж–∞ –Є —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ —Д—А–∞–Ї—Ж–Є–Є –≤—Л–±—А–Њ—Б–∞, –Љ–Є–љ—Г—В–љ–Њ–≥–Њ –Њ–±—К–µ–Љ–∞ –Ї—А–Њ–≤–Є, —Г–і–∞—А–љ–Њ–≥–Њ –Њ–±—К–µ–Љ–∞.
–Я–Њ–Љ–Є–Љ–Њ —В–∞–Ї–Є—Е –і–∞–≤–љ–Њ –Є–Ј–≤–µ—Б—В–љ—Л—Е –Є –∞–≥—А–µ—Б—Б–Є–≤–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞, –Ї–∞–Ї –љ–∞—А—Г—И–µ–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ–≥–Њ —А–Є—В–Љ–∞, –≤ –і–∞–љ–љ—Л–є –Љ–Њ–Љ–µ–љ—В –∞–Ї—В–Є–≤–љ–Њ –Є–Ј—Г—З–∞–µ—В—Б—П –њ—А–Њ–±–ї–µ–Љ–∞ —А–∞–Ј–≤–Є—В–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –Є–љ—Б—Г–ї—М—В–Њ–≤ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є. –°—А–µ–і–Є —В–∞–Ї–Є—Е —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л –ї–Є–і–Є—А—Г—О—Й–Є–µ –њ–Њ–Ј–Є—Ж–Є–Є –Ј–∞–љ–Є–Љ–∞–µ—В –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П, –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Ї–Њ—В–Њ—А–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –≤ 3–4 —А–∞–Ј–∞ [1, 8, 19, 21, 27, 35].
–Э–∞—З–∞–ї—М–љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є –і–µ—Д–Є—Ж–Є—В–∞—А–љ–Њ—Б—В–Є —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ —Г–Ї–ї–∞–і—Л–≤–∞—О—В—Б—П –≤ —В–Є–њ–Є—З–љ—Г—О –Ї–∞—А—В–Є–љ—Г —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Є—И–µ–Љ–Є–Є –Љ–Њ–Ј–≥–∞ (–•–Ш–Ь) 1–2 –Р —Б—В–∞–і–Є–є. –•—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (–Р–У, –Ш–С–° –Є –і—А.) —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В —Б—Г–ґ–µ–љ–Є–µ –њ—А–Њ—Б–≤–µ—В–∞ –Є–љ—В—А–∞–Ї—А–∞–љ–Є–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є–є, –љ–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–є —Н–љ–і–Њ—В–µ–ї–Є—П —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —А–Є–≥–Є–і–љ–Њ—Б—В–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є, —З—В–Њ –≤–њ–Њ—Б–ї–µ–і—Б—В–≤–Є–Є –≤—Л–Ј—Л–≤–∞–µ—В —Е—А–Њ–љ–Є—З–µ—Б–Ї—Г—О –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ —Б –і–Є—Д—Д—Г–Ј–љ—Л–Љ–Є –Є–ї–Є –Њ—З–∞–≥–Њ–≤—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –≤–µ—Й–µ—Б—В–≤–∞ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞. –С–∞–Ј–Є—Б–љ—Л–µ –Ї–∞—А–і–Є–∞–ї—М–љ—Л–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –њ—А–Њ–≤–Њ—Ж–Є—А—Г—О—В –њ—А–Њ—П–≤–ї–µ–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–≥–Њ –і–Є—Б–±–∞–ї–∞–љ—Б–∞, —Б–Њ–Ј–і–∞–≤–∞—П –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є —Д–Њ–љ –і–ї—П —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В—А–Њ–є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –Ї–∞—В–∞—Б—В—А–Њ—Д—Л. –Я—А–Є —Н—В–Њ–Љ –њ—А–µ–і–Є–Ї—В–Њ—А–∞–Љ–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ —А–∞–Ј—А–µ—И–µ–љ–Є—П –і–∞–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –≤ –Њ—Б—В—А–Њ–µ –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л —П–≤–ї—П—О—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–µ —Д–∞–Ї—В–Њ—А—Л:
• –љ–∞–ї–Є—З–Є–µ –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —Б—В–µ–љ–Њ–Ј–Њ–≤ —Н–Ї—Б—В—А–∞–Ї—А–∞–љ–Є–∞–ї—М–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ (–±–Њ–ї–µ–µ 60%);
• —Б–љ–Є–ґ–µ–љ–Є–µ –Њ–±—К–µ–Љ–љ–Њ–є —Б–Ї–Њ—А–Њ—Б—В–Є –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –Є —Б—Г–Љ–Љ–∞—А–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Є–љ—В—А–∞–Ї—А–∞–љ–Є–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є—П—Е —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–є —А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є;
• —Б–љ–Є–ґ–µ–љ–Є–µ —Д—А–∞–Ї—Ж–Є–Є —Б–µ—А–і–µ—З–љ–Њ–≥–Њ –≤—Л–±—А–Њ—Б–∞ (–і–Њ 40% –Є –Љ–µ–љ–µ–µ) [14].
–°—Г—Й–µ—Б—В–≤—Г–µ—В –Є –Њ–±—А–∞—В–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Є —В–µ–Љ –±–Њ–ї–µ–µ –Њ—Б—В—А–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ –љ–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –Є —Г—Б—Г–≥—Г–±–ї–µ–љ–Є–µ –љ–∞—А—Г—И–µ–љ–Є–є –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞. –Ю–њ–Є—Б—Л–≤–∞–µ–Љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Е–∞—А–∞–Ї—В–µ—А–љ—Л –і–ї—П —Ж–µ—А–µ–±—А–Њ–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞.
–Я–Њ–љ—П—В–Є–µ —Ж–µ—А–µ–±—А–Њ–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –±—Л–ї–Њ –≤–≤–µ–і–µ–љ–Њ –≤ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї—Г—О —В–µ—А–Љ–Є–љ–Њ–ї–Њ–≥–Є—О F. Wuhrmann –≤ –љ–∞—З–∞–ї–µ 1950-—Е –≥–≥. –Ш–Ј–љ–∞—З–∞–ї—М–љ–Њ –Њ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Њ—Б—М –і–ї—П –Њ–њ–Є—Б–∞–љ–Є—П –Є–Ј–Љ–µ–љ–µ–љ–Є–є, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є—Е –≤ –Љ–Є–Њ–Ї–∞—А–і–µ (–њ–Њ –і–∞–љ–љ—Л–Љ –≠–Ъ–У) –≤ –Њ—Б—В—А—Л–є –њ–µ—А–Є–Њ–і –Ю–Э–Ь–Ъ. –¶–µ—А–µ–±—А–Њ–Ї–∞—А–і–Є–∞–ї—М–љ—Л–є —Б–Є–љ–і—А–Њ–Љ – –≤–∞—А–Є–∞–љ—В –љ–∞—А—Г—И–µ–љ–Є—П —Ж–µ—А–µ–±—А–Њ–≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–є —А–µ–≥—Г–ї—П—Ж–Є–Є, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є–є –Њ –≤–Ј–∞–Є–Љ–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –ґ–Є–Ј–љ–µ–і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є —Б–Є—Б—В–µ–Љ—Л –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є [26]. –£ 70% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Њ—З–∞–≥–∞ –Ю–Э–Ь–Ъ –≤ –≤–µ—А—В–µ–±—А–∞–ї—М–љ–Њ-–±–∞–Ј–Є–ї—П—А–љ–Њ–Љ –±–∞—Б—Б–µ–є–љ–µ –љ–∞–±–ї—О–і–∞—О—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П [11].
–†–∞—Б—Б—В—А–Њ–є—Б—В–≤–Њ —А–µ–≥—Г–ї—П—Ж–Є–Є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –≤—Л—А–∞–ґ–µ–љ–Њ –њ—А–Є —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Є–љ—Б—Г–ї—М—В–∞—Е, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –Њ–±—И–Є—А–љ–Њ–Љ –њ–Њ–ї—Г—И–∞—А–љ–Њ–Љ –Њ—З–∞–≥–µ —Б–Њ –≤—В–Њ—А–Є—З–љ—Л–Љ —Б—В–≤–Њ–ї–Њ–≤—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–Є–Ј–љ–∞–Ї–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ —Ж–µ—А–µ–±—А–Њ–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ (—В–∞–Ї–Є–µ –Ї–∞–Ї –±—А–∞–і–Є–Ї–∞—А–і–Є—П, —Б–Є–љ–і—А–Њ–Љ —В–∞—Е–Є-–±—А–∞–і–Є, —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–∞—П –Є—И–µ–Љ–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞, –љ–µ–Ї—А–Њ–Ј –њ–Њ —В–Є–њ—Г «–Є–љ—Б—Г–ї—М—В-–Є–љ—Д–∞—А–Ї—В») —П–≤–ї—П—О—В—Б—П –Ї—А–Є—В–µ—А–Є—П–Љ–Є –њ–ї–Њ—Е–Њ–≥–Њ –њ—А–Њ–≥–љ–Њ–Ј–∞ –Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞ [32], –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –≤ –±–ї–Є–ґ–∞–є—И–Є–µ 30 —Б—Г—В. [16].
–°—Г—Й–µ—Б—В–≤—Г—О—В —А–∞–Ј–ї–Є—З–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є —Ж–µ—А–µ–±—А–Њ–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –љ–µ —В–Њ–ї—М–Ї–Њ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Њ—З–∞–≥–∞ –Є—И–µ–Љ–Є–Є –≤ –њ–Њ–ї—Г—И–∞—А–Є—П—Е –Є–ї–Є –≤ –Њ–±–ї–∞—Б—В–Є —Б—В–≤–Њ–ї–Њ–≤—Л—Е —Б—В—А—Г–Ї—В—Г—А –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –љ–Њ –Є –Њ—В –ї–∞—В–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є –і–∞–љ–љ–Њ–≥–Њ –Њ—З–∞–≥–∞. –Т—Л–і–µ–ї—П—О—В –њ—А–∞–≤–Њ- –Є –ї–µ–≤–Њ—Б—В–Њ—А–Њ–љ–љ–Є–µ —Ж–µ—А–µ–±—А–Њ–Ї–∞—А–і–Є–∞–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е R.D. Lane –Є —Б–Њ–∞–≤—В. (1992) –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ—Л –і–∞–љ–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П: —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ —Б—Г–±–і–Њ–Љ–Є–љ–∞–љ—В–љ–Њ–≥–Њ –њ–Њ–ї—Г—И–∞—А–Є—П –Њ–њ—А–µ–і–µ–ї—П–ї–Є—Б—М –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ —Ж–Є—Д—А—Л –Є –≤–∞—А–Є–∞–±–µ–ї—М–љ–Њ—Б—В—М –Р–Ф –Є –І–°–°, —З–∞—Й–µ –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –∞—А–Є—В–Љ–Є–Є [36].
–Я–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–≥–Њ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—З–∞–≥–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –љ–∞—А—Г—И–µ–љ–Є–µ —А–∞–±–Њ—В—Л —Ж–µ–љ—В—А–Њ–≤ –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –∞ —В–∞–Ї–ґ–µ –њ—А—П–Љ–Њ–µ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –Ј–Њ–љ—Л –љ–µ–Ї—А–Њ–Ј–∞ –љ–∞ –≥–Њ–ї–Њ–≤–љ–Њ–є –Љ–Њ–Ј–≥. –≠—В–Њ –Љ–Њ–ґ–µ—В –њ–Њ–≤–ї–µ—З—М –Ј–∞ —Б–Њ–±–Њ–є –Њ—В–µ–Ї –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –њ–Њ–≤—Л—И–µ–љ–Є–µ –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, —Б–і–∞–≤–ї–µ–љ–Є–µ –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ —Б—В–≤–Њ–ї–∞, –љ–∞—А—Г—И–µ–љ–Є–µ –ї–Є–Ї–≤–Њ—А–Њ–і–Є–љ–∞–Љ–Є–Ї–Є. –Ъ–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –≤–Њ–Ј–Љ–Њ–ґ–љ—Л –љ–∞—А—Г—И–µ–љ–Є–µ —А–µ–≥—Г–ї—П—Ж–Є–Є —Б–µ—А–і–µ—З–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Є –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є—П —Б–Є—Б—В–µ–Љ–љ–Њ–є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є.
–Т —Б–≤—П–Ј–Є —Б–Њ —Б–ї–Њ–ґ–љ–Њ–є –≤–Ј–∞–Є–Љ–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М—О —Б–Є—Б—В–µ–Љ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ –Є —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П –њ–∞—В–Њ–ї–Њ–≥–Є—П, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–∞—П –≤ –Њ–і–љ–Њ–є –Є–Ј –љ–Є—Е, –љ–µ–Љ–Є–љ—Г–µ–Љ–Њ –≤–ї–µ—З–µ—В –Ј–∞ —Б–Њ–±–Њ–є –і–Є—Б–±–∞–ї–∞–љ—Б –Є –≤–Њ–Ј–Љ–Њ–ґ–љ—Г—О –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є—О –≤ –і—А—Г–≥–Њ–є —Б–Є—Б—В–µ–Љ–µ. –≠—В–Њ –і–Є–Ї—В—Г–µ—В —В–∞–Ї—В–Є–Ї—Г –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ —А–∞–љ–љ–µ–≥–Њ –≤—Л—П–≤–ї–µ–љ–Є—П —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Г –±–Њ–ї—М–љ—Л—Е –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П, –∞ —В–∞–Ї–ґ–µ —В—Й–∞—В–µ–ї—М–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –њ—А–µ–≤–µ–љ—В–Є–≤–љ–Њ–є –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Э–Ь–Ъ.
–Т –њ–µ—А–Є–Њ–і –Ю–Э–Ь–Ъ, –љ–∞—А—П–і—Г —Б –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ–Љ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є –Љ–Є–Њ–Ї–∞—А–і–∞ –љ–∞ —Б–Є—Б—В–µ–Љ–љ–Њ–Љ —Г—А–Њ–≤–љ–µ, –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –Є —А–µ—И–∞—О—Й–Є–Љ–Є –і–ї—П –Ю–Э–Ь–Ъ —П–≤–ї—П—О—В—Б—П –њ—А–Њ—Ж–µ—Б—Б—Л, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–Є–µ –≤ –≥–Њ–ї–Њ–≤–љ–Њ–Љ –Љ–Њ–Ј–≥–µ –љ–∞ —Ж–Є—В–Њ–≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ —Г—А–Њ–≤–љ–µ.
–Я–Њ–і—А–Њ–±–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—П –Љ–Њ–Ј–≥–Њ–≤–Њ–є –Є–љ—Б—Г–ї—М—В —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є–Є –Ї–ї–µ—В–Њ—З–љ—Л—Е –Є –љ–µ–є—А–Њ–≥—Г–Љ–Њ—А–∞–ї—М–љ—Л—Е —Б–Є—Б—В–µ–Љ, –µ–≥–Њ –Љ–Њ–ґ–љ–Њ –Њ—Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞—В—М –Ї–∞–Ї —Б–њ—А–Њ–≤–Њ—Ж–Є—А–Њ–≤–∞–љ–љ—Г—О –≥–Є–њ–Њ–Ї—Б–Є–µ–є —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї—Г—О –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї—Г—О –Ї–∞—В–∞—Б—В—А–Њ—Д—Г.
–≠–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є–µ –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ —А–∞–Ј–Њ–±—Й–µ–љ—Л –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є –≤–Њ –≤—А–µ–Љ–µ–љ–Є. –Я–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –∞–Ї—В–Є–≤–љ—Л –њ—А–Њ—Ж–µ—Б—Б—Л —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞, –Ј–∞—В–µ–Љ –Є–Љ–µ—О—Й–Є–µ—Б—П –Є–Ј–Љ–µ–љ–µ–љ–Є—П –і–Њ–њ–Њ–ї–љ—П—О—В—Б—П –≥–ї—Г—В–∞–Љ–∞—В–љ–Њ–є —Н–Ї—Б–∞–є—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О, –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –±–∞–ї–∞–љ—Б–∞ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Ї–∞–ї—М—Ж–Є—П, –ї–∞–Ї—В–∞—В–∞—Ж–Є–і–Њ–Ј–Њ–Љ. –°—Г—Й–µ—Б—В–≤—Г–µ—В –њ—А—П–Љ–∞—П –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М—О –і–∞–љ–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –Є –≥–ї—Г–±–Є–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –ї–Њ–Ї–∞–ї—М–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ [13]. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –Є –љ–µ–Њ–±—А–∞—В–Є–Љ–Њ —Б—В—А–∞–і–∞–µ—В —П–і–µ—А–љ–∞—П –Ј–Њ–љ–∞ –Є—И–µ–Љ–Є–Є, –≤–Њ–Ї—А—Г–≥ –Ї–Њ—В–Њ—А–Њ–є —Д–Њ—А–Љ–Є—А—Г–µ—В—Б—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ–Љ–∞—П –Ј–Њ–љ–∞ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –њ–Њ–ї—Г—В–µ–љ–Є – –њ–µ–љ—Г–Љ–±—А—Л. –Ш–Љ–µ–љ–љ–Њ –љ–∞ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–є –љ–µ–є—А–Њ–љ–Њ–≤ –≤ –Њ–±–ї–∞—Б—В–Є –њ–µ–љ—Г–Љ–±—А—Л –Є –љ–∞–њ—А–∞–≤–ї–µ–љ—Л –≤—Б–µ —Г—Б–Є–ї–Є—П –љ–µ–≤—А–Њ–ї–Њ–≥–Њ–≤ –≤ –Њ—Б—В—А—Л–є –њ–µ—А–Є–Њ–і –Ю–Э–Ь–Ъ.
–Т –њ–µ—А–Є–Њ–і —А–∞–Ј–≤–Є—В–Є—П –Є—И–µ–Љ–Є–Є —В–Ї–∞–љ–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –ї–Њ–Ї–∞–ї—М–љ–Њ –љ–∞—А—Г—И–∞–µ—В—Б—П —Г—В–Є–ї–Є–Ј–∞—Ж–Є—П –≥–ї—О–Ї–Њ–Ј—Л –Є –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –љ–µ–є—А–Њ–љ–∞–Љ–Є –њ–Њ—Б—В—А–∞–і–∞–≤—И–µ–≥–Њ —Г—З–∞—Б—В–Ї–∞. –Я—А–Њ—Ж–µ—Б—Б—Л –∞—Н—А–Њ–±–љ–Њ–≥–Њ –Њ–Ї–Є—Б–ї–µ–љ–Є—П –Њ—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В—Б—П. –†–∞—Б—Й–µ–њ–ї–µ–љ–Є–µ –≥–ї—О–Ї–Њ–Ј—Л –љ–∞—З–Є–љ–∞–µ—В –њ—А–Њ—В–µ–Ї–∞—В—М –њ–Њ –∞–љ–∞—Н—А–Њ–±–љ–Њ–Љ—Г –њ—Г—В–Є, —З—В–Њ –≤–ї–µ—З–µ—В –Ј–∞ —Б–Њ–±–Њ–є —А–∞–Ј–≤–Є—В–Є–µ –∞—Ж–Є–і–Њ–Ј–∞. –Я–Њ—Б–ї–µ–і–љ–Є–є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є —Д–µ—А–Љ–µ–љ—В–љ—Л—Е —Б–Є—Б—В–µ–Љ, —Г–њ—А–∞–≤–ї—П—О—Й–Є—Е —В—А–∞–љ—Б–Љ–µ–Љ–±—А–∞–љ–љ—Л–Љ –њ–µ—А–µ–љ–Њ—Б–Њ–Љ –Є–Њ–љ–Њ–≤ –Ъ+, Na+, Ca2+. –≠—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –Є–Ј–±—Л—В–Њ—З–љ–Њ–Љ—Г –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—О –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Ї–∞–ї—М—Ж–Є—П —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–µ–Ї–∞ –љ–µ–є—А–Њ–љ–Њ–≤, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–є –∞–±—Б–Њ—А–±—Ж–Є–µ–є –Є–Љ–Є –≤–Њ–і—Л. –Т—Б–µ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –≤–ї–µ–Ї—Г—В –Ј–∞ —Б–Њ–±–Њ–є —А–µ–Ј–Ї–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Є–љ—В–µ–Ј–∞ –Љ–Њ–ї–µ–Ї—Г–ї –Р–Ґ–§ –Є –Р–Ф–§, —А–∞–Ј—А—Г—И–µ–љ–Є–µ —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л—Е –Љ–µ–Љ–±—А–∞–љ –љ–µ–є—А–Њ–љ–Њ–≤ –Є –Є—Е –Њ—А–≥–∞–љ–µ–ї–ї. –Ь–∞—Б—Б–Њ–≤–∞—П –≥–Є–±–µ–ї—М —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Г—Б—Г–≥—Г–±–ї—П–µ—В –Љ–∞—Б—Б–Є–≤–љ–Њ—Б—В—М –њ—А–Њ—Ж–µ—Б—Б–∞ –Я–Ю–Ы –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–Њ—П–≤–ї–µ–љ–Є—О –µ—Й–µ –±–Њ–ї—М—И–µ–≥–Њ —З–Є—Б–ї–∞ —Б–≤–Њ–±–Њ–і–љ—Л—Е —А–∞–і–Є–Ї–∞–ї–Њ–≤. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –љ–µ–Њ–±—А–∞—В–Є–Љ–∞—П –њ–Њ—В–µ—А—П –љ–µ–є—А–Њ–љ–Њ–≤ [13].
–°–Њ–≤–Љ–µ—Б—В–љ–Њ —Б –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л–Љ–Є –љ–∞ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–Љ –і–µ—Д–Є—Ж–Є—В–µ –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–Љ –і–Є—Б–±–∞–ї–∞–љ—Б–µ, —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –≤—В–Њ—А–Є—З–љ–∞—П —А–µ–∞–Ї—Ж–Є—П –ї–Њ–Ї–∞–ї—М–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П. –Я—А–Њ–Є—Б—Е–Њ–і–Є—В –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–Є–µ –≥–µ–љ–Њ–≤, –Ї–Њ–і–Є—А—Г—О—Й–Є—Е –њ—А–Њ—Ж–µ—Б—Б—Л –∞–њ–Њ–њ—В–Њ–Ј–∞. –Т—Б–µ —Н—В–Њ —Г—Б–Ї–Њ—А—П–µ—В –њ—А–Њ—Ж–µ—Б—Б—Л –≥–Є–±–µ–ї–Є –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–Ј–≤–Є—В–Є—О –≤—В–Њ—А–Є—З–љ—Л—Е –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –љ–∞ —Б–Є—Б—В–µ–Љ–љ–Њ–Љ (–≤ —В.—З. –Є –Ї–∞—А–і–Є–∞–ї—М–љ–Њ–Љ) –Є –Њ—А–≥–∞–љ–Є–Ј–Љ–µ–љ–љ–Њ–Љ —Г—А–Њ–≤–љ—П—Е.
–Я—Л—В–∞—П—Б—М –њ—А–Њ—В–Є–≤–Њ—Б—В–Њ—П—В—М –Ї–∞—Б–Ї–∞–і—Г —А–∞–Ј—А—Г—И–Є—В–µ–ї—М–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ–∞—П —Б–Є—Б—В–µ–Љ–∞ –Є—Б—В–Њ—Й–∞–µ—В —Б–≤–Њ–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є, –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ –Њ—Д–Њ—А–Љ–ї—П–µ—В—Б—П —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –≥–Є–±–µ–ї–Є –љ–µ–є—А–Њ–љ–Њ–≤ – –Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–є —Б—В—А–µ—Б—Б.
–Т—Б–µ —Г—Б–Є–ї–Є—П —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –љ–µ–є—А–Њ–љ–∞—Г–Ї –Є —Б–Љ–µ–ґ–љ—Л—Е –і–Є—Б—Ж–Є–њ–ї–Є–љ –љ–∞–њ—А–∞–≤–ї–µ–љ—Л –љ–∞ —Н–ї–Є–Љ–Є–љ–∞—Ж–Є—О –Њ–њ–Є—Б–∞–љ–љ—Л—Е –≤—Л—И–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤. –Я—А–Є —Н—В–Њ–Љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –Љ–Є—И–µ–љ—М—О –і–ї—П –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –Љ–Њ–ґ–µ—В —Б—В–∞—В—М –ї—О–±–∞—П –Є–Ј —Б—В–∞–і–Є–є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Є –≥–Є–±–µ–ї–Є –љ–µ–є—А–Њ–љ–Њ–≤.
–Ю—Б–љ–Њ–≤–љ—Л–µ —Г—Б–Є–ї–Є—П –љ–µ–≤—А–Њ–ї–Њ–≥–Њ–≤ –і–Њ–ї–ґ–љ—Л –±—Л—В—М –љ–∞–њ—А–∞–≤–ї–µ–љ—Л –љ–∞:
– —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ—Г—О –Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –∞–Ї—В–Є–≤–љ—Г—О —А–µ–њ–µ—А—Д—Г–Ј–Є—О;
– –Ї–Њ—А—А–µ–Ї—Ж–Є—О –Њ—Б–љ–Њ–≤–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –ґ–Є–Ј–љ–µ–і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є – —Г—А–Њ–≤–љ—П —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф, –І–°–°, —А–µ–≥—Г–ї—П—Ж–Є—О –≤–Њ–і–љ–Њ-—Н–ї–µ–Ї—В—А–Њ–ї–Є—В–љ–Њ–≥–Њ –±–∞–ї–∞–љ—Б–∞, –І–Ф–Ф, —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л —В–µ–ї–∞, —Б–Њ—Б—В–Њ—П–љ–Є—П –і–Є—Г—А–µ–Ј–∞, —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л, —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є —В.–і.;
– –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г –Є –±–Њ—А—М–±—Г —Б –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є, —Б–≤—П–Ј–∞–љ–љ—Л–Љ–Є —Б –Њ—Б–љ–Њ–≤–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ (–Ю–Э–Ь–Ъ): –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ–Є, —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є, –∞—Б–њ–Є—А–∞—Ж–Є–Њ–љ–љ—Л–Љ–Є, –≥–Є–њ–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Є –і—А.;
– —А–∞–љ–љ—О—О —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є—О;
– –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Г—О —В–µ—А–∞–њ–Є—О.
–Ю—Б–Њ–±–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–∞—П –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–∞—П –Ї–∞—А–і–Є–Њ–љ–µ–≤—А–Њ–ї–Њ–≥–Є—П –њ—А–Є–і–∞–µ—В –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –С–ї–∞–≥–Њ–і–∞—А—П —Г—Б–Є–ї–Є—П–Љ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤ –≤ –Њ–±–ї–∞—Б—В–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л —Г–і–∞–ї–Њ—Б—М –њ–Њ–ї—Г—З–Є—В—М –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞, —Б–њ–Њ—Б–Њ–±–љ—Л–µ –≤–ї–Є—П—В—М –љ–∞ –Ї–∞–ґ–і—Л–є –Є–Ј —Н—В–∞–њ–Њ–≤ –њ–∞—В–Њ–±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–∞—Б–Ї–∞–і–∞. –Ґ–µ—А–∞–њ–Є–µ–є, –Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–є –љ–∞ –њ—А–Є–љ—Ж–Є–њ–∞—Е –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л, —П–≤–ї—П–µ—В—Б—П –≤—В–Њ—А–Є—З–љ–∞—П –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ–∞—П –≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–Љ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є–Є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Б —Ж–µ–ї—М—О –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —А–∞–Ј–≤–Є—В–Є—П –Њ—В—Б—А–Њ—З–µ–љ–љ—Л—Е –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є –Є—И–µ–Љ–Є–Є –Љ–Њ–Ј–≥–∞. –≠—В–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –Њ—Б—Г—Й–µ—Б—В–≤–Є—В—М –њ—Г—В–µ–Љ –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –Є–Ј–±—Л—В–Њ—З–љ–Њ–≥–Њ —Б–Є–љ—В–µ–Ј–∞ –Њ–Ї—Б–Є–і–∞ –∞–Ј–Њ—В–∞, –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –Њ–Ї—Б–Є–і–∞–љ—В–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞ –Є —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤–Њ–≥–Њ –і–Є—Б–±–∞–ї–∞–љ—Б–∞, –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П –Є —Г–Љ–µ–љ—М—И–µ–љ–Є—П —П–≤–ї–µ–љ–Є–є –ї–Њ–Ї–∞–ї—М–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є, –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –У–≠–С, —В–Њ—А–Љ–Њ–ґ–µ–љ–Є—П –∞–њ–Њ–њ—В–Њ–Ј–∞ –Є —В.–і. –£—Б—В—А–∞–љ–µ–љ–Є–µ –і–∞–љ–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –≤ —Б–≤—П–Ј–Є —Б –Є—Е —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–Є–Љ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ –њ—А–Њ—Ж–µ—Б—Б—Л –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П —Б–Њ—Б—Г–і–Њ–≤ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, —З—В–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —А–Є—Б–Ї —В—П–ґ–µ–ї—Л—Е —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–є –њ–Њ—Б–ї–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–≥–Њ –Ю–Э–Ь–Ъ, –∞ —В–∞–Ї–ґ–µ —А–Є—Б–Ї –њ–Њ–≤—В–Њ—А–љ—Л—Е –Ю–Э–Ь–Ъ. –Т—В–Њ—А–Є—З–љ–∞—П –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—Ж–Є—П –≤–Ї–ї—О—З–∞–µ—В –≤ —Б–µ–±—П –Ї–∞–Ї –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Г—О —В–µ—А–∞–њ–Є—О, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ –Є –Љ–Њ–ї–µ–Ї—Г–ї –Ї–ї–µ—В–Њ—З–љ–Њ–є –∞–і–≥–µ–Ј–Є–Є, —А–µ–≥—Г–ї—П—В–Њ—А–Њ–≤ —А–µ—Ж–µ–њ—В–Њ—А–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А (–≥–∞–љ–≥–ї–Є–Њ–Ј–Є–і—Л), —В–∞–Ї –Є –љ–µ–є—А–Њ—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–µ, –љ–µ–є—А–Њ–Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–Є–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ [7, 29].
–Т–µ–і—Г—Й–∞—П —А–Њ–ї—М –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –∞–ї—М—В–µ—А–∞—Ж–Є–Є –Є –≥–Є–±–µ–ї–Є –Ї–ї–µ—В–Њ–Ї –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ –Є—И–µ–Љ–Є–Є –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В –Њ–Ї—Б–Є–і–∞–љ—В–љ–Њ–Љ—Г —Б—В—А–µ—Б—Б—Г –Є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Я–Ю–Ы. –≠—В–Њ –њ–Њ–і—В–∞–ї–Ї–Є–≤–∞–µ—В –Ї –±–Њ–ї–µ–µ –∞–Ї—В–Є–≤–љ–Њ–Љ—Г –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–Њ–≤ –Є –Є—Е –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ [23] —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Э–Ь–Ъ –Є –Њ—Б—В—А—Л–Љ –Ї–Њ—А–Њ–љ–∞—А–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ (–Ю–Ъ–°) –Є–ї–Є –Њ—Б—В—А—Л–Љ –Є–љ—Д–∞—А–Ї—В–Њ–Љ –Љ–Є–Њ–Ї–∞—А–і–∞ (–Ю–Ш–Ь). –Ґ–∞–Ї–ґ–µ –Њ–±—К—П—Б–љ–Є–Љ–Њ –Є –њ–Њ–Ї–∞–Ј–∞–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л —Г –±–Њ–ї—М–љ—Л—Е —Б –Ю–Э–Ь–Ъ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —А–∞–Ј–≤–Є—В–Є—П —Ж–µ—А–µ–±—А–Њ–Ї–∞—А–і–Є–∞–ї—М–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Є —Г –±–Њ–ї—М–љ—Л—Е —Б –Ю–Ъ–°/–Ю–Ш–Ь –і–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П –Є –Ј–∞–±–ї–∞–≥–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Ј–∞—Й–Є—В—Л –љ–µ–є—А–Њ–љ–Њ–≤ –Њ—В –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є –Ї–∞—А–і–Є–Њ—Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞.
–Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–є —А–∞–±–Њ—В—Л –Ш–С–•–§ –Є–Љ. –Э.–Ь. –≠–Љ–∞–љ—Г—Н–ї—П –†–Р–Э, –Э–Ш–Ш —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є –†–Р–Ь–Э –Є –Т–Э–¶ –С–Р–Т –±—Л–ї —А–∞–Ј—А–∞–±–Њ—В–∞–љ 2-—Н—В–Є–ї-6-–Љ–µ—В–Є–ї-3-–≥–Є–і—А–Њ–Ї—Б–Є–њ–Є—А–Є–і–Є–љ–∞ —Б—Г–Ї—Ж–Є–љ–∞—В (–≠–Ь–У–Я–°). –Э–∞ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–Љ —А—Л–љ–Ї–µ –Њ–љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –Ї–Њ–Љ–њ–∞–љ–Є–µ–є «–°–Њ—В–µ–Ї—Б» –њ–Њ–і –љ–∞–Ј–≤–∞–љ–Є–µ–Љ –Э–µ–є—А–Њ–Ї—Б. –Я—А–µ–њ–∞—А–∞—В –Є–Љ–µ–µ—В –і–≤—Г–љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ: —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Њ–љ –і–µ–є—Б—В–≤—Г–µ—В –Ї–∞–Ї –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В, –∞ —Б –і—А—Г–≥–Њ–є – —П—А–Ї–Њ –њ—А–Њ—П–≤–ї—П–µ—В –∞–љ—В–Є–≥–Є–њ–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞, —В–µ–Љ —Б–∞–Љ—Л–Љ –љ–Њ—А–Љ–∞–ї–Є–Ј—Г—П –Є —Г—Б–Є–ї–Є–≤–∞—П —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є–є –Њ–±–Љ–µ–љ –≤ –Ї–ї–µ—В–Ї–µ. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ—Л–Љ–Є —П–≤–ї—П—О—В—Б—П –µ–≥–Њ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–µ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –і—А—Г–≥–Є–Љ–Є –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–µ –Є –∞–љ—В–Є–≥–Є–њ–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ [2]. –Ф–Њ—Б—В–Њ–Є–љ—Б—В–≤–∞–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞ —П–≤–ї—П—О—В—Б—П –Є –µ–≥–Њ –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–є –њ–µ—А–µ—З–µ–љ—М –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є, –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –Є —Е–Њ—А–Њ—И–∞—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М [10].
–Я—А–µ–њ–∞—А–∞—В –Э–µ–є—А–Њ–Ї—Б –Њ–±–ї–∞–і–∞–µ—В –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ—Л–Љ, –≥–Є–њ–Њ–ї–Є–њ–Є–і–µ–Љ–Є—З–µ—Б–Ї–Є–Љ, –∞–љ—В–Є—Б—В—А–µ—Б—Б–Њ–≤—Л–Љ, –љ–Њ–Њ—В—А–Њ–њ–љ—Л–Љ, –У–Р–Ь–Ъ-–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–Љ —Н—Д—Д–µ–Ї—В–∞–Љ–Є. –§–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П –љ–∞ —В—А–µ—Е —Г—А–Њ–≤–љ—П—Е – –љ–µ–є—А–Њ–љ–∞–ї—М–љ–Њ–Љ, —Б–Њ—Б—Г–і–Є—Б—В–Њ–Љ –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–Љ. –Э–µ–є—А–Њ–Ї—Б –љ–Њ—А–Љ–∞–ї–Є–Ј—Г–µ—В —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є–є –Њ–±–Љ–µ–љ –Ї–ї–µ—В–Ї–Є, —Г–ї—Г—З—И–∞–µ—В —Б–Є–љ–∞–њ—В–Є—З–µ—Б–Ї—Г—О –њ–µ—А–µ–і–∞—З—Г. –С–ї–∞–≥–Њ–і–∞—А—П –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ–Њ–Љ—Г –і–µ–є—Б—В–≤–Є—О –Э–µ–є—А–Њ–Ї—Б –Є–љ–≥–Є–±–Є—А—Г–µ—В —Б–≤–Њ–±–Њ–і–љ–Њ—А–∞–і–Є–Ї–∞–ї—М–љ–Њ–µ –Њ–Ї–Є—Б–ї–µ–љ–Є–µ –ї–Є–њ–Є–і–Њ–≤ –Љ–µ–Љ–±—А–∞–љ, –њ–Њ–≤—Л—И–∞–µ—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ [30].
–Ч–∞ —Б—З–µ—В —Б–≤–Њ–µ–≥–Њ –∞–љ—В–Є—Б—В—А–µ—Б—Б–Њ–≤–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –Э–µ–є—А–Њ–Ї—Б [2] —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –Ю–Ъ–° –Є –Ю–Э–Ь–Ъ –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ, —В.–Ї. –і–Њ–Ї–∞–Ј–∞–љ–∞ —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —Б—В—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ —А–∞–Ј–≤–Є—В–Є–µ–Љ –Ю–Ъ–°, –∞ —В–∞–Ї–ґ–µ –љ–∞–ї–Є—З–Є–µ–Љ –Ю–Э–Ь–Ъ –Є —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –і–µ–Ј–∞–і–∞–њ—В–∞—Ж–Є–Є –Є —В—А–µ–≤–Њ–ґ–љ–Њ-–і–µ–њ—А–µ—Б—Б–Є–≤–љ—Л–Љ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–Њ–Љ –≤ –Њ—Б—В—А–Њ–Љ –Є —А–∞–љ–љ–µ–Љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Ю–Э–Ь–Ъ. –Ф–µ–є—Б—В–≤–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –±—Г–і–µ—В –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –љ–∞ –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–µ –њ–Њ–≤—В–Њ—А–љ—Л—Е –ї–Є–±–Њ –≤—В–Њ—А–Є—З–љ—Л—Е –Ї–∞—А–і–Є–Њ–љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Я—А–µ–њ–∞—А–∞—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ –Ї–∞–Ї —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–µ –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–µ —Б—А–µ–і—Б—В–≤–Њ –≤ —В–µ—А–∞–њ–Є–Є –Ю–Э–Ь–Ъ –Є –Ю–Ъ–° [2].
–°—Е–µ–Љ–∞ –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Ю–Э–Ь–Ъ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –Э–µ–є—А–Њ–Ї—Б: –≤ –њ–µ—А–≤—Л–µ 10–14 –і–љ–µ–є –Э–µ–є—А–Њ–Ї—Б –њ—А–Є–Љ–µ–љ—П—О—В –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –Ї–∞–њ–µ–ї—М–љ–Њ –њ–Њ 200–500 –Љ–≥ 2–4 —А–∞–Ј/—Б—Г—В., –Ј–∞—В–µ–Љ –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ –њ–Њ 200–250 –Љ–≥ 2–3 —А–∞–Ј–∞/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 2 –љ–µ–і.
–Т—Б–ї–µ–і—Б—В–≤–Є–µ –Њ–±—И–Є—А–љ–Њ—Б—В–Є –Є —В—П–ґ–µ—Б—В–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –љ–µ–є—А–Њ–љ–Њ–≤ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ —А–∞–Ј–љ—Л–µ –Ј–≤–µ–љ—М—П –њ–∞—В–Њ–±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–∞—Б–Ї–∞–і–∞.
–¶–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ —А–∞–Ј–љ–Њ–њ–ї–∞–љ–Њ–≤–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –њ—А–Њ—Ж–µ—Б—Б—Л –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Ї–∞–Ї –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —Б –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ, —В–∞–Ї –Є –љ–µ–є—А–Њ–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є.
–§–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –Ї–Њ–Љ–њ–∞–љ–Є–µ–є «–°–Њ—В–µ–Ї—Б» —В–∞–Ї–ґ–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–µ —Б—А–µ–і—Б—В–≤–Њ –¶–µ—А–µ—В–Њ–љ (—Е–Њ–ї–Є–љ–∞ –∞–ї—М—Д–Њ—Б—Ж–µ—А–∞—В) – –љ–µ–є—А–Њ–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л–є –њ—А–µ–њ–∞—А–∞—В. –Ь–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г—П—Б—М –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤ –≥–Њ–ї–Њ–≤–љ–Њ–Љ –Љ–Њ–Ј–≥–µ –і–Њ —Е–Њ–ї–Є–љ–∞, —Б—В–Є–Љ—Г–ї–Є—А—Г—П –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ–µ –≤—Л–і–µ–ї–µ–љ–Є–µ –∞—Ж–µ—В–Є–ї—Е–Њ–ї–Є–љ–∞, –¶–µ—А–µ—В–Њ–љ, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —П–≤–ї—П–µ—В—Б—П —Ж–µ–љ—В—А–∞–ї—М–љ—Л–Љ —Е–Њ–ї–Є–љ–Њ–Љ–Є–Љ–µ—В–Є–Ї–Њ–Љ. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є –Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Е–Њ–ї–Є–љ–∞ –∞–ї—М—Д–Њ—Б—Ж–µ—А–∞—В —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –љ–µ–є—А–Њ–њ–ї–∞—Б—В–Є—З–љ–Њ—Б—В—М –Љ–µ–Љ–±—А–∞–љ –≤ —Е–Њ–ї–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Є—Е –љ–µ–є—А–Њ–љ–∞—Е [39], —Г–ї—Г—З—И–∞–µ—В –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—Б—Б–Є—О –≤ –≥–Њ–ї–Њ–≤–љ–Њ–Љ –Љ–Њ–Ј–≥–µ [43], –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —Ж–Є—В–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ, —Г–Љ–µ–љ—М—И–∞–µ—В –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л–є –і–µ—Д–Є—Ж–Є—В [28, 38, 40]. –С–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П –±–Њ–ї—М–љ—Л—Е —Б –Ю–Э–Ь–Ъ –Є–Љ–µ–µ—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Е–Њ–ї–Є–љ–∞ –∞–ї—М—Д–Њ—Б—Ж–µ—А–∞—В–∞ –њ–Њ–≤—Л—И–∞—В—М —Г—А–Њ–≤–µ–љ—М —Б–Њ–Ј–љ–∞–љ–Є—П, —Б–Њ–Ї—А–∞—Й–∞—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М —Б–Њ–њ–Њ—А–∞ –Є–ї–Є –Ї–Њ–Љ—Л, —Г–Љ–µ–љ—М—И–∞—П –≤—А–µ–Љ—П –њ—А–µ–±—Л–≤–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –њ–∞–ї–∞—В–∞—Е –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є [28]. –Т —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, —Н—В–Є –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–∞ —Б–љ–Є–ґ–∞—О—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –≥–Є–њ–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Є—Е –Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —А–∞–љ–љ–µ–є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –±–Њ–ї—М–љ—Л—Е, —З—В–Њ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б –±–Њ–ї–µ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –њ—А–Њ–≥–љ–Њ–Ј–Њ–Љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —Г—В—А–∞—З–µ–љ–љ—Л—Е –Љ–Њ—В–Њ—А–љ—Л—Е –Є –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є. –Я–Њ –і–∞–љ–љ—Л–Љ –Ь–†-—Б–њ–µ–Ї—В—А–Њ—Б–Ї–Њ–њ–Є–Є –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Є–љ—Б—Г–ї—М—В–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Е–Њ–ї–Є–љ–∞ –Є –Ї—А–µ–∞—В–Є–љ–Є–љ–∞. –Т–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Е–Њ–ї–Є–љ–∞ –≤ —В–Ї–∞–љ–Є –Љ–Њ–Ј–≥–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Ї 10–14-–Љ—Г –і–љ—О, —Г—А–Њ–≤–µ–љ—М –Ї—А–µ–∞—В–Є–љ–Є–љ–∞ –Њ—Б—В–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–љ—Л–Љ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –µ—Й–µ 3 –Љ–µ—Б. [37, 41, 42]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –¶–µ—А–µ—В–Њ–љ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г–µ—В —Е–Њ—А–Њ—И–Є–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б—В—А—Л–Љ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ [6, 17, 30].
–Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –¶–µ—А–µ—В–Њ–љ –Є –Э–µ–є—А–Њ–Ї—Б —П–≤–ї—П–µ—В—Б—П –Є–і–µ–∞–ї—М–љ–Њ–є –љ–µ —В–Њ–ї—М–Ї–Њ –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Ю–Э–Ь–Ъ –Є –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞, –љ–Њ –Є –і–ї—П –±–Њ–ї—М–љ—Л—Е —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –¶–Т–Ч. –Я—А–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –і–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ —А–∞–Ј–љ—Л–µ –Ј–≤–µ–љ—М—П –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Ж–µ–њ–Є –Њ—Б—В—А–Њ–є –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Є—И–µ–Љ–Є–Є. –С–ї–∞–≥–Њ–і–∞—А—П –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Э–µ–є—А–Њ–Ї—Б –≤–Њ–Ј–Љ–Њ–ґ–љ—Л –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ –Є –≤–Њ–Ј–Љ–µ—Й–µ–љ–Є–µ —Г–ґ–µ –≤–Њ–Ј–љ–Є–Ї—И–µ–≥–Њ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞, –Ј–∞–Љ–µ–і–ї–µ–љ–Є–µ –Є —В–Њ—А–Љ–Њ–ґ–µ–љ–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Я–Ю–Ы. –Р–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –¶–µ—А–µ—В–Њ–љ –њ—А–Є —Н—В–Њ–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–∞ –љ–∞ –њ—А–Њ—В–µ–Ї—Ж–Є—О –Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –±–Є–ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–ї–Њ—П –Љ–µ–Љ–±—А–∞–љ –Ї–ї–µ—В–Њ–Ї –Љ–Є—И–µ–љ–µ–є (–≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є –Љ–Є–Њ–Ї–∞—А–і–∞), –љ–∞ —Б–Є–љ—В–µ–Ј —Д–Њ—Б—Д–Њ—В–Є–і–Є–ї—Е–Њ–ї–Є–љ–∞. –Ъ–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ –і–∞–љ–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–Љ–Є –Є —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–µ –њ–µ—А–µ–Ї—А–µ—Б—В–љ—Л—Е –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –Љ–Є–Њ–Ї–∞—А–і–∞ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –µ–≥–Њ —Б–Њ–Ї—А–∞—В–Є—В–µ–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є. –С–ї–∞–≥–Њ–і–∞—А—П —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –¶–µ—А–µ—В–Њ–љ —Б–љ–Є–ґ–∞—О—В—Б—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Є —В–µ–Љ–њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ–≥–љ–Є—В–Є–≤–љ–Њ-–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤, —З—В–Њ, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –≤–∞–ґ–љ–Њ, —Г—З–Є—В—Л–≤–∞—П –љ–∞–ї–Є—З–Є–µ —Г –Ї–∞–ґ–і–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ –°–°–Ч —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Ї–∞–Ї –Љ–Є–Њ–Ї–∞—А–і–∞ (–Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ –≤ —Д–Њ—А–Љ–µ –Ш–С–°), —В–∞–Ї –Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ (–≤ —Д–Њ—А–Љ–µ –•–Ш–Ь –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б—В–∞–і–Є—П—Е).
–Я—А–Є –Њ—Б—В—А—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е –¶–µ—А–µ—В–Њ–љ –≤–≤–Њ–і—П—В –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –Є–ї–Є –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ –њ–Њ 1000 –Љ–≥ (1 –∞–Љ–њ—Г–ї–∞) 1 —А–∞–Ј/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 2 –љ–µ–і. —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –њ–µ—А–µ—Е–Њ–і–Њ–Љ –≤ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –љ–∞ –њ–µ—А–Њ—А–∞–ї—М–љ—Г—О —Д–Њ—А–Љ—Г, –Ї–∞–њ—Б—Г–ї—Л, –њ–Њ 400 –Љ–≥ 3 —А–∞–Ј–∞/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –Я—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ—П—О—В –Ї–∞–њ—Б—Г–ї—Л –њ–Њ 400 –Љ–≥ 3 —А–∞–Ј–∞/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 3–6 –Љ–µ—Б.
–Т —Е–Њ–і–µ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞–Љ–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Е–Њ–ї–Є–љ–∞ –∞–ї—М—Д–Њ—Б—Ж–µ—А–∞—В–∞ –Є –≠–Ь–У–Я–° —Г –±–Њ–ї—М–љ—Л—Е –≤ –Њ—Б—В—А—Л–є –њ–µ—А–Є–Њ–і –љ–∞—А—Г—И–µ–љ–Є—П –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П –њ–Њ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–Љ—Г —В–Є–њ—Г. –Т –≥—А—Г–њ–њ—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л 32 –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Ю–Э–Ь–Ъ –њ–Њ–ї—Г—И–∞—А–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є, —Б –±–∞–ї–ї–Њ–Љ –њ–Њ —И–Ї–∞–ї–µ –†—Н–љ–Ї–Є–љ –Њ—В 4 –Є –±–Њ–ї–µ–µ, –Ї–Њ—В–Њ—А—Л–µ —Б –њ–µ—А–≤—Л—Е —Б—Г—В–Њ–Ї –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –њ–Њ–ї—Г—З–∞–ї–Є –±–∞–Ј–Њ–≤—Г—О —В–µ—А–∞–њ–Є—О –Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –¶–µ—А–µ—В–Њ–љ –Є –Э–µ–є—А–Њ–Ї—Б. –Я–Њ–Љ–Є–Љ–Њ —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ –њ–ї–∞–љ–∞ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г –±–Њ–ї—М–љ—Л—Е –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –њ—А–Њ–≤–Њ–і–Є–ї—Б—П –Ї–Њ–љ—В—А–Њ–ї—М –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —И–Ї–∞–ї—Л NIHSS, —И–Ї–∞–ї—Л –і–µ–њ—А–µ—Б—Б–Є–Є MADRS, —И–Ї–∞–ї—Л –†—Н–љ–Ї–Є–љ –Ї–∞–ґ–і—Л–µ 3 —Б—Г—В. –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 21 –і–љ—П. –Ч–∞ –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є–є –љ–Є–Ї–∞–Ї–Є—Е –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –Є –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ –љ–µ –±—Л–ї–Њ.
–¶–µ–ї—М—О –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —П–≤–Є–ї–∞—Б—М –Њ—Ж–µ–љ–Ї–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Е–Њ–ї–Є–љ–∞ –∞–ї—М—Д–Њ—Б—Ж–µ—А–∞—В–Њ–Љ (–¶–µ—А–µ—В–Њ–љ) –Є –≠–Ь–У–Я–° (–Э–µ–є—А–Њ–Ї—Б) –њ—А–Є —Б–ї–µ–і—Г—О—Й–µ–Љ —А–µ–ґ–Є–Љ–µ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П: –¶–µ—А–µ—В–Њ–љ – 1000 –Љ–≥/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 10 –і–љ–µ–є –њ—А–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–Љ, –Ї–∞–њ–µ–ї—М–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –љ–∞ 200,0 —Д–Є–Ј—А–∞—Б—В–≤–Њ—А–∞; –Э–µ–є—А–Њ–Ї—Б – 250 –Љ–≥/5,0 –Љ–ї –њ—А–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–Љ –±–Њ–ї—О—Б–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –љ–∞ 15 –Љ–ї —Д–Є–Ј—А–∞—Б—В–≤–Њ—А–∞.
–Ь–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Ю—В–Ї—А—Л—В–Њ–µ –∞–Ї—В–Є–≤–љ–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Е–Њ–ї–Є–љ–Њ–Љ –∞–ї—М—Д–Њ—Б—Ж–µ—А–∞—В–Њ–Љ –Є —Н—В–Є–ї–Љ–µ—В–Є–ї–≥–Є–і—А–Њ–Ї—Б–Є–њ–Є—А–Є–і–Є–љ–∞ —Б—Г–Ї—Ж–Є–љ–∞—В–Њ–Љ –≤ –Ї–∞—З–µ—Б—В–≤–µ –і–Њ–њ–Њ–ї–љ–µ–љ–Є—П –Ї —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ –њ–Њ–ї—Г—И–∞—А–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є. –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –≤ –њ—А–Є–≤–µ–і–µ–љ–љ–Њ–Љ —А–µ–ґ–Є–Љ–µ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П – 10 –і–љ–µ–є. –Я–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П – 21 –і–µ–љ—М.
–Т —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г—З–∞—Б—В–≤–Њ–≤–∞–ї–Є –њ–∞—Ж–Є–µ–љ—В—Л: –≤ –Њ—Б—В—А–µ–є—И–µ–Љ –њ–µ—А–Є–Њ–і–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞; –±–µ–Ј –њ—А–µ–і—Л–і—Г—Й–µ–≥–Њ –Љ–Њ—В–Њ—А–љ–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞; –≤ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –Њ—В 55 –і–Њ 65 –ї–µ—В; —Б –Ъ–Ґ/–Ь–†–Ґ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ—Л–Љ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Њ—З–∞–≥–Њ–Љ –њ–Њ–ї—Г—И–∞—А–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є; —Б –±–∞–ї–ї–Њ–Љ –њ–Њ —И–Ї–∞–ї–µ –†—Н–љ–Ї–Є–љ–∞ –Њ—В 4; –±—Л–ї–Њ –њ–Њ–ї—Г—З–µ–љ–Њ —Б–Њ–≥–ї–∞—Б–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞ –Є–ї–Є –µ–≥–Њ —А–Њ–і—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ –љ–∞ —Г—З–∞—Б—В–Є–µ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Њ–є —А–∞–±–Њ—В–µ, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –і–∞–љ–љ—Л—Е –њ—А–Є –Њ–±—А–∞–±–Њ—В–Ї–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –љ–∞–±–ї—О–і–µ–љ–Є—П, –Њ–Ї–∞–Ј–∞–љ–Є–µ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є.
–Ъ—А–Є—В–µ—А–Є–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П: –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–∞—П –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤; –љ–∞–ї–Є—З–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є–є, —П–≤–ї—П—О—Й–Є—Е—Б—П –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –і–∞–љ–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤; —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ —В—П–ґ–µ–ї—Л–µ —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤ —Б—В–∞–і–Є–Є –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Ї–Њ—В–Њ—А—Л—Е –Љ–Њ–≥–ї–Є –±—Л –њ–Њ–Љ–µ—И–∞—В—М –Њ—Ж–µ–љ–Ї–µ –і–Є–љ–∞–Љ–Є–Ї–Є —Б–Њ—Б—В–Њ—П–љ–Є—П; –Љ–µ—А—Ж–∞—В–µ–ї—М–љ–∞—П –∞—А–Є—В–Љ–Є—П, –љ–∞—А—Г—И–µ–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ–≥–Њ —А–Є—В–Љ–∞ –і—А—Г–≥–Њ–≥–Њ —А–Њ–і–∞; –љ–∞—А—Г—И–µ–љ–Є—П —Б–Њ–Ј–љ–∞–љ–Є—П, –љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–∞ –Њ—Ж–µ–љ–Є—В—М —Б–≤–Њ–µ –њ—Б–Є—Е–Њ—Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–µ –Є —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ –Ј–і–Њ—А–Њ–≤—М–µ.
–Ф–Є–∞–≥–љ–Њ–Ј —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї—Б—П –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –і–∞–љ–љ—Л—Е –∞–љ–∞–Љ–љ–µ–Ј–∞, –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—Б–Љ–Њ—В—А–∞ —Б –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ–Љ –і–∞–љ–љ—Л–Љ–Є –Ъ–Ґ/–Ь–†–Ґ-–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Ю—Ж–µ–љ–Ї–∞ –њ–Њ —И–Ї–∞–ї–∞–Љ NIHSS, MADRS, —И–Ї–∞–ї–µ –†—Н–љ–Ї–Є–љ–∞ –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–∞—Б—М –≤ –Љ–Њ–Љ–µ–љ—В –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П, –љ–∞ 3, 6, 9, 12, 15, 18 –Є 21-–µ —Б—Г—В. –ї–µ—З–µ–љ–Є—П.
–С–∞–Ј–Њ–≤–∞—П —В–µ—А–∞–њ–Є—П, –њ—А–Њ–≤–Њ–і–Є–≤—И–∞—П—Б—П —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ —Б—В–∞–љ–і–∞—А—В–∞–Љ –†–§ (–њ—А–Њ—В–Њ–Ї–Њ–ї—Г –≤–µ–і–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е «–Ш–љ—Б—Г–ї—М—В») –Є —Б—В–∞–љ–і–∞—А—В–∞–Љ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –±–Њ–ї—М–љ—Л–Љ —Б –Є–љ—Б—Г–ї—М—В–Њ–Љ 2007 –≥.
–Ф–ї—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –њ–Њ–і—Б—З–Є—В—Л–≤–∞–ї–Є—Б—М —Б—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –Є —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–µ. –†–∞–Ј–ї–Є—З–Є—П —Б—З–Є—В–∞–ї–Є—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ–Є –њ—А–Є —А<0,05. –Ю–±—А–∞–±–Њ—В–Ї–∞ –і–∞–љ–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –њ—А–Њ–≥—А–∞–Љ–Љ–љ—Л—Е –њ–∞–Ї–µ—В–Њ–≤ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ SPSS statistics 17.0 –Є STATISTICA 6.0.
–†–µ–Ј—Г–ї—М—В–∞—В—Л
–•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –±–Њ–ї—М–љ—Л—Е
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л 32 –њ–∞—Ж–Є–µ–љ—В–∞. –£ –≤—Б–µ—Е –Є–Љ–µ–ї–∞—Б—М —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–∞—П –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П (–њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–∞—П –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л–Љ–Є, –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є –Є –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ–Љ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–∞). –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б—В—А–∞–і–∞–ї–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є 3 —Б—В–µ–њ–µ–љ–Є, —А–Є—Б–Ї 4; –Ш–С–°, –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є–Љ –Ї–∞—А–і–Є–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ; –≥–Є–њ–µ—А—В—А–Њ—Д–Є–µ–є –Љ–Є–Њ–Ї–∞—А–і–∞ –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞; –≥–Є–њ–µ—А-, –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є–µ–є. –Я—А–µ–≤–∞–ї–Є—А—Г—О—Й–µ–µ —З–Є—Б–ї–Њ –Є–љ—Б—Г–ї—М—В–Њ–≤ – –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞.
–Ю—Ж–µ–љ–Ї–∞ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –ї–µ—З–µ–љ–Є—П
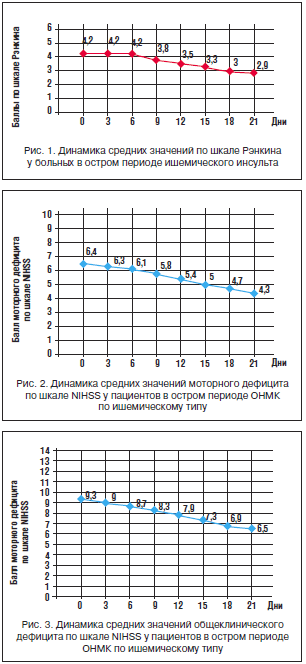
–Я–Њ –Є—В–Њ–≥–∞–Љ –Њ—Ж–µ–љ–Ї–Є –≤—Б–µ—Е –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л—Е, –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Є –њ–Њ –і–∞–љ–љ—Л–Љ —И–Ї–∞–ї, —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–Њ–ї—М–љ—Л—Е –љ–∞ –Љ–Њ–Љ–µ–љ—В –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –Љ–Њ–ґ–љ–Њ –Њ—Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞—В—М –Ї–∞–Ї —В—П–ґ–µ–ї–Њ–µ (—Б—А–µ–і–љ–Є–є –±–∞–ї–ї –њ–Њ —И–Ї–∞–ї–µ NIHSS –±—Л–ї —А–∞–≤–µ–љ 9,3, –њ—А–Є —Н—В–Њ–Љ —В—П–ґ–µ–ї—Л–Љ –Є–љ—Б—Г–ї—М—В —Б—З–Є—В–∞–µ—В—Б—П –љ–∞—З–Є–љ–∞—П —Б 9 –±–∞–ї–ї–Њ–≤). –Э–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –Њ—В–Љ–µ—З–∞–ї–∞—Б—М –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞, –≤—Л—А–∞–ґ–∞–≤—И–∞—П—Б—П –≤ —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Љ–Њ—В–Њ—А–љ–Њ–≥–Њ –Є –љ–µ–Љ–Њ—В–Њ—А–љ–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞, —Б–љ–Є–ґ–µ–љ–Є–Є —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –љ–∞—А—Г—И–µ–љ–Є—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Ї —Б–∞–Љ–Њ–Њ–±—Б–ї—Г–ґ–Є–≤–∞–љ–Є—О, —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –і–µ–њ—А–µ—Б—Б–Є–Є. –Я–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ—В—А–∞–ґ–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–∞—Е 1–4.
–Т —Е–Њ–і–µ –ї–µ—З–µ–љ–Є—П –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ –Љ–Њ—В–Њ—А–љ–Њ–≥–Њ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞, –Њ—Ж–µ–љ–µ–љ–љ–Њ–≥–Њ –њ–Њ —И–Ї–∞–ї–µ NIHSS – —Б 6,4 –±–∞–ї–ї–∞ –њ—А–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є –і–Њ 4,3 –±–∞–ї–ї–∞ –љ–∞ 21-–µ —Б—Г—В. –Ю–±—Й–Є–є –±–∞–ї–ї –њ–Њ —И–Ї–∞–ї–µ NIHSS –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є —Г–Љ–µ–љ—М—И–∞–ї—Б—П —Б 9,3 –і–Њ 6,5 –±–∞–ї–ї–∞ (—А<0,05) –Ї –Њ–Ї–Њ–љ—З–∞–љ–Є—О –љ–∞–±–ї—О–і–µ–љ–Є–є. –°–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї —Б–∞–Љ–Њ–Њ–±—Б–ї—Г–ґ–Є–≤–∞–љ–Є—О, –Њ—Ж–µ–љ–µ–љ–љ–∞—П –њ–Њ —И–Ї–∞–ї–µ –†—Н–љ–Ї–Є–љ–∞, —Г–ї—Г—З—И–∞–ї–∞—Б—М —Б 4,2 –±–∞–ї–ї–∞ (—З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ–Љ—Г –љ–∞—А—Г—И–µ–љ–Є—О –ґ–Є–Ј–љ–µ–і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є; –љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Е–Њ–і–Є—В—М –Є —Б–њ—А–∞–≤–ї—П—В—М—Б—П —Б–Њ —Б–≤–Њ–Є–Љ–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Є–Љ–Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В—П–Љ–Є –±–µ–Ј –њ–Њ—Б—В–Њ—А–Њ–љ–љ–µ–є –њ–Њ–Љ–Њ—Й–Є) –≤ –Љ–Њ–Љ–µ–љ—В –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –і–Њ 2,9 (—З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —Г–Љ–µ—А–µ–љ–љ–Њ–Љ—Г –љ–∞—А—Г—И–µ–љ–Є—О –ґ–Є–Ј–љ–µ–і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є; –љ–∞–ї–Є—З–Є—О –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –љ–µ–Ї–Њ—В–Њ—А–Њ–є –њ–Њ–Љ–Њ—Й–Є, –љ–Њ –њ–∞—Ж–Є–µ–љ—В —Б–њ–Њ—Б–Њ–±–µ–љ –њ–µ—А–µ–Љ–µ—Й–∞—В—М—Б—П —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ) –Ї –Љ–Њ–Љ–µ–љ—В—Г –Њ–Ї–Њ–љ—З–∞–љ–Є—П –љ–∞–±–ї—О–і–µ–љ–Є—П. –Т—Л—А–∞–ґ–µ–љ–љ—Л—Е –і–µ–њ—А–µ—Б—Б–Є–≤–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –Ј–∞ –≤—А–µ–Љ—П –љ–∞–±–ї—О–і–µ–љ–Є–є –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ –±—Л–ї–Њ.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤
–Т –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –љ–∞–±–ї—О–і–µ–љ–Є–Є –њ–Њ–Ї–∞–Ј–∞–љ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Е–Њ–ї–Є–љ–∞ –∞–ї—М—Д–Њ—Б—Ж–µ—А–∞—В–∞ –Є –≠–Ь–У–Я–° (–¶–µ—А–µ—В–Њ–љ –Є –Э–µ–є—А–Њ–Ї—Б) –љ–∞ –і–Є–љ–∞–Љ–Є–Ї—Г –Њ–±—Й–µ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Є –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є (–њ–Њ —И–Ї–∞–ї–µ NIHSS), –љ–∞ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї —Б–∞–Љ–Њ–Њ–±—Б–ї—Г–ґ–Є–≤–∞–љ–Є—О (–њ–Њ —И–Ї–∞–ї–µ –†—Н–љ–Ї–Є–љ–∞). –Ю—В–Љ–µ—З–µ–љ —Е–Њ—А–Њ—И–Є–є –њ—А–Њ—Д–Є–ї—М –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –і–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –љ–µ –±—Л–ї–Њ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –Є –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є, –љ–∞–њ—А—П–Љ—Г—О —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Є–ї–Є —А–µ–ґ–Є–Љ–Њ–Љ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П. –Р–љ–∞–ї–Є–Ј–Є—А—Г—П –і–∞–љ–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –Є –Њ–њ–Є—А–∞—П—Б—М –љ–∞ –Є–Ј–≤–µ—Б—В–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –і–µ–є—Б—В–≤–Є—П –і–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Љ–Њ–ґ–љ–Њ —Б–і–µ–ї–∞—В—М –≤—Л–≤–Њ–і –Њ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –і–∞–љ–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –≤ —Б–≤—П–Ј–Є —Б –љ–∞–±–ї—О–і–∞–µ–Љ–Њ–є –Є—Е —Б–Є–љ–µ—А–≥–Є–µ–є.

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Р–Ї–Є–Љ–Њ–≤ –У.–Р., –Ч–Є–љ—З–µ–љ–Ї–Њ –Т.–Р. –Э–µ–Ї–Њ—В–Њ—А—Л–µ —Б—В–Њ—А–Њ–љ—Л –ї–µ—З–µ–љ–Є—П –≥–Є–њ–Њ–Ї—Б–Є–Є –њ—А–Є —Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –Љ–Њ–Ј–≥–∞. // –Р–Ї—В—Г–∞–ї—М–љ—Л–µ –≤–Њ–њ—А–Њ—Б—Л –љ–µ–≤—А–Њ–њ–∞—В–Њ–ї–Њ–≥–Є–Є –Є –љ–µ–є—А–Њ—Е–Є—А—Г—А–≥–Є–Є. –Ґ–∞–ї–ї–Є–љ, 1984, вДЦ 1. –°. 6–8.
2. –С–∞–і–∞–ї—П–љ –Ю.–Ы., –Я–Њ–≥–Њ—Б—П–љ –Р.–°., –°–∞–≤–µ–љ–Ї–Њ–≤ –Р.–Р. –Є –і—А. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Э–µ–є—А–Њ–Ї—Б –Є –¶–µ—А–µ—В–Њ–љ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є // –†–Ь–Ц. –≠–ї–µ–Ї—В—А–Њ–љ–љ–Њ–µ –Є–Ј–і–∞–љ–Є–µ - http://www.rmj.ru/articles_7709.htm.
3. –С–Њ–Ї–µ—А–Є—П –Ы.–Р., –°—В—Г–њ–∞–Ї–Њ–≤ –Ш.–Э., –У—Г–і–Ї–Њ–≤–∞ –†.–У. –£—Б–њ–µ—Е–Є –Є –њ—А–Њ–±–ї–µ–Љ—Л —А–Њ—Б—Б–Є–є—Б–Ї–Њ–є –Ї–∞—А–і–Є–Њ—Е–Є—А—Г—А–≥–Є–Є // –Ч–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є–µ. 2012. вДЦ 3. –°. 24–33.
4. –Т–∞—А–∞–Ї–Є–љ –Ь.–Р., –Ъ–Є–њ–Є–∞–љ–Є –Ь.–Ъ., –Ь–Њ–ї–∞-–Ч–∞–і–µ –Э.–Ч. –Є –і—А. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Є —Б—В—А—Г–Ї—В—Г—А–∞ –¶–Т–Ч –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ–≥–Є–Њ–љ–∞—Е –°–°–°–† –њ–Њ –і–∞–љ–љ—Л–Љ –Њ–і–љ–Њ–Љ–Њ–Љ–µ–љ—В–љ–Њ–≥–Њ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П // –Э–µ–≤—А–Њ–ї–Њ–≥–Є—П –Є –њ—Б–Є—Е–Є–∞—В—А–Є—П. 1990. вДЦ 11. –°. 7–10.
5. –Т–µ—А–µ—Й–∞–≥–Є–љ –Э.–Т. –Є –і—А. –Я–∞—В–Њ–ї–Њ–≥–Є—П –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –њ—А–Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–µ –Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є. –Ь.: –Ь–µ–і–Є—Ж–Є–љ–∞, 1997. 288 —Б.
6. –Т–Њ–Ј–љ—О–Ї –Ш.–Р., –Ю–і–Є–љ–∞–Ї –Ь.–Ь., –Ъ—Г–Ј–љ–µ—Ж–Њ–≤ –Р.–Э. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –≥–ї–Є–∞—В–Є–ї–Є–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б—В—А—Л–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П // –°–Њ—Б—Г–і–Є—Б—В–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –°–Я–±., 1998. –°. 167–172.
7. –У—Г—Б–µ–≤ –Х.–Ш. –Э–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞. –≠–ї–µ–Ї—В—А–Њ–љ–љ–Њ–µ –Є–Ј–і–∞–љ–Є–µ: http://www.medee.ru/post/view/8931
8. –У—Г—Б–µ–≤ –Х.–Ш., –°–Ї–≤–Њ—А—Ж–Њ–≤–∞ –Т.–Ш., –°—В–∞—Е–Њ–≤—Б–Ї–∞—П –Ы.–Т. –Я—А–Њ–±–ї–µ–Љ–∞ –Є–љ—Б—Г–ї—М—В–∞ –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є: –≤—А–µ–Љ—П –∞–Ї—В–Є–≤–љ—Л—Е —Б–Њ–≤–Љ–µ—Б—В–љ—Л—Е –і–µ–є—Б—В–≤–Є–є // –Ц—Г—А–љ. –љ–µ–≤—А–Њ–ї. –Є –њ—Б–Є—Е–Є–∞—В—А. 2007. вДЦ 8. –°. 4–10.
9. –У—Г—Б–µ–≤ –Х.–Ш., –°–Ї–≤–Њ—А—Ж–Њ–≤–∞ –Т.–Ш. –Э–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞. II. –Т—В–Њ—А–Є—З–љ–∞—П –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—Ж–Є—П // –Ц—Г—А–љ. –љ–µ–≤—А–Њ–њ–∞—В. –Є –њ—Б–Є—Е–Є–∞—В—А. 2002. –Т—Л–њ. 6. –°. 3–19.
10. –У—Г—Б–µ–≤ –Х.–Ш., –°–Ї–≤–Њ—А—Ж–Њ–≤–∞ –Т.–Ш. –Э–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞. I. –Я–µ—А–≤–Є—З–љ–∞—П –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—Ж–Є—П // –Ц—Г—А–љ. –љ–µ–≤—А–Њ–ї. –Є –њ—Б–Є—Е–Є–∞—В—А. 2002. –Т—Л–њ. 5. –°. 3–17.
11. –Ъ–∞–і—Л–Ї–Њ–≤ –Р.–°., –®–∞—Е–њ–∞—А–Њ–љ–Њ–≤–∞ –Э.–Т. –Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ // Consilium Medicum –£–Ї—А–∞–Є–љ–∞. 2008. вДЦ 2. –°. 96–99.
12. –Ъ–Њ–≤–∞–ї–µ–≤–∞ –Ґ.–Т. –Ъ–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Б–Њ—З–µ—В–∞–љ–љ–Њ–≥–Њ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –Є –Ї–∞—А–Њ—В–Є–і–љ—Л—Е –∞—А—В–µ—А–Є–є –њ—А–Є –∞—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ —Б–Њ–љ–љ—Л—Е –∞—А—В–µ—А–Є–є: –Р–≤—В–Њ—А–µ—Д. –і–Є—Б. …–Ї–∞–љ–і. –Љ–µ–і. –љ–∞—Г–Ї. –Ь., 2005. 23 —Б.
13. –Ь–∞–Љ—З—Г—А –Т.–Ш., –Ф—А–Њ–љ–Њ–≤ –°.–Э.,. –Ц–Є–ї—О–Ї –Т.–Ш. –¶–µ—А–µ–±—А–Њ–њ—А–Њ—В–µ–Ї—Ж–Є—П: –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є –Ј–∞—Й–Є—В—Л –Є—И–µ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ // –†–∞—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П. 2008. вДЦ 3. –≠–ї–µ–Ї—В—А–Њ–љ–љ–Њ–µ –Є–Ј–і–∞–љ–Є–µ:- http://rpht.com.ua/article/126.html
14. –Э—Г–≥–Љ–∞–љ–Њ–≤–∞ –Э.–Я. –Ъ–∞—А–і–Є–Њ—Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–µ –≤–∞—А–Є–∞–љ—В—Л –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є: –Р–≤—В–Њ—А–µ—Д. –і–Є—Б. …–Ї–∞–љ–і. –Љ–µ–і. –љ–∞—Г–Ї. –°–∞—А–∞—В–Њ–≤, 2010. 25 —Б.
15. –†–Њ–ґ–Ї–Њ–≤–∞ –Ґ.–Ш. –Ъ–ї–Є–љ–Є–Ї–Њ-—Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –Ї–∞—З–µ—Б—В–≤–∞ –Њ–Ї–∞–Ј–∞–љ–Є—П –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –±–Њ–ї—М–љ—Л–Љ —Б –Є–љ—Б—Г–ї—М—В–Њ–Љ –≤ –Њ—В–і–µ–ї—М–љ—Л—Е —А–µ–≥–Є–Њ–љ–∞—Е –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є (–њ–Њ –і–∞–љ–љ—Л–Љ –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–≥–Њ —А–µ–≥–Є—Б—В—А–∞): –Р–≤—В–Њ—А–µ—Д. –і–Є—Б. …–Ї–∞–љ–і. –Љ–µ–і. –љ–∞—Г–Ї. –Ь., 2010. 27 —Б.
16. –°–∞–≤–Є–љ–∞ –Ь.–Р. –Я–Њ—Б—В–Є–љ—Б—Г–ї—М—В–љ—Л–µ –і–µ–њ—А–µ—Б—Б–Є–Є: –Р–≤—В–Њ—А–µ—Д. –і–Є—Б. …–Ї–∞–љ–і. –Љ–µ–і. –љ–∞—Г–Ї. –Ь., 2006. 23 —Б.
17. –°–µ—А–µ–≥–Є–љ –Т.–Ш. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –≥–ї–Є–∞—В–Є–ї–Є–љ–∞ –Є –Љ–µ–Ї—Б–Є–і–Њ–ї–∞ –≤ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є —В—П–ґ–µ–ї–Њ–≥–Њ –Њ—Б—В—А–Њ–≥–Њ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ // –§–∞—А–Љ–∞—В–µ–Ї–∞. 2006. вДЦ 5 (120).
18. –°–Є–Љ–Њ–љ–µ–љ–Ї–Њ –Т.–С., –®–Є—А–Њ–Ї–Њ–≤ –Х.–Р., –Т–Є–ї–µ–љ—Б–Є–є –С.–°. –°–Њ–≤–µ—А—И–µ–љ—Б—В–≤–Њ–≤–∞–љ–Є–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є–љ—Б—Г–ї—М—В–∞ —В—А–µ–±—Г–µ—В –њ–µ—А–µ—Б–Љ–Њ—В—А–∞ –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ // –Э–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –ґ—Г—А–љ–∞–ї. 2006. вДЦ 2. –°. 39–44.
19. –°–Ї–≤–Њ—А—Ж–Њ–≤–∞ –Т.–Ш. –Ш–љ—Б—Г–ї—М—В. –£—З–∞—Б—В–Є–µ –∞–њ–Њ–њ—В–Њ–Ј–∞ –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Њ–Ј–≥–∞ // –Ц—Г—А–љ–∞–ї –љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є –Є –њ—Б–Є—Е–Є–∞—В—А–Є–Є –Є–Љ. –°.–°.–Ъ–Њ—А—Б–∞–Ї–Њ–≤–∞ (–њ—А–Є–ї.). 2001. вДЦ 2. –°. 12–19.
20. –°–Ї–≤–Њ—А—Ж–Њ–≤–∞ –Т.–Ш., –Х–≤–Ј–µ–ї—М–Љ–∞–љ –Ь.–Р. –Ш—И–µ–Љ–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—Г–ї—М—В. –Ь.: –Ь–µ–і–Є—Ж–Є–љ–∞, 2006. 421 —Б.
21. –°–Љ–Є—А–љ–Њ–≤ –Т.–Х. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М —Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є –Ј–љ–∞—З–µ–љ–Є–µ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ (—Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ): –∞–≤—В–Њ—А–µ—Д. –і–Є—Б... –і–Њ–Ї—В. –Љ–µ–і. –љ–∞—Г–Ї. –Ь., 1977. 21 —Б.
22. –°—Г—Б–ї–Є–љ–∞ 3.–Р. –Ы–µ—З–µ–љ–Є–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ // –Ы–µ—З–µ–љ–Є–µ –љ–µ—А–≤–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є. 2000. вДЦ 1. –°. 3–7.
23. –°—Г—Б–ї–Є–љ–∞ –Ч.–Р., –Ь–∞–Ї—Б–Є–Љ–Њ–≤–∞ –Ь.–Ѓ. –Ъ–Њ–љ—Ж–µ–њ—Ж–Є—П –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—Ж–Є–Є: –љ–Њ–≤—Л–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Г—А–≥–µ–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ //–Р—В–Љ–Њ—Б—Д–µ—А–∞. –Э–µ—А–≤–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є. 2004. вДЦ 3. –° .4–7.
24. –°—Г—Б–ї–Є–љ–∞ –Ч.–Р., –§–Њ–љ—П–Ї–Є–љ –Р.–Т., –Я–µ—В—А–Њ–≤–∞ –Х.–Р. –Є –і—А. –Ч–љ–∞—З–µ–љ–Є–µ —Е–Њ–ї—В–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ –Љ–Њ–љ–Є—В–Њ—А–Є—А–Њ–≤–∞–љ–Є—П –≠–Ъ–У —Г –±–Њ–ї—М–љ—Л—Е –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ // –Ґ–µ—А. –∞—А—Е–Є–≤. 1997. вДЦ 4. –°. 24–26.
25. –Ґ–Њ–љ–Ї–Є—Е P.B. –Ь–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ –Є –∞–ї–≥–Њ—А–Є—В–Љ–Є–Ј–∞—Ж–Є—П –Є–Љ–Љ—Г–љ–Њ–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –њ—А–Є —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –Є –Є–љ—Б—Г–ї—М—В–µ —Б –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є–µ–Љ —В—П–ґ–µ—Б—В–Є —В–µ—З–µ–љ–Є—П: –Р–≤—В–Њ—А–µ—Д. –і–Є—Б. …–Ї–∞–љ–і. –Љ–µ–і. –љ–∞—Г–Ї. –Ь., 2009. 25 —Б.
26. –§–Њ–љ—П–Ї–Є–љ –Р.–Т., –°—Г—Б–ї–Є–љ–∞ –Ч.–Р., –У–µ—А–∞—Б–Ї–Є–љ–∞ –Ы.–Р. –Ъ–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –њ—А–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–Љ –Є–љ—Б—Г–ї—М—В–µ. –°-–Я–±: –Ш–љ–Ї–∞—А—В, 2005. 224 —Б.
27. –І–∞–Ј–Њ–≤–∞ –Ш.–Х. –Ш–љ—Б—Г–ї—М—В. –Ы–µ—З–µ–љ–Є–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є –Ї–∞–Ї –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ // –Ц—Г—А–љ. –љ–µ–≤—А–Њ–ї. –Є –њ—Б–Є—Е–Є–∞—В—А. –Є–Љ. –°.–°. –Ъ–Њ—А—Б–∞–Ї–Њ–≤–∞ (–њ—А–Є–ї.). 2001. вДЦ 3. –°. 3–76.
28. –І–µ—А–љ–Є–є –Т.–Ш. –•–Њ–ї–Є–љ–∞ –∞–ї—М—Д–Њ—Б—Ж–µ—А–∞—В: —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є –≤–Ј–≥–ї—П–і –љ–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –Њ—Б—В—А–Њ–є —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є // –Ч–і–Њ—А–Њ–≤—М–µ –£–Ї—А–∞–Є–љ—Л. 2011. вДЦ 1. –°. 20–21.
29. –®–∞—Е–њ–∞—А–Њ–љ–Њ–≤–∞ –Э.–Т., –Ъ–∞–і—Л–Ї–Њ–≤ –Р.–°. –†–µ–∞–±–Є–ї–Є—В–∞—Ж–Є—П –±–Њ–ї—М–љ—Л—Е —Б –њ–Њ—Б—В–Є–љ—Б—Г–ї—М—В–љ–Њ–є –і–µ–њ—А–µ—Б—Б–Є–µ–є // –Р—В–Љ–Њ—Б—Д–µ—А–∞. –Э–µ—А–≤–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є. 2005. вДЦ 3. –°. 22–24.
30. –®–Љ—Л—А–µ–≤ –Т.–Ш., –Ъ—А—Л–ґ–∞–љ–Њ–≤—Б–Ї–Є–є –°.–Ь. –Ы–µ—З–µ–љ–Є–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞: –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–∞—П —В–µ—А–∞–њ–Є—П —Е–Њ–ї–Є–љ–Њ–Љ –∞–ї—М—Д–Њ—Б—Ж–µ—А–∞—В–Њ–Љ –Є —Н—В–Є–ї–Љ–µ—В–Є–ї–≥–Є–і—А–Њ–Ї—Б–Є–њ–Є—А–Є–і–Є–љ–∞ —Б—Г–Ї—Ж–Є–љ–∞—В–Њ–Љ. –≠–ї–µ–Ї—В—А–Њ–љ–љ–Њ–µ –Є–Ј–і–∞–љ–Є–µ: http://www.rmj.ru/articles_8032.htm
31. –ѓ—Е–љ–Њ H.H., –Т–∞–ї–µ–љ–Ї–Њ–≤–∞ –Т.–Р. –Ю —Б–Њ—Б—В–Њ—П–љ–Є–Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –±–Њ–ї—М–љ—Л–Љ —Б –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П // –Э–µ–≤—А–Њ–ї. –ґ—Г—А–љ. 1999. –Ґ 4, вДЦ 4. –°. 44–45.
32. Chua H.C., Sen S., Cosgriff R.F. et al. Neurogenic ST depression in stroke // Clin. Neurol. Neurosurg. 1999. Vol. 101. P. 4–48.
33. Come P.C., Riley M.F., Bivas N.K. Roles of echocardiography and arrhythmia monitoring in the evaluation of patients with suspected systemic embolism // Ann. Neurol. 1983. Vol. 3. P. 527–531.
34. Feidin V.L., Lawes C.M., Bennett D.A., Anderson C.S. Stroke epidemiology: a rewiew of population-based-studies of incidence, prevalence, and case-fatality in the late 20th century // Lancet. Neurol. 2003. Vol. 2. P. 43–53.
35. Gorelick P.B. New horizons for stroke prevention: PROGRESS and HOPE // Lancet. Neurol. 2002. Vol. 1. P. 149–156.
36. Lane R.D., Wallace J.D., Petrovsky P.P. et al. Supraventricular tachycardia in patients with right hemispere strokes // Stroke. 1992. Vol. 23. P. 362–366.
37. Maniega S.M., Cvoro V., Armitage P.A. Choline and Creatine Are Not Reliable Denominators for Calculating Metabolite Ratios in Acute Ischemic Stroke // Stroke. 2008. Vol. 39. P. 123–131.
38. Miglio G., Varsaldi F., Francioli E. et al. Cabergoline protects SH-SY5Y neuronal cells in an in vitro model of ischemia // Eur. J. Pharmacol. 2004. Vol. 12, вДЦ 489 (3). P. 157–165.
39. Muccioli G., Ghe C., Faccani G. Prolactin receptors in human meningiomas: characterization and biological role // J. Endocrinol. 1997. Vol. 6.1, вДЦ 53(3). P. 71–365.
40. Nickerson C., Drago R. Antiatherogenic effects of captopril in the watanbe heritable hyperlipidemic rabbit // Hypertens. 1990. Vol. 15. P. 32–33.
41. Robertus H., Bisschops C., Kappelle J. et al. Hemodynamic and Metabolic Changes in Transient Ischemic Attack Patients // Stroke. 2002. Vol. 33. P. 110–115.
42. Rutgers D.R., P. van Osch M.J., Kappelle L.J. et al. Cerebral Hemodynamics and Metabolism in Patients With Symptomatic Occlusion of the Internal Carotid Artery // Stroke. 2003. Vol. 34. P. 648–652.
43. Schettini A., Monig I., Moreshead G. Influence of cerebral vascular factors on brain relative tissue stiffness // Intracranial pressure. Berlin-New-York. 1972. P. 27–32.












