Введение
Внезапные боли в пояснице – одна из наиболее частых причин обращения к врачам общей практики [1–3]. По данным эпидемиологических исследований, проведенных в США, более 70% населения хотя бы раз в жизни испытывают приступ таких болей [4,5]. Поэтому боли в пояснице остаются одной из наиболее частых причин заболеваемости и нетрудоспособности [6]. Еще в 1990–х гг. затраты на их диагностику и лечение в США превышали 23 млрд. $ [7], а непрямые затраты, как полагают, в 5–10 раз больше [8–10].
Несмотря на высокую распространенность болей в пояснице, выявить их этиологию достаточно сложно, и установить причину таких болей удается лишь в 15–20% случаев [7,11]. Хотя боли в пояснице могут купироваться самостоятельно [11] и спонтанно регрессировать вне зависимости от проводимого лечения, у многих пациентов они рецидивируют, что сопровождается стойким ограничением трудоспособности [12]. Поэтому неудивительно, что эксперты Всемирной Организации Здравоохранения (ВОЗ) придают большое значение подострым болям в пояснице, как промежуточному этапу на пути к хроническому болевому синдрому [6]. В документах Инициативы ВОЗ проанализированы результаты самых современных исследований по стандартизации подходов к тактике ведения пациентов с такими болями; они указывают на необходимость внимательно отнестись к этой проблеме [6].
За последнее десятилетие было разработано множество внедренных в разных странах руководств по диагностике и лечению болей в пояснице [13–15], основополагающим принципом которых является ранняя активизация пациента. Однако большинство специалистов в этой области склоняются к мнению, что залогом успешного лечения служит прежде всего обезболивание, которое достигается за счет использования комбинированной терапии, что повышает эффективность анальгетиков и снижает их токсичность [16,17]. Комбинирование лекарственных средств усиливает обезболивающее действие, по меньшей мере, двумя путями. Во–первых, потенциально могут суммироваться эффекты препаратов с различной фармакокинетикой, например, лекарств быстрого действия (ацетаминофена) и пролонгированных центральных опиоидных анальгетиков [18]. Во–вторых, как установлено, ацетилсалициловая кислота (АСК) или ацетаминофен в сочетании с «ненаркотическими» опиоидами оказывает гораздо более мощное обезболивающее действие, чем каждый из препаратов по отдельности в двойной дозировке [16,18,19].
Ацетаминофен, часто используемый в качестве препарата первого ряда для лечения болей в пояснице, был открыт больше 100 лет назад. Клинический же опыт его применения насчитывает больше 50 лет [20,21]. Он обладает и обезболивающими, и жаропонижающими свойствами; согласно результатам двойных слепых плацебо–контролируемых испытаний его обезболивающее действие сравнимо с таковым АСК [22]. В терапевтической концентрации ацетаминофен достаточно безопасен и хорошо переносится, вызывая меньше побочных явлений, чем АСК. Гепатотоксический эффект развивается только после приема очень больших (>10 мг) доз препарата [18,20]. Несмотря на многочисленные исследования, механизм действия этого неопиоидного анальгетика, не относящегося к нестероидным противовоспалительным препаратам (НПВП), не установлен. Ацетаминофен способен подавлять или модулировать активность медиаторов боли на периферии [19]. Однако показано, что анальгетический эффект ацетаминофена опосредован на спинальном и супраспинальном уровнях центральной нервной системы (ЦНС). На молекулярном уровне аналгезия вызвана торможением функций синтетаз простагландина Н2 ЦНС [23] и ингибированием высвобождения спинального простагландина Е2 [24], в то время как на периферические циклооксигеназы ацетаминофен практически не влияет (чем объясняется незначительный противовоспалительный эффект препарата). Кроме того, ацетаминофен блокирует синтетазу оксида, выступая в роли антагониста N–метил–D–аспартата или субстанции Р, которые обусловливают спинальную гипералгезию [25], а также опосредованно стимулируют спинальные серотониновые пути [26].
Если с помощью ацетаминофена боли в спине купировать не удается, назначают слабые опиоиды, такие как трамадол. Трамадола гидрохлорид – это синтетический опиоидный анальгетик центрального действия с двойным механизмом действия [27]. Трамадол и его О–деметилированный метаболит (М1) являются агонистами опиатных (преимущественно m) рецепторов, а трамадол также активирует противоболевые системы в спинном мозге, стимулируя секрецию и ингибируя обратный захват серотонина и норадреналина [28,29]. Низкий процент случаев злоупотребления [30], отсутствие максимальной выраженности аналгезии [31] и не столь выраженное по сравнению с истинными опиоидами угнетение дыхания (в тех же дозах) делают использование трамадола более предпочтительным [32,33]. Данные, полученные в течение последних десяти лет, свидетельствуют о том, что добавление ацетаминофена к небольшому количеству трамадола на раннем этапе подбора дозы способно усилить обезболивающий эффект и улучшить профиль переносимости этого опиоидного препарата [34].
Целью данного исследования стало сравнительное изучение свойств комбинированного препарата, содержащего 325 мг ацетаминофена и 37,5 мг трамадола (П/Т), и монопрепарата трамадола (Т; 50 мг) у пациентов с подострыми болями в пояснице. Помимо анализа эффективности и переносимости этих лекарственных средств, мы попытались установить, способен ли комбинированный препарат, содержащий меньшее количество опиоидного анальгетика, но дополненный ацетаминофеном, обеспечить тот же самый анальгетический эффект, что и монопрепарат с большей дозировкой опиоида. В частности, мы оценивали степень удовлетворенности результатами лечения, а также частоту встречаемости побочных явлений на фоне приема П/Т и, соответственно, профиль переносимости комбинированного препарата по сравнению с монотерапией трамадолом.
Пациенты и методы
Для исследования были отобраны пациенты с подострыми болями в пояснице как минимум умеренной интенсивности (>40 мм по 100–мм визуально–аналоговой шкале, ВАШ) без признаков радикулопатии, возникшими за 10–42 дня до момента включения в списки испытуемых. Все пациенты были старше 18 лет, состояние их здоровья оценивалось как удовлетворительное.
Критериями исключения являлись:
– прием препаратов, обладающих обезболивающим действием (антидепрессантов, снотворных и противоэпилептических средств, спазмолитиков, кортикостероидов) или анальгетиков пролонгированного действия не позднее, чем за 3 недели до внесения в списки испытуемых;
– прием анальгетиков быстрого действия (НПВП и других препаратов периферического действия, опиоидов, анестетиков или средств для местного применения) не позднее, чем за 24 часа до внесения в списки испытуемых;
– неэффективность трамадола в анамнезе или прием трамадола не позднее, чем за 15 дней до внесения в списки испытуемых;
– опухоли или инфекции спинного мозга и его оболочек (и иной локализации); сильные боли любой локализации, отдающие в спину; фибромиалгии; грыжи позвоночных дисков с клинической симптоматикой; спондилолистез 2 степени и более; выраженный стеноз позвоночного канала; переломы позвонков; воспалительные процессы, затрагивающие позвоночник;
– процедуры чрескожной электрической нейростимуляции, лечение у хиропрактиков, курсы массажа или физиотерапии, завершенные не позднее, чем за 3 недели до внесения в списки испытуемых;
– наличие противопоказаний к приему опиоидных анальгетиков или ацетаминофена;
– наличие серьезных психических расстройств (глубокая депрессия, деменция), прием нейролептических средств в анамнезе, суицидальные попытки или склонность к суицидам в анамнезе, выраженная хроническая алкогольная или иная зависимость.
В ходе исследования исключались прием иных препаратов, обладающих обезболивающим действием, а также физиотерапевтическое и другое дополнительное лечение.
Исследование проводилось в соответствии с Хельсинкской Декларацией (1996 г.) [35], Правилами качественной медицинской практики [36] в 17 французских и 2 итальянских исследовательских центрах. Каждое из этих медицинских учреждений получило одобрение независимого этического комитета на проведение испытаний. Перед началом исследования каждый пациент давал добровольное информированное согласие в письменном виде.
Дизайн исследования
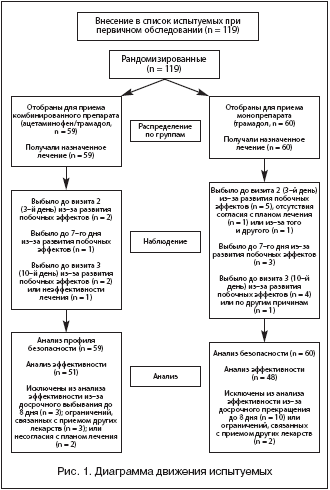
В течение 10 дней в двух параллельных группах, получавших изучаемые препараты, проводилось рандомизированное активно контролируемое двойное слепое многоцентровое исследование. Чтобы избежать этических конфликтов и дополнительных трудностей, контрольную группу пациентов, которые получали бы плацебо, набирать не стали. Испытуемые были рандомизированы в соотношении 1:1. В группу получавших комбинированный препарат (П/Т) вошло 60 человек, в группу получавших монопрепарат (Т) – 59. Рандомизационный код был сгенерирован на компьютере сотрудником отдела биометрии корпорации Grunenthal GmbH (Аахен, Германия), который не принимал непосредственного участия в исследовании. На основании этого рандомизационного кода каждый исследователь получил серию рандомизационных номеров и каждому пациенту последовательно присваивался низший рандомизационный номер из имевшихся. Испытуемых осматривали в стационаре (визит 1) и в тот же день начинали лечение. Затем пациентов обследовали на 3–й день и по завершении исследования (на 10–й день). В случае досрочного прекращения исследования испытуемого в медицинском центре просили оценить результаты проведенного лечения на данный момент.
Изучаемые препараты
и схемы терапии
В группе П/Т испытуемые принимали комбинированный препарат, содержащий 325 мг ацетаминофена и 37,5 мг трамадола (торговое название – Залдиар®, Gru¬nenthal GmbH, Аахен, Германия), а в группе Т – монопрепарат, содержащий 50 мг трамадола гидрохлорида (торговое название – Трамал®, Gru¬nenthal GmbH, Аахен, Германия). Учитывая разницу в содержании активного компонента, использован т.н. режим двойной маскировки, т.е. каждая «доза» состояла из 1 таблетки комбинированного препарата и 1 капсулы плацебо или 1 таблетки плацебо и 1 капсулы трамадола. Изготовителем и поставщиком активных препаратов и плацебо являлась корпорация Gru¬nenthal GmbH. Пронумерованные упаковки изучаемых препаратов для слепого получения выдавались испытуемому при первом и втором медицинских осмотрах, неиспользованные таблетки при следующем визите пациент возвращал врачу. В ходе начальной фазы исследования протяженностью два дня (до второго посещения врача) испытуемый ежедневно принимал 4 «дозы» лекарственного средства. Затем при необходимости количество таблеток, принимаемых ежедневно для достижения достаточной аналгезии, увеличивали таким образом, чтобы за 24 часа пациент получал не более 8 «доз» (максимальная 24–часовая доза комбинированного препарата – 2600 мг/300 мг, монопрепарата – 400 мг)
Оценка результатов лечения
При первичном медицинском осмотре анализировали демографические характеристики испытуемых (пол, возраст, расовую принадлежность, массу тела, рост, индекс массы тела), показатели жизненно важных функций организма (артериальное давление и частоту сердечных сокращений, которые измеряли с помощью полуавтоматических сфигмоманометров по стандартной методике – на правом плече после 5–минутного пребывания в положении лежа на спине), результаты физикального обследования, а также данные анамнеза (особое внимание уделялось последнему эпизоду болей в пояснице). Также отмечали случаи приема любых лекарственных средств в предыдущие 2 месяца.
Исходы
Первичный анализ эффективности осуществляли на основании удовлетворенности пациента результатами лечения, которая оценивалась в ходе последнего визита к врачу. Эта оценка касалась и эффективности, и переносимости препарата в целом и проводилась по 4–балльной шкале («полностью удовлетворен», «удовлетворен», «не удовлетворен», «совершенно не удовлетворен»). В то же время испытуемый отдельно оценивал по 4–балльной шкале эффективность предложенного лечения («высокоэффективное», «эффективное», «малоэффективное», «неэффективное») и его переносимость («очень хорошая», «хорошая», «плохая», «очень плохая»). Интенсивность болей и степень их уменьшения за прошедшие 24 часа также оценивали в ходе последнего визита к врачу. Интенсивность болей определяли по 100–мм горизонтальной ВАШ – от «отсутствия болей» (левый конец) до «самой сильной боли, какую можно представить» (правый конец); результаты выражали в процентах от максимума. Степень уменьшения выраженности болей (по сравнению с их интенсивностью до внесения в списки испытуемых) оценивали по 5–балльной шкале как «исчезновение болевого синдрома», «значительное», «умеренное», «незначительное» уменьшение и «без изменений». В конце лечения общую оценку результатов лечения по 5–балльной шкале давали и сами врачи («очень хорошие», «хорошие», «плохие», «очень плохие», «лечение безрезультатно»).
Профиль безопасности лечения оценивали по частоте встречаемости побочных эффектов, а также путем мониторинга жизненно важных функций. Любые нежелательные явления, возникавшие у пациента к моменту второго и третьего визитов, оценивались и фиксировались лечащим врачом. Используя общепринятые протоколы, устанавливали природу побочной реакции, определяли ее выраженность, прогноз, а также возможную связь с приемом изучаемого лекарственного препарата. Кроме того, отмечали меры, принятые с целью купирования побочных эффектов, и исходы.
Методы статистической
обработки результатов
Проводя это пилотное исследование, мы не располагали данными, которые позволили бы выполнить расчеты для указанного объема выборки. Основываясь на предыдущем опыте и используя стандартный подход, мы приняли число пациентов в каждой группе за 50, а общий объем выборки с учетом возможных выпадений – за 120.
К анализу полученных результатов приступили после вскрытия базы данных и демаскирования исследования. Количественные данные (демографические характеристики, доза препарата, интенсивность болей, показатели жизненно важных функций организма) были представлены как среднее ± стандартное отклонение, а качественные данные оценки эффективности (степень удовлетворенности пациента результатами лечения, уменьшение выраженности болей, контроль над болевым синдромом) и безопасность (побочные эффекты) – как частотное распределение (количество испытуемых и частота встречаемости). Статистическое сравнение результатов, полученных в обеих группах, проводили с помощью метода c2–квадратов и метода пропорций в случае качественных данных. При первом и последнем медицинских осмотрах количественные показатели определяли с помощью двустороннего анализа вариант, учитывающего зависимость последовательных наблюдений друг от друга (ANOVA). При этом в качестве независимых переменных выступали сроки и профиль лечения, а сочетание этих факторов (эффективность лечения во времени) принималось за статистически значимый результат.
Результаты
Демографические характеристики
и распределение пациентов
119 пациентов, принимавших участие в исследовании, были рандомизированы для приема комбинированного (П/Т, n = 59) или монопрепарата (Т, n = 60) (рис. 1). Все испытуемые получали по меньшей мере 1 дозу изучаемого лекарственного средства. В ходе проведения исследования досрочно выбыли 6 человек из группы П/Т и 15 человек из группы Т, в основном из–за развития побочных реакций. Анализ эффективности лечения осуществляли у тех пациентов, которые принимали участие в исследовании на протяжении 75% времени (т.е. 8 из 10 дней) и предоставили необходимую для оценки информацию к концу испытания. Из анализа эффективности были исключены данные тех пациентов (рис. 1), которые употребляли запрещенные протоколом исследования лекарственные средства. Выбрасывались и данные тех испытуемых, которые, как обоснованно считалось, не соблюдали предписанную схему терапии. Таким образом, объем выборки, в которой проводился анализ эффективности лечения, составил 51 человек (86,4%) из группы П/Т и 48 человек (80,0%) из группы Т соответственно.
В таблице 1 суммированы демографические характеристики 69 женщин и 50 мужчин, привлеченных к исследованию. По исходным характеристикам статистически достоверных и клинически значимых различий между обеими группами не было. Примерно одинаковое число испытуемых в группах П/Т и Т относились к белой расе (96,1 и 94,2% соответственно). У всех пациентов отмечались подострые поясничные боли без признаков корешкового синдрома, не сопровождающиеся неврологической симптоматикой со стороны ног. Все пациенты удовлетворяли критериям включения. В обеих группах общее время, прошедшее с момента возникновения болей в пояснице до внесения в списки испытуемых, оказалось практически одинаковым – 21,8±7,9 дней в группе П/Т и 22,5±9,6 дней в группе Т (p статистически незначимо).
Эффективность
и переносимость анальгетиков
Значения первичного конечного параметра для анализа эффективности, а именно удовлетворенности пациентов результатами лечения при последнем медицинском осмотре, представлены на рисунке 2. Одинаковое количество испытуемых отметили, что они удовлетворены или полностью удовлетворены результатами лечения (72,5%, или 37 человек из 51 в группе П/Т и 72,9%, или 35 человек из 48 в группе Т; p статистически незначимо). Лишь 2 пациента из группы П/Т и 3 пациента из группы Т ответили, что совершенно не удовлетворены результатами лечения.
Значения показателей интенсивности болей по ВАШ до начала лечения были одинаково повышены в обеих группах (67,5±13,0 в группе П/Т и 65,3±14,6 в группе Т; p статистически незначимо), а в ходе проведения исследования они неуклонно снижались, и к концу испытания средние уровни интенсивности болей достигли 27,9% (П/Т) и 24,8% (Т) (рис. 3). Двусторонний ANOVA, учитывающий зависимость последовательных наблюдений друг от друга, подтвердил статистически значимое уменьшение интенсивности болей в обеих группах испытуемых (p<0,001) при отсутствии заметного влияния на него характера проводимого лечения с течением времени (p статистически незначимо). Результаты ретроспективного анализа свидетельствуют о том, что в обеих группах выраженность болей на момент начала исследования и степень ослабления их интенсивности к его концу оказались сопоставимы (p статистически незначимо). Не было обнаружено никаких отличий между группами и при анализе ответов на лечение с достижением адекватного уровня обезболивания (рис. 3). Термин «адекватный» подразумевает умеренно выраженное, значительное или полное купирование болевого синдрома, чего удалось добиться у 81,6% (40/49) пациентов группы П/Т и 82,9% (39/47) пациентов группы Т (p статистически незначимо). Лишь 4 испытуемых не испытали облегчения.
На рисунке 4 представлены значения остальных конечных параметров, которые анализировались при завершающем медицинском осмотре. Большинство пациентов обеих групп оценили обезболивающий эффект препарата как превосходный, хороший или, по крайней мере, умеренный (94,1%, т.е. 48/51, в группе П/Т против 91,7%, т.е. 44/48, в группе Т; Р статистически незначимо). Лишь 3 испытуемых из группы П/Т и 4 испытуемых из группы Т заявили, что предложенный им препарат неэффективен. Хорошо или очень хорошо лечение перенесли 84,3% (43/51) пациентов из группы П/Т и 68,8% (33/48) пациентов из группы Т (p статистически незначимо). Согласно оценкам лечащих врачей у 66,7% (34/51) испытуемых из группы П/Т и 77,1% (37/48) испытуемых из группы Т наблюдались очень хорошие или хорошие результаты лечения (p статистически незначимо).
Дозировка препаратов
На протяжении всего исследования (дни 1–10) среднесуточная доза изучаемого препарата составила 4,39±1,02 в группе П/Т и 4,34±0,96 в группе Т (p статистически незначимо). Для вычисления начальной ежедневной дозы препарата для каждого пациента рассчитали среднюю дозу препарата, принятого в первые два дня (табл. 2). После второго визита к врачу пациентам предлагали отрегулировать и при необходимости повысить дозу препарата настолько, чтобы купировать болевой синдром. В течение этого периода (дни 3–10) количество принимаемых ежедневно таблеток препарата варьировало без линейного отклонения по времени. Для представления полученных данных был использован двойной подход: (1) для каждого испытуемого рассчитали среднюю дозу препарата с 3 по 10–й день и спрогнозировали его конечную дозу; (2) начиная с 3–го дня, для каждого испытуемого рассчитали максимальную дневную дозу препарата вне зависимости от того, когда была достигнута эта доза – на 10–й день или раньше. Результаты для групп П/Т и Т суммированы в таблице 2. Двусторонний ANOVA, учитывающий зависимость последовательных наблюдений друг от друга, подтвердил статистически значимое увеличение конечной среднесуточной дозы лекарственного средства по сравнению с начальной в обеих группах (p<0,001) при отсутствии значительной разницы между группами испытуемых (p статистически незначимо) или влияния характера проводимого лечения на повышение дозы препарата в ходе исследования (p статистически незначимо) для средних дозировок изучаемого препарата. Ретроспективный анализ свидетельствует о том, что начальные и конечные (к 10 дню) среднесуточные дозы препаратов в обеих группах сопоставимы (p статистически незначимо).
В таблице 2 также представлены среднесуточные дозы трамадола в миллиграммах (которые, как очевидно, ниже в группе П/Т) и ацетаминофена (отсутствуют для группы Т). Двусторонний ANOVA, учитывающий зависимость последовательных наблюдений друг от друга, подтвердил, что дозы трамадола оказались статистически значимо ниже в группе П/Т (p<0,001), заметно повышаясь к концу исследования (p<0,001) при отсутствии влияния характера проводимого лечения на повышение дозы трамадола в ходе исследования (p статистически незначимо). Статистическое сравнение максимальных дневных доз препаратов в обеих группах испытуемых указывает на их равнозначность (p статистически незначимо), в то время как доза трамадола была заметно ниже в группе П/Т по сравнению с группой Т (p<0,001).
Профиль безопасности
и выведение из исследования
Из 119 человек, принимавших изучаемый препарат, 21 пациент досрочно выбыл из исследования (10,2%, или 6 испытуемых, из группы П/Т и 25%, или 15 испытуемых, из группы Т; p статистически незначимо). Причиной досрочного прекращения участия в исследовании у 5 пациентов группы П/Т (8,5%) и 13 пациентов группы Т (21,7%) стало развитие побочных эффектов. У выбывших из группы П/Т наблюдалось в среднем более одного нежелательного явления; наиболее часто встречались тошнота (n = 2) и локализованный кожный зуд (n = 2). В группе Т аналогичный показатель составил 3,0; у выбывших возникали тошнота (n = 9), головокружение (n = 5), рвота (n = 5) и сонливость (n = 4). Один испытуемый из группы П/Т был досрочно выведен из исследования из–за того, что у него обострился артроз суставов запястья, не связанный с приемом изучаемого препарата.
Всего же у 74 пациентов отмечено 160 нежелательных явлений (распространенность 62,2%). Среди этих побочных эффектов не было серьезных или непредвиденных. Согласно данным таблицы 3 в группе П/Т общая частота встречаемости нежелательных явлений оказалась статистически значимо ниже по сравнению с группой Т (50,8% против 73,3%; p = 0,019). При этом в группе П/Т развилось 49 побочных эффектов (0,83 на пациента), а в группе Т – 111 (1,85 на пациента), т.е. разница этих показателей статистически достоверна (p<0,001).
В таблице 3 дано и сравнение основных разновидностей побочных эффектов. Наиболее часто встречалась тошнота, причем в группе П/Т на нее жаловались лишь 8 человек, а в группе Т – 21 (p = 0,012). Головокружение также реже возникало у принимавших П/Т (3 из 59 испытуемых по сравнению с 15 из 60 в группе Т при p = 0,006). То же самое касалось и других нежелательных явлений – запоров (3 и 9 человек соответственно; p статистически незначимо), сонливости (7 и 15 человек соответственно; p статистически незначимо) и рвоты (2 и 8 человек соответственно; p статистически незначимо). У большинства пациентов обеих групп побочные эффекты носили характер умеренно выраженных (49% в группе П/Т и 40% в группе Т) или среднетяжелых (41 и 45% соответственно), и лишь в немногих случаях их можно было расценить как тяжелые (10 и 15% соответственно). Обязательного проведения лечения, согласно опросам лечащих врачей, требовали 10% нежелательных явлений в группе П/Т и 25% – в группе Т; возможного – 65 и 59% соответственно; а маловероятного – 20 и 14% соответственно. Следовательно, у пациентов, лечившихся трамадолом, причинно–следственная связь между приемом изучаемого препарата и развитием побочных эффектов носит не столь явный характер. Контрмеры оказались необходимы лишь у 6% испытуемых, и в большинстве случаев (69%) не пришлось ни уменьшать дозу лекарственного средства, ни прерывать лечения (43/49 в группе П/Т против 108/111 в группе Т). У всех пациентов нежелательные явления купировались без последствий. Показатели жизненно важных функций организма в обеих группах на протяжении всего периода лечения оставались стабильными (табл. 4).
Обсуждение
В ходе проведения этого крупного многоцентрового исследования было установлено, что у пациентов с неспецифическими подострыми болями в пояснице одинаково эффективны и традиционный трамадол, и новый комбинированный анальгетик (ацетаминофен + трамадол). Однако во втором случае адекватного обезболивания удалось достичь при использовании меньшей дозы трамадола (комбинированный препарат содержит 37,5 мг трамадола, что на 25% меньше, чем в монопрепарате). Это первое рандомизированное двойное слепое исследование, результаты которого демонстрируют лучшую переносимость комбинации ацетаминофена и трамадола по сравнению с монопрепаратом трамадола.
Для предоставления информации об эквивалентности анальгетического действия обоих препаратов были использованы разнообразные стандартизованные обоснованные независимые методы. В качестве параметра для анализа первичной эффективности был выбран такой аспект, как степень удовлетворенности пациента результатами лечения. Процент пациентов, которые были удовлетворены или полностью удовлетворены результатами лечения, оказался одинаково высок в обеих когортах испытуемых (72,5% в группе П/Т и 72,9% в группе Т). Та же самая тенденция наблюдалась и при анализе вторичных параметров, отражающих эффективность лечения – уменьшения выраженности болей и частоты их «адекватного» купирования, возможности хорошо или очень хорошо контролировать болевой синдром (по оценкам врачей) и высокой эффективности лечения по ценкам самих пациентов.
Суточная доза принимаемого лекарства в обеих группах оказалась сопоставима (~4,4 дозы) – 4,39 в группе П/Т и 4,34 в группе Т, причем как в начале исследования (~3,6; 3,59 и 3,55 дозы соответственно), так и в его конце (~4,6; 4,6 и 4,55 дозы соответственно). Из этого можно заключить, что комбинированный препарат (325 мг ацетаминофена + 37,5 мг трамадола) и монопрепарат (50 мг трамадола) обеспечивают одинаковую аналгезию при подострых болях в пояснице. Косвенным подтверждением полученных данных являются результаты исследования с использованием единичных доз, согласно которым комбинированный препарат, содержащий ацетаминофен и трамадол, более эффективно купирует послеоперационные зубные боли, чем трамадол в той же самой дозировке как монотерапия [37,38]. Все это свидетельствует о том, что даже если уменьшить содержание трамадола в комбинированном препарате, его обезболивающий эффект останется прежним.
При проведении этого исследования была выявлена разница в профиле переносимости препаратов между обеими группами, причем лучшая переносимость комбинированного препарата подтверждается данными нескольких независимых наблюдений. 84,3% пациентов группы П/Т сообщили, по меньшей мере, о хорошей переносимости лечения вне зависимости от его эффективности, что на 16% больше по сравнению с группой Т (68,8%; p статистически незначимо). Кроме того, частота случаев досрочного прекращения исследования (как в целом, так и из–за развития побочных эффектов) в группе П/Т оказалась в 2,5 раза ниже, чем в группе Т. В первой из упомянутых групп также гораздо реже регистрировались нежелательные явления (и в целом, и по частоте встречаемости). Приведенные данные доказывают высказанную в начале исследования гипотезу о том, что в комбинации с ацетаминофеном даже меньшая доза опиоидного компонента позволяет достичь такого же обезболивающего эффекта при лучшей переносимости по сравнению с монопрепаратом. Предположение о лучшей переносимости П/Т вследствие снижения дозы опиоида подтверждает также и тот факт, что типичные для опиоидов побочные явления (тошнота, головокружение, сонливость, запоры и рвота) встречаются у таких пациентов гораздо реже.
Способность препарата, содержащего меньше трамадола, вызывать достаточное анальгезирующее действие объясняется, по–видимому, аддитивным (или даже синергичным [39]) эффектом, развивающимся при комбинировании трамадола с ацетаминофеном [16,18,19]. Обоснование фиксированного соотношения дозировок (9:1) [17] было получено в доклинических испытаниях [39], результаты которых продемонстрировали, что такое комбинирование трамадола с ацетаминофеном обусловливает синергичный (сверхаддитивный) эффект, а сочетание ацетаминофена с другими опиоидами (кодеином, дигидроксикодеиноном, оксикодеиноном) в том же соотношении – только аддитивный эффект [18,40].
Результаты проведенного нами исследования свидетельствуют о том, что комбинированные анальгетики, например, ацетаминофен в сочетании с трамадолом, можно включать в схемы лечения подострых болей в пояснице. И хотя до сих пор во многих случаях их оставляют в качестве резервных препаратов, такие обезболивающие средства с фиксированным соотношением дозировок компонентов можно применять более активно, если они соответствуют рациональным критериям фармакокинетики и фармакодинамики при условии, что их эффективность подтверждена методами доказательной медицины и результатами клинических испытаний требуемого дизайна [16]. Рациональная стратегия лекарственного лечения болевых синдромов заключается в комбинировании препаратов с различными фармакологическими и фармакокинетическими свойствами, которые обладали бы несколькими механизмами анальгетического действия. Этим условиям удовлетворяет новый комбинированный препарат (ацетаминофен + трамадол), эффективность и безопасность которого в лечении умеренно выраженных и сильных болей продемонстрирована экспериментально. В ходе клинических испытаний установлено, что такой препарат обеспечивает хороший обезболивающий эффект при послеоперационных зубных болях, жгучих болях, характерных для остеоартрита, фибромиалгиях, хронических болях в пояснице и хронических болях, вызванных остеоартритом [41]. Теперь то же самое можно утверждать и в отношении подострых болей в пояснице. Полученные результаты также можно экстраполировать на другие подострые и хронические болевые синдромы.
Заключение
Трамадол в стандартных капсулах (50 мг) и новый комбинированный препарат (325 мг ацетаминофена + 37,5 мг трамадола) одинаково эффективны в лечении неспецифических подострых болей в пояснице. Это подтверждают результаты проведенного нами в параллельных группах активно контролируемого двойного слепого рандомизированного исследования. Хотя оба лекарственных средства переносились пациентами достаточно хорошо, уменьшение дозировки трамадола на 25% по сравнению с монопрепаратом позволило значительно улучшить переносимость лечения со снижением частоты встречаемости нежелательных побочных явлений.
Реферат подготовлен Е.Б. Третьяк по материалам статьи
S. Perrot, D. Krause, Ph. Crozes, C. Naim
«Efficacy and Tolerability of Paracetamol/Tramadol
(325 mg/37.5 mg) Combination Treatment Compared with Tramadol (50 mg) Monotherapy in Patients with Subacute Low Back Pain: A Multicenter, Randomized,
Double–Blind, Parallel–Group, 10–Day Treatment Study»
Clinical Therapeutics/Volume 28, Number 10, 2006






Литература
1. Hagen KB, Hilde G, Jamtvedt G, Winnem M. Bed rest for acute low-back pain and sciatica. Cocbrane Database Syst Rev. 2004;(4):CD001254.
2. Jensen S. Back pain-clinical assessment. Aust Fam Physidan. 2004;33:393-395, 397-401.
3. Manek N J, MacGregor AJ. Epidemiology of back disorders: Prevalence, risk factors, and prognosis. Curr Opin Rheumatol. 2005;17:134-140.
4. Borenstein DG. Epidemiology, etiology, diagnostic evaluation, and treatment of low back pain. Curr Opin Rheumatol. 2001 ;13:128-134.
5. Lawrence RC, Helmick CG, Amett FC, et al. Estimates of the prevalence of arthritis and selected musculoskeletal disorders in the United States. Arthritis Rheum. 1998;41:778-799.
6. Ehrlich GE. Back pain. j Rheumatol Suppl. 2003;67:26-31. Z jackson KC II. Pharmacotherapy in lower back pain. Drugs Today (Bare). 2004;40:765-772.
8. Frymoyer JW, Cats-Baril WL Anoverview of the incidences and costs of low back pain. Orthop Clin North Am. 1991 ;22:263-271.
9. Maniadakis N, Gray A. The economic burden of back pain in the UK. Pain. 2000;84:95-103.
10. Patel AT, Ogle AA. Diagnosis and management of acute low back pain. Am Faro Physidan. 2000;61:1779-1786.
11. Hildebrandt J. Does unspecific low back pain really exist [in German]? Z Orthop Ihre Grenzgeb. 2004; 142:139-145.
12. Care), -IS, Garrett J, Jackman A, et al. The outcomes and costs of care for acute low back pain among patients seen by primary care practitioners, chiropractors, and orthopedic surgeons. The North Carolina Back Pain Project. N En~ j Med. 1995;333:913-917.
13. European Commission COST B13 Management Committee. European guidelines for the management of low back pain. Acta Orthop Scand Suppl. 2002;73:20-25.
14. Burton AK, Waddell G. Clinical guidelines in the management of low back pain. Baillieres C/in Rheumatol. 1998;12:17-35.
15. van Tulder MW, Tuut M, PennickV, et al. Quality of primary care guidelines for acute low back pain. Spine. 2004;29: E357-E362.
16. Desmeules J, Rollason V, Piguet V, Dayer P. Clinical pharmacology and rationale of analgesic combinations. Eur J Anaesthesiol Suppl. 2003;28:7-11.
17. Raffa RB, Clark-Vetri R, Tallarida RJ, Wertheimer AI. Combination strategies for pain management. Expert Opin Pharmacother. 2003;4:1697-1708.
18. Barkin RL Acetaminophen, aspirin, or Ibuprofen in combination analgesic products. AmJ Ther. 2001;8:433-442.
19. Raffa RB. Pharmacology of oral combination analgesics: Rational therapy for pain. J Clin Pharm Ther. 2001 ;26:257-264.
20. Clissold SP. Paracetamol and phenacetin. Drugs. 1986;32(SuppI 4):46-59.
21. SpoonerJB, HarveyJG. The history and usage of paracetamol. J Int Med Res. 1976;4(SuppI 4):1-6.
22. Ameer B, Greenblatt DJ. Acetaminophen. Ann Intern Med. 1977;87:202-209.
23. AronoffDM, OatesJA, Boutaud O. New insights into the mechanism of action ofacetaminophen: Its clinical pharmacologic characteristics reflect its inhibition of the two prostaglandin H2 synthases. Clin Pharmacol Ther. 2006;79:9-19.
24. Muth-Selbach US, Tegeder I, Brune K, Geisslinger G. Acetaminophen inhibits spinal prostaglandin E2 release after peripheral noxious stimulation. AnesthesioloDt. 1999;91 : 231-239.
25. Bjorkman R, Hallman KM, Hednerj, et al. Acetaminophen blocks spinal hyperalgesia induced by NMDA and substance P. Pain. 1994;57:259-264.
26. PelissierT, AIIoui A, Caussade F, et al. Paracetamol exerts a spinal antinociceptive effect involving an indirectinteraction with S-hydroxytryptamine3 receptors: In vivo and in vitro evidence. J Pharmacol F_xp Ther. 1996; 278:8-14.
27. Raffa RB, Friderichs E, Reimann W, et al. Opioid and nonopioid components independently contribute to the mechanism of action of tramadol, an 'atypical' opioid analgesic. J Pharmacol Exp Ther. 1992;260:27.5-285.
28. Raffa RB, Nayak RK, Liao S, Minn FL The mechanism(s) of action and pharmacokinetics of tramadol hydrochloride. Rev Contemp Pharmacother. 1995;6:485-497.
29. Raffa RB, Friderichs E. The basic science aspect oftramadol hydrochloride. Pain Rev. 1996;3:249-271.
30. Richter W, Barth H, Flohe L, Giertz H. Clinical investigation on the development of dependence during oral therapy with tramadol. Arzneimit+.elforschung. 1985;35:1742-1744.
31. Besson JM, Vickers MD. Panel discussion. Dm~. 1994;47(SuppI 1 ): 44-46.
32. Houmes RJ, Voets MA, Verkaaik A, et al. Efficacy and safety of tramadol versus morphine for moderate and severe postoperative pain with special regard to respiratory depression. Anesth Analg. 1992;74:510-514.
33. Vickers MD, O'Flaherty D, Szekely SM, et al. Tramadol: Pain relief by an opioid without depression of respiration. Anaesthesia. 1992;47:291-296.
34. Barkin RL Alternative dosing for tramadol aids effectiveness. Formulary. 199.5;30:542-543.
35. World Medical Association Declaration of Helsinki: Recommenda-
tions Guiding Medical Doctors in Biomedical Research Involving Human Subjects [WMA Web site].
Ferney-Voltaire, France: WMA; 1989. Available at: http://www.wma.net. Accessed June 15, 2005.
36. European Agency for the Evaluation of Medicinal Products, International ConFerence on Harmonisation-World Health Organization. Guideline for Good Clinical Practice [EMEA Web site]. ICH Topic E6. Geneva, Switzerland: WHO; 2002. Available at: http://www.emea.eu. int. Accessed June 15, 2005.
37. EdwardsJE, McQuay HJ, Moore RA. Combination analgesic efficacy: Individual patient data meta-analysis of single-dose oral tramadol plus acetaminophen in acute postoperative pain. J Pain Symptom Manage. 2002;23:121-130.
38. Medve RA, Wang J, Karim R. Tramadol and acetaminophen tablets for dental pain. Anesth Prog. 2001; 48:79-81.
39. Tallarida RJ, Raffa RB.Testing for synergism over a range of'fixed ratio drug combinations: Replacing the isobologram. L//~ Sd. 1996;58:PL 23-PL 28.
40. BeaverWT. Combination analgesics. AmJ Med. 1984;77:38-53.
41. McClellan K, Scott LJ. Tramadol/paracetamol [published correction appears in Drugs. 2003;63:1636]. Drugs. 2003;63:1079-1086, discussion 1087-1088.












