Введение
Остеоартрит (ОА) характеризуется деградацией суставного хряща и является основной причиной инвалидизации пожилых людей, которые составляют примерно 15% от всего населения мира [1].
Применение маркеров обмена костной ткани при заболеваниях костей значительно повысило возможность субклассифицировать пациентов, выявлять больных с высоким риском развития таких заболеваний и содействовать в исследовании лекарственной терапии. Эти биомаркеры можно идентифицировать среди некоторых продуктов деградации хряща, таких как внеклеточный матрикс или коллагенновые компоненты. Деградацию хряща при ОА можно оценить по ферментам, вовлеченным в этот процесс, и веществам, первоначально присутствующим в хряще, поступающим в кровь и отражающим процесс деградации. Сывороточные уровни олигомерного матриксного протеина хряща (СОМР), компонента внеклеточного матрикса, существенно выше у пациентов с ОА, чем в контрольной группе [2]. Также уровни СОМР хорошо коррелируют с наличием синовита при ОА [3] и могут служить индикатором прогрессирования ОА [4]. Поэтому мы измеряли сывороточные уровни СОМР и далее анализировали потенциал СОМР в качестве диагностического или прогностического маркера для установления начала ОА или его прогрессирования.
При ОА деградация суставного хряща ухудшает функцию сустава и, как следствие, качество жизни. Протеолитическая деградация внеклеточного матрикса играет важную роль в эрозии хряща. Из всех протеиназ, расщепляющих хрящ, матриксные металлопротеиназы (ММР) представляют особый интерес. Их активность может регулироваться путем прямой активации, модулирования выработки проэнзимов или изменения уровней эндогенных ингибиторов [5,6]. Фактически у пациентов с ОА сывороточные уровни ММР анормально высокие.
Эффекты нестероидных противовоспалительных препаратов (НПВП) на метаболизм хрящевой ткани являются спорными. Некоторые НПВП могут ускорять разрушение хряща, тогда как другие могут оказывать хондропротективное действие [9]. Нимесулид ингибирует синтез матрикса [10], но in vitro снижает синтез ММР [11,12]. Поэтому мы посчитали, что полезно изучить in vivo действие нимесулида на хрящ; эффекты оценивали по сывороточным уровням СОМР и трех металлопротеиназ в ходе поискового клинического исследования с участием пациентов с ОА.
Основным механизмом противовоспалительного и анальгезирующего действий нимесулида является ингибирование синтеза простагландинов [13]. Однако, помимо преимущественного подавления ЦОГ–2, особый интерес представляет ингибирование ММР [11,12,14]. По–видимому, этот НПВП может подавлять катаболизм хрящевой ткани за счет механизмов, не связанных с простагландинами.
Методы
Пациенты
В исследуемую группу были включены 20 взрослых пациентов в возрасте 41–72 лет (среднее значение возраста: 55,3±8,1) с рентгенологически доказанным (Kellgren и Lawrence ≥2 стадии) ОА коленного и/или тазобедренного сустава и острой болью (ВАШ >3,5 см). После предоставления информированного согласия этих пациентов включили в открытое поисковое исследование. В контрольную группу для сравнения данных биохимического анализа крови были включены 22 здоровых добровольца без боли. Выбранная исследуемая популяция четко отражала общую популяцию больных с гонартритом и коксартритом в равном соотношении ОА коленного и тазобедренного суставов. Средняя продолжительность ОА составила 7,2±5,6 года, ОА Kellgren и Lawrence степени 2 у 42,1% больных, степени 3 у 52,6% пациентов и степени 4 у 5,3% больных.
Критериями невключения в исследование были наличие аллергии на НПВП, наличие в анамнезе язвы желудка и/или двенадцатиперстной кишки, беременность, лактация, клинически значимые заболевание сердечно–сосудистой системы, почек, печени, дыхания, желудочно–кишечного тракта, применение противовоспалительной или анальгезирующей терапии в течение 3 дней до начала исследования.
Исследуемая группа (n=20) пациентов получала нимесулид в дозе 100 мг (таблетки Аулин, СиЭсСи– Фармацевтикэлз Хендэлз ГмбХ, Австрия) утром и вечером в течение 3 нед. исследования. Контрольная группа не получала никакого лечения и служила только референсом для данных биохимического анализа крови.
Клинические исследования
Симптомы и физическую недееспособность оценивали по индексу WOMAC (индекс ОА университетов МакМастера и Западного Онтарио), переведенному на немецкий язык [15]. Глобальный показатель WOMAC определяли путем суммирования совокупных (итоговых) показателей боли, скованности и физической активности. Боль при движении и в покое оценивали по горизонтальной, визуальной аналоговой шкале (ВАШ; показатель 0–10 см). Измерения проводили в начале исследования (до приема нимесулида в день 0) и в конце недель 1, 2 и 3. Во время каждого визита регистрировали побочные эффекты.
Лабораторные анализы
Кровь для лабораторных анализов забирали до первого приема нимесулида (в начале исследования) и в конце 3–недельной терапии. Определяли стандартные лабораторные параметры (эритроциты, лейкоциты, тромбоциты, С–реактивный белок, азот мочевины крови, креатинин, ураты, триглицериды, холестерин, билирубин, АСТ, АЛТ, ГГТ и щелочную фосфатазу). В сыворотке крови измеряли уровень олигомерного матриксного протеина хряща (Wielisa–kit, Wieslab, Швеция) и металлопротеиназ–1, –3 и –8 (Biotrak ELISA System, Амершам биотех, Великобритания).
Статистический анализ
Использовались параметрические и непараметрические методы (SPSS10.0.7: критерий t Стьюдента, корреляция Пирсона [параметрический], тау–б критерий Кендалла [непараметрический], У критерий Вилкоксона–Манна–Уитни, критерий Фредманна и регрессионный анализ ANOVA).
Результаты
Данные клинического исследования
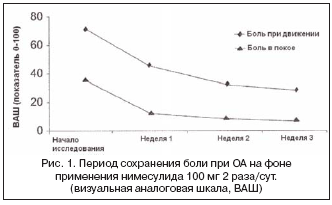
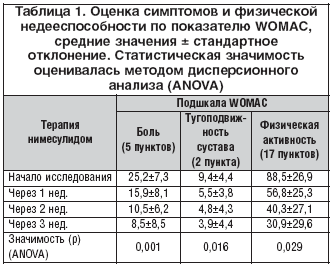
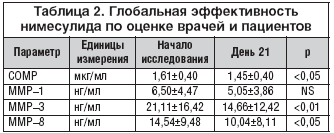
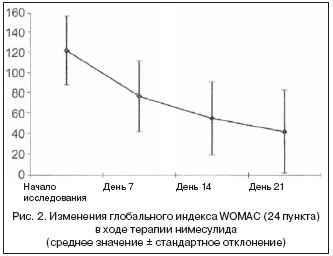
Терапия нимесулидом улучшала все измеряемые клинические параметры боли и индекс артрита. Уменьшение боли при активных движениях, измеренное по ВАШ, было высоко значимым (рис. 1; табл. 1). Также отмечено существенное понижение значений индивидуальных компонентов индекса ОА WOMAC (табл. 1) и глобального показателя, полученного при оценке ответов на вопросник (рис. 2). Общая оценка эффективности терапии, проведенная врачами и пациентами по 5–балльной шкале, показала хороший профиль нимесулида (табл. 2). Врачи признали, что 80% пациентов получили благоприятное воздействие от нимесулида, а 65% больных отметили заметное улучшение самочувствия (табл. 2).
Лабораторные данные
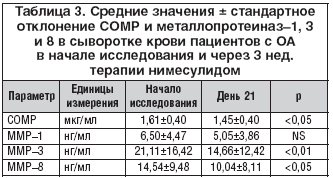
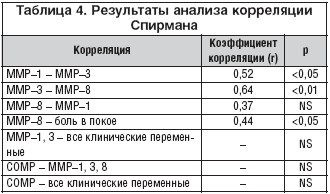
При сравнении со значениями сывороточных уровней СОМР, ММР–1, ММР–3 и ММР–8 контрольных добровольцев у пациентов, получавших нимесулид в течение 21 дня, отмечено снижение уровней СОМР, ММР–3 и ММР–8, хотя понижение уровня ММР–1 не имело статистической значимости (табл. 3). Непараметрический анализ указывает на существование корреляции между ММР–1 и ММР–3 0,52, р<0,05) и между ММР–3 и ММР–8 (0,64; р<0,01, табл. 4). Не отмечено значимой корреляции между уровнями СОМР и металлопротеиназ. Более того, наблюдалась слабая корреляция между улучшением в покое (ВАШ) и уровнем ММР–8, хотя с уровнями других исследуемых металлопротеиназ и СОМР корреляция отсутствовала.
Профиль безопасности
В двух случаях развившиеся нежелательные явления вероятно, но не определенно связаны с проводимой терапией. У одного пациента наблюдался умеренный отек век, у второго больного – умеренная диарея (на эндоскопии не выявлено патологий). Эпистаз, отмеченный у пациента с эпистазом в анамнезе, признан не связанным с проводимой терапией. Отсутствовали признаки влияния нимесулида на параметры клинического и биохимического анализов крови, кроме минимального повышения уровней азота мочевины крови и креатинина.
Обсуждение
Основным результатом этого открытого, поискового исследования нимесулида является значительное уменьшение уровня ММР–3 и ММР–8, а также СОМР. Коллагеназы ММР–1, ММР–8 и ММР–13 играют главную роль в ОА, инициируя деградацию человеческого коллагена типа II, чьи фрагменты далее расщепляются металлопротеиназой–3 (стромелизин) [16,17]. Наши результаты показывают, что нимесулид может влиять на первичные проявления метаболизма внеклеточного матрикса (путем снижения ММР–8) и вторичные проявления, которые приводят к деградации N–телопептида коллагена типа II за счет уменьшения уровня ММР–3. Наши результаты исследования in vivo согласуются с предыдущими данными исследований in vitro, показывающими снижение синтеза стромелизина [12]. Нимесулид также ингибировал активность коллагеназ in vitro [11] и активность коллагеназ в синовиальной жидкости пациентов с ОА.
Необходимо отметить, что ферментная атака металлопротеиназ и процесс деградации хряща начинаются до появления клинических симптомов, таких как острая боль. Поэтому сложно установить статистическую корреляцию между клиническими симптомами и уровнями ферментов, деградирующих хрящ, и/или структурных матриксных макромолекул.
Снижение уровней металлопротеиназ сопровождалось уменьшением уровня СОМР в сыворотке крови, что говорит о том, что процесс ферментного ингибирования сопровождается уменьшением распада хряща. Также по этой причине обнаружена слабая корреляция между уровнями ММР и клиническими симптомами.
Увеличение уровня СОМР в сыворотке крови может служить индикатором рентгенографически подтвержденного прогрессирования ОА [4,18]. Сывороточные уровни СОМР значительно повышались с увеличением Kellgren и Lawrence степени тяжести ОА и количества вовлеченных коленных и тазобедренных суставов [2]. Так как на начальной стадии ОА пациенты и врачи часто не замечают развития заболевания, сывороточный уровень СОМР может быть ценным показателем для раннего установления ОА [19]. Повышенные уровни СОМР хорошо коррелируют с присутствием синовита у пациентов с ОА [3], и воспалительные процессы могут также повышать уровни ММР [20] и СОМР за счет повышенной деградации матрикса. Снижение сывороточных уровней СОМР у пациентов, получавших нимесулид, в нашем исследовании, вероятно, отражает изменения в обмене матрикса. Так как СОМР является маркером прогрессирования болезни на ранней стадии остеоартрита коленного сустава [4], наши результаты поддерживают важность его измерения при оценке разрушения сустава при ОА и оценке эффективности НПВП и их воздействия на хрящ.
Оценка биохимических маркеров позволила идентифицировать различные аспекты тканевого обмена в костной, хрящевой и синовиальной тканях [21]. В этом контексте ОА коленного сустава сопровождается:
• снижением обмена костной ткани, что подтверждалось оценкой уровня остеокальцина и С–терминального фрагмента коллагена типа I;
• увеличением деградации хряща, что подтверждалось повышенными уровнями С–терминального фрагмента коллагена типа II в моче и уровня СОМР в сыворотке крови;
• повышенным обменом синовиальной ткани, что наблюдалось по увеличению уровня Glc–Gal–PYD в моче и N–пропептида коллагена типа III (PIIINP).
Таким образом, нимесулид снижает повышенный обмен хрящевой ткани при ОА. Это представляет интерес при оценке воздействия препарата на повышенный обмен синовиальной ткани при ОА.
В ряде исследований была установлена клиническая эффективность нимесулида в лечении различных болезненных, воспалительных заболеваний, в том числе ОА [14,22–25]. Мы также обнаружили заметное и прогрессирующее уменьшение боли при приеме нимесулида и значимое улучшение состояния, измеряемое по шкале WOMAC.
Профиль безопасности нимесулида при длительном приеме пациентами с ОА – хороший [26], и мы также наблюдали хорошую переносимость этого препарата. Два нежелательных явления, вероятно, но не определенно, связанные с терапией нимесулидом, были не серьезными, и практически отсутствовало воздействие препарата на различные параметры клинического и биохимического анализа крови.
В заключение, помимо преимущественного ингибирования ЦОГ–2, нимесулид оказывает благоприятные эффекты, снижая сывороточные уровни двух металлопротеиназ, которые способны непосредственно [27,28] расщеплять коллаген типа II (за счет ММР–1) и последующие фрагменты N–телопептида (за счет ММР–3).
по материалам статьи
W.C. Kullich, F. Niksic, G. Clein
«Effect of nimesulide on metalloproteinases
and matrix degradation in osteoarthritis: A pilot clinical study».
IJCP Supplement 128 July 2002, p. 24–29
Таким образом, нимесулид, снижая сывороточные уровни металлопротеиназ ММР–3 и ММР–8, а также COMP и замедляя процесс распада хряща при ОА, обладает выраженным хондропротективным эффектом. Указанное свойство исключительно важно в терапии ОА и делает нимесулид препаратом выбора в лечении заболевания.
Литература
1. Huskisson EC. Nimesulide, a balanced drug for the treatment of osteoarthritis. Clin Exp Rheumatol 2001; 19(Suppl 22): 21–25.
2. Clark AG, Jordan JM, Vilim V et al. Serum cartilage oligomeric matrix protein reflects 28 IJCP Supplement 128 July 2002 osteoarthritis presence and severity. Arthritis Rheum 1999; 42(11): 2356–2364.
3. Vilim V, Vytasck R, Vencovsky J ef al. The effect of synovitis on COMP levels in sera of patients with osteoarthrosis (abstract). Trans Orthop Res Soc 1999; 24: 441.
4. Petersson IF, Boegard T, Svensson B et al. Changes in cartilage and bone metabolism identified by serum markers in early osteoarthritis of the knee joint. Br J Rheumatol 1998; 37: 46–50.
5. Martel–Pelletier J, McCollum R, Fujimoto N et al. Excess of metalloproteases over tissue inhibitor of metalloprotease may contribute to cartilage degradation in osteoarthritis and rheumatoid arthritis. Lab Invest 1994; 70: 807–815.
6. Nagase H. Activation mechanisms of matrix metalloproteinases. Biol Chem 1997; 378: 151 160.
7. Manicourt DH, Fujimoto N, Obata K, Thonar EJMA. Serum levels of collagenase, stromelysin–1 and TIMP–1: Age and sex related differences in normal subjects and relationship to the extent of joint involvement and serum levels of antigenic keratan sulfate in patients with osteoarthritis. Arthritis Rheum 1994; 37: 1774–1783.
8. Naito K, Takahashi M, Kushida K et al. Measurement of matrix metalloproteinases (MMPs) and tissue inhibitor of metailoproteinases–1 (TIMP–1) in patients with knee osteoarthritis: comparison with generalized osteoarthritis. Rheumatology 1999; 38: 510–515.
9. Brandt KD. Effect of nonsteroidal anti–inflammatory drugs on chondrocyte metabolism in vitro and in vivo. Am J Med 1987; 83: 29–34.
10. Dingle JT.The effects of NSAIDs on the matrix of human articular cartilages. Z Rheumatol 1999; 58: 125–129.
11. Barracchini A, Franceschini N, Amicosante G ef al. Can Non–steroidal Anti–inflammatory Drugs Act as Metalloproteinase Modulators? An In– vitro Study of inhibition of Collagenase Activity. J Pharm Pharmacol 1998; 50: 1417–1423.
12. Pelletier JP, Martel–Pelietier J. Effects of Nimesulide and Naproxen on the Degradation and Metalloprotease Synthesis of Human Osteoarthritic Cartiiaqe. Drugs 1993; 46(Suppl 1): 34–39.
13. Famaey JP. In vitro and in vivo pharmacological evidence of selective cyclooxygenase–2 inhibition by nimesulide: An overview. Inflamm Res 1997;46:437–446.
14. Bennett A, Villa G. Nimesulide: an NSAID that preferentially inhibits COX–2, and has various unique pharmacological activities. Exp Opin Pharmacother 2000; 1(2): 277–286.
15. Stucki G, Meier D, Stucki S ef al. Evaluation einer deutschen Version des WOMAC (Western Ontario und McMaster Universities) Arthroseindex. Z Rheumatol 1996; 55: 40–49.
16. Saito S, Katoh M, Masumoto M ef al. Involvement of MMP–1 and MMP–3 in collagen degradation induced by IL–1 in rabbit cartilage explant culture. Life Sci 1998; 62: 359–365.
17. Wu J J, Lark MW, Chun LE, Eyre DR. Sites of stromelysin cleavage in collagen types II, IX, and XI of cartilage. J Biol Chem 1991; 266: 5625–5628.
18. Sharif M, Saxne T, Shepstone L ef al. Relationship between serum cartilage oligomeric matrix protein levels and disease progression in osteoarthritis of the knee joint. Br J Rheumatol 1995;34:306–310.
19. Neidhart M, Hauser N, Paulsson M ef al. Small fragments of cartilage oligomeric matrix protein in synovial fluid and serum as markers for cartilage degradation. Br J Rheumatol 1997; 36: 1151–1160.
20. Ribbens C, Andre B, Kaye O ef al. Synovial fluid matrix metalloproteinase–3 levels are increased in inflammatory arthritides whether erosive or not. Rheumatology 2000; 39: 1357–1365.
21. Ganu V Goldberg R, Peppard J et al. Inhibition of interleukin–1 alpha–induced cartilage oligomeric matrix protein degradation in bovine articular cartilage by matrix metalloproteinase inhibitors: potential role for matrix metallopro– teinase in the generation of cartilage oligomeric matrix protein fragments in arthritic synovial fluid. Arthritis Rheum 1998; 41(12): 2143–2151.
22. Davis R, Brogden RN. Nimesulide. An Update of its Pharmacodynamic and Pharmacokinetic Properties, and Therapeutic Efficacy. Druas 1994; 48(3): 431–454.
23. Famaey JP, Vandekerckhove K, Geczy J, Bruhwyler J. A large, open–label trial of nimesulide in patients with osteoarticular conditions treated in a general practice setting. Curr Ther Res Clin E 1998; 59(7): 467–482.
24. Huskisson EC, Macciocchi A, Rahlfs VW ef al. Nimesulide Versus Diclofenac in the Treatment of Osteoarthritis of the Hip or Knee: An Active Controlled Equivalence Study. Curr Ther Res Clin E 1999; 60(5): 253–265.
25. Pohjolainen T, Jekunen A, Autio L, Vuorela H. Treatment of Acute Low Back Pain with the COX– 2–Selective Anti–Inflammatory Drug Nimesulide. Spine 2000; 25(12): 1579–1585.
26. Dreiser RL, Benevelli DC. Long Term Toierabllity Profile of Nimesulide in the Treatment of Osteoarthritis. Drugs 1993; 46(Supp! 1): 270–274.
27. Hui W, Rowan AD, Cawston T. Insulin–like growth factor 1 blocks collagen release and down regulates matrix metalloproteinase–1, –3, –8, and –13 mRNA expression in bovine nasal cartilage stimulated with oncostatin M in combination with interleukin 1a. Ann Rheum Dis 2001; 60: 254–261.
28. Billinghurst RC, Dahlberg L, lonescu M ef al. Enhanced cleavage of type II collagen by collagenases in osteoarthritic articular cartilage. J Clin Invest 1997; 99: 1534–1545.












