–Ю—Б–Њ–±–µ–љ–љ–Њ –∞–Ї—В—Г–∞–ї—М–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –Љ–љ–µ–љ–Є–µ –∞–Ї–∞–і–µ–Љ–Є–Ї–∞ –†–Р–Э, –њ—А–Њ—Д. –Х.–Ы. –Э–∞—Б–Њ–љ–Њ–≤–∞, —З—В–Њ ¬Ђ–≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–∞–Ј—А–µ–ї–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Є–Ј—Г—З–∞—В—М —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —З–µ—А–µ–Ј –њ—А–Є–Ј–Љ—Г ¬Ђ–Љ—Г–ї—М—В–Є–Љ–Њ—А–±–Є–і–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є¬ї, –≤ –Ї–Њ—В–Њ—А—Г—О –Є–љ—В–µ–≥—А–Є—А–Њ–≤–∞–љ—Л –≤—Б–µ –±–µ–Ј –Є—Б–Ї–ї—О—З–µ–љ–Є—П –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ—Л–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –љ–∞–Ї–∞–њ–ї–Є–≤–∞–µ–Љ—Л–µ –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є –≤ —В–µ—З–µ–љ–Є–µ –ґ–Є–Ј–љ–Є¬ї [2].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤ –†–Њ—Б—Б–Є–Є –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П 19 –љ–µ–њ–∞—В–µ–љ—В–Њ–≤–∞–љ–љ—Л—Е –љ–∞–Ј–≤–∞–љ–Є–є –Э–Я–Т–Я. –Я—А–Є —Н—В–Њ–Љ –∞–Ї—В–Є–≤–љ–∞—П —А–µ–Ї–ї–∞–Љ–љ–∞—П –Ї–∞–Љ–њ–∞–љ–Є—П –Ї–Њ–Љ–њ–∞–љ–Є—П–Љ–Є-–њ—А–Њ–Є–Ј–≤–Њ–і–Є—В–µ–ї—П–Љ–Є –Ј–∞—З–∞—Б—В—Г—О –Ј–∞—В—А—Г–і–љ—П–µ—В –≤—Л–±–Њ—А —В–Њ–≥–Њ –Є–ї–Є –Є–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞. –Ъ—А–Њ–Љ–µ —Н—В–Њ–≥–Њ, –≤ —А–µ–∞–ї—М–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –љ–∞–Ј–љ–∞—З–∞—О—В—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–µ –Є–ї–Є –љ–µ–і–Њ–њ—Г—Б—В–Є–Љ–Њ –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –њ—А–Є —Б–ї–Є—И–Ї–Њ–Љ –Ї–Њ—А–Њ—В–Ї–Є—Е –Є–ї–Є —З—А–µ–Ј–Љ–µ—А–љ–Њ –і–ї–Є—В–µ–ї—М–љ—Л—Е –Ї—Г—А—Б–∞—Е, –љ–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ—В—Б—П —А–µ–≥—Г–ї—П—А–љ–Њ—Б—В—М –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Т—Б–µ —Н—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –љ–µ–∞–і–µ–Ї–≤–∞—В–љ—Г—О –Њ—Ж–µ–љ–Ї—Г –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –і–Њ—Б—В–Њ–Є–љ—Б—В–≤ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–љ–Є–ґ–∞–µ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї–Є —А–∞–Ј–≤–Є—В–Є—П –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ [3].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ–±—Й–µ–њ—А–Є–Ј–љ–∞–љ–љ–Њ, —З—В–Њ –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–∞—П –Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е (—Б-–Э–Я–Т–Я) –Є –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е (–љ-–Э–Я–Т–Я) –Э–Я–Т–Я –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≤ –∞–і–µ–Ї–≤–∞—В–љ—Л—Е –і–Њ–Ј–∞—Е (—Б—А–µ–і–љ–Є—Е –Є –≤—Л—Б–Њ–Ї–Є—Е —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е) –љ–µ –Њ—В–ї–Є—З–∞–µ—В—Б—П –њ—А–Є —В—А–∞–≤–Љ–∞—Е, –Њ–њ–µ—А–∞—Ж–Є—П—Е –Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –Њ–њ–Њ—А–љ–Њ-–і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞, —З—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ –і–∞–љ–љ—Л–Љ–Є –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (–†–Ъ–Ш) [3, 4]. –Э–∞–њ—А–Є–Љ–µ—А, –њ–Њ –і–∞–љ–љ—Л–Љ –†–Ъ–Ш, —З–µ—А–µ–Ј 2 —З –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ —Ж–µ–ї–µ–Ї–Њ–Ї—Б–Є–±–∞ –≤ –і–Њ–Ј–µ 400 –Љ–≥ –Є –љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞ 550 –Љ–≥ —Г 60 –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б—В—А—Л–Љ –Љ–Є–≥—А–µ–љ–Њ–Ј–љ—Л–Љ –њ—А–Є—Б—В—Г–њ–Њ–Љ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –±–Њ–ї–Є –њ–Њ –≤–Є–Ј—Г–∞–ї—М–љ–Њ–є –∞–љ–∞–ї–Њ–≥–Њ–≤–Њ–є —И–Ї–∞–ї–µ —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М —Б 6,5¬±1,5 –і–Њ 2,4¬±2,5 –Є —Б 7,3¬±1,6 –і–Њ 2,63¬±2,65 –±–∞–ї–ї–Њ–≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [5]. –Ю—В–Љ–µ—З–∞–µ—В—Б—П, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –Љ–Њ–ґ–µ—В –Њ–±–µ—Б–њ–µ—З–Є—В—М –±–Њ–ї–µ–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–є –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–Є–є —Н—Д—Д–µ–Ї—В. –Ю–±—Л—З–љ–Њ –і–ї—П –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П —Н–њ–Є–Ј–Њ–і–∞ –Њ—Б—В—А–Њ–є –њ–Њ—П—Б–љ–Є—З–љ–Њ–є –±–Њ–ї–Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ—А–Є–µ–Љ–∞ –Э–Я–Т–Я –≤ —В–µ—З–µ–љ–Є–µ 7вАУ14 –і–љ–µ–є, –Њ–і–љ–∞–Ї–Њ –µ—Б–ї–Є –±–Њ–ї—М —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –і–Њ–ї—М—И–µ, –Ї—Г—А—Б –ї–µ—З–µ–љ–Є—П –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Њ–і–ї–µ–љ –і–Њ 4вАУ8 –љ–µ–і. –Є –±–Њ–ї–µ–µ.
–°—Г—Й–µ—Б—В–≤—Г–µ—В –і–≤–∞ –њ–Њ–і—Е–Њ–і–∞ –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Н—В–Њ–є –≥—А—Г–њ–њ—Л. –° –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Э–Я–Т–Я –љ–∞–Ј–љ–∞—З–∞—О—В—Б—П –Ї–Њ—А–Њ—В–Ї–Є–Љ–Є –Ї—Г—А—Б–∞–Љ–Є, –і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ–Є –і–ї—П –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –Њ—Б—В—А–Њ–є –Є–ї–Є —Г–Љ–µ–љ—М—И–µ–љ–Є—П –Њ–±–Њ—Б—В—А–µ–љ–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –і–ї–Є—В–µ–ї—М–љ–Њ–µ –љ–µ–њ—А–µ—А—Л–≤–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Э–Я–Т–Я, —З—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –ї—Г—З—И–Є–є –Ї–Њ–љ—В—А–Њ–ї—М —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –±–Њ–ї–µ–Ј–љ–Є, —З–µ–Љ –Є—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≤ —А–µ–ґ–Є–Љ–µ ¬Ђ–њ–Њ —В—А–µ–±–Њ–≤–∞–љ–Є—О¬ї. –Ю–± —Н—В–Њ–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –і–∞–љ–љ—Л–µ –†–Ъ–Ш, –≤ –Ї–Њ—В–Њ—А–Њ–Љ 853 –±–Њ–ї—М–љ—Л—Е –Њ—Б—В–µ–Њ–∞—А—В—А–Њ–Ј–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –њ–Њ–ї—Г—З–∞–ї–Є —Б-–Э–Я–Т–Я ¬Ђ–њ–Њ —В—А–µ–±–Њ–≤–∞–љ–Є—О¬ї (—В–Њ–ї—М–Ї–Њ –њ—А–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–Є) –Є–ї–Є –њ–Њ—Б—В–Њ—П–љ–љ–Њ (–љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –љ–∞–ї–Є—З–Є—П –±–Њ–ї–Є). –Х—Б–ї–Є –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Э–Я–Т–Я ¬Ђ–њ–Њ —В—А–µ–±–Њ–≤–∞–љ–Є—О¬ї –Њ–±–Њ—Б—В—А–µ–љ–Є—П –≤–Њ–Ј–љ–Є–Ї–∞–ї–Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –µ–ґ–µ–Љ–µ—Б—П—З–љ–Њ (0,93 —Н–њ–Є–Ј–Њ–і–∞/–Љ–µ—Б—П—Ж), —В–Њ —Г –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Э–Я–Т–Я –њ–Њ—Б—В–Њ—П–љ–љ–Њ вАУ –њ–Њ—З—В–Є –≤ 2 —А–∞–Ј–∞ —А–µ–ґ–µ (0,54; —А<0,001) [6].
–Я–Њ—П–≤–ї–µ–љ–Є–µ –љ–Њ–≤–Њ–є –≥—А—Г–њ–њ—Л —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л-2 (–¶–Ю–У-2) –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б–љ–Є–Ј–Є—В—М —З–Є—Б–ї–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞. –Э–Њ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ —Н—В–Є –ї–µ–Ї–∞—А—Б—В–≤–∞ –Љ–Њ–≥—Г—В –≤—Л–Ј—Л–≤–∞—В—М —А–∞–Ј–ї–Є—З–љ—Л–µ —Б–µ—А—М–µ–Ј–љ—Л–µ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л: –Њ—В –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –і–Њ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞, —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –Є –≤–љ–µ–Ј–∞–њ–љ–Њ–є –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–є —Б–Љ–µ—А—В–Є. –Ґ–∞–Ї, –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ–µ—А–≤–Њ–≥–Њ –Ї—А—Г–њ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ–Њ—Б–≤—П—Й–µ–љ–љ–Њ–≥–Њ –Њ—Ж–µ–љ–Ї–µ –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –¶–Ю–У-2 —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–±–∞ (50 –Љ–≥/—Б—Г—В) –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ –Э–Я–Т–Я –љ–∞–њ—А–Њ–Ї—Б–µ–љ–Њ–Љ (1000 –Љ–≥/—Б—Г—В) —Г –±–Њ–ї—М–љ—Л—Е —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–Љ –∞—А—В—А–Є—В–Њ–Љ (–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ VIGOR), –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞ (–Ш–Ь) —А–∞–Ј–≤–Є–≤–∞–ї—Б—П –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —З–∞—Й–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–±, вАУ 0,4% —Б–ї—Г—З–∞–µ–≤ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б 0,1% вАУ –≤ –≥—А—Г–њ–њ–µ –љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞ [7]. –Я—А–Є —Н—В–Њ–Љ –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –Љ–µ–ґ–і—Г –Ш–Ь –Є –Р–У, —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В—М—О –Є —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–Љ–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ–Є —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞–Љ–Є. –Ш–Ј-–Ј–∞ –Њ—В—Б—Г—В—Б—В–≤–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≥—А—Г–њ–њ—Л –њ–ї–∞—Ж–µ–±–Њ –Њ—Б—В–∞–≤–∞–ї–Њ—Б—М –љ–µ—П—Б–љ—Л–Љ, –±—Л–ї–∞ –ї–Є —Н—В–∞ –њ—А–Њ–±–ї–µ–Љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –њ–Њ–≤—Л—И–µ–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А–Є—Б–Ї–∞ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Є–µ–Љ–∞ —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–±–∞ –Є–ї–Є –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ–Њ–≥–Њ (–∞—Б–њ–Є—А–Є–љ–Њ–њ–Њ–і–Њ–±–љ–Њ–≥–Њ) —Н—Д—Д–µ–Ї—В–∞ –љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞, –ї–Є–±–Њ —Н—В–Њ –њ—А–Њ—Б—В–Њ —Б–ї—Г—З–∞–є–љ–Њ–µ —Б–Њ–≤–њ–∞–і–µ–љ–Є–µ [8, 9]. –Ю—В–≤–µ—В –љ–∞ –і–∞–љ–љ—Л–є –≤–Њ–њ—А–Њ—Б –±—Л–ї –њ–Њ–ї—Г—З–µ–љ –≤ —Е–Њ–і–µ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –і–≤—Г—Е –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є –њ–Њ—З—В–Є –і–≤—Г–Ї—А–∞—В–љ–Њ–µ –њ—А–µ–≤—Л—И–µ–љ–Є–µ —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е —Б–Њ–±—Л—В–Є–є (–Ш–Ь, –Є–љ—Б—Г–ї—М—В—Л) —Г –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ї–Њ–Ї—Б–Є–± (1,5 —Б–ї—Г—З–∞—П –љ–∞ 100 –њ–∞—Ж–Є–µ–љ—В–Њ-–ї–µ—В) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –њ–ї–∞—Ж–µ–±–Њ (0,78) (—А=0,008) [10].
–Я–Њ—Б–ї–µ –њ–Њ–ї—Г—З–µ–љ–Є—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А–Њ–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —А–Є—Б–Ї –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л—Е –і–µ–є—Б—В–≤–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞, –Ї–Њ–Љ–њ–∞–љ–Є—П-–њ—А–Њ–Є–Ј–≤–Њ–і–Є—В–µ–ї—М –і–Њ–±—А–Њ–≤–Њ–ї—М–љ–Њ –Њ—В–Њ–Ј–≤–∞–ї–∞ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–є –Є–љ–≥–Є–±–Є—В–Њ—А –¶–Ю–У-2 —А–Њ—Д–µ–Ї–Њ–Ї—Б–Є–± —Б —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ —А—Л–љ–Ї–∞. –° —В–µ—Е –њ–Њ—А –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2 —П–≤–ї—П–µ—В—Б—П –њ—А–µ–і–Љ–µ—В–Њ–Љ –њ–Њ—Б—В–Њ—П–љ–љ—Л—Е –і–Є—Б–Ї—Г—Б—Б–Є–є, –Є –≤—Б–Ї–Њ—А–µ –љ–∞—З–∞–ї–Є –≤—Л—Б–Ї–∞–Ј—Л–≤–∞—В—М—Б—П –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ –Њ–њ–∞—Б–µ–љ–Є—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е –Э–Я–Т–Я.
–С—Л–ї–Њ –њ–µ—А–µ—Б–Љ–Њ—В—А–µ–љ–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–µ –Њ —В–Њ–Љ, —З—В–Њ –¶–Ю–УвАУ2 —П–≤–ї—П–µ—В—Б—П —В–Њ–ї—М–Ї–Њ ¬Ђ–њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ¬ї —Д–µ—А–Љ–µ–љ—В–Њ–Љ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –і–Њ–Ї–∞–Ј–∞–љ–∞ —А–Њ–ї—М –¶–Ю–У-2-–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ —Б–Є–љ—В–µ–Ј–∞ –Я–У –≤ –Ј–∞–ґ–Є–≤–ї–µ–љ–Є–Є —П–Ј–≤, ¬Ђ–∞–і–∞–њ—В–Є–≤–љ–Њ–є —Ж–Є—В–Њ–њ—А–Њ—В–µ–Ї—Ж–Є–Є¬ї –Ї–ї–µ—В–Њ–Ї –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –Ї –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–Є–Љ —Д–∞–Ї—В–Њ—А–∞–Љ, –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –Њ–≤—Г–ї—П—Ж–Є–Є, —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї, —Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ—Б—В–∞—Ж–Є–Ї–ї–Є–љ–∞ –Ї–ї–µ—В–Ї–∞–Љ–Є —Н–љ–і–Њ—В–µ–ї–Є—П —Б–Њ—Б—Г–і–Њ–≤, —А–µ–њ–∞—А–∞—Ж–Є–Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –Ї–Њ—Б—В–µ–є —Б–Ї–µ–ї–µ—В–∞ [11].
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л —Н—В–Њ—В –≤–Њ–њ—А–Њ—Б –≤—Л–Ј—Л–≤–∞–µ—В –Њ–ґ–Є–≤–ї–µ–љ–љ—Л–є –Є–љ—В–µ—А–µ—Б –љ–µ —В–Њ–ї—М–Ї–Њ –≤ —Б–≤—П–Ј–Є —Б –≤–Њ–Ј–љ–Є–Ї—И–Є–Љ–Є —Б–Њ–Љ–љ–µ–љ–Є—П–Љ–Є –≤ –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ—Л—Е —Б–≤–Њ–є—Б—В–≤–∞—Е –і–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –љ–Њ –Є –≤ —Б–≤–µ—В–µ –њ–Њ—П–≤–ї–µ–љ–Є—П –љ–Њ–≤—Л—Е —Б–≤–µ–і–µ–љ–Є–є –Њ —А–Њ–ї–Є –¶–Ю–УвАУ2 –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Н—В–Є –і–∞–љ–љ—Л–µ –≤–∞–ґ–љ—Л –і–ї—П –Њ—Ж–µ–љ–Ї–Є –Є—Б—В–Є–љ–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ї–Њ–Ї—Б–Є–±–Њ–≤, –і–ї—П –Ї–Њ—В–Њ—А—Л—Е –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–µ –Э–Я–Т–Я —Б—В–∞—А–Њ–є –≥–µ–љ–µ—А–∞—Ж–Є–Є (–і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї, –Є–±—Г–њ—А–Њ—Д–µ–љ, –љ–∞–њ—А–Њ–Ї—Б–µ–љ –Є –і—А.) –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є —Б–ї—Г–ґ–∞—В –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —Б—А–∞–≤–љ–µ–љ–Є—П. –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –Њ –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —Н—В–Њ–є –≥—А—Г–њ–њ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –±–∞–Ј–Є—А—Г—О—В—Б—П, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ, –љ–∞ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–Њ—В–Њ—А—Л—Е –≤–∞—А—М–Є—А—Г—О—В –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Ї–Њ–љ—В–Є–љ–≥–µ–љ—В–∞ –±–Њ–ї—М–љ—Л—Е –Є –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –∞–љ–∞–ї–Є–Ј–∞. –Ґ–∞–Ї, –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —А–∞–±–Њ—В–∞—Е —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ш–Ь –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ (–Њ—В 1,2 –і–Њ 1,7) [12вАУ14]. –Ю—В–Љ–µ—З–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Ш–Ь –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Є–±—Г–њ—А–Њ—Д–µ–љ–Њ–Љ —Г –±–Њ–ї—М–љ—Л—Е, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –ї–Є—Ж, –љ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–≤—И–Є—Е –і–∞–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –≤ –Ї–∞—А–і–Є–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ—Л—Е –і–Њ–Ј–∞—Е. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Є–±—Г–њ—А–Њ—Д–µ–љ–∞ –≤ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј–∞—Е –≤ —В–µ—З–µ–љ–Є–µ –±–Њ–ї–µ–µ 60 –і–љ–µ–є –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ —Б–µ—А—М–µ–Ј–љ—Л—Е –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е —Б–Њ–±—Л—В–Є–є –љ–∞ 33% [15]. –Э–∞–њ—А–Њ–Ї—Б–µ–љ —З–∞—Й–µ –і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї —Б–љ–Є–ґ–µ–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ш–Ь, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г –±–Њ–ї—М–љ—Л—Е, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г, –Є –±–µ–Ј —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ [16].
–Я—А–µ–і—Б—В–∞–≤–ї—П–µ—В –Њ–≥—А–Њ–Љ–љ—Л–є –Є–љ—В–µ—А–µ—Б –Њ–і–љ–Њ –Є–Ј —Б–∞–Љ—Л—Е –Ї—А—Г–њ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ –∞–љ–∞–ї–Є–Ј—Г –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Э–Я–Т–Я, –≤–Ї–ї—О—З–∞—О—Й–µ–µ –і–∞–љ–љ—Л–µ 31 –Ї—А—Г–њ–љ–Њ–Љ–∞—Б—И—В–∞–±–љ–Њ–≥–Њ –†–Ъ–Ш, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Б—А–∞–≤–љ–Є–≤–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М 7 —А–∞–Ј–ї–Є—З–љ—Л—Е –Э–Я–Т–Я, –њ–∞—А–∞—Ж–µ—В–∞–Љ–Њ–ї–∞ –Є (–Є–ї–Є) –њ–ї–∞—Ж–µ–±–Њ [17]. –Ф–ї—П –≤–Ї–ї—О—З–µ–љ–Є—П –†–Ъ–Ш –≤ —Б–µ—В–µ–≤–Њ–є –∞–љ–∞–ї–Є–Ј –≤ –љ–Є—Е –і–Њ–ї–ґ–љ—Л –±—Л–ї–Є —Г—З–∞—Б—В–≤–Њ–≤–∞—В—М –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ 10 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ–µ—А–µ–љ–µ—Б–ї–Є –Ш–Ь. –Я–µ—А–≤–Є—З–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є –∞–љ–∞–ї–Є–Ј–∞ –±—Л–ї–∞ —З–∞—Б—В–Њ—В–∞ —Д–∞—В–∞–ї—М–љ–Њ–≥–Њ –Є –љ–µ—Д–∞—В–∞–ї—М–љ–Њ–≥–Њ –Ш–Ь. –Т—В–Њ—А–Є—З–љ—Л–µ –Ї–Њ–љ–µ—З–љ—Л–µ —В–Њ—З–Ї–Є –≤–Ї–ї—О—З–∞–ї–Є —Д–∞—В–∞–ї—М–љ—Л–є –Є –љ–µ—Д–∞—В–∞–ї—М–љ—Л–є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є –Є–ї–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—Г–ї—М—В; —Б–Љ–µ—А—В—М –Њ—В –ї—О–±—Л—Е –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (–Ш–Ь, —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М —Б–Њ —Б–љ–Є–ґ–µ–љ–љ–Њ–є —Д—А–∞–Ї—Ж–Є–µ–є –≤—Л–±—А–Њ—Б–∞, —Д–∞—В–∞–ї—М–љ–∞—П –∞—А–Є—В–Љ–Є—П, –ї–µ–≥–Њ—З–љ–∞—П —Н–Љ–±–Њ–ї–Є—П, –Є–љ—Б—Г–ї—М—В); —Б–Љ–µ—А—В—М, –љ–∞—Б—В—Г–њ–Є–≤—И—Г—О –њ–Њ –љ–µ—Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–є –њ—А–Є—З–Є–љ–µ. –Т—Б–µ–≥–Њ –≤ –∞–љ–∞–ї–Є–Ј –њ–µ—А–≤–Є—З–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Є –≤–Ї–ї—О—З–µ–љ—Л 116 429 –±–Њ–ї—М–љ—Л—Е (117 218 –њ–∞—Ж–Є–µ–љ—В–Њ-–ї–µ—В –љ–∞–±–ї—О–і–µ–љ–Є—П). –Ш—Б—Е–Њ–і–љ—Л–µ –і–∞–љ–љ—Л–µ –±—Л–ї–Є –Њ—В–Њ–±—А–∞–љ—Л –і–≤—Г–Љ—П –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П–Љ–Є –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –і—А—Г–≥ –Њ—В –і—А—Г–≥–∞ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ–Є –Ї—А–Є—В–µ—А–Є—П–Љ–Є.
–І–∞—Б—В–Њ—В–∞ –Ш–Ь –Њ–њ—А–µ–і–µ–ї—П–ї–∞—Б—М –≤ 29 –†–Ъ–Ш (554 —Б–ї—Г—З–∞—П). –Ф–ї—П —В—А–µ—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞, –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ –Є —Н—В–Њ—А–Є–Ї–Њ–Ї—Б–Є–±–∞) —А–Є—Б–Ї –Ш–Ь –љ–µ –њ—А–µ–≤—Л—И–∞–ї —В–∞–Ї–Њ–≤–Њ–є –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ–ї–∞—Ж–µ–±–Њ. –Ф–ї—П –і—А—Г–≥–Є—Е –Э–Я–Т–Я –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ–ї–∞—Ж–µ–±–Њ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–є —А–Є—Б–Ї (–Ю–†) –Ш–Ь –±—Л–ї –≤—Л—И–µ –Ј–∞–њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –≥—А–∞–љ–Є—Ж—Л 1,3: —Г –Є–±—Г–њ—А–Њ—Д–µ–љ–∞ вАУ 1,61 (95% –Ф–Ш 0,50вАУ5,77), —Ж–µ–ї–µ–Ї–Њ–Ї—Б–Є–±–∞ вАУ 1,35 (0,71вАУ2,72) –Є –ї—Г–Љ–Є—А–∞–Ї–Њ–Ї—Б–Є–±–∞ вАУ 2,00 (0,71вАУ6,21).
–І–∞—Б—В–Њ—В–∞ –Є–љ—Б—Г–ї—М—В–∞ –Њ—Ж–µ–љ–µ–љ–∞ –њ–Њ –і–∞–љ–љ—Л–Љ 26 –†–Ъ–Ш (377 —Б–ї—Г—З–∞–µ–≤). –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –ї—О–±—Л—Е –Э–Я–Т–Я —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Є–љ—Б—Г–ї—М—В–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ. –Я—А–Є —Н—В–Њ–Љ –љ–∞–Є–Љ–µ–љ—М—И–Є–є —А–Є—Б–Ї –Њ—В–Љ–µ—З–∞–ї—Б—П –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞ вАУ 1,76 (0,91вАУ3,33), —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Њ—В–ї–Є—З–∞—П—Б—М –≤ –ї—Г—З—И—Г—О —Б—В–Њ—А–Њ–љ—Г –Њ—В –Є–±—Г–њ—А–Њ—Д–µ–љ–∞, вАУ 3,36 (1,00вАУ11,60), –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ вАУ 2,86 (1,09вАУ8,36), —Н—В–Њ—А–Є–Ї–Њ–Ї—Б–Є–±–∞ вАУ 2,67 (0,82вАУ8,72).

–Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –њ–Њ –і–∞–љ–љ—Л–Љ 26 –†–Ъ–Ш, –≤ –Ї–Њ—В–Њ—А—Л—Е –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ 312 —Б–Њ–±—Л—В–Є–є, —З—В–Њ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 46% —Б–Љ–µ—А—В–µ–ї—М–љ—Л—Е —Б–ї—Г—З–∞–µ–≤ –Њ—В –≤—Б–µ—Е –њ—А–Є—З–Є–љ. –Т—Б–µ –Э–Я–Т–Я, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞, —Г–≤–µ–ї–Є—З–Є–≤–∞–ї–Є —А–Є—Б–Ї —Б–Љ–µ—А—В–Є –Њ—В –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є: –Є–±—Г–њ—А–Њ—Д–µ–љ вАУ 2,39 (0,69вАУ8,64), –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї вАУ 3,98 (1,48вАУ12,70), —Ж–µ–ї–µ–Ї–Њ–Ї—Б–Є–± вАУ 2,07 (0,98вАУ4,55), —Н—В–Њ—А–Є–Ї–Њ–Ї—Б–Є–± вАУ 4,07 (1,23вАУ15,70). –°—Г–Љ–Љ–∞—А–љ—Л–є —А–Є—Б–Ї –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (–њ–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—О –Њ—В–љ–Њ—И–µ–љ–Є—П —И–∞–љ—Б–Њ–≤) —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Э–Я–Т–Я –±—Л–ї –љ–∞–Є–Љ–µ–љ—М—И–Є–Љ —Г –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –љ–∞–њ—А–Њ–Ї—Б–µ–љ вАУ 1,22 (—А–Є—Б. 1).
–Ю—Ж–µ–љ–Ї–∞ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ш–Ь –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –љ-–Э–Я–Т–Я –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–µ, –Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–Љ –љ–∞ –і–∞–љ–љ—Л—Е 14 –†–Ъ–Ш. –°—Г–Љ–Љ–∞—А–љ–Њ (–і–ї—П –≤—Б–µ—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤) –Њ–љ –Њ–Ї–∞–Ј–∞–ї—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –љ–Є–Ј–Ї–Є–Љ вАУ –Ю–† 1,19 (1,08вАУ1,31), –љ–Њ –±—Л–ї –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ –і–ї—П –і–Є–Ї–ї–Њ—Д–µ–љ–∞–Ї–∞ (–Ю–† 1,38; 1,22вАУ1,57). –Ф–ї—П –Є–±—Г–њ—А–Њ—Д–µ–љ–∞ –Њ–љ —Б–Њ—Б—В–∞–≤–Є–ї 1,11 (1,06вАУ1,17), –і–ї—П –љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞ вАУ 0,99 (0,88вАУ1,11) [17].
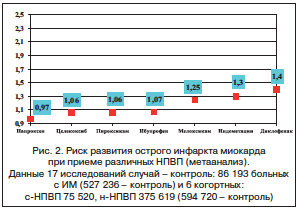
–Я–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ–Љ —Н—В–Є—Е –і–∞–љ–љ—Л—Е —П–≤–ї—П—О—В—Б—П —А–µ–Ј—Г–ї—М—В–∞—В—Л, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –њ—А–Є –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–µ 17 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б–ї—Г—З–∞–євАУ–Ї–Њ–љ—В—А–Њ–ї—М, –≤ –Ї–Њ—В–Њ—А—Л–є –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л 86 193 –±–Њ–ї—М–љ—Л—Е —Б —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ –Ш–Ь. –Ъ–Њ–љ—В—А–Њ–ї—М–љ–∞—П –≥—А—Г–њ–њ–∞ –≤–Ї–ї—О—З–∞–ї–∞ 527 236 –љ–∞–±–ї—О–і–µ–љ–Є–є. –Ф–ї—П –љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞ –±—Л–ї –њ–Њ–Ї–∞–Ј–∞–љ –љ–∞–Є–Љ–µ–љ—М—И–Є–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Њ—Б—В—А–Њ–≥–Њ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ (–Ю–®) вАУ1,06 (0,94вАУ1,2) [18] (—А–Є—Б. 2).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї—А—Г–њ–љ–Њ–Љ–∞—Б—И—В–∞–±–љ—Л—Е –†–Ъ–Ш –љ–µ –≤—Л—П–≤–Є–ї–Є —З–µ—В–Ї–Њ–є –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –¶–Ю–У-2 –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є –љ–µ—Б–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ—Б—В—М —Г—В–≤–µ—А–ґ–і–µ–љ–Є—П –Њ–± –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ—Б—В–Є —Г–≤–µ–ї–Є—З–µ–љ–Є—П —З–∞—Б—В–Њ—В—Л –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2.
–Т–∞–ґ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Э–Я–Т–Я –Є–Љ–µ–µ—В –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є—П –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–У [19]. –Ю–±—Б—Г–ґ–і–∞–µ—В—Б—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–∞–љ–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤, –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є—Е –њ—А–Њ–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л–є —Н—Д—Д–µ–Ї—В –Э–Я–Т–Я: —Б–љ–Є–ґ–µ–љ–Є–µ –≤—Л–≤–µ–і–µ–љ–Є—П –љ–∞—В—А–Є—П –Ј–∞ —Б—З–µ—В –≤–ї–Є—П–љ–Є—П –љ–∞ –Ї–ї—Г–±–Њ—З–Ї–Њ–≤—Г—О —Д–Є–ї—М—В—А–∞—Ж–Є—О –Є —Г—Б–Є–ї–µ–љ–Є–µ –µ–≥–Њ –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –Ї–∞–љ–∞–ї—М—Ж–µ–≤–Њ–є —А–µ–∞–±—Б–Њ—А–±—Ж–Є–Є; —Б—Г–ґ–µ–љ–Є–µ —Б–Њ—Б—Г–і–Њ–≤ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ–Њ–і–∞–≤–ї–µ–љ–Є—П —Б–Є–љ—В–µ–Ј–∞ –Я–У —Б –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—В–Њ—А–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О (–Я–У–Х2 –Є –Я–УI2) –Є/–Є–ї–Є —Г—Б–Є–ї–µ–љ–Є—П –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ–∞ –Є–Ј —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е –љ–µ—А–≤–љ—Л—Е –Њ–Ї–Њ–љ—З–∞–љ–Є–є, –∞ —В–∞–Ї–ґ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є –Ї –і–µ–є—Б—В–≤–Є—О –≤–∞–Ј–Њ–Ї–Њ–љ—Б—В—А–Є–Ї—В–Њ—А–љ—Л—Е —Б—Г–±—Б—В–∞–љ—Ж–Є–є; —Б–љ–Є–ґ–µ–љ–Є–µ –≤–µ–ї–Є—З–Є–љ—Л –њ–Њ—З–µ—З–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –Є —Б–Ї–Њ—А–Њ—Б—В–Є –Ї–ї—Г–±–Њ—З–Ї–Њ–≤–Њ–є —Д–Є–ї—М—В—А–∞—Ж–Є–Є, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–µ–Ї—А–µ—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є–љ–∞-1; —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Э–Я–Т–Я –љ–∞ –њ–Њ—З–Ї–Є (–ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–∞—П –љ–µ—Д—А–Њ–њ–∞—В–Є—П). –Я–Њ—З–µ—З–љ–∞—П —А–µ–≥—Г–ї—П—Ж–Є—П –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –≤–Њ –Љ–љ–Њ–≥–Њ–Љ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –¶–Ю–У-2. –Я–Њ—Н—В–Њ–Љ—Г –ї—О–±—Л–µ –Э–Я–Т–Я (—БвАУ–Э–Я–Т–Я –Є –љ-–Э–Я–Т–Я) —Б–њ–Њ—Б–Њ–±–љ—Л –Њ–Ї–∞–Ј—Л–≤–∞—В—М –њ—А–Њ–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ. –Ю—Ж–µ–љ–Є—В—М —А–µ–∞–ї—М–љ—Г—О —З–∞—Б—В–Њ—В—Г –і–∞–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Б–ї–Њ–ґ–љ–Њ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ–њ–Њ—А–љ–Њ-–і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (–Ї–∞–Ї –њ—А–Є—З–Є–љ–∞ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Э–Я–Т–Я) –Є –Р–У –Њ—З–µ–љ—М —З–∞—Б—В–Њ —Б–Њ—З–µ—В–∞—О—В—Б—П, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞.
–†–µ–Ј—Г–ї—М—В–∞—В—Л —Б–µ—А–Є–Є –Љ–∞—Б—И—В–∞–±–љ—Л—Е —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Є –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –≤ –°–®–Р, —З–µ—В–Ї–Њ –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –њ—А–Є–µ–Љ–Њ–Љ –Э–Я–Т–Я –Є —А–∞–Ј–≤–Є—В–Є–µ–Љ –Р–У. –Ґ–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ NHS (NursesвАЩ Health Study) I, II, —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —Н—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Г –ґ–µ–љ—Й–Є–љ, —А–µ–≥—Г–ї—П—А–љ–Њ –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –Э–Я–Т–Я, –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –љ–∞ 30вАУ60% [64, 65]. –І–∞—Б—В–Њ—В–∞ —А–∞–Ј–≤–Є—В–Є—П –Є–ї–Є –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є –Р–У, –Њ—В–Љ–µ—З–µ–љ–љ–∞—П –≤ –і–ї–Є—В–µ–ї—М–љ—Л—Е –†–Ъ–Ш, –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –≤ –њ—А–µ–і–µ–ї–∞—Е 5вАУ7%. –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј 51 –†–Ъ–Ш (n=130 541), –њ—А–Є–µ–Љ —Б-–Э–Я–Т–Я –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Р–У –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ (–Ю–® 1,49; 95% –Ф–Ш 1,18вАУ1,88; —А=0,04). –°—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–є —А–∞–Ј–љ–Є—Ж—Л –Љ–µ–ґ–і—Г —Б-–Э–Я–Т–Я –Є —Б-–Э–Я–Т–Я –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ (–Ю–® 1,12; 95% –Ф–Ш 0,93вАУ1,35; —А=0,23). –Я—А–Є —Н—В–Њ–Љ –љ–∞–Є–±–Њ–ї–µ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Р–Ф –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –њ—А–Є –њ—А–Є–µ–Љ–µ —Н—В–Њ—А–Є–Ї–Њ–Ї—Б–Є–±–∞ [20]. –†–µ–Ј—Г–ї—М—В–∞—В—Л –†–Ъ–Ш –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ –Є–љ–і–Њ–Љ–µ—В–∞—Ж–Є–љ, –њ–Є—А–Њ–Ї—Б–Є–Ї–∞–Љ –Є –љ–∞–њ—А–Њ–Ї—Б–µ–љ –≤ —Б—А–µ–і–љ–Є—Е —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –і–Њ–Ј–∞—Е, –Є–±—Г–њ—А–Њ—Д–µ–љ –≤ –≤—Л—Б–Њ–Ї–Њ–є –і–Њ–Ј–µ –Є —Б-–Э–Я–Т–Я —Б–њ–Њ—Б–Њ–±–љ—Л —Б–љ–Є–ґ–∞—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –±–µ—В–∞-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤, –і–Є—Г—А–µ—В–Є–Ї–Њ–≤, –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–њ—А–µ–≤—А–∞—Й–∞—О—Й–µ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞, –љ–Њ –≤ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –≤–ї–Є—П—О—В –љ–∞ –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –Ї–∞–ї—М—Ж–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤ [1].
–° –Љ–Њ–Љ–µ–љ—В–∞ –њ–Њ—П–≤–ї–µ–љ–Є—П –≤ –Ї–ї–Є–љ–Є–Ї–µ –≥—А—Г–њ–њ—Л –Э–Я–Т–Я —Б –љ–Є–Љ–Є –±—Л–ї–Є –њ—А–Њ–≤–µ–і–µ–љ—Л –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ґ–∞–Ї, –≤ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –≤ –С–Њ—Б—В–Њ–љ–µ (–°–®–Р) –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ –њ—А–Є–µ–Љ –Э–Я–Т–Я 4425 –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, –њ–µ—А–µ–љ–µ—Б—И–Є–Љ–Є –Є–љ—Д–∞—А–Ї—В, –Є 17 700 –ї–Є—Ж–∞–Љ–Є –Є–Ј –≥—А—Г–њ–њ—Л –Ї–Њ–љ—В—А–Њ–ї—П. –Т —Ж–µ–ї–Њ–Љ –њ—А–Є–µ–Љ –Э–Я–Т–Я –љ–µ —Б–љ–Є–ґ–∞–ї —А–Є—Б–Ї –Ш–Ь. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –њ—А–Є–µ–Љ –љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞ –µ–≥–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–∞–ї: —Б—В–∞–љ–і–∞—А—В–Є–Ј–Њ–≤–∞–љ–љ–Њ–µ –Њ—В–љ–Њ—И–µ–љ–Є–µ —И–∞–љ—Б–Њ–≤ –±—Л–ї–Њ 0,86 [21]. –Т –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ–Љ –Ї–∞–љ–∞–і—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –Ї—Г–і–∞ –≤–Њ—И–ї–Є 14 163 –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Ш–Ь –Є 14 160 –ї–Є—Ж –Є–Ј –≥—А—Г–њ–њ—Л –Ї–Њ–љ—В—А–Њ–ї—П, –Њ—В–љ–Њ—И–µ–љ–Є–µ —И–∞–љ—Б–Њ–≤ –і–ї—П –љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 0,71. –Я—А–Є —Н—В–Њ–Љ –≥–ї–∞–≤–љ—Л–Љ —А–µ–і–∞–Ї—В–Њ—А–Њ–Љ Archives of Internal Medicine –Ф–ґ–µ–є–Љ—Б–Њ–Љ –Ф–∞–ї–µ–љ–Њ–Љ –і–∞–µ—В—Б—П –Ї–Њ–Љ–Љ–µ–љ—В–∞—А–Є–є: ¬Ђ–•–Њ—В—П –љ–∞–њ—А–Њ–Ї—Б–µ–љ –Є —Г–Љ–µ–љ—М—И–∞–µ—В —А–Є—Б–Ї –Є–љ—Д–∞—А–Ї—В–∞, –Њ–љ —Г—Б—В—Г–њ–∞–µ—В –∞—Б–њ–Є—А–Є–љ—Г¬ї. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–Є–≤–Њ–і—П—В—Б—П –∞—А–≥—Г–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л —Б –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є —Ж–µ–ї—М—О, —Б—А–µ–і—Б—В–≤–∞ —Н—В–Њ–є –≥—А—Г–њ–њ—Л –і–Њ–ї–ґ–љ—Л –љ–∞–Ј–љ–∞—З–∞—В—М—Б—П –њ–Њ—Б–ї–µ –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–ї—Г—З–∞—П [1].
–°–њ–µ—Ж–Є–∞–ї–Є—Б—В—Л –Р–і–Љ–Є–љ–Є—Б—В—А–∞—Ж–Є–Є –њ–Њ –Ї–Њ–љ—В—А–Њ–ї—О –Ј–∞ –њ—А–Њ–і—Г–Ї—В–∞–Љ–Є –Є –ї–µ–Ї–∞—А—Б—В–≤–∞–Љ–Є –°–®–Р (FDA) —Г—Б—В–∞–љ–Њ–≤–Є–ї–Є, —З—В–Њ –љ–∞–њ—А–Њ–Ї—Б–µ–љ –≤—Л–Ј—Л–≤–∞–µ—В –љ–∞–Є–Љ–µ–љ—М—И–µ–µ —З–Є—Б–ї–Њ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Б—А–µ–і–Є –≤—Б–µ—Е –Э–Я–Т–Я. –Ъ—А–Њ–Љ–µ —Н—В–Њ–≥–Њ, –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ 754 –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞ –љ–µ —Б–≤—П–Ј–∞–љ–Њ —Б –≤—Л—Б–Њ–Ї–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М—О —А–∞–Ј–≤–Є—В–Є—П –Є–љ—Д–∞—А–Ї—В–Њ–≤, –Є–љ—Б—Г–ї—М—В–Њ–≤ –Є —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ [22]. –≠–Ї—Б–њ–µ—А—В, —А—Г–Ї–Њ–≤–Њ–і–Є—В–µ–ї—М –Њ—В–і–µ–ї–∞ –∞–љ–µ—Б—В–µ–Ј–Є–Њ–ї–Њ–≥–Є–Є, –∞–љ–∞–ї–≥–µ–Ј–Є–Є –Є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є FDA Sharon Hertz –Ї–Њ–љ—Б—В–∞—В–Є—А–Њ–≤–∞–ї, —З—В–Њ ¬Ђ–Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј –њ–Њ–і—В–≤–µ—А–і–Є–ї –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —А–Є—Б–Ї —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Э–Я–Т–Я –Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У-2, –Њ–і–љ–∞–Ї–Њ —В–∞–Ї–ґ–µ —Н—В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –љ–∞–њ—А–Њ–Ї—Б–µ–љ –љ–µ –њ–Њ–≤—Л—И–∞–µ—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П –і–∞–љ–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є¬ї [23]. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ —Н–Ї—Б–њ–µ—А—В—Л FDA —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–ї–Є –Њ—В—А–∞–Ј–Є—В—М –љ–∞ —Г–њ–∞–Ї–Њ–≤–Ї–µ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О –Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Ы–° –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Њ—В–љ–µ—Б–µ–љ–љ—Л—Е –Ї –≥—А—Г–њ–њ–µ —А–Є—Б–Ї–∞ –њ–Њ –і–∞–љ–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ.
–Т —Ж–µ–ї–Њ–Љ –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –†–Ъ–Ш, –љ–∞–±–ї—О–і–∞—В–µ–ї—М–љ—Л—Е –Є —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –љ–∞–њ—А–Њ–Ї—Б–µ–љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ –≤—Б–µ–Љ–Є –і—А—Г–≥–Є–Љ–Є –Э–Я–Т–Я —П–≤–ї—П–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Є —Г–і–Њ–±–љ—Л–Љ –≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –Є –љ–µ —Г—Б—В—Г–њ–∞–µ—В –њ–Њ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–Љ—Г –њ–Њ—В–µ–љ—Ж–Є–∞–ї—Г –і—А—Г–≥–Є–Љ –Э–Я–Т–Я, –Є–Љ–µ–µ—В –љ–∞–Є–Љ–µ–љ—М—И–Є–є —А–Є—Б–Ї –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Ї–∞—В–∞—Б—В—А–Њ—Д [24, 25] –Є –њ–Њ –њ—А–∞–≤—Г —Б—З–Є—В–∞–µ—В—Б—П –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М ¬Ђ–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ¬ї –Ї–∞—А–і–Є–Њ–±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є. –Я–Њ—Н—В–Њ–Љ—Г –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–љ–љ–Њ –љ–∞–њ—А–Њ–Ї—Б–µ–љ–∞, –Ї–Њ—В–Њ—А—Л–є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –≤ –†–Њ—Б—Б–Є–Є –њ–Њ–і —В–Њ–≤–∞—А–љ—Л–Љ –Ј–љ–∞–Ї–Њ–Љ –Э–∞–ї–≥–µ–Ј–Є–љ¬Ѓ (¬ЂK–†–Ъ–Р, –і. –і., –Э–Њ–≤–Њ –Ь–µ—Б—В–Њ¬ї, –°–ї–Њ–≤–µ–љ–Є—П). –Э–∞–ї–≥–µ–Ј–Є–љ, —В–∞–±–ї–µ—В–Ї–Є, –њ–Њ–Ї—А—Л—В—Л–µ –њ–ї–µ–љ–Њ—З–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є, –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ –≤ –і–Њ–Ј–Є—А–Њ–≤–Ї–µ 275 –Љ–≥ вДЦ 10 –Є вДЦ 20 –Ї–∞–Ї –±–µ–Ј—А–µ—Ж–µ–њ—В—Г—А–љ—Л–є –њ—А–µ–њ–∞—А–∞—В (—Б—Г—В–Њ—З–љ–∞—П –і–Њ–Ј–∞ 2вАУ4 —В–∞–±–ї–µ—В–Ї–Є) [26]. –Э–∞–ї–≥–µ–Ј–Є–љ —Д–Њ—А—В–µ, —В–∞–±–ї–µ—В–Ї–Є, –њ–Њ–Ї—А—Л—В—Л–µ –њ–ї–µ–љ–Њ—З–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є, 550 –Љ–≥ вДЦ 10 вАУ –Ї–∞–Ї –њ—А–µ–њ–∞—А–∞—В —А–µ—Ж–µ–њ—В—Г—А–љ–Њ–≥–Њ –Њ—В–њ—Г—Б–Ї–∞ (—Б—Г—В–Њ—З–љ–∞—П –і–Њ–Ј–∞ 1вАУ2 —В–∞–±–ї–µ—В–Ї–Є) [27] . –Ю–±—Й–Є–Љ –њ—А–∞–≤–Є–ї–Њ–Љ –њ—А–Є –њ—А–Є–µ–Љ–µ –≤—Б–µ—Е –Э–Я–Т–Я –Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –Ц–Ъ–Ґ —П–≤–ї—П–µ—В—Б—П –њ–∞—А–∞–ї–ї–µ–ї—М–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л [1].
–Т –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –Є–Ј-–Ј–∞ –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В—Л –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–є –Є –љ–µ–і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л –і–ї—П –Њ–њ—В–Є–Љ–Є–Ј–∞—Ж–Є–Є —В–µ—А–∞–њ–Є–Є –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Є–Љ–µ–µ—В —Б–±–Њ—А –∞–љ–∞–Љ–љ–µ–Ј–∞ –Є –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л. –Я—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤—Л–±–Њ—А–∞ –і–ї—П –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Г –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –Э–Я–Т–Я, —П–≤–ї—П—О—В—Б—П –±–ї–Њ–Ї–∞—В–Њ—А—Л –Ї–∞–ї—М—Ж–Є–µ–≤—Л—Е –Ї–∞–љ–∞–ї–Њ–≤.












