Yu.S. Astakhov, E.A. Egorov,
S.Yu. Astakhov, Yu.A.Brezel
Ophthalmology department of St.-Petersburg State Medical University named after I.P. Pavlov
Russian State Medical University, Moscow
St.-Petersburg Medical Academy
of post-diploma education
Authors give literary review of types of surgical treatment of refractory glaucoma. They describe structure of artificial drainages and principles of development of valving for implantation. Technique of implantation of valving AhmedЩ model FP7 and experience of it’s implantation in 20 patients are presented.
Несмотря на успехи медикаментозного и лазерного лечения глаукомы, достигнутые в последние годы, остается значительная группа наиболее тяжелых форм заболевания, которая объединена термином «рефрактерная глаукома» (франц. refractaire – невосприимчивый). К рефрактерной глаукоме относят врожденную, ювенильную, ранее оперированную первичную глаукому, а также большинство видов вторичной глаукомы.
В течение последних десятилетий наибольшее распространение в хирургическом лечении глаукомы, независимо от вида и стадии заболевания, получили различные модификации трабекулэктомии, предложенной в 1968 году J.E. Cairns. Известно, что непосредственный эффект этой операции высок, однако частота рецидивов гипертензии заметно повышается с увеличением периода наблюдения, что связано с рубцеванием и облитерацией сформированных в ходе вмешательства путей оттока водянистой влаги. Исходя из этого велись поиски вариантов операционной техники, предотвращающих развитие рубцового процесса.
Наиболее значимым достижением последних 20 лет явилось широкое применение так называемых антиметаболитов. Первым из них был 5-фторурацил, механизм действия которого основан на угнетении синтеза дезоксирибонуклеиновой кислоты, через подавление фермента тимидилатсинтетазы, что, в свою очередь, приводит к снижению пролиферации эписклеральных фибробластов и, возможно оказывает на них токсическое действие, уменьшая рубцевание в области фильтрационной подушки. Первые результаты применения 5-фторурацила были обнадеживающими. Вскоре, однако, появились сообщения о серьезных осложнениях, связанных с его использованием (Wolner B. c соавт., 1991; Hurvitz L.M., 1994). U. Ticho и A. Ophir (1993), изучив результаты 105 операций (у 105 больных) по поводу глаукомы с применением 5-фторурацила, обнаружили следующие поздние осложнения: эндофтальмит у 4 больных (3,8%), наружную фильтрацию водянистой влаги в области фильтрационной подушки у 2 больных (1,9%), длительную гипотонию у 3 больных (2,9%), «гигантскую» фильтрационную подушку, распространяющуюся на роговицу у 2 больных (1,9%) и иридоциклит у 9 больных (8,6%). Недостатки 5-фторурацила заставили исследователей искать новые антиметаболиты – митомицин С (Chen C.W., с соавт., 1986; 1991; Palmer S.S., 1991; Cohen J.S., 1992; Zeiter J.H. с соавт., 1992; Kitazawa Y. с соавт., 1991, 1993), Daunorubicin (Demailly P., Kretz G., 1992) и др. Однако, несмотря на хороший гипотензивный эффект, использование антиметаболитов может приводить к избыточной фильтрации водянистой влаги в послеоперационном периоде, являясь причиной снижения зрительных функций вследствие гипотонии и симптоматической макулопатии, развития и прогрессирования катаракты. А.П. Нестеров (1995) рекомендовал воздерживаться от применения антиметаболитов при выраженном истончении конъюнктивы, у больных с высокой близорукостью и на глазах больных старческого возраста.
Другим подходом, который давно привлекал офтальмологов, были попытки создания искусственных дренажей, обеспечивающих направленный отток водянистой влаги под конъюнктиву для снижения офтальмотонуса. В 1959 году Е. Epstein продемонстрировал возможность имплантации капиллярной трубочки, просвет которой оставался открытым со стороны передней камеры. Вокруг другого конца, находившегося под конъюнктивой, формировалась фильтрационная подушка, которая через несколько недель сокращалась, а наружный просвет трубочки закрывался плотной соединительной тканью.
В 1968 году А.С.В. Molteno предложил соединить дренажную трубочку с акриловой «тарелкой» диаметром 13 мм. Идея состояла в том, что водянистая влага должна не только оттекать из передней камеры, но и всасываться на довольно большой площади. Акриловая «тарелка» гарантировала, что фильтрационная подушка не будет меньше, чем ее площадь. Сначала трубочки были короткими, а эписклеральные «тарелки» подшивали в области хирургического лимба. Это приводило к формированию «гигантских» фильтрационных подушек, наползавших на роговицу. В дальнейшем были предложены импланты с длинными трубочками, а эписклеральные «тарелки» стали фиксировать выше мест прикрепления прямых мышц, добиваясь формирования фильтрационных зон в области экватора глаза.
Другой проблемой имплантов Molteno была выраженная и длительная послеоперационная гипотония вследствие слишком большого, ничем не регулируемого оттока водянистой влаги. Первым способом борьбы с этой проблемой была двухэтапная имплантация: сначала – «тарелка», через 6 недель (после ее инкапсуляции) – трубочка в переднюю камеру. В дальнейшем вернулись к одномоментной имплантации, но трубочку стали перевязывать рассасыващимся викриловым швом, который препятствовал чрезмерному оттоку водянистой влаги в раннем послеоперационном периоде.
Модифицированным вариантом шунта Molteno является имплантат G. Baerveldt, внедренный в клиническую практику в 1990 году. Эта бесклапанная конструкция состоит из силиконовой трубочки, заканчивающейся в гибком полидиметилсилоксановом резервуаре толщиной 1 мм, который имплантируется через относительно небольшой разрез конъюнктивы (Lloyd M.A. с соавт. 1994; Sidoti P.A. с соавт., 1995; Fechter H.P., Parrish R.K., 2004).
Невозможность регулировать отток водянистой влаги (особенно в раннем послеоперационном периоде) с помощью шунтов послужила поводом к созданию клапанных устройств, поддерживающих ее фильтрацию при определенных значения внутриглазного давления (ВГД).
Первым подобным устройством явился клапан Krupin-Denver (1980), состоящий из внутренней (внутрикамерной) супрамидной трубочки, соединенной с наружной (субконъюнктивальной) силиконовой трубкой. Клапанный эффект обусловлен наличием прорезей в запаянном дистальном конце силиконовой трубки. Давление открытия равно 11,0-14,0 мм рт. ст., закрытие происходит при уменьшении ВГД на 1,0-3,0 мм рт.ст. Поскольку прорези нередко зарастали фиброзной тканью, на смену стандартного клапана Krupin-Denver пришли его модификации. Последняя, предложенная T. Krupin с соавт. в 1994 году, очень напоминает имплант Molteno, снабженный силиконовой трубочкой-клапаном.
В 1993 году M. Ahmed разработал клапанное устройство, состоявшее из трубочки, соединенной с силиконовым клапаном, заключенным в полипропиленовый корпус-резервуар. Клапанный механизм состоит из двух мембран, работающих на основании эффекта Venturi. Давление открытия составляет 8,0 мм рт. ст.
Первый опыт использования клапана AhmedЄ подтвердил его способность предотвращать избыточную фильтрацию водянистой влаги в раннем послеоперационном периоде и существенно снизить частоту такого осложнения, как отсутствие передней камеры (Сoleman A.L. с соавт., 1995, 1997; Englert J.A. с соавт., 1999; Huang M.C. c соавт., 1999; Taglia D.P. c соавт., 2002). По данным J. Lowery с соавт. (2001), имплантат AhmedЄ cтал одним из наиболее популярных устройств, используемых в лечении рефрактерной глаукомы.
Первоначальная конструкция клапана AhmedЄ (модель S2) была усовершенствована, и нами была проведена клиническая апробация гибкого силиконового глаукомного клапана AhmedЄ модели FP7. Основные технические характеристики этой модели: толщина клапана – 0,9 мм; ширина – 13,0 мм; длина – 16,0 мм; площадь – 184,0 мм2; внутренний диаметр дренажной трубочки – 0,305 мм; наружный диаметр – 0,635 мм.
Техника операции:
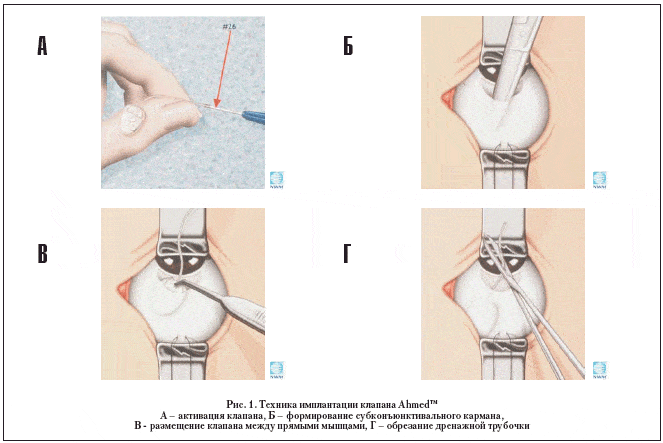
Операция проводится под местной перибульбарной анестезией. Разрез конъюнктивы в верхне-внутреннем или верхне-наружном отделе глазного яблока (в зависимости от того, на каком глазу выполняем операцию – правом или левом, и места предшествовавших оперативных вмешательств) – по лимбу, длиной 12-14 мм. Формируем лоскут конъюнктивы, основанием к своду. Выкраиваем склеральный лоскут основанием к лимбу на 2/3 толщины склеры в форме квадрата со стороной 5 мм. После парацентеза роговицы у лимба в удобном для хирурга месте заполняем переднюю камеру вискоэластиком (Healon®, Amvisc®, Provisc® и т.п.). Проверяем отсутствие видимых дефектов импланта и активируем клапан, пропуская через трубочку 1,0-1,5 мл сбалансированного солевого (BSS®) или физиологического раствора (рис. 1А). Вводим клапан в субконъюнктивальный карман в зоне между верхней и наружной (или внутренней) прямыми мышцами (рис. 1 Б,В) и фиксируем его к эписклере двумя нейлоновыми швами (10-0). При этом край клапана находится на расстоянии 8-10 мм от лимба. Обрезаем дренажную трубочку под углом примерно 30°(рис. 1Г), что облегчает ее последующее введение в переднюю камеру. Под поверхностным склеральным лоскутом, в прозрачной части лимба, вскрываем переднюю камеру с помощью обычной инъекционной иглы 23-го калибра. Иглу проводим параллельно плоскости радужки. Особое внимание этому этапу следует уделять в факичных глазах, так как неосторожность может привести к повреждению хрусталика со всеми вытекающими отсюда последствиями. Через прокол в лимбе в переднюю камеру вводим дренажную трубочку, которая должна выстоять на 2-3 мм и располагаться параллельно плоскости радужки. Поверхностный склеральный лоскут укладываем на место и фиксируем двумя швами (шелк или Vicryl® 8-0). На середине расстояния от края склерального лоскута до края клапана фиксируем дренажную трубочку дополнительным нейлоновым швом (10-0) к эписклере. Накладываем два шва на края конъюнктивального лоскута. Под конъюнктиву вводим раствор дексазона и антибиотика широкого спектра действия. Монокулярная наклейка до первой перевязки.
В течение 2005 года нами было выполнено 20 имплантаций глаукомного клапана АhmedЄ FP7 (AhmedЄ Glaucoma Valve, New World Medical, Inc.) 19 больным (20 глаз) в возрасте от 22 до 76 лет (средний возраст – 53 года), из них 10 мужчин и 9 женщин. В 10 глазах отмечена начальная катаракта, в 9 – артифакия и в 1 – афакия. У всех больных глаукома находилась в далекозашедшей стадии. У 14 больных (15 глаз) была открытоугольная форма глаукомы, у троих – закрытоугольная и у двоих – увеальная. Всем пациентам ранее были выполнены (от одного до трех) лазерные или хирургические гипотензивные вмешательства. Все пациенты находились на постоянном режиме инстилляций одного или более препаратов для снижения внутриглазного давления. При этом к моменту имплантации клапана AhmedЄ у всех больных офтальмотонус был повышен – от 22 до 43 мм рт. ст. (по Гольдману). У всех пациентов отмечена краевая субтотальная экскавация диска зрительного нерва и характерные для далекозашедшей стадии глаукомы изменения полей зрения. Острота зрения с коррекцией была до операции от 0,02 до 0,4. Среди сопутствующей глазной патологии следует отметить одну пациентку с ранее оперированной отслойкой сетчатки (с прилеганием).
Всем больным операции были выполнены по вышеописанной методике. Осложнений в ходе операций не было. В раннем послеоперационном периоде у половины больных при обследовании на В-скане отмечена цилиохориоидальная отслойка (ЦХО). Однако дополнительное хирургическое вмешательство – задняя склерэктомия потребовалось лишь в одном случае. В остальных случаях ЦХО прилегла в течение 3-4-х дней в результате консервативного лечения. Гифема не была частым спутником ЦХО, поскольку передняя камера в ходе операции заполнялась вискоэластиком, который не вымывался в конце вмешательства. Гифема отмечена у двух больных, она была малой и рассосалась самостоятельно. Срок госпитализации – от 4-х до 9 дней (в среднем – 6,2 койко-дня). Операция может быть выполнена и амбулаторно, но в период освоения нового хирургического вмешательства целесообразно наблюдение за больным в условиях стационара. В течение месяца после операции острота зрения вернулась к исходной у всех больных. Также у всех больных отмечено расширение периферических границ поля зрения на 10-15° (проекционный периметр с полусферическим экраном). Внутриглазное давление без дополнительного медикаментозного лечения в течение первого месяца было ниже 21 мм рт. ст. (по Гольдману) у всех пациентов. В дальнейшем у одного больного ВГД повысилось из-за печального стечения обстоятельств: окулист в поликлинике решил провести массаж «фильтрационной подушки» и сместил слишком коротко обрезанную в ходе операции дренажную трубочку, которая вышла из передней камеры под склеральный лоскут. Потребовалось дополнительное хирургическое вмешательство – ревизия зоны операции с подшиванием клапана на 2,0 мм ближе к лимбу и повторным введением трубочки в переднюю камеру.
Очевидно, что динамическое послеоперационное наблюдение за пациентами в срок менее 1 года недостаточно для суждения об успехе операции. Многочисленные работы, касающиеся использования шунтирующих и клапанных конструкций, трудно сопоставимы из-за разных подходов к отбору пациентов, различий хирургических методик и произвольно выбранных критериев успеха. Тем не менее первый опыт использования глаукомного клапана AhmedЄ показывает, что операция по его имплантации может быть легко освоена офтальмологами, владеющими микрохирургической техникой. В послеоперационном периоде отмечены осложнения, которые являются закономерными для больных с «рефрактерной»глаукомой, а снижение офтальмотонуса и стабилизация остаточных зрительных функций позволяет надеяться на то, что данное хирургическое вмешательство будет эффективным у больных, которые ранее были обречены на слепоту.
Литература
1. Нестеров А.П. Глаукома. – М.: Медицина, 1995. – 255 с.
2. Cairns J.E. Trabeculectomy. Preliminary report of a new method // Am. J. Ophthalmol. – 1968. – Vol. 66. – P. 673-679.
3. Chen C.W., Huang H.T., Sheu M.M. Enhancement of IOP control effect of trabeculectomy by local application of anticancer drug // Acta Ophthalmol. Scand. – 1986. – Vol. 25. – P. 1487-1491.
4. Chen C.W., Huang H.T., Bair J., Lee C. Trabeculectomy with simultaneous topical application of mitomycin C in refractory glaucoma // J. Ocul. Pharmacol. – 1990. – Vol. 6. – P. 175-182.
5. Cohen J.S. Cataract, IOL and filtering surgery with intraoperative application of mitomycin C, a preliminary study // ARVO Abstract. // Invest. Ophthalmol. Vis. Sci. – 1992. – Vol. 34, № 4, Suppl. – p. 1391.
6. Coleman A.L., Hill R., Wilson M.R. et al. Initial clinical experience with the Ahmed glaucoma valve implant // Am. J. Ophthalmol. – 1995. – Vol. 120, № 1. – P.23-31.
7. Coleman A.L., Smyth R.G., Wilson M.R., Tam M. Initial clinical experience with the Ahmed glaucoma valve implant in pediatric patients // Arch. Ophthalmol. – 1997. – Vol. 115, № 2. – P.186-191.
8. Demailly P., Kretz G. Daunorubicin versus 5-fluorouracil in surgical treatment of primary open-angle glaucoma: a prospective study // Int. Ophthalmol. – 1992. – Vol. 16, № 4/5. – P. 367-370.
9. Englert J.A., Freedman S.F., Cox T.A. The Ahmed valve in refractory pediatric glaucoma // Am. J. Ophthalmol. – 1999. – Vol. 127, № 1. – P. 34-42.
10. Epstein E. Fibrosing response to aqueous: its relation to glaucoma // Br. J. Ophthalmol. – 1959. – Vol. 43. – P.641.
11. Fechter H.P., Parrish R.K. Preventing and treating complications of Baerveldt glaucoma drainage device surgery // Int. Ophthalmol. Clin. – 2004. – Vol. 44, № 2. – P. 107-136.
12. Huang M.C., Netland P.A., Coleman A.L. et al. Intermediate-term clinical experience with the Ahmed glaucoma valve implant // Am. J. Ophthalmol. – 1999. – Vol. 127, № 1. – P.27-33.
13. Hurvitz L.M. Corneal opacification after 5-fluorouracil injections // Ophthalmic. Surg. – 1994. – Vol 25, № 2. – P.130.
14. Kitazawa Y., Kawase K., Matsushita H., Minobe M. Trabeculectomy with mitomycin: a comparative study with fluorouracil // Arch. Ophthalmol. – 1991. –Vol. 109, № 12. – P. 1693-1698.
15. Kitazawa Y., Suemori-Matsushita H., Yamamoto T., Kawase K. Low-dose and high-dose mitomycin trabeculectomy as an initial surgery in primary open-angle glaucoma // Ophthalmology. – 1993. – Vol. 100, № 11. – P 1624-1628.
16. Krupin T., Kaufman P., Mandell A. et al. Filtering valve implant surgery for eyes with neovascular glaucoma // Am. J. Ophthalmol. – 1980. – Vol. 89, № 3. – P. 338-343.
17. The Krupin eye valve filtering surgery study group. Krupin eye valve with disc for filtration surgery // Ophthalmology. – 1994. – Vol. 101, № 4. – P. 651-658.
18. Lloyd M.A., Baerveldt G., Heur D.K. et al. Initial clinical experience with Baerveldt implant in complicated glaucomas // Ophthalmology. – 1994. Vol. 101, № 4. – P. 640-650.
19. Lowery J., Carlson A.N., Abelson M.B. et al. 2001 year in review // Rev. Ophthalmol. – 2001. – Vol. 8, № 11. – P. 73-87.
20. Molteno A.C.B. New implant for drainage in glaucoma // Br. J. Ophthalmol. – 1969. – Vol. 53. – P.164.
21. Molteno A.C.B., Polkinghorne P.J., Bowbyes J.A. The vicryl tie technique for inserting a draining implant in the treatment of secondary glaucoma // Aust. NZ. J. Ophthalmol. – 1986. – Vol. 14, № 4. – P. 343.
22. Palmer S.S. Mitomycin as adjunct chemotherapy with trabeculectomy // Ophthalmology. – 1991. – Vol 98, № 3. – P. 317-321.
23. Sidoti P.A., Dunphy T.R., Baerveldt G. et al. Experience with the baerveldt glaucoma implant in treating neovascular glaucoma // Ophthalmology. – 1995. – vol. 102, № 7. – P. 1107-1118.
24. Taglia D.P., Perkins T.W., Gangnon R. et al. Comparison of the Ahmed glaucoma valve, the Krupin eye valve with disc and the double-plate Molteno implant // Glaucoma. – 2002. – Vol. 11, № 4 . – P. 347-353.
25. Ticho U., Ophir A. Late complications after glaucoma filtering surgery with adjunctive 5-fluorouracil // Am. J. Ophthalmol. – 1993. – Vol. 115, № 4. – P. 506-510.
26. Wolner B., Liebmann J.M., Sassani J.W. et al. Late bleb-related endophthalmitis after trabeculectomy with adjunctive 5-fluorouracil // Ophthalmology. – 1991. – Vol. 98, № 7. – P. 1053-1060.
27. Zeiter J.H., Juzych M.S., Shin D.H. et al. Adjunctive subscleral flap mitomycin in trabeculectomy combined with cataract surgery // Ophthalmology. – 1992. – Vol. 100, Suppl. – P.87.












