Целью данной работы стало определение производных характеристик офтальмотонуса и клинико-функциональных корреляций между показателями АД и ВГД при проведении круглосуточного мониторирования у пациентов с эссенциальной АГ и ПОУГ.
Материал и методы
Научно-клиническое комбинированное проспективное исследование проводилось на базе офтальмологического отделения ФКУ «ЦВКГ им. П.В. Мандрыка» МО РФ в период с октября 2013 по декабрь 2016 г. В итоговый протокол исследования были включены данные 80 человек (80 глаз; 20 женщин и 60 мужчин), средний возраст которых составлял 73,12±7,75 года. На основании наличия АГ в анамнезе пациенты были разделены на две группы. В 1–ю группу (основную) было включено 40 пациентов (12 женщин, 28 мужчин, средний возраст – 73,76±8,36 года), у которых ПОУГ сочеталась с эссенциальной АГ (1–2 ст.), с достигнутыми на фоне гипотензивной терапии целевыми значениями АД. Гипотензивная терапия была подобрана врачом поликлиники и продолжена в стационаре. Во 2-ю группу (контрольную) вошли 40 пациентов (8 женщин, 32 мужчины, средний возраст – 72,45±6,94 года), у которых ПОУГ протекала на фоне нормальных цифр АД, без диагностированной АГ.Помимо рутинного офтальмологического обследования, включавшего рефрактометрию, визометрию, биомикроскопию и пневмотонометрию, проводилось исследование уровней ВГД с помощью прибора ICare TA01i (Tiolat, Финляндия, рис. 1, 2) в интервале с 12:00 до 11:30 следующего дня (1 сут), каждые 30 мин силами 4 врачей.


Принцип действия прибора основан на индукционном методе оценки упругости при мгновенном ударе маленького легкого наконечника по центру роговицы. Измерение не требует использования местной анестезии, поскольку занимает 0,1 с, а корнеальный рефлекс возникает в среднем через 0,2 с. Диапазон измерений составляет от 1 до 99 мм рт. ст., предел допускаемой погрешности измерения в диапазоне от 5 до 30 мм рт. ст. – не более ±2,8 мм рт. ст., а в диапазоне от 30 до 80 мм рт. ст. – не более ±15%. Тонометр ICare позволяет измерять истинный уровень офтальмотонуса (P0).
Таким образом, из особенностей прибора можно выделить: многократное использование без применения местных анестетиков; отсутствие риска инфекционных осложнений; большой диапазон измерений уровней ВГД; автоматический вывод данных измерений на экран; автоматическое сохранение данных десяти предыдущих измерений; простота управления прибором; автономная работа от зарядных батарей с продолжительным сроком действия; компактность.
Для изучения показателей системной гемодинамики анализировали данные, полученные после проведения суточного мониторирования артериального давления (СМАД) с помощью прибора для суточного мониторирования АД (модель МнСДП-2, № К08034500, Россия). Запись проводилась в течение 24 ч, каждые 15 мин днем (от 06:00 до 23:00) и каждые 30 мин ночью (с 23:30 до 05:45 следующего дня). Постановка монитора осуществлялась в промежутке от 12:00 до 13:00. Перед постановкой монитора проводилось измерение АД по методу Н.С. Короткова на обеих руках, с последующим сравнением приборного значения АД на мониторе.
При оценке данных СМАД в первую очередь оценивались количество успешных измерений (75% измерений должны были быть успешными), а также среднее систолическое АД днем и ночью (СрСАДдн, СрСАДн), среднее диастолическое АД днем и ночью (СрДАДдн, СрДАДн), среднее пульсовое давление (СрПульс), вариабельность САД и ДАД днем и ночью (ВарСАДдн, ВарДАДдн, ВарСАДн, ВарДАДн), скорость утреннего подъема САД и ДАД. Также всем пациентам проводилось стандартное кардиологическое обследование, включавшее регистрацию ЭКГ и Эхо-КГ.
Статическая автоматическая периметрия (САП) проводилась на 2 аппаратах Humphrey 745i и 750i (HFA, Carl Zeiss Meditec Inc., США). Для определения показателей средней светочувствительности сетчатки (MD) и ее стандартного отклонения (PSD) использовалась программа пороговой периметрии SITA Threshold (30-2). Исследование внесенных в протокол данных морфофункциональных исследований (кроме показателей офтальмотонуса) проводилось в интервале от 10:00 до 12:00.
Дизайн исследования
На первом этапе проводили уточнение данных анамнеза заболевания и заполнение протоколов исследования. Проспективный этап исследования включал постановку систем для суточного мониторирования АД с одновременным мониторированием уровней ВГД с помощью прибора iCare и записью результатов. Пациенты обеих групп (основная и контрольная) были дополнительно разделены на 2 подгруппы в соответствии со стадией ПОУГ. В 1-ю подгруппу обеих групп вошли пациенты с начальной стадией глаукомы, во 2-ю (объединенную) – больные с развитой и далеко зашедшей стадиями заболевания.
Критерии исключения
Выраженные помутнения оптических сред, затрудняющие использование морфометрических или функциональных методов исследования или приводящие к неправильной трактовке их результатов; пациенты с заболеваниями сетчатки (например, возрастная макулодистрофия), состояния после окклюзий и осложнений диабетической ретинопатии; пациенты с травмами и заболеваниями органа зрения в анамнезе, затрудняющими проведение тонометрии; пациенты после проведенной интракапсулярной экстракции катаракты, «классической» экстракапсулярной экстракции катаракты или факоэмульсификации, прошедших с осложнениями (например, частичная потеря стекловидного тела, в т. ч. и в случае наличия послеоперационного астигматизма более ±3 диоптрий); пациенты с любой формой отслойки сетчатки (оперированная или неоперированная); пациенты с общими (системными) заболеваниями, требующими гормональной терапии, с сахарным диабетом, перенесенными инфарктом миокарда, ишемическим и геморрагическим инсультами.
Методы статистического анализа
Обработка полученных данных проводилась с использованием программы Statistica (версии 10.0, StatSoft Inc., США). Приводимые параметры представлены в формате: Мe (Q25%;Q75%), где Мe – медиана, Q25% и Q75% – квартили. При сравнении нескольких независимых выборок использовался анализ для попарного сравнения двух независимых выборок – Z-аппроксимация U-критерия Манна – Уитни, для повторных внутригрупповых сравнений применялась Z-аппроксимация T-критерия Вилкоксона. С целью анализа взаимосвязи между признаками использовали непараметрический ранговый r-коэффициент корреляции Спирмена, а критический уровень значимости при проверке статистических гипотез принимался равным p<0,05.
Результаты и обсуждение
Согласно утвержденному протоколу всем пациентам были выполнены дополнительные исследования, необходимые для верификации диагноза. В таблице 1 представлены суммированные результаты анализа возрастных и морфофункциональных показателей на момент включения пациентов в исследование.
В основной группе (пациенты с диагностированной АГ) 21 пациент был с диагностированной 1-й стадией ПОУГ (52,5%), 9 – со 2-й (22,5%), 10 – с 3-й (25%). С учетом малого распределения пациенты со 2-й и 3-й стадиями были объединены в одну подгруппу – с продвинутыми стадиями ПОУГ. Все пациенты получали лечение различными группами системных гипотензивных препаратов в течение 6,71±4,77 года.
В контрольной группе распределение больных по стадиям ПОУГ было следующим: 20 пациентов – с 1-й стадией (50%), 10 – со 2-й (25%), 10 – с 3-й (25%).
При межгрупповом сравнении данных, характеризующих сроки продолжительности болезни, а также средний возраст на момент включения пациентов в исследование, не было получено статистически значимых различий (p>0,05). В свою очередь внутригрупповые различия между показателями MD и PSD были достоверно значимы (p<0,05).
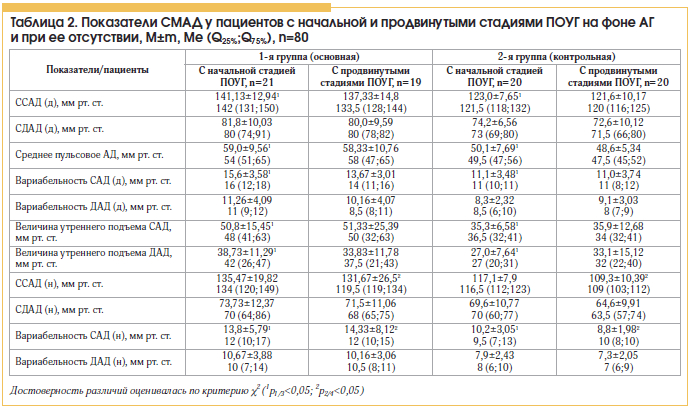
При оценке показателей системной гемодинамики (табл. 2) у пациентов с различными стадиями ПОУГ внутри группы достоверных отличий выявлено не было (р>0,05). В то же время средние показатели САД в дневное время, среднее пульсовое АД, величина утреннего подъема САД и ДАД были достоверно выше у пациентов основной группы на фоне течения АГ (р<0,05). Также у пациентов 1-й группы отмечалась статистически достоверная повышенная вариабельность САД днем и ночью (р<0,05). Повышенная вариабельность САД как в дневное, так и в ночное время у пациентов на фоне течения АГ закономерна, ведь эти пациенты имеют поражение органов-мишеней в виде гипертрофии левого желудочка, и, возможно, недостаточно эффективное системное гипотензивное лечение. Кроме этого, у пациентов основной группы с продвинутыми стадиями глаукомы отмечены более высокие показатели CСАД ночью (р<0,05).
До постановки монитора СМАД и начала мониторирования ВГД с помощью iCare всем пациентам проводилось пневмотонометрическое исследование офтальмотонуса. В таблице 3 указаны средние показатели уровня ВГД у пациентов обеих групп до начала проведения мониторинга. Установленные межгрупповые результаты были статистически недостоверны (р>0,05).

Следующим этапом исследования стало сопоставление данных офтальмотонуса и времени его изменений в течение суток с целью определения новых производных показателей, характеризующих компенсацию уровня ВГД. К числу таких показателей мы отнесли оригинальные производные: среднюю скорость изменения офтальмотонуса в течение суток, скорость подъема и спуска, а также продолжительность плато в точке минимального снижения уровня ВГД (интервал колебаний ≤1 мм рт. ст., что подразумевает исключение погрешности при контрольном измерении офтальмотонуса, выполненном методом пневмотонометрии или тонометром Маклакова), и количество абсолютных пиков колебаний между > 1 ≤ 2 мм рт. ст.
Максимальный уровень ВГД (пик) у пациентов с АГ был отмечен около 06:00 при начальной стадии ПОУГ, а у пациентов с продвинутыми стадиями пик пришелся на 07:00 (табл. 4). Минимальный уровень офтальмотонуса был зарегистрирован днем (около 17:00) у пациентов с начальной ПОУГ, а у группы больных со 2-й и 3–й стадиями пришелся на 19:00. Статистически достоверные различия выявлены для максимального и минимального уровней ВГД у пациентов на фоне течения АГ (р<0,05). Уровни же среднесуточных колебаний достоверно не отличались (р>0,05).

Среди пациентов контрольной группы максимальный уровень ВГД (пик) приходился на 06:00 у подгруппы с начальной стадией ПОУГ и на 04:00 у пациентов с продвинутыми стадиями. Минимальное значение офтальмотонуса регистрировалось вечером: в 21:00 у пациентов с 1-й стадией ПОУГ и в 20:00 у пациентов с продвинутыми стадиями. Статистически достоверных отличий между максимальным и минимальным уровнем ВГД в этой группе получено не было (р>0,05), однако уровень среднесуточных колебаний достоверно отличался в подгруппах и составил 2,42 мм рт. ст. для пациентов с начальной стадией ПОУГ и 1,96 мм рт. ст. для продвинутых стадий (р<0,05). Характеристики пиковых значений офтальмотонуса пациентов с 1–й стадией ПОУГ при межгрупповом сравнении не отличались достоверно (р>0,05). В то же время для пациентов с продвинутыми стадиями ПОУГ на фоне течения АГ были характерны меньшие среднесуточные уровни ВГД (максимальные и минимальные значения) и больший уровень среднесуточных колебаний, в отличие от группы пациентов при отсутствии системной гипертензии (р<0,05), в то время как при однократной тонометрии достоверных отличий в указанных группах получено не было. Были получены данные о том, что наши пациенты имеют нормальный (прямой, падающий) тип суточной кривой офтальмотонуса, когда максимальные значения уровней ВГД приходятся преимущественно на утренние часы [7].
Многократное измерение офтальмотонуса в течение суток позволило использовать новые производные характеристики офтальмотонуса. Зная минимальные и максимальные значения уровня офтальмотонуса и соответствующие им временные показатели, мы вычислили среднюю скорость изменения уровня ВГД для данного промежутка времени, которая была определена по формуле:
ВГД max – ВГД min
V = ---------------------------
T max – T min,
где V – скорость изменения ВГД (мм рт. ст./мин);
ВГД max – уровень максимального значения ВГД (мм рт. ст.);
ВГД min – уровень минимального значения ВГД (мм рт. ст.);
T max – время суток, когда ВГД имеет максимальное значение (часы и минуты);
T min – время суток, когда ВГД имеет минимальное значение (часы и минуты).
Ранее при использовании высокотехнологичного оборудования для круглосуточного мониторинга уровня ВГД (Sensimed TriggerFish, Швейцария) нами уже было установлено, что изменение показателя скорости уровня ВГД связано с изменением его пиковых значений и продолжительности плато в точке минимального понижения уровня ВГД [15]. В нашем исследовании показатель «средняя скорость» изменения уровня ВГД в течение суток не имел достоверного отличия при внутригрупповом сравнении – предположительно вследствие того, что и средние показатели уровней офтальмотонуса до начала исследования также достоверно не отличались (табл. 3). Однако продолжительность плато у пациентов с продвинутыми стадиями ПОУГ и АГ была меньше по времени, чем у пациентов с начальной стадией, и составила 165 мин (р<0,05). В то же время у больных этой подгруппы отмечалось большее число пиков колебаний (р<0,05).
В группе больных без АГ средние скорости изменения и средняя скорость спуска уровня ВГД в течение суток в подгруппах значимо не отличались, в то время как средняя скорость подъема уровня ВГД была выше у пациентов с продвинутыми стадиями ПОУГ (р<0,05). Также у этой подгруппы в сравнении с пациентами с начальной стадией ПОУГ были менее продолжительное по времени плато, которое составило 15 мин, и большее число пиков ВГД в интервале от 1 до 2 мм рт. ст. (р<0,05). Детальные данные, касающиеся производных характеристик офтальмотонуса, приведены в таблице 5.
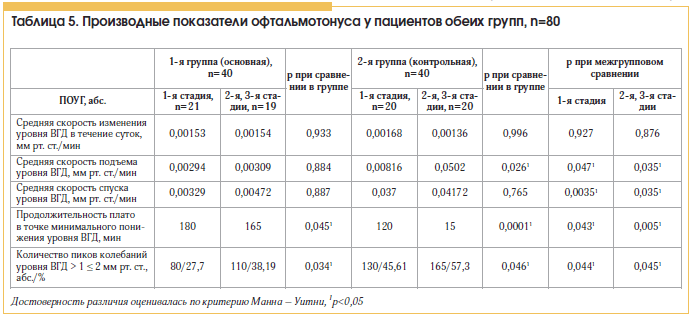
Так, у пациентов с 1-й стадией ПОУГ и АГ в анамнезе была диагностирована меньшая скорость подъема уровня ВГД, чем у пациентов без АГ (р<0,05) (табл. 5). Продолжительность плато в точке минимального понижения уровня ВГД была более длительной у пациентов на фоне течения АГ и составила 180 мин против 120 мин у пациентов без АГ (р<0,05). А большее количество пиков более 1 мм рт. ст. было диагностировано у пациентов контрольной группы.
При оценке показателей у пациентов с продвинутыми стадиями картина несколько другая. У пациентов контрольной группы выявлены более высокие скорости как подъема, так и спуска уровня ВГД, что, вероятно, сигнализирует о неустойчивости стабилизации глаукомного процесса (р<0,05), а также о возможном благоприятном влиянии более высоких показателей АД на ПОУГ в целом. Продолжительность плато у пациентов без АГ была самой незначительной, составив всего 15 мин, и коррелировала с наибольшим числом пиков (р<0,05).
У пациентов основной группы с начальной стадией ПОУГ не было обнаружено статистически достоверных корреляций между показателями CАД и ВГД, а умеренная взаимосвязь между уровнями ДАД и ВГД была выявлена в 06:00 (r=0,52). У больных с продвинутыми стадиями ПОУГ прямая сильная корреляция между САД и уровнем офтальмотонуса была установлена однократно в 22:00 (r=0,94). В то же время между ДАД и ВГД было выявлено несколько временных значений, при которых присутствовала сильная прямая взаимосвязь: ночь и утро – 00:00, 03:00, от 06:30 до 08:00, день – 12:30 и 13:00, вечер – 20:30 (r= от 0,81 до 0,94).
У пациентов контрольной группы с продвинутыми стадиями ПОУГ были определены умеренная и сильная отрицательные корреляции между САД и ВГД (в 12:00 и 03:30, r= -0,64 и r= -0,63) и ДАД и ВГД (в 23:00, r= -0,72). У пациентов с начальной глаукомой был установлен аналогичный характер связи корреляции между уровнями САД и ВГД утром и в дневные часы (05:00, 14:00, 17:30, от 17:30 до 18:30) (от r= -0,63 до r= -0,78), а единственная достоверная взаимосвязь между ДАД и ВГД была сильной прямой по состоянию на 15:30 (r= -0,68).
При межгрупповом сравнении показателей мы установили, что у пациентов с АГ и ПОУГ происходят медленный спуск офтальмотонуса до вечерних часов (временной промежуток от 20:00 до 21:30) и следующий за ним постепенный подъем до 06:00 (часы пробуждения) с некоторым постепенным понижением. В то же время у больных без эссенциальной гипертензии изменения уровня ВГД происходят с более высокой скоростью. Обнаруженные производные характеристики были свойственны пациентам контрольной группы со всеми стадиями глаукомы. При оценке внутригрупповых изменений было выявлено, что у больных контрольной группы с развитой и далеко зашедшей стадиями глаукомы подъем уровня ВГД происходит достоверно более быстро, чем у пациентов с начальной стадией глаукомы.
На рисунке 3 приведены схемы суммированных графиков суточных показателей офтальмотонуса у пациентов всех подгрупп.

Из рисунка 3 видно, что наибольшая по времени продолжительность плато отмечается у пациентов 1-й группы (голубой и салатовый цвет), в то время как у пациентов 2–й группы с продвинутыми стадиями ПОУГ (фиолетовый цвет) плато как таковое отсутствует и в точке минимального снижения уровня ВГД сохраняется всего в течение 15 мин, со значительным числом пиковых колебаний в абсолютных значениях в интервале от 1 до 2 мм рт. ст.
Заключение
Оценка показателей офтальмотонуса позволяет обеспечивать объективную картину прогрессирования заболевания. Вместе с тем нельзя недооценивать и вклад системных гемодинамических реакций при определении развития глаукоматозного процесса. Так, повышенная вариабельность уровней АД, эпизоды гипо- или гипертонии в течение суток являются прогностически отрицательными маркерами, которые могут оказывать негативное влияние на глазную перфузию.При оценке клинико-функциональных корреляций между показателями ДАД и ВГД у пациентов основной группы с продвинутыми стадиями глаукомы была установлена прямая сильная взаимосвязь, свидетельствующая о недостаточной коррекции уровней системного и внутриглазного давления, взаимно влияющих на показатели перфузиии.
До начала нашего исследования все пациенты имели сопоставимые значения уровня ВГД и нормальный тип суточной кривой с максимальными значениями офтальмотонуса в утренние часы, подчеркивающие стабилизацию глаукомного процесса. При использовании новых расчетных показателей, таких как средняя скорость изменения офтальмотонуса в течение суток, скорость его подъема и спуска, а также продолжительность плато в точке минимального снижения офтальмотонуса и количество патологических пиков колебаний, были выявлены статистически достоверные различия в суточных флюктуациях офтальмотонуса, характеризующих прогрессирование заболевания.
Комплексная оценка суточных флюктуаций офтальмотонуса и системного АД в перспективе позволит персонализировать выбор и назначение местных и системных гипотензивных препаратов.












