T.G. Kamenskikh, A.N. Bashkatov, V.V. Tuchin, E.A. Genina
Saratov State Medical University
Saratov State University
Purpose: to study the sclera permeability as the most significant tissue barrier in the local application of medicines in ophthalmology for Cortexin in vitro and to detect the effectiveness of «Cortexin» treatment of the patients with partial optic atrophy development as the result of the disease of the central nervous system and craniocerebral trauma.
Materials and methods: 23 sclera samples of 7 patients were taken for the research in vitro .
The water solution of Cortexin has been tested too. The radiation reflected from sclera has been controlled by the system of receiving fibers of fiber optics probe and has been registered by optical multichannel analyzer (LESA- 5).
Clinical part: 79 patients with descending optic atrophy developed as a result of the disease of the central nervous system have been examined.
The visual acuity of the patients of the I group (61 eyes) was 0,4±0,02; in the II group (35 eyes) it was 0,04±0.02. The treatment course of 45 eyes included transcutaneous electrostimulation (apparatus ESO-2M) and transcranial magnetic therapy in the visual pathways area in non-stop regime (apparatus «ATOS») with the attachment «Ogoloviye». In 51 cases besides physiotherapy parabulbar «Cortexin» injections were applied..
Results: The experimental research makes it possible to assume that the full penetration of «Cortexin» through sclera after the parabulbar injection lasts 3 hours. The analysis of everyday dynamics of visual acuity and visual evoked potentials has elicited the advantages of medicamental and physiotherapeutic treatment with the usage of «Cortexin» .
Conclusion: The experimental part of the research reveals that «Cortexin» penetrates rapidly through sclera and other tissue barriers. Our experience in the usage of drug gives evidence concerning the possibility to achieve stable positive results in the treatment of the patients with partial optic atrophy.
Проблема коррекции метаболических нарушений в зрительном нерве при его частичной атрофии, развивающейся в результате воспаления, интоксикации, нарушения кровообращения, глаукомной оптической нейропатии, остается актуальной.
Е.А. Егоров, Ю.С. Астахов, Т.В. Ставицкая (2004) отмечают, что ткани глаза, особенно те, которые отвечают за зрительные функции, хорошо изолированы от системного кровообращения множеством барьеров, обеспечивающих высокую степень отбора растворимых веществ. При системном применении в среднем около 0,01 – 0,07% введенной дозы лекарства достигает тканей глаза.
Ряд авторов проводили сравнительные исследования эффективности воздействия на глаз лекарств при введении их разными способами. Так, при анализе концентрации препаратов в тканях глаза после перорального, внутримышечного и внутривенного введения более эффективным оказалось внутривенное введение [B.J. Curtin, 1987]. Сравнение концентрации препаратов в тканях глаза при внутривенном и субконъюнктивальном способе введения выявило, что концентрация выше при субконъюнктивальном введении [V.D. Shiose, 1989]. В 1989 году А.П. Нестеровым, С.Н. Басинским был предложен новый метод введения лекарственных препаратов в теноново пространство глаза – субтеноновая имплантация коллагеновой инфузионной системы.
В настоящее время в клинической практике используются различные способы местного введения лекарств. При лечении частичной атрофии зрительного нерва (ЧАЗН) мы вводим препараты нейротрофического действия парабульбарно или субтеноново.
Многолетний опыт использования цитомединов (Ретиналамин, Кортексин) в клинической практике показал высокую эффективность данного класса веществ в различных областях медицины, в том числе в офтальмологии. Кортексин обладает тропным действием в отношении нервной ткани, регулирует процессы метаболизма нейромедиаторов и перекисное окисление в коре головного мозга, зрительном нерве и нейронах сетчатки [Хавинсон В.Х., Трофимова С.В., 1999].
Целью нашей работы явилось исследование проницаемости склеры, как наиболее значимого тканевого барьера при местном использовании лекарств в офтальмологии, для препарата кортексин in vitro, а также определение эффективности данного препарата в лечении больных частичной атрофией зрительного нерва, развившейся вследствие заболеваний центральной нервной системы или черепно–мозговых травм.
Экспериментальное исследование
Материалом для in vitro исследования послужили 23 образца склеры глаза человека, полученные от 7 пациентов. Образцы были получены из энуклеированного глаза человека во время проведения плановой операции – энуклеации слепого глаза с формированием опорной культи для протеза. Возраст 7 пациентов – 38–45 лет, все мужчины. Причины энуклеации слепых глаз (острота зрения 0 в течение 3–11 лет): абсолютная глаукома врожденного генеза, субатрофия вследствие проникающего ранения. Необходимость энуклеации возникала в связи с неудовлетворительным внешним видом слепого глаза по желанию больных. Непосредственно после забора образцов склеры они помещались в 0,9%–й раствор NaCl и хранились в нем до проведения спектральных измерений в течение 3–24 часов при температуре порядка 4–5°С. Перед проведением измерений у образцов склеры удалялся слой пигмента (lamina fuska). Толщина образцов биоткани измерялась микрометром, для чего образцы помещались между двумя предметными стеклами и измерения выполнялись в нескольких точках образца. Точность каждого измерения ±50 мкм. Полученные значения усреднялись.
В качестве исследуемого препарата использовался водный раствор кортексина (концентрация 20 мг/мл). Показатель преломления раствора кортексина – 1,342, он измерялся с помощью рефрактометра Аббе (l = 589 нм) непосредственно перед проведением измерений.
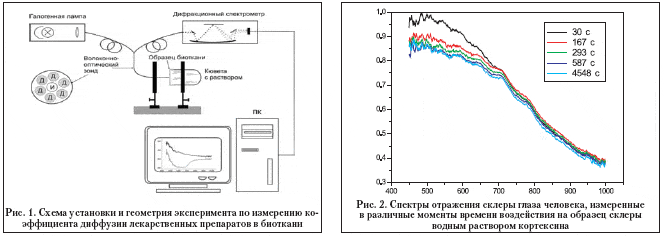
Оценка коэффициента диффузии кортексина в склере глаза выполнялась на основе анализа динамики изменения коэффициента отражения исследуемых образцов биоткани. Схема экспериментальной установки представлена на рис. 1.
Из рисунка видно, что свет от галогенной лампы, используемой в качестве источника излучения в спектральной области от 450 до 1000 нм, через волоконно–оптический зонд падает на образец биоткани, закрепленный на пробирке с лекарственным препаратом. Излучение, отраженное от образца склеры, собирается системой приемных волокон волоконно–оптического зонда и регистрируется оптическим многоканальным анализатором ЛЕСА–5 (БиоСпек, Москва). Время накопления сигнала – 100 мс. Конструкционно волоконно–оптический зонд состоит из 7 волокон, центральное из которых служит для транспорта излучения в биоткань, а шесть других, симметрично расположенных по окружности вокруг центрального волокна, служат для сбора излучения, обратно рассеянного образцом биоткани. Диаметр каждого волокна 200 мкм, расстояние между центрами излучающего и приемных волокон 280 мкм. Все измерения были выполнены при комнатной температуре около 20°С.
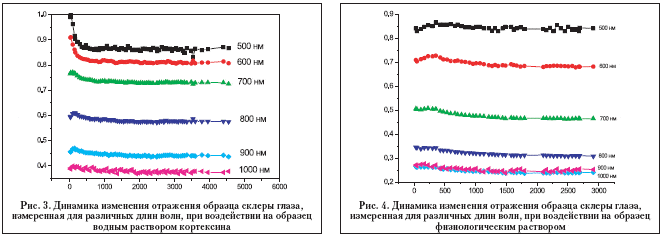
В начальный момент времени форма спектра отражения (рис. 2) определяется спектральной зависимостью коэффициента рассеяния склеры глаза. Поскольку в исследуемом спектральном интервале коэффициент поглощения коллагена склеры, а также воды и протеинов внутритканевого матрикса незначителен, то поглощением света в склере глаза можно пренебречь [Тучин, 1997].
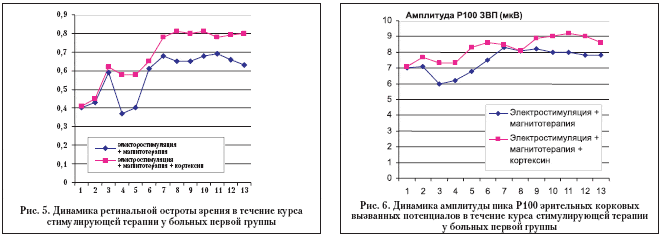
Спектральная зависимость коэффициента рассеяния определяется как длиной волны падающего излучения, так и отношением показателей преломления рассеивателей склеры глаза и окружающей их внутритканевой жидкости [Борен и Хафмен, 1986]. Показатель преломления внутритканевой жидкости склеры глаза (после 24–часового хранения ее в физиологическом растворе) можно считать равным показателю преломления воды, т.е. 1,332. Показатель преломления коллагеновых волокон – 1,411 [Leonard and Meek, 1997]. Проникая в склеру, лекарственные препараты с показателем преломления большим чем у внутритканевой жидкости склеры, вызывают согласование показателей преломления коллагеновых волокон и окружающей их среды, снижение светорассеяния (оптическая иммерсия) и как следствие – уменьшение коэффициента отражения склеры [Tuchin et al 1997; Башкатов и др., 2003]. Анализ динамики изменения коэффициента отражения биоткани позволяет оценить скорость проникновения лекарственного препарата в склеру и вычислить его коэффициент диффузии. Из представленного рисунка хорошо видно, что все изменения в спектрах отражения локализованы в спектральной области 450–700 нм. О том же свидетельствует и динамика изменения обратно рассеянного излучения, измеренная для разных длин волн (рис. 3).
Отсутствие изменения коэффициента отражения в спектральной области 700–1000 нм объясняется тем, что в данной области снижение светорассеяния, вызванное согласованием показателей преломления, компенсируется ростом светорассеяния вследствие увеличения фактора упаковки рассеивателей, вызванного осмотической дегидратацией образца.
Влияние проникновения воды на изменение коэффициента отражения склеры исследовалось аналогичным образом. На рис. 4 представлена динамика изменения коэффициента отражения склеры глаза, измеренная для различных длин волн при воздействии на склеру физиологическим раствором. Из приведенного рисунка хорошо видно, что проникновение воды в склеру глаза практически не изменяет отражения склеры во всем исследуемом диапазоне длин волн, и таким образом можно заключить, что изменения в спектрах отражения, наблюдаемые на рис. 2 и 3, связаны с диффузией кортексина во внутритканевой жидкости склеры глаза.
Процесс транспорта лекарственных препаратов в биотканях может быть описан в рамках модели свободной диффузии [Котык и Яначек, 1980; Ambati et al., 2003; Boubriak et al., 2003; Bashkatov et al., 2003]. При этом обычно используются следующие допущения относительно процесса переноса: 1) имеет место только концентрационная диффузия, т.е. поток вещества в биоткань в данной точке пропорционален градиенту концентрации вещества в этой точке; 2) коэффициент диффузии постоянен во всех точках внутри исследуемого образца биоткани.
Геометрически образец биоткани представляется в виде плоско–параллельной пластины конечной толщины. Поскольку при проведении экспериментов проникновение лекарственного препарата осуществляется только с одной стороны образца, то можно решать одномерную задачу диффузии, т.е. уравнение:
(1)
представляющее собой второй закон Фика, где С(x,t) – концентрация препарата (кортексин) в склере глаза, г/мл; D – коэффициент диффузии, см2/с; t – время, в течении которого происходит процесс диффузии, с; и x – пространственная координата по толщине образца биоткани, см. Соответствующие граничные условия имеют вид:
(2)
где С0 – концентрация лекарственного препарата в растворе, г/мл; l – толщина образца биоткани, см. Второе граничное условие отражает тот факт, что диффузия препарата внутрь образца склеры происходит только с одной стороны образца. Начальные условия отражают отсутствие препарата во всех внутренних точках образца склеры до ее взаимодействия с препаратом, т.е.
(3)
Решение уравнения диффузии (1) с учетом начальных (3) и граничных (2) условий позволяет оценить среднюю концентрацию препарата внутри образца в каждый момент времени.
(4)
Здесь – усредненная по объему концентрация препарата. В первом приближении уравнение (4) может быть переписано в виде:
(5)
Анализ динамики изменения коэффициента отражения позволяет оценить величину постоянной времени диффузии как 484,1±314,1 с. Среднее значение коэффициента диффузии равно см2/с, что достаточно хорошо согласуется с известными значениями коэффициентов диффузии различных веществ в биотканях и внутритканевой жидкости. Полученное значение позволяет оценить время, необходимое для полного проникновения лекарственного препарата через склеральную мембрану глаза при субтеноновой инъекции препарата. Хорошо известно, что при трансмембранной диффузии вещества из малого объема с ненулевой концентрацией препарата (в нашем случае область инъекции) в больший объем с нулевой концентрацией препарата концентрация препарата в малом объеме описывается уравнением [Котык и Яначек, 1980)
(6)
Подставляя в уравнение (6) полученные нами значения, мы можем заключить, что полное проникновение кортексина через склеру глаза происходит в течение примерно 3 часов после инъекции препарата.
Клиническое исследование
В исследование было включено 79 больных (96 глаз) нисходящей частичной атрофией зрительного нерва, развившейся вследствие заболеваний центральной нервной системы (церебральный поствоспалительный и посттравматический арахноидит, лейкоэнцефалит, рассеянный склероз, последствия черепно – мозговой травмы) из них 48 мужчин, 39 женщин. Больные были рандомизированы по возрасту (45±8 лет) и исходной остроте зрения. В первой группе (61 глаз) средняя острота зрения составила 0,4±0,2, во второй (35 глаз) – 0,04±0,02. Всем пациентам проводилось определение остроты зрения с коррекцией, лазерная ретинометрия для определения ретинальной остроты зрения (аппарат «АРОЛ–1»), компьютерная периметрия («Периком»), офтальмобиомикроскопия, регистрировались зрительные вызванные потенциалы на паттерн («МБН–электроретинограф»), HRT – лазерная томография диска зрительного нерва. На основании этих данных была диагностирована частичная атрофия зрительного нерва.
Курс лечения 45 глаз включал чрескожную электростимуляцию на аппарате «ЭСО–2М» и транскраниальную магнитотерапию на область зрительных путей в бегущем режиме на аппарате «АТОС» с приставкой «Оголовье», в 51 случае, помимо указанных физиовоздействий, производили также парабульбарные инъекции препарата «Кортексин» ежедневно в дозировке, составляющей 5 мг активного вещества на одну парабульбарную инъекцию. Лечение проводили в течение 10 дней. Для исследования динамики зрительных функций в течение курса лечения и в отдаленном периоде в качестве скрининговых использовали исследование ретинальной остроты зрения и зрительных вызванных потенциалов на паттерн. Показатели определяли ежедневно до проведения лечебных воздействий в течение всего курса, а затем через 3, 10 и 30 дней по завершении лечения.
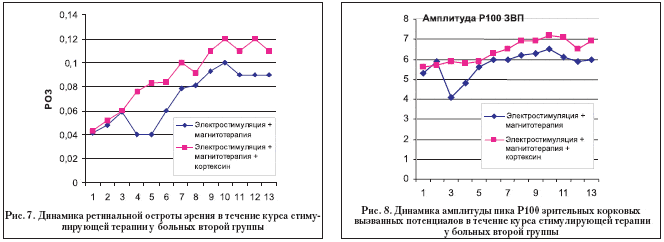
Результаты. Анализ средней динамики ретинальной остроты зрения и значений амплитуды пика Р100 зрительных корковых вызванных потенциалов у больных частичной атрофией зрительного нерва со значениями исходной остроты зрения 0,4±0,1 показал, что значения исследованных показателей в ходе лечения претерпевали ряд изменений. В подгруппе больных, получавших только физиовоздействия (29 глаз), на третий день лечения острота зрения повышалась в среднем на 0,2, а затем на 4 и 5–й день лечения вновь снижалась до исходного уровня. На 6–й день острота зрения вновь повышалась на 0,2 – 0,3, после чего мы наблюдали стабилизацию показателя. В подгруппе больных с исходной остротой зрения 0,4±0,1, получавших, помимо физиотерапии, парабульбарные инъекции препарата «Кортексин», динамика достоверно отличалась – снижение остроты зрения на 4 и 5–й день лечения было незначительным, острота зрения повысилась в большей степени и с лучшим отдаленным результатом. Данные представлены на рисунке 5.
Амплитуда зрительных вызванных потенциалов у больных первой группы, получавших только физиотерапевтическое лечение имеет тенденцию к снижению на третий день лечения, т.е. снижение активности зрительной коры на фоне лечения предшествует транзиторному спаду ретинальной остроты зрения. У больных, получавших, помимо физиолечения, препарат «Кортексин», колебания значений амплитуды пика Р100 менее выражены. В результате фармакофизиотерапевтического лечения амплитуда пика Р100 зрительных вызванных потенциалов повышается при неизменной длительности латентного периода в несколько большей степени, чем при проведении только физиотерапии (рис. 6).
Во второй группе у больных, получавших электростимуляцию и транскраниальную магнитотерапию (16 глаз), и у больных, получавших электростимуляцию, магнитотерапию и кортексин (19 глаз), динамика исследованных показателей была аналогичной соответствующим подгруппам первой группы (рис. 7, 8).
Таким образом, лечение больных нисходящей частичной атрофией зрительного нерва с применением электростимуляции и транскраниальной магнитотерапии эффективно, но исследование ежедневной динамики остроты зрения и зрительных вызванных потенциалов выявили преимущество фармакофизиотерапевтического лечения данной патологии с использованием препарата из группы цитомединов «Кортексина». Препарат быстро диффундирует через склеру и другие тканевые барьеры, что рассмотрено в экспериментальной части работы. Наш опыт использования данного препарата свидетельствует о возможности достижения стабильных положительных результатов у больных частичной атрофией зрительного нерва.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 06–02–16740) и Федеральной целевой программы «Предупреждение и борьба с заболеваниями социального характера 2002–2006 годы» (Государственный контракт № 06/888 от 24.05.06).
Литература
1. Егоров Е.А., Астахов Ю.С., Ставицкая Т.В. Общие принципы медикаментозного лечения заболеваний глаз // Клиническая офтальмология. – 2004. – Т. 5 – № 1.
2. Басинский С.Н. Способ адресной доставки лекарственных препаратов в лечении дистрофических состояний глаз // Клиническая офтальмология. – 2004. – Т.5. – № 1.
3. Хавинсон В.Х, Трофимова С.В. Пептидные биорегуляторы в офтальмологии. – СПб.: ИКФ «Фолиант», 2000. – 48 с.
4. Тучин В.В. Исследование биотканей методами светорассеяния // Успехи Физических Наук, Т. 167, С. 517–539, 1997
5. Борен К., Хафмен Д. Поглощение и рассеяние света малыми частицами / М.: Мир, 1986, 656 c.
6. Leonard D.W., Meek K.M. Refractive indices of the collagen fibrils and extrafibrillar material of the corneal stroma // Biophysical J., Vol. 72, P. 1382–1387, 1997
7. Башкатов А.Н., Генина Э.А., Синичкин Ю.П., Кочубей В.И., Лакодина Н.А., Тучин В.В. Определение коэффициента диффузии глюкозы в склере глаза человека // Биофизика, Т. 48, № 2, С. 309–313, 2003
8. Tuchin V.V., Maksimova I.L., Zimnyakov D.A., Kon I.L., Mavlutov A.H., Mishin A.A. Light propagation in tissues with controlled optical properties // J. Biomed. Opt., Vol. 2, N. 4, P. 401–417, 1997
9. Котык А., Яначек К. Мембранный транспорт / М.: Мир, 1980, 341 с.
10. Bashkatov A.N., Genina E.A., Sinichkin Yu.P., Kochubey V.I., Lakodina N.A., Tuchin V.V. Glucose and mannitol diffusion in human dura mater // Biophys. J., Vol. 85, N. 5, P. 3310–3318, 2003
11. Ambati J., Canakis C.S., Miller J.W., Gragoudas E.S., Edwards A., Weissgold D.J., Kim I., Delori F.C., Adamis A.P. Diffusion of high molecular weight compounds through sclera // Invest. Ophthalmol. & Vis. Sci., Vol. 41, N. 5, P. 1181–1185, 2000
12. Boubriak O.A., Urban J.P.G., Akhtar S., Meek K.M., Bron A.J. The effect of hydration and matrix composition on solute diffusion in rabbit sclera // Exp. Eye Res., Vol. 71, P. 503–514, 2000












