–Т –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–є —А–Њ–≥–Њ–≤–Є—Ж—Л –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Є–Љ–µ—О—В –Ј–љ–∞—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Д–∞–Ї—В–Њ—А–Њ–≤ (—А–Є—Б. 1). –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Є–Ј –љ–Є—Е —П–≤–ї—П—О—В—Б—П –і–µ–≥–Є–і—А–∞—В–∞—Ж–Є—П –Ї–ї–µ—В–Њ–Ї —Н–њ–Є—В–µ–ї–Є—П —А–Њ–≥–Њ–≤–Є—Ж—Л –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ–Њ—В–µ—А–Є –Є–Љ–Є –≤–ї–∞–≥–Є –≤ –≥–Є–њ–µ—А–Њ—Б–Љ–Њ–ї—П—А–љ—Г—О —Б–ї–µ–Ј–љ—Г—О –њ–ї–µ–љ–Ї—Г –њ–Њ –≥—А–∞–і–Є–µ–љ—В—Г –Њ—Б–Љ–Њ–ї—П—А–љ–Њ—Б—В–Є, –∞ —В–∞–Ї–ґ–µ —Б–≤—П–Ј–∞–љ–љ–∞—П —Б –љ–µ–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П —А–µ–∞–Ї—Ж–Є—П –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л—Е —В–Ї–∞–љ–µ–є —А–Њ–≥–Њ–≤–Є—Ж—Л –Є –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л. –Т —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–Є –Њ–љ–Є —Г—В—П–ґ–µ–ї—П—О—В –і—А—Г–≥ –і—А—Г–≥–∞, –њ—А–Є–≤–Њ–і—П –Ї –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ –љ–∞—А—Г—И–µ–љ–Є—П–Љ –≤ —Н–њ–Є—В–µ–ї–Є–Є, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –њ—А–Њ—П–≤–ї—П—О—Й–Є–Љ—Б—П –і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є —А–Њ–≥–Њ–≤–Є—Ж—Л, –µ–µ —Н—А–Њ–Ј–Є—А–Њ–≤–∞–љ–Є–µ–Љ, –Є–Ј—К—П–Ј–≤–ї–µ–љ–Є–µ–Љ, –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–µ–є –Є —В. –њ. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Н—В–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В—М —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є –љ–∞—А—Г—И–∞–µ—В—Б—П, —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В—Б—П –µ–µ –Є—Б–њ–∞—А—П–µ–Љ–Њ—Б—В—М –Є –Њ—Б–Љ–Њ–ї—П—А–љ–Њ—Б—В—М, –Ј–∞–Љ—Л–Ї–∞–µ—В—Б—П –њ–Њ—А–Њ—З–љ—Л–є –Ї—А—Г–≥.
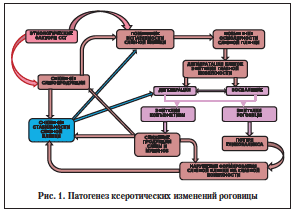
–Ъ–∞–Ї –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ—А–∞–Ї—В–Є–Ї–∞, –≤–Њ–Ј–љ–Є–Ї—И–Є–µ –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —А–Њ–≥–Њ–≤–Є—Ж—Л –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –≤ 3 –Њ—Б–љ–Њ–≤–љ—Л—Е –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П—Е, —В–∞–Ї–Є—Е –Ї–∞–Ї –µ–µ –ї–Њ–Ї–∞–ї—М–љ–∞—П –і–µ—Б—В—А—Г–Ї—Ж–Є—П (—Н—А–Њ–Ј–Є—А–Њ–≤–∞–љ–Є–µ –Є –Є–Ј—К—П–Ј–≤–ї–µ–љ–Є–µ), —А—Г–±—Ж–µ–≤–∞–љ–Є–µ (—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –≥—А—Г–±–Њ–≥–Њ –≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –±–µ–ї—М–Љ–∞ –Є/–Є–ї–Є –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–Є–Ј–∞—Ж–Є—П) –Є–ї–Є —В–Њ—В–∞–ї—М–љ–Њ–µ —А–∞—Б–њ–ї–∞–≤–ї–µ–љ–Є–µ (–њ–∞—А–µ–љ—Е–Є–Љ–∞—В–Њ–Ј–љ—Л–є –Ї—Б–µ—А–Њ–Ј —Б –Є—Б—Е–Њ–і–Њ–Љ –≤ –Ї–µ—А–∞—В–Њ–Љ–∞–ї—П—Ж–Є—О).
–Ы–Њ–Ї–∞–ї—М–љ–∞—П –і–µ—Б—В—А—Г–Ї—Ж–Є—П —А–Њ–≥–Њ–≤–Є—Ж—Л —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ–є –µ–µ –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є —Г –±–Њ–ї—М–љ—Л—Е —Б —В—П–ґ–µ–ї–Њ–є —Д–Њ—А–Љ–Њ–є –°–°–У, –њ—А–Њ—П–≤–ї—П—П—Б—М –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–є —Н—А–Њ–Ј–Є–µ–є —А–Њ–≥–Њ–≤–Є—Ж—Л.
–†–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–∞—П —Н—А–Њ–Ј–Є—П —А–Њ–≥–Њ–≤–Є—Ж—Л —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Є–Љ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ–Љ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л—Е –Љ–Є–Ї—А–Њ–і–µ—Д–µ–Ї—В–Њ–≤ —Н–њ–Є—В–µ–ї–Є—П —А–Њ–≥–Њ–≤–Є—Ж—Л, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –≤ –Ј–Њ–љ–µ –Ї–Њ–љ—В–∞–Ї—В–∞ —Б –Ј–∞–і–љ–Є–Љ —А–µ–±—А–Њ–Љ —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –Ї—А–∞—П –≤–µ—А—Е–љ–µ–≥–Њ –≤–µ–Ї–∞. –Ю–і–љ–∞–Ї–Њ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –љ–µ–±–Њ–ї—М—И—Г—О –њ–ї–Њ—Й–∞–і—М, —В–∞–Ї–Є–µ —Н—А–Њ–Ј–Є–Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –і–Њ–ї–≥–Њ (–і–Њ 3вАУ5 —Б—Г—В –Є –±–Њ–ї–µ–µ) —Б–Њ—Е—А–∞–љ—П—О—В—Б—П, –Љ–µ–і–ї–µ–љ–љ–Њ —Н–њ–Є—В–µ–ї–Є–Ј–Є—А—Г—П—Б—М. –•–∞—А–∞–Ї—В–µ—А–µ–љ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —А–Њ–≥–Њ–≤–Є—З–љ—Л–є —Б–Є–љ–і—А–Њ–Љ, —Б–Љ–µ–љ—П—О—Й–Є–є—Б—П –і–ї–Є—В–µ–ї—М–љ—Л–Љ –Љ–µ–і–ї–µ–љ–љ–Њ –Ј–∞—В—Г—Е–∞—О—Й–Є–Љ –і–Є—Б–Ї–Њ–Љ—Д–Њ—А—В–Њ–Љ –њ–Њ—Б–ї–µ –Ј–∞–≤–µ—А—И–µ–љ–Є—П —Н–њ–Є—В–µ–ї–Є–Ј–∞—Ж–Є–Є —Н—А–Њ–Ј–Є–Є. –Ю–і–љ–∞–Ї–Њ —Г–ґ–µ —З–µ—А–µ–Ј 2вАУ3 –Љ–µ—Б., –∞ –Є–љ–Њ–≥–і–∞ –Є —А–∞–љ—М—И–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –Њ–±—Л—З–љ–Њ –≤–љ–Њ–≤—М —А–µ—Ж–Є–і–Є–≤–Є—А—Г–µ—В [2].
–Т –Њ—Б–љ–Њ–≤–µ —А–∞–Ј–≤–Є—В–Є—П —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ–±—Л—З–љ–Њ –ї–µ–ґ–Є—В —Б–Ї–ї–µ–Є–≤–∞–љ–Є–µ –≤–Њ –≤—А–µ–Љ—П —Б–љ–∞ —Н–њ–Є—В–µ–ї–Є—П —А–Њ–≥–Њ–≤–Є—Ж—Л —Б –Ј–∞–і–љ–Є–Љ —А–µ–±—А–Њ–Љ —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –Ї—А–∞—П –≤–µ–Ї–∞ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –Њ—В—Б–ї–Њ–є–Ї–Њ–є –Є –Њ—В—А—Л–≤–Њ–Љ —Г—З–∞—Б—В–Ї–∞ —В–∞–Ї–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –Њ—В –њ–µ—А–µ–і–љ–µ–є –њ–Њ–≥—А–∞–љ–Є—З–љ–Њ–є –њ–ї–∞—Б—В–Є–љ–Ї–Є —А–Њ–≥–Њ–≤–Є—Ж—Л. –§–∞–Ї—В–Њ—А–∞–Љ–Є, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є–Љ–Є —Н—В–Њ–Љ—Г –њ—А–Њ—Ж–µ—Б—Б—Г, —Б–ї—Г–ґ–∞—В –њ–∞—В–Њ–ї–Њ–≥–Є—П –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Є (–≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є) –Љ—Г—Ж–Є–љ–Њ–≤–Њ–≥–Њ —Б–ї–Њ—П –њ—А–µ—А–Њ–≥–Њ–≤–Є—З–љ–Њ–є —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є, –∞ —В–∞–Ї–ґ–µ —Б–ї–∞–±–∞—П –∞–і–≥–µ–Ј–Є—П —Н–њ–Є—В–µ–ї–Є—П —А–Њ–≥–Њ–≤–Є—Ж—Л –љ–∞ –њ–Њ—З–≤–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–є —А–∞–љ–µ–µ –µ–≥–Њ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–є —В—А–∞–≤–Љ—Л. –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ—А–∞–Ї—В–Є–Ї–∞, –љ–∞–Є–±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л–Љ–Є —В—А–∞–≤–Љ–Є—А—Г—О—Й–Є–Љ–Є –∞–≥–µ–љ—В–∞–Љ–Є –њ—А–Є —Н—В–Њ–Љ —П–≤–ї—П—О—В—Б—П –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Њ–±—К–µ–Ї—В—Л: –≤–µ—В–Њ—З–Ї–∞ –і–µ—А–µ–≤–∞, –Є–≥–Њ–ї–Ї–∞ —Е–≤–Њ–є–љ–Њ–≥–Њ —А–∞—Б—В–µ–љ–Є—П, —Б—В–µ–±–µ–ї—М —В—А–∞–≤—Л –Є (—З–∞—Б—В–Њ —Г –Љ–Њ–ї–Њ–і—Л—Е —А–Њ–і–Є—В–µ–ї–µ–є) –љ–Њ–≥–Њ—В—М —А–µ–±–µ–љ–Ї–∞.
–Ъ—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–∞—П —П–Ј–≤–∞ —А–Њ–≥–Њ–≤–Є—Ж—Л —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ –Њ–њ–∞—Б–љ—Л–Љ —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Ї–∞–Ї —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤, —В–∞–Ї –Є —Б–Њ—Е—А–∞–љ–µ–љ–Є—П –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞ –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Ї—А–∞–є–љ–µ —В—П–ґ–µ–ї–Њ–≥–Њ —А–Њ–≥–Њ–≤–Є—З–љ–Њ-–Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–≥–Њ –Ї—Б–µ—А–Њ–Ј–∞. –•–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –і–µ—Д–µ–Ї—В–∞ —А–Њ–≥–Њ–≤–Є—Ж—Л —Б –Ј–∞—Е–≤–∞—В–Њ–Љ –µ–µ —Б—В—А–Њ–Љ—Л –Є —В–µ–љ–і–µ–љ—Ж–Є–µ–є –Ї –і–∞–ї—М–љ–µ–є—И–µ–Љ—Г –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–Љ—Г —Г–≥–ї—Г–±–ї–µ–љ–Є—О (—З–∞—Й–µ вАУ –±–µ–Ј —А–∞—Б—И–Є—А–µ–љ–Є—П –њ–Њ –њ–ї–Њ—Й–∞–і–Є), –≤–њ–ї–Њ—В—М –і–Њ —А–∞–Ј–≤–Є—В–Є—П –і–µ—Б—Ж–µ–Љ–µ—В–Њ—Ж–µ–ї–µ –Є –њ–µ—А—Д–Њ—А–∞—Ж–Є–Є —А–Њ–≥–Њ–≤–Є—Ж—Л –≤ –≥–ї—Г–±–Є–љ–µ —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞. –Ґ–∞–Ї–∞—П —П–Ј–≤–∞ –њ–Њ—З—В–Є –≤—Б–µ–≥–і–∞ –ї–Њ–Ї–∞–ї–Є–Ј—Г–µ—В—Б—П –≤ –њ—А–µ–і–µ–ї–∞—Е –Њ—В–Ї—А—Л—В–Њ–є –≥–ї–∞–Ј–љ–Њ–є —Й–µ–ї–Є. –Я—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ–Њ, —З—В–Њ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–∞—П —П–Ј–≤–∞ —А–Њ–≥–Њ–≤–Є—Ж—Л —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –љ–∞ —Д–Њ–љ–µ –Њ—В—Б—Г—В—Б—В–≤–Є—П –Њ—В–і–µ–ї—П–µ–Љ–Њ–≥–Њ –Є–Ј –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Є –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞ [4, 6].
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Ј–∞—В—П–ґ–љ–Њ–µ, —Б –Љ–µ–і–ї–µ–љ–љ—Л–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –∞–Ї—В–Є–≤–љ–Њ –њ—А–Њ–≤–Њ–і–Є–Љ—Г—О –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Г—О —В–µ—А–∞–њ–Є—О.
–Ы–µ—З–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е —Б –ї–Њ–Ї–∞–ї—М–љ–Њ–є –і–µ—Б—В—А—Г–Ї—Ж–Є–µ–є —А–Њ–≥–Њ–≤–Є—Ж—Л –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞–µ—В —Ж–µ–ї—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є, –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Н—Д—Д–µ–Ї—В–∞ –Њ—В –Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г–ґ–Є—В —Б—В–Є–Љ—Г–ї–Њ–Љ –і–ї—П —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –≠—В–Є –Љ–µ—А–Њ–њ—А–Є—П—В–Є—П –љ–∞–њ—А–∞–≤–ї–µ–љ—Л –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –љ–∞ —Г–≤–ї–∞–ґ–љ–µ–љ–Є–µ –≥–ї–∞–Ј–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Є —Б—В–Є–Љ—Г–ї—П—Ж–Є—О —А–µ–њ–∞—А–∞—В–Є–≤–љ–Њ–є —А–µ–≥–µ–љ–µ—А–∞—Ж–Є–Є. –Ш—Е –і–Њ–њ–Њ–ї–љ—П—О—В –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П, –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–∞—П –Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П, –∞ –њ—А–Є –≥–ї—Г–±–Њ–Ї–Њ–є –і–µ—Б—В—А—Г–Ї—Ж–Є–Є —А–Њ–≥–Њ–≤–Є—Ж—Л вАУ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є –њ—А–Њ—В–Є–≤–Њ—Д–µ—А–Љ–µ–љ—В–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ [3, 4]. –Т–∞–ґ–љ—Л–Љ –∞—Б–њ–µ–Ї—В–Њ–Љ –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б —Б–Є–љ–і—А–Њ–Љ–∞–ї—М–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є —А–Њ–≥–Њ–≤–Є—З–љ–Њ-–Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–≥–Њ –Ї—Б–µ—А–Њ–Ј–∞ —П–≤–ї—П–µ—В—Б—П —В–µ—А–∞–њ–Є—П —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б –°–°–У, –Ї–Њ—В–Њ—А—Г—О –љ–∞–Ј–љ–∞—З–∞–µ—В –Є –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ—В —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–≥–Њ –њ—А–Њ—Д–Є–ї—П (—А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥, —Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥, –≥–µ–Љ–∞—В–Њ–ї–Њ–≥ –Є –і—А.).
–° —Г—З–µ—В–Њ–Љ –±–Њ–ї—М—И–Њ–≥–Њ –Љ–љ–Њ–≥–Њ–Њ–±—А–∞–Ј–Є—П –Ї–Њ–Љ–њ–Њ–Ј–Є—Ж–Є–є ¬Ђ–Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є —Б–ї–µ–Ј—Л¬ї, –Њ–±–ї–∞–і–∞—О—Й–Є—Е, –љ–∞—А—П–і—Г —Б —Г–≤–ї–∞–ґ–љ—П—О—Й–Є–Љ–Є, —Ж–µ–ї—Л–Љ —А—П–і–Њ–Љ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е —Б–≤–Њ–є—Б—В–≤, –∞–Ї—В—Г–∞–ї—М–љ—Л–Љ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –Є—Е —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –≤—Л–±–Њ—А –њ—А–Є –ї–µ—З–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є —А–Њ–≥–Њ–≤–Є—Ж—Л –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞. –Т —В–∞–±–ї–Є—Ж–µ 1 –њ–µ—А–µ—З–Є—Б–ї–µ–љ—Л –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л–µ –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ —Б–ї–µ–Ј–Њ–Ј–∞–Љ–µ–љ–Є—В–µ–ї–Є, –Њ–±–ї–∞–і–∞—О—Й–Є–µ —В—А–µ–±—Г–µ–Љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є.

–Я–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ –≤ —В–∞–±–ї–Є—Ж–µ –њ—А–µ–њ–∞—А–∞—В—Л —Б–Њ–і–µ—А–ґ–∞—В –≤–µ—Й–µ—Б—В–≤–∞, —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–Є–µ —А–µ–њ–∞—А–∞—В–Є–≤–љ—Г—О —А–µ–≥–µ–љ–µ—А–∞—Ж–Є—О —А–Њ–≥–Њ–≤–Є—Ж—Л, —Б–ї—Г–ґ–∞—Й–Є–µ –ї–Є–±–Њ –њ–Њ–ї–Є–Љ–µ—А–љ–Њ–є –Њ—Б–љ–Њ–≤–Њ–є –њ—А–µ–њ–∞—А–∞—В–∞, –ї–Є–±–Њ –µ–≥–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ–Є –Є–љ–≥—А–µ–і–Є–µ–љ—В–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–і–∞—О—В –і–∞–љ–љ–Њ–Љ—Г —Б–Њ—Б—В–∞–≤—Г ¬Ђ–Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є —Б–ї–µ–Ј—Л¬ї —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–µ —Б–≤–Њ–є—Б—В–≤–∞.
–°—А–µ–і–Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ—Л—Е –њ–Њ–ї–Є–Љ–µ—А–љ—Л—Е –Њ—Б–љ–Њ–≤ —Б–ї–µ–Ј–Њ–Ј–∞–Љ–µ–љ–Є—В–µ–ї–µ–є –љ–∞–Є–±–Њ–ї—М—И–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –њ–Њ–ї—Г—З–Є–ї–Є –њ—А–Є—А–Њ–і–љ—Л–µ –Љ—Г–Ї–Њ–њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і—Л: –љ–∞—В—А–Є–µ–≤–∞—П —Б–Њ–ї—М –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ 0,1вАУ0,3%), –≥–Є–і—А–Њ–Ї—Б–Є–њ—А–Њ–њ–Є–ї-–≥—Г–∞—А, —Е–Њ–љ–і—А–Њ–Є—В–Є–љ–∞ —Б—Г–ї—М—Д–∞—В –љ–∞—В—А–Є—П (0,05%), —В—А–µ–≥–∞–ї–Њ–Ј–∞ (3%) –Є –њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і –Є–Ј —Б–µ–Љ—П–љ —В–∞–Љ–∞—А–Є–љ–і–∞ (TS-–њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і).
–Я—А–Є —Н—В–Њ–Љ, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –љ–∞—В—А–Є—П –≥–Є–∞–ї—Г—А–Њ–љ–∞—В–∞ –Є –њ—А–Њ—З–Є—Е –Њ—Б–љ–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ ¬Ђ–Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є —Б–ї–µ–Ј—Л¬ї, TS-–њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і –њ–Њ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ —Б—Е–Њ–і–µ–љ —Б –Љ—Г—Ж–Є–љ–Њ–Љ MUC1 –њ—А–µ—А–Њ–≥–Њ–≤–Є—З–љ–Њ–є —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є, –Њ–±–ї–∞–і–∞—П –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ–Є –Љ—Г–Ї–Њ–∞–і–≥–µ–Ј–Є–≤–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є [13, 27, 31]. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ TS-–њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і —Г–і–µ—А–ґ–Є–≤–∞–µ—В—Б—П –≤ —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–µ –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є [13]. –≠—В–Є —Б–≤–Њ–є—Б—В–≤–∞ TS-–њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і–∞ –њ–Њ–Ј–≤–Њ–ї—П—О—В —Г–њ–Њ–Љ—П–љ—Г—В–Њ–Љ—Г –≤ —В–∞–±–ї–Є—Ж–µ –њ—А–µ–њ–∞—А–∞—В—Г –Т–Є–Ј–Є–љ¬Ѓ –І–Є—Б—В–∞—П —Б–ї–µ–Ј–∞ –Є –µ–≥–Њ –±–µ—Б–Ї–Њ–љ—Б–µ—А–≤–∞–љ—В–љ–Њ–Љ—Г –∞–љ–∞–ї–Њ–≥—Г –Т–Є–Ј–Є–љ¬Ѓ –І–Є—Б—В–∞—П —Б–ї–µ–Ј–∞ (–љ–∞ 1 –і–µ–љ—М) –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П —Г–і–µ—А–ґ–Є–≤–∞—В—М—Б—П –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —А–Њ–≥–Њ–≤–Є—Ж—Л –Є –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л [13, 27, 31].
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤–Њ–і–љ—Л–µ —А–∞—Б—В–≤–Њ—А—Л TS-–њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і–∞ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є —В–Є–њ–Є—З–љ—Л—Е –њ—Б–µ–≤–і–Њ–њ–ї–∞—Б—В–Є—З–љ—Л—Е –ґ–Є–і–Ї–Њ—Б—В–µ–є: –≤—Л—Б–Њ–Ї–Њ–є –≤—П–Ј–Ї–Њ—Б—В—М—О –≤ –њ–Њ–Ї–Њ–µ –Є –њ—А–Њ–≥—А–µ—Б—Б–Є–≤–љ—Л–Љ –µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –њ—А–Є –њ–Њ–≤—Л—И–µ–љ–Є–Є —Б–Ї–Њ—А–Њ—Б—В–Є —Б–і–≤–Є–≥–∞ (–љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Є –Љ–Є–≥–∞–љ–Є–Є). –Ъ —В–Њ–Љ—Г –ґ–µ –≤—П–Ј–Ї–Њ—Б—В—М —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–≥–Њ –њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і–∞ –Ј–∞–≤–Є—Б–Є—В –Є –Њ—В —А–Э —Б—А–µ–і—Л, –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞—П –њ—А–Є –њ–Њ–≤—Л—И–µ–љ–Є–Є —Н—В–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П (–Њ—В 4,5 –≤–Њ —Д–ї–∞–Ї–Њ–љ–µ –і–Њ 7,4 –≤ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є). –≠—В–Њ —В–∞–Ї–ґ–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Г–≤–µ–ї–Є—З–µ–љ–Є—О –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–µ–±—Л–≤–∞–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —Б—В—А—Г–Ї—В—Г—А–µ –њ—А–µ—А–Њ–≥–Њ–≤–Є—З–љ–Њ–є —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є –±–Њ–ї—М–љ—Л—Е —Б –°–°–У, —А–Э –Ї–Њ—В–Њ—А–Њ–є –≤—Л—И–µ 7,4, –њ–Њ–≤—Л—И–µ–љ–Є—О –µ–µ —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В–Є –Є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ —А–Њ–≥–Њ–≤–Є—З–љ–Њ-–Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–≥–Њ –Ї—Б–µ—А–Њ–Ј–∞ [21, 27].
–Я—А–Є —Н—В–Њ–Љ —А—П–і –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л—Е –љ–∞ –њ—А–Є—А–Њ–і–љ—Л—Е –њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і–∞—Е, –≤ —Б–≤–Њ–µ–Љ —Б–Њ—Б—В–∞–≤–µ —В–∞–Ї–ґ–µ —Б–Њ–і–µ—А–ґ–∞—В –Є–љ–≥—А–µ–і–Є–µ–љ—В—Л, —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–Є–µ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –Є —Г—Б–Є–ї–Є–≤–∞—О—Й–Є–µ —Н—Д—Д–µ–Ї—В –±–∞–Ј–Њ–≤–Њ–≥–Њ –њ—А–Є—А–Њ–і–љ–Њ–≥–Њ –њ–Њ–ї–Є–Љ–µ—А–∞ ¬Ђ–Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є —Б–ї–µ–Ј—Л¬ї. –£–Ї–∞–Ј–∞–љ–љ—Г—О –Ј–∞–і–∞—З—Г –≤ —В–∞–Ї–Є—Е –Ї–Њ–Љ–њ–Њ–Ј–Є—Ж–Є—П—Е —Б–ї–µ–Ј–Њ–Ј–∞–Љ–µ–љ–Є—В–µ–ї–µ–є —А–µ—И–∞—О—В –і–µ–Ї—Б–њ–∞–љ—В–µ–љ–Њ–ї, –≥–µ–њ–∞—А–Є–љ –љ–∞—В—А–Є—П, –≤–Є—В–∞–Љ–Є–љ –Т12 (—Ж–Є–∞–љ–Ї–Њ–±–∞–ї–∞–Љ–Є–љ) –Є –і—А. [38].
–Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Ї–ї–µ—В–Њ–Ї —Н–њ–Є—В–µ–ї–Є—П –≥–ї–∞–Ј–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –љ–∞ –њ–Њ—З–≤–µ –Є—Е –і–µ–≥–Є–і—А–∞—В–∞—Ж–Є–Є —В–∞–Ї–ґ–µ —Б–≤—П–Ј–∞–љ—Л —Б –і–Є—Б–∞—Е–∞—А–Є–і–Њ–Љ —В—А–µ–≥–∞–ї–Њ–Ј–∞ (–Ґ–µ–∞–ї–Њ–Ј), —Б–њ–Њ—Б–Њ–±–љ—Л–Љ, –Ј–∞–Љ–µ—Й–∞—П –≤–Њ–і—Г, —Б—В–∞–±–Є–ї–Є–Ј–Є—А–Њ–≤–∞—В—М –Є—Е –Ї–ї–µ—В–Њ—З–љ—Г—О –Љ–µ–Љ–±—А–∞–љ—Г. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Б–љ–Є–ґ–∞–µ—В—Б—П –њ–Њ—В–µ—А—П –Ї–ї–µ—В–Ї–∞–Љ–Є –≤–Њ–і—Л –Є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –Є—Е –і–µ–≥–Є–і—А–∞—В–∞—Ж–Є—П, —З—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–є –∞–љ–≥–Є–і—А–Њ–±–Є–Њ–Ј —В–Ї–∞–љ–µ–є, –Ј–∞–Ї–ї—О—З–∞—О—Й–Є–є—Б—П –≤ –Є—Е —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –Ї –≤—Л—Б—Г—И–Є–≤–∞–љ–Є—О [14, 25, 26].
–Я–∞—Ж–Є–µ–љ—В–∞–Љ, –°–°–У —Г –Ї–Њ—В–Њ—А—Л—Е –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –Є—Б–њ–∞—А—П–µ–Љ–Њ—Б—В—М—О –Є –≥–Є–њ–µ—А–Њ—Б–Љ–Њ–ї—П—А–љ–Њ—Б—В—М—О —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є, —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–љ—Л —Б–ї–µ–Ј–Њ–Ј–∞–Љ–µ–љ–Є—В–µ–ї–Є, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –Њ—Б–Љ–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А—Л: –ї–µ–≤–Њ–Ї–∞—А–љ–Є—В–Є–љ –Є —Н—А–Є—В—А–Є—В–Њ–ї (–њ—А–µ–њ–∞—А–∞—В –Њ–њ—В–Є–≤), –∞ —В–∞–Ї–ґ–µ –≥–ї–Є—Ж–µ—А–Є–љ (–Ї–∞—В–Є–Њ–љ–Њ—А–Љ). –Ю—Б–Љ–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А—Л, –њ—А–Њ–љ–Є–Ї–∞—П –≤–љ—Г—В—А—М –Ї–ї–µ—В–Њ–Ї —Н–њ–Є—В–µ–ї–Є—П –≥–ї–∞–Ј–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є, –њ–Њ–≤—Л—И–∞—О—В –Є—Е –Њ—Б–Љ–Њ–ї—П—А–љ–Њ—Б—В—М, –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞—П –і–µ–≥–Є–і—А–∞—В–∞—Ж–Є—О –љ–∞ –њ–Њ—З–≤–µ –њ–Њ—В–µ—А–Є –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –≤ ¬Ђ–≥–Є–њ–µ—А–Њ—Б–Љ–Њ–ї—П—А–љ—Г—О¬ї —Б–ї–µ–Ј–љ—Г—О –њ–ї–µ–љ–Ї—Г –њ–Њ –Њ—Б–Љ–Њ—В–Є—З–µ—Б–Ї–Њ–Љ—Г –≥—А–∞–і–Є–µ–љ—В—Г [23].
–Т –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ –≤—Л–±–Њ—А –њ—А–µ–њ–∞—А–∞—В–∞ ¬Ђ–Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є —Б–ї–µ–Ј—Л¬ї –Є–Ј –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–≥–Њ –≤ —В–∞–±–ї–Є—Ж–µ –њ–µ—А–µ—З–љ—П –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П —Б —Г—З–µ—В–Њ–Љ –≤—П–Ј–Ї–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –Є –µ–≥–Њ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є. –Я—А–Є —Н—В–Њ–Љ –±–Њ–ї—М–љ—Л–Љ —Б –Ї—Б–µ—А–Њ–Ј–Њ–Љ –ї–µ–≥–Ї–Њ–є –Є –Ї—А–∞–є–љ–µ —В—П–ґ–µ–ї–Њ–є —Б—В–µ–њ–µ–љ–Є –њ–Њ–Ї–∞–Ј–∞–љ—Л –њ—А–µ–њ–∞—А–∞—В—Л –љ–Є–Ј–Ї–Њ–є –≤—П–Ј–Ї–Њ—Б—В–Є, —Б—А–µ–і–љ–µ–є —В—П–ґ–µ—Б—В–Є –Є —В—П–ґ–µ–ї—Л–Љ вАУ –≥–µ–ї–µ–≤—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л.
–Э–∞—А—П–і—Г —Б –Њ—Д–Є—Ж–Є–љ–∞–ї—М–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є ¬Ђ–Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є —Б–ї–µ–Ј—Л¬ї –≤ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ—Л—Е —Ж–µ–ї—П—Е –њ—А–Є–Љ–µ–љ—П—О—В—Б—П —В–∞–Ї–ґ–µ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –ґ–Є–і–Ї–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–∞: —Б—Л–≤–Њ—А–Њ—В–Ї–∞, –њ–ї–∞–Ј–Љ–∞ –Ї—А–Њ–≤–Є –Є —Б–ї—О–љ–∞ [22]. –Ю–љ–Є —Б–Њ–і–µ—А–ґ–∞—В —А–∞–Ј–ї–Є—З–љ—Л–µ —Н–њ–Є—В–µ–ї–Є–Њ—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л (—Д–∞–Ї—В–Њ—А—Л —А–Њ—Б—В–∞, –љ–µ–є—А–Њ—В—А–Њ–њ–Є–љ—Л, –≤–Є—В–∞–Љ–Є–љ—Л, –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ—Л –Є –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л–µ –Љ–∞—В—А–Є—З–љ—Л–µ –±–µ–ї–Ї–Є), –Є–≥—А–∞—О—Й–Є–µ –∞–Ї—В–Є–≤–љ—Г—О —А–Њ–ї—М –≤ –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј–µ —Н–њ–Є—В–µ–ї–Є—П –≥–ї–∞–Ј–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є. –°–Њ–≤—А–µ–Љ–µ–љ–љ–∞—П —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–∞—П –Є–љ–і—Г—Б—В—А–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ–Њ–ї—Г—З–µ–љ–љ—Г—О —Г –±–Њ–ї—М–љ–Њ–≥–Њ —Б—Л–≤–Њ—А–Њ—В–Ї—Г –Ї—А–Њ–≤–Є —А–∞—Б—Д–∞—Б–Њ–≤–∞—В—М –њ–Њ —Б—В–µ—А–Є–ї—М–љ—Л–Љ 3вАУ5-–Љ–ї –њ–ї–∞—Б—В–Є–Ї–Њ–≤—Л–Љ —Д–ї–∞–Ї–Њ–љ–∞–Љ, –Ј–∞–Љ–Њ—А–Њ–Ј–Є—В—М –≤ –і–Њ–Љ–∞—И–љ–µ–Љ —Е–Њ–ї–Њ–і–Є–ї—М–љ–Є–Ї–µ –Є –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≤ –≤–Є–і–µ –≥–ї–∞–Ј–љ—Л—Е –Ї–∞–њ–µ–ї—М –њ–Њ–і–Њ–±–љ–Њ –њ—А–µ–њ–∞—А–∞—В—Г ¬Ђ–Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є —Б–ї–µ–Ј—Л¬ї [14, 29]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ —В–∞–Ї–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ–Њ–Ї–∞ –Њ—В—Б—Г—В—Б—В–≤—Г—О—В, —З—В–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –ґ–Є–і–Ї–Њ—Б—В–µ–є.
–С–Њ–ї—М—И–Є–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤—Л –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —А–Њ–≥–Њ–≤–Є—Ж—Л —Б–≤—П–Ј–∞–љ—Л —Б —А–∞–Ј—А–∞–±–Њ—В–Ї–Њ–є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Ъ–∞—Ж–Є–Ї–Њ–ї, —Г–ґ–µ –њ—А–Њ—И–µ–і—И–µ–≥–Њ –Є—Б–њ—Л—В–∞–љ–Є—П –≤ –Х–≤—А–Њ–њ–µ, –љ–Њ –њ–Њ–Ї–∞ –љ–µ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ. –≠—В–Њ—В –њ—А–µ–њ–∞—А–∞—В —Б–њ–Њ—Б–Њ–±–µ–љ —Г–Ї—А–µ–њ–ї—П—В—М –Љ–∞—В—А–Є–Ї—Б–љ—Л–µ –њ—А–Њ—В–µ–Є–љ—Л –≤ —Б—В—А—Г–Ї—В—Г—А–µ —Н–њ–Є—В–µ–ї–Є—П —А–Њ–≥–Њ–≤–Є—Ж—Л, –њ—А–µ–њ—П—В—Б—В–≤—Г—П –µ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є –і–µ—Б—В—А—Г–Ї—Ж–Є–Є, –Є —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞—В—М –µ–µ —А–µ–њ–∞—А–∞—В–Є–≤–љ—Г—О —А–µ–≥–µ–љ–µ—А–∞—Ж–Є—О [8].
–Т–∞–ґ–љ—Л–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ–Љ –ї–µ—З–µ–љ–Є—П –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —А–Њ–≥–Њ–≤–Є—Ж—Л —П–≤–ї—П–µ—В—Б—П –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П. –° —Г—З–µ—В–Њ–Љ —В–Њ–≥–Њ, —З—В–Њ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –≤ –ї–µ—З–µ–љ–Є–Є —В–∞–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е –љ–µ –њ—А–Є–Љ–µ–љ—П—О—В—Б—П, –љ–∞ –њ–µ—А–≤—Л–є –њ–ї–∞–љ –≤—Л—Е–Њ–і—П—В –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ (–Э–Я–Т–°), –Є–љ–≥–Є–±–Є—А—Г—О—Й–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л –Є –њ—А–Њ–і—Г–Ї—Ж–Є—О –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ –≤ —В–Ї–∞–љ—П—Е –≥–ї–∞–Ј–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є [11]. –°—А–µ–і–Є –љ–Є—Е –≤ —Г–Ї–∞–Ј–∞–љ–љ—Л—Е —Ж–µ–ї—П—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ–Њ–ї—Г—З–Є–ї –±—А–Њ–Љ—Д–µ–љ–∞–Ї –≤ –љ–Є–Ј–Ї–Њ–є (0,07вАУ0,09%) –і–Њ–Ј–Є—А–Њ–≤–Ї–µ: –њ—А–µ–њ–∞—А–∞—В—Л –Я—А–Њ–ї–µ–љ—Б–∞ –Є –†–µ–Љ—Г—А–∞ (ISTA Pharmaceutical), —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–µ –≤ –Х–≤—А–Њ–њ–µ [34, 35], –Є –С—А–Њ–Ї—Б–Є–љ–∞–Ї (Sentiss) вАУ –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ. 0,09% –С—А–Њ–љ—Д–µ–љ–∞–Ї —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ –≤ —В–µ—А–∞–њ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Н—А–Њ–Ј–Є–µ–є –Є —П–Ј–≤–Њ–є —А–Њ–≥–Њ–≤–Є—Ж—Л –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞, –Ї–Њ–≥–і–∞ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ—Л –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і—Л, –∞ —В–∞–Ї–ґ–µ –≤ –њ–µ—А–≤—Л–µ 3вАУ4 –љ–µ–і. –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є —А–µ—Б—В–∞—Б–Є—Б–∞ –≤ —Ж–µ–ї—П—Е –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –µ–≥–Њ —А–∞–Ј–і—А–∞–ґ–∞—О—Й–µ–≥–Њ —Н—Д—Д–µ–Ї—В–∞. –Х–≥–Њ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Ј–∞–Ї–∞–њ—Л–≤–∞—В—М 1 —А./—Б—Г—В [20].
–° —Г—З–µ—В–Њ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Г –±–Њ–ї—М–љ—Л—Е —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –≤—В–Њ—А–Є—З–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Њ—А–Є–≥–Є–љ–∞–ї—М–љ—Л–Љ —А–µ—И–µ–љ–Є–µ–Љ —П–≤–Є–ї–Њ—Б—М –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ 1% –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞, –Њ–±–ї–∞–і–∞—О—Й–µ–≥–Њ –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–Љ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ [19].
–Ш–љ—В–µ–љ—Б–Є–≤–љ–Њ –њ—А–Њ–≤–Њ–і–Є–Љ—Л–µ –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞—В—М –љ–Њ–≤–Њ–µ –Є–љ–љ–Њ–≤–∞—Ж–Є–Њ–љ–љ–Њ–µ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —А–Њ–≥–Њ–≤–Є—Ж—Л –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є. –°—А–µ–і–Є —В–∞–Ї–Є—Е —А–∞–Ј—А–∞–±–Њ—В–Њ–Ї —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М –њ—А–µ–њ–∞—А–∞—В –Ы–Є—Д–Є—В–µ–≥—А–∞—Б—В (5% Sarcode), –Ї–Њ—В–Њ—А—Л–є –≤ –≥–ї–∞–Ј–љ—Л—Е –Ї–∞–њ–ї—П—Е –Є–љ–≥–Є–±–Є—А—Г–µ—В –Ґ-–Ї–ї–µ—В–Њ—З–љ—Г—О –∞–Ї—В–Є–≤–∞—Ж–Є—О, –∞–і–≥–µ–Ј–Є—О, –Љ–Є–≥—А–∞—Ж–Є—О –Є –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ [28, 34].
–У–ї–∞–Ј–љ—Л–µ –Ї–∞–њ–ї–Є –†–µ–≥–µ–љ–µ—А–µ–Ї—Б (RGN-259) –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї—Г—О –Ї–Њ–њ–Є—О –њ–µ–њ—В–Є–і–∞ –Ґќ≤4, –Њ–±–ї–∞–і–∞—О—Й–µ–≥–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –Є —А–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є. –Я—А–Є —Н—В–Њ–Љ –њ–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ–љ –і–∞–ґ–µ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ –Р [17].
–Я—А–µ–њ–∞—А–∞—В ESBA-105, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–є —Б–Њ–±–Њ–є –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л–є –∞–љ—В–Є-TNF-ќ± —Д—А–∞–≥–Љ–µ–љ—В, —А–∞—Б—В–≤–Њ—А–µ–љ–љ—Л–є –≤ –≥–ї–∞–Ј–љ—Л—Е –Ї–∞–њ–ї—П—Е –і–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є 10 –Љ–≥/–Љ–ї, –Њ–Ї–∞–Ј–∞–ї—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –і–ї—П –ї–µ—З–µ–љ–Є—П TNF-–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≥–ї–∞–Ј –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є [30].
–Т—Л—П–≤–ї–µ–љ —В–∞–Ї–ґ–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В —Г –Є–Ј–≤–µ—Б—В–љ–Њ–≥–Њ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Ј–Є—А—Г—О—Й–µ–≥–Њ —Б—А–µ–і—Б—В–≤–∞ –і–ї—П —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –†–Є–≤–Њ–≥–ї–Є—В–∞–Ј–Њ–љ. –Я—А–µ–њ–∞—А–∞—В –Њ–Ї–∞–Ј–∞–ї—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –≤ —В–µ—А–∞–њ–Є–Є –Ї–µ—А–∞—В–Њ–њ–∞—В–Є–Є –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Ј–∞ —Б—З–µ—В —Г–ї—Г—З—И–µ–љ–Є—П –±–∞—А—М–µ—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є —Н–њ–Є—В–µ–ї–Є—П —А–Њ–≥–Њ–≤–Є—Ж—Л [37]. –Т –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї —Н—В–Є–Љ –Є—Б–њ—Л—В–∞–љ–Є—П–Љ –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –њ—А–Њ–≤–Њ–і–Є—В—Б—П –Є–Ј—Г—З–µ–љ–Є–µ –≥–ї–∞–Ј–љ—Л—Е –Ї–∞–њ–µ–ї—М DE-101 SEGRA, –і–µ–є—Б—В–≤—Г—О—Й–µ–µ –≤–µ—Й–µ—Б—В–≤–Њ –Ї–Њ—В–Њ—А—Л—Е —П–≤–ї—П–µ—В—Б—П —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ –∞–≥–Њ–љ–Є—Б—В–Њ–Љ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Я—А–µ–њ–∞—А–∞—В –Њ–±–ї–∞–і–∞–µ—В —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –Э–Я–Т–° –Є –њ—А–Њ—В–Є–≤–Њ–∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ [24].
–°—Е–Њ–і–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –Њ–±–ї–∞–і–∞–µ—В –і—А—Г–≥–Њ–є –Є–љ–љ–Њ–≤–∞—Ж–Є–Њ–љ–љ—Л–є –∞–≥–Њ–љ–Є—Б—В –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ вАУ –Ь–∞–њ—А–∞–Ї–Њ—А–∞—В, –Ї–Њ—В–Њ—А—Л–є –Є–љ–≥–Є–±–Є—А—Г–µ—В –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ —Ж–Є—В–Њ–Ї–Є–љ—Л, –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л–µ –≥–Є–њ–µ—А–Њ—Б–Љ–Њ–ї—П—А–љ–Њ—Б—В—М—О —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є, –∞ –њ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –љ–µ —Г—Б—В—Г–њ–∞–µ—В –і–µ–Ї—Б–∞–Љ–µ—В–∞–Ј–Њ–љ—Г [39].
–Ш, –љ–∞–Ї–Њ–љ–µ—Ж, –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤—Л —Б–≤—П–Ј–∞–љ—Л —Б –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –†–µ–Ј–Њ–ї—М–≤–Є–Ї—Б [RX-10045], –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–Љ —Б–Њ–±–Њ–є —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Њ–≥ —А–µ–Ј–Њ–ї—М–≤–Є–љ–∞. –Я—А–µ–њ–∞—А–∞—В —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–Ј—А–µ—И–µ–љ–Є—О –Њ—Б—В—А–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, –њ—А–Њ—В–µ–Ї–∞—О—Й–µ–≥–Њ —Б —Г—З–∞—Б—В–Є–µ–Љ –Љ–љ–Њ–≥–Є—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л—Е –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ [16].
–Т–µ—Б—М–Љ–∞ –і–µ–є—Б—В–≤–µ–љ–љ—Л–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ–Љ –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б —П–Ј–≤–Њ–є —А–Њ–≥–Њ–≤–Є—Ж—Л –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є —Б–ї—Г–ґ–Є—В –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П [5]. –Т—Л–±–Њ—А —Н—В–Є—Е –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —В–∞–Ї –ґ–µ –Ї–∞–Ї –Є –Э–Я–Т–°, –Њ—Б–Њ–±–µ–љ–љ–Њ –∞–Ї—В—Г–∞–ї–µ–љ –≤ —Б–≤—П–Ј–Є —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –љ–∞–Ј–љ–∞—З–∞—В—М —В–∞–Ї–Є–Љ –±–Њ–ї—М–љ—Л–Љ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л.
–Т –Њ—Б–љ–Њ–≤–µ –і–∞–љ–љ–Њ–≥–Њ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –ї–µ–ґ–Є—В –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є –≤ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ—Г—О –њ–Њ–ї–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ 0,05% —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ–∞ –Р. –У–Њ—А–∞–Ј–і–Њ –Љ–µ–љ—М—И–µ–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ—Л—Е —Ж–µ–ї—П—Е –њ–Њ–ї—Г—З–Є–ї–Є –Є–Љ–Љ—Г–љ–Њ–Ї–Њ—А—А–µ–Ї—В–Њ—А—Л –і–ї—П —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –Є –Љ–µ—Б—В–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П: —В–∞–Ї—А–Њ–ї–Є–Љ—Г—Б, —Б–Є—А–Њ–ї–Є–Љ—Г—Б, –ї–µ–≤–∞–Љ–Є–Ј–Њ–ї (–і–µ–Ї–∞—А–Є—Б), —В–Є–Љ–∞–ї–Є–љ, —В–Є–Љ–Њ–≥–µ–љ, –ї–Є–Ї–Њ–њ–Є–і, –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є, –≥–∞–ї–∞–≤–Є—В –Є –і—А.
–Ч–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л–є –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ –њ—А–µ–њ–∞—А–∞—В 0,05% —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ–∞ –Р –†–µ—Б—В–∞—Б–Є—Б –Є–љ—Б—В–Є–ї–ї–Є—А—Г—О—В –≤ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ—Г—О –њ–Њ–ї–Њ—Б—В—М –±–Њ–ї—М–љ–Њ–≥–Њ –≥–ї–∞–Ј–∞ —Б —З–∞—Б—В–Њ—В–Њ–є 2 —А./—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. [32]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є —Н—В–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ –ї–Є—И–µ–љ—Л –Є –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, –Ј–∞–Ї–ї—О—З–∞—О—Й–Є—Е—Б—П –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –≤ –µ–≥–Њ —А–∞–Ј–і—А–∞–ґ–∞—О—Й–µ–Љ –і–µ–є—Б—В–≤–Є–Є. –Ю–љ–Њ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –ґ–ґ–µ–љ–Є–µ–Љ –≤ –≥–ї–∞–Ј—Г (—Г 14,7% –њ–∞—Ж–Є–µ–љ—В–Њ–≤), –њ–Њ–Ї–∞–ї—Л–≤–∞–љ–Є–µ–Љ (6,5%), –љ–µ—З–µ—В–Ї–Њ—Б—В—М—О –Ј—А–µ–љ–Є—П (1,7%) [12, 33]. –≠—В–Є –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–∞ —Г 9,4% –±–Њ–ї—М–љ—Л—Е —Б –°–°–У –і–∞–ґ–µ –њ–Њ—Б–ї—Г–ґ–Є–ї–Є –њ—А–Є—З–Є–љ–Њ–є —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –ї–µ—З–µ–љ–Є—П —А–µ—Б—В–∞—Б–Є—Б–Њ–Љ [32]. –Ь—Л —В–∞–Ї–ґ–µ –љ–∞–±–ї—О–і–∞–ї–Є –њ–Њ–і–Њ–±–љ—Л–µ —Б–ї—Г—З–∞–Є: –Ј–∞—З–∞—Б—В—Г—О –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–µ –≤—А–∞—З–Є –Є–і—Г—В –љ–∞ –њ–Њ–≤–Њ–і—Г —Г –±–Њ–ї—М–љ–Њ–≥–Њ, –њ—А–µ–і—К—П–≤–Є–≤—И–µ–≥–Њ –ґ–∞–ї–Њ–±—Л –љ–∞ —Г—В—П–ґ–µ–ї–µ–љ–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Ї—Б–µ—А–Њ–Ј–∞ –≤ –њ–µ—А–≤—Л–µ –љ–µ–і–µ–ї–Є –Ј–∞–Ї–∞–њ—Л–≤–∞–љ–Є–є —А–µ—Б—В–∞—Б–Є—Б–∞, –Є –Њ—В–Љ–µ–љ—П—О—В –њ—А–µ–њ–∞—А–∞—В.
–£–Ї–∞–Ј–∞–љ–љ—Л–µ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–∞ —П–≤–Є–ї–Є—Б—М —Б—В–Є–Љ—Г–ї–Њ–Љ –і–ї—П –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ–∞ –Р –≤ —Ж–µ–ї—П—Е –њ–Њ–≤—Л—И–µ–љ–Є—П –Є—Е –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є, –љ–Њ –±–µ–Ј —Б–љ–Є–ґ–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, —Г—Б–Њ–≤–µ—А—И–µ–љ—Б—В–≤–Њ–≤–∞–љ–љ—Л–є –≤–∞—А–Є–∞–љ—В —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ–∞ вАУ –†–µ—Б—В–∞—Б–Є—Б –• –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–љ–Њ–≥–Њ –≤—Л—И–µ –∞–љ–∞–ї–Њ–≥–∞ —Г–Љ–µ–љ—М—И–µ–љ–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є –і–µ–є—Б—В–≤—Г—О—Й–µ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Є –±–Њ–ї–µ–µ —Б–Њ–≤–µ—А—И–µ–љ–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є –µ–≥–Њ –і–Њ—Б—В–∞–≤–Ї–Є –≤ —В–Ї–∞–љ–Є —А–Њ–≥–Њ–≤–Є—Ж—Л –Є –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л [10]. –†–∞–Ј—А–∞–±–Њ—В–∞–љ—Л —В–∞–Ї–ґ–µ –Є –Ї–∞—В–Є–Њ–љ–љ—Л–µ —Н–Љ—Г–ї—М—Б–Є–Є —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ–∞ –Р: –Я–∞–њ–Є–ї–Њ–Ї –Љ–Є–љ–Є –Є –Р–є–Ї–µ—А–≤–Є—Б —Б —Г–ї—Г—З—И–µ–љ–љ–Њ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –њ—А–µ–њ–∞—А–∞—В–∞ –Є —Г–≤–µ–ї–Є—З–µ–љ–љ–Њ–є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –µ–≥–Њ –њ—А–µ–±—Л–≤–∞–љ–Є—П –≤ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –њ–Њ–≤—Л—Б–Є—В—М –і–Њ–Ј—Г —Ж–Є–Ї–ї–Њ—Б–њ–Њ—А–Є–љ–∞ –≤ –≥–ї–∞–Ј–љ—Л—Е –Ї–∞–њ–ї—П—Е, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Є –Њ–±–Њ–є—В–Є—Б—М –Њ–і–љ–Њ–Ї—А–∞—В–љ—Л–Љ –µ–≥–Њ –Ј–∞–Ї–∞–њ—Л–≤–∞–љ–Є–µ–Љ –≤ —В–µ—З–µ–љ–Є–µ –і–љ—П вАУ —Б –і—А—Г–≥–Њ–є.
–° —Г—З–µ—В–Њ–Љ —В–Њ–≥–Њ, —З—В–Њ —В–µ—З–µ–љ–Є–µ –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є —П–Ј–≤—Л —А–Њ–≥–Њ–≤–Є—Ж—Л –Ј–∞—З–∞—Б—В—Г—О –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –∞–Ї—В–Є–≤–љ–Њ –њ—А–Њ–≤–Њ–і–Є–Љ—Г—О —В–µ—А–∞–њ–Є—О, –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ –≤—Б—В–∞–µ—В –≤–Њ–њ—А–Њ—Б –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—П—Е –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П —В–µ—З–µ–љ–Є—П —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –Ф–ї—П –Њ—В–≤–µ—В–∞ –љ–∞ —Н—В–Њ—В –≤–Њ–њ—А–Њ—Б –°.–У. –Ц—Г—А–Њ–≤–∞ –Є —Б–Њ–∞–≤—В. (2011) –њ—А–µ–і–ї–Њ–ґ–Є–ї–Є –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞—В—М—Б—П –љ–∞ –і–Є–љ–∞–Љ–Є–Ї—Г –њ—А–Њ—В–µ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б–ї–µ–Ј–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є (–≤ –љ–Њ—А–Љ–µ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 232вАУ298 –Ъ–Х/–Љ–ї) –Є –њ—А–Є –µ–µ –њ–Њ–≤—Л—И–µ–љ–Є–Є –≤—Л—И–µ 300 –Ъ–Х/–Љ–ї –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞—В—М –і–∞–ї—М–љ–µ–є—И–µ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ [3].
–Т —В–∞–Ї–Є—Е —Б–ї—Г—З–∞—П—Е –Ї –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О –і–Њ–±–∞–≤–ї—П—О—В 4вАУ6-–Ї—А–∞—В–љ—Л–µ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є –≤ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ—Г—О –њ–Њ–ї–Њ—Б—В—М –∞–њ—А–Њ—В–Є–љ–Є–љ–∞ (–≥–Њ—А–і–Њ–Ї—Б–∞). –Ш –µ—Б–ї–Є —В–µ–љ–і–µ–љ—Ж–Є—П –Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О —П–Ј–≤—Л —А–Њ–≥–Њ–≤–Є—Ж—Л –љ–∞ —Д–Њ–љ–µ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П, —В–Њ –њ—А–Є—Б—В—Г–њ–∞—О—В –Ї –љ–µ–Њ—В–ї–Њ–ґ–љ–Њ–Љ—Г —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О —В–∞–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–µ–і–ї–Њ–ґ–µ–љ–Њ –±–Њ–ї—М—И–Њ–µ —З–Є—Б–ї–Њ –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–≥–Њ –њ–ї–∞–љ–∞: –Њ—В –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–є –њ–ї–∞—Б—В–Є–Ї–Є –њ–Њ –Ъ—Г–љ—В—Г –і–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л—Е –њ–Њ–Ї—А—Л—В–Є–є, –Ї–Њ–ї–њ–∞—З–Ї–Њ–≤, –Ї–Њ–љ—В–∞–Ї—В–љ—Л—Е –ї–Є–љ–Ј, —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –ї–Є–Љ–±–∞ –Є —В. –њ. –Я—А–∞–Ї—В–Є—З–µ—Б–Ї—Г—О –њ—А–Њ–≤–µ—А–Ї—Г –≤—А–µ–Љ–µ–љ–µ–Љ –њ—А–Њ—И–ї–Є –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –ї–Є—И—М –Љ–µ—А–Њ–њ—А–Є—П—В–Є—П, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –љ–∞ –њ–ї–Њ–Љ–±–Є—А–Њ–≤–∞–љ–Є–µ –і–µ—Д–µ–Ї—В–∞ —А–Њ–≥–Њ–≤–Є—Ж—Л –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є —В–Ї–∞–љ—П–Љ–Є: –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–Њ–є, —В–µ–љ–Њ–љ–Њ–≤–Њ–є –Є –∞–Љ–љ–Є–Њ—В–Є—З–µ—Б–Ї–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є, –∞–ї–ї–Њ–њ–ї–∞–љ—В–Њ–Љ –Є –і—А. –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ—А–∞–Ї—В–Є–Ї–∞, –≤—Л–±–Њ—А –Љ–∞—В–µ—А–Є–∞–ї–∞ –і–ї—П –њ–ї–Њ–Љ–±–Є—А–Њ–≤–∞–љ–Є—П –≤–Њ –Љ–љ–Њ–≥–Њ–Љ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≥–ї—Г–±–Є–љ–Њ–є —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞, –љ–∞–ї–Є—З–Є–µ–Љ –Є–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –њ–µ—А—Д–Њ—А–∞—Ж–Є–Є –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞, —Е–∞—А–∞–Ї—В–µ—А–Њ–Љ –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є. –Ґ–∞–Ї, –њ–Њ–Ї—А—Л—В–Є–µ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л—Е —П–Ј–≤ —А–Њ–≥–Њ–≤–Є—Ж—Л —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М –∞–Љ–љ–Є–Њ–љ–Њ–Љ, –њ–Њ–і—И–Є–≤–∞—П –µ–≥–Њ ¬Ђ–Ї—А–∞–є –≤ –Ї—А–∞–є¬ї –≤ –њ—А–µ–і–µ–ї–∞—Е –і–µ—Д–µ–Ї—В–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л—Е —Б–ї–Њ–µ–≤ —А–Њ–≥–Њ–≤–Є—Ж—Л, –∞ –њ–Њ–і –њ–Њ–і—И–Є—В—Л–є –ї–Њ—Б–Ї—Г—В –њ–Њ–Љ–µ—Б—В–Є—В—М –Є —А–∞—Б–њ—А–∞–≤–Є—В—М –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–є –њ–Њ –њ–ї–Њ—Й–∞–і–Є –ї–Њ—Б–Ї—Г—В –∞–Љ–љ–Є–Њ—В–Є—З–µ—Б–Ї–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є. –Х—Б–ї–Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–µ–ї—М–µ—Д —А–Њ–≥–Њ–≤–Є—Ж—Л, –Љ–Њ–ґ–љ–Њ –≤–Њ—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –Љ—П–≥–Ї–Њ–є –Ї–Њ–љ—В–∞–Ї—В–љ–Њ–є –ї–Є–љ–Ј–Њ–є –≤ –Ї–∞—З–µ—Б—В–≤–µ –±–∞–љ–і–∞–ґ–∞.
–У–ї—Г–±–Њ–Ї–Є–µ —П–Ј–≤—Л —А–Њ–≥–Њ–≤–Є—Ж—Л, –≤ —В. —З. –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–µ –і–µ—Б—Ж–µ–Љ–µ—В–Њ—Ж–µ–ї–µ, —Б–ї—Г–ґ–∞—В –њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –і–ї—П –Є—Е –њ–ї–Њ–Љ–±–Є—А–Њ–≤–∞–љ–Є—П –ї–Њ—Б–Ї—Г—В–Њ–Љ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л ¬Ђ–љ–∞ –љ–Њ–ґ–Ї–µ¬ї —Б —Д–Є–Ї—Б–∞—Ж–Є–µ–є —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –Ї–Њ–љ—Ж–∞ –ї–Њ—Б–Ї—Г—В–∞ –Ї –Ї—А–∞—П–Љ –і–µ—Д–µ–Ї—В–∞ —А–Њ–≥–Њ–≤–Є—Ж—Л [4]. –Я—А–Є —Н—В–Њ–Љ –Љ—Л –њ—А–µ–і–њ–Њ—З–Є—В–∞–µ–Љ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞—В—М —Н—В–Њ—В –Љ–µ—В–Њ–і —Б –∞–Љ–љ–Є–Њ–њ–ї–∞—Б—В–Є–Ї–Њ–є –њ–Њ –њ—А–Є–≤–µ–і–µ–љ–љ–Њ–є –≤—Л—И–µ –Љ–µ—В–Њ–і–Є–Ї–µ. –Я–ї–Њ–Љ–±–Є—А–Њ–≤–∞–љ–Є–µ —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞ –ї–Њ—Б–Ї—Г—В–Њ–Љ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –≤ —В–∞–Ї–Є—Е —Б–ї—Г—З–∞—П—Е –њ–Њ–Ј–≤–Њ–ї—П–µ—В, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М –і–∞–ї—М–љ–µ–є—И–µ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Є–Ј—К—П–Ј–≤–ї–µ–љ–Є—П —А–Њ–≥–Њ–≤–Є—Ж—Л –Є –њ–µ—А—Д–Њ—А–∞—Ж–Є–Є –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞, –∞ —Б –і—А—Г–≥–Њ–є вАУ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–ї—Г—З—И–Є—В—М —Б–Њ—Б—В–Њ—П–љ–Є–µ —А–Њ–≥–Њ–≤–Є—Ж—Л, –µ—Й–µ –љ–µ –≤–Њ–≤–ї–µ—З–µ–љ–љ–Њ–є –≤ –≥–ї—Г–±–Њ–Ї–Є–є –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б [4]. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –њ–µ—А–µ—Б–∞–ґ–µ–љ–љ—Л–є –ї–Њ—Б–Ї—Г—В –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ –Є—Б—В–Њ–љ—З–∞–µ—В—Б—П, –њ—А–Њ–і–Њ–ї–ґ–∞—П –≤—Л–њ–Њ–ї–љ—П—В—М —Б–≤–Њ–Є —Д—Г–љ–Ї—Ж–Є–Є.
–ѓ–Ј–≤—Л —А–Њ–≥–Њ–≤–Є—Ж—Л, –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–µ –њ–µ—А—Д–Њ—А–∞—Ж–Є–µ–є –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞, —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –њ–ї–Њ–Љ–±–Є—А–Њ–≤–∞—В—М –ї–Њ—Б–Ї—Г—В–Њ–Љ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л ¬Ђ–љ–∞ –љ–Њ–ґ–Ї–µ¬ї —Б —Д–Є–Ї—Б–∞—Ж–Є–µ–є —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –Ї–Њ–љ—Ж–∞ –ї–Њ—Б–Ї—Г—В–∞ –Ї –Ї—А–∞—П–Љ –і–µ—Д–µ–Ї—В–∞ —А–Њ–≥–Њ–≤–Є—Ж—Л.
–†—Г–±—Ж–Њ–≤—Л–є –Ї—Б–µ—А–Њ–Ј —А–Њ–≥–Њ–≤–Є—Ж—Л, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Б–ї—Г–ґ–Є—В –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ (–Є–ї–Є –Є—Б—Е–Њ–і–Њ–Љ) —А–∞–Ј–≤–Є–≤–∞—О—Й–µ–≥–Њ—Б—П –≥–ї–∞–Ј–љ–Њ–≥–Њ —А—Г–±—Ж—Г—О—Й–µ–≥–Њ –њ–µ–Љ—Д–Є–≥–Њ–Є–і–∞, –њ—Б–µ–≤–і–Њ–њ–µ–Љ—Д–Є–≥–Њ–Є–і–∞, –±—Г–ї–ї–µ–Ј–љ–Њ–≥–Њ —Н–њ–Є–і–µ—А–Љ–Њ–ї–Є–Ј–∞, –Љ—Г–ї—М—В–Є—Д–Њ—А–Љ–љ–Њ–є —Н–Ї—Б—Б—Г–і–∞—В–Є–≤–љ–Њ–є —Н—А–Є—В–µ–Љ—Л (–≤ —В. —З. –µ–µ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–∞—А–Є–∞–љ—В–∞ вАУ —Б–Є–љ–і—А–Њ–Љ–∞ –°—В–Є–≤–µ–љ—Б вАУ –Ф–ґ–Њ–љ—Б–Њ–љ–∞), —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ —Н–њ–Є–і–µ—А–Љ–∞–ї—М–љ–Њ–≥–Њ –љ–µ–Ї—А–Њ–ї–Є–Ј–∞ (—Б–Є–љ–і—А–Њ–Љ–∞ –Ы–∞–є–µ–ї–ї–∞), —В–µ—А–Љ–Є—З–µ—Б–Ї–Є—Е –Є —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –Њ–ґ–Њ–≥–Њ–≤ –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞, —В—П–ґ–µ–ї–Њ–є –њ—Б–µ–≤–і–Њ–Љ–µ–Љ–±—А–∞–љ–Њ–Ј–љ–Њ–є —Д–Њ—А–Љ—Л –∞–і–µ–љ–Њ–≤–Є—А—Г—Б–љ–Њ–≥–Њ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–Є—В–∞, —В—А–∞—Е–Њ–Љ—Л –Є –і—А.
–°–Њ–≥–ї–∞—Б–љ–Њ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Т.–Х. –®–µ–≤–∞–ї–µ–≤–∞ (1959), –≤ —Б–≤–Њ–µ–Љ —А–∞–Ј–≤–Є—В–Є–Є —А—Г–±—Ж–Њ–≤—Л–є –Ї—Б–µ—А–Њ–Ј –њ—А–Њ—Е–Њ–і–Є—В 3 —Б—В–∞–і–Є–Є [7]:
вАУ –љ–∞—З–∞–ї—М–љ—Л–є (–њ—А–µ–Ї—Б–µ—А–Њ–Ј);
вАУ —А–∞–Ј–≤–Є—В–Њ–є;
вАУ –і–∞–ї–µ–Ї–Њ –Ј–∞—И–µ–і—И–Є–є.
–Э–∞ —Д–Њ–љ–µ —А–∞–Ј–≤–Є–≤–∞—О—Й–µ–≥–Њ—Б—П —А—Г–±—Ж–Њ–≤–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–µ –µ–µ —Н–ї–∞—Б—В–Є—З–љ–Њ—Б—В—М –Є –њ–ї–Њ—Й–∞–і—М –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ —Г–Љ–µ–љ—М—И–∞—О—В—Б—П, —Б–≤–Њ–і—Л —Г–Ї–Њ—А–∞—З–Є–≤–∞—О—В—Б—П. –Ю—В–Љ–µ—З–∞–µ—В—Б—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П —А–µ–∞–Ї—Ж–Є—П –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л, –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –Ї–Њ—В–Њ—А–Њ–є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Н—В–Є–Њ–ї–Њ–≥–Є–µ–є —А—Г–±—Ж–Њ–≤–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —В–∞–Ї–ґ–µ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –Є –њ–ї–Њ—В–љ–Њ—Б—В—М —Б–µ–Ї—А–µ—В–Њ—А–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л, –њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е —Б–ї–Є–Ј—М –Є —Б–ї–µ–Ј—Г, —З—В–Њ —Г—Б–Є–ї–Є–≤–∞–µ—В –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б, –Ї–Њ—В–Њ—А—Л–є –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –і–∞–ї—М–љ–µ–є—И–µ–µ —А—Г–±—Ж–µ–≤–∞–љ–Є–µ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л.
–Т –Є—Б—Е–Њ–і–µ —А—Г–±—Ж–Њ–≤–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П —А–µ–∞–Ї—Ж–Є—П –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –Ј–∞—В—Г—Е–∞–µ—В, –Њ—В–Љ–µ—З–∞–µ—В—Б—П –≤—Л—А–∞–ґ–µ–љ–љ–∞—П —Б—Г—Е–Њ—Б—В—М –≥–ї–∞–Ј–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є, —Б–Љ–∞—З–Є–≤–∞–µ–Љ–Њ—Б—В—М –Ї–Њ—В–Њ—А–Њ–є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є ¬Ђ–Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є —Б–ї–µ–Ј—Л¬ї —А–µ–Ј–Ї–Њ –љ–∞—А—Г—И–∞–µ—В—Б—П. –Ъ—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ—П–µ—В—Б—П –Є –љ–∞ —А–Њ–≥–Њ–≤–Є—Ж—Г. –Э–∞ —Д–Њ–љ–µ —А–∞–Ј–≤–Є–≤–∞—О—Й–µ–є—Б—П –Ї–µ—А–∞—В–Њ–њ–∞—В–Є–Є –Њ—В–Љ–µ—З–∞–µ—В—Б—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –њ—Б–µ–≤–і–Њ–њ—В–µ—А–Є–≥–Є—Г–Љ–∞, –Ї–Њ—В–Њ—А—Л–є –≤ –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е —Б–ї—Г—З–∞—П—Е –Ј–∞–≤–µ—А—И–∞–µ—В—Б—П —З–∞—Б—В–Є—З–љ–Њ–є –Є–ї–Є –і–∞–ґ–µ –њ–Њ–ї–љ–Њ–є ¬Ђ–Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–µ–є¬ї —А–Њ–≥–Њ–≤–Є—Ж—Л. –°—В–µ–њ–µ–љ—М —Б–Њ—Е—А–∞–љ–љ–Њ—Б—В–Є –Ј—А–Є—В–µ–ї—М–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Б—В–µ–њ–µ–љ—М—О –њ—А–Њ–Ј—А–∞—З–љ–Њ—Б—В–Є —А–Њ–≥–Њ–≤–Є—Ж—Л.
–Ы–µ—З–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А—Г–±—Ж–Њ–≤—Л–Љ –Ї—Б–µ—А–Њ–Ј–Њ–Љ —А–Њ–≥–Њ–≤–Є—Ж—Л –њ—А–µ—Б–ї–µ–і—Г–µ—В —Ж–µ–ї—М –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Е—А–∞–љ–µ–љ–Є—П –њ—А–Њ–Ј—А–∞—З–љ–Њ—Б—В–Є —А–Њ–≥–Њ–≤–Є—Ж—Л. –Я—А–Є —Н—В–Њ–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ—Б—В—М –Њ—Б–љ–Њ–≤–љ—Л—Е —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є –≤–Њ –Љ–љ–Њ–≥–Њ–Љ —Б—Е–Њ–і–љ–∞ —Б —Г–ґ–µ —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–љ–Њ–є –≤—Л—И–µ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —А–Њ–≥–Њ–≤–Є—Ж—Л –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є.
–¶–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ —Г–≤–ї–∞–ґ–љ–µ–љ–Є–µ –≥–ї–∞–Ј–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є ¬Ђ–Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є —Б–ї–µ–Ј—Л¬ї, –Њ–±–ї–∞–і–∞—О—Й–Є–Љ–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ (—Б–Љ. —В–∞–±–ї. 1). –Э–∞ —Б—В–∞–і–Є—П—Е –љ–∞—З–∞–ї—М–љ–Њ–≥–Њ –Є —А–∞–Ј–≤–Є—В–Њ–≥–Њ –Ї—Б–µ—А–Њ–Ј–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П –Є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П, –њ—А–Њ–≤–Њ–і–Є–Љ–∞—П –њ–Њ –Є–Ј–ї–Њ–ґ–µ–љ–љ—Л–Љ –≤—Л—И–µ –њ—А–∞–≤–Є–ї–∞–Љ. –Т —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ —А—Г–±—Ж–Њ–≤—Л–є –Ї—Б–µ—А–Њ–Ј —А–Њ–≥–Њ–≤–Є—Ж—Л –Є –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ —Б–Є—Б—В–µ–Љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є, –Ї –Љ–µ—Б—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б–Љ–µ–ґ–љ—Л–µ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В—Л –њ–Њ–і–Ї–ї—О—З–∞—О—В —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–µ –ї–µ—З–µ–±–љ—Л–µ –Љ–µ—А–Њ–њ—А–Є—П—В–Є—П.
–°–њ–Њ—А–љ—Л–Љ –≤–Њ–њ—А–Њ—Б–Њ–Љ –Њ—Б—В–∞–µ—В—Б—П –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —В–∞–Ї–Є–Љ –±–Њ–ї—М–љ—Л–Љ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є –≤ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ—Г—О –њ–Њ–ї–Њ—Б—В—М –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –° –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л —П–≤–ї—П—О—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ –і–µ–є—Б—В–≤–µ–љ–љ—Л–Љ–Є –≤ —Ж–µ–ї—П—Е –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –≤ —В–Ї–∞–љ—П—Е —А–Њ–≥–Њ–≤–Є—Ж—Л, –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –Є –ґ–µ–ї–µ–Ј, —Б–µ–Ї—А–µ—В–Є—А—Г—О—Й–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є. –≠—Д—Д–µ–Ї—В —В–∞–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –±–∞–Ј–Є—А—Г–µ—В—Б—П –љ–∞ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–Є –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–∞–Љ–Є –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –њ—А–Њ–і—Г–Ї—Ж–Є–Є –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ –Є —Е–µ–Љ–Њ–Ї–Є–љ–Њ–≤, —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –∞–њ–Њ–њ—В–Њ–Ј–∞ –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤, —Б–љ–Є–ґ–µ–љ–Є–Є —Б–Є–љ—В–µ–Ј–∞ –Љ–∞—В—А–Є—З–љ—Л—Е –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–∞–Ј (–Ь–Ь–Я-9), –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤, —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –ґ–µ–ї–∞—В–Є–љ–∞–Ј—Л –≤ —Н–њ–Є—В–µ–ї–Є–Є —А–Њ–≥–Њ–≤–Є—Ж—Л –Є –і—А. [15, 18]. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і—Л —Б–љ–Є–ґ–∞—О—В –Є–ї–Є –≤–Њ–≤—Б–µ –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞—О—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –і–µ—Б–Ї–≤–∞–Љ–∞—Ж–Є–Є —Н–њ–Є—В–µ–ї–Є—П —А–Њ–≥–Њ–≤–Є—Ж—Л, —Б–Њ—Е—А–∞–љ—П—П –µ–≥–Њ –≥–ї–∞–і–Ї–Њ—Б—В—М –Є –±–∞—А—М–µ—А–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О [18]. –Т –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ, –Њ–±–ї–∞–і–∞—П –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ, –≤ —В. —З. –∞–љ—В–Є–њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ—Л–Љ, —Н—Д—Д–µ–Ї—В–Њ–Љ, —Н—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –њ—А–µ–њ—П—В—Б—В–≤—Г—О—В –Є–Ј–±—Л—В–Њ—З–љ–Њ–Љ—Г —А—Г–±—Ж–µ–≤–∞–љ–Є—О –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –Є –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–Є —А–Њ–≥–Њ–≤–Є—Ж—Л. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Є—Е –і–ї–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ј–∞—З–∞—Б—В—Г—О —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Є—Б—В–Њ–љ—З–µ–љ–Є–µ–Љ –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Є –Є–Ј–Љ–µ–љ–µ–љ–љ–Њ–є —А–Њ–≥–Њ–≤–Є—Ж—Л, –≤ —В. —З. —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–° —Г—З–µ—В–Њ–Љ —Н—В–Є—Е –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤ –љ–∞–Ј–љ–∞—З–∞—В—М –Њ—Д–Є—Ж–Є–љ–∞–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б —А—Г–±—Ж–Њ–≤—Л–Љ –Ї—Б–µ—А–Њ–Ј–Њ–Љ —А–Њ–≥–Њ–≤–Є—Ж—Л, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–Љ—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П (–≤ —Д–∞–Ј–∞—Е –љ–∞—З–∞–ї—М–љ–Њ–≥–Њ –Є —А–∞–Ј–≤–Є—В–Њ–≥–Њ –Ї—Б–µ—А–Њ–Ј–∞), —Б–ї–µ–і—Г–µ—В –ї–Є—И—М –њ—А–Є –µ–µ –њ–Њ–ї–љ–Њ–є —Н–њ–Є—В–µ–ї–Є–Ј–∞—Ж–Є–Є. –Э–µ–Њ–±—Е–Њ–і–Є–Љ —Б—В—А–Њ–≥–Є–є –Ї–Њ–љ—В—А–Њ–ї—М –Ј–∞ —В–Њ–ї—Й–Є–љ–Њ–є —А–Њ–≥–Њ–≤–Є—Ж—Л –≤ —Е–Њ–і–µ –ї–µ—З–µ–љ–Є—П. –Т –њ—А–Њ—З–Є—Е —Б–Є—В—Г–∞—Ж–Є—П—Е (–Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ —Б–ї—Г—З–∞–µ–≤ –Њ–±—И–Є—А–љ–Њ–є –і–µ—Н–њ–Є—В–µ–ї–Є–Ј–∞—Ж–Є–Є —А–Њ–≥–Њ–≤–Є—Ж—Л –Є–ї–Є –µ–µ –Є–Ј—К—П–Ј–≤–ї–µ–љ–Є—П) —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –Њ–≥—А–∞–љ–Є—З–Є—В—М—Б—П –Є–љ—Б—В–Є–ї–ї—П—Ж–Є—П–Љ–Є –≤ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ—Г—О –њ–Њ–ї–Њ—Б—В—М —А–∞—Б—В–≤–Њ—А–∞ –і–µ–Ї—Б–∞–Љ–µ—В–∞–Ј–Њ–љ–∞ –љ–Є–Ј–Ї–Њ–є (0,01%) –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є. –Я—А–Є—З–µ–Љ –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М —Н—В–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–ї—Г—З—И–∞–µ—В—Б—П –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ —А–∞—Б—В–≤–Њ—А–Є—В–µ–ї—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ 6% —А–∞—Б—В–≤–Њ—А–∞ –њ–Њ–ї–Є–≤–Є–љ–Є–ї–њ–Є—А—А–Њ–ї–Є–і–Њ–љ–∞ (–њ—А–µ–њ–∞—А–∞—В –≥–µ–Љ–Њ–і–µ–Ј) [1].
–Э–∞—И –Љ–љ–Њ–≥–Њ–ї–µ—В–љ–Є–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Г–њ–Њ–Љ—П–љ—Г—В–Њ–≥–Њ –≤—Л—И–µ –њ—А–µ–њ–∞—А–∞—В–∞ –Ф–µ–Ї—Б–∞–≥–µ–Љ–Њ–і–µ–Ј –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –µ–≥–Њ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є –±–Њ–ї—М–љ—Л–Љ —Б –°–°–У, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–Љ—Б—П –і–∞–ґ–µ –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є —А–∞–Ј–і—А–∞–ґ–µ–љ–Є—П –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞ –ї–Є–±–Њ —Д–Њ–ї–ї–Є–Ї—Г–ї–µ–Ј–∞ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л. –Ю–±–ї–∞–і–∞—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ (–Ј–∞ —Б—З–µ—В 0,01% –і–µ–Ї—Б–∞–Љ–µ—В–∞–Ј–Њ–љ–∞), –њ—А–µ–њ–∞—А–∞—В –Є–Љ–µ–µ—В —Б–≤–Њ–є—Б—В–≤–∞ ¬Ђ–Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є —Б–ї–µ–Ј—Л¬ї (6% –њ–Њ–ї–Є–≤–Є–љ–Є–ї–њ–Є—А—А–Њ–ї–Є–і–Њ–љ), –Њ–Ї–∞–Ј—Л–≤–∞—П –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В.
–Я–∞—А–µ–љ—Е–Є–Љ–∞—В–Њ–Ј–љ—Л–є –Ї—Б–µ—А–Њ–Ј —Б –Є—Б—Е–Њ–і–Њ–Љ –≤ –Ї–µ—А–∞—В–Њ–Љ–∞–ї—П—Ж–Є—О —П–≤–ї—П–µ—В—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —А–µ–і–Ї–Њ–є —Д–Њ—А–Љ–Њ–є –Ї—А–∞–є–љ–µ —В—П–ґ–µ–ї–Њ–≥–Њ —А–Њ–≥–Њ–≤–Є—З–љ–Њ-–Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–≥–Њ –Ї—Б–µ—А–Њ–Ј–∞. –Т –Њ—Б–љ–Њ–≤–µ –µ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П –ї–µ–ґ–Є—В –љ–∞—А—Г—И–µ–љ–Є–µ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –њ—А–µ—А–Њ–≥–Њ–≤–Є—З–љ–Њ–є —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є –Є–Ј-–Ј–∞ –і–µ—Д–Є—Ж–Є—В–∞ –Љ—Г—Ж–Є–љ–Њ–≤–Њ–≥–Њ –њ–Њ–Ї—А—Л—В–Є—П –≥–ї–∞–Ј–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є. –І–∞—Й–µ –≤—Б–µ–≥–Њ –Њ–љ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –љ–∞ –њ–Њ—З–≤–µ —Б–Є—Б—В–µ–Љ–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –≤–Є—В–∞–Љ–Є–љ–∞ –Р, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–µ–≥–Њ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є—О –±–Њ–Ї–∞–ї–Њ–≤–Є–і–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л [9, 36].
–Я–∞—А–µ–љ—Е–Є–Љ–∞—В–Њ–Ј–љ—Л–є –Ї—Б–µ—А–Њ–Ј —А–Њ–≥–Њ–≤–Є—Ж—Л –Њ–±—Л—З–љ–Њ —Б–ї–µ–і—Г–µ—В –њ–Њ—Б–ї–µ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–≥–Њ. –Я–Њ–≤–µ—А—Е–љ–Њ—Б—В—М —А–Њ–≥–Њ–≤–Є—Ж—Л –њ—А–Є–Њ–±—А–µ—В–∞–µ—В ¬Ђ—И–∞–≥—А–µ–љ–µ–≤—Л–є¬ї –≤–Є–і, —В–µ—А—П–µ—В –±–ї–µ—Б–Ї –Є —В–∞–Ї—В–Є–ї—М–љ—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М. –†–∞–Ј–≤–Є–≤–∞—О—Й–∞—П—Б—П –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є—П –Ї–ї–µ—В–Њ–Ї —Б—В—А–Њ–Љ—Л —А–Њ–≥–Њ–≤–Є—Ж—Л –њ—А–Є–≤–Њ–і–Є—В –Ї –µ–µ –њ–Њ–Љ—Г—В–љ–µ–љ–Є—О, –Є–Љ–µ—О—Й–µ–Љ—Г —Б–Є–љ–µ–≤–∞—В–Њ-–Љ–Њ–ї–Њ—З–љ—Л–є –Њ—В—В–µ–љ–Њ–Ї. –Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е –≤ –њ–µ—А–µ–і–љ–µ–є –Ї–∞–Љ–µ—А–µ –њ–Њ—П–≤–ї—П–µ—В—Б—П –∞—Б–µ–њ—В–Є—З–µ—Б–Ї–Є–є –≥–Є–њ–Њ–њ–Є–Њ–љ. –Ф–∞–ї—М–љ–µ–є—И–µ–µ –љ–µ—Г–Ї–ї–Њ–љ–љ–Њ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ —А–Њ–≥–Њ–≤–Є—З–љ–Њ-–Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–≥–Њ –Ї—Б–µ—А–Њ–Ј–∞, –њ—А–Њ—В–µ–Ї–∞—О—Й–µ–≥–Њ –љ–∞ —Д–Њ–љ–µ –і–µ—Д–Є—Ж–Є—В–∞ –Љ—Г—Ж–Є–љ–Њ–≤ —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є, –Љ–Њ–ґ–µ—В –Њ—Б–ї–Њ–ґ–љ–Є—В—М—Б—П –Ї–µ—А–∞—В–Њ–Љ–∞–ї—П—Ж–Є–µ–є вАУ —Б–Ї–Њ—А–Њ—В–µ—З–љ—Л–Љ —А–∞–Ј–ґ–Є–ґ–∞—О—Й–Є–Љ –љ–µ–Ї—А–Њ–Ј–Њ–Љ –Њ—В–і–µ–ї—М–љ—Л—Е —Б–ї–Њ–µ–≤ –Є–ї–Є –і–∞–ґ–µ –≤—Б–µ–є —В–Њ–ї—Й–Є —А–Њ–≥–Њ–≤–Є—Ж—Л. –Т —В–∞–Ї–Є—Е —Б–ї—Г—З–∞—П—Е —А–Њ–≥–Њ–≤–Є—Ж–∞ —Б—В—А–µ–Љ–Є—В–µ–ї—М–љ–Њ ¬Ђ—В–∞–µ—В¬ї, –њ—А–µ–≤—А–∞—Й–∞—П—Б—М –≤ –Љ—Г—В–љ—Г—О —Б—В—Г–і–µ–љ–Є—Б—В—Г—О –Љ–∞—Б—Б—Г —Б–≤–µ—В–ї–Њ-–ґ–µ–ї—В–Њ–≤–∞—В–Њ–≥–Њ —Ж–≤–µ—В–∞, –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±—Л—Б—В—А–Њ –Є—Б—В–Њ–љ—З–∞–µ—В—Б—П –Є –њ–µ—А—Д–Њ—А–Є—А—Г–µ—В.
–Ы–µ—З–µ–љ–Є–µ —Н—В–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ—Б—А–µ–і–Њ—В–Њ—З–µ–љ–Њ –љ–∞ –≤–Њ—Б–њ–Њ–ї–љ–µ–љ–Є–Є –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ –Р –њ—Г—В–µ–Љ –Ї–∞–Ї —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –µ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П, —В–∞–Ї –Є –Љ–µ—Б—В–љ–Њ–≥–Њ вАУ —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –∞–њ–њ–ї–Є–Ї–∞—Ж–Є—П–Љ–Є –≤ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ—Г—О –њ–Њ–ї–Њ—Б—В—М –≥–µ–ї—П –Т–Є—В–Р-–Я–Њ—Б. –£–Љ–µ—Б—В–љ—Л –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є —Б–ї–µ–Ј–Њ–Ј–∞–Љ–µ–љ–Є—В–µ–ї–µ–є —Б –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є (—Б–Љ. —В–∞–±–ї. 1), –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П (–Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤), –њ—А–Њ—В–Є–≤–Њ—Д–µ—А–Љ–µ–љ—В–љ–∞—П –Є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П.
–Т —Ж–µ–ї–Њ–Љ –ї–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —А–Њ–≥–Њ–≤–Є—Ж—Л –Ї—Б–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –љ–µ–њ—А–Њ—Б—В—Г—О –Ј–∞–і–∞—З—Г. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –≤—Л–±–Њ—А –њ—А–µ–њ–∞—А–∞—В–Њ–≤ ¬Ђ–Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є —Б–ї–µ–Ј—Л¬ї, –≤ —Б–Њ—Б—В–∞–≤ –Ї–Њ—В–Њ—А—Л—Е –≤—Е–Њ–і—П—В –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л–µ –Є–љ–≥—А–µ–і–Є–µ–љ—В—Л, –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е, –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ—Л—Е –Є –і—А—Г–≥–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б–Њ–Ј–і–∞–µ—В —А–µ–∞–ї—М–љ—Л–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Ї–∞–Ї –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П —В–∞–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Ї—Б–µ—А–Њ–Ј–∞, —В–∞–Ї –Є –Є—Е —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є. –≠—В–Є –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–∞ —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В –Ї –∞–Ї—В–Є–≤–љ–Њ–Љ—Г –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –±–Њ–ї—М–љ—Л–Љ —Б –Ї—Б–µ—А–Њ–Ј–Њ–Љ —А–Њ–≥–Њ–≤–Є—Ж—Л —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–љ—Л—Е –≤—Л—И–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Є —Б–Ї–Њ—А–µ–є—И–µ–Љ—Г –≤–љ–µ–і—А–µ–љ–Є—О –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Њ–≤ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤, —А–∞–Ј—А–∞–±–∞—В—Л–≤–∞–µ–Љ—Л—Е –Ї—А—Г–њ–љ–µ–є—И–Є–Љ–Є —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Є–Љ–Є —Д–Є—А–Љ–∞–Љ–Є –Љ–Є—А–∞, вАУ —Б –і—А—Г–≥–Њ–є.








.gif)



