–Т–≤–µ–і–µ–љ–Є–µ
–Э–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –і–µ—Б—П—В–Є–ї–µ—В–Є–є –њ–Њ–≤—Л—И–µ–љ–љ–Њ–µ –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ (–Т–У–Ф) –њ—А–Є–Ј–љ–∞–≤–∞–ї–Њ—Б—М –≤–µ–і—Г—Й–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–є –Њ–њ—В–Є–Ї–Њ–љ–µ–є—А–Њ–њ–∞—В–Є–Є (–У–Ю–Э) [1вАУ3]. –Ю–і–љ–∞–Ї–Њ –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –Є–Љ–µ–µ—В—Б—П –љ–µ–Љ–∞–ї–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–є —В–Њ–Љ—Г, —З—В–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –Љ–Њ–ґ–µ—В –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞—В—М –Є –њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ –Т–У–Ф [4]. –°—А–µ–і–Є –њ—А–Њ—З–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –У–Ю–Э —Г–њ–Њ–Љ–Є–љ–∞—О—В—Б—П –≤–Њ–Ј—А–∞—Б—В [5, 6], –њ–Њ–ї [7, 8], —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞-–љ–Є—П [9, 10], –±–ї–Є–Ј–Њ—А—Г–Ї–Њ—Б—В—М [11], —А–∞—Б–∞ [8, 12], –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –±–µ—В–∞-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–µ—Б—В–љ–Њ–≥–Њ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П [13], –±–Є–Њ–Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ —А–Њ–≥–Њ–≤–Є—Ж—Л [14, 15]. –°–ї–µ–і—Г–µ—В, –Њ–і–љ–∞–Ї–Њ, –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –≤–ї–Є—П–љ–Є—П –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ –љ–∞ —В–µ—З–µ–љ–Є–µ –У–Ю–Э —Б—Г—Й–µ—Б—В–≤—Г—О—В —А–∞–Ј–љ—Л–µ —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П. –Ґ–∞–Ї, –µ—Б–ї–Є –і–Њ –љ–µ–і–∞–≤–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –±–Њ–ї—М—И–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ —Г–і–µ–ї—П–ї–Њ—Б—М —Б–≤—П–Ј–Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є —В–Њ–ї—Й–Є–љ—Л —А–Њ–≥–Њ–≤–Є—Ж—Л (–¶–Ґ–†) —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [16], —В–Њ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–∞ –њ–µ—А–≤—Л–є –њ–ї–∞–љ –≤—Л—Е–Њ–і–Є—В —В–∞–Ї–Њ–є –њ–∞—А–∞–Љ–µ—В—А, –Ї–∞–Ї –Ї–Њ—А–љ–µ–∞–ї—М–љ—Л–є –≥–Є—Б—В–µ—А–µ–Ј–Є—Б (–Ъ–У), –Њ—В—А–∞–ґ–∞—О—Й–Є–є –≤—П–Ј–Ї–Њ—Н–ї–∞—Б—В–Є—З–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ —А–Њ–≥–Њ–≤–Є—Ж—Л [1]. –Т –ї–Є—В–µ—А–∞—В—Г—А–µ –Љ—Л –љ–µ –≤—Б—В—А–µ—В–Є–ї–Є –љ–Є –Њ–і–љ–Њ–є —А–∞–±–Њ—В—Л, –≤ –Ї–Њ—В–Њ—А–Њ–є –±—Л —А–Њ–ї—М –Ъ–У –≤ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–Є –У–Ю–Э –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –і—А—Г–≥–Є–Љ–Є –Љ–Њ—А—Д–Њ—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ–Є
–њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є.
–¶–µ–ї—М: –Њ–њ—А–µ–і–µ–ї–Є—В—М —А–Њ–ї—М –Ъ–У –Ї–∞–Ї –њ—А–µ–і–Є–Ї—В–Њ—А–∞ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –У–Ю–Э –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Љ–Њ—А—Д–Њ—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Ф–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–Њ—Б–Є—В —Е–∞—А–∞–Ї—В–µ—А —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї–Њ–≥–Њ—А—В–љ–Њ–≥–Њ. –° —Ж–µ–ї—М—О –њ—А–Њ–≤–µ–і–µ–љ–Є—П –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В—Л –Є–Ј 2 —В—Л—Б. –љ–∞–±–ї—О–і–∞–µ–Љ—Л—Е –≤ –¶–µ–љ—В—А–µ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є –§–Ь–С–Р –±–Њ–ї—М–љ—Л—Е —Б –њ–µ—А–≤–Є—З–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є –і–ї—П –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ–Њ –±—Л–ї–Њ –Њ—В–Њ–±—А–∞–љ–Њ 128 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (173 –≥–ї–∞–Ј–∞): 78 –±–Њ–ї—М–љ—Л—Е (108 –≥–ї–∞–Ј) —Б–Њ —Б—В–∞–±–Є–ї—М–љ—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –У–Ю–Э (–≥—А—Г–њ–њ–∞ 1) –Є 50 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (65 –≥–ї–∞–Ј) —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (–≥—А—Г–њ–њ–∞ 2).–Ъ—А–Є—В–µ—А–Є—П–Љ–Є –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —П–≤–ї—П–ї–Є—Б—М: –Я–Ю–£–У, –Я–Ч–£–У –њ–Њ—Б–ї–µ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –ї–∞–Ј–µ—А–љ–Њ–є –Є—А–Є–і–Њ—В–Њ–Љ–Є–Є (–Я–Ы–Ш–Ґ) –љ–∞—З–∞–ї—М–љ–Њ–є, —Г–Љ–µ—А–µ–љ–љ–Њ–є —Б—В–∞–і–Є–є, c—Д–µ—А–Њ—Н–Ї–≤–Є–≤–∞–ї–µ–љ—В <6,0 –і–њ—В—А., –∞—Б—В–Є–≥–Љ–∞—В–Є–Ј–Љ <2,0, –Њ—В–Ї—А—Л—В—Л–є —Г–≥–Њ–ї –њ–µ—А–µ–і–љ–µ–є
–Ї–∞–Љ–µ—А—Л (–£–Я–Ъ) вАФ –љ–µ –Љ–µ–љ–µ–µ 30¬∞, –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Њ—А–≥–∞–љ–∞ –Ј—А–µ–љ–Є—П.
–Ъ—А–Є—В–µ—А–Є—П–Љ–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П —П–≤–ї—П–ї–Є—Б—М: –≥–ї–∞—Г–Ї–Њ–Љ–∞ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, –њ–Є–≥–Љ–µ–љ—В–љ–∞—П –≥–ї–∞—Г–Ї–Њ–Љ–∞, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ—А–Њ–Ј—А–∞—З–љ—Л–µ –Њ–њ—В–Є—З–µ—Б–Ї–Є–µ —Б—А–µ–і—Л –≥–ї–∞–Ј–∞, –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Г—Б—В–Њ–є—З–Є–≤–Њ–є —Д–Є–Ї—Б–∞—Ж–Є–Є, –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л–є –Љ–Є–Њ–Ј, c—Д–µ—А–Њ—Н–Ї–≤–Є–≤–∞–ї–µ–љ—В
>6,0 –і–њ—В—А., –∞—Б—В–Є–≥–Љ–∞—В–Є–Ј–Љ >2,0 –і–њ—В—А., –љ–Є–Ј–Ї–Њ–µ –Ї–∞—З–µ—Б—В–≤–Њ —Б–љ–Є–Љ–Ї–∞ –і–Є—Б–Ї–∞ –Ј—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –љ–µ—А–≤–∞ (–Ф–Ч–Э), –Љ–µ–љ–µ–µ 5 –њ—А–Њ—В–Њ–Ї–Њ–ї–Њ–≤ –њ–µ—А–Є–Љ–µ—В—А–Є–Є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ—Л–µ –Њ–њ–µ—А–∞—Ж–Є–Є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ —Б–Є—Б—В–µ–Љ–љ—Л–µ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В, –±–Њ–ї–µ–Ј–љ—М –Я–∞—А–Ї–Є–љ—Б–Њ–љ–∞, –±–Њ–ї–µ–Ј–љ—М –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞, –і–µ–Љ–µ–љ—Ж–Є—П.
–°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –±–Њ–ї—М–љ—Л—Е —Б–Њ—Б—В–∞–≤–Є–ї 68 –ї–µ—В (44вАУ88). –С–Њ–ї—М–љ—Л–µ —Б –≤–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ–љ—Л–Љ–Є –Я–Ю–£–У –Є –Я–Ч–£–У –Є –њ—Б–µ–≤–і–Њ—Н–Ї—Б—Д–Њ–ї–Є–∞—В–Є–≤–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є (–Я–≠–У) –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –њ–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ –≤ —В–µ—З–µ–љ–Є–µ 7 –ї–µ—В.
–Ф–Є–∞–≥–љ–Њ–Ј –≥–ї–∞—Г–Ї–Њ–Љ—Л –±—Л–ї –њ–Њ—Б—В–∞–≤–ї–µ–љ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Ф–Ч–Э, –≤—Л—П–≤–ї—П–µ–Љ—Л—Е –њ—А–Є –Њ—Д—В–∞–ї—М–Љ–Њ—Б–Ї–Њ–њ–Є–Є (–њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–µ –Њ—В –љ–Њ—А–Љ—Л –њ—А–Њ–њ–Њ—А—Ж–Є–є –љ–µ–≤—А–∞–ї—М–љ–Њ–≥–Њ –Њ–±–Њ–і–Ї–∞, –≥–ї–∞—Г–Ї–Њ–Љ–љ–∞—П —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є—П –Ф–Ч–Э, –њ–µ—А–Є–њ–∞–њ–Є–ї–ї—П—А–љ–∞—П –∞—В—А–Њ—Д–Є—П, –Ї–ї–Є–љ–Њ–≤–Є–і–љ—Л–µ –і–µ—Д–µ–Ї—В—Л –≤ —Б–ї–Њ–µ –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ —Б–µ—В—З–∞—В–Ї–Є, –њ—А–Є–Љ—Л–Ї–∞—О—Й–Є–µ –Ї –Ї—А–∞—О –Ф–Ч–Э, –≥–µ–Љ–Њ—А—А–∞–≥–Є–Є –њ–Њ –Ї—А–∞—О –Ф–Ч–Э), –њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞, –≤—Л—Е–Њ–і—П—Й–Є—Е –Ј–∞ –њ—А–µ–і–µ–ї—Л –љ–Њ—А–Љ—Л —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –∞–≤—В–Њ–Љ–∞—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є –њ–µ—А–Є–Љ–µ—В—А–Є–Є (–°–Р–Я).
–Т–Њ –≤—А–µ–Љ—П –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –Є–Ј–Љ–µ—А–µ–љ–Є–µ —Д–ї—Г–Ї—В—Г–∞—Ж–Є–Є –Т–У–Ф, –∞ —В–∞–Ї–ґ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –њ–Є–Ї–Њ–≤ –Т–У–Ф –≤ —В–µ—З–µ–љ–Є–µ —Б—Г—В–Њ–Ї.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–µ–і–µ–љ–Њ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —Н—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Є–љ—Ж–Є–њ–∞–Љ–Є, –Ј–∞–ї–Њ–ґ–µ–љ–љ—Л–Љ–Є –•–µ–ї—М—Б–Є–љ–Ї—Б–Ї–Њ–є –і–µ–Ї–ї–∞—А–∞—Ж–Є–µ–є –Є –Њ—В—А–∞–ґ–µ–љ–љ—Л–Љ–Є –≤ –њ—А–∞–≤–Є–ї–∞—Е –Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є (GCP) –Є –љ–Њ—А–Љ–∞—В–Є–≤–љ—Л—Е —В—А–µ–±–Њ–≤–∞–љ–Є—П—Е. –Я—А–Њ—В–Њ–Ї–Њ–ї –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г—В–≤–µ—А–ґ–і–µ–љ —Н—В–Є—З–µ—Б–Ї–Є–Љ –Ї–Њ–Љ–Є—В–µ—В–Њ–Љ –§–У–С–£ –У–Э–¶ –§–Ь–С–¶ –Є–Љ. –Р.–Ш. –С—Г—А–љ–∞–Ј—П–љ–∞ –§–Ь–С–Р –†–Њ—Б—Б–Є–Є.
–Ю–±—К–µ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–Ї–ї—О—З–∞–ї –≤ —Б–µ–±—П –Є–Ј–Љ–µ—А–µ–љ–Є–µ
—А–Њ–≥–Њ–≤–Є—З–љ–Њ-–Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, –Ъ–У –Є —Д–∞–Ї—В–Њ—А–∞ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —А–Њ–≥–Њ–≤–Є—Ж—Л –љ–∞ –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–µ –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ —А–Њ–≥–Њ–≤–Є—Ж—Л ORA (USA). –Ґ–∞–Ї–ґ–µ –≤—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –≤—Л–њ–Њ–ї–љ—П–ї–Є—Б—М –∞–≤—В–Њ—А–µ—Д—А–∞–Ї—В–Њ–Љ–µ—В—А–Є—П, –≤–Є–Ј–Њ–Љ–µ—В—А–Є—П, –≥–Њ–љ–Є–Њ—Б–Ї–Њ–њ–Є—П, –Њ–њ—В–Є—З–µ—Б–Ї–∞—П –Ї–Њ–≥–µ—А–µ–љ—В–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П (–Ю–Ъ–Ґ вАФ –њ—А–Њ—В–Њ–Ї–Њ–ї GCC, ONH), –≤–Ї–ї—О—З–∞—П –Ю–Ъ–Ґ –њ–µ—А–µ–і–љ–µ–≥–Њ –Њ—В—А–µ–Ј–Ї–∞ –≥–ї–∞–Ј–∞ c –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ —А–∞–Ј–Љ–µ—А–Њ–≤ –£–Я–Ъ –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≥–∞–љ–≥–ї–Є–Њ–Ј–љ–Њ–≥–Њ —Б–ї–Њ—П —Б–µ—В—З–∞—В–Ї–Є —Б –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ —В–Њ–ї—Й–Є–љ—Л –≥–∞–љ–≥–ї–Є–Њ–Ј–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ (GCC) –Є –µ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї: –Њ–±—К–µ–Љ–∞ –≥–ї–Њ–±–∞–ї—М–љ—Л—Е (GLV) –Є —Д–Њ–Ї–∞–ї—М–љ—Л—Е –µ–≥–Њ –њ–Њ—В–µ—А—М (FLV) –љ–∞ –њ—А–Є–±–Њ—А–µ Optovue, –°A, –њ–∞—Е–Є–Љ–µ—В—А–Є—П (SP-100, –У–µ—А–Љ–∞–љ–Є—П), –±–Є–Њ–Љ–µ—В—А–Є—П (Lenstar LS 900, Haag-Streit Diagnostics, –®–≤–µ–є—Ж–∞—А–Є—П). –Я—А–Њ–≤–Њ–і–Є–ї–Є —В–∞–Ї–ґ–µ —Б—В–∞–љ–і–∞—А—В–љ—Г—О –∞–≤—В–Њ–Љ–∞—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Г—О –њ–µ—А–Є–Љ–µ—В—А–Є—О –њ–Њ –њ—А–Њ–≥—А–∞–Љ–Љ–µ 24-2 SITA Standard (Humphrey Field Analyzer), –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Ф–Ч–Э —Б –µ–≥–Њ —Д–Њ—В–Њ–≥—А–∞—Д–Є—А–Њ–≤–∞–љ–Є–µ–Љ (Visucam 500, –У–µ—А–Љ–∞–љ–Є—П).
–С–Њ–ї—М—И–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ —Г–і–µ–ї—П–ї–Њ—Б—М –Ї–∞—З–µ—Б—В–≤—Г –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –њ—А–Њ—В–Њ–Ї–Њ–ї–Њ–≤. –Ґ–∞–Ї, –Є—Б–Ї–ї—О—З–∞–ї–Є –њ—А–Њ—В–Њ–Ї–Њ–ї—Л —Б –њ–Њ—В–µ—А–µ–є —Д–Є–Ї—Б–∞—Ж–Є–Є –±–Њ–ї–µ–µ 30%, –ї–Њ–ґ–љ–Њ–љ–µ–≥–∞—В–Є–≤–љ—Л–Љ–Є –Њ—И–Є–±–Ї–∞–Љ–Є, –∞ —В–∞–Ї–ґ–µ –±–Њ–ї–µ–µ 15% –ї–Њ–ґ–љ–Њ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤. –Я—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –У–Ю–Э –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –њ–Њ –і–∞–љ–љ—Л–Љ –њ–µ—А–Є–Љ–µ—В—А–Є–Є, –∞ –Є–Љ–µ–љ–љ–Њ –њ–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—О –Є–љ–і–µ–Ї—Б–∞ –њ–Њ–ї—П –Ј—А–µ–љ–Є—П (VFI, Visual Field Index), –Ї–Њ—В–Њ—А—Л–є –Њ—В—А–∞–ґ–∞–µ—В –њ–Њ—В–µ–љ—Ж–Є–∞–ї –њ–Њ–ї—П –Ј—А–µ–љ–Є—П –≤ –њ—А–Њ—Ж–µ–љ—В–љ–Њ–Љ –≤—Л—А–∞–ґ–µ–љ–Є–Є [17, 18]. –°–Ї–Њ—А–Њ—Б—В—М –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П (ROP, –і–С/–≥–Њ–і) –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –њ–Њ –і–∞–љ–љ—Л–Љ GPA (Glaucoma Progression Analysis) –Љ–µ—В–Њ–і–Њ–Љ –°–Р–Я [19], –њ—А–Є —Н—В–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–≤–µ—В–Њ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Њ–њ—А–µ–і–µ–ї—П–ї–Њ—Б—М –Ї–∞–Ї ¬Ђ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–µ¬ї (possible progression) –Є –Ї–∞–Ї ¬Ђ–≤–µ—А–Њ—П—В–љ–Њ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ¬ї (likely progression), –∞ —А–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї—Б—П –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Є–Љ–µ—О—Й–Є—Е—Б—П –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ –і–≤—Г—Е –±–∞–Ј–Њ–≤—Л—Е —В–µ—Б—В–Њ–≤. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –њ–Њ–≤—В–Њ—А–љ—Л–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –Ї–∞–ґ–і—Л–µ –њ–Њ–ї–≥–Њ–і–∞. –Т –Њ–±—Й–µ–є —Б–ї–Њ–ґ–љ–Њ—Б—В–Є –Ј–∞ –≤–µ—Б—М –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П –±—Л–ї–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–Њ –љ–µ –Љ–µ–љ–µ–µ 14 –њ–µ—А–Є–Љ–µ—В—А–Є–є —Г –Ї–∞–ґ–і–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞.
–° —Ж–µ–ї—М—О –Њ—В–Ї—А—Л—В–Є—П —Г–≥–ї–∞ –њ–µ—А–µ–і–љ–µ–є –Ї–∞–Љ–µ—А—Л –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –Я–Ч–£–У –њ–µ—А–≤—Л–Љ —Н—В–∞–њ–Њ–Љ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –Я–Ы–Ш–Ґ.
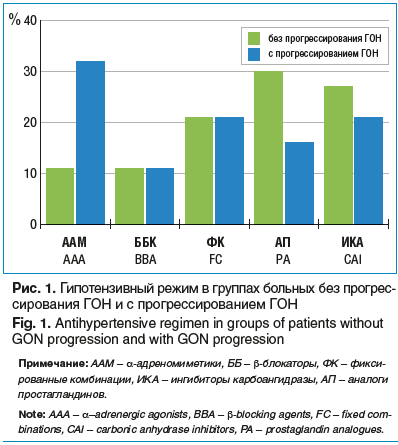
–Т—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —Ж–µ–ї—М—О –љ–∞–Ј–љ–∞—З–∞–ї–Є—Б—М –Љ–µ—Б—В–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (—А–Є—Б. 1) –Є/–Є–ї–Є –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М —Б–µ–ї–µ–Ї—В–Є–≤–љ–∞—П –ї–∞–Ј–µ—А–љ–∞—П —В—А–∞–±–µ–Ї—Г–ї–Њ–њ–ї–∞—Б—В–Є–Ї–∞. –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –≤–ї–Є—П–љ–Є—П –≤–Є–і–∞ –Љ–µ—Б—В–љ–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞ —Е–∞—А–∞–Ї—В–µ—А —В–µ—З–µ–љ–Є—П –У–Ю–Э —Г—З–Є—В—Л–≤–∞–ї–Є —В–µ –≥—А—Г–њ–њ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –љ–∞–Ј–љ–∞—З–∞–ї–Є—Б—М –≤ –њ–µ—А–Є–Њ–і –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ —Б—А–Њ–Ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П (–±–Њ–ї–µ–µ –њ–Њ–ї–Њ–≤–Є–љ—Л) –≤ –Ї–∞–ґ–і–Њ–Љ –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–Љ —Б–ї—Г—З–∞–µ, –≤ —В. —З. –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е 3 –ї–µ—В.
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ –і–∞–љ–љ—Л—Е. –Ф–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П –≥—А—Г–њ–њ –±–Њ–ї—М–љ—Л—Е –љ–µ –њ–Њ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ –≤—Л–±–Њ—А–Ї–∞–Љ, –∞ –њ–Њ –њ–Њ–ї–љ—Л–Љ –і–∞–љ–љ—Л–Љ –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М –Љ–µ—В–Њ–і—Л, —Г—З–Є—В—Л–≤–∞—О—Й–Є–µ –Ї–Њ—А—А–µ–ї—П—Ж–Є—О –љ–∞–±–ї—О–і–µ–љ–Є–є –і–ї—П –њ–∞—А–љ—Л—Е –≥–ї–∞–Ј. –Я—А–Є–Љ–µ–љ—П–ї–Є –Њ–±–Њ–±—Й–µ–љ–Є–µ Rosner вАФ Glynn вАФ Lee –Є –Ї—А–Є—В–µ—А–Є–є —А–∞–љ–≥–Њ–≤—Л—Е —Б—Г–Љ–Љ Mann вАФ Whitney вАФ Wilcoxon –≤ —Б–ї—Г—З–∞—П—Е –Ї–ї–∞—Б—В–µ—А–Є–Ј–Њ–≤–∞–љ–љ—Л—Е –љ–∞–±–ї—О–і–µ–љ–Є–є; –Њ–±–Њ–±—Й–µ–љ–Є–µ Obuchowski –Њ—Ж–µ–љ–Ї–Є AUC (–Њ—Ж–µ–љ–Ї–∞ –њ–ї–Њ—Й–∞–і–Є –њ–Њ–і —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є—З–µ—Б–Ї–Њ–є ROC-–Ї—А–Є–≤–Њ–є) –љ–∞ —Б–ї—Г—З–∞–є –Ї–ї–∞—Б—В–µ—А–Є–Ј–Њ–≤–∞–љ–љ—Л—Е –љ–∞–±–ї—О–і–µ–љ–Є–є. –Ф–ї—П –≤—Л—З–Є—Б–ї–µ–љ–Є—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М –њ–∞–Ї–µ—В—Л clusrank, Exact —П–Ј—Л–Ї–∞ R –Є –њ—А–Њ–≥—А–∞–Љ–Љ–∞ funcs clustered ROC.R. Cutoff score —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї—Б—П –љ–∞ –Њ—Б–љ–Њ–≤–µ YoudenвАЩs index (MedCalc, –≤–µ—А—Б–Є—П 11.5.1). –І–Є—Б–ї–Њ–≤—Л–µ –і–∞–љ–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –Ї–∞–Ї —Б—А–µ–і–љ–µ–µ ¬± SD. –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ –њ–∞–Ї–µ—В–∞ –њ—А–Њ–≥—А–∞–Љ–Љ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ SPSS 15.0 for Windows. –Ч–љ–∞—З–µ–љ–Є—П p<0,05 —Б—З–Є—В–∞–ї–Є—Б—М —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ–Є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е —Г—З–∞—Б—В–Є–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 1.
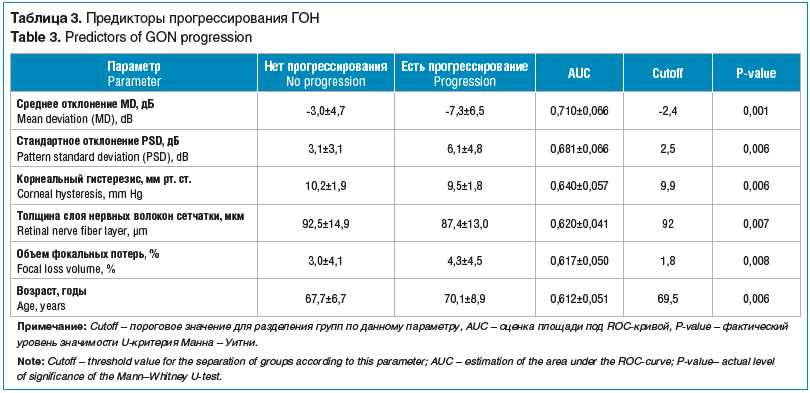
–†–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Є–Ј —В—А–µ—Е —Д–Њ—А–Љ –≥–ї–∞—Г–Ї–Њ–Љ—Л —Г –љ–∞–±–ї—О–і–∞–µ–Љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –У–Ю–Э –њ—А–µ–Њ–±–ї–∞–і–∞–ї–Є –±–Њ–ї—М–љ—Л–µ —Б –Я–≠–У. –Я—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Я–Ч–£–У –≤ 2 —А–∞–Ј–∞ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є–ї–Њ —В–∞–Ї–Њ–≤–Њ–µ –њ—А–Є –Я–Ю–£–У (—В–∞–±–ї. 2). –Р–љ–∞–ї–Є–Ј —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –њ–µ—А–Є–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–µ –Є–љ–і–µ–Ї—Б—Л (MD, PSD), —В–Њ–ї—Й–Є–љ–∞ —Б–ї–Њ—П –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ (RNFL), –Њ–±—К–µ–Љ —Д–Њ–Ї–∞–ї—М–љ—Л—Е –њ–Њ—В–µ—А—М (FLV), –Ъ–У –Є –≤–Њ–Ј—А–∞—Б—В –њ–∞—Ж–Є–µ–љ—В–∞ –Є–Љ–µ—О—В —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ –У–Ю–Э (—В–∞–±–ї. 3). –Ш–Ј —А–Є—Б—Г–љ-–Ї–∞ 2 –≤–Є–і–љ–Њ, —З—В–Њ –Ъ–У –≤ –≥—А—Г–њ–њ–µ —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –У–Ю–Э —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Њ—В–ї–Є—З–∞–ї—Б—П –Њ—В —В–∞–Ї–Њ–≤–Њ–≥–Њ –≤ –≥—А—Г–њ–њ–µ –±–µ–Ј –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П, –Є —Н—В–Њ –Њ—В–ї–Є—З–Є–µ –±—Л–ї–Њ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ, —З–µ–Љ –і–ї—П –Њ—Б–љ–Њ–≤–љ—Л—Е –Љ–Њ—А—Д–Њ—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є.

–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–†–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞—Б—В–Њ—П—Й–µ–є —А–∞–±–Њ—В—Л –≤–њ–µ—А–≤—Л–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Ъ–У –Є–Љ–µ–µ—В —Б—В–Њ–ї—М –ґ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–і–Є–Ї—В–Њ—А–∞ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –У–Ю–Э, –Ї–∞–Ї –Є –Є—Б—Е–Њ–і–љ–∞—П —Б—В–µ–њ–µ–љ—М –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –≤—Л—А–∞–ґ–∞–µ–Љ–∞—П –і–∞–љ–љ—Л–Љ–Є –њ–µ—А–Є–Љ–µ—В—А–Є–Є. –Ю–і–љ–∞–Ї–Њ –µ—Б–ї–Є —Г—З–µ—Б—В—М —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–љ–Є–µ ¬Ђ–њ—А–µ–њ–µ—А–Є–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–є¬ї –≥–ї–∞—Г–Ї–Њ–Љ—Л, —В–Њ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –Њ—З–µ–≤–Є–і–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–∞—П –≤–∞–ґ–љ–Њ—Б—В—М –њ–∞—А–∞–Љ–µ—В—А–Њ–≤, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є—Е –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞—В—М —В–µ—З–µ–љ–Є–µ –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Њ—В—Б—Г—В—Б—В–≤–Є—П –≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤ –њ–Њ–ї–µ–є –Ј—А–µ–љ–Є—П. –Ґ–∞–Ї–Є–Љ–Є –њ–∞—А–∞–Љ–µ—В—А–∞–Љ–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ —Б—З–Є—В–∞—О—В—Б—П –Љ–Њ—А—Д–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ї–Њ—В–Њ—А—Л—Е –Њ–њ–µ—А–µ–ґ–∞—О—В –њ–Њ—П–≤–ї–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –і–µ—Д–µ–Ї—В–Њ–≤ [20вАУ22]. –†–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–∞—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –Ъ–У –љ–∞ –Љ–Њ–Љ–µ–љ—В –≤—Л—П–≤–ї–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–µ —Г—Б—В—Г–њ–∞–µ—В —В–∞–Ї–Њ–≤–Њ–є –і–ї—П –љ–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ—Л—Е –Љ–Њ—А—Д–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є: —В–Њ–ї—Й–Є–љ—Л —Б–ї–Њ—П –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ —Б–µ—В—З–∞—В–Ї–Є –Є–ї–Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –µ–µ –≥–∞–љ–≥–ї–Є–Њ–Ј–љ–Њ–≥–Њ —Б–ї–Њ—П (—Б–Љ. —В–∞–±–ї. 2).–Т–Њ–њ—А–Њ—Б–∞–Љ –≤–ї–Є—П–љ–Є—П –±–Є–Њ–Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ —А–Њ–≥–Њ–≤–Є—Ж—Л –љ–∞ —В–µ—З–µ–љ–Є–µ –У–Ю–Э —Г–і–µ–ї—П–µ—В—Б—П –±–Њ–ї—М—И–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ъ–У –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–∞–Ї–Њ–≤—Л–Љ —Г –Ј–і–Њ—А–Њ–≤—Л—Е –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л—Е [23] –Є –ї–Є—Ж —Б –Њ—Д—В–∞–ї—М–Љ–Њ–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–µ–є [24]. –Ъ–∞–Ї –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≤ –њ—А–µ–і—Л–і—Г—Й–Є—Е –љ–∞—И–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –Ъ–У —П–≤–ї—П–µ—В—Б—П –Љ–∞—А–Ї–µ—А–Њ–Љ –њ—А–µ–њ–µ—А–Є–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–є —Б—В–∞–і–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л [20].
–Я—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ–Њ, —З—В–Њ –≤ –љ–∞—Б—В–Њ—П—Й–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —В–Њ–ї—Й–Є–љ–∞ —А–Њ–≥–Њ–≤–Є—Ж—Л –≤ –µ–µ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є —З–∞—Б—В–Є –љ–µ –≤–Њ—И–ї–∞ –≤ —З–Є—Б–ї–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Ј–љ–∞—З–Є–Љ—Л—Е –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–≤ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –У–Ю–Э. –≠—В–Њ —Б–Њ–≤–њ–∞–і–∞–µ—В —Б —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є, –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ–Є –і—А—Г–≥–Є–Љ–Є –∞–≤—В–Њ—А–∞–Љ–Є. –Ґ–∞–Ї, –≤ –Њ–і–љ–Њ–Љ –Є–Ј —В–∞–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–Њ—Е–Њ–ґ–Є—Е –њ–Њ –і–Є–Ј–∞–є–љ—Г –љ–∞ –љ–∞—И—Г —А–∞–±–Њ—В—Г (—Б—А–Њ–Ї –љ–∞–±–ї—О–і–µ–љ–Є—П –Ј–∞ –±–Њ–ї—М–љ—Л–Љ–Є вАФ 5 –ї–µ—В, 230 –≥–ї–∞–Ј), –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М –≤ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–Є –У–Ю–Э –Є–≥—А–∞–µ—В –Њ—В–љ—О–і—М –љ–µ –¶–Ґ–†, –∞ –Є–Љ–µ–љ–љ–Њ –љ–Є–Ј–Ї–Є–є –Ъ–У [25]. F. Medeiros et al. [26] —В–∞–Ї–ґ–µ –Њ—В–Љ–µ—З–∞—О—В, —З—В–Њ –Ъ–У –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л. –Т —Е–Њ–і–µ –Њ–і–љ–Њ—Д–∞–Ї—В–Њ—А–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Є–Љ–Є –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Ї–∞–ґ–і–Њ–Љ—Г –Љ–Є–ї–ї–Є–Љ–µ—В—А—Г —А—В. —Б—В. –Ъ–У —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–Њ —Г—Е—Г–і—И–µ–љ–Є–µ –Є–љ–і–µ–Ї—Б–∞ –њ–Њ–ї–µ–є –Ј—А–µ–љ–Є—П –љ–∞ 0,25%/–≥–Њ–і (p<0,001). –Т –Љ–љ–Њ–≥–Њ—Д–∞–Ї—В–Њ—А–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —А–Њ–ї—М –Т–У–Ф –≤ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–Є –У–Ю–Э –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–∞ —З–µ—А–µ–Ј –Ъ–У. –†–Є—Б–Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –±—Л–ї –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ –≤ –≥–ї–∞–Ј–∞—Е —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –Т–У–Ф –Є –љ–Є–Ј–Ї–Є–Љ –Ъ–У. –Ъ –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ–Љ—Г –≤—Л–≤–Њ–і—Г –њ—А–Є—И–ї–Є –Є –і—А—Г–≥–Є–µ –∞–≤—В–Њ—А—Л [27]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤ —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –¶–Ґ–† —Б–≤—П–Ј–∞–љ–∞ —Б —В—П–ґ–µ—Б—В—М—О –≥–ї–∞—Г–Ї–Њ–Љ—Л –Є —П–≤–ї—П–µ—В—Б—П —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –У–Ю–Э [21, 28, 29]. –Ю–і–љ–∞–Ї–Њ –µ—Б–ї–Є –≥–Њ–≤–Њ—А–Є—В—М –Њ –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ъ–У –Є –¶–Ґ–† –≤ —А–∞–Ј–≤–Є—В–Є–Є –У–Ю–Э –≤ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –∞—Б–њ–µ–Ї—В–µ, —В–Њ –±–Њ–ї—М—И–µ–µ ¬Ђ–њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ¬ї –∞–≤—В–Њ—А—Л –Њ—В–і–∞—О—В –Є–Љ–µ–љ–љ–Њ –Ъ–У. –Ґ–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ De Moraes et al., –≤ 17,4% —Б–ї—Г—З–∞–µ–≤ —Б–Ї–Њ—А–Њ—Б—В—М –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –У–Ю–Э –±—Л–ї–∞ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–∞ —Б –Є—Б—Е–Њ–і–љ–Њ –љ–Є–Ј–Ї–Є–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –Ъ–У, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Б –¶–Ґ–† вАФ –ї–Є—И—М –≤ 5,2% [27]. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –¶–Ґ–† –љ–∞ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –У–Ю–Э –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ –±—Л–ї–Њ. –†–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–є –∞–љ–∞–ї–Є–Ј —Б–µ—А–Є–є —Б–љ–Є–Љ–Ї–Њ–≤ –Ф–Ч–Э –≤ –і–Є–љ–∞–Љ–Є–Ї–µ, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л–є Chee et al. [30], –њ–Њ–Ї–∞–Ј–∞–ї –њ—А—П–Љ—Г—О —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –Ъ–У (–љ–Њ –љ–µ –¶–Ґ–† –Є–ї–Є –Т–У–Ф) –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –У–Ю–Э.
–Ґ–∞–Ї–ґ–µ —Б–ї–µ–і—Г–µ—В —Г–њ–Њ–Љ—П–љ—Г—В—М, —З—В–Њ –Ъ–У, –њ–Њ –і–∞–љ–љ—Л–Љ –ї–Є—В–µ—А–∞—В—Г—А—Л, –Љ–Њ–ґ–µ—В –Є–≥—А–∞—В—М –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –њ–Њ–≤—Л—И–µ–љ–Є–Є –≤–Њ—Б–њ—А–Є–Є–Љ—З–Є–≤–Њ—Б—В–Є –Ј—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –љ–µ—А–≤–∞ –Ї –≥–ї–∞—Г–Ї–Њ–Љ–∞—В–Њ–Ј–љ–Њ–Љ—Г –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—О. –Ґ–∞–Ї –Ї–∞–Ї —Д–Є–±—А–Њ–Ј–љ–∞—П –Ї–∞–њ—Б—Г–ї–∞ –≥–ї–∞–Ј–∞ (—А–Њ–≥–Њ–≤–Є—Ж–∞ –Є —Б–Ї–ї–µ—А–∞) —П–≤–ї—П–µ—В—Б—П —Б—В—А—Г–Ї—В—Г—А–Њ–є, –Є–≥—А–∞—О—Й–µ–є –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М –≤ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–є —Ж–µ–ї–Њ—Б—В–љ–Њ—Б—В–Є –≥–ї–∞–Ј–∞, —В–Њ –ї–Њ–≥–Є—З–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –њ—А–Є –Є–Ј–Љ–µ–љ–µ–љ–Є–Є –µ–µ –ґ–µ—Б—В–Ї–Њ—Б—В–Є –Є–Ј–Љ–µ–љ—П–µ—В—Б—П –Є —Б—В–µ–њ–µ–љ—М –µ–µ –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є –њ—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–Љ —Г—А–Њ–≤–љ–µ –Т–У–Ф [32]. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ —Д–Є–±—А–Њ–Ј–љ–Њ–є –Ї–∞–њ—Б—Г–ї—Л –≥–ї–∞–Ј–∞ –Њ–Ї–∞–Ј—Л–≤–∞—О—В –≤–ї–Є—П–љ–Є–µ –Є –љ–∞ –±–Є–Њ–Љ–µ—Е–∞–љ–Є–Ї—Г –Ф–Ч–Э [32, 33]. –≠–ї–∞—Б—В–Є—З–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ —Б–Ї–ї–µ—А—Л –Љ–Њ–≥—Г—В —Б–ї—Г–ґ–Є—В—М –≤ –Ї–∞—З–µ—Б—В–≤–µ –±—Г—Д–µ—А–Є—А—Г—О—Й–µ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –і–ї—П –Љ–Є–Ї—А–Њ–Њ–±—К–µ–Љ–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –≥–ї–∞–Ј—Г, —З—В–Њ –Ј–∞—Й–Є—Й–∞–µ—В –µ–≥–Њ –Њ—В —Д–ї—Г–Ї—В—Г–∞—Ж–Є–є –Т–У–Ф [32].
–†–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞—Б—В–Њ—П—Й–µ–є —А–∞–±–Њ—В—Л –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Є—Б—Е–Њ–і–љ–Њ –љ–Є–Ј–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —В–Њ–ї—Й–Є–љ—Л —Б–ї–Њ—П –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ (RNFL) –Є –Њ–±—К–µ–Љ –њ–Њ—В–µ—А—М –≥–∞–љ–≥–ї–Є–Њ–Ј–љ–Њ–≥–Њ —Б–ї–Њ—П —Б–µ—В—З–∞—В–Ї–Є —В–∞–Ї–ґ–µ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–Є—Б—М —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (—Б–Љ. —В–∞–±–ї. 2, —А–Є—Б. 2), —З—В–Њ —Б–Њ–≤–њ–∞–і–∞–µ—В —Б –і–∞–љ–љ—Л–Љ–Є –ї–Є—В–µ—А–∞—В—Г—А—Л [33].
–Ш—Б—Е–Њ–і–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Т–У–Ф –≤ –љ–∞—Б—В–Њ—П—Й–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–µ –≤–Њ—И–µ–ї –≤ —З–Є—Б–ї–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Ј–љ–∞—З–Є–Љ—Л—Е –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–≤ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –У–Ю–Э, —Н—В–Њ –Љ—Л –Њ–±—К—П—Б–љ—П–µ–Љ —В–µ–Љ —Д–∞–Ї—В–Њ–Љ, —З—В–Њ –≤—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ —Б—А–∞–Ј—Г –±—Л–ї–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Њ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –±—Л–ї–Њ –Ј–∞–Љ–µ—З–µ–љ–Њ, —З—В–Њ –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –У–Ю–Э —З–Є—Б–ї–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –љ–∞ –ї–µ—З–µ–љ–Є–Є –∞–љ–∞–ї–Њ–≥–∞–Љ–Є –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ (–Р–Я), –≤ 2 —А–∞–Ј–∞ –њ—А–µ–≤—Л—И–∞–ї–Њ —В–∞–Ї–Њ–≤–Њ–µ –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –У–Ю–Э.
–Р–Я –Њ—В–љ–Њ—Б—П—В—Б—П –Ї –њ—А–µ–њ–∞—А–∞—В–∞–Љ –њ–µ—А–≤–Њ–≥–Њ –≤—Л–±–Њ—А–∞ –≤ –ї–µ—З–µ–љ–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ—Л. –Ю–і–љ–∞–Ї–Њ –і–∞–љ–љ—Л—Е –Њ–± –Є—Е –≤–ї–Є—П–љ–Є–Є –љ–∞ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –њ–Њ–Ї–∞ –љ–µ–Љ–љ–Њ–≥–Њ. –Т–њ–µ—А–≤—Л–µ —Н—В–Њ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≤ –љ–µ–і–∞–≤–љ–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є UKGTS, –≥–і–µ –∞–≤—В–Њ—А—Л –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є, —З—В–Њ —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –ї–∞—В–∞–љ–Њ–њ—А–Њ—Б—В–Њ–Љ –±—Л–ї –љ–Є–ґ–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ [34]. –°–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ —Н—В–Њ –Њ—В–ї–Є—З–Є–µ –±—Л–ї–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —В–Њ–ї—М–Ї–Њ –љ–∞ –≤—В–Њ—А–Њ–Љ –≥–Њ–і—Г –љ–∞–±–ї—О–і–µ–љ–Є—П. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–∞—И–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —П–≤–ї—П–µ—В—Б—П –њ–µ—А–≤—Л–Љ, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –њ—Г—Б—В—М –Є –Ї–Њ—Б–≤–µ–љ–љ–Њ, –љ–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –љ–∞ –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –Р–Я —Б —Ж–µ–ї—М—О –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –У–Ю–Э, –њ—А–Є—З–µ–Љ —Н—В–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–ї—Г—З–µ–љ—Л –њ—А–Є –љ–∞–±–ї—О–і–µ–љ–Є–Є, –≤ 3 —А–∞–Ј–∞ –њ—А–µ–≤–Њ—Б—Е–Њ–і—П—Й–µ–Љ –њ–Њ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є UKGTS.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є –±–Њ–ї–µ–µ —З–∞—Б—В–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ ќ±2-–∞–і—А–µ–љ–Њ–Љ–Є–Љ–µ—В–Є–Ї–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –У–Ю–Э, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Є–Ј–≤–µ—Б—В–љ—Л–є —Д–∞–Ї—В –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –±—А–Є–Љ–Њ–љ–Є–і–Є–љ–∞ [35]. –Ю–і–љ–∞–Ї–Њ —Н—В–Њ –Љ—Л –Њ–±—К—П—Б–љ—П–µ–Љ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —А–µ–ґ–Є–Љ–∞ –Ј–∞–Ї–∞–њ—Л–≤–∞–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –µ–≥–Њ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ [36].
–Т—Л–≤–Њ–і—Л
–Ш—Б—Е–Њ–і–љ–Њ –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Ъ–У (–љ–Њ –љ–µ –Є—Б—Е–Њ–і–љ–Њ–µ –Т–У–Ф)–∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –У–Ю–Э.
–Ф—А—Г–≥–Є–µ –Ј–љ–∞—З–Є–Љ—Л–µ —Д–∞–Ї—В–Њ—А—Л вАФ –≤–Њ–Ј—А–∞—Б—В –±–Њ–ї—М–љ—Л—Е –Є —Б—В–µ–њ–µ–љ—М –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ–Љ–∞—П –њ–µ—А–Є–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–Љ–Є –Є–љ–і–µ–Ї—Б–∞–Љ–Є –Є —В–Њ–ї—Й–Є–љ–Њ–є —Б–ї–Њ—П –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ —Б–µ—В—З–∞—В–Ї–Є, –∞ —В–∞–Ї–ґ–µ –Њ–±—К–µ–Љ–Њ–Љ —Д–Њ–Ї–∞–ї—М–љ—Л—Е –њ–Њ—В–µ—А—М –µ–µ –≥–∞–љ–≥–ї–Є–Њ–Ј–љ–Њ–≥–Њ —Б–ї–Њ—П.
–°–≤–µ–і–µ–љ–Є—П –Њ–± –∞–≤—В–Њ—А–∞—Е: 1–Ъ—Г—А—Л—И–µ–≤–∞ –Э–∞—В–∞–ї–Є—П –Ш–≤–∞–љ–Њ–≤–љ–∞ вАФ –і.–Љ.–љ., –њ—А–Њ—Д–µ—Б—Б–Њ—А, —А—Г–Ї–Њ–≤–Њ–і–Є—В–µ–ї—М –Ї–Њ–љ—Б—Г–ї—М—В–∞—В–Є–≤–љ–Њ-–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–і–µ–ї–∞; 2–®–∞—В–∞–ї–Њ–≤–∞ –Х–Ї–∞—В–µ—А–Є–љ–∞ –Ю–ї–µ–≥–Њ–≤–љ–∞ вАФ –≤—А–∞—З-–Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥; 1–Ы–µ–њ–µ—И–Ї–Є–љ–∞ –Ы—О–і–Љ–Є–ї–∞ –Т—П—З–µ—Б–ї–∞–≤–Њ–≤–љ–∞ вАФ –≤—А–∞—З-–Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥. 1–§–У–С–£ –У–Э–¶ –†–§ –§–Ь–С–¶ –Є–Љ. –Р.–Ш. –С—Г—А–љ–∞–Ј—П–љ–∞ –§–Ь–С–Р –†–Њ—Б—Б–Є–Є. 123098, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –У–∞–Љ–∞–ї–µ–Є, –і. 15. 2–Ю–Ю–Ю ¬Ђ–Ъ–ї–Є–љ–Є–Ї–∞ –Ф–Њ–Ї—В–Њ—А–∞ –®–∞—В–∞–ї–Њ–≤–∞¬ї. 1426113, –†–Њ—Б—Б–Є—П, –Ь–Њ—Б–Ї–Њ–≤—Б–Ї–∞—П –Њ–±–ї., –≥. –Ю—А–µ—Е–Њ–≤–Њ-–Ч—Г–µ–≤–Њ, —Г–ї. –Э–∞–±–µ—А–µ–ґ–љ–∞—П, –і. 10–∞. –Ъ–Њ–љ—В–∞–Ї—В–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П: –Ъ—Г—А—Л—И–µ–≤–∞ –Э–∞—В–∞–ї–Є—П –Ш–≤–∞–љ–Њ–≤–љ–∞, e-mail: e-natalia@list.ru. –Я—А–Њ–Ј—А–∞—З–љ–Њ—Б—В—М —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є: –љ–Є–Ї—В–Њ –Є–Ј –∞–≤—В–Њ—А–Њ–≤ –љ–µ –Є–Љ–µ–µ—В —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–∞—Е –Є–ї–Є –Љ–µ—В–Њ–і–∞—Е. –Ъ–Њ–љ—Д–ї–Є–Ї—В –Є–љ—В–µ—А–µ—Б–Њ–≤ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В. –°—В–∞—В—М—П –њ–Њ—Б—В—Г–њ–Є–ї–∞ 16.09.2018.
About the authors: 1Natalia I. Kurysheva вАФ MD, PhD, Professor, Head of the Clinical Diagnostic Department; 2Ekaterina O. Shatalova вАФ ophthalmologist; 1Ludmila V. Lepeshkina вАФ ophthalmologist. 1Burnazyan Federal Medical Biophysical Center of Federal Medical Biological Agency. 15, Gamalei str., Moscow, 123098, Russian Federation. 2LLC вАЬDoctor Shatalov ClinicвАЭ. 10A, Naberezhnaja str., Orekhovo-Zuyevo, Moscow region, 1426113, Russian Federation. Contact information: Natalia I. Kurysheva, e-mail: e-natalia@list.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 16.09.2018.








.gif)



