after trabeculoplasty
I.Yu. Mazunin, S.A. Kichataya
GOU VPO NIZHGMA of Ministry of Health and social development of Russia
Purpose: Evaluation of neuroprotective activity of Retinalamin in early stage of compensated POAG after supraliminal micropulse infared laser trabeculoplasty with wide spot.
Materials and methods: SLT was performed by IQ 810 «IRIDEX» ophthalmic laser. In postoperative period all patients were prescribed Retinalamin by 3 courses during a year in retrobulbar injections. Also OCT was carried out before treatment and in 12 months after it.
Results: 10 patients (20 eyes) with early POAG were included into the study. In 1 months after surgery IOP level was 16,6 ±1,9 mm Hg without additional drugs usage and didn’t increase 21 mm Hg during next 12 months.
Conclusion: Retinalamin usage is reasonable in postoperative period by 3 courses of 10 injections each. It may contribute both to stabilization of glaucomatous neuropathy and improvement of tomographical indices in patients with early glaucoma after trabeculoplasty.
Введение
В Российской Федерации установлен значительный рост уровня первичной инвалидизации вследствие первичной открытоугольной глаукомы (ПОУГ), которая в настоящее время выросла до 30% от всех случаев первично регистрируемой инвалидности по патологии глаз. Общая распространенность глаукомы среди населения в возрасте после 40 лет составляет в среднем 1,5–1,7% и увеличивается с возрастом. Уровень слепоты и слабовидения вследствие глаукомы достиг 15,2, а уровень полной слепоты – 7,1 случая на 10 000 населения [5].
Аргоновая линейная трабекулопластика в течение десятилетий являлась основной операцией в лазерном лечении ПОУГ. Позднее стала применяться диодная инфракрасная линейная трабекулопластика. При этом часто возникает послеоперационный реактивный синдром (ПРС) с резким подъемом внутриглазного давления (ВГД), который иногда требует хирургических вмешательств. Другой эффективный способ воздействия на трабекулу – селективная лазерная трабекулопластика – пока не получил достаточного распространения, что обусловлено высокой стоимостью лазера при использовании его для проведения только одной операции.
Сегодня эволюция лазерной трабекулопластики идет по пути снижения деструктивного воздействия на ткани трабекулы – от более радикальных к щадящим методикам, направленным в основном на активацию «биологического отклика тканей» на лазерное излучение. Так, известно, что абсорбирующая способность меланина составляет всего 7% по отношению к излучению диодного лазера с длиной волны 810 нм [9,13]. Еще одним его важным свойством является способность работать в импульсном режиме, когда лазерная установка генерирует излучение с экспозицией в микросекунды. Часто повторяющиеся циклы включения микроимпульсов чередуются с периодами выключения, при этом индукция тепла от поглощающего его пигментного слоя ткани не успевает распространиться на окружающие структуры и оказать повреждающее действие, так как время выключения составляет от 80 до 95% всей продолжительности импульса [6,7]. В результате этого термомеханическое повреждающее действие лазеркоагуляции минимально, особенно при использовании субпорогового уровня энергии. Эти особенности микроимпульсного режима значительно снижают риск случайной передозировки энергии [12,14]. Клинические исследования подтвердили, что пациента можно лечить с помощью микроимпульсного режима, но используя только долю (до 15%) мощности, необходимой для получения тестового коагулята, и соответственно увеличенную экспозицию излучения [11]. Таким образом, микроимпульсное воздействие предпочтительнее непрерывного потому, что делает лазерное лечение патологии тканей глаза абсолютно безопасным в отношении осложнений и предсказуемо эффективным по своим результатам: минимизирует выраженность послеоперационного рубцевания, снижает вероятность развития ПРС и рецидива подъема ВГД [8,10].
После снижения ВГД до давления цели процесс прогрессирования оптической глаукомной нейропатии не прекращается, и в этой связи необходимо применение нейроретинопротекторов, в частности, Ретиналамина [2], так как он способствует восстановлению синтеза тканеспецифичных белков. Препарат состоит из 5 мг нейтральных полипептидов сетчатки телят (стабилизатор – глицин 17 мг), включающих в себя аспарагиновую и глутаминовую кислоты, метионин, треонин, изолейцин, серин, лейцин, тирозин, пролин, фенилаланин, гистидин, аланин, лизин, валин и аргинин [1]. При лечении ПОУГ Ретиналамин применяется в суточной дозе 5,0 мг парабульбарно, а также путем введения в субтеноново пространство [4]. Специфическое и неспецифическое действие Ретиналамина заключается в стимуляции фоторецепторов и клеточных элементов сетчатки, улучшении функционального взаимодействия пигментного эпителия и наружных сегментов фоторецепторов. При лечении Ретиналамином происходят ускорение восстановления световой чувствительности сетчатки, нормализация проницаемости сосудов, уменьшение проявления воспалительной реакции, стимуляция репаративных процессов в сетчатке. Он также оказывает иммуномодулирующее действие, увеличивая экспрессию рецепторов на Т– и В–лимфоцитах и повышает фагоцитарную активность нейтрофилов [1]. После анализа данных вакуум–компрессионной пробы с контролем зрительно вызванных корковых потенциалов выявлено, что Ретиналамин обладает выраженным нейропротекторным действием (увеличивает толерантность зрительного нерва к повышенному ВГД) в начальной, развитой и далеко зашедшей стадиях ПОУГ. В сравнении с другими нейропротекторами при лечении Ретиналамином доказано достоверное увеличение средней толщины ретинальных нервных волокон при начальной и развитой стадиях ПОУГ [3].
Цель исследования. Изучение нейроретинопротекторного действия Ретиналамина при лечении ранних стадий компенсированной ПОУГ после операции СМИЛТ ШП.
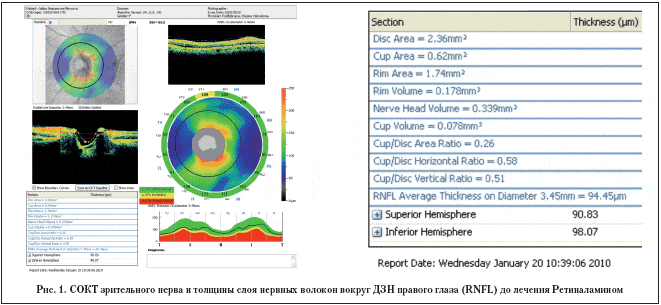
Материалы и методы. СМИЛТ ШП проведена на офтальмологическом лазере IQ 810 IRIDEX (США) 10 пациентам (20 глаз) с ПОУГ. У всех пациентов была диагностирована I стадия ПОУГ, примерно одинаковая по степени развития на обоих глазах. Площадь диска зрительного нерва (ДЗН) по данным СОКТ в среднем составляла 2,1±1,34 мм2, толщина роговицы – 551±4 mm. Исключались из исследования больные с аномалиями рефракции высокой степени (перипупиллярными стафиломами) и дистрофическими изменениями макулярной зоны сетчатки. Через 1 мес. после операции уровень ВГД составил в среднем 16,6±1,9 мм рт.ст. без дополнительного гипотензивного лечения и держался в пределах нормы (до 21 мм рт.ст.) во всех глазах в течение 12 мес.
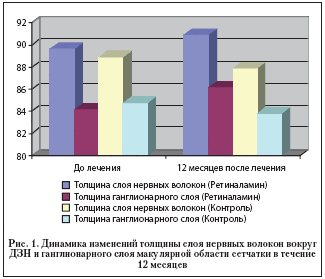
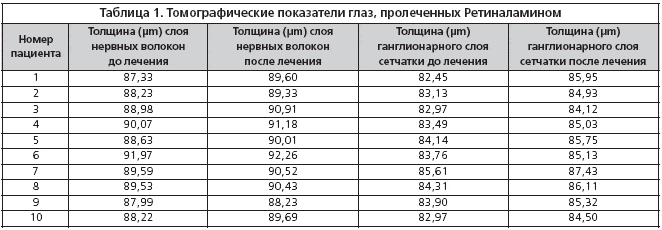
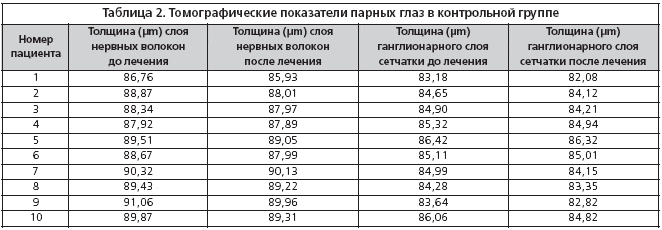
Результаты исследования. При анализе показателей томографии была выявлена их нормализация или улучшение применительно к толщине слоя нервных волокон и ганглионарных клеток сетчатки в макулярной зоне (ММ 7), а также толщине слоя нервных волокон вокруг ДЗН (RNFL) в пролеченном Ретиналамином глазу по сравнению с парным контрольным глазом (табл. 1, 2).
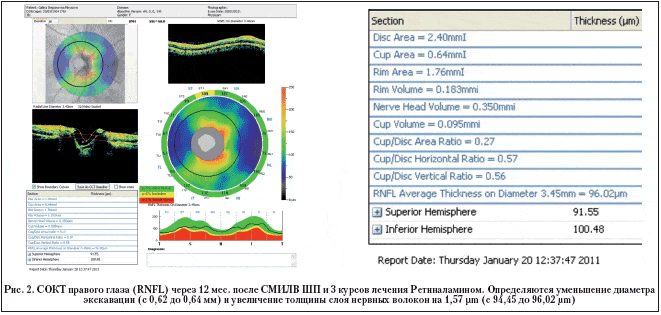
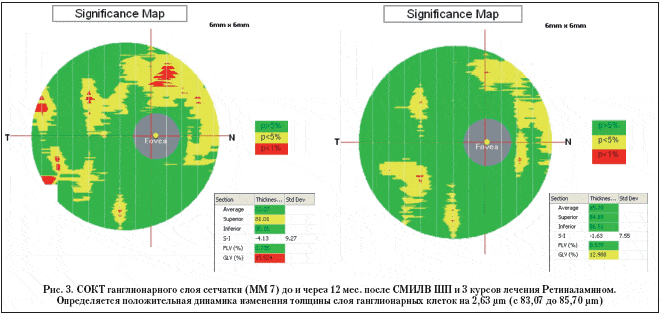
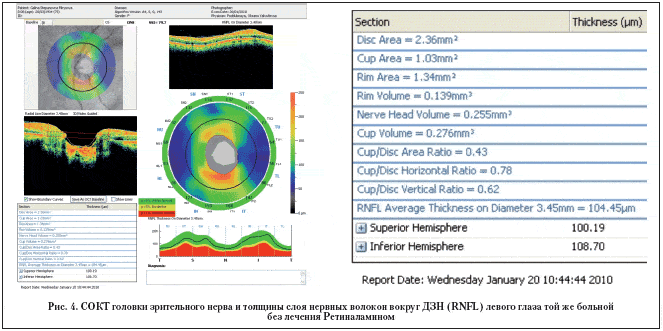
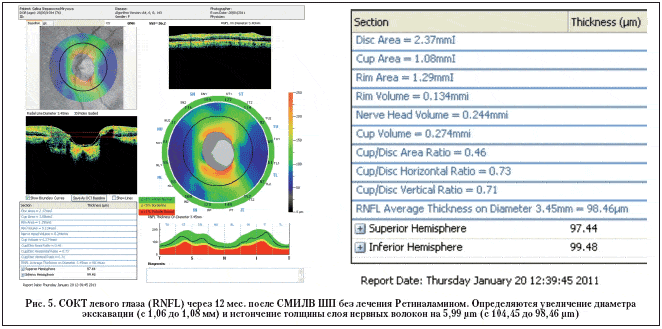
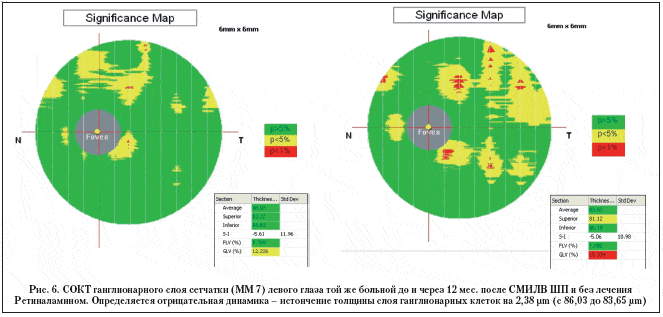
При анализе результатов исследования выявлено улучшение функциональных и томографических показателей в пролеченных Ретиналамином глазах. Средняя толщина слоя нервных волокон вокруг ДЗН увеличилась на 1,28 µm (с 89,65±2,32 µm до 90,93±1,33 µm), средняя толщина ганглионарного слоя сетчатки в макулярной области – на 1,97 µm (с 84,2±1,75 µm до 86,17±1,63 µm). В контрольных парных глазах, наоборот, наблюдались либо отсутствие положительной динамики, либо незначительная отрицательная динамика. Средняя толщина слоя нервных волокон вокруг ДЗН уменьшилась на 1,06 µm (с 88,92±2,14 µm до 87,86±1,93 µm), средняя толщина ганглионарного слоя – на 0,99 µm (с 84,8±1,62 µm до 83,81±1,73 µm) (рис. 1).
Выводы. Основным направлением развития микрохирургического и лазерного лечения глаукомы является уменьшение инвазивности операций при сохранении или увеличении гипотензивного эффекта. Однако применение нейропротекторных средств в послеоперационном периоде (после достижении давления цели) является необходимым, т.к. доказано, что процесс глаукомной атрофии ДЗН не прекращается немедленно после снижения и нормализации ВГД. Полученные в ходе данного исследования результаты доказывают эффективность применения Ретиналамина в послеоперационном периоде лазерного лечения ПОУГ. Целесообразно применение 3 курсов терапии Ретиналамином в течение 1 года каждые 4 мес. в виде 10 ежедневных ретробульбарных инъекций, что способствует не только длительной эффективной стабилизации глаукомной нейропатии, но и улучшению томографических показателей состояния зрительного нерва и сетчатки у послеоперационных больных с начальными стадиями ПОУГ после трабекулопластики.
Литература
1. Астахов Ю. С., Бутин Е. В., Морозова Н.В., Соколов В.О. Оценка нейропротекторного действия Ретиналамина при лечении больных с первичной открытоугольной глаукомой // Terra medica. – СПб., 2006. – № 2. – С. 52–54.
2. Астахов. Ю.С., Бутин Е.В., Морозова Н.В., Соколов В.О. Результаты применения ретиналамина у больных с первичной открытоугольной глаукомой // Глаукома. – № 2. – М., 2006. – С. 43–47.
3. Бутин Е.В. Оценка нейропротекторного действия различных препаратов у больных с первичной открытоугольной глаукомой // Автореф. дисс. ... канд. мед. наук. – СПб., 2008. – 20 с.
4. Каменских Т.Г. Клиническое исследование действия препарата Ретиналамин у больных открытоугольной глаукомой при парабульбарном и субтеноновом введении // Клиническая офтальмология. – М., 2006. – Т. 7. – № 4. – С. 142–144.
5. Либман Е.С., Шахова Е.В., Чумаева Е.А., Елькина Я.Э. Инвалидность вследствие глаукомы в России // Мат. Всерос. науч–практ. конф. «Глаукома: проблемы и решения». – М., 2004. – С. 429–432.
6. Connolli B.P., Redgillo C.D., Ralph C.E. The histopathologic effects of transpupillary termoterapy in human eyes. // Ophthalmolgy. – 2003. – № 2. – P. 415–420.
7. Dorin G. Subthreshold and MicroPulse Diode Laser Photocoagulation // Semin. Ophthalmol. – 2003. – Vol. 1. – № 3. – P.147–153.
8. Friberg T.R., Roider J. Subthreshold Laser Photocoagulation and Criminal Fraud // Arch. Ophthalmol. – 2003 – Vol. 121. – № 9. – P.1343.
9. Gabel V.P., Lorenz B., Obana A., Vogel A., Birngruber R. Problems of clinical of diode lasers // Lasers and Light in Ophthalmol. – 1992. – Vol. 4. – P. 157–163.
10. Iwach A.G. Micropulse Laser Trabeculoplasty. // Glaucoma today. – 2008. – Vol. 6. – № 1. – P. 36–38.
11. Kim S.Y., Sanislo S.R., Dalal R., Blumenkranz M.S. The selective effect of micropulse diode laser upon the retina // Invest Ophthalmol Vis Sci. – 1996. – Vol. 37. – № 3. – P. 773–779.
12. Moorman CM, Hamilton AMP. Clinical applications of the micropulse diode laser // Eye. – 1999. – Vol. 13. – № 7. – P. 145–150.
13. Obana A. The therapeutic range of chorioretinal photocoagulation with diode and argon laser: an experimental comparison // Lasers and Light in Ophthalmol. – 1992. – Vol. 4. – P. 147–156.
14. Stanga PE, Reck AC, Hamilton AMP. Micropulse laser in the treatment of diabetic macular edema // Semin. Ophthalmol. – 1999. – Vol. 14. – № 4. – P. 210–213.












