New possibilities of neuroprotection in complex treatment of glaucoma with phytogenous drugs (literary review)
Yu.S. Astahov, Yu.V. Skorobogatov
State Medical University named after Pavlov I.P.
Diagnostic Eye Center № 7 for children and grown-ups,
St.-Petersburg
Authors present review devoted to complex treatment of glaucoma optic neuropathy including oligomerous proanthocyanidins (OPCS).
OPCs have antioxidant, neutrophic and antiexcitotoxic influence and may be used as additional agent in neuroprotective therapy.
Ability of OPCs to induce endothelial growth factor makes their usage in patients with neovascular glaucoma and subretinal neovascular membranes doubtful.
Глаукома является одной из основных причин слепоты и инвалидности по зрению, несмотря на очевидные успехи в диагностике и лечении этого заболевания. Около 105 миллионов человек на планете болеют глаукомой, и до 2030 года, по прогнозу, это количество может удвоиться. Около 9,1 миллиона человек в мире ослепли от глаукомы [Курышева Н.И., 2004]. В России, по официальным данным, насчитывается около 800 000 больных глаукомой [Егоров Е.А., 2000], а в Санкт–Петербурге свыше 52 000.
Профилактика слепоты от глаукомы, по многочисленным данным литературы, заключается в ее ранней диагностике, своевременно начатом лечении и динамическом наблюдении.
Основной метод лечения глаукомной оптической нейропатии – гипотензивная терапия. Адекватное снижение ВГД обеспечивает и нейропротекторный эффект. Однако нормализация давления зачастую оказывается малоэффективной без соответствующей нейропротекции [Астахов Ю.С., 2006]. По мнению Марченко Л.Н. (2003 г.), нейропротекция опосредуется в основном антиоксидантным, антиэксайтотоксичным, блокирующим ионы кальция и нейротрофическим влиянием. Повреждение зрительного нерва при оптикопатиях связано с воздействием возбужденных ишемией клеток глии на жизнеспособные нейрональные структуры, то есть в первую очередь страдают аксоны и глиальные клетки, а затем уже и ганглиозные клетки. При комплексном лечении глаукомы применяют нейропротекторы непрямого (или опосредованного) действия, повышающие перфузионное давление главным образом за счет снижения ВГД, прямого (или непосредственного) действия на нервные клетки и препараты комбинированного действия. Такие лекарства широко известны. Это блокаторы кальциевых каналов (нифедипин, флунаризин, бетаксолол); антагонисты NMDA–рецепторов (мемантин); антиоксиданты (каталаза, супероксиддисмутаза, витамины С и Е, экстракты Ginkgo biloba); нейтротрофины, способствующие увеличению уровня нейроэндогенного фактора, вырабатываемого головным мозгом – BDNF (бримонидин, цилиарный нейротрофин и др.) и цитомедины (ретиналамин и др.).
Множество исследователей сходятся в том, что в механизме гибели ганглиозных клеток (апоптоза) принимают участие как механические, так и сосудистые факторы. Механические факторы связываются в первую очередь с повышением внутриглазного давления, что приводит к блокаде аксоплазматического тока и прекращению поступления нейротрофических веществ. Сосудистые факторы приводят к снижению перфузионного давления, недостаточности ауторегуляции и вазоспазму. В результате всего возникает ишемия области головки зрительного нерва, что приводит к уменьшению количества АТФ, увеличению уровня глутамата, активации NMDA–рецепторов, увеличению поступления ионов кальция в клетки, фрагментации ДНК и, как следствие, к апоптозу клетки. Апоптоз клетки был открыт J. Kerr и соавт. в 1972 году. Слово апоптоз (от греч. «apoptosis», где «apos» – отделение, «ptosis» – падение) в переводе с греческого означает «отделение лепестков от цветка», а в биологическом смысле – это распад клетки на отдельные составляющие. Говоря об апоптозе, цитологи выделяют в первую очередь чрезмерные (необратимые или малообратимые) повреждения хромосом (многочисленные разрывы ДНК, нарушения ее конформации, сшивки между цепями, неправильная сегрегация хромосом и т.д.). Кроме того, возможно, пусковым механизмом апоптоза являются серьезные повреждения внутриклеточных мембран (и особенно митохондрий) в результате перекисного окисления липидов [Мушкамбаров Н.Н., Кузнецов С.Л., 2003].
Олигомерные проантоцианидины (OPCs) – одни из наиболее распространенных полифенольных веществ растений. Они обладают высокой антиоксидантной активностью, и с недавних пор стали объектом научных исследований, в которых были продемонстрированы антиканцерогенные, антивоспалительные, антимикробные, сосудорасширяющие и коллаген–стабилизирующие свойства проантоцианидинов, что делает эти вещества потенциально полезными для использования в терапевтических целях для лечения большого количества заболеваний.
Синонимом для олигомерных проантоцианидинов являются такие названия, как процианидины, процианодольные олигомеры (PCOs), лейкоантоцианы, конденсированные танины и пикногенолы, хотя последний термин использовался недолго.
Проантоцианидины являются неотъемлемой частью человеческой диеты. Показано, что высокая концентрация проантоцианидинов содержится в яблоках, грушах и винограде, ягодах, а также в шоколаде, вине, и чае. Используемые в пищевых добавках OPCs главным образом получают из косточек винограда или сосновой коры.
Проантоцианидины — высокомолекулярные олигомеры или полимеры, состоящие из флаванов–3–оl (flavan–3–ol) мономеров, степень полимеризации колеблется между 4 и 11. Предполагается, что восстановительная способность OPCs в большей степени пропорциональна их весовой концентрации, чем степени полимеризации [2,3]. Проантоцианидины, полученные из растительного сырья, представляют собой смесь из димеров, тримеров, тетрамеров, олигомеров и полимеров. Полимерная природа проантоцианидинов уникальна среди полифенолов; они сязывают и приводят к выпадению в осадок протеины и ингибируют ферменты, участвующие в деградации сосудистых тканей. Способности OPCs связываться с протеинами приписывают ощущение терпкости и «сморщивания», когда чай или красное вино взаимодействует со слюной и тканями щеки [4].
Известно, что антоцианы из различных ягод улучшают состояние соединительных тканей, обладают коллаген–стабилизирующим эффектом, уменьшают ломкость капилляров, обладают сильными антиоксидантными эффектами, что позволяет их использовать для профилактики и ослабления симптомов развития различных сердечно–сосудистых заболеваний, других заболеваний сосудов и др. Другой, пожалуй, наиболее известной областью использования антоцианов является профилактика и лечение различных нарушений зрения. Это стало возможным, главным образом, из–за более высокого сродства к тканям глаза, что позволяет антоцианам более эффективно воздействовать на эти ткани. Наиболее известным источником содержания антоцианов является экстракт черники. Другие источники антоцианов менее известны, хотя они также как и экстракт черники способны оказывать положительное воздействие на глаза, обладая рядом дополнительных эффектов, обусловленных источником происхождения, процентным соотношением и содержанием различных антоцианов.
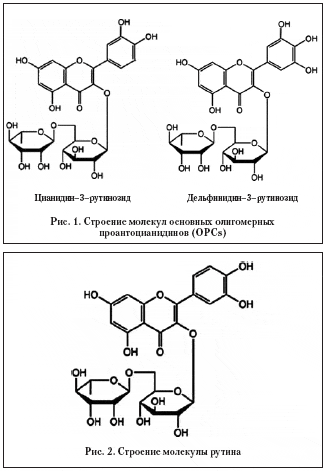
На рисунке 1 мы приводим строение молекул основных олигомерных проантоцианидинов (OPCs).
Схожесть строения молекул OPCs и рутина (рис. 2) определяет и схожесть действия препаратов. Рутин обладает выраженным ангиопротекторным действием и является корректором микроциркуляции [5].
Рутин (кверцетин–3–рутинозид) — органическое соединение из группы флавоноидов, обладающее витаминной активностью. Рутин укрепляет стенки капилляров, регулируя их проницаемость; усиливает действие аскорбиновой кислоты.
Молекула рутина образована флавоном кверцетином и дисахаридом рутинозой. Содержится в листьях руты душистой и чайного куста, в гречихе и других растениях. Обладает витаминной активностью; регулирует проницаемость капилляров. Применяется как медицинский препарат (часто совместно с аскорбиновой кислотой).
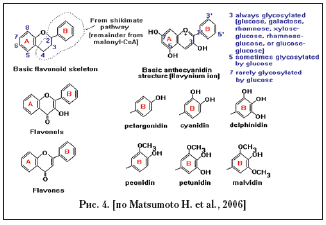
Наибольшее число публикаций об OPCs посвящено веществам, полученным из черники, черной смородины и косточек винограда, основным действующим компонентом которых являются антоцианины (антоцианозиды), представляющие гликозилированные (содержащие остаток сахара) антоцианидины. Как правило, используются экстракты стандартизированные именно по антоцианинам. Естественно, что такие экстракты должны различаться и по другим веществам, входящим в их состав, однако на такие различия, как правило, не обращают внимание, в том числе и из–за способа получения экстрактов, когда большое количество других веществ разрушается. Известно, что антоцианозиды способны накапливаться практически во всех тканях глаза, причем в больших количествах, чем в плазме крови, в других тканях антоцианозиды не были обнаружены [7] (опыты проводили на кроликах и крысах, в исследовании использовались антоцианозиды черной смородины, для черники таких данных нет). Антоцианидины это полифенолы, относящиеся к группе флавоноидов, базовые структуры которых приведены на рисунке 3. При этом в антоцианидинах могут варьировать различные сахарные остатки, а также ароматическое кольцо, помеченное, как «В» на рисунке 4, может содержать одну или несколько ОН групп в различных положениях.
Листья и плоды черники оказывает вяжущее и бактерицидное действие [5]. Настои и кисели из сухих плодов черники оказывают выраженное закрепляющее действие, экстракты из плодов черники применяются при острых и хронических заболеваниях желудочно–кишечного тракта: гастриты, энтероколиты, сопровождающиеся диареей [5]. Плоды черники рекомендуют для лечения и профилактики различных нарушений зрения, таких как: миопия средней и высокой степени, приобретенная гемералопия, диабетическая ретинопатия, нарушение механизмов адаптации к темноте как при ночном, так и при сумеречном зрении, мышечная астенопия, центральная атеросклеротическая хориоретинальная дегенерация сетчатки типа Кунт–Юниуса, тапеторетинальная абиотрофия сетчатки (пигментная дегенерация сетчатки) [5].
Черника используется для улучшения целого ряда нарушений зрения, включая такие заболевания как катаракта, глаукома и диабетическая ретинопатия. Считается, что основным активным компонентом черники при ее воздействии на зрительные функции являются флавоноиды антоцианы (антоцианозиды), сильные антиоксиданты, обладающие особенным сродством к тканям глаз и сосудов [8]. Антоцианы обычно используются в виде 25% стандартизованного экстракта черники. Существует несколько десятков различных клинических исследований, посвященных влиянию черники на зрительные функции, однако, не все из них показали эффективность черники по сравнению с контролем [8–10].
В работе Canter P.H. и Еrnst E. [10] был проведен анализ более 30 плацебо–контролируемых исследований, проведенных до 2002 года, посвященных влиянию черники на ночное зрение. Отбор исследований проводился при помощи поиска в следующих базах данных: MEDLINE, EMBASE, AMED, CINAHL, PsycINFO и CCTR (Cochrane); ключевыми словами для поиска были: bilberry, Vaccinium myriillus, Myrttli folium, anthocyanosides и vision. При этом авторы указывают на трудность получения информации из–за отсутствия электронных версий (давности проведения исследований), отсутствия англоязычных версий. Кроме того, из рассмотрения исключались результаты, интерпретация которых проводилась отлично от принятых в настоящее время стандартов. Авторы этого исследования утверждают, что не было обнаружено ни одного исследования, в котором показано положительное воздействие черники на ночное зрение (и другие заболевания), и которое соответствует современным стандартам проведения клинических исследований (примечание – рандомизированное, двойное слепое, плацебо контролируемое, перекрестное, длительное с контролем получаемых препаратов и продуктов до и после исследования, наблюдение после исследования и т.д.). Авторы, однако, не ставят под сомнение полезность использования антоцианозидов черники для улучшения зрения, они указывают на отсутствие грамотно проведенных клинических исследований. Авторами обзора не ставятся под сомнение данные многочисленных работ, проведенных на животных, а также результаты небольшого клинического исследования, показавшего положительное воздействие антоцианозидов черной смородины на темновую адаптацию и утомляемость глаз [11]. На наш взгляд, основной недостаток выводов полученных в этой работе — относительная давность проведенных клинических исследований, а также то, что большая часть этих работ не была выполнена в соответствии со стандартами, принятыми в настоящее время. Заметим, что подобная ситуация типична для так называемых биологически активных добавок (БАД): вещество давно и успешно применяется в народной медицине и в составе многих пищевых добавок. Его эффективность не ставится под сомнение (по крайней мере их достаточно активно рекомендуют пациентам многие врачи), однако отсутствуют проведенные на надлежащем уровне клинические испытания, подтверждающие эффективность этого вещества, или, наоборот, показывающие низкую эффективность этих веществ.
Ниже приведены результаты нескольких клинических исследований [8,9], посвященных воздействию черники на функции зрения. Экстракт черники применялся у 31 пациента с различной патологией сетчатки: диабетической ретинопатией (n=20); пигментной дегенерацией сетчатки (n=5); дегенерацией желтого пятна (n=4); и геморрагической ретинопатией после антикоагулянтного медикаментозного лечения (n=2). Было установлено, что при применении экстракта черники наблюдалась тенденция к уменьшению проницаемости сосудов и случаев кровоизлияния у всех пациентов, особенно страдающих диабетом. Типичной дозой черники при исследовании было 80–160 мг три раза в день стандартизованного экстракта, содержащего 25% антоцианозида. Из данных этого исследования можно заключить, что экстракт черники способен положительно воздействовать при диабетической ретинопатии. В другом исследовании 50 пациентам, страдающим старческой катарактой, давали чернику, стандартизованную по 25% содержанию антоцианозидов (по 180 мг дважды в день) и синтетический витамин Е, в форме ацетата Dl–a–токоферола (по 100 мг дважды в день). Было показано, что в течение 4 месяцев развитие катаракты было остановлено у 96% пациентов (n=25), по сравнению с 76% в контрольной группе (n=25).
Считается, что антоцианозиды улучшают состояние соединительных тканей, уменьшают ломкость капилляров, обладают сильными антиоксидантными эффектами и имеют особенное сродство к сетчатке. Именно этими свойствами обусловлено положительное воздействие этих веществ на функции зрения [8,9]. Существует предположение, что антоцианы способствуют регенерации светочувствительного пигмента сетчатки – родопсина и таким образом улучшают чувствительность сетчатки к различным уровням светового излучения и усиливают остроту зрения при низкой освещенности.
При проведении исследований антоцианозиды черники использовались в дозе 80–160 мг в день. Как правило, для получения этого количества антоцианозидов пациенты получали экстракт черники.
Побочным действием применения экстракта из плодов черники являются запоры, оксалатурия, в отдельных случаях аллергические реакции. Черника противопоказана при перечисленных состояниях [5].
Также как в чернике, активным компонентом в черной смородине считаются антоцианидины или их гликозилированные соединения антоцианы (антоцианозиды) — сильные антиоксиданты, обладающие особенным сродством к тканям глаз и сосудов [6]. В небольшом (n=12) двойном слепом, плацебо контролируемом перекрестном исследовании было установлено, что после применения 50 мг антоцианозидов черной смородины достоверно снижается утомляемость глаз при последующей зрительной нагрузке и время темновой адаптации при вспышке яркого света [11].
Как и в случае с черникой нет данных о длительности положительных эффектов черной смородины. Предположительно, антоцианы черной смородины действуют аналогично антоцианам черники. Кроме того, наличие в черной смородине и в чернике витамина С предполагает, что положительное воздействие на зрение обусловлено также и им. Витамин С является антиоксидантом, который защищает сетчатку от действия яркого света и способствует сохранению родопсина в палочках [8]. Предполагается, что витамин С инактивирует свободные радикалы, препятствуя таким образом гликозилированию протеинов (показано на здоровых людях и in vitro) и уменьшает проницаемость и ломкость капилляров, что, в свою очередь, способствует предотвращению развития диабетической ретинопатии [8]. Витамин С также может быть полезен при профилактике и остановке развития глаукомы и катаракты [9]. Правда, все эти вышеописанные эффекты могут наблюдаться при достаточно высоких количествах витамина С (по сравнению с его количеством, обычно присутствующем в экстрактах).
Способность сохранять родопсин в палочках выявлена и у антоцианов черной смородины [12]. Было показано, что содержащиеся в черной смородине цианидин–3–глюкозид и цианидин–3–рутинозид способствуют регенерации родопсина в ретине лягушки. При этом наибольшей активностью отличался цианидин–3–рутинозид. Соединения дельфинидина не оказывали эффектов на восстановление родопсина. Было показано, что проантоцианидины также способны ингибировать перекисное окисление липидов, агрегацию тромбоцитов, влияют на проницаемость и жесткость сосудов, а также воздействуют на некоторые ферменты, включая фосфолипазу А2, цикло– и липооксигеназу[13].
Поскольку морфологические изменения, наблюдающиеся в структуре коллагена, связаны с развитием глаукомы, кажется логичным использовать для лечения такие вещества, которые способны оказывать положительное воздействие на гликозаминогликаны.
Витамин С, вероятно, исследовался больше других экстрактивных веществ, используемых для лечения глаукомы, основным проявлением которой является увеличение внутриглазного давления за пределы толерантного. Исследователи, кажется, не сошлись во мнении, существует ли у больных глаукомой недостаток аскорбиновой кислоты. Однако эффективность витамина С при лечении глаукомы не подвергается сомнению [9]. Также Head K.A. [9] было установлено, что пероральное применение больших количеств витамина С (500 мг/кг веса тела) способствовало снижению внутриглазного давления. Всего проводилось лечение 49 глаз, 25 из них имели хроническую открытоугольную глаукому. На других глазах были отмечены такие заболевания как острая глаукома, геморрагическая глаукома и вторичная глаукома. Наиболее серьезные изменения при применении витамина С были отмечены для случаев хронической открытоугольной глаукомы. Было установлено, что чем выше было первоначальное внутриглазное давление тем сильнее оно затем снижалось после приема аскорбата. Этими же самыми авторами было обнаружено и снижение величины внутриглазного давления при инстилляциях 10% водного раствора витамина С.
Предполагается, что витамин C защищает глаз от повреждений, вызванных воздействием света, при помощи антиоксидантных механизмов [8]. У крыс, на которых воздействовали ярким светом, наблюдалось преждевременное старение наружных сегментов палочек (похожие симптомы наблюдаются при возрастной макулодистрофии у человека). Применение аскорбата предотвращает потерю родопсина и сохраняет докозагексаеновую кислоту, предотвращая их окисление. В этой работе защитный эффект витамина С наблюдался в том случае, когда витамин давали перед воздействием света. Было предложено несколько механизмов, объясняющих способность аскорбата снижать внутриглазное давление [9]. В высоких концентрациях он работает как сильный осмотический агент. Также предполагают, что на снижение внутриглазного давления оказывает влияние способность витамина С останавливать пероксидацию благодаря своим антиоксидантным свойствам. Кроме того, исследованиями in vitro было показано, что витамин С стимулирует синтез гиалуроновой кислоты в трабекулярной системе глаз, страдающих глаукомой. Также было показано, что аскорбат уменьшает вязкость гиалуроновой кислоты и увеличивает отток жидкости через трабекулярную сеть, что способствует нормализации внутриглазного давления.
Черника и черная смородина различаются по содержанию основных антоцианозидов (табл. 1) [5].
В чернике было обнаружено 15 различных антоцианозидов, около 40% из которых глюкозиды, и приблизительно по 30% галактозидов и арабинозидов. Наиболее часто в экстракте черники встречаются антоцианины: дельфинидин (>40%), цианидин (около 30%), мальвидин (13,5%) и петунидин (13%). В состав черной смородины входит 5 (можно сказать 4 основных) антоцианинов, из которых около 23% – глюкозиды, а остальные – рутинозиды (остатки дисахарида рамноза+глюкоза). При этом более половины антоцианинов – дельфинидины, а более 45% – цианидины.
Возможно, что именно различие в составе (преобладание рутинозидов, а также немного большее количество дельфинидинов и антоцианидинов) обуславливает способность экстракта черной смородины при предварительном применении снижать утомляемость глаз при последующей зрительной нагрузке, а также время темновой адаптации при вспышке яркого света после получения экстракта. Подобный результат для черной смородины был подтвержден клиническим исследованием [8], для экстракта черники такие данные отсутствуют. Также была показана большая антиоксидантная активность (по способности инактивировать радикалы) для экстракта черной смородины по сравнению с экстрактом черники [5].
Фармакокинетика
Исследования абсорбции полифенолов на человеке ограничены и, как правило, представляют собой различные зависимости от структуры и растворимости фенольных компонентов. В литературе приведены результаты исследований, в которых показано, что кислая среда желудка не приводит к полному расщеплению проантоцианидинов, таким образом, уровень их абсорбции в верхней части желудочно–кишечного тракта невысок. Тем не менее, показано, что даже незначительное количество проантоцианидинов, обнаруженных в моче после орального применения (обычно менее 25% от первоначальной дозы), достаточно для того, чтобы значительно увеличить антиоксидантные способности плазмы/сыворотки [14–16]. OPCs, попадающие в толстую кишку, интенсивно разрушаются ее флорой. Метаболиты и биологические свойства этих процессов еще не исследованы, но было предположено, что они также могут оказывать прямое антиоксидантное и протекторное воздействие на ткани толстой (ободочной) кишки [3,17].
Антиоксидантные свойства
Сильные антиоксидантные свойства OPCs обуславливают их терапевтический эффект при заболеваниях, характеризующихся окислительным стрессом. OPCs демонстрируют концентрационно–зависимую способность эффективно удалять свободные радикалы [17]. Исследования на мышах показали, что OPCs ингибируют химически индуцируемую пероксидацию липидов, фрагментацию ДНК и последующий апоптоз (индикаторы окислительного повреждения тканей) в тканях печени и мозга, причем величина эффекта зависит от концентрации [18]. Исследования на человеке, подтвержденные доказательствами, также демонстрируют антиоксидантный механизм уменьшения пероксидации липопротеинов низкой плотности [19,20] и увеличения способности поглощать свободные радикалы после употребления красного вина, содержащего OPCs [16].
OPCs, похоже, обладают сродством к сосудистым тканям и способны к сильному ингибированию некоторых энзимов, вовлеченных в механизм деградации коллагена, эластина и гиалуроновой кислоты – главных структурных компонентов экстраваскулярного матрикса [21]. Возможно, эти эффекты связаны со способностью OPCs улавливать активные формы кислорода и предотвращать окислительное повреждение эндотелия сосудов. Исследованиями in vitro также было показано, что OPCs увеличивает сопротивляемость мембраны клетки к повреждению и деградации [22,23].
Проантоцианидины обладают способностью расслаблять кровеносные сосуды за счет увеличения синтеза окиси азота (NO) [24] и стимулировать фактор роста эндотелия сосудов – сигнальный, ответственный за заживление ран. Также OPCs способен защищать микрососудистую систему сетчатки и увеличивать остроту зрения, возможно за счет увеличения регенерации родопсина [24–26]. В модельной системе ишемии/реперфузии на кролике показан благотворный эффект OPCs, который, по всей видимости, обусловлен их способностью связываться с медью и железом, высвобождаемыми из миокардиальных тканей, и таким образом уменьшать окислительные эффекты [27]. Положительные эффекты, оказываемые OPCs, связывают с их способностью ингибировать окисление липопротеинов низкой плотности [19,20,28] и уменьшать количество так называемых пенистых клеток, являющихся маркерами для ранних стадий артериосклероза [29]. Высказано предположение, что проантоцианидины из косточек винограда могут обладать способностью запасать витамин Е [30]. Клинические исследования, проводимые на 10 здоровых пациентах, целью которых было проверить эффект влияния OPCs на уровень окислительного стресса, показали значительное увеличение уровня a–токоферолов в мембранах клеток крови [31].
Особое внимание уделялось противовоспалительным свойствам препаратов OPCs, полученным из коры сосны. Исследованиями in vitro был показан антивоспалительный эффект, вероятно обусловленный ингибированием образования пероксидов макрофагами [32,33]. Кроме того, исследованиями на животных было показано, что OPCs из виноградных косточек, значительно ингибируют образование провоспалительных белков цитокинов, интерлейкинов 1–b и ракового некротического фактора–a [34].
Антимутагенные/Антиканцерогенные свойства
OPCs обладает натуральными антимутагенными свойствами и способен воздействовать на некоторые штаммы бактерий [35]. Хотя точный механизм этих эффектов неизвестен, исследованиями in vitro было установлено, что OPCs проявляют избирательную цитотоксичность для определенных канцерогенных клеточных линий, и в то же время не токсичны для нормальных клеток слизистой оболочки желудка человека и макрофагов [36]. Также исследованиями in vitro на модельной системе раковых клеток из мышиной кожи было показано ингибирование OPCs двух маркеров промотирования опухоли [37].
Воздействие на сосуды
Поскольку существует сродство OPCs с тканями сосудов, базальными мембранами клеток кожи, слизистой оболочки желудка, преобладающее количество исследований сфокусировано на эффектах, которые оказывают проантоцианидины на эти ткани. В Европе OPCs используется для лечения различный сосудистых нарушений, включая и ретинопатию. Ряд клинических исследований подтверждают положительный эффект, оказываемый OPC, при лечении сосудистых дисфункций [38–41].
Сердечно–сосудистые заболевания
Одним из объяснений «французского парадокса» – относительно низкого уровня сердечно–сосудистых заболеваний во Франции, несмотря на большое количество потребляемой пищи, – является предположение, что OPCs, содержащиеся в красном вине, обладают протекторным эффектом, уменьшая окисление липопротеинов низкой плотности, ингибируя цикло– и липооксигеназу в тромбоцитах и макрофагах и уменьшая тромботические эффекты [42]. Эпидемиологические исследования подтверждают эту теорию и свидетельствуют, что потребление красного вина уменьшает риск заболеваний коронарной болезнью сердца [43,44].
Natella et al. исследовали эффекты проантоцианидинов из виноградных косточек на окислительный стресс в плазме, возникающий после приема пищи. Восемь здоровых добровольцев потребляли специальную тестовую, насыщенную липидами пищу с добавлением или без добавления OPCs. В результате потребления OPC наблюдалось уменьшение пероксидации липидов, увеличение антиоксидантного уровня плазмы и устойчивости липопротеинов низкой плотности к окислению [19]. В рандомизированном, двойном слепом, плацебо контролируемом исследовании на 40 гиперхолестерольных пациентах исследовался эффект добавления хрома, связанного с никотиновой кислотой, и экстракта из виноградных косточек на общее содержание холестерола, липопротеинов низкой плотности и антител, выработанных к окисленным липопротеинам низкой плотности. Применение экстракта из виноградных косточек не оказывало статистически достоверного улучшения ситуации с содержанием холестерола или липопротеинов низкой плотности по сравнению с плацебо, однако смесь хром/экстракт из виноградных косточек приводила к значительному улучшению показателей по обоим параметрам, причем данный эффект был гораздо больше, когда эти вещества применялись отдельно. Группа пациентов, получающая только экстракт из виноградных косточек, показывала более чем 50% уменьшение количества антител к окисленным липопротеинам высокой плотности (ЛПВП). Как известно, ЛПВП оказывают защитное и стабилизирующее действия на мембранные стуктуры клетки, увеличивая их эластичность [28]. Данный эффект является важной защитой от пускового механизма апоптоза клетки – повреждения внутриклеточных мембран (особенно митохондрий) в результате перекисного окисления липидов [1].
Ретинопатия и офтальмологические нарушения
Многочисленные клинические исследования во Франции обнаружили защитное воздействие OPCs на состояние сетчатки. В рандомизированном, дважды слепом, плацебо контролируемом исследовании 75 пациентам после зрительного стресса, полученного от видеодисплеев, давали или OPCs экстракт из виноградных косточек, или экстракт Vaccinium myrtillus (черника), или плацебо. Для всех трех групп дозировка составляла 100 мг три раза в день в течение 60 дней. На основании этих экспериментов было установлено, что экстракты OPCs из черники значительно улучшали восприятие контраста, субъективное ощущение восприятия видеоинформации, по сравнению с плацебо. В группе, применяющей экстракт из виноградных косточек, были показаны лучшие результаты, чем для группы, применяющей экстракт из черники [45].
В дополнительных исследованиях, проведенных на пациентах без патологии сетчатки и других офтальмологических нарушений, было показано, что при добавлении проантоцианидинов в количестве 150–300 мг ежедневно в течение 30–60 дней, происходило улучшение остроты зрения и контрастности у пациентов, глаза которых подвергались стрессу после использования видеодисплеев, также было показано улучшение зрительных характеристик после ослепления вспышкой яркого света [25,26]. В других исследованиях на 91 пациентах с двусторонней миопией было показано, что 100 мг OPCs, применяемых ежедневно в течение 30 дней, улучшают чувствительность сетчатки во время темновой адаптации у 72 пациентов (79%). Ощущение субъективного улучшения наблюдалось у большего количества пациентов – 90% [55]. Исследования 26 пациентов, страдающих диабетической ретинопатией, показали, что OPCs оказывает положительный эффект при повреждении сосудов, микроаневризмах и экссудатах [27].
Лечение ран
Проантоцианидины обладают способностью расслаблять кровеносные сосуды за счет увеличения синтеза окиси азота (NO) [24]. Окись азота стимулирует синтез коллагена с последующим излечением раненого участка [46,47] и индуцирование фактора роста эндотелия сосудов (VEGF), необходимого в реэпитализационной стадии репарации кожи [48,49]. Проантоцианидиновый экстракт из косточек винограда обладает способностью стимулировать экспрессию VEGF в культуре кераноцитов, что делает OPCs потенциальным терапевтическим средством в заживлении ран на коже [50,51]. Данный факт кажется нам важным и делает сомнительным применение OPCs у пациентов с неоваскулярной глаукомой и субретинальными неоваскулярными мембранами.
Взаимодействие с лекарствами
Не было обнаружено взаимодействий между OPC экстрактами и другими препаратами. Однако исследования in vitro и проведенные на человеке показали, что OPCs оказывает ингибирующий эффект на агрегацию тромбоцитов, аналогично тому, как это было показано для аспирина [52,53]. Поэтому предполагается, что пациентам, применяющим дезагреганты, следует с осторожностью использовать проантоцианидины.
Побочные эффекты и токсичность
OPCs исключительно безопасны. При применении не было выявлено побочных эффектов, токсичных свойств или взаимодействий с другими лекарствами. Исследования на крысах показали, что OPCs обладает высоким уровнем немутагенности и нетоксичности. Уровень вещества, при котором не наблюдается вредных эффектов (NOAEL), по хронической токсичности экстракта из виноградных косточек составляет для крыс 1400–1500 мг/на кг веса/день [54], что соответствует приблизительно 93–100 г экстракта из косточек винограда для взрослого человека, весящего чуть меньше 70 кг. В литературе очень мало исследований по оценке безопасности и токсичности OPCs, однако в них не было обнаружено побочных эффектов после применения этих веществ.
Дозировка
Рекомендуемая дозировка для OPCs, по данным литературы, обычно колеблется в диапазоне 50–150 мг в день, хотя в некоторых исследованиях использовалась дозировка и 300 мг в день. Также рекомендуемой дозировкой является 1 мг на килограмм веса.
Выводы
1. Механизм действия OPCs–содержащих препаратов соответствует современным представлениям о нейропротекции и опосредуется антиоксидантным, антиэксайтотоксичным, блокирующим ионы кальция и нейротрофическим эффектами.
2. OPCs–содержащие препараты могут использоваться в качестве нейропротекторов как дополнительное средство в комплексном лечении глаукоматозной нейрооптикопатии.
3. Необходимо проведение клинических исследований для OPCs–содержащих препаратов, соответствовующих современным стандартам.
4. Способность OPCs–содержащих препаратов к индуцированию фактора роста эндотелия сосудов делает сомнительным их применение у пациентов с неоваскулярной глаукомой и субретинальными неоваскулярными мембранами.
Статья принята в печать 1 июня 2007 г.


Литература
1. Мушкамбаров Н.Н., Кузнецов С.Л. Апоптоз. Молекулярная биология. 443;444; М.: ООО «Медицинское информационное агентство», 2003.
2. Santos–Buelga C., Scalbert A. Proanthocyanidins and tannin–like compounds: nature, occurrence, dietary intake and effects on nutrition and health. J Food Sci Agric 2000;80:1094.
3. Scalbert A., Deprez S., Mila I. et al. Proanthocyanidins and human health: systemic effects and local effects in the gut. Biofactors 2000;13:115–120.
4. Baxter N.J., Lilley T.H., Haslam E., Williamson M.P. Multiple interactions between polyphenols and a salivary proline–rich protein repeat result in complexation and precipitation. Biochemistry 1997;36:5566–5577.
5. CD–ROM «VIDAL® 2005.Справочник Видаль. Лекарственные препараты в России». АстраФармСервис, Москва (2005).
6. Murray M., Pizzorno J. Procyanidolic oligomers. In: Murray M, Pizzorno J, eds. The Textbook of Natural Medicine. 2nd ed. London, England: Churchill Livingston; 1999:899–902.
7. Matsumoto H., Nakamura Y., Iida H., Ito K., Ohguro H. Comparative assessment of distribution of blackcurrant anthocyanins in rabbit and rat ocular tissues. Exp Eye Res 83, 348–356 (2006).
8. Head K.A. Natural therapies for ocular disorders, part one: diseases of the retina. Altern. Med. Rev. 4, 342–359 (1999).
9. Head K.A. Natural therapies for ocular disorders, part two: cataracts and glaucoma. Altern. Med. Rev. 6, 141–166 (2001).
10. Canter P.H., Ernst E. Anthocyanosides of Vaccinium myrtillus (bilberry) for night vision—a systematic review of placebo–controlled trials. Surv. Ophthalmol. 49, 38–50 (2004).
11. Nakaishi H., Matsumoto H., Tominaga S., Hirayama M. Effects of black current anthocyanoside intake on dark adaptation and VDT work–induced transient refractive alteration in healthy humans. Altern. Med. Rev. 5, 553–562 (2000).
12. Matsumoto H., Nakamura Y., Tachibanaki S., Kawamura S., Hirayama M. Stimulatory effect of cyanidin 3–glycosides on the regeneration of rhodopsin. J Agric Food Chem 51, 3560–3563 (2003).
13. Fine A.M. Oligomeric proanthocyanidin complexes: history, structure, and phytopharmaceutical applications. Altern. Med. Rev. 5, 144–151 (2000).
14. Duthie GG, Pedersen MW, Gardner PT, et al. The effect of whiskey and wine consumption on total phenol content and antioxidant capacity of plasma from healthy volunteers. Eur J Clin Nutr 1998;52:733–736.
15. Whitehead TP, Robinson D, Allaway S, et al. Effect of red wine ingestion on the antioxidant capacity of serum. Clin Chem 1995;41:32–35.
16. Serafini M, Maiani G, Ferro–Luzzi A. Alcoholfree red wine enhances plasma antioxidant capacity in humans. J Nutr 1998;128:1003–1007.
17. Bokkenheuser VD, Shackleton CH, Winter J. Hydrolysis of dietary flavonoid glycosides by strains of intestinal Bacteroides from humans. Biochem J 1987;248:953–956.
18. Bagchi D, Garg A, Krohn RL, et al. Oxygen free radical scavenging abilities of vitamins C and E, and a grape seed proanthocyanidin extract in vitro. Res Commun Mol Pathol Pharmacol 1997;95:179–189.
19. Natella F, Belelli F, Gentili V, et al. Grape seed proanthocyanidins prevent plasma postprandial oxidative stress in humans. J Agric Food Chem 2002;50:7720–7725.
20. Fuhrman B, Lavy A, Aviram M. Consumption of red wine with meals reduces the susceptibility of human plasma and low–density lipoprotein to lipid peroxidation. Am J Clin Nutr 1995;61:549–554.
21. Maffei Facino R, Carini M, Aldini G, et al. Free radicals scavenging action and antienzyme activities of procyanidines from Vitis vinifera. A mechanism for their capillary protective action. Arzneimittelforschung 1994;44:592–601.
22. Gavignet C, Groult N, Godeau G, et al. Effect of procyanidolic oligomers on cultured mesenchymal cells. I. Effect on attachment, proliferation and detachment of cells. Pathol Biol (Paris) 1989;37:746–753. [Article in French]
23. Robert AM, Groult N, Six C, Robert L. The effect of procyanidolic oligomers on mesenchymal cells in culture. II. Attachment of elastic fibers to the cells. Pathol Biol (Paris) 1990;38:601–607. [Article in French]
24. Fitzpatrick DF, Fleming RC, Bing B, et al. Isolation and characterization of endotheliumdependent vasorelaxing compounds from grape seeds. J Agric Food Chem 2000;48:6384–6390.
25. Corbe C, Boissin JP, Siou A. Light vision and chorioretinal circulation. Study of the effect of procyanidolic oligomers (Endotelon). J Fr Ophtalmol 1988;11:453–460. [Article in French]
26. Boissin JP, Corbe C, Siou A. Chorioretinal circulation and dazzling: use of procyanidol oligomers (Endotelon). Bull Soc Ophtalmol Fr 1988;88:173–174, 177–179. [Article in French]
27. Froantin M. Procyanidolic oligomers in the treatment of capillary fragility and retinopathy in diabetics. Med Int 1981;16:432–434. [Article in French]
28. Preuss HG, Wallerstedt N, Talpur S, et al. Effects of niacin–bound chromium and grape seed proanthocyanidin extract on the lipid profile of hypercholesterolemic subjects: a pilot study. J Med 2000;31:227–246.
29. Vinson JA, Tuefel K, Wu N. Red wine, dealcoholized red wine, and especially grape juice inhibit atherosclerosis in a hamster model. Atherosclerosis 2001;156:67–72.
30. Maffei Facino R, Carini M, Aldini G, et al. Sparing effect of procyanidins from Vitis vinifera on vitamin E: in vitro studies. Planta Med 1998;64:343–347.
31. Simonetti P, Ciappellano S, Gardana C, et al. Procyanidins from Vitis vinifera seeds: in vivo effects on oxidative stress. J Agric Food Chem 2002;50:6217–6221.
32. Bayeta E, Lau B. Pycnogenol inhibits generation of inflammatory mediators in macrophages. Nutr Res 2000;20:249–259.
33. Blazso G, Gabor M, Rohdewald P. Antiinflammatory activities of procyanidin–containing extracts from Pinus pinaster Ait. after oral and cutaneous application. Pharmazie 1997;52:380–382.
34. Li WG, Zhang XY, Wu YJ, Tian X. Antiinflammatory effect and mechanism of proanthocyanidins from grape seeds. Acta Pharmacol Sin 2001;22:1117–1120.
35. Liviero L, Puglisi P. Antimutagenic activity of procyanidins from Vitis vinifera. Fitoterapia 1994;65:203–209.
36. Ye X, Krohn RL, Liu W, et al. The cytotoxic effects of a novel IH636 grape seed proanthocyanidin extract on cultured human cancer cells. Mol Cell Biochem 1999;196:99–108.
37. Bomser JA, Singletary KW, Wallig MA, Smith MA. Inhibition of TPA–induced tumor promotion in CD–1 mouse epidermis by a polyphenolic fraction from grape seeds. Cancer Lett 1999;135:151–157.
38. Delacroix P. Double–blind study on Endotelon in chronic venous insufficiency. Rev Med (Paris) 1981;1793:27–28.
39. Thebaut JF, Thebaut P, Vin F. Study of Endotelon in functional manifestations of peripheral venous insufficiency. Results of a double–blind study on 92 patients. Gaz Med (Montr) 1985;92:12.
40. Amsellem M, Masson JM, Negui B, et al. Endotelon in the treatment of venolymphatic problems in premenstrual syndrome, a multicentered study on 165 patients. Tempo Med 1987;November:282. [Article in French]
41. Pecking A. Oligomeric proanthocyanidins (Endotelon®) in the treatment of post therapeutic lymphoedema of the upper limbs. Association de Lymphologyie de Lange Francaise Hospital Saint–Louis, Paris 1989;69–73. [Article in French]
42. Frankel EN, Kanner J, German JB, et al. Inhibition of oxidation of human low–density lipoprotein by phenolic substances in red wine. Lancet 1993;341:454–457.
43. Das DK, Sato M, Ray PS, et al. Cardioprotection of red wine: role of polyphenolic antioxidants. Drugs Exp Clin Res 1999;25:115–120.
44. Sato M, Maulik N, Das DK. Cardioprotection with alcohol: role of both alcohol and polyphenolic antioxidants. Ann N Y Acad Sci 2002;957:122–135.
45. He J, Chen Y, Farzan M, et al. CCR3 and CCR5 are co–receptors for HIV–1 infection of microglia. Nature 1997;385:645–649.
46. Witte MB, Thornton FJ, Efron DT, Barbul A. Enhancement of fibroblast collagen synthesis by nitric oxide. Nitric Oxide 2000;4:572–582.
47. Stallmeyer B, Kampfer H, Kolb N, et al. The function of nitric oxide in wound repair: inhibition of inducible nitric oxide–synthase severely inhibits wound reepithelialization. J Invest Dermatol 1999;113:1090–1098.
48. Frank S, Stallmeyer B, Kampfer H, et al. Nitric oxide triggers enhanced induction of vascular endothelial growth factor expression in cultured keratinocytes (HaCaT) and during cutaneous wound repair. FASEB J 1999;13:2002–2014.
49. Most D, Efron DT, Shi HP, et al. Characterization of incisional wound healing in inducible nitric oxide synthase knockout mice. Surgery 2002;132:866–876.
50. Khanna S, Roy S, Bagchi D, et al. Upregulation of oxidant–induced VEGF expression in cultured keratinocytes by a grape seed proanthocyanidin extract. Free Radic Biol Med 2001;31:38–42.
51. Khanna S, Venojarvi M, Roy S, et al. Dermal wound healing properties of redox–active grape seed proanthocyanidins. Free Radic Biol Med 2002;33:1089–1096.
52. Putter M, Grotemeyer KH, Wurthwein G, et al. Inhibition of smoking–induced platelet aggregation by aspirin and pycnogenol. Thromb Res 1999;95:155–161.
53. Yamakoshi J, Saito M, Kataoka S, Kikuchi M. Safety evaluation of proanthocyanidin–rich extract from grape seeds. Food Chem Toxicol 2002;40:599–607.
54. Chang WC, Hsu FL. Inhibition of platelet aggregation and arachidonate metabolism in platelets by procyanidins. Prostaglandins Leukot Essent Fatty Acids 1989;38:181–188.
55. Moriconi S, Bellezza PG. Clinical study on the activity of procyanidolic oligomers of Vitis vinifera on retinal sensitivity in myopic patients. Ann Ottalmol Clin Ocul 1988;114:585–594.












