–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤–Њ–њ—А–Њ—Б—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П —Б–Є–љ–і—А–Њ–Љ–∞ ¬Ђ—Б—Г—Е–Њ–≥–Њ –≥–ї–∞–Ј–∞¬ї (–°–°–У) –њ—А–Є–Њ–±—А–µ—В–∞—О—В –≤—Б–µ –±–Њ–ї—М—И—Г—О –∞–Ї—В—Г–∞–ї—М–љ–Њ—Б—В—М. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Н—В–Њ —Б–Њ—Б—В–Њ—П–љ–Є–µ –≤—Л—И–ї–Њ –Ј–∞ —А–∞–Љ–Ї–Є –Њ—В–і–µ–ї—М–љ–Њ–є –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ—Л, —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –°–°–У —Б–Њ—Б—В–∞–≤–ї—П–µ—В —Б—А–µ–і–Є –Њ–±—Й–µ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є 35% [1], –∞ —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П вАУ 45%, —Г–≤–µ–ї–Є—З–Є–≤–∞—П—Б—М —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ [2]. –Ю–њ—А–µ–і–µ–ї–µ–љ —Б–њ–µ–Ї—В—А –Њ—Б–љ–Њ–≤–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≥–ї–∞–Ј, –Є–Љ–µ—О—Й–Є—Е —В–µ—Б–љ—Г—О –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї—Г—О —Б–≤—П–Ј—М —Б –°–°–У, –љ–µ –Њ—Б–ї–∞–±–µ–≤–∞–µ—В –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –Њ–±—Й–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, –љ–µ—А–µ–і–Ї–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є—Е—Б—П –µ–≥–Њ —А–∞–Ј–≤–Є—В–Є–µ–Љ. –Ю–і–љ–∞–Ї–Њ –љ–∞—А—П–і—Г —Б –Њ–±—Й–µ–Є–Ј–≤–µ—Б—В–љ—Л–Љ–Є –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є –°–°–У –Њ—Б–ї–Њ–ґ–љ—П–µ—В—Б—П –µ—Й–µ —Ж–µ–ї—Л–є —А—П–і –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Њ—А–≥–∞–љ–∞ –Ј—А–µ–љ–Є—П, —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –љ–µ —Г—З–Є—В—Л–≤–∞—О—Й–Є—Е—Б—П –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–Љ–Є –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–∞–Љ–Є.
–Я—Б–µ–≤–і–Њ—Н–Ї—Б—Д–Њ–ї–Є–∞—В–Є–≤–љ—Л–є —Б–Є–љ–і—А–Њ–Љ (–Я–≠–°), –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–є —Б–Њ–±–Њ–є —Б–Є—Б—В–µ–Љ–љ—Г—О –њ–∞—В–Њ–ї–Њ–≥–Є—О —Б –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Њ—А–≥–∞–љ–∞ –Ј—А–µ–љ–Є—П, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–µ–є –Є –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ–Љ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А–∞—Е –≥–ї–∞–Ј–∞ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Н–Ї—Б—В—А–∞—Ж–µ–ї–ї—О–ї—П—А–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ [3]. –Я—Б–µ–≤–і–Њ—Н–Ї—Б—Д–Њ–ї–Є–∞—В–Є–≤–љ—Л–µ –Њ—В–ї–Њ–ґ–µ–љ–Є—П –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –Є –≤ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л—Е —В–Ї–∞–љ—П—Е –≥–ї–∞–Ј, –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ї–Њ—В–Њ—А—Л—Е –љ–µ—А–µ–і–Ї–Њ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ—Л —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –°–°–У [4]. –Ю–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ —А—П–і –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Ї–∞—Б–∞—О—Й–Є—Е—Б—П –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ—А–µ—А–Њ–≥–Њ–≤–Є—З–љ–Њ–є —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Я–≠–° [5вАУ7], –Њ–і–љ–∞–Ї–Њ –Є—Е –µ–і–Є–љ–Є—З–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А, –љ–∞—А—П–і—Г —Б –≤—Л—Б–Њ–Ї–Њ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М—О –Я–≠–° –≤ –¶–µ–љ—В—А–∞–ї—М–љ–Њ–є –†–Њ—Б—Б–Є–Є [8] –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М—О –Я–≠–° –Є –°–°–У, –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—О—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ —Г–≥–ї—Г–±–ї–µ–љ–љ–Њ–≥–Њ –Є–Ј—Г—З–µ–љ–Є—П —Н—В–Њ–≥–Њ –≤–Њ–њ—А–Њ—Б–∞.
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Ю—Ж–µ–љ–Є—В—М –≤–ї–Є—П–љ–Є–µ –Я–≠–° –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —В–µ—З–µ–љ–Є–µ –°–°–У.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Т —А–∞–Љ–Ї–∞—Е –њ–Њ–њ–µ—А–µ—З–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П ¬Ђ—Б–ї—Г—З–∞–є вАУ –Ї–Њ–љ—В—А–Њ–ї—М¬ї –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Њ 120 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (240 –≥–ї–∞–Ј) —Б –Я–≠–° —А–∞–Ј–ї–Є—З–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є, —Б–Њ—Б—В–∞–≤–Є–≤—И–Є—Е –Њ—Б–љ–Њ–≤–љ—Г—О –≥—А—Г–њ–њ—Г, –Є 120 –ї–Є—Ж (240 –≥–ї–∞–Ј) –±–µ–Ј –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Я–≠–° (–Ї–Њ–љ—В—А–Њ–ї—М–љ–∞—П –≥—А—Г–њ–њ–∞). –Ю—Б–љ–Њ–≤–љ–∞—П –Є –Ї–Њ–љ—В—А–Њ–ї—М–љ–∞—П –≥—А—Г–њ–њ—Л –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л –њ–Њ –≤–Њ–Ј—А–∞—Б—В–љ–Њ-–њ–Њ–ї–Њ–≤–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ (—В–∞–±–ї. 1).
–Т—Л–±–Њ—А–Ї–∞ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–ї–∞—Б—М —Б–њ–ї–Њ—И–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –њ–Њ –Љ–µ—А–µ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –±–Њ–ї—М–љ—Л—Е –і–ї—П –њ–ї–∞–љ–Њ–≤–Њ–≥–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ї–∞—В–∞—А–∞–Ї—В—Л –≤ –њ—А–Њ—Д–Є–ї—М–љ—Л–µ –Њ—В–і–µ–ї–µ–љ–Є—П. –Ъ—А–Є—В–µ—А–Є—П–Љ–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П —П–≤–ї—П–ї–Є—Б—М: –≥–ї–∞—Г–Ї–Њ–Љ–∞, –ї—О–±—Л–µ –Њ–њ–µ—А–∞—Ж–Є–Є –Є —В—А–∞–≤–Љ—Л –≥–ї–∞–Ј –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –Њ—А–≥–∞–љ–∞ –Ј—А–µ–љ–Є—П, –Ј–∞—В—А—Г–і–љ—П—О—Й–Є–µ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г –Я–≠–° (–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —В—А–∞–Ї—В–∞, –Є–Ј–Љ–µ–љ–µ–љ–Є—П —А–Њ–≥–Њ–≤–Є—Ж—Л –Є —В. –њ.), –Њ–±—Й–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (–∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–µ, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В), –∞ —В–∞–Ї–ґ–µ –Љ–µ—Б—В–љ–Њ–µ –Є –Њ–±—Й–µ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е —Б—А–µ–і—Б—В–≤, —Б–њ–Њ—Б–Њ–±–љ—Л—Е –≤—Л–Ј–≤–∞—В—М —Б–љ–Є–ґ–µ–љ–Є–µ —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В–Є —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є –Є —Г–≥–љ–µ—В–µ–љ–Є–µ —Б–ї–µ–Ј–Њ–њ—А–Њ–і—Г–Ї—Ж–Є–Є.
–Т—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤–Ї–ї—О—З–∞–≤—И–µ–µ –≤–Є–Ј–Њ–Љ–µ—В—А–Є—О, –±–Є–Њ–Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—О, —В–Њ–љ–Њ–Љ–µ—В—А–Є—О –њ–Њ –Ь–∞–Ї–ї–∞–Ї–Њ–≤—Г, –Њ—Д—В–∞–ї—М–Љ–Њ—Б–Ї–Њ–њ–Є—О. –Ф–Є–∞–≥–љ–Њ–Ј –Я–≠–° —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї—Б—П –њ—А–Є –љ–∞–ї–Є—З–Є–Є –њ—Б–µ–≤–і–Њ—Н–Ї—Б—Д–Њ–ї–Є–∞—В–Є–≤–љ—Л—Е –Њ—В–ї–Њ–ґ–µ–љ–Є–є –њ–Њ –Ј—А–∞—З–Ї–Њ–≤–Њ–Љ—Г –Ї—А–∞—О —А–∞–і—Г–ґ–Ї–Є –Є/–Є–ї–Є –љ–∞ –њ–µ—А–µ–і–љ–µ–є –Ї–∞–њ—Б—Г–ї–µ —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ (–≤ —Г—Б–ї–Њ–≤–Є—П—Е –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –і–Њ—Б—В–Є–ґ–Є–Љ–Њ–≥–Њ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–≥–Њ –Љ–Є–і—А–Є–∞–Ј–∞). –°—В–µ–њ–µ–љ—М –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Я–≠–° –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –њ–Њ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Х.–С. –Х—А–Њ—И–µ–≤—Б–Ї–Њ–є (1997). –§—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –Љ–µ—В–Њ–і—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –°–°–У –≤–Ї–ї—О—З–∞–ї–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –≤—А–µ–Љ–µ–љ–Є —А–∞–Ј—А—Л–≤–∞ —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є (–Т–†–°–Я) (–њ—А–Њ–±–∞ –Э–Њ—А–љ–∞) –Є –≤–µ–ї–Є—З–Є–љ—Л —Б—Г–Љ–Љ–∞—А–љ–Њ–є —Б–ї–µ–Ј–Њ–њ—А–Њ–і—Г–Ї—Ж–Є–Є (—В–µ—Б—В –®–Є—А–Љ–µ—А–∞ I —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —В–µ—Б—В-–њ–Њ–ї–Њ—Б–Њ–Ї —Д–Є—А–Љ—Л Baus—Бh & Lomb, –У–µ—А–Љ–∞–љ–Є—П).
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ –і–∞–љ–љ—Л—Е –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–∞—Б—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ–∞–Ї–µ—В–∞ –њ—А–Є–Ї–ї–∞–і–љ—Л—Е –њ—А–Њ–≥—А–∞–Љ–Љ Statistica 8.0 (StatSoftInc., –°–®–Р). –Р–љ–∞–ї–Є–Ј –≤—Л–±–Њ—А–Њ–Ї –љ–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–µ –Ј–∞–Ї–Њ–љ—Г –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ—А–Њ–≤–µ—А—П–ї–Є –Ї—А–Є—В–µ—А–Є–µ–Љ –Ъ–Њ–ї–Љ–Њ–≥–Њ—А–Њ–≤–∞ вАУ –°–Љ–Є—А–љ–Њ–≤–∞. –†–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–∞—Е –≤ –≤–Є–і–µ –Љ–µ–і–Є–∞–љ—Л (Me), –≤–µ—А—Е–љ–µ–≥–Њ –Є –љ–Є–ґ–љ–µ–≥–Њ –Ї–≤–∞—А—В–Є–ї–µ–є (Q25%; Q75%), –∞ —В–∞–Ї–ґ–µ –≤ —Д–Њ—А–Љ–∞—В–µ –Ь¬±ѕГ (–≥–і–µ –Ь вАУ —Б—А–µ–і–љ–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ, ѕГ вАУ —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–µ —Б—А–µ–і–љ–µ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П), —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б–Њ–њ–Њ—Б—В–∞–≤–Є—В—М –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ —Б –і–∞–љ–љ—Л–Љ–Є —А–∞–љ–µ–µ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Т—Л–±–Њ—А–Ї–Є –љ–µ –њ–Њ–і—З–Є–љ—П–ї–Є—Б—М –Ј–∞–Ї–Њ–љ—Г –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –љ–∞ —Г—А–Њ–≤–љ–µ –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є p<0,05, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–Є–є –≥—А—Г–њ–њ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О Z-–∞–њ–њ—А–Њ–Ї—Б–Є–Љ–∞—Ж–Є–Є –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ U-–Ї—А–Є—В–µ—А–Є—П –Ь–∞–љ–љ–∞ вАУ –£–Є—В–љ–Є. –°—А–∞–≤–љ–µ–љ–Є–µ –≥—А—Г–њ–њ –њ–Њ –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ –њ—А–Є–Ј–љ–∞–Ї–∞–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї—А–Є—В–µ—А–Є—П ѕЗ2 (–Љ–µ—В–Њ–і –Я–Є—А—Б–Њ–љ–∞), –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–є —А–∞–љ–≥–Њ–≤—Л–є r-–Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –°–њ–Є—А–Љ–µ–љ–∞. –Ъ—А–Є—В–Є—З–µ—Б–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є –њ—А–Є –њ—А–Њ–≤–µ—А–Ї–µ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є—Е –≥–Є–њ–Њ—В–µ–Ј –њ—А–Є–љ–Є–Љ–∞–ї—Б—П —А–∞–≤–љ—Л–Љ <0,05.
–†–µ–Ј—Г–ї—М—В–∞—В—Л
–†–µ–Ј—Г–ї—М—В–∞—В—Л —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –њ—А–Њ–± –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ –Њ—В–ї–Є—З–∞–ї–Є—Б—М –Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л. –Т–†–°–Я –Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Б—Г–Љ–Љ–∞—А–љ–Њ–є —Б–ї–µ–Ј–Њ–њ—А–Њ–і—Г–Ї—Ж–Є–Є (—В–µ—Б—В –®–Є—А–Љ–µ—А–∞ I) —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Я–≠–° –±—Л–ї–Є —Б–љ–Є–ґ–µ–љ—Л –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б —В–∞–Ї–Њ–≤—Л–Љ–Є —Г –ї–Є—Ж –±–µ–Ј –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (—В–∞–±–ї. 2). –†–∞–Ј–ї–Є—З–Є—П —Б–Њ—Е—А–∞–љ—П–ї–Є—Б—М –Ї–∞–Ї —Б—А–µ–і–Є –Љ—Г–ґ—З–Є–љ, —В–∞–Ї –Є —Б—А–µ–і–Є –ґ–µ–љ—Й–Є–љ –њ–Њ—Б–ї–µ —Б—В—А–∞—В–Є—Д–Є–Ї–∞—Ж–Є–Є –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –≥—А—Г–њ–њ –њ–Њ –њ–Њ–ї—Г (p<0,001 –і–ї—П –Њ–±–Њ–Є—Е —В–µ—Б—В–Њ–≤). –Ф–Њ–ї—П –≥–ї–∞–Ј —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Т–†–°–Я (–Љ–µ–љ–µ–µ 10 —Б) –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –њ–Њ—З—В–Є –≤ 2 —А–∞–Ј–∞ –њ—А–µ–≤—Л—Б–Є–ї–∞ –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ –і–∞–љ–љ—Л–µ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ (78,3% –Є 42,1% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ). –Ч–љ–∞—З–µ–љ–Є–µ –њ—А–Њ–±—Л –®–Є—А–Љ–µ—А–∞ I –Љ–µ–љ–µ–µ 15 –Љ–Љ –Є–Љ–µ–ї–Њ –Љ–µ—Б—В–Њ –≤ 92,1% –≥–ї–∞–Ј —Б –Я–≠–° –Є 82,9% –≥–ї–∞–Ј –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П, –Љ–µ–љ–µ–µ 5 –Љ–Љ вАУ –≤ 7,1% –Є 2,9% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ.
–Я—А–Є –±–Є–Њ–Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є–Є —З–∞—Б—В–Њ—В–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є—П –њ–∞—А–∞–ї–ї–µ–ї—М–љ—Л—Е –љ–Є–ґ–љ–µ–Љ—Г –≤–µ–Ї—Г –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ—Л—Е —Б–Ї–ї–∞–і–Њ–Ї (–Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–Њ—Е–∞–ї–∞–Ј–Є—Б, LIPCOF) –њ—А–Є –Я–≠–° –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ—А–µ–≤—Л—И–∞–ї–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є—П. –Ф–∞–љ–љ—Л–є –њ—А–Є–Ј–љ–∞–Ї –Њ–њ—А–µ–і–µ–ї—П–ї—Б—П –≤ 73,8% –≥–ї–∞–Ј —Б –Я–≠–° –њ—А–Њ—В–Є–≤ 52,9% –≥–ї–∞–Ј –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ (p=0,000002, ѕЗ2=22,428) (—А–Є—Б. 1).

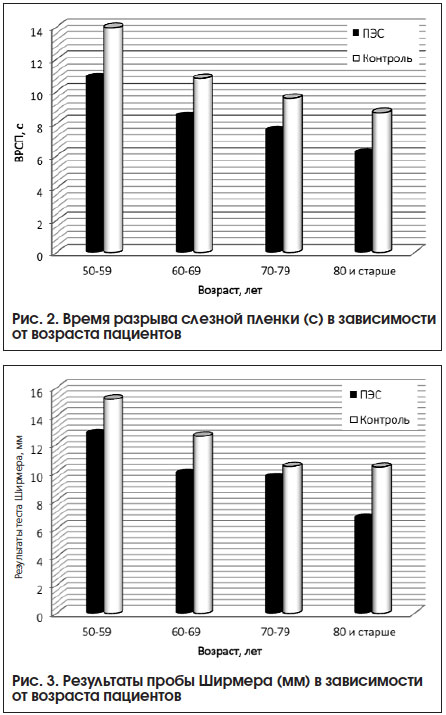
–° —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –≤–Њ–Ј—А–∞—Б—В–∞ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Т–†–°–Я –Ї–∞–Ї –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є, —В–∞–Ї –Є –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ (–Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є r=0,557 –Є r=0,502 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ; p<0,001). –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–∞–ї–Є—З–Є–µ–Љ –Я–≠–° –Є –±–µ–Ј –Я–≠–° —Б–Њ—Е—А–∞–љ—П–ї–Є—Б—М –≤ –Ї–∞–ґ–і–Њ–є –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –≥—А—Г–њ–њ–µ (p<0,001) (—А–Є—Б. 2). –Р–љ–∞–ї–Њ–≥–Є—З–љ–∞—П —В–µ–љ–і–µ–љ—Ж–Є—П –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ—А–Њ–±—Л –®–Є—А–Љ–µ—А–∞ I (—А–Є—Б. 3) (–Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –Љ–µ–ґ–і—Г —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є —В–µ—Б—В–∞ –Є –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л—Е r=0,456 –Є r=0,461 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ; p<0,001).
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–∞ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В–Є –њ—А–µ—А–Њ–≥–Њ–≤–Є—З–љ–Њ–є —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є –Њ—В —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –њ—Б–µ–≤–і–Њ—Н–Ї—Б—Д–Њ–ї–Є–∞—В–Є–≤–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –° –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є–µ–Љ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –њ—Б–µ–≤–і–Њ—Н–Ї—Б—Д–Њ–ї–Є–∞—В–Є–≤–љ—Л—Е –Њ—В–ї–Њ–ґ–µ–љ–Є–є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є—Е—Б—П –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є –і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –њ–µ—А–µ–і–љ–µ–≥–Њ –Њ—В–і–µ–ї–∞ –≥–ї–∞–Ј–∞, –Т–†–°–Я —Б–Њ–Ї—А–∞—Й–∞–µ—В—Б—П. –Я—А–Є –Я–≠–° I —Б—В–µ–њ–µ–љ–Є —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Б–Њ—Б—В–∞–≤–Є–ї 9,0¬±1,74 —Б; 9,00 (8,00; 10,00), –њ—А–Є II —Б—В–µ–њ–µ–љ–Є вАУ 7,77¬±1,79 —Б; 8,00 (7,00; 9,00), –њ—А–Є III —Б—В–∞–і–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П вАУ 6,76¬±2,09 —Б; 6,50 (5,00; 7,00) (p1,2=0,002, Z=3,309; —А2,3=0,0004, Z=3,515).
–†–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–±—Л –®–Є—А–Љ–µ—А–∞ I —В–∞–Ї–ґ–µ –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –≤ –Њ–±—А–∞—В–љ–Њ–є –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—В–∞–і–Є–Є –Я–≠–°, —Б–љ–Є–ґ–∞—П—Б—М —Б 10,81¬±2,59; 10,00 (9,00; 12,00) –њ—А–Є –Я–≠–° I —Б—В–µ–њ–µ–љ–Є –і–Њ 9,43¬±2,51; 9,00 (8,00; 10,00) –њ—А–Є II —Б—В–µ–њ–µ–љ–Є –Є 8,65¬±3,26; 9,00 (7,00; 11,00) –њ—А–Є III —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Б–Є–љ–і—А–Њ–Љ–∞ (p1,2=0,025, Z=2,236; —А2,3=0,106, Z=1,619).
–Ф–∞–љ–љ—Л–µ –ї–Є—В–µ—А–∞—В—Г—А—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Є —Н–ї–µ–Ї—В—А–Њ–љ–љ–Њ-–Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –њ–∞—А–љ—Л—Е –≥–ї–∞–Ј, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –љ–µ –≤–Њ–≤–ї–µ—З–µ–љ–љ—Л—Е –≤ –њ—А–Њ—Ж–µ—Б—Б, –њ—А–Є–Ј–љ–∞–Ї–Є –Я–≠–° –≤—Л—П–≤–ї—П—О—В—Б—П –≤ 100% —Б–ї—Г—З–∞–µ–≤. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, —В–µ—А–Љ–Є–љ—Л ¬Ђ–Њ–і–љ–Њ—Б—В–Њ—А–Њ–љ–љ–Є–є¬ї –Є–ї–Є ¬Ђ–і–≤—Г—Б—В–Њ—А–Њ–љ–љ–Є–є¬ї –Я–≠–° –љ–µ —Б–Њ–≤—Б–µ–Љ –≤–µ—А–љ—Л, –Є —А–µ—З—М –љ–∞–і–Њ –≤—Б–µ–≥–і–∞ –≤–µ—Б—В–Є –Њ–± –∞—Б—Б–Є–Љ–µ—В—А–Є—З–љ–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–Є [9, 10]. –Т —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Я–≠–° –Њ–њ—А–µ–і–µ–ї—П–ї—Б—П —В–Њ–ї—М–Ї–Њ —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Т–†–°–Я –љ–∞ –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–Љ –≥–ї–∞–Ј—Г –±—Л–ї —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ –Љ–µ–љ—М—И–µ. –Ч–љ–∞—З–µ–љ–Є–µ –њ—А–Њ–±—Л –Э–Њ—А–љ–∞ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 8,5¬±2,1 —Б; 8,0 (7,0; 10,0) –љ–∞ –≥–ї–∞–Ј—Г —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є–µ–є –Я–≠–° –Є 9,9¬±1,7 —Б; 10,0 (9,0; 10,0) вАУ –љ–∞ –њ–∞—А–љ–Њ–Љ (p=0,001; Z=3,335). –°—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П —В–µ—Б—В–∞ –®–Є—А–Љ–µ—А–∞ I –љ–∞ –≥–ї–∞–Ј–∞—Е —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Њ–њ—А–µ–і–µ–ї—П–µ–Љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ —В–∞–Ї–ґ–µ –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–Є–ґ–µ вАУ 10,7¬±2,42 –Љ–Љ; 10,0 (9,0; 12,0) –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б 11,6¬±2,42 –Љ–Љ; 11,0 (9,0; 10,0) –љ–∞ –њ–∞—А–љ–Њ–Љ –≥–ї–∞–Ј—Г, –≤–њ—А–Њ—З–µ–Љ, –љ–µ –і–Њ—Б—В–Є–≥–∞—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є (p=0,139; Z=1,481). –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Т–†–°–Я –Є —В–µ—Б—В–∞ –®–Є—А–Љ–µ—А–∞ I –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –љ–∞ –≥–ї–∞–Ј–∞—Е –±–µ–Ј –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є–Є –Я–≠–° —Е–Њ—В—П –Є –±—Л–ї–Є –љ–Є–ґ–µ, —З–µ–Љ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ, —В–∞–Ї–ґ–µ –љ–µ –і–Њ—Б—В–Є–≥–∞–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є (p=0,403; Z=-0,836 –Є p=0,924; Z=0,010 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ).
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ—Б–µ–≤–і–Њ—Н–Ї—Б—Д–Њ–ї–Є–∞—В–Є–≤–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –Љ–Њ–ґ–µ—В –њ–Њ—А–∞–ґ–∞—В—М –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —В–Ї–∞–љ–µ–є –≥–ї–∞–Ј–∞. –Я–≠–° –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ —Б–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є –Њ—А–≥–∞–љ–∞ –Ј—А–µ–љ–Є—П, –≤ —В. —З. —Б –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є, –Ї–∞—В–∞—А–∞–Ї—В–Њ–є, –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –≥–µ–Љ–∞—В–Њ–Њ—Д—В–∞–ї—М–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –±–∞—А—М–µ—А–∞, –і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –њ–µ—А–µ–і–љ–µ–≥–Њ –Њ—В–і–µ–ї–∞ –≥–ї–∞–Ј–∞ [3]. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Н–ї–µ–Ї—В—А–Њ–љ–љ–Њ–є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є–Є –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –Њ–±–љ–∞—А—Г–ґ–Є—В—М –њ—Б–µ–≤–і–Њ—Н–Ї—Б—Д–Њ–ї–Є–∞—В–Є–≤–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї –≤ –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–µ –≤–µ–Ї –Є –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞ [10]. –Т —А—П–і–µ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е —А–∞–љ–µ–µ —А–∞–±–Њ—В –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–∞–ї–Є—З–Є–µ –Я–≠–° –Љ–Њ–ґ–µ—В –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞—В—М —Б –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б–ї–µ–Ј—Л, —Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е –і–ї—П –°–°–У. –Ю–±–Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ —Н—В–Њ–≥–Њ —Д–∞–Ї—В–∞ –Љ–Њ–ґ–љ–Њ —Б—З–Є—В–∞—В—М –і–∞–љ–љ—Л–µ, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–Є –±–Њ–Ї–∞–ї–Њ–≤–Є–і–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л –љ–∞ —Д–Њ–љ–µ –Я–≠–°, —З—В–Њ, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј–∞—В—М –≤–ї–Є—П–љ–Є–µ –љ–∞ –Љ—Г—Ж–Є–љ–Њ–≤—Л–є —Б–ї–Њ–є –њ—А–µ—А–Њ–≥–Њ–≤–Є—З–љ–Њ–є —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є [6].
–Т –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Т–†–°–Я –Є —Б—Г–Љ–Љ–∞—А–љ–Њ–є —Б–ї–µ–Ј–Њ–њ—А–Њ–і—Г–Ї—Ж–Є–Є –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Я–≠–° –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–Њ–є, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ—В–љ–µ—Б—В–Є –њ—Б–µ–≤–і–Њ—Н–Ї—Б—Д–Њ–ї–Є–∞—В–Є–≤–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –Ї —Д–∞–Ї—В–Њ—А–∞–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –°–°–У. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –≥–Њ–≤–Њ—А—П—В –Њ–± —Г—Е—Г–і—И–µ–љ–Є–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б–ї–µ–Ј—Л —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –≤–Њ–Ј—А–∞—Б—В–∞ –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л—Е, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –њ–Њ–ґ–Є–ї–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞, –Њ–і–љ–∞–Ї–Њ –≤ –Ї–∞–ґ–і–Њ–є –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –≥—А—Г–њ–њ–µ —Б–Њ—Е—А–∞–љ—П–ї–Є—Б—М —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –±–Њ–ї—М–љ—Л–Љ–Є —Б –Я–≠–° –Є –≥—А—Г–њ–њ–Њ–є —Б—А–∞–≤–љ–µ–љ–Є—П.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –њ—А—П–Љ–Њ–є –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Љ–µ–ґ–і—Г —Б—В–µ–њ–µ–љ—М—О –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Я–≠–° –Є —Е–∞—А–∞–Ї—В–µ—А–Њ–Љ —Г–≥–љ–µ—В–µ–љ–Є—П –Т–†–°–Я –Є —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є —В–µ—Б—В–∞ –®–Є—А–Љ–µ—А–∞ I. –≠—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Є–Ј—Г—З–∞–µ–Љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ–Њ –Љ–µ—А–µ —Г–≤–µ–ї–Є—З–µ–љ–Є—П —Б—В–∞–і–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –Є—Е –Ј–љ–∞—З–Є–Љ—Л–Љ —Г—Е—Г–і—И–µ–љ–Є–µ–Љ –≤ –≥–ї–∞–Ј–∞—Е —Б –љ–∞–ї–Є—З–Є–µ–Љ –Я–≠–° –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ–∞—А–љ—Л–Љ–Є –≥–ї–∞–Ј–∞–Љ–Є –±–µ–Ј –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Њ—В–ї–Њ–ґ–µ–љ–Є—П –њ—Б–µ–≤–і–Њ—Н–Ї—Б—Д–Њ–ї–Є–∞—В–Є–≤–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –њ—А–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Њ–і–љ–Њ—Б—В–Њ—А–Њ–љ–љ–µ–Љ –њ—А–Њ—Ж–µ—Б—Б–µ.
–Я–≠–° вАУ —Д–∞–Ї—В–Њ—А, –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞—О—Й–Є–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ї–∞—В–∞—А–∞–Ї—В—Л –Є –≥–ї–∞—Г–Ї–Њ–Љ—Л. –•–Є—А—Г—А–≥–Є—П –Ї–∞—В–∞—А–∞–Ї—В—Л —Б–∞–Љ–∞ –њ–Њ —Б–µ–±–µ –Љ–Њ–ґ–µ—В –≤—Л–Ј–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ –°–°–У –ї–Є–±–Њ —Г—Б—Г–≥—Г–±–Є—В—М —В–µ—З–µ–љ–Є–µ —Г–ґ–µ –Є–Љ–µ—О—Й–µ–≥–Њ—Б—П –њ—А–Њ—Ж–µ—Б—Б–∞. –У–ї–∞—Г–Ї–Њ–Љ–∞ —В—А–µ–±—Г–µ—В –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Љ–µ—Б—В–љ–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є, —Б–њ–Њ—Б–Њ–±–љ–Њ–є –≤—Л–Ј–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ –°–°–У [11вАУ15]. –Т —Н—В–Њ–є —Б–≤—П–Ј–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М –Ї –°–°–У —Г –ї–Є—Ж —Б –Я–≠–° –њ—А–Є –≤—Л–±–Њ—А–µ –њ—А–µ–њ–∞—А–∞—В–∞ –і–ї—П –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є —В–∞–Ї—В–Є–Ї–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –і–∞–љ–љ—Л—Е –≥—А—Г–њ–њ –±–Њ–ї—М–љ—Л—Е [16, 17].
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ–± –Є–Ј–Љ–µ–љ–µ–љ–Є—П—Е —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б—Г–Љ–Љ–∞—А–љ–Њ–є —Б–ї–µ–Ј–Њ–њ—А–Њ–і—Г–Ї—Ж–Є–Є –Є —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В–Є –њ—А–µ—А–Њ–≥–Њ–≤–Є—З–љ–Њ–є —Б–ї–µ–Ј–љ–Њ–є –њ–ї–µ–љ–Ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Я–≠–°. –≠—В–Њ –Љ–Њ–ґ–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М—Б—П –Ї–∞–Ї —Д–∞–Ї—В –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В–Є –і–∞–љ–љ–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –±–Њ–ї—М–љ—Л—Е –Ї —А–∞–Ј–≤–Є—В–Є—О –°–°–У. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б–ї–µ–Ј–Њ–њ—А–Њ–і—Г–Ї—Ж–Є–Є –Є –Т–†–°–Я –Њ—В —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Я–≠–°. –° —Г—З–µ—В–Њ–Љ —З–∞—Б—В–Њ—В—Л –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —Г —В–∞–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е –≥–ї–∞—Г–Ї–Њ–Љ—Л –Є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –њ–µ—А—Б–њ–µ–Ї—В–Є–≤—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Љ–µ—Б—В–љ—Л—Е –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е —Б—А–µ–і—Б—В–≤, —Б–њ–Њ—Б–Њ–±–љ—Л—Е –≤—Л–Ј–≤–∞—В—М –ї–Є–±–Њ —Г—Б—Г–≥—Г–±–Є—В—М —В–µ—З–µ–љ–Є–µ –°–°–У, –Њ—З–µ–≤–Є–і–љ—Л –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Н—В–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –∞–і–µ–Ї–≤–∞—В–љ—Л–є –≤—Л–±–Њ—А —В–µ—А–∞–њ–Є–Є, –∞ —В–∞–Ї–ґ–µ —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ ¬Ђ–Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–є —Б–ї–µ–Ј—Л¬ї.












