Введение
Современные стратегии ранней диагностики и лечения ретинобластомы направлены на обеспечение возможности применения органосохраняющих методик. Общая пятилетняя выживаемость больных с интраокулярной ретинобластомой в настоящее время достигает 100% [1]. У 65–75% больных удается сохранить глазное яблоко и зачастую обеспечить адекватную зрительную функцию [2]. Вместе с тем в случаях экстраокулярной экспансии ретинобластомы либо при массивном интраокулярном поражении (клиническая группа Е и часть глаз группы D) единственным методом радикального лечения остается энуклеация, в ряде случаев дополненная системным химиотерапевтическим воздействием и лучевой терапией (ЛТ). Основными задачами системной полихимиотерапии (ПХТ) являются так называемая «up-front therapy», или химиоредукция, — уменьшение размеров опухоли перед этапом локального контроля, а также профилактика развития регионарных и отдаленных метастазов.
Энуклеация
Удаление глазного яблока с опухолью имеет свои особенности [3]. Операцию следует выполнять быстро, но в то же время крайне деликатно во избежание гематогенного диссеминирования. Пересечение зрительного нерва во время энуклеации производится на расстоянии не менее 15 мм от заднего полюса глазного яблока. В ближайшие 5–7 дней после операции следует приступить к глазному протезированию. Подбор постоянного глазного протеза осуществляется в течение 6 нед. после энуклеации.
Корректная морфологическая характеристика соотношения опухоли с окружающими анатомическими структурами в удаленном глазу определяет тактику дальнейшего лечения пациента и прогноз заболевания [4–8]. Основные гистопатологические критерии неблагоприятного прогноза заболевания были представлены еще в 1996 г. группой французских ученых из Института М. Кюри [4]. На основании статистического анализа сведений о 172 пациентах с ретинобластомой после первичной энуклеации было доказано, что массивное вовлечение хориоидеи, экстрасклеральное распространение опухоли, ретроламинарная инвазия и наличие опухолевых клеток в крае резекции зрительного нерва значимо ухудшают прогноз заболевания.
Подходы к определению патогистологической группы риска в мировой литературе несколько различаются. К настоящему времени накоплен разнообразный опыт проведения риск-адаптированных программ лечения больных с ретинобластомой после энуклеации в зависимости от морфологических характеристик опухоли [4–8].
В исследование RET5 были включены 50 пациентов с односторонней ретинобластомой после энуклеации [5]. Больше половины глаз были отнесены к группе низкого риска на основании наличия очаговой инвазии сосудистой оболочки с или без преламинарной инвазии зрительного нерва. Эти пациенты не получали системное лечение. К средней группе риска относились глаза, в которых были обнаружены опухолевые клетки в передней камере глаза, инвазия цилиарного тела и/или радужки, массивная инвазия сосудистой оболочки с или без постламинарной инвазии зрительного нерва. Таким пациентам было назначено 4 курса ПХТ. В группе высокого риска обнаруживались либо инвазия склеры, либо опухолевые клетки в крае резекции зрительного нерва, пациентам проводились 6 курсов ПХТ. Только 1 пациенту в группе высокого риска была проведена ЛТ на орбиту в связи с микроскопически выявленным экстраокулярным распространением опухоли. Общая выживаемость составила 100% при медиане наблюдения за пациентами 3,4 года (от 0,8 до 6,4 года).
I. Aerts et al. (2013 г.) провели проспективную оценку общей и безрецидивной выживаемости 123 пациентов с односторонней ретинобластомой после энуклеации [7] в зависимости от гистопатологических факторов риска экстраокулярного рецидива или метастазирования. В группе низкого риска имелось минимальное или полное отсутствие инвазии хориоидеи и/или преламинарное или полное отсутствие поражения зрительного нерва. Эти пациенты не получали адъювантное лечение. В группе среднего риска были выявлены массивное поражение хориоидеи, и/или интра- или ретроламинарное поражение зрительного нерва, и/или вовлечение переднего сегмента глаза. В этом случае проводились 4 курса адъювантной ПХТ с включением винкаалкалоидов, алкиляторов различных групп и ингибиторов топоизомеразы II. И лишь 1 больной был отнесен к группе высокого риска на основании следующих критериев: инвазия края резекции зрительного нерва и/или микроскопически выявленное экстраокулярное распространение опухоли. Этому пациенту были проведены 6 курсов ПХТ и курс высокодозной ПХТ с аутотрансплантацией периферических стволовых клеток крови (ПСКК). При медиане наблюдения в 71 мес. не было ни одного случая рецидива или прогрессирования заболевания. У 2 больных с конституциональной мутацией гена RВ1 отмечалась латерализация поражения (у 1 пациента из группы низкого риска через 11 мес. и у 1 — из группы среднего риска через 14 мес. после энуклеации).
S. Kaliki et al. (2011 г.) проанализировали ретроспективные сведения о 406 глазах клинической группы Е, удаленных в период с 1994 по 2010 г. [8]. Критерием высокого риска было наличие любого из следующих признаков: инвазия переднего сегмента, массивная инвазия сосудистой оболочки, изолированное вовлечение в опухолевый процесс зрительного нерва за пределами зубчатой линии или любая инвазия сосудистой оболочки в сочетании с любым вовлечением зрительного нерва. Пациенты получали от 4 до 6 курсов ПХТ. Лишь у 1 больного морфологически было зафиксировано экстрасклеральное распространение опухоли, что потребовало комбинации ПХТ с дистанционной ЛТ на орбиту. Все пациенты при среднем сроке наблюдения 66 мес. (12–202 мес.) были живы, при этом не возникло ни одного случая ни прогрессирования заболевания, ни развития вторых опухолей.
Согласно Федеральным клиническим рекомендациям критериями низкого риска являются отсутствие или фокальная инвазия хориоидеи, отсутствие или преламинарная инвазия зрительного нерва [3]. Пациентам этой группы системная терапия не показана, осуществляется динамический контроль. Группа среднего риска характеризуется следующими признаками: опухолевые клетки в передней камере глаза, инвазия ресничного тела, радужки, массивная инвазия хориоидеи или вовлечение зрительного нерва позади решетчатой пластинки. Больным проводят 4 курса системной ПХТ, а наличие ретроламинарной инвазии является показанием к проведению дистанционной ЛТ на орбиту. При обнаружении инвазии склеры и/или опухолевых клеток в крае резекции зрительного нерва больных относят к группе высокого риска. В этом случае после ЛТ на орбиту и 4 курсов ПХТ в качестве консолидирующей терапии проводится высокодозная ПХТ с аутотрансплантацией ПСКК.
Таким образом, очевидно отсутствие единого подхода как к определению критериев стратификации пациентов на группы риска, так и к объему и интенсивности адъювантной ПХТ. И тем не менее все терапевтические подходы демонстрируют высокую эффективность, позволяющую добиться излечения абсолютного большинства больных. Оценивая результаты исследования S. Kaliki, можно сделать вывод о возможности деэскалации лечебной нагрузки даже у больных с массивным интраокулярным распространением опухоли. Единым у всех авторов остается ограничение показаний к дистанционной ЛТ только в случаях экстраокулярной экспансии ретинобластомы [3, 5, 8].
Органосохраняющие методики лечения ретинобластомы
Применение органосохраняющих методик стало прорывом в лечении интраокулярной ретинобластомы. Еще в 1996 г. A.L. Murphree доказал эффективность использования системной химиотерапии препаратами платины, винкаалкалоидами и ингибиторами топоизомеразы II с целью редукции размеров опухоли перед проведением локальной терапии [9]. Выбор этих препаратов был обоснован их хорошим проникновением через гематоофтальмический барьер. Уже в 1997 г. схема VEC (винкристин, этопозид, карбоплатин) стала общепризнанным «золотым стандартом» благодаря фундаментальным проспективным исследованиям C.L. Shields et al., показавшим возможность уменьшения размеров первичной опухоли более чем на 50% после применения системного лечения [10]. Комбинация 6 курсов VEC с такими методами локального воздействия, как криотерапия, фотокоагуляция аргонным лазером, термотерапия и брахитерапия, позволяла сохранить пораженный глаз у 100% пациентов I–IV групп и у 78% пациентов из V группы по классификации Reese — Ellsworth. Публикация столь впечатляющих результатов сочетания системной ПХТ с физическими методами органосохраняющего лечения интраокулярной ретинобластомы стала предвестником заката «эры» дистанционной ЛТ [11, 12].
Суперселективная интраартериальная химиотерапия
В отличие от системной ПХТ, суперселективная интраартериальная химиотерапия (СИАХТ) относится к методам локальной химиотерапии наряду с интравитреальной химиотерапией (ИВХ) и субконъюнктивальным введением химиопрепаратов.
Первенство в разработке техники СИАХТ принадлежит японским исследователям T. Yamane et al., которые в 2004 г. подробно описали методику проведения в общей сложности 563 процедур у 187 пациентов с интраокулярной ретинобластомой [13]. Метод заключался во введении с помощью супертонкого катетера цитостатического препарата через бедренную и внутреннюю сонную артерию непосредственно в устье глазной артерии. Предварительно выполнялась каротидная ангиография с целью визуализации анатомии сосудов. В подавляющем большинстве случаев (74%) СИАХТ комбинировалась с различными физическими методами локального контроля, в 36% — проводилась в монорежиме. Выбор в качестве химиотерапевтического агента мелфалана основывался на сведениях о высокой чувствительности к нему культуры клеток ретинобластомы. Доза препарата варьировала в диапазоне от 5 до 40 мг. Авторы сообщили лишь о 14 технических неудачах во время проведения СИАХТ. Сведений об отдаленных результатах лечения представлено не было, тем не менее эта методика быстро приобрела популярность как в Северной Америке, так и в Европе.
В 2011 г. D.H. Abramson, являющийся основоположником СИАХТ в США, в своей статье подвел итоги пятилетнего опыта химиохирургии в клиниках Нью-Йорка и Филадельфии [2]. Автором была определена оптимальная доза мелфалана — 7,5 мг, обладавшая наибольшей эффективностью и удовлетворительным профилем токсичности. Отдаленные результаты, оцениваемые в сравнении с традиционными на тот момент методами лечения, оказались весьма впечатляющими, с учетом того факта, что первоначально методика применялась в глазах V группы по Reese — Ellsworth (кандидаты на энуклеацию). При сроке наблюдения 2 года в общей группе удалось сохранить 70% глаз: в группе традиционного лечения — 58%, а в группе СИАХТ — 82%. Методика показала хороший результат и в качестве второй линии после неудач предшествовавшего лечения. А при лечении клинических групп С и D были сохранены 100% глаз. Однако в 2 случаях развились отдаленные метастазы, что указывает на необходимость тщательной первичной диагностики и последующего мониторинга для исключения экстраокулярной экспансии опухоли. Системные осложнения СИАХТ были незначительными и заключались в возникновении нейтропении 3–4-й степени у 11% больных, не сопровождавшейся инфекционными эпизодами. Кроме того, часто отмечался бронхоспазм, который автор объяснял особенностями анестезиологического пособия. Нарушения внутримозгового кровообращения зафиксировано не было. У 15% пациентов развивались гиперемия конъюнктивы и век. В заключение автор постулировал возможность излечения интраокулярной ретинобластомы методом СИАХТ в монорежиме.
В 2018 г. исследователи из Мемориального центра Слоан-Кеттеринг (США) представили уже десятилетний опыт применения СИАХТ на 452 глазах [14]. Следует отметить, что методика использовалась как единственная химиотерапевтическая опция, и лишь часть пациентов на первом этапе получали системную ПХТ в качестве так называемого «моста» в связи с опасностью задержки начала химиохирургического лечения. С 2013 г., когда наступила «эра» интравитреальной химиотерапии, эти два метода стали комбинироваться и дополнять друг друга, особенно в лечении отсевов в стекловидное тело. В качестве химиотерапевтических агентов применялись карбоплатин, мелфалан и топотекан. Среднее количество процедур равнялось 3. Авторы сообщают лишь о 16 технических неудачах, потребовавших удаления глаза. На первом году наблюдения развитие рецидивов было отмечено почти у четверти глаз, однако в подавляющем большинстве они хорошо контролировались физическими методами лечения (криодеструкция, термо- и брахитерапия). Энуклеация понадобилась лишь в 33 случаях неконтролируемого течения ретинобластомы. Авторы одними из первых среди онкоофтальмологов в мире предложили понятие «рецидив ретинобластомы» — визуализируемое при офтальмоскопии и/или ультразвуковом исследовании и магнитно-резонансной томографии появление новой опухолевой активности, такой как возобновившийся рост из регрессировавшей опухоли и/или новые субретинальные или интравитреальные отсевы. Подобные рецидивы не являются показанием к энуклеации. Случаи, когда опухоль не отвечала на лечение, не увеличиваясь, не уменьшаясь в размерах, относились к понятию персистенции заболевания. Подобные ситуации также считались неудачами СИАХТ, и дальнейшие терапевтические воздействия определялись индивидуально для каждого
глаза.
Согласно Федеральным клиническим рекомендациям у пациентов клинических групп С и D СИАХТ сочетается с системной ПХТ, а также, при необходимости, с физическими методами локального контроля и ИВХ [3]. Количество курсов СИАХТ варьирует от 1 до 3, в зависимости от ответа опухоли на лечение. Данная методика более эффективна при экзофитном характере роста опухоли и не столь результативна при эндофитном распространении ретинобластомы. Наиболее частыми осложнениями процедуры являются транзиторный отек век, гиперемия век и конъюнктивы, кратковременная анизокория, спазм центральной артерии сетчатки, ее отслойка, атрофия зрительного нерва, косоглазие, экзофтальм, синдром «верхней глазничной щели». Отмечены также острые нарушения мозгового кровообращения.
Интравитреальная химиотерапия
Первые сведения о применении ИВХ относятся к 1995 г., когда S. Seregard et al. сообщили об интравитреальном введении тиотепы у 3 детей с рецидивом билатеральной ретинобластомы в виде появления отсевов в стекловидное тело в единственном глазу [15]. Этот опыт оказался неудачным, и метод был забыт почти на десятилетие, а наличие интравитреальных отсевов оставалось абсолютным показанием к энуклеации.
В 2012 г. F.L. Munier et al. сообщили о первом удачном клиническом опыте ИВХ на 23 глазах, получавших предшествующую терапию [16]. Пациентам были проведены в общей сложности 122 инъекции мелфалана с интервалом в 7–10 дней. Количество процедур на каждом глазу определялось достижением полной эрадикации отсевов. У части пациентов ИВХ комбинировалась с системной ПХТ. При медиане наблюдения 22 мес. не было отмечено ни одного рецидива заболевания, а двухлетняя общая выживаемость пациентов составила 84%. Наиболее частым осложнением процедуры была локализованная периферическая ретинопатия, отмеченная в 43% случаев.
С 2013 г. ИВХ нашла свою нишу в лечении достаточно сложных и нередко сомнительных в плане сохранения глаз, особенно у пациентов с двухсторонней ретинобласто-мой [14]. Основным показанием для применения этой методики является наличие опухолевых отсевов в стекловидное тело, однако ИВХ используется только в комбинации с системной химиотерапией и методами локального воздействия, а также в случае уверенного контроля над первичным опухолевым очагом.
Процедура ИВХ представляет собой инъекцию мелфалана в дозе от 20 до 40 мкг тонкой иглой 32 G в стекловидное тело через конъюнктиву, склеру и pars plana ресничного тела, выполняемую под общей анестезией. Кратность инъекций варьирует от 3 до 8 с оптимальным интервалом в 7–10 дней и напрямую зависит от размеров отсевов (пылевидные, сферические либо облаковидные) и динамики процесса. Ответом на лечение может быть либо полное исчезновение отсевов, либо конверсия их в кальцификаты или аморфные массы неправильной, несферической формы [16, 17].
Локальные физические методы органосохраняющего лечения
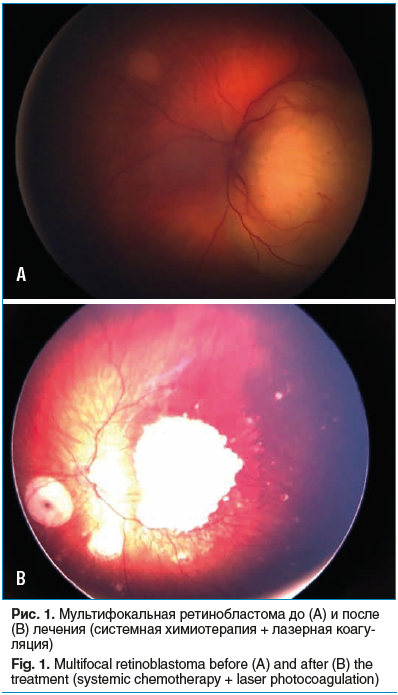
Лазерная коагуляция является методом выбора и применяется в монорежиме при лечении опухолей у пациентов клинической группы А. Кроме того, этот метод зарекомендовал себя в адъювантном режиме после предварительной системной или локальной химиотерапии (рис. 1), а также в лечении ретинальных или субретинальных рецидивов ретинобластомы [9, 10, 14]. Достоинством метода является отсутствие выраженной перифокальной реакции окружающих опухоль тканей, что позволяет производить лазерную коагуляцию вблизи зрительного нерва [18].
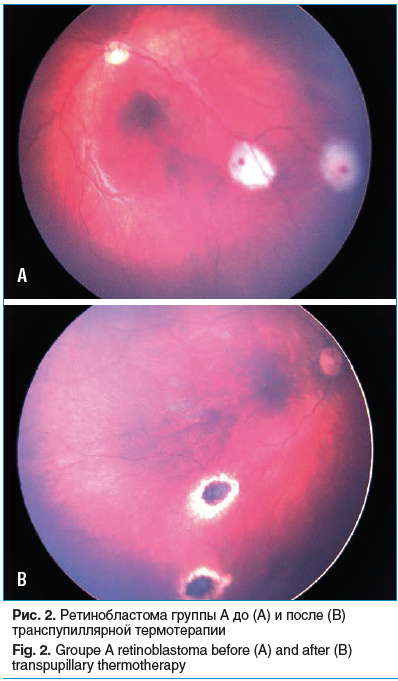
Транспупиллярная термотерапия (ТТТ) — это метод лазерного воздействия на опухоль путем ее прогревания с помощью диодного лазера, который вызывает процесс гибели опухолевых клеток без прямого коагуляционного эффекта. Впервые метод ТТТ был разработан и применен J.J. Lagendijk в 1982 г. [19]. С тех пор эта методика стала ведущей для лечения постэкваториальных опухолей диаметром до 3 мм и высотой до 1,5 мм, позволяя добиться регрессии более чем 80% опухолей (рис. 2).
В настоящее время большинство офтальмологических центров используют модифицированный диодный лазер с длиной волны 810 нм [20]. В последние годы появились работы, касающиеся способов усиления терапевтического эффекта ТТТ посредством применения хромофоров, а именно индоцианина зеленого [21, 22]. Теоретическое обоснование использования подобных адъювантов заключается в том, что оптимальный эффект теплового воздействия инфракрасного излучения с длиной волны 810 нм осуществляется благодаря поглощению ее нормальным пигментом сетчатки. Однако в случае ретинобластомы, когда сетчатка значительно повреждена и подверглась рубцовым изменениям после предыдущих терапевтических воздействий, фоновый пигмент практически отсутствует. Это приводит к неэффективности ТТТ, в результате чего часть опухолей либо не отвечают на лечение, либо развиваются рецидивы [21, 22]. Пиковая длина волны излучения диодного лазера оптимально совпадает со спектром поглощения индоцианина зеленого. Внутривенное введение препарата за 1 мин до проведения ТТТ значительно повышает ее фототермический эффект.
Криодеструкция при лечении ретинобластомы стала применяться еще в середине 1970-х гг., показывая высокую результативность [23, 24]. Поздние исследования очертили показания и определили место методики в комплексном лечении интраокулярной ретинобластомы [25, 26]. Криохирургию считают показанной при опухолях диаметром до 3,5 мм и толщиной не более 2,5 мм, локализованных в преэкваториальной зоне. Криодеструкция осуществляется жидким азотом с температурой на поверхности криоаппликатора -196 °С.
Брахитерапия — локальное облучение опухоли с помощью подшивания к склере радиоактивного офтальмоаппликатора. Локальное облучение ретинобластомы насчитывает более чем 50-летнюю историю применения и относится к числу наиболее ранних органосохраняющих методик [27]. Показанием к применению брахитерапии являются рецидивы опухоли при неэффективности других методов лечения, ее применяют в качестве второй линии после химиотерапии, а также сочетают с другими локальными методами лечения. Возможно первичное использование офтальмоаппликаторов при наличии единичного узла опухоли относительно небольшого размера с проминенцией до 5–7 мм и диаметром не более 12–14 мм [28]. Достоинством терапии с использованием радиоактивных изотопов является то, что она позволяет подвести к новообразованию большую дозу излучения, не повредив окружающие здоровые ткани. В качестве радиоактивного источника наиболее часто применяют офтальмоаппликаторы с изотопами рутения (Ru-106) и стронция (Sr-90). Офтальмоаппликатор подшивают к склере в области, соответствующей расположению опухоли, удаляют его через 2–4 дня. Условием успешной брахитерапии является правильный расчет дозы облучения, которая должна составлять 80–100 Гр на вершину опухоли при использовании рутения и 120 Гр при использовании стронция [28, 29].
Диспансерное наблюдение
Диспансерное наблюдение за пациентами с ретинобластомой после окончания лечения осуществляется пожизненно. Всем семьям пациентов с ретинобластомой рекомендовано генетическое консультирование и исследование на наличие герминальной мутации гена RВ1 [29]. В случае выявления наследственных форм заболевания необходимо, с одной стороны, наблюдение за излеченным пациентом в связи с повышенным риском развития у него вторых опухолей, а с другой стороны, более тщательное офтальмологическое обследование здоровых сиблингов. Однако до сих пор не существует четких рекомендаций, касающихся кратности офтальмологических осмотров членов семей с положительным семейным анамнезом ретинобластомы.
В Институте Кюри было проведено ретроспективное исследование эффективности интенсивного скрининга сиблингов из семей с наследственной ретино-
бластомой [30]. Для детей из группы высокого риска, а именно имеющих родителей с анамнезом двухсторонней ретинобластомы либо носящих мутацию гена RВ1, был предложен следующий график наблюдения: первый осмотр — в возрасте 8 дней, далее — ежемесячно до полутора лет, затем — раз в 3 мес. Для сиблингов больных с двухсторонней ретинобластомой и детей пациентов с односторонней ретинобластомой первый осмотр проводится в возрасте 1 мес., далее каждые 2 мес. до 2 лет, затем — каждые 6 мес. до 4 лет. Авторы показали, что скрининг привел к снижению числа энуклеаций или необходимости применения дистанционной ЛТ, однако не повлиял на частоту использования системной ПХТ и улучшение визуальной функции.
Заключение
В настоящее время в мире накоплен огромный опыт лечения интраокулярной ретинобластомы, позволяющий подходить дифференцированно к каждому случаю заболевания — от энуклеации и системного химиотерапевтического воздействия до применения локальных методов лечения в монорежиме. Определение показаний и ограничений для каждого метода и комбинирование различных терапевтических подходов требуют дальнейшего изучения с учетом приоритетности сохранения жизни ребенка. Не вызывает сомнения тот факт, что лечение ребенка с ретинобластомой требует работы мультидисциплинарной команды, включающей педиатра, офтальмолога, детского онколога, лучевого диагноста, радиотерапевта, интервенционного хирурга, генетика. Крайне важно тщательное наблюдение за излеченными больными. Семьи пациентов с положительным анамнезом ретинобластомы должны быть обязательно информированы о рисках развития опухоли в поколениях и ориентированы на офтальмологический скрининг.
Сведения об авторах:
1Иванова Светлана Вячеславовна — к.м.н., детский онколог отделения химиотерапии и комбинированного лечения злокачественных опухолей у детей, ORCID iD 0000-0002-0585-0907;
1Кулева Светлана Александровна — д.м.н., заведующая отделением химиотерапии и комбинированного лечения злокачественных опухолей у детей, ORCID iD 0000-0003-0390-8498;
2Садовникова Наталья Николаевна — к.м.н., заведующая офтальмологическим отделением, ORCID iD 0000-0002-5943-1046;
2Комиссаров Михаил Игоревич — к.м.н., заведующий отделением рентгенохирургических методов лечения, ORCID iD 0000-0003-4788-7561;
2Чистякова Маргарита Николаевна — врач-офтальмолог офтальмологического отделения, ORCID iD 0000-0001-7410-3650;
1Хохлова Анна Валерьевна — врач-патологоанатом патологоанатомического отделения с прозектурой, ORCID iD 0000-0002-0551-804X;
3Щеголева Наталья Адольфовна — главный внештатный детский хирург, заместитель главного врача по хирургии, ORCID iD 0000-0003-3672-7319.
1ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России. 197758, Россия, г. Санкт-Петербург, пос. Песочный, ул. Ленинградская, д. 68.
2ФГБОУ ВО СПбГПМУ Минздрава России. 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2.
3СПб ГБУЗ «ДГМКЦ ВМТ им. К.А. Раухфуса». 191036, г. Санкт-Петербург, Лиговский пр., д. 8, лит. А.
Контактная информация: Иванова Светлана Вячеславовна, e-mail: tabalinadoc@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 10.01.2020.
About the authors:
1Svetlana V. Ivanova — Cand. of Sci. (Med.), pediatric oncologist of the Department of Chemotherapy and Combined Treatment of Malignant Tumors in Children, ORCID iD 0000-0002-0585-0907;
1Svetlana A. Kuleva — Dr. of Sci. (Med.), Head of the Department of Chemotherapy and Combined Treatment of Malignant Tumors in Children, ORCID iD 0000-0003-0390-8498;
2Natal’ya N. Sadovnikova — Cand. of Sci. (Med.), Head of Ophthalmological Department, ORCID iD 0000-0002-5943-1046;
2Mikhail I. Komissarov — Cand. of Sci. (Med.), Head of the Department of Interventional Radiology Procedures, ORCID iD 0000-0003-4788-7561;
2Margarita N. Chstyakova — ophthalmologist of Ophthalmological Department, ORCID iD 0000-0001-7410-3650;
1Anna V. Khokhlova — pathologist of Pathoanatomic Department with Prosection, ORCID iD 0000-0002-0551-804X;
3Natal’ya A. Shchegoleva — Chief Visiting Pediatric Surgeon, Deputy Head Doctor for Surgery, ORCID iD 0000-0003-3672-7319.
1N.N. Petrov National Medical Research Center of Oncology.68, Leningradskaya str., Pesochnyy Village, St. Petersburg, 197758, Russian Federation.
2St. Petersburg State Pediatric Medical University. 2, Litovskaya str., St. Petersburg, 194100, Russian Federation.
3K.A. Rauchfuss St. Petersburg Children’s City Multi-disciplinary Clinical Center of High Medical Technologies. 8A, Ligovskiy av., St. Petersburg, 191036, Russian Federation.
Contact information: Svetlana V. Ivanova, e-mail: tabalinadoc@yandex.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 10.01.2020.












